Síndrome Metabólico
description
Transcript of Síndrome Metabólico
Síndrome Metobólico.
El Síndrome Metabólico también es conocido como síndrome X, síndrome plurimetabólico, síndrome de insulinorresistencia, síndrome de Reaven o CHAOS en Australia. ANTECEDENTES: El síndrome metabólico tiene una interesante historia, en la cual muchos investigadores han aportado sus mejores esfuerzos, los que a la postre han permitido configurar una herramienta diagnostica interesante, aun cuando discutido valor preventivo. En 1923 Eskil Kylin describió un síndrome que involucraba hipertensión, hiperglicemia e hiperuricemia. En 1947, Vague escribió acerca de la obesidad abdominal, la distribución de la grasa y su relación con la diabetes y otros desordenes. Posteriormente en 1965 Avogaro y Crepaldi describieron un síndrome que incluía hipertensión, hiperglicemia y obesidad. En 1966, Welborn menciono una asociación entre hipertensión arterial e hiperinsulinemia, y luego en 1985 Modan describió, entre los pacientes hipertensos, una prevalencia de hiperinsulinemia y tolerancia alterada a la glucosa mayor que en la población general. Gerry Reaven, en 1988, basado en sus observaciones clínicas, hallo cierta asociación entre algunos factores de riesgo cardiovascular tales como obesidad, diabetes, hipertensión y dislipidemia. Describió así un síndrome que denomino síndrome X. Sus investigaciones posteriores lo llevaron a la conclusión que su base fisiopatológica se relacionaba con la resistencia a la actividad periférica de la insulina, siendo este uno de sus aportes más significativos. El termino “resistencia a la insulina” evoluciono desde los años treinta, época en la cual se aplicaba a aquellos pacientes que requerían altas dosis de insulina. Se necesitaron muchas décadas para que el término adoptara su actual significado. Este síndrome propuesto por Revaen, a posteriori se denominaría síndrome metabólico. Desafortunadamente la definición del síndrome metabólico ha recorrido caminos alternos y no se ha logrado aun cristalizar una definición unificada. En 1999, la Organización Mundial de la Salud (OMS) estableció unos criterios diagnósticos; en 2002 la ATP III (Adult Treatment panel III) propuso unos criterios que buscaban obviar las determinaciones analíticas complejas; y el EGIR (Grupo Europeo del Estudio de la Insulinorresistencia) propuso también sus propios criterios, los cuales son muy exigentes en la demostración de la resistencia a la insulina, incluyendo para su diagnostico el HOMA (Homeostasis Model Assesment). Para 2005 la IDF (International Diabetes Federation), para obviar la sobrecarga oral de glucosa y el HOMA, lanzo una propuesta basada fundamentalmente en la medición del perímetro abdominal, el cual ha demostrado ser un muy buen indicador clínico de resistencia a la insulina.
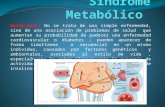
La causa subyacente del síndrome metabólico continúa siendo un reto para los expertos, pero tanto la resistencia a la insulina como la obesidad central se consideran factores de riesgo significativos. La genética, la actividad física, el envejecimiento, un estado pro inflamatorio y cambios hormonales también pueden tener un efecto causal, pero el papel de estos factores puede variar dependiendo del grupo étnico, problemas de coagulación, gota etc. El síndrome metabólico (SM) se describió originalmente en 1988 como síndrome X, con la intención de mostrar cómo se agrupan entre sí los factores de riesgo cardiovascular: obesidad, hiperglucemia, dislipidemia e hipertensión arterial. La patogenia del síndrome metabólico está fuertemente ligada a los cambios del metabolismo asociados con la obesidad. Existen numerosos criterios diagnósticos que confunden al clínico y dificultan el estudio de la epidemiología de este síndrome. Sus factores de riesgo son los de la obesidad: nutrición inadecuada y poca actividad física, que se relacionan con cambios sociales y económicos. Se ha informado que la prevalencia del síndrome metabólico en México es de 13 a 56 %, dependiendo de la población estudiada y del criterio diagnóstico. DEFINICIÓN El síndrome metabólico (SM) es una entidad clínica controvertida que aparece, con amplias variaciones fenotípicas, en personas con una predisposicion endógena, determinada genéticamente y condicionada por factores ambientales. Se caracteriza por la presencia de resistencia a la insulina, asociada a trastornos del metabolismo hidrocarbonado, cifras elevadas de presión arterial, alteraciones lipídicas (hipertrigliceridemia, descenso del HDL, presencia de LDL tipo B, aumento de ácidos grasos libres y lipemia postprandial) y obesidad, con un incremento de la morbimortalidad de origen ateroesclerótico. Además de la susceptibilidad genética, el SM precisa de la presencia de otros factores ambientales tales como obesidad central o abdominal, sedentarismo, dieta hipocalórica rica en grasas-carbohidratos y tabaquismo. Otros factores relacionados con la RI y el SM son la hiperuricemia, hipercoagulabilidad, hiperleptinemia o resistencia a la leptina, leucocitosis, hiperandrogenismo, hígado graso, cálculos biliares, osteoporosis, acantosis nigricans y síndrome del ovario poliquistico. El síndrome metabólico (SM) comprende un conjunto de factores de riesgo cardiovascular isquémica representado por obesidad central, dislipidemias, anormalidades en el metabolismo de la glucosa e hipertensión arterial, estrechamente asociado a resistencia a la insulina; actualmente no existe un criterio único para definirlo; y diabetes mellitus tipo 2. Se asocia con frecuencia a la obesidad y al sedentarismo. Los rasgos característicos del síndrome son la obesidad central, la dislipidemia aterógena, altas cifras de presión arterial, la resistencia a la insulina, una tendencia a la inflamación de bajo grado y un estado protrombótico. Se trata principalmente con cambios en el estilo de vida: dietas sanas, ejercicios físicos y eliminación de los hábitos tóxicos. Las morbilidades asociadas se tratan enérgicamente con fármacos. El combate al sedentarismo es un pilar de su terapéutica.
Resumen de los criterios diagnósticos del síndrome metabólico según los diferentes grupos internacionales.
Criterios diagnósticos OMS EGIR NCEP-ATP III IDF
Insulinoresistencia e hiperinsulinismo compensador
Disminución de la captación de glucosa en condiciones euglicémicas, con hiperinsulinemia*
Insulinemia >25% de los valores en ayunas en no-diabéticos*
No lo considera
No lo considera
Metabolismo hidrocarbonato
Glicemia en ayunas (mmol/L)
≥6.1* ≥6.1 ≥5.6 ≥5.6
PTG (mmol/L) ≥7,8* No lo considera
Alterada previamente
No lo considera
Otros DM* No lo considera
DM DM
Metabolismo lipídico
Triglicéridos (mmol/L) ≥1,695 ≥2,0 o tratamiento
≥1,70 o tratamiento
≥1,70 o tratamiento
cHDL (mmol/L) M ≤0.9 F ≤1.0
<1.0 o tratamiento
M<1.04 F<1.29 o tratamiento
M<1.04 F<1.29 o tratamiento
Presión arterial (mmHg)
≥140/90 ≥140/90 o HTA
≥130/85 o HTA
≥130/85 o HTA
Obesidad
CA (cm) M >90 F >85
M ≥94 F ≥80
M>102 F>88
Variable según grupo étnico*
IMC (kg/m2) >30 No lo considera
No lo considera
No lo considera
Otros Microalbuminuria
Positiva No lo considera
No lo considera
No lo considera
*Criterio de obligatoriedad para establecer el diagnóstico del Síndrome Metabólico, que para la OMS se requiere la presencia de al menos uno de los cuatro criterios de obligatoriedad: M-sexo masculino; F-sexo femenino; cHDL-colesterol asociado a lipoproteína de alta densidad; CA-diámetro de cintura abdominal; IMC-índice de masa corporal; DM-diagnóstico previo de diabetes mellitus; HTA-diagnóstico previo de hipertensión arterial aunque esté normotenso en el momento del estudio; Tratamiento- se refiere a presentar valores normales de los lípidos en el momento del estudio pero está bajo tratamiento por diagnóstico previo; Microalbuminuria positiva- se considera cuando la excreción de albúmina ≥20 mg/min o la relación albúmina/creatinina en orina es ≥30 mg/g en 24 h.
EPIDEMIOLOGIA: Considerando lo anterior los datos publicados acerca de la prevalencia de SM pueden variar debido a diferencias en género, grupo étnico, prevalencia de diabetes mellitus, y criterios diagnósticos utilizados. Por otro lado, hasta hace poco se desconocía la prevalencia real de SM en Estados Unidos, recientemente se ha reportado una prevalencia general ajustada para la edad de 23.7%. Sin embargo, esta prevalencia es mayor en sujetos México-americanos en los que la prevalencia general es de 31.9%, cuando se realiza un análisis por género en esta población se observa que la prevalencia es mayor en las mujeres alcanzando un valor de 35.6%, esta misma tendencia se ha observado en otros estudios. La obesidad juega un papel primordial en la génesis del SM debido a su asociación con diversas alteraciones metabólicas como diabetes, hipertensión arterial, hipercolesterolemia, etc., llama la atención que la población México-americana no tenga la mayor prevalencia de obesidad en Estados Unidos (la mayor prevalencia de obesidad se observa en sujetos de raza negra presentándose hasta en el 50.6% de los sujetos) lo que podría indicar al menos indirectamente que en el desarrollo del SM parecen estar involucrados una constelación de factores en los que la obesidad puede estar influida por diversas alteraciones. La edad parece ser uno de los factores que más incluyen en la presentación del SM ya que la prevalencia incrementa desde un 6.7% entre los sujetos de 20 a 29 años de edad hasta alcanzar valores del 43.5% y 42.0% entre los sujetos de 60 a 69 años y mayores de 70 años respectivamente. También se ha observado que los sujetos mayores de 65 años de edad tienen una probabilidad de tener SM casi cinco veces mayor en comparación con sujetos entre 20 a 34 años. De hecho, se observa que la prevalencia del SM alcanza su valor máximo en hombres de 50 a 70 años de edad y en mujeres de 60 a 80 años. Un grupo de alto riesgo para el desarrollo de SM es el grupo de mujeres posmenopáusicas las cuales tienen un incremento del riesgo hasta en un 60%, aun después de ajustarse para variables confusoras como edad, índice de masa corporal, ingreso económico, y actividad física, lo que hace pensar que este grupo de alto riesgo posee características intrínsecas que le confieren una mayor propensión al desarrollo de anormalidades metabólicas. Otro de los factores asociados a una alta prevalencia del SM es el índice de masa corporal, observándose que en general la prevalencia del SM se incrementa conforme se incrementa el peso, ya que en hombres con peso normal la prevalencia es de 4.6%, en sujetos con sobrepeso del 22.4%, y en sujetos obesos la prevalencia alcanza valores de hasta 59.6%.
Esta tendencia se observa también en mujeres donde la prevalencia es de 6.2%, 28.1%, y 50% en mujeres con peso normal, sobrepeso, y obesas, respectivamente, más aún en los sujetos con el índice de masa corporal mayor o igual a 35 se observa una mayor asociación con SM (OR 67.7; IC95% 40.5- 113.3), es importante mencionar que en sujetos con peso normal menos del 6% cumplen los criterios del SM, este incremento en la prevalencia SM puede estar influida por la alta prevalencia de anormalidades metabólicas que acompañan a la obesidad, incluyendo hipertensión, dislipidemia e intolerancia a la glucosa, estas alteraciones se observan también en sujetos aparentemente sanos, ya que comparando sujetos con índice de masa corporal menor de 20 contra sujetos con índice de masa corporal mayor de 30, se puede observar que tienen niveles de presión arterial, colesterol total, colesterol LDL, apolipoproteína B, triglicéridos de y glucosa de ayuno significativamente más elevados, mientras que los niveles de colesterol HDL y apolipoproteína A1 se encuentran disminuidos. Es importante destacar que existe poca información en la literatura donde se documente cómo la menopausia se asocia con un incremento en la resistencia a la insulina. Diversos grupos han demostrado un incremento en los niveles de insulina de ayuno, así como un incremento en los niveles de glucosa plasmática, de ayuno en mujeres posmenopáusicas comparativamente con mujeres premenopáusicas, esto puede implicarse debido a que existe una disminución en la sensibilidad a la acción de la insulina asociada a la menopausia. Sin embargo, se sabe que la sensibilidad de la insulina empeora conforme avanza la edad y con la presencia de obesidad central, lo que hace difícil determinar el efecto de la menopausia en estos procesos. Estudios realizados con técnicas altamente precisas para determinar la resistencia la insulina (pinza euglucémica hiperinsulinémica) han demostrado una sensibilidad reducida a la insulina en mujeres posmenopáusicas comparadas con mujeres premenopáusicas ajustadas para el índice de masa corporal, estos datos no han sido reproducidos por otros autores. Aunque sí se ha observado un incremento en las citocinas proinflamatorias en este grupo de mujeres. Las alteraciones metabólicas que acompañan a este Síndrome, en su gran mayoría son consideradas factores de riesgo cardiovascular, por lo que desde su descripción, el SM se ha asociado con incremento importante en la morbilidad y mortalidad cardiovascular. En estudios respectivos a largo plazo se ha observado la gran relación de las enfermedades cardiovasculares con el SM, notando que en todos los sujetos con SM (independientemente de la presencia o no de diabetes o alguna otra alteración del metabolismo de los carbohidratos), el riesgo de presentar enfermedades cardiovasculares se incrementa por un factor de tres. Utilizando modelos de regresión múltiple se observa que de los distintos componentes del SM, el género se relacionan con la presencia de enfermedad coronaria (riesgo relativo en hombres 1.12 vs riesgo relativo en mujeres de 1.44), también la dislipidemia se asocia con un incremento en el riesgo de presentar enfermedad coronarias, particularmente en sujetos con diabetes mellitus tipo 2. La hipertensión arterial, se asocia también con un incremento en el riesgo de presentar enfermedad coronaria, particularmente en sujetos con tolerancia normal a la glucosa (riesgo relativo de 2.33). En relación con la mortalidad general se observa un incremento importante en los sujetos que presentan SM con un incremento en el riesgo relativo en 1.81 en modelos ajustados.
En la encuesta de 1993 realizada en México, la prevalencia del SM por los criterios de la OMS y del ATP-III fue del 13.6 y 26.6%, respectivamente y, si bien no hay comparación con las poblaciones estudiadas, sí observamos que la prevalencia en los últimos 15 años se ha incrementado, tal como lo demuestran diversos estudios realizados en México como el de una población de pacientes no diabéticos del Estado de Durango de 30 a 64 años, en donde se señala una; prevalencia total del Síndrome Metabólico de 15.4, 22.3, 22.6% acorde a los criterios de la OMS, IDF, NCEP-ATPIII, y otro previo realizado en la Ciudad de México, en sujetos no diabéticos de 35 a 64 años, en donde la prevalencia del SM fue del 54.4% en hombres y de 61.0% en mujeres, de acuerdo con la IDF. El panorama epidemiológico en México en cuanto a enfermedades crónicas no transmisibles es motivo ya de una gran preocupación. De acuerdo con la Encuesta Nacional de Salud y Nutrición 2006 (ENSANUT 2006), el 70% de los habitantes en México tiene sobrepeso u obesidad, la prevalencia de hipertensión arterial es del 30.8% y de diabetes del 7% y las complicaciones propias de estas enfermedades y del SM, tales como las enfermedades cardiovasculares, son la primera causa de mortalidad en el país, por lo que no debe sorprender que la prevalencia del SM en México, de acuerdo con lo antes mencionado, es mayor que la observada actualmente en Estados Unidos (34.6, 39.1% de acuerdo con los criterios del ATPIII e IDF, respectivamente).
CONSIDERACIONES PATOGÉNICAS: La patogenia del SM no es bien conocida, la insulinorresistencia se considera como la responsable de la mayor parte de las anomalías presentes en este, fundamentalmente de la hiperglucemia, la HTA, el aumento en la producción hepática de VLDL y triglicéridos y la estimulación de la proliferación endotelial por acción sobre receptores endoteliales causante del inicio del proceso de aterosclerosis. La insulinorresistencia se define como la incapacidad de una cantidad conocida de insulina endógena o exógena para incrementar la entrada y utilización de la glucosa por los tejidos periféricos, especialmente hígado, músculo esquelético y tejido adiposo. Los mecanismos moleculares causantes de la IR y SM no están claros, entre estos se proponen:
Mal nutrición fetal. Incremento en la adiposidad visceral. Anomalías genéticas de una o más proteínas en la cascada de acción de la insulina Niveles reducidos de receptores de la insulina. Actividad tirosina kinasa en músculo esquelético (no parece defecto primario). Defectos posreceptores. Defecto en la señalización PI - 3 kinasa que causa reducción de traslocación de GLUT - 4
a la membrana plasmática (foco actual en la patogénesis). Alteraciones en la estructura, función y regulación de factores de transcripción genética parecen ser esenciales en la patogénesis del SM, en especial la superfamilia de receptores nucleares de hormonas (PPAR y SREBPs) los cuales son diana para hormonas como insulina y leptina, factores de crecimiento y señales de inflamación, que al parecer actúan como punto de convergencia de señales a un nivel de regulación genética. Se plantea que hallazgos individuales de componentes del SM están parcialmente determinados por factores genéticos. La posible relación entre polimorfismo del gen PON y el grado de IR fue investigada por Barbieri en 213 sujetos saludables, al genotipo LL se le considera como un predictor significativo de IR, independientemente de la edad, sexo, IMC, triglicéridos en ayunas y colesterol- HDL. Poulsen estudió el impacto relativo de factores genéticos vs. ambientales para el desarrollo de los componentes del SM entre 303 pares de gemelos de edad avanzada masculinos y femeninos. La frecuencia de concordancia para intolerancia a la glucosa, obesidad, disminución de colesterol – HDL resultó significativamente más elevada entre monocigóticos que entre dicigóticos lo cual indica que existe una influencia genética en el desarrollo de estos fenotipos. En dependencia del fondo genético del individuo, el SM puede conducir al desarrollo de diabetes tipo 2, HTA, aterosclerosis acelerada o síndrome de ovarios poliquísticos. La disfunción endotelial se señala como uno de los factores relacionados con la patogenia de la IR. El endotelio vascular representa un órgano metabólico y endocrino intensamente activo mediante la producción de péptidos hormonales vasoactivos, factores de crecimiento, citoquinas, etc., regula el balance entre vasoconstricción/vasodilatación, coagulación/fibrinólisis, proliferación/ apoptosis, adhesión/diapédesis de leucocitos, etcétera. El SM se asocia con cambios en la proliferación de células de la musculatura lisa y disfunción endotelial, se señala que la hiperinsulinemia anula la vasodilatación dependiente del endotelio en grandes arterias, probablemente por incremento del estrés oxidativo.
Estos datos pueden aportar una nueva base fisiopatológica al enlace epidemiológico entre hiperinsu-linemia /IR y aterosclerosis en seres humanos. La microalbuminuria, marcador renal de daño endotelial y aterosclerosis temprana está asociada con diabetes, IR y adiposidad central. Diversos estudios demuestran que signos de disfunción endotelial temprana, manifestados por microalbuminuria están fuertemente e independientemente asociados con adiposidad central y se deben considerar en el contexto del SM. La producción del péptido leptina derivado del adiposito ha sido relacionada con adiposidad, insulina y sensibilidad a la insulina, se afirma que variaciones interindividuales en las concentraciones de leptina plasmática están fuertemente relacionadas con los principales componentes del SM. Datos epidemiológicos soportan que la hiperleptinemia desempeña sinérgicamente con la hiperinsulinemia, una función central en la génesis de los factores componentes del SM, se observa una correlación entre hiperleptinemia e IR, independientemente de los cambios en el peso corporal. Los aspectos patogénicos fundamentales del SM, HTA, intolerancia a la glucosa, dislipidemia y obesidad abdominal y su relación con la IR serán abordados a continuación. aumenta potencialmente los niveles citosólicos de calcio. Hipertensos con hipertrofia de ventrículo izquierdo (HVI) demostrada por ecocardiografía presentan cifras de insulina en ayunas significativamente superiores a los hipertensos sin HVI, lo cual demuestra que la IR es un determinante importante del índice de masa ventricular izquierda. La insulina per se es capaz de causar hipertrofia del músculo liso vascular al ser el más potente estimulador de su crecimiento mediante el protoncógeno cmyc por medio de receptores del factor de crecimiento 1-insulina like (IGF-1). Se ha comprobado que existe gran similitud de 2 péptidos estimuladores del crecimiento endotelial: IGF-1 e IGF-2 con la proinsulina y con la propia insulina. Estudios recientes indican el papel de la glucosa en el control de la tensión arterial. Se ha demostrado que eleva la TA en presencia de disfunción endotelial y que los valores de glucosa en el rango superior al normal se asocian con incremento en la mortalidad cardiovascular. Factores de riesgo para síndrome metabólico. El análisis de factores no ha logrado demostrar que los componentes del síndrome metabólico se agrupen en un solo vector; de manera que el síndrome metabólico ya no se considera como entidad única asociada a la resistencia a la insulina, más bien es un conglomerado de anormalidades metabólicas diferentes pero altamente relacionadas. El principal factor de riesgo para el síndrome metabólico es la obesidad. La obesidad es más frecuente en personas de más edad, pues con la edad aumenta la cantidad y cambia el patrón de depósito de la grasa. Este fenómeno se explica en parte por cambios en el metabolismo de las hormonas sexuales, como en la menopausia. En mujeres más jóvenes esta asociación es más evidente en el síndrome de ovarios poliquísticos. Quien tiene menos actividad física69,70 y ocupa más tiempo frente al televisor y quien tiene un patrón de alimentación con mayor densidad energética, tiene más probabilidad de aumentar su IMC y el perímetro de la cintura y, en consecuencia, mayor prevalencia del síndrome metabólico. La obesidad se gesta en largos periodos de tiempo y habitualmente el desbalance de energía que la causa no suele exceder 3 % de la energía total que se intercambia cada día. Los alimentos con mayor densidad energética suelen ser más baratos y apetecibles y quien los consume suele reducir el consumo de otros alimentos más saludables. El tamaño de las porciones de la comida ha crecido. En consecuencia, también intervienen la cultura el estado socioeconómico79,80 y otros fenómenos económicos y sociales como la mercadotecnia. Se ha señalado que en la comunidad, la obesidad se adquiere por “proximidad”,
que atestigua la importancia de los factores sociales en la génesis de la epidemia de obesidad. Se dice que vivimos en un ambiente “obesígeno”. Aún no es posible separar del todo los componentes biológicos y sociales entre los factores de riesgo del síndrome metabólico. Las emociones, el sueño y las relaciones Personales parecen relacionarse con el riesgo de obesidad y síndrome metabólico. También la desnutrición in utero incrementa el riesgo de obesidad, enfermedad cardiovascular y diabetes en la edad adulta. Ésta es la base del concepto de gen frugal, que se ha asociado con resistencia a la insulina y síndrome metabólico. DIAGNÓSTICO: Los criterios diagnósticos del síndrome metabólico (SM) son clínicos y su etiología multifactorial, desempeñando la genética y el estilo de vida (actividad física, dieta, tabaco, entre otros) un papel fundamental. Dentro de los factores del SM destacamos los metabólicos (obesidad,diabetes tipo 2, dislipemia, hiperglucemia) y los no metabólicos (hipertensión arterial, inflamatorios, protrombóticos). Tras la sospecha clínica de resistencia a la insulina se puede completar el estudio en el ámbito especializado y/o conjuntamente con Atención Primaria. La cuantificación de la resistencia a la insulina se puede realizar por diferentes métodos indirectos, basados en la medida de los niveles de glucemia e insulina en ayunas o tras sobrecarga oral de glucosa. En niños obesos con historia familiar de diabetes mellitus tipo 2, es más frecuente la existencia de un aumento de la resistencia periférica a la insulina y de hiperinsulinemia posprandial. Asimismo, los marcadores biológicos de la inflamación son predictores de enfermedad cardiovascular, siendo la elevación de los niveles séricos de la proteína C reactiva (PCR), la interleuquina 6 (IL-6), el factor de necrosis tumoral alfa (TNF-α) y la leptina, los que presentan una mayor correlación con las alteraciones que constituyen el síndrome metabólico, así como la disminución de los niveles de adiponectina e interleuquina-10 (IL-10). El tratamiento se basará en la realización de una dieta y el cambio en los estilos de vida, cuyo objetivo será mejorar la sensibilidad a la insulina y prevenir o corregir las alteraciones metabólicas y cardiovasculares asociadas. Asimismo, se debe realizar ejercicio físico regular, que aumenta el gasto energético, mejora la sensibilidad a la insulina y disminuye la lipogénesis, siendo útil para mantener la pérdida de peso. Las estrategias para la prevención de la obesidad y SM deben iniciarse en Atención Primaria, con programas dirigidos al ambiente familiar del niño con riesgo de obesidad y con programas desarrollados en el medio escolar.
FlSIOPATOLOGÍA: Uno de los sustentos de la existencia del SM como entidad clínica es una patogenia común para la mayoría de los casos, si bien esto no constituye una condición sine qua non para el diagnóstico de SM. Inicialmente se consideró al SM como la expresión fenotípica de la resistencia a la insulina (RI). Ésta corresponde a una respuesta subnormal del organismo a la acción insulínica en los tejidos periféricos. Secundario a la RI, las células 8 pancreáticas aumentan su secreción de insulina compensatoriamente, produciendo hiperinsulinemia, la cual se pensó era responsable de muchos de los fenómenos encontrados en el SM.
Actualmente, la visión fisiopatológica del SM ha cambiado, racionalizando y justificando nuevas intervenciones terapéuticas. Los principales conceptos en la patogenia del SM son:
A. Considerar a la obesidad como el eje central patogénico del SM y a la RI como una consecuencia de ésta. B. Reconocer al adipocito como una célula inflamatoria y directamente
contribuyente a la génesis del SM. C. Considerar los efectos biológicos no clásicos de la insulina, que explican muchas de las alteraciones observadas en el SM.
A. Obesidad y síndrome metabólico. El tejido adiposo en los obesos es insulinorresistente, lo que eleva los ácidos grasos libres (AGL) en el plasma. Éstos tienen un efecto directo en los órganos diana de la insulina, como hígado y músculo, mediante acciones específicas que bloquean la señalización intracelular del receptor de insulina
22. Este fenómeno, conocido como lipo-toxicidad,
sería responsable de la RI en estos órganos y la falta de regulación pancreática a la glicemla elevada. Además, los AGL serían capaces de aumentar el estrés oxidativo, el ambiente proinflamatorio sistémico y disminuir la reactividad vascular. Los AGL, a través de la inhibición de la acción insulínica, determinan una supresión insuficiente de la lipasa hormonosensible del adipocito, mayor incremento de AGL y autoperpetuación del ciclo.
En los pacientes con SM el tejido adiposo es de predominio central, asociado a mayor cantidad de grasa visceral comparado con la distribución periférica de ésta. Los adipocitos de la grasa visceral son metabólicamente más activos, liberando mayor cantidad de AGL y citoquinas inflamatorias que drenan directamente al hígado a través de la circulación portal.
B. El adipocito como célula inflamatoria. El estado proinflamatorio asociado a la obesidad (y por tanto al SM) se explica por la presencia de células inflamatorias entre las células adipocitarias y por la actividad inflamatoria propia de los adipocitos. Se ha observado un aumento de moléculas como el factor de necrosis tumoral - -1), interleuquina 6 y leptina y disminución de la adiponectlna, las cuales tienen la capacidad de modular reacciones inflamatorias, trombóticas y vasoactivas.
El efecto de las citoquinas inflamatorias sobre la sensibilidad insulínica es conocido. El FNT-produce una fosforilación anormal del sustrato del receptor de la insulina (IRS), que a su vez produce una nueva fosforilación en un sitio incorrecto del receptor de insulina (serina en lugar de tirosina) y con esto una alteración en su transducción
29. El mecanismo por el cual las citoquinas
inflamatorias alteran la fosforilación normal del receptor de insulina es mediante la activación de "Suppressor of cytokine signalling 3" (SOCS-3), una proteína capaz de interferir con dicha fosforilación y también degradar al IRS.
La adiponectina es una citoquina antiinflamatoria producida exclusivamente por los adipocitos. Es capaz de aumentar la sensibilidad a la insulina e inhibir varios pasos en el proceso inflamatorio. También disminuiría la producción hepática de glucosa y la lipólisis. La disminución de adiponectina se asocia, en modelos experimentales y clínicos, con SM y progresión de enfermedad cardiovascular.
Los alimentos también se han involucrado con el estado proinflamatorio asociado a la obesidad. Aijada y cols mostraron que la ingesta de un menú de comida rápida era capaz de producir un estado proinflamatorio a través de la activación del factor nuclear kappa B (FN-kB). Esto mismo se ha repetido al realizar una infusión intravenosa de triglicéridos en sujetos sanos. Desde este punto de vista, parece razonable plantear que una disminución en la ingesta calórica podría disminuir el estado proinflamatorio y de estrés oxidativo (Figura 1).
C. Efectos no clásicos de la insulina. La insulina posee efectos vasodilatadores, antitrombóticos, antiinflamatorios, antioxidantes y natriuréticos, los que se verían alterados en caso de RI
22. Estos
efectos explican algunas de las alteraciones observadas en el SM, especialmente en cuanto al mayor riesgo atero-trombótico. Así, la RI se transforma en un estado capaz de determinar un mayor riesgo de eventos cardiovasculares per se y no sólo asociado a los FRCV independientes. Las consecuencias sistémicas de la RI determinan un aumento de las especies reactivas de oxígeno y disminución de la actividad de la óxido nítrico sintetasa endotelial (eNOS). Esto se acompaña de aumentos a nivel local y sistémico en endotelina y angiotensina, potentes moléculas vasoconstrictoras e inflamatorias, que también están involucradas en la generación de estrés oxidativo. Lo anterior conduce a un estado inflamatorio crónico en la pared vascular y a disfunción endotelial, que finalmente determinará la ateromatosis y el eventual episodio agudo de la placa.
D. Factores genéticos. Explicarían la RI en individuos no obesos, poblaciones asiáticas y parientes directos de personas diabéticas. El polimorfismo de la "Fatty Acid Binding Protein 2" (FABP2) es uno de los genes candidatos que han sido asociados con RI y obesidad. Esta proteína participa en el transporte de ácidos grasos de cadena larga a nivel intestinal. Los portadores de un alelo específico (Thr54) en FABP2 tienen el doble de afinidad por ácidos grasos de cadena larga que aquellos con la forma nativa, lo cual podría llevar a un aumento de los AGL en la circulación con la consecuente lipotoxicidad.
E. Rol de los PPAR (Receptor del proliferador peroxosimal activado). Los PPAR son receptores intracelulares capaces de modular el funcionamiento de los órganos metabólicamente activos.
y son esenciales para la diferenciación y proliferación normal de los adipocitos, como también para el almacenamiento de los ácidos
grasos en ellos. Son capaces de aumentar la síntesis de adiponectina y de evitar la salida de AGL a la circulación
37. No está clara la regulación endógena de los PPAR y, pero su modulación
mediante agonistas puede determinar una disminución de la RI y, con esto, una mejoría en el SM.
Cuadro Clínico De acuerdo al Programa Nacional de Educación en Colesterol (ATPIII), el síndrome metabólico se integra con la presencia de tres o más de las siguientes condiciones: Obesidad central (> 88 cm en mujeres y > 102 cm en hombres) Hipertrigliceridemia: > 150 mg/dL Colesterol HDL bajo: 40 en hombres y 50 mg/dL en mujeres Hipertensión arterial: 130/85 mmHg o diagnóstico previo. Diabetes o glucosa anormal de ayuno: >100 mg/dL Laboratorio y Gabinete Laboratorio: Biometría hemática completa Química sanguínea incluyendo glucosa, ácido úrico, urea y creatinina Perfil de lípidos (triglicéridos, colesterol total, colesterol HDL, LDL, VLDL,) Proteína C reactiva. Insulina sérica basal Curva de tolerancia a la glucosa en caso de ser necesario Perfil hepático en caso de ser necesario Gabinete: Electrocardiograma en reposo Tele de Tórax
ENFOQUE TERAPÉUTICO: El objetivo principal del tratamiento de individuos con SM es prevenir el desarrollo de enfermedad cardiovascular
1. La terapia de primera línea está dirigida
hacia la pérdida de peso y el control de los factores de riesgo mayores: C-LDL, hipertensión arterial y alteración en el metabolismo de hidratos de carbono. Por lo tanto, la evaluación inicial de todo paciente con SM debe considerar la valoración de su riesgo cardiovascular global.
La diferencia en el enfoque del manejo del SM como entidad clínica radica en optimizar el control integral de los factores de riesgo asociados mediante cambios en el estilo de vida, realización de actividad física, ingesta de una dieta equilibrada y suspensión del tabaquismo. La terapia farmacológica está indicada para los casos en que estas intervenciones no logren conseguir los objetivos planteados para los distintos factores de riesgo. No hay guías de manejo especiales para la hipertensión arterial, diabetes o dislipidemla en los pacientes con SM, por lo que debieran seguirse las guías o recomendaciones de práctica clínica vigentes en la siguiente tabla mencionados.
Fármacos empleados que se usan en tratamiento del Síndrome Metabólico Reducción de peso dosis dependiente Segura y sin efectos colaterales Efectiva a largo plazo Activa vía oral Preferencia reduzca grasa visceral Mejoría de los componentes del Sind. Met. Bajo costo. Drogas aprobadas para uso prolongado Sibutramina: estrategia para reducir la ingesta y aumentar el gasto energético Orlistat: para bloquear la absorción de grasas. RIMONABANT: reduce apetito, reducción del tabaquismo, actúa en adipocitos,
insulinosencibilizante, anti inflamatorio algunos de sus efectos. BUPROPION (WELLBUTRIN): Aprobado como Antidepresivo y para dejar de fumar, Inhibidor
de recaptura de NE, Dopamina; Sin efecto clínico sobre la neurotransmisión serotoninérgica • Varios estudios realizados mostraron baja de peso en sujetos con y sin depresión • Contraindicado en personas con antecedentes de convulsiones y en bulímicos
• Estudio a 48 sems doble ciego, bupropion SR 300, 400, placebo… pérdida de peso dosis dependiente, superior a placebo Ef adv: boca seca, ansiedad, cefalea, temblor, insomnio, convulsiones, sudoración, mareos. TOPIRAMATO (TOPAMAX):antiepiléptico; Modula los canales de Na y Ca neuronal, bloquea
los receptores de glutamato. • Asociado a reducción de peso y de grasa visceral, clínicamente significativo • Trabajos con uso en pacientes obesos sin convulsiones están en desarrollo • Efectos favorables sobre la tolerancia a la glucosa y control glicemia en DM2 • En desarrollo formula de liberación prolongada • Efectos Adversos frecuentes SNC: parestesias, mareos, fatiga, pérdida de memoria, Somnolencia. LEPTINA: Hormona secretada por adipocitos, refleja contenido de grasa corporal; Adultos obesos tratados con Leptina humana recombinante, tiene efecto en reducción de peso • Pérdida de peso dosis dependiente promedio 7.1 kg /24 Semanas. Efectos adversos: dolor en sitio de inyección. Problema: utilidad en sujetos con resistencia a Leptina. PRAMLINTIDE (Symlin) Análogo sintético de amilina; La amilina es una hormona secretada por el páncreas en respuesta a estímulos insulinogénicos; Se administra por vía subcutánea • Disminuye la ingesta de alimentos, retarda el vaciamiento gástrico y suprime la secreción postprandial de glucagón; Mejora la glicemia y reduce el peso en sujetos con DM2; Aprobado por la FDA para DM 1 y 2. Efectos adversos: malestar gastrointestinal. hipoglicemias Estrategia de Acción para Drogas 1.- Reducir la ingesta de alimentos 2.- Bloquear la absorción de nutrientes 3.- Aumentar la termogénesis 4.- Modular el metabolismo y el almacenamiento de grasas o proteínas 5.- Modular el controlador central que regula el peso.
Fármacos para el Tratamiento de las Dislipidemias del Síndrome Metabólico Estatinas: disminuye Col-LDL;fectivas en prevención secundaria y primaria Fibratos: Mejoran dislipidemia aterogénica. Efectivas en prevención secundaria Ac.Nicotínico: Mejora dislipidemia aterogénica. Efectiva en prevención secundaria Estatinas + Fibratos o Estatinas + Ac. Nicotínico son más efectivas en dislipidemias aterogénicas, pero no hay estudios que evalúen impacto en RCV
Complicaciones Hay una gran evidencia: todos los componentes del síndrome metabólico son factores de riesgo, solo o en combinación, llevando a un alto riesgo de desarrollar ateroesclerosis clínica, ya sea bajo la forma de infarto del miocardio, accidente cerebro vascular o enfermedad arterial periférica. La relación entre resistencia a la insulina y enfermedad cardiovascular es probablemente mediada por estrés oxidativo, el cual produce disfunción endotelial, de tal forma que se promueve el daño de la pared vascular y la formación posterior del ateroma. El estudio Kuopio Ischaemic Heart incluyo a 1.200 sujetos varones, aparentemente sanos, entre 42 y 60 anos, y se busco evaluar el síndrome metabólico de acuerdo con los criterios del ATP III y criterios de la OMS en un seguimiento de 12 anos. Se pudo determinar que los afectados por síndrome metabólico tuvieron entre 2,9 y 4,2 veces más riesgo de morir por enfermedad cardiovascular que aquellos que no tenían el síndrome. Otros estudios como el WOSCOPS también concluyen que aquellos catalogados como síndrome metabólico su riesgo cardiovascular de muerte es mayor. La segunda complicación mayor esta con relación a la obesidad/sobrepeso y la diabetes mellitus. El estudio de Nurses Health Study mostro que el riesgo relativo para desarrollar diabetes para pacientes con índice de masa corporal mayor de 35 kg/m2 tenia un riesgo del 39%. En el estudio WOSCOPS, uno de los pocos estudios prospectivos en síndrome metabólico, la incidencia de diabetes fue significativamente incrementada para los pacientes con síndrome metabólico; del estudio Framingham se encontró que el riesgo relativo para desarrollar diabetes fue cinco veces mayor en pacientes con síndrome metabólico. Los pacientes con diabetes tipo 2 muestran anormalidades en la acción de la insulina y de la secreción de la misma. Es ampliamente aceptado que la resistencia a la insulina es un hallazgo precoz antes del inicio de la hiperglicemia y es predictivo de un subsecuente desarrollo de diabetes.
DISCUSIÓN
El concepto de SM o agrupación de factores asociados a mayor riesgo cardiovascular viene gestándose desde hace mucho tiempo. Como expresaran Alberti y cols. la primera descripción corresponde a Kylin en 1923 cuando definió un síndrome consistente en hipertensión, hiperglicemia e hiperuricemia; posteriormente, en 1947, Vague llamó la atención sobre la distribución de la obesidad en el trastorno metabólico, sin embargo, no fue hasta la década de los ochenta en que adquirió mayor interés. En 1988, Reaven describió un síndrome que se basa en un conjunto de anormalidades con mayor riesgo cardiovascular y propuso el término de síndrome X; se refirió a la resistencia a la insulina como el común denominador, así como a la hipercoagulabilidad, los estados proinflamatorios y la microalbuminuria.
(16)
A lo largo de los años se han añadido otros componentes a la definición de este síndrome, a la vez que comenzó a recibir nuevas denominaciones como fueron la de Síndrome X plus, Cuarteto mortífero, Síndrome plurimetabólico, Síndrome de insulinorresistencia, Síndrome de OROP (dislipidemia, resistencia a la insulina, obesidad e hipertensión arterial, por sus siglas en inglés) y otros. En 1998, un grupo consultor de la OMS propuso que se denominara Síndrome Metabólico y sugirió una definición de trabajo que fue la primera designación unificada del mismo.
Este síndrome se caracteriza por la presencia de insulinoresistencia e hiperinsulinismo compensador asociados a trastornos del metabolismo hidrocarbonato, cifras elevadas de presión arterial, alteraciones lipídicas (hipertrigliceridemia, descenso del colesterol-lipoproteína de alta densidad (cHDL), presencia del colesterol-lipoproteína de baja densidad tipo B, aumento de ácidos grasos libres y lipemia postprandial) y obesidad, con un incremento de la morbimortalidad de origen ateroesclerótico, aunque aún no se ha determinado con certeza el riesgo absoluto conferido por el SM en las diferentes poblaciones. Por otra parte, la resistencia a la insulina (RI) se define, clínicamente, como la incompetencia de una determinada concentración de insulina para conseguir el control de la glucosa en sangre. La RI es la base fisiopatológica de la diabetes pero no unifica a todos los aspectos etiológicos del SM; es una anormalidad celular compleja que implica fundamentalmente a los tejidos adiposo, hepático y muscular esquelético. En sus aspectos etiológicos, además de la susceptibilidad genética se involucran la presencia de otros factores ambientales:
(8)
Obesidad central o abdominal. Sedentarismo. Dieta hipercalórica rica en grasas y carbohidratos. Tabaquismo.
Otros factores relacionados con la RI y el SM son:
Hiperuricemia o gota. Hipercoagulabilidad y defectos de la fibrinolisis. Hiperleptinemia o resistencia a la leptina. Y también: homocisteína (papel controvertido en la RI), leucocitosis,
elevación del volumen de sedimentación globular (VSG), hiperandrogenismo, hígado graso, cálculos biliares, osteoporosis, acantosis nigricans, síndrome del ovario poliquístico.
A nivel internacional, en la actualidad no existe un criterio único para definir el SM. Desde la aparición de su primera definición oficial, hasta la actualidad, han surgido disímiles propuestas con el objetivo de identificar a los individuos que lo presentan y de estimar su prevalencia en diferentes poblaciones. Esos conceptos muestran diferencias, no solo con relación a los componentes que se proponen para su diagnóstico, sino también con respecto a los puntos de corte fijados para cada uno de ellos. En la literatura consultada se encontraron cinco grupos de criterios, propuestos por organismos internacionales o locales de expertos, para el diagnóstico del SM; estas fueron las siguientes:
1. World Health Organization (Organización Mundial de la Salud, OMS) 2. European Group for Study of Insulin Resistance (EGIR) 3. National Cholesterol Education Programme (NCEP-ATP III) 4. International Diabetes Federation Consensus Panel (IDF) 5. American College of Endocrinology (ACE)
Todas las definiciones, de los organismos anteriormente citados, tienen en común el agrupar una serie de anormalidades en un mismo individuo, que le imprimen un mayor riesgo de diabetes y de enfermedad cardiovascular, teniendo como base la resistencia insulínica A continuación se describen los diferentes criterios diagnósticos establecidos por dichas organizaciones.
CONCLUSIONES
El SM se ha convertido en una pandemia, gatillado por la creciente prevalencia de obesidad y estilos de vida no saludables. Independientemente de los criterios diagnósticos que se utilicen, el SM afecta cerca del 20% de la población adulta.
El tejido adiposo parece ser el responsable del estado de resistencia a la insulina que caracteriza a este síndrome. La lipotoxicidad producida por los AGL liberados de los adipocitos intraabdomi-nales determina una respuesta inflamatoria y pro-trombótica y la perpetuación del estado de insulino-resistencia. Este fenotipo alterado explica la aparición de los distintos componentes del SM, como hipertensión arterial, dislipidemia y alteración en el metabolismo glucídico.
El tratamiento del SM se basa en la reducción de peso y en la adquisición de un estilo de vida saludable. Una dieta equilibrada, actividad física y suspensión del tabaquismo son medidas fundamentales en el manejo de estos pacientes. En el estado actual del conocimiento, los componentes del SM deben ser tratados de forma individual, buscando alcanzar los objetivos planteados por las guías de manejo respectivas. El uso de moléculas con efectos pleiotrópicos, que inhiban el sistema RAA o actúen sobre PPAR parece promisorio y orientan al estudio de nuevas terapias para estos pacientes.
REFERENCIAS:
1. Kannel WB, Mcgee DL. Diabetes and Cardiovascular disease. The Framinghan Study. J AM Med Assoc 1997: 241: 2035- 2038.
2. Reaven GM. Role of insulin resistance in human disease. Diabetes 1988; 1595-1607. 3. Albert KG, Zimmet PZ. Definition, Diagnosis and Classification of Diabetes Mellitus and its
Complications. Part 1: diagnosis and classification of diabetes mellitus provisional report of a WHO consultation. Diabetes Med 1998; 15: 539-553.
4. Isomaa B et al. Cardiovascular Morbidity and Mortality Associated With the Metabolic Syndrome. Diab Care 2001 24: 638-689.
5. González C, Stern TA, Haffner S et al. The Insulin Resistance Syndrome in Mexico. Prevalence and clinical characteristics: A Population Based Study. Arch Med Res 1995; 26 (suppl): 59-515.
6. Rantala AO, Kauma H, Lilja M et al. Prevalence of Metabolic Sindrome in drug-treated Hypertensive Patients and Control Subjects. J Intern Med 1999; 245(2): 163-174.
7. Wannamethee SG, Shaper AG, Durrington PN et al. Hypertension, Serum-insulin, Obesity and Metabolic Syndrome. J Hum Hypertens 1998; 12(11): 735-741.
8. Vanhala MJ, Kumpusato GA, Tkajarvitk P et al. Metabolic Syndrome in a Middle–Aged Finnish Population. J Cardiovasc Risk 1997; 4(4): 291-295.
9. Trevisan M, Liu J, Bahsas FB, Menotti A. Syndrome X and Mortality a Population–Based Study. Risk Factor and Life Expectancy Research Group. Am J Epidemiol 1998; 148(10): 958-966.
10. ADA. Annual Review of Diabetes 2001. 11. Derk Le Roith, Yehiel Zick. Recent Advances in our Understandind of Insulin Action and
Insulin Resistance Diabetes Care 2001; 24(3): 59-70. 12. DeFronzo RA. Insulin Resistence and Hyperinsulinemia: The Link Between NIDDM,
Hypertension and Dyslipidemia. 13. In: Schwartz CJ, Bon Gd (eds). New Horizons in Diabetes Mellitus and Cardiovascular
Disease. London, UK; Current 14. Science. 1995. 15. Khan CR. The Insulin Receptor, Insulin Action and the Mechanism of Insulin Resistance in
Diabetes and Atheroesclerosis: 16. In: Schuartx CJ, Bom GV (eds). New Horizons in Diabetes Mellitus and Cardiovascular
Disease. London, UK; Current 17. Science. 1995. 18. Bjorntorp P. Body Fat Distribution, Insulin Resistance, and Metabolic Diseases. Nutrition
1997; 13: 795-803. 19. Despres JP, Larmarcha B, Meuriege MSP et al. Hyperinsulinemia as an Independent Risk
Factor for Ischemic Heart Disease. N Engl J Med 1996; 334: 952-957 20. Zimmet P, O’Dea K. Thrifty Genotype. Causes of Diabetes. Genetics and Enviromental
Factors. De. DG Laslie. Wiley & Sons. Chichester 1993: 269-290 21. American Diabetes Association. Consensus Development Conference on Insulin
Resistance. Diabetes Care 1998; 21: 310-314. 22. Grupo de Estudio del Síndrome Metabólico. Consenso Mexicano de Resistencia a la
Insulina y Síndrome Metabólico. Rev Mex Cardiol 1999; 10(1): 3-18. 23. Cholesterol and Recurrent Events Trial Investigators: The effect of pravastatin on
coronary events after myocardial infarction in patients with average cholesterol levels. N Engl J Med 1996; 335: 1001-1009.
24. Air Force-Texas Coronary Atherosclerosis Prevention Study Group: Primary prevention of acute coronary events with lovastatinin men and women with average cholesterol levels:
25. Martinez de Morentín BE, Rodriguez MC, Martinez JA. Síndrome Metabólico, Resistencia a la insulina y metabolismo tisular. Endocrinol Nutr. 2003;50:324-33.
26. Serrano Ríos M. El síndrome metabólico: una versión moderna de la enfermedad ligada al estrés. Rev Esp Cardiol 2005; 58: 768-771.
27. Scarsella C; Después JP. Tratamiento de la obesidad: necesidad de centrar la atención en los pacientes de alto riesgo caracterizados por la obesidad abdominal Cad. Saúde Pública 2003; 19(1): 57-59. Soto N, Mericq VG.' Restricción del crecimiento fetal e insulinorresistencia. Nuevos hallazgos y revisión de la literatura. Rev. méd. Chile 2005; 133(1): 97-104.
28. Weiss R, Dziura J, Burget TS, Tamborlane WV, Taksali SE, Yeckel CW, et al. Obesity and the metabolic syndrome in children and adolescents. New Engl J Med 2004; 350: 2362-74.
29. Estudio en niños obesos del test de tolerancia a la glucosa, lipidograma, tensión arterial, proteína C y niveles de adiponectina. La prevalencia de síndrome metabólico se incrementa significativamente con la severidad de la obesidad y con el aumento de la resistencia a la insulina.
30. Goodman E, Daniels SRD, Meigs JB, Doland LM.Inestability in the diagnosis of metabolic syndrome. Circulation 2007; 115: 2316-22. Revisión de 1.098 adolescentes en seguimiento durante 3 años. En la adolescencia, existe una falta de criterios diagnósticos del SM y, por tanto, el uso de fármacos en los jóvenes es prematuro.
31. Kris-Etherton P, Eckel RH, Howard BV, et al. Nutrition Committee Population Science Committee and Clinical Science Committee of the American Heart Association. AHA
Science Advisory: Lyon Diet Heart Study: benefits of a Mediterranean-style, National Cholesterol Education Program/American Heart Association Step I dietary pattern on cardiovascular disease. Circulation. 2001;103:1823-1825.
32. Harper CR, Jacobson TA. The fats of life: the role of omega-3 fatty acids in the prevention of coronary heart disease. Arch Intern Med. 2001;161:2185-2192.
33. De Lorgeril M, Renaud S, Mamelle N, et al. Mediterranean alphalinolenic acid-rich diet in secondary prevention of coronary heart disease. Lancet. 1994;343:1454-1459. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop.
34. Hypertension (DASH) diet. DASH-Sodium Collaborative Research 35. Group. New Engl J Med. 2001;344:3-10. Physical Activity and Health: A Report of the
Surgeon General. Atlanta, Ga: US Dept of Health and Human Services, Centers for Disease Control and Prevention, National Center for Chronic.
36. Disease Prevention and Health Promotion; 1996. Chakravarthy MV, Joyner MJ, Booth FW. An obligation for primary care physicians to prescribe physical activity to sedentary patients to reduce the risk of chronic health conditions. Mayo Clin Proc. 2002;77:165-173.
37. Knowler WC, Barrett-Connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med. 2002;346:393-403.
38. Blair SN, Dunn AL, Marcus BH, et al. Active Living Every Day: 20 Weeks to Lifelong Vitality. Champaign, Ill: Human Kinetics: 2001. Available at: http://www.humankinetics.com. Accessed September 27, 2002. Dunn AL, Marcus BH, Kampert JB, et al. Comparison of lifestyle and structured interventions to increase physical activity and cardiorespiratory fitness: a randomized trial. JAMA. 1999;281:327-334.
39. Eden KB, Orleans CT, Mulrow CD, et al. Does counseling by clinicians improve physical activity? A summary of the evidence for the US Preventive Services Task Force. Ann Intern Med. 2002;137:208-215.
Aarón Aguirre Viam Asesor de aplicaciones de Diagnóstico Consultor de laboratorios clínicos. ID: 72*706373*9