Qué Es Un Modelo Atómico
-
Upload
jose-lara-suarez -
Category
Documents
-
view
249 -
download
3
description
Transcript of Qué Es Un Modelo Atómico
Modelos atomicos
Alumna: Betsabe Diego Valenciadmodelos atomicos
CEP LA ALBORADA
Modelos atmicos
Qu es un modelo atmico?Un modelo atmico es una idea aproximada de lo que es un tomo. El modelo atmico que utilices depende de para qu lo quieras. El modelo atmico ms sencillo que se me ocurre es imaginarse al tomo como una canica muy pequeita ("modelo de la canica"). Si lo queremos complicar un poco ms, puedes verlo como un sistema planetario de ncleo y electrones girando alrededor ("modelo planetario"). Los modelos atmicos ms exactos utilizan complicadas expresiones de matemticas avanzadas. Entre los mltiples usos del trminomodelo, se encuentra aquel que asocia el concepto a una representacin o un esquema.Atmico, por su parte, es lo que est vinculado altomo(la cantidad ms pequea de un elemento qumico que es indivisible y que tiene existencia propia).
Unmodelo atmico, por lo tanto, consiste enrepresentar, de manera grfica, la materia en su dimensin atmica. El objetivo de estos modelos es que el estudio de este nivel material resulte ms sencillo gracias a abstraer la lgica del tomo y trasladarla a unesquema.Existen distintos tipos de modelos atmicos. Elmodelo atmico de Bohro deBohr-Rutherford, por ejemplo, es un modelo cuantizado del tomo que se desarroll para dar explicacin a la forma en que los electrones logran trazar rbitas que resultan estables en torno al ncleo. Este modelo funcional no se basa en la representacin fsica del tomo: se orienta, en cambio, a usarecuacionespara explicar su funcionamiento.Elmodelo atmico de Schrdinger, por su parte, es un modelo cuntico no relativista sustentando en la resolucin de la llamadaecuacin de Schrdingerpara un potencial electrosttico con simetra esfrica.Personaje este, el citado Erwin Schrdinger, un fsico austraco que fue galardonado en el ao 1933 con el Premio Nobel de Fsica por haber llevado a cabo lo que era el desarrollo de la mencionada ecuacin de Schrdinger que est considerado como el fundador del mtodo atmico actual. A travs de ella lo que se consigue es realizar la descripcin de la evolucin temporal de lo que es una partcula masiva pero no relativista.En concreto, como decamos anteriormente, este cientfico est considerado como el padre del modelo atmico actual que tambin es conocido con el nombre de Ecuacin de Onda. Una denominacin bajo la cual se enclava una frmula matemtica que tiene como principios valores tales como la dualidad de la materia, la llamada probabilidad en un lugar de certeza, los niveles de energa o estados estacionarios as como la presencia de un ncleo atmico con respecto a las partculas conocida.
Otro modelo atmico es el deThomson, tambin conocido comomodelo del pudn. Se trata de unateorapropuesta porJoseph John Thomson(quien descubri el electrn) acerca de la estructura atmica.Por ltimo podemos mencionar almodelo atmico de Rutherford, ideado porErnest Rutherfordpara brindar una explicacin sobre el resultado de sus experimentos con lminas de oro. Este fsico y qumico indic que los tomos disponen de electrones y que stos se hallan girando alrededor de un ncleo central. Dicho ncleo, paraRutherford, concentrara casi la totalidad de la masa y toda la carga positiva de un tomo.De la misma forma tampoco podemos pasar por alto el modelo atmico de Dalton. A principios del siglo XIX sera cuando vio la luz dicho planteamiento que, aunque tena ciertos errores, supuso un hito muy importante en aquel momento y es que ofreci unos importantes avances en lo que respecta a la estructura de la materia.Entre los principales pilares de dicha teora destacan ideas como que la materia est conformada por partculas denominadas tomos, que los tomos que pertenecen a un mismo elemento son idnticos o que estos citados tomos no se pueden dividir.
Definicin de modelo atmico educativo
Unmodelo educativoconsiste en una recopilacin o sntesis de distintasteorasyenfoques pedaggicos, que orientan a los docentes en la elaboracin de losprogramas de estudiosy en la sistematizacin del proceso deenseanzayaprendizaje.
En otras palabras, un modelo educativo es unpatrn conceptuala travs del cual se esquematizan las partes y los elementos de un programa de estudios. Estos modelos varan de acuerdo al periodo histrico, ya que su vigencia y utilidad depende del contexto social.Al conocer un modelo educativo, eldocentepuede aprender cmo elaborar y operar un plan de estudios, teniendo en cuenta los elementos que sern determinantes en laplaneacin didctica. Por eso, se considera que el mayor conocimiento del modelo educativo por parte del maestro generar mejores resultados en el aula.Elmodelo educativo tradicionalse centra en la elaboracin de un programa de estudios, sin demasiados elementos adicionales ya que no se tienen en cuenta de forma explcita las necesidades sociales ni la intervencin de especialistas, entre otros factores.Este modelo educativo contempla la figura delprofesor(que cumple un papel activo), elmtodo(la clase tipo conferencia), elalumno(con un papel receptivo) y lainformacin(los contenidos presentados como distintos temas).En este sentido, el modelo tradicional presenta una escasa influencia de los avances cientfico-tecnolgicos en laeducacin, por lo que resulta algo limitado en la actualidad. De todas formas, se reconoce su utilidad comobase pedaggicaen la formacin de diversas generaciones de profesores y de alumnos.Modelo atmico actualElmodelo de Bohresdeterminista, pero funcionaba muy bien para el tomo de hidrgeno. En los espectros realizados para otros tomos se observaba que los electrones de un mismo nivel energtico tenan distinta energa. Algo andaba mal. La conclusin fue que dentro de un mismo nivel energtico existansubniveles.En 1916, Arnold Sommerfeldmodifica el modelo atmico de Bohr, en el cual los electrones slo giraban en rbitas circulares, al decir que tambin podan girar enrbitas elpticas.Esto dio lugar a un nuevo nmero cuntico:"Elnmero cuntico azimutal o secundario", que determina la forma de los orbitales, se lo representa con la letra "l" y toma valores que van desde 0 hasta n-1.Los modelos atmicos de Bohr y de Sommerfeld nacieron de la combinacin de aspectos de la mecnica clsica newtoniana con aspectos de la teora cuntica de Planck, constituyendo lateora cuntica antigua.La imposibilidad de abordar el mundo subatmico con los principios de la mecnica clsica condujo al fracaso de ambos modelos y al desarrollo, en la segunda dcada del siglo XX, de una nuevamecnica cuntica.
El edificio de la nueva mecnica cuntica se basa en tres pilares: la teora de Planck, y en otros dos principios fundamentales, la dualidad onda-corpsculo de De Broglie y el principio de incertidumbre de Heisemberg.El modelo atmico actual llamado "modelo orbital" o "cuntico - ondulatorio" se basa en:Ladualidad onda-corpsculo: Louisde Broglie.(1924) postula que el electrn y toda partcula material en movimiento tienen un comportamiento ondulatorio. Las propiedades ondulatorias y corpusculares de la materia se relacionan mediante:
Siendohla constante de Planck ypel momento lineal de la partculaElprincipio de incertidumbre de Heisenberg(1927) establece la imposibilidad de determinar simultneamente y con precisin la posicin y el momento lineal de una partcula en un momento dado. Ya no se podra decir dnde se encontrara con exactitud una partcula, como mximo se podra llegar a precisar el punto en dnde se hallara con mayor probabilidad."Es imposible determinar simultneamente y con exactitud, la posicin y la velocidad del electrn".El producto de las imprecisiones de esas magnitudes e ve afectado por la restriccin dada por la ecuacin:
La naturaleza ondulatoria del electrn permite que este sea descrito por una ecuacin de ondas.Schrdinger(1926) formul una ecuacin (ecuacin de ondas de Schrdinger) que describe el comportamiento y la energa de las partculas subatmicas. Esta ecuacin incorpora tanto el comportamiento de partcula, en trminos de la masa m, como el de onda, en trminos de unafuncin de onda , que depende de la ubicacin del sistema en el espacio.La ecuacin de onda de Schrdinger, toma la forma:
Donde H es un operador matemtico llamado Hamiltoniano y E es la energa de los niveles permitidos. La funcin de ondacarece de significado fsico en si misma. pero su cuadrado en una determinada regin del espacio2es un indicador de la probabilidad de encontrar el electrn en dicha regin espacial.Cada solucin de la ecuacin de ondas de Schrdinger describe un posible estado del electrn, que se denomina orbital atmico, concepto anlogo al de rbita en el modelo de Bohr. El valor tan bajo de la constante de Planck h=6,62610-34Jsimpide percibir el comportamiento ondulatorio de la materia en objetos grandes o cotidianos, ya que la longitud de onda asociada es tan pequea que dicho comportamiento resulta indetectable. Aunque con lamecnica cunticaqueda claro que no se puede saber dnde se encuentra un electrn, s define la regin en la que puede encontrarse en un momento dado. El cuadrado de la funcin de onda,2, define la distribucin dedensidad electrnicaalrededor del ncleo. Este concepto de densidad electrnica da laprobabilidadde encontrar un electrn en una cierta regin del tomo, llamadaorbital. Las regiones de alta densidad electrnica representan la mayor probabilidad de localizar un electrn, mientras que lo contrario se aplica a regiones de baja densidad electrnica. En la descripcin de un tomo en el contexto de la mecnica cuntica, se sustituye el concepto de rbita por el deorbital atmico. Un orbital atmico es la regin del espacio alrededor del ncleo en el que laprobabilidadde encontrar un electrn es mxima. Cada orbital tiene asociado un valor de2y un ciertovalor de energa.[E=f(nAunque con la mecnica cuntica queda claro que no se puede saber con certeza dnde se encuentra un electrn, s define la regin en la que puede encontrarse en un momento dado. El cuadrado de la funcin de onda, 2, define la distribucin de densidad electrnica alrededor del ncleo. Este concepto dedensidad electrnicada la probabilidad de encontrar un electrn en una cierta regin del tomo, llamada orbital. Las regiones de alta densidad electrnica representan la mayor probabilidad de localizar un electrn, mientras que lo contrario se aplica a regiones de baja densidad electrnica.Losdiagramas de superficie lmiteencierran el 90 % de probabilidad de localizar el electrn.Losdiagramas de contorno de probabilidad como los representados en la figura,son curvas que encierran diferentes porcentajes de probabilidad electrnica.Lasolucin matemtica de la ecuacin de Schrdingerprecisa detres nmeros cunticos. Cada tro de valores de estos nmeros describe un orbital. N cuntico principal (n): puede tomar valores enteros (1, 2, 3...) y coincide con el mismo n cuntico introducido por Bohr. Est relacionado con la distancia promedio del electrn al ncleo en un determinado orbital y, por tanto, con el tamao de este e indica el nivel de energa. N cuntico secundario (): puede tener todos los valores desde 0 hasta n 1. Est relacionado con la forma del orbital e indica el subnivel de energa. N cuntico magntico (m): puede tener todos los valores desde - hasta + pasando por cero. Describe la orientacin espacial del orbital e indica el nmero de orbitales presentes en un subnivel determinado.
Para explicar determinadas caractersticas de los espectros de emisin se consider que los electrones podan girar en torno a un eje propio, bien en el sentido de las agujas del reloj, bien en el sentido contrario. Para caracterizar esta doble posibilidad se introdujo eln cuntico de espn (ms)que toma los valores de + o - .(n,, m)Definen un orbital(n, , m, ms)Definen a un electrn en un orbital determinadoLaconfiguracin electrnicade un tomo es la manera en que estn distribuidos los electrones entre los distintos orbtales atmicos.El conocimiento de las configuraciones electrnicas es fundamental para entender y predecir las propiedades de los elementos.En el estado fundamental de un tomo, los electrones ocupan orbtales atmicos de tal modo que la energa global del tomo sea mnima.Se denominaprincipio de construccin(Aufbau) al procedimiento para deducir la configuracin electrnica de un tomo, y consiste en seguir un orden para el llenado de los diferentes orbtales, basado en los diferentes valores de la energa de cada uno de ellos. Para recordarlo se utiliza eldiagrama de Mllero de las diagonales, as como la regla de la mnima energa (n+l)..Adems del principio de construccin hay que tener en cuenta:El principio de exclusin de Pauli: establece que no es posible que dos electrones de un tomo tengan los mismos cuatro nmeros cunticos iguales. Esto implica que en un mismo orbital atmico slo pueden coexistir dos electrones con espines opuestos.La regla de Hund: establece que si hay ms de un orbital en un mismo subnivel, los electrones estn lo ms desapareados posibles, ocupando el mayor nmero de ellos.Elmodelo atmico de Daltonsurgido en el contexto de la qumica, fue el primermodeloatmico con bases cientficas, formulado entre 1803 y 1807 porJohn Dalton.Modelo Atmico de Dalton
El modelo permiti aclarar por primera vez por qu las sustancias qumicas reaccionaban enproporciones estequiomtricasfijas (Ley de las proporciones constantes), y por qu cuando dos sustancias reaccionan para formar dos o ms compuestos diferentes, entonces las proporciones de estas relaciones son nmeros enteros (Ley de las proporciones mltiples). Por ejemplo 12 g de carbono (C), pueden reaccionar con 16 g de oxgeno (O2) para formarmonxido de carbono(CO) o pueden reaccionar con 32 g de oxgeno para formardixido de carbono(CO2). Adems el modelo aclaraba que an existiendo una gran variedad de sustancias diferentes, estas podan ser explicadas en trminos de una cantidad ms bien pequea de constituyentes elementales o elementos. En esencia, el modelo explicaba la mayor parte de la qumica defines del siglo XVIII y principios del siglo XIX, reduciendo una serie de hechos complejos a una teora combinatoria realmente simple.Postulados de DaltonDalton explic suteoraformulando una serie de enunciados simples:11. Lamateriaest formada por partculas muy pequeas llamadastomos, que son indivisibles y no se pueden destruir.2. Los tomos de un mismo elemento son iguales entre s, tienen el mismo peso e iguales propiedades. Los tomos de diferentes elementos tienen peso diferente. Comparando el peso de los elementos con los del hidrgeno tomado como la unidad propuso el concepto depeso atmico relativo.3. Los tomos permanecen sin divisin, aun cuando se combinen en lasreacciones qumicas.4. Los tomos, al combinarse para formarcompuestosguardan relaciones simples.5. Los tomos de elementos diferentes se pueden combinar en proporciones distintas y formar ms de un compuesto.6. Los compuestos qumicos se forman al unirse tomos de dos o ms elementos distintos.La materia est formada por partculas muy pequeas llamadas tomos. Estos tomos no se pueden dividir ni romper, no se crean ni se destruyen en ninguna reaccin qumica, y nunca cambian.Insuficiencias del modeloLa hiptesis de John Dalton, que afirmaba que los elementos en estado gaseoso eranmonoatmicosy que los tomos de los elementos se combinaban en la menor proporcin posible para formartomos de los compuestos, lo que hoy llamamosmolculas, gener algunas dificultades. Por ejemplo, Dalton pens que la frmula delaguaera HO. En consecuencia de esto se realizaron clculos errneos sobre la masa y peso de algunos compuestos bsicos.
Modelo atmico de Thomson
Elmodelo atmico de Thomsones una teora sobre la estructuraatmicapropuesta en 1904 porJoseph John Thomson, quien descubri elelectrn1en 1897, mucho antes del descubrimiento delprotny delneutrn. En dicho modelo, eltomoest compuesto porelectronesde carga negativa en un tomo positivo, embebidos en ste al igual que las pasas de un budn. A partir de esta comparacin, fue que el supuesto se denomin"Modelo del budn de pasas".23Postulaba que los electrones se distribuan uniformemente en el interior del tomo suspendidos en una nube de carga positiva. El tomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeos grnulos. La herramienta principal con la que cont Thomson para su modelo atmico fue la electricidad.Insuficiencias del modeloSi bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la qumica y los rayos catdicos, haca predicciones incorrectas sobre la distribucin de la carga positiva en el interior de los tomos. Las predicciones del modelo de Thomson resultaban incompatibles con los resultados delexperimento de Rutherford,4que sugera que la carga positiva estaba concentrada en una pequea regin en el centro del tomo, que es lo que se conoci comoncleo atmico. Elmodelo atmico de Rutherford, permiti explicar esto ltimo, revelando la existencia de un ncleo atmico cargado positivamente y de elevada densidad.5Otro hecho que el modelo de Thomson haba dejado por explicar era la regularidad de la tabla peridica de Mendeleiev. Los modelos de Bohr, Sommerfeld y Schrdinger finalmente explicaran las regularidades peridicas en las propiedades de los elementos qumicos de la tabla, como resultado de una disposicin ms estructurada de los electrones en el tomo, que ni el modelo de Thomson ni el modelo de Rutherford haban considerado.
Modelo atmico de Rutherford.
Elmodelo atmico de Rutherfordes unmodelo atmicoo teora sobre la estructura interna deltomopropuesto por el qumico y fsico britnico-neozelandsErnest Rutherfordpara explicar los resultados de su"experimento de la lmina de oro", realizado en 1911.El modelo de Rutherford fue el primer modelo atmico que consider al tomo formado por dos partes: la "corteza" (luego denominada periferia), constituida por todos sus electrones, girando a gran velocidad alrededor de un "ncleo" muy pequeo; que concentra toda la carga elctrica positiva y casi toda la masa del tomo.Rutherford lleg a la conclusin de que la masa del tomo se concentraba en una regin pequea de cargas positivas que impedan el paso de las partculas alfa. Sugiri un nuevo modelo en el cual el tomo posea un ncleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa..Importancia del modelo y limitacionesLa importancia del modelo de Rutherford residi en proponer por primera vez la existencia de un ncleo en el tomo (trmino que, paradjicamente, no aparece en sus escritos). Lo que Rutherford consider esencial, para explicar los resultados experimentales, fue "una concentracin de carga" en el centro del tomo, ya que sin ella, no poda explicarse que algunas partculas fueran rebotadas en direccin casi opuesta a la incidente. Este fue un paso crucial en la comprensin de la materia, ya que implicaba la existencia de unncleo atmicodonde se concentraba toda lacarga positivay ms del 99,9% de lamasa. Las estimaciones del ncleo revelaban que el tomo en su mayor parte estaba vaco.Rutherford propuso que loselectronesorbitaran en ese espacio vaco alrededor de un minsculo ncleo atmico, situado en el centro del tomo. Adems se abran varios problemas nuevos que llevaran al descubrimiento de nuevos hechos y teoras al tratar de explicarlos:
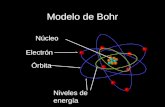
Modelo atmico de Bohr
Elmodelo atmico de Bohrode Bohr-Rutherfordes un modelo clsico del tomo, pero fue el primermodelo atmicoen el que se introduce unacuantizacina partir de ciertos postulados. Fue propuesto en1913por el fsico dansNiels Bohr, para explicar cmo loselectronespueden tenerrbitas establesalrededor delncleoy por qu los tomos presentaban espectros de emisin caractersticos (dos problemas que eran ignorados en elmodelo previo de Rutherford). Adems el modelo de Bohr incorporaba ideas tomadas delefecto fotoelctrico, explicado porAlbert Einsteinen1905..Postulados de BohrEn1913,Niels Bohrdesarroll su clebre modelo atmico de acuerdo a tres postulados fundamentales:1Primer postuladoLos electrones describen rbitas circulares en torno al ncleo del tomo sin irradiar energa.Segundo postuladoNo toda rbita para electrn est permitida, tan solo se puede encontrar en rbitas cuyo radio cumpla que elmomento angular del electrn sea un mltiplo entero Tercer postuladoEl electrn solo emite o absorbe energa en los saltos de una rbita permitida a otra. En dicho cambio emite o absorbe un fotn cuya energa es la diferencia de energa entre ambos niveles. Este fotn, segn laley de Plancktiene una energa:
dondeidentifica la rbita inicial yla final, yes la frecuencia.
Modelo atmico de SommerfeldElModelo atmico de Sommerfeldes un modelo atmico hecho por el fsico alemnArnold Sommerfeld(1868-1951) que bsicamente es una generalizacin relativista delmodelo atmico de Bohr(1913).
Caractersticas del modeloEn 1916, Sommerfeld perfeccion el modelo atmico de Bohr intentando paliar los dos principales defectos de ste. Para eso introdujo dos modificaciones bsicas: rbitas casi-elpticaspara los electrones y velocidades relativistas. En el modelo de Bohr los electrones slo giraban en rbitas circulares. Laexcentricidadde la rbita dio lugar a un nuevonmero cuntico: elnmero cuntico azimutal, que determina la forma de los orbitales, se lo representa con la letraly toma valores que van desde 0 hastan-1. Las rbitas son: l= 0 se denominaran posteriormenteorbitalessosharp l= 1 se denominaranpoprincipal. l= 2 se denominarandodiffuse. l= 3 se denominaranfofundamental.
Para hacer coincidir las frecuencias calculadas con las experimentales, Sommerfeld postul que elncleodel tomo no permanece inmvil, sino que tanto el ncleo como el electrn se mueven alrededor del centro de masas del sistema, que estar situado muy prximo al ncleo al tener este una masa varios miles de veces superior a la masa del electrn.Para explicar el desdoblamiento de las lneas espectrales, observando al emplearespectroscopiosde mejor calidad, Sommerfeld supuso que las rbitas del electrn pueden ser circulares y elpticas. Introdujo el nmero cuntico secundario o azimutal, en la actualidad llamado l, que tiene los valores 0, 1, 2,(n-1), e indica el momento angular del electrn en la rbita en unidades de, determinando los subniveles de energa en cada nivel cuntico y la excentricidad de la rbita.
Modelo atmico de Schrdinger
Elmodelo atmico de Schrdinger(1924) Es unmodelo cunticonorelativista. Se basa en la solucin de laecuacin de Schrdingerpara un potencial electrosttico con simetra esfrica, llamado tambintomo hidrogenoide. En este modelo los electrones se contemplaban originalmente como una onda estacionaria de materia cuya amplitud decaa rpidamente al sobrepasar el radio atmico.Elmodelo de Bohrfuncionaba muy bien para eltomodehidrgeno. En los espectros realizados para otros tomos se observaba que electrones de un mismo nivel energtico tenan energas ligeramente diferentes. Esto no tena explicacin en el modelo de Bohr, y sugera que se necesitaba alguna correccin. La propuesta fue que dentro de un mismo nivel energtico existan subniveles. La forma concreta en que surgieron de manera natural estos subniveles, fue incorporando rbitas elpticas y correcciones relativistas. As, en1916,Arnold Sommerfeldmodific el modelo atmico de Bohr, en el cual los electrones slo giraban enrbitascirculares, al decir que tambin podan girar en rbitas elpticas ms complejas y calcul los efectos relativistas.
Caractersticas del modeloEl modelo atmico de Schrdinger conceba originalmente los electrones comoondas de materia. As la ecuacin se interpretaba como la ecuacin ondulatoria que describa la evolucin en el tiempo y el espacio de dicha onda material. Ms tardeMax Bornpropuso una interpretacin probabilstica de lafuncin de ondade los electrones. Esa nueva interpretacin es compatible con los electrones concebidos como partculas cuasi puntuales cuya probabilidad de presencia en una determinada regin viene dada por la integral del cuadrado de la funcin de onda en una regin. Es decir, en la interpretacin posterior del modelo, ste era modeloprobabilistaque permita hacer predicciones empricas, pero en el que la posicin y lacantidad de movimientono pueden conocerse simultneamente, por elprincipio de incertidumbre. As mismo el resultado de ciertas mediciones no estn determinadas por el modelo, sino slo el conjunto de resultados posibles y su distribucin.Insuficiencias del modelo Si bien el modelo de Schrdinger describe adecuadamente la estructura electrnica de los tomos, resulta incompleto en otros aspectos:1. El modelo de Schrdinger en su formulacin original no tiene en cuenta elespnde los electrones, esta deficiencia es corregida por elmodelo de Schrdinger-Pauli.1. El modelo de Schrdinger ignora los efectos relativistas de los electrones rpidos, esta deficiencia es corregida por laecuacin de Diracque adems incorpora la descripcin del espn electrnico. 1. El modelo de Schrdinger si bien predice razonablemente bien los niveles energticos, por s mismo no explica por qu un electrn en un estado cuntico excitado decae hacia un nivel inferior si existe alguno libre. Esto fue explicado por primera vez por laelectrodinmica cunticay es un efecto de laenerga del punto cerodelvaco cuntico. Cuando se considera un tomo de hidrogeno los dos primeros aspectos pueden corregirse aadiendo trminos correctivos al hamiltoniano atmico.