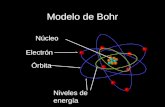
Modelo Atómico de Borh
-
Upload
antogiovannini -
Category
Education
-
view
122 -
download
0
Transcript of Modelo Atómico de Borh

Modelo Atómico de Bohr.-
Profesorado de Química.Alumnas:Lazo Florencia.-Giovannini Antonella.-Profesor:Mainero Pedro.

MODELO ATÓMICO DE BOHR.-
•Físico danés, que hizo aportaciones fundamentales en el campo de la física nuclear y en el de la estructura atómica. •Su modelo sobre la estructura atómica fue publicado en el año 1913.•La teoría de la estructura atómica de Bohr, que le valió el Premio Nobel de Física en 1922.


Bunsen y Kirchoff, aportes al modelo de Bohr.-Un objeto sólido caliente produce luz en
espectro continuo.Un gas tenue produce luz con líneas
espectrales en longitudes de onda discretas que dependen de la composición química del gas.-
Un objeto sólido a alta temperatura rodeado de un gas tenue a temperaturas inferiores produce luz en un espectro continuo con huecos en longitudes de onda discretas cuyas posiciones dependen de la composición química del gas.-

Lo niveles de energía permitidos son múltiplos de la constante de Planck.
Cuando un electrón pasa de un nivel de energía a otro, se absorbe o emite energía. Cuando el electrón esta en n=1 se dice que esta en el nivel fundamental (nivel de mínima energía); al cambiar de nivel el electrón absorbe energía y pasa a llamarse electrón excitado.
Cuando un electrón pasa de una órbita externa a una mas interna la diferencia de energía entre varias orbitas se emiten en forma de radiación electromagnética.


Las nuevas ideas sobre la cuantizacion de energía
formulada en el modelo de Borh, son las siguientes: El electrón gira en unas orbitas circulares al
rededor del núcleo, y cada orbita es un estado estacionario que va asociado a un numero natural “n” y toma valores 1 al 7.
Los electrones del orbital, el átomo en niveles discretos y cuantizados de energía, es decir, no todas las orbitas están permitidas tan solas un numero finito de estas.-
Así mismo cada nivel n esta formado por distintos subniveles, “l”. Y su vez estos se desdoblan en otros, “m”. Y por ultimo hay un cuarto numero cuántico que se refiere al sentido “s”.-


¿Cómo Interpreta Bohr La Existencia De Los Espectros Atómicos?
El electromagnetismo clásico predecía que una partícula cargada moviéndose de un forma circular emitiría energía y por lo tanto los electrones debería colapsar sobre el núcleo en breve instaste en tiempo.
Para superar este problema Borh supuso que los electrones solamente se podían mover en orbitas especificas, cada una de las cuales caracterizadas por su nivel energético, de esta manera giraban alrededor del núcleo sin emitir energía y por lo tanto mientras se mantuvieran en ese nivel, no perderían ni ganarían energía.-

¿Cuál Es El Concepto Fundamental De Este Modelo?
Cualquiera sea la órbita del electrón, este no emite energía radiante.
Únicamente son posibles aquellas orbitas para las que el momento angular del electrón es un múltiplo entero de h/2π.
Momento angular =m.v.r = La energía liberada al caer el electrón de una
órbita superior activada a otra más cerca del núcleo de menor o nula activación, se emite por medio de un fotón o cuanto de energía.

Reconocimiento de Iones MetálicosElementos utilizados: vela,
pulverizador, agua, cloruro de sodio, sulfato cúprico.-

Experiencia con Sulfato Cúprico:

Experencia con Cloruro de Sodio (Sal de Mesa)