Modelo atómico 1° medio
-
Upload
daniel-krashtchenko -
Category
Travel
-
view
1.610 -
download
2
description
Transcript of Modelo atómico 1° medio


1-Biografia
2-postulados
3-modelo atómico
4-espectro

Nació el 7 de octubre de 1885 en Copenhague. Hijo de un profesor de fisiología, cursó estudios en la universidad de su ciudad natal, doctorándose en 1911. En ese mismo año viaja para estudiar en la Universidad de Cambridge (Inglaterra) con la intención de estudiar física nuclear con J.J. Thomson, aunque pronto se trasladó a la Universidad de Manchester para trabajar con ErnestRutherford.

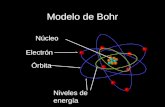
1-Primer Postulado:
Los electrones giran alrededor del
núcleo en órbitas estacionarias sin emitir
energía

Segundo postulado:
Cuando un electrón pasa de una órbita
externa a una más interna, la diferencia de
energía entre ambas órbitas se emite en
forma de radiación electromagnética.

El electrón no puede girar en cualquier
órbita, sino sólo en un cierto número de
órbitas estables. En el modelo de Rutherford
se aceptaba un número infinito de órbitas.

Cuando el electrón gira en estas órbitas no
emite energía.
Cuando un átomo estable sufre una
interacción, como puede ser el imapacto
de un electrón o el choque con otro
átomo, uno de sus electrones puede pasar
a otra órbita estable o ser arrancado del
átomo.

El átomo de hidrógeno tiene un núcleo con un protón.
El átomo de hidrógeno tiene un electrón que está girando en la primera órbita alrededor del núcleo. Esta órbita es la de menor energía.
Si se le comunica energía a este electrón, saltará desde la primera órbita a otra de mayor energía. cuando regrese a la primera órbita emitirá energía en forma de radiación luminosa.

Normalmente el electrón en un
átomo de hidrógeno se encuentra en
la órbita más próxima al núcleo (n=1).
Esta es la energía permitida más baja,
o el estado fundamental. Cuando el
electrón adquiere un cuanto de
energía pasa a un nivel más alto
(n=2,3, ...) se dice entonces que el
átomo se encuentra en un estado
excitado. En este estado excitado el
átomo no es estable y cuando el
electrón regresa a un estado más
bajo de energía emite una cantidad
determinada de energía, que es la

La Energía (E) equivalente a 1 “cuanto”
de energía, viene dada por:
En donde:
E: Energía de 1 cuanto de luz (J)
h: constante de planck.
ν: Frecuencia, expresada en Hz o s-1
*E h
346.63*10 *J s


La luz blanca produce al
descomponerla lo que llamamos un
espectro continuo, que contiene el
conjunto de colores que corresponde
a la gama de longitudes de onda
que la integran.