Evolución del modelo atómico
-
Upload
nayla-fernandez -
Category
Documents
-
view
388 -
download
3
description
Transcript of Evolución del modelo atómico

EVOLUCIÓN DEL MODELO ATÓMICO
LA ESTRUCTURA Y LAS PROPIEDADES DE LAS SUTANCIAS I
U.E.P. Nº 57 “Fray Mamerto Esquiú” - Esp. Prof. Fernández, Nayla S

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
460-370 a. C.
1807
1896
Filósofos Griegos y otros…
Teoría Atómica de Dalthon
1897
Radiactividad
Descubrimiento de los electrones

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
1898
1911
Modelo Atómico de Thomson
Modelo Atómico de Rutherford
1913
Descubrimiento del protón
1919
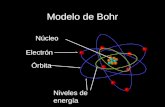
Modelo atómico de Borh

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
1932 Descubrimiento del neutrón
Modelo Atómico Rutherford - Bohr
Correcciones

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Modelo Atómico Actual Mecánico-
Cuántico
Se basa en la Teoría de
PlanckSe inicia con los Trabajos
Dualidad onda-partícula de
De Broglie
Principio de Incertidumbre de
Heisenberg
Mecánica Ondulatoria de
Schödinger
ACELERADORES

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Demócrito sostuvo que la materia estaba constituida por “átomos” (indivisible)
Durante las épocas de Platón y Aristóteles la perspectiva atómica se desvaneció.
Resurge la idea de átomo en Europa cuando los científicos intentan explicar las propiedades de los gases. Newton (1642-1727)

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Apoya la idea de átomo
“Bloques fundamentales de los elementos”
A medida que se combinaban elementos para formar nuevas sustancias, se establecían los
cimientos de una Teoría Atómica que vinculaba la idea de elemento con la de
átomo.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Postulados:1- Cada elemento está formado por 2- Los de un elemento son idénticos entre
sí, masa y propiedades, pero los de un elemento son diferentes a los de otro elemento.
3- Los de un elemento no pueden transformarse en otros, no se crean ni se destruyen.
4- Los compuestos se forman cuando los de más de un elemento se combinan. Explican

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
LEYES sobre combinaciones
químicas
LEY DE LA COMPOSICIÓN CONSTANTE (4)
LEY DE LA CONSEVACIÓN DE MASA (3)
LEY DE LAS PROPORCIONES
MÚLTIPLES
Ni él ni quienes lo siguieron durante un siglo después de su trabajo, contaron con evidencia directa de la existencia del átomo. Sus observaciones se basaron en observaciones macroscópicas en el laboratorio.

Joseph Thomson (1856-1940) Tubos de descarga
U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
RAYOS CATÓDICOS

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Son radiaciones que se propagan en línea recta, constituidas por partículas materiales dotadas de carga eléctrica negativa.
Robert Millikan 1909. Experiencia de la gota de aceite
ELECTRÓN Masa: 9,1.10-28 gCarga: 1,6.10-19 cuolomb

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Descubierta por el físico Henri Bequerel, es la propiedad que tienen ciertos elementos químicos de emitir radiaciones, y Marie Curie le dio el nombre.
Alfa: partícula eléctrica positiva
poco penetrante. He
Beta: formada por electrones negativos, son más penetrante
que las alfa.
Gama: son radiaciones electromagnéticas, se mueven a altas velocidad, no tienen carga eléctrica y tienen gran poder de
penetración

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
El átomo es una esfera sólida cargada
uniformemente de electricidad positiva,
dentro de la cual están incrustados los
electrones negativos. El número de éstos es
suficiente para neutralizar las cargas positivas
de la esfera, de modo que es eléctricamente
neutro.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Se basó en la siguiente experiencia:
Con la interpretación de estos resultados propuso el siguiente
modelo

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
El átomo está formado por un núcleo central con carga +, rodeado de electrones –
El núcleo es muy pequeño con relación al diámetro total, pero contiene la mayor parte de la masa atómica. Lo que indica que tienen grandes espacios vacíos.
Los electrones giran alrededor del núcleo sin chocar con él.
El número de electrones compensa la carga + del núcleo, por lo que el átomo resulta neutro.
Los electrones tienen masa despreciable. Problemas.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Si los electrones estuvieran en reposo, serían atraídos por el núcleo por tener carga opuesta y caerían en él.
Carga eléctrica en movimiento irradia energía en forma de onda electromagnética. Esta pérdida de energía reduciría la velocidad, lo cual le restaría capacidad para resistir la atracción del núcleo; y al cabo de un tiempo caería en él.
Electrones giran alrededor del núcleo para contrarrestar la atracción nuclear.
Espectros ópticos.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Por Rutherford, cuando se disparaban partículas alfas contra un gas de nitrógeno.
Anteriormente, Goldstein en 1886, ya había utilizado el término protones a las cargas eléctricas (iones positivos) que constituían los rayos canales, cuando experimentaba con tubos de descargas que contenían hidrógeno.
Masa: 1,67.10-24 g Carga Eléctrica: 1,6.10-19 coulomb

Espectro es la secuencia de bandas de colores que van desde el rojo hasta el violeta.
Fenómeno descubiertopor Issac Newton
U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Los diferentes colores del espectro dependen de la longitud de onda de las radiaciones, que les corresponden distintas energía.
Las sustancias al ser calentadas emiten radiaciones luminosas de colores característicos, y el espectro está formado por un conjunto de líneas muy finas de colores separadas por espacios oscuros; denominado ESPECTRO DE RAYAS

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Cada elemento químico origina un espectro de rayas que le es característico, y que es distinto al de otros elementos.
Bohr explica la causa de estos espectros tomando como base la teoría cuántica de Planck, la cual sostiene que la energía es discontinua y está formada por
Bohr sostuvo que los electrones no pueden encontrarse en el átomo con cualquier cantidad de energía, sino con valores concretos y definidos; en niveles de energía
cuantos

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Cuanto: cantidad elemental de energía que una partícula puede emitir o absorber en forma de radiación electromagnética.
Nivel de energía: es la órbita o capa donde gira el electrón alrededor del núcleo, se identifican con Nº naturales, denominado “Número Cuántico Principal n”.
El de menor energía es n=1 y está más cerca del núcleo.El nº de electrones por nivel 2.n2
n=1
n=2

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Cuando el átomo recibe energía los electrones
pasan a niveles superiores de energía.
Cuando el átomo se va enfriando emite la
energía ganada en forma de radiaciones luminosas y los electrones vuelven a los niveles inferiores.
Esta es la causa de los espectros de reyas

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Los no poseen cualquier cantidad de energía sino valores determinados (cuantos)
Los solo pueden girar alrededor del en determinados niveles de energía, en donde se mueven sin perder energía.
Cuando los giran en nivel más próximo al se encuentra en su estado más estable, estado fundamental.
Cuando el salta a un nivel inferior pierde un cuanto de energía, emitiendo radiación. Cuando salta a un nivel superior absorbe energía que recibe en forma de calor, luz o electricidad.
-
- +
- +
-

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
En 1920 Rutherford suponía la existencia de una partícula neutra.
En 1932, James Chadwick descubre el neutrón bombardeando Be con núcleos de He
Masa: 1,65.10-24 gNo tiene carga eléctrica.
En realidad está compuesto por tres partículas fundamentales cargadas llamadas quarks,
cuyas cargas sumadas son cero.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
núcleo
Protones +
Neutrones
Electrones -
Zona extra nuclear o corteza
Giran describiendo orbitas circulares a distintas distancia del núcleo
Niveles de energía (2.n2= electrones)

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Bohr explicaba bien el espectro del átomo de hidrógeno, pero no de los átomos más complejos.
SommerfifeldLos electrones también
describen órbitas elípticas
Kessel, Lewis y Langmuir
Las órbitas elípticas no se encuentran en un mismo plano y el núcleo puede
estar en el centro o desplazado

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Bohr suponía que todos los electrones del mismo nivel tienen igual energía, pero el estudio de los espectro demostró que los niveles están formados por subniveles (s-p-d-f)
El nº de subniveles para cada nivel es igual al número cuántico principal n.
n=1: 1 subnivel sn=2: 2 subniveles, s y pn=3: 3 subniveles, s, p y d Lo cual se demuestra al resolver la ecuación de
Schödinger con los números cuánticos.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
En 1900 emitió una hipótesis que interpretaba los resultados experimentales satisfactoriamente en como los cuerpos captaban o emitían energía en forma de radiación electromagnética .
La ley de Planck establece que la radiación no puede ser emitida ni absorbida de forma continua, si no sólo en determinados momentos y pequeñas cantidades denominadas cuantos o fotones.
La energía de un cuanto o fotón depende de la frecuencia de la radiación (v) y es siempre un múltiplo de la constante de Planck (h = 6,62.10-34 J/s)
E = h.v

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Sostuvo que las partículas en movimiento (como el electrón) tienen la propiedad de comportarse como corpúsculo material y como onda.
El carácter ondulatorio prevalece en ciertos fenómenos y el material en otros.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Es imposible conocer con certeza en forma simultánea la velocidad y la posición de una partícula en movimiento.
Como resulta imposible determinar la trayectoria del electrón dentro del átomo, se busca la probabilidad de encontrar al electrón en determinada zona del átomo.
Orbital atómico es la zona alrededor del núcleo donde existe la mayor probabilidad de encontrar al electrón.
Resolviendo la ecuación de onda de Schödinger.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
La ecuación de onda de Schödinger establece los números cuánticos, los cuales indican la ubicación y propiedades de los electrones.
Número cuántico principal n: indica el nivele de energía y determina el volumen del orbital.
Número cuántico secundario o azimutal l: establece el subnivel y la forma geométrica. Valores comprendido entre 0 y n-1
Número cuántico magnético m: indica la orientación del orbital en el espacio. Valores desde -l hasta +l.
Número cuántico spin ms: señala el sentido de rotación del electrón sobre si mismo.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Para estudiar el interior del núcleo se idearon los Aceleradores.
Son capaces de acelerar las subpartículas y hacerlas colisionar con otras.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Clasificación de subpartículasPortadoras de fuerzas o Fotones (fuerza electromagnética)o Gluones (fuerza fuerte)o Bosones (fuerza débil)
Leptoneso Electróno Muón carga eléctrica negativao Tauo Tres tipos de neutrinos partículas neutras

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
up (arriba)Hadrones quars down (abajo) strange (extraño) Protones o Bariones (constituidos por Neutronestres quars) o Mesones Formados por un quars y un
antiquars

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Los gluones, partículas portadoras de la fuerza nuclear fuerte, que mantienen unidos a los quarks para formar otras partículas.
Esta fuerza es la responsable de mantener unidos a los nucleones (protones y neutrones) que coexisten en el núcleo atómico, venciendo a la repulsión electromagnética entre los protones y haciendo que los neutrones, que no tienen carga eléctrica, permanezcan unidos entre sí y también a los protones.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S
Los bosones W y Z, partículas mediadoras de la interacción nuclear débil. Fueron descubiertas en el CERN, en 1983
Existen dos tipos de bosones W: uno con carga eléctrica positiva y el otro con la misma carga pero negativa (W+ y W−)y ambos son respectivamente antipartículas del otro. El bosón Z es eléctricamente neutro, y es su propia antipartícula.
Fuerza nuclear débil, es una de las cuatro fuerzas fundamentales de la naturaleza. En el modelo estándar de la física de partículas, ésta se debe al intercambio de los bosones W y Z, que son muy masivos. El efecto más familiar es el decaimiento beta y la radiactividad.

U.E.P. Nº 57 - Esp. Prof. Fernández, Nayla S