Modelo atómico 2
Transcript of Modelo atómico 2


A este modelo se lo conoce
como el “budín de
pasas”
1904MODELO ATÓMICOde THOMPSON
Propuso una masa
cargada positivamente
y distribuidos en su interior
los electrones negativos
FUE EL PRIMER
MODELO ATÓMICO

Rutherford
utilizó partículas alfa
para bombardearuna lámina de oro
Observó que:· la mayoría de las radiaciones no se desviaban. · un porcentaje de ellas se desviaban ángulos diferentes.· algunas “rebotaban”.

Núcleo de los átomos
electrones
Rutherford
explicó que los
átomos
debían tener
la mayor parte
de su masa
concentrada
en el centro
al que llamó
núcleo atómico

El modelo atómico de RUTHERFORDno explica:
Un modelo sólo es válido si explica los fenómenos observados
? ¿Por qué la masa del átomo es mayor que la calculada?
? ¿Por qué los electrones no caen hacia el núcleo?
Aún no se conocen
los neutrones.

1913
MODELO ATÓMICO de BOHR
frecuencia = R (1/ nf2 – 1/ ni
2)
radio atómico r = r0.n2/ Z
energía En = - Z2.E0 / n2
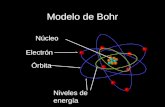
OBSERVA EL
ESQUEMA
DEL MODELO DE
BOHR

OBSERVA EL
ESQUEMA
DEL MODELO DE
BOHRLos electrones giran en torno al núcleo en órbitas estacionariascon energía determinada
Si cambian de órbita hay un intercambio energético ΔE.
Esto explica la pregunta que se planteaba a Rutherford:¿Por qué los electrones no caen hacia el núcleo?

El modelo de Bohr explicalas líneas del espectro …
se originan cuandolos electrones
cambian de órbita.
Si el electrón se encuentra en el nivel n = 5
y cambia al nivel n = 2
emite luz de longitud de onda cercana a 400nm

El modelo de Bohr explicalas líneas del espectro …
se originan cuandolos electrones
cambian de órbita.
Si el electrón se encuentra en el nivel n = 4
y cambia al nivel n = 2
emite luz de longitud de onda cercana a 480nm

El modelo de Bohr explicalas líneas del espectro …
se originan cuandolos electrones
cambian de órbita.
Si el electrón se encuentra en el nivel n = 3
y cambia al nivel n = 2
emite luz de longitud de onda cercana a 650nm

El modelo de Bohr explicalas líneas del espectro …
El resultado es una serie de líneas
espectrales
en la zona del visible
que se conoce como Serie de Balmer.

Pero este modelosólo puede explicar
el espectro del átomo de hidrógeno.
Un modelo sólo es válido
si explica TODOS los fenómenos observados