Teoría Del Campo Cristalino
description
Transcript of Teoría Del Campo Cristalino

TEORÍA DEL CAMPO CRISTALINO
Desde mucho tiempo atrás, los químicos han sido deslumbrados por los metales de transición (tales como el hierro, el cobalto, el cromo y el niquel) en virtud de sus intrigantes geometrías, sus propiedades magnéticas, y sobre todo, su gran variedad de colores. Considérese la amplia gama de colores exhibidos tan sólo por los óxidos de los metales de transición: Ti2O3 (morado), TiO (bronceado), V2O5 (amarillo), VO2 (azul), CrO3 (rojo), Cr2O3 (verde esmeralda), Fe2O3 (rojo ladrillo), NiO (verde pálido) y MnO (verde oliva). Contrástese esto con la mayoría de los óxidos de aquellos metales que no son metales de transición, los cuales son incoloros y si no son blancos entonces son grises y opacos. Otro fenómeno que siempre ha llamado mucho la atención es que muchos cristales pulverizados que no muestran color alguno en cuanto son disueltos en el agua (con lo cual se hidratan los iones metálicos que hay en dichos cristales) adquieren una coloración distintiva. Desde la formulación muy temprana de la teoría mecánico-cuántica de los orbitales atómicos, se descubrió que los electrones de los orbitales atómicos d de los metales de transición pueden ser considerados como los responsables de estas propiedades inusuales. Esta es la tesis de una teoría conocida como la teoría del campo cristalino (en virtud de que la acepción inglesa original es Crystal Field Theory, tal vez una traducción más correcta sería teoría del campo del cristal, aunque la costumbre ha favorecido lo primero), la cual ha correlacionado de manera elegante la estructura electrónica, el color, la geometría, los efectos magnéticos y muchas otras propiedades físicas y químicas de los metales de transición.
La teoría del campo del cristal fue propuesta en 1929 por el físico Hans Bethe, tras lo cual fue mejorada con varias modificaciones formuladas por John Hasbrouck van Vleck en 1935 permitiendo la participación de la covalencia en las interacciones.
Existen muchos niveles de energía disponibles para los electrones en los estados excitados de los iones gaseosos aislados de los metales de transición, y las posiciones de estos en relación a sus estados basales son bien conocidas gracias a un estudio cuidadoso de los espectros de emisión. De cualquier modo, esto no es suficiente para explicar las las energías de absorción relacionadas con los colores de los compuestos de los metales de transición. Cualquier teoría respetable de sus estructuras debe poder remediar este vacío y también debe ser compatible con los cambios experimentalmente observados en el color y las propiedades magnéticas en los números de oxidación y los entornos que rodean al ión metálico. La teoría del campo cristalino ha tenido éxito en esto y en muchas otras cosas. Aunque los detalles de la teoría son algo elaborados, afortunadamente para poder entenderla

cualitativamente solo se requiere aceptar dos cosas:
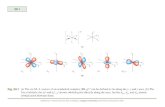
1) Las formas geométricas de los orbitales 3d (de los cuales hay cinco, a saber: dxy, dyz, dxz,dx2-y2 y dz2).
2) La ley electrostática que nos dice que cargas eléctricas iguales se repelen.
Las formas geométicas de los orbitales 3d son, desde luego, las siguientes:
Es importante no olvidar que todos estos orbitales conviven juntos en un mismo espacio traslapándose entre sí, aparentemente confundiéndose pero de alguna manera logrando mantenerse independientes y separados el uno del otro como las soluciones matemáticas que son a la ecuación de Schrödinger:
La teoría supone que el ion de metal de transición es libre y gaseoso; que los ligantes se comportan como cargas puntuales (Una carga puntual es una carga eléctrica hipotética, de magnitud finita, contenida en un punto geométrico carente de toda dimensión, en otras palabras una carga puntual consiste en dos cuerpos con carga que son muy pequeños en comparación con la distancia que los separa. Esta suposición resulta muy práctica al resolver problemas de electrostática, pues los efectos derivados de una distribución de cargasen un espacio finito se anulan y el problema se simplifica enormemente); y que no hay interacciones entre los orbitales del metal y los orbitales de los ligantes.
La teoría del campo cristalino está basada en la idea de que existe una interacción de naturaleza puramente electroestática entre el ión metálico central y los átomos (o moléculas) que lo rodean formando la unidad básica de lo que se ha dado en llamar un ión complejo.
Podemos considerar la formación de complejos como una serie de sucesos:

1. La aproximación inicial de los electrones de los ligantes forma una concha esférica alrededor del ion del metal. La repulsión entre los electrones de los ligantes y los del ion del metal causa un aumento en la energía de los orbitales d del ion del metal.2. Los electrones de los ligantes se reacomodan de modo que quedan distribuidos en pares a lo largo de las direcciones reales de los enlaces (digamos octaédricas o tetraédricas). Las energías medias de los orbitales d no cambian, pero los orbitales orientados a lo largo de las direcciones de enlace aumentan su energía, y los orientados entre dichas direcciones disminuyen su energía. Este cambio en la degeneración de los orbitales d es el foco de la explicación de la teoría del campo cristalino.3. Hasta este punto, la formación de complejos no se favorecería, porque ha habido un aumento neto de la energía como resultado de la repulsión entre los electrones de los ligantes y los del metal (paso 1).
Además, la disminución en el número de especies libres implica que la formación de complejos por lo general tiene como resultado una disminución de la entropía. Sin embargo, habrá una atracción entre los electrones de los ligantes y el ion del metal, con carga positiva, cuyo resultado será una disminución neta en la energía. Es este tercer paso el que proporciona la fuerza impulsora para la formación de complejos.
Como ésta es una teoría electrostática centrada en la interacción entre las orbitales d del ion central y los átomos donores de los ligantes. Se parte del principio de que las orbitales d del ion central en ausencia de ligantes tienen la misma energía, son o están degenerados, cuando los ligantes se acercan al ion central apuntan más hacia unas densidades d que hacia otras, las afectadas por los ligantes aumentan su energía, las otras la disminuyen, se desdobla la energía, se forma una diferencia de energía entre ellas, esta diferencia de energía es la base para explicar el color de los compuestos de coordinación.
Imaginemos ahora una situación en la cual tomamos de una bolsa externa de electrones un total de 12 electrones en su forma probabilista de nubes borrosas, moldeándolos como un cascarón esférico borroso que rodeará por completo al ión Ti3+:
El electrón solitario en el ión metálico Ti3+ encontrará cada uno de los cinco sub-orbitales 3d igualmente incómodos en virtud de la simetría esférica de la nube electrónica repulsiva. Hablando en términos de la energía del sistema, el sistema será menos estable (más energético) que el ión aislado (esto en lo que concierne al electrón), aunque la degeneración orbital será retenida, como lo muestra el diagrama de energía de arriba en donde se ha pasado del “ión metálico aislado” al “ión en campo de simetría esférica”. Para poder compaginar el modelo que estamos construyendo de modo tal que corresponda en forma más estrecha con la realidad, concebimos otro proceso mediante el cual la nube esférica borrosa se reacomoda en forma tal que dos electrones estarán concentrados en pequeños volumenes a distancias ±r del ión metálico a lo largo de los tres ejes coordenados rectangulares como lo muestra la siguiente figura:
Lo que tenemos aquí es en esencia una distribución octaédrica de electrones. No resulta difícil imaginar la razón por la cual se le identifica de esta manera:

Al efectuarse este proceso mediante el cual terminamos con un arreglo electrónico de aspecto octaédrico, ocurre algo muy interesante. El electrón solitario del ión metálico ahora encuentra a los dos orbitales dz2 y dx2-y2, con sus lóbulos apuntando directamente hacia los 6 electrones situados octaédricamente a lo largo de los ejes, electrostáticamente más incómodos que en el caso esféricamente simétrico, una situación más inestable en la cual se requerirá de una cantidad mayor de energía que la que se requería para tener al electrón rodeado por una nube simétricamente esférica:
Del mismo modo, el electrón solitario del ión metálico encuentra a los orbitales dxy, dyz ydxz, con sus lóbulos apuntando no hacia alguno de los 6 electrones ubicados octaédricamente sino hacia el espacio vacío que hay entre los ejes rectangulares coordenados, mucho más cómodos que en el caso esféricamente simétrico. La consecuencia directa es que los orbitales d ya no están degenerados con respecto a la energía, y de hecho se han desdoblado en dos niveles, habiéndose pasado del “ión en campo de simetría esférica” al “ión en campo octaédrico” en el diagrama de energía de arriba. Los orbitales más “cómodos” serán más estables (y por lo tanto inferiores en energía) que los orbitales más “incómodos”.
Rota la degeneración, se puede argumentar (y demostrar) que, si designamos como Δ a la diferencia energética entre el conjunto de sub-orbitales {dxy, dyz,dxz} y el conjunto de sub-orbitales {dz2, dx2-y2}, entonces el aumento en la estabilidad y la disminución en la estabilidad con respecto al caso esféricamente simétrico son (2/5)Δ y (3/5)Δ, respectivamente. Esto puede verse como una consecuencia requerida del balance de energía: en el reacomodo de la nube electrónica el número de orbitales (3) que aumentó en estabilidad multiplicado por el incremento (2/5)Δ es igual al número de orbitales (2) que disminuyeron en estabilidad multiplicado por el decremento (3/5)Δ. Esta regla siempre se mantiene en pie, sin importar los desdoblamientos que ocurran en el diagrama de energía.
Si la separación entre los orbitales d en un campo octaédrico es Δoct, los tres orbitales t2g se encuentran estabilizados con respecto al baricentro en 2/5 de Δoct, y los orbitales eg se encuentran desestabilizados en 3/5 de Δoct. C

La energía de estabilización de campo cristalino (EECC) es la estabilidad comparativa que resulta de colocar un ion de un metal de transición en un campo cristalino generado por un grupo de ligandos, en relación a colocar a ese mismo ion en un campo esférico. Esto se deduce del hecho de que, cuando los orbitales atómicos d se separan energéticamente en el campo formado por un grupo de ligandos, algunos de ellos terminan con una energía menor que la que tendrían en un campo perfectamente esférico conocido como baricéntrico. En un campo baricéntrico los cinco orbitales d se encontrarían degenerados. Por ejemplo, en el caso octaédrico, el grupo t2g se convierte en un grupo de menor energía que los orbitales en el baricentro. Como consecuencia de esto, si un electrón cualquiera se encuentra ocupando uno de estos orbitales, el ion metálico es más estable en ese campo de ligandos con respecto al baricentro en una cantidad conocida como EECC. Por el contrario, los orbitales eg en el caso octaédrico son de mayor energía que en un campo baricéntrico, de modo que cualquier electrón en uno de estos orbitales reduce la EECC.
Si construimos diagramas de energía para los diferentes números de electrones d, vemos que para las configuraciones dI, d2 Y d 3 todos los electrones caben en el conjunto de más baja energía.
Para la configuración d4 hay dos posibilidades: el cuarto electrón d se puede aparear con un electrón en el nivel de energía más bajo o puede ocupar el nivel de energía más alto, dependiendo de cuál situación sea más favorable energéticamente. Si la separación del campo cristalino octaédrico, t.oct' es menor que la energía de apareamiento, el cuarto electrón ocupará el orbital más alto. Si la energía de apareamiento es menor que la separación del campo cristalino, se preferirá energéticamente que el cuarto electrón ocupe el orbital más bajo.
Para aparear un electrón se requiere energía de apareamiento (P) para vencer la repulsión que existe entre los dos electrones que ocupan el mismo orbital
Sin embargo existe además un cierto grado de repulsión entre electrones que ocupan un mismo orbital, este grado de repulsión causa lo que se denomina energía de apareamiento, que es la energía que hay que entregarle a un electrón para que ocupe un orbital que ya se encuentra semilleno. Es por esto que un electrón cuando tiene la posibilidad de optar entre varios orbitales degenerados (con la misma energía) tratará siempre de ocupar el mayor número posible de orbitales vacíos, antes de empezar a completar orbitales semillenos. Esto

que se conoce como regla de Hund es la base en la que se sustentan las propiedades magnéticas y algunas de las propiedades ópticas de los complejos.
Los ligandos que causan una gran separación Δ en los orbitales atómicos d del metal se suelen referir como ligandos de campo fuerte, tales como por ejemplo el CN− y CO de la serie espectroquímica. En complejos formados por estos ligandos la separación en energía Δ entre el grupo de orbitales de mayor y menor energía resulta mayor que la energía de apareamiento de los electrones, esto causa que los orbitales de menor energía se completen, aún a costa del apareamiento de electrones, antes de comenzar a completar los de mayor energía (ocurre según el principio de Aufbau) este tipo de compuestos son llamados de "bajo espín", porque en ellos la suma de los momentos magnéticos causados por los electrones es la mínima posible. Por ejemplo, el NO2
− es un ligando de campo fuerte y produce una gran Δ. El ion octaédrico Fe(NO2)6]3− que posee 5 electrones d, muestra un diagrama de campo octaédrico donde todos los electrones se encuentran en el nivel t2g, este ion es por lo tanto un complejo de espín bajo.
Por el contrario, ligandos como el I− y Br−, que causan un pequeño grado de separación Δ entre orbitales d son llamados "ligandos de campo débil". En estos complejos resulta energéticamente más rentable para los electrones ocupar todos los orbitales siguiendo la regla de Hund, es decir haciéndolo con espines desapareados. Esto ocurre así porque la energía de apareamiento es mayor que la separación Δ entre orbitales de baja y alta energía. Un complejo de este tipo se dice que es de "alto espín" porque la suma de los momentos magnéticos de todos sus electrones es la máxima posible. Por ejemplo, Br− es un ligando de campo débil y produce una Δoct pequeña. De modo que el ion [FeBr6]3−, que también posee cinco electrones d, muestra un diagrama de campo octaédrico con los cinco orbitales semillenos. Este ion por lo tanto es un complejo de espín alto.
Es decir que para que se forme un complejo de bajo espín, el costo energético de colocar un electrón en un orbital semilleno tiene que ser menor que el costo de colocar a ese mismo electrón desapareado en un orbital de mayor energía. Por otro lado si el costo energético de colocar un electrón en un orbital semilleno es mayor que la separación entre orbitales de menor y mayor energía, entonces se forma un complejo de alto espín.
La brecha energética para un complejo metálico tetraédrico (con cuatro ligandos), Δtet es aproximadamente igual a 4/9 de Δoct. Esto significa que la energía requerida para aparear dos electrones en estos complejos es típicamente mayor que la energía requerida para colocar electrones en orbitales de alta energía. Por lo tanto, los complejos tetraédricos son, usualmente, de espín alto.
La utilización de estos diagramas de separación energética puede ayudar en la predicción de las propiedades magnéticas de los compuestos de coordinación. Un compuesto que en su diagrama de separación energética muestra electrones con espines desapareados será paramagnético y se verá atraído por los campos magnéticos, mientras que un compuesto que no posea electrones desapareados en su diagrama energético será diamagnético y se verá débilmente repelido por los campos magnéticos.

La separación de los niveles energéticos depende de cuatro factores:1. La identidad del metal. La separación del campo cristalino, ~, es alrededor de 50 por ciento mayor en el caso de la segunda serie de transición en comparación con la primera, en tanto que en la tercera serie es aproximadamente 25 por ciento mayor que en la segunda. Hay un pequeño aumento en la separación del campo cristalino a lo largo de cada serie.2. El estado de oxidación del metal. En general, cuanto mayor es el estado de oxidación del metal, mayor es la separación del campo cristalino. Así, por ejemplo, la mayor parte de los complejos de cobalto(II) son de alto espín porque la separación del campo cristalino es pequeña, mientras que casi todos los complejos de cobalto(III) son de bajo espín a consecuencia de la mucho mayor separación producida por el ion 3+.3. El número de ligantes. La separación del campo cristalino en un ambiente tetraédrico es alrededor de % de la correspondiente a un ambiente octaédrico.4. La naturaleza de los ligantes. Los ligantes comunes se pueden ordenar con base en el efecto que tienen sobre la separación del campo cristalino. Esta lista ordenada se conoce como la serie espectroquimica. Entre los ligantes comunes, la separación es máxima con el carbonilo y el cianuro y mínima con el yoduro. El orden para la mayor parte de los metales es
I- < Br- < Cl- < F- < OH- < OH2 < NH3 < en < CN- < COConsidere el ion hexaacuohierro(II), [Fe(OH2)6]2+, que se sabe posee cuatro electrones no apareados. Los ligantes de agua, que ocupan una posición baja en la serie espectroquímica, producen una ~oct pequeña; por ello, los electrones adoptan una configuración de alto espín. En cambio, se observa que el ion hexaciaanoferrato(Il) [Fe( CN)6]4- , es diamagnético (cero electrones desapareados). El cianuro ocupa una posición alta en la serie espectroquímica y produce una delta grande; por ello, los electrones adoptan una configuración de bajo espín.
La estereoquímica es la parte de la química que toma como base el estudio de la distribución espacial de los átomos que componen las moléculas y el como afecta esto a las propiedades y reactividad de dichas moléculas. También se puede definir como el estudio de los isómeros: compuestos químicos con la misma fórmula molecular pero de diferentes fórmulas estructurales.

Los compuestos tetraédricos son los segundos más comunes; en estos se considera que cuatro ligandos se acercan al ion metálico central desde los vértices de un tetraedro. Bajo un campo repulsivo tetraédrico los orbitales d se separan nuevamente en dos grupos con una diferencia de energía que se suele llamar Δtet, sin embargo al disponer estos cuatro ligandos lo más alejados uno del otro que resulte posible (no olvidar que los ligandos se repelen también entre sí), se nota que quedan en posiciones "entre" los ejes x, y, z. Por lo que las mayores repulsiones las recibirán los orbitales que posean componentes mayoritarias "entre" los ejes. Al observar el gráfico se puede ver que esos orbitales son los dxy, dxz y dyz formando el grupo de mayor energía, mientras que dz
2 y dx2
-y2 forman el grupo de menor energía, por lo que la
situación resulta a la inversa que en un campo octaédrico. Además debido a que los electrones de los ligandos en el complejo tetraédrico no se encuentran directamente orientados hacia los orbitales d del ion metálico central, la separación entre orbitales de alta y baja energía resulta menor que en el caso de los octaédricos.


Fig. 9. a) Una sustancia es negra si absorbe todas las radiaciones del espectro visible; b) Si refleja todas las radiaciones se verá blanca; c) Un objeto es naranja si absorbe todas las radiaciones excepto la naranja; d) Un objeto se percibirá también de color naranja si refleja todos los colores excepto el azul, que es el complementario del naranja.

Ion HEXACUOTITANIO(III)
Níquel
Metales de acuñación