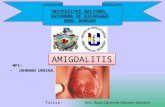
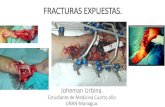
Reparación y muerte celular. Joheman Urbina
-
Upload
joheman-urbina -
Category
Health & Medicine
-
view
45 -
download
0
Transcript of Reparación y muerte celular. Joheman Urbina

JOHEMAN URBINA.
UNIVERSIDAD NACIONAL AUTÓNOMA DE NICARAGUA.
UNAN-MANAGUA.
FACULTAD:
CIENCIAS MÉDICAS.
ASIGNATURA:
PATOLOGÍA.
SEMINARIO 1:
ADAPTACIÓN, REPARACIÓN Y MUERTE CELULAR.
AUTOR:
JOHEMAN URBINA.
DOCENTE:
Dr. RAFAEL VELAZQUÉZ.
GRUPO: 1
FECHA DE ENTREGA:
04/04/2013.
NO NECESITO SABERLO TODO, TÁN SÓLO NECESITO SABER DONDE ENCONTRAR LO
QUE ME HAGA FALTA CUANDO LO NECESITE.

JOHEMAN URBINA.
OBJETIVO Nº1.
1. DESCRIBIR LOS CUATROS ASPECTOS BASICOS DE UN PROCESO PATOLOGICO:
2. Etiología: Son las causas de la enfermedad. hay dos tipos principales de factores
etiológicos: genéticos y adquiridos (infecciosos, nutricionales, químicos, físicos)
3. Patogenia: Son los mecanismos por los que se desarrolla la enfermedad. se refiere a
la secuencia de hechos que ocurren como respuesta de las células, tejidos o de todo el
organismo a la etiología, desde el estímulo inicial hasta la última expresión de las
manifestaciones de la enfermedad.
4. Cambios morfológicos: Son las alteraciones estructurales que se producen en las
células y órganos y los cambios funcionales asociados.
5. Trastornos funcionales y manifestaciones Clínicas: Son las consecuencias
funcionales de los cambios morfológicos. : la naturaleza de los cambios morfológicos y su
distribución en los diferentes órganos y tejidos alteran la función normal y determinan los
rasgos clínicos (síntomas y signos), la evolución y el pronóstico de la enfermedad.
OBJETIVO Nº3
DESCRIBIR LAS CAUSAS DE LESION CELULAR:
1. Isquemia e hipoxia
2. Traumatismo
3. Sustancias químicas
4. Agentes infecciosos
5. Variaciones térmicas
6. Radiaciones ionizantes
7. Agentes inmunológicos
8. Alteraciones genéticas
9. Desequilibrio Nutricional
1. Causas de hipoxia
a) Pérdida de riego sanguíneo: por ejemplo, en casos de aterosclerosis.
Aterosclerosis: en algunas arterias de las mayores se depositan en sus paredes placas de
grasas (ateromas) que pueden obstruir el lumen.
Trombosis: en algunas venas se forma un coágulo o trombo que queda adherido a la pared,
el cual puede crecer disminuyendo el flujo u obstruyéndolo.
Embolias: el émbolo es un cuerpo sólido, líquido o gaseoso que circula pudiendo obstruir un
vaso.
b) Pérdida de la capacidad transportadora de oxigeno.
Anemia: menor cantidad de hemoglobina.
c) Envenenamiento de enzimas oxidativas
Cianuro: que inactiva enzimas capaces de producir oxidación
d) Oxigenación inadecuada: insuficiencias respiratorias o cardiacas
Cualquiera sea la causa, el menor riego disminuye la oxigenación
Patogenia de la hipoxia: isquemia: disminución del riego.

JOHEMAN URBINA.
2. Agentes físicos.
a) De tipo mecánico (traumas)
Lesiones de tejidos blandos: heridas, úlceras, erosiones, fisuras, contusiones.
Lesiones de tejidos duros: fisuras, fracturas, contusiones.
Ambas situaciones producen alteración de la morfología y de la función y pérdida de tejido.
b) Agentes térmicos: el organismo se mueve entre 31 y 410C.
Hipotermia local: formación de cristales en la sangre, los que hacen de trombo en la
microvasculatura.
Hipotermia sistémica: falla vascular generalizada que puede llevar a la muerte por paro
cardíaco.
Hipertermia local: necrosis por coagulación.
Hipertermia sistémica o generalizada: el organismo para defenderse produce una
vasoconstricción periférica para concentrar la circulación central; este volumen central
aumenta tanto que se produce una falla por edema pulmonar.
c) Cambios de la presión atmosférica: el organismo soporta ciertas variaciones; soporta
mejor o puede permanecer más tiempo en aumento que en descenso. El organismo puede
aceptar un aumento de 2 presiones atmosféricas (20 mts bajo nivel del mar; a los 10 mts
comienza a sufrir alteraciones). Cuando un buzo asciende bruscamente, el descenso brusco
de la presión hace que algunos compuestos disueltos en la sangre (nitrógeno y oxigeno) se
transformen en burbujas formando un émbolo aéreo o gaseoso pudiendo producir la muerte.
Cuando asciende, a los 2.500 comienza a sufrir alteraciones como insuficiencia pulmonar.
Aumento
Descenso
Eléctricos: depende del tipo de electricidad, la que más afecta es la alterna.
Quemaduras (efecto térmico): necrosis tisular.
Efecto específico neurológico: fibrilación ventricular.
Radiaciones:
Directos
Indirectos: a través de radicales libres.
Los efectos finales pueden ser:
Inhibición de la proliferación celular (se usa en terapia)
Lisis celular (se usa en terapia)
Efectos teratogénicos
Efectos oncogénicos
Mutaciones
Las radiaciones pueden ser de distintos tipos:
Rx-Rgama
Partículas radioactivas: Co, Cs.
Radiaciones actínicas (sol): ultravioletas, infrarroja, luz visible.

JOHEMAN URBINA.
3. Agentes químicos.
Aquí están todos los gases como anhidrido carbónico, productos de fármacos, iatrogenia (mal
uso de los medicamentos) farmacológica.
Mecanismos
Daño directo sobre la membrana celular, produciendo alteración de la permeabilidad.
Peroxidación lipídica
Enlace covalente de sustancias químicas con componentes de la membrana.
4. Agentes biológicos.
Virus: entra a la célula, se replica y se libera y multiplica (replicación viral). Cuando entra
a la célula modifica la estructura de la célula y se transforma en un antígeno (algo
desconocida para el organismo), desatando una lesión inmunológica, la que puede ser de
tipo:
Celular: mediada por linfocitos T.
Humoral: mediada por linfocitos B: anticuerpos.
Además los virus producen una acción directa, destruyendo el DNA, RNA y proteínas,
produciendo:
a) efecto citopático, del cual podemos obtener los siguientes resultados:
Efecto citolítco: polio, herpes simple.
Hiperplasia: aumento de volumen a expensas del aumento del número de células:
virus del papiloma.
Hiperpiasia con una consecuente necrosis celular: varicela.
Células multinucleadas
Cuerpos de inclusión (por destrucción del DNA).
b) También puede haber un efecto oncogénico, como el:
Virus de la hepatitis B, relacionado con cáncer hepático.
Ebstein Barr Virus: produce linfomas.
Papiloma virus (HPV): papiloma.
Virus herpes simple tipo 8: relacionado con el sarcoma de Kaposi.
c) Además pueden producir mutaciones: Síndrome de TORCH (rubeola, citomegalovirus,
herpes): si la madre se infecta con algunos de estos virus, el niño puede tener una serie de
alteraciones, muchas veces incompatibles con la vida.
Bacterias: son muchos los mecanismos:
Adherencia:
Especificidad tisular: los microorganismos se adhieren con mayor facilidad a algunas
células que a otras.
Los microorganismos tienen adhesinas.
Factores de diseminación:
Enzimas que van degradando tejidos, como las colagenasas.
Coagulasas: como las del stafilococo, que encierra la infección con una malla,
dificultando la llegada de antibióticos.
Hialuronidasas: como en los streptococos.
Cohartar las barreras defensivas:
Escape de la fagocitosis.

JOHEMAN URBINA.
Liberación de endotoxinas (toxinas que se liberan cuando el microorganismo muere) y
de exotoxinas (se liberan antes que muera: diftería).
5. Factores inmunológicos
Son aquellos factores capaces de desencadenar una respuesta inmunológica, ya sea celular o
humoral.
Barreras del organismo:
Piel-mucosas
Fagocitosis
Ambos llamados mecanismos defensivos inespecíficos
Inmunológico, que puede ser celular o humoral. Este es un mecanismo específico, la
respuesta es específica frente a un agente específico.
6. Factores genéticos
Los factores pueden producir
Mutaciones.
Alteraciones cromosómicas.
7. Factores nutricionales
Pueden ser por:
Déficit: desnutrición.
Exceso: ateroesclerosis, hipertensión, obesidad.
8. Agentes endógenos
Radicales libres: Es una especie química que tiene un electrón único impar en una órbita
externa; puede ceder o captar otro electrón. Estos elementos se producen en procesos
normales y anormales; la protección a esto se puede descompensar y provocar algún daño,
incluso matar a la célula:
Daño en la membrana celular (peroxidaxión lipídica)
Inactivación de enzimas que protegen de los oxidantes derivados del oxígeno (O.D.O.)
Fragmentación del D.N.A. celular.
Entre los radicales libres más conocidos tenemos:
Ion superoxido 02
Ion hidroxilo OH+
Peróxido de hidrógeno H202
Ion hipoclorito HC1O
Los peróxidos se caracterizan por ser muy reactivos; en las células tiene reacciones con
sustancias químicas orgánicas e inorgánicas, especialmente a nivel de membranas y ácidos
nucleídos. Se encuentran en concentraciones bajas. Los antioxidantes evitan los daños de los
radicales libres.
Protectores específicos para radicales libres.
Superoxido dismutasa
Catalasa
Peroxidasa

JOHEMAN URBINA.
Protectores inespecíficos
Glutation
Folatos
Manitol.
Glucocorticoides
Reacción de los radicales libres
Iniciación.
Propagación.
Terminación.
Participación de radicales libres:
Envejecimiento.
Shock.
Isquemia-reperfusión.
Procesos inflamatorios.
Superóxidos 02
Fagocito activado leucocito polimorfo nuclear (LPMN)
Cascada isquemia reperfusión (reactivar la circulación).
Metabolismo araquidónico.
Autoxidación de catecoles.
Cualquier proceso inflamatorio libera radicales libres
Radiaciones.
Traumas.
Hipoxia.
Quemaduras.
Aporte exagerado de oxígeno
Radiación ionizante: al actuar sobre el agua produce radicales libres, que pueden actuar
sobre células proliferantes, produciendo daño en el D.N.A., fallando la replicación (esto se
usa en el tratamiento de cáncer en radioterapia); por otro lado produce peroxidación lipídica,
llevando en ambos casos a la muerte celular.
Traumatismo: se liberan sustancias biológicamente activas, se forma un edema
inflamatorio, el que produce compresión de la microvasculatura, produciendo una hipoxia en
la zona; cuando el edema desaparece hay una reperfusión, donde se libera gran cantidad de
radicales libres superóxidos, produciendo daño endotelial y una acumulación de edema post
trauma.
Tejido isquémico (tejido pobre en 02): la hipoxantina no se transforma en xantina por
falta de 02, su acumulación produce xantinooxidasa, el que da finalmente ácido úrico y
radical libre.
OBJETIVO Nº5.
MECANISMOSBIOQUIMICOS GENERALES DE LA LESION CELULAR
Agotamiento de ATP
Oxígenos y radicales libres
Calcio intracelular y pérdida de la homeostasis
Defectos de la permeabilidad de la membrana
Lesión mitocondrial irreversible

JOHEMAN URBINA.
Lesión isquémica e hipóxica
Lesión celular por radicales libres
Lesión química
NECROSIS El término necrosis hace referencia a un espectro de cambios morfológicos que
siguen a la muerte Celular en el tejido vivo, derivados en gran parte de la acción degradativa
progresiva de las enzimas sobre las células mortalmente lesionadas.
El aspecto morfológico de la necrosis es el resultado de dos procesos esencialmente
concurrentes:
1. Digestión enzimática de la célula.
2. Desnaturalización de las proteínas. Las enzimas catalíticas proceden de los
lisosomas de las células muertas en cuyo caso la digestión enzimática se denomina autólisis,
o de los lisosomas de los leucocitos se denomina heterólisis. Estos procesos tardan horas en
evolucionar, por lo que pueden no existir cambios detectables en las células de un infarto al
miocardio que produjo la muerte súbita. La evidencia histológica más precoz de la necrosis
miocárdica no se manifiesta hasta transcurridas 4 a 12 horas, aunque las enzimas se pueden
demostrar en el torrente sanguíneo dos horas después de la muerte celular.
MORFOLOGIA:
Las células necróticas muestran aumento de la eosinofilia, atribuible en parte a la perdida de
la basofilia normal proporcionada por el ARN en el citoplasma y, en parte al aumento de la
unión de la eosina a las proteínas intracelulares desnaturalizadas.La célula puede tener un
aspecto esmerilado más homogéneo que las células normales, como resultado de la perdida
de partícula de glucógeno.Un aspecto en apolillado del citoplasma como consecuencia como
consecuencia de la degradación de que las organelas citoplasmáticas son digeridas por las
enzimas adoptando un aspecto vacuolizado del citoplasma.
Lesión celular reversible
CON EL MICROSCOPÍO DE LUZ SE PUEDEN RECONOCER DOS PATRONES:
Tumefacción o hinchazón celular: aparece siempre en células que son incapaces
de mantener una homeostasis de iones y fluidos. , Se manifiesta por aumento en el tamaño
de las células, presencia de pequeñas vacuolas en el interior del citoplasma.
Cambios grasos. Esta se produce en lesiones hipóxicas, toxica o metabólica,
produciendo degeneración grasa o infiltración grasa se manifiesta por la presencia de
vacuolas opticamente vacias en el cipoplasma celular o en el interticio,en coloraciones con H-
E.
OBJETIVO Nº10
DESCRIBIR MORFOLOGIA Y CARACTERISTICAS BIOQUIMICAS Y MECANISMO DE LA
APOPTOSIS
La apoptosis o "muerte celular programada" es una forma de suicidio celular genéticamente
definida, que ocurre de manera fisiológica durante la morfogénesis, la renovación tisular y en
la regulación del sistema inmunitario.
Los mecanismos que regulan la muerte celular son esenciales para el normal desarrollo y
mantenimiento de la homeostasia. Las células crecen controladamente gracias a la expresión

JOHEMAN URBINA.
de nuevos genes que inducen señales de muerte en estadios definidos de diferenciación y en
respuesta a estímulos fisiológicos determinados.
Se considera a la apoptosis como un mecanismo fisiológico de muerte (inherente al
desarrollo celular), que se desencadena por diversas señales, las cuales pueden ser
fisiológicas, o por estimulaciones exógenes ambientales. Estas señales pueden actuar sobre
receptores de superficie y causar la activación en cascada de proteínas citoplasmáticas; ello
trae como resultado la activación de un programa genético que conduce, generalmente, a la
nucleolisis por la acción de las endonucleasas. Este mecanismo de muerte celular interviene
en importantes fenómenos fisiológicos como: embriogénesis, mantenimiento de la
homeostasia, renovación tisular y desarrollo y funcionamiento del sistema inmunitario.
CARACTERÍSTICAS MORFOLÓGICAS DE LA APOPTOSIS:
Las características de la célula apoptótica difieren de las observadas en las células que sufren
necrosis. En este último fenómeno la muerte es un proceso "pasivo" que no requiere de
síntesis proteica, y es causado por la pérdida de la homeostasia. Se caracteriza por daño
mitocondrial, rotura de la membrana, lisis celular y liberación de su contenido al medio
extracelular.Contrariamente, la apoptosis es un proceso activo que implica síntesis proteica,
en el cual la célula sufre una condensación nuclear y citoplasmática. Sus características
morfológicas revelan condensación de la cromatina nuclear, desintegración nucleolar,
disminución del tamaño nuclear, compactación del citoplasma y de organelo (excepto
mitocondrias y ribosomas), alteraciones del citoesqueleto y aspecto de burbuja de la
membrana, aunque no se rompa. Durante el proceso final ocurre fragmentación del DNA
debido a una ruptura internucleosomal del DNA y se forman fragmentos nucleares
recubiertos de membrana (cuerpos apoptóticos), que son fagocitados sin evidencia de
reacción inflamatoria.
MECANISMOS BIOQUÍMICOS DE LA APOPTOSIS
Las vías bioquímicas involucradas en la apoptosis se encuentran actualmente en
investigación. Se conoce que los linfocitos y la mayoría de las células nucleadas
experimentan ruptura internucleosomal del DNA mediante endonucleasas Ca2+ Mg2+
dependiente, entre las que se encuentran la NUC-18, la DNAsa I y la DNAsa II.
Sin embargo, existen múltiples evidencias de apoptosis en células enucleadas, por tanto el
mecanismo apoptótico puede no interesar al núcleo. Ciertos experimentos realizados en
células enucleadas de nematodos que sufren apoptosis, han evidenciado la existencia de más
de una vía de apoptosis, donde los cambios citoplasmáticos pueden ser decisivos. En esta
especie se han definido varios genes que codifican proteínas citoplasmáticas relacionadas con
la apoptosis, como la Ced-3 (ICE-enzima convertidora de IL1 b), Ced-4 y la Ced-9. En los
mamíferos existe la proteasa "ICE like" que forma una familia de proteasas suicidas y es
homóloga a la proteína Ced-3 de nematodos, también se observa homología entre los genes
Ced-9 nematodos y bcl-2 de mamíferos, ambos inhibidores de la apoptosis.
GENES INVOLUCRADOS EN LA APOPTOSIS FAMILIA DE GENES bcl-2:
El bcl-2 (B cell leukemia/lymphoma 2 genes) fue el primer proto-oncogen detectado y fue
asociado con procesos malignos de las células B. Durante la maduración de las células B
puede ocurrir una traslocación cromosomal 14,18 en el gen bcl-2; ello provoca un aumento
en la expresión de la proteína citoplasmática Bcl-2, que origina inhibición de la apoptosis en
células B y da por resultado la supervivencia de la célula transformada. Está demostrado que
la sobreexpresión del gen bcl-2 en linformas inducidos experimentalmente, se asocia con la

JOHEMAN URBINA.
proliferación neoplásica por los efectos inhibitorios de Bcl-2 sobre las vías de apoptosis. Este
gen facilita el aumento de la supervivencia de la célula transformada y de este modo
aumenta la posibilidad de futuras aberraciones genéticas que pueden conducir a la
progresión maligna. La expresión de este gen en algunos tipos de cáncer es un marcador de
mal pronóstico.El gen bcl-2 forma parte de una familia de genes que intervienen en la
regulación de la supervivencia de la célula. Los miembros de la familia Bcl-2 están integrados
por: Bcl-2, Bax, Bad, Bcl-X1, Bcl-Xs, Mcl-1
ANGINA DE PECHO:
Síndrome ocasionado por isquemia miocárdica y caracterizado por episodios de dolor o
sensación de opresión precordial, desencadenado principalmente por el esfuerzo y aliviado
por el reposo o la administración sublingual de nitroglicerina.
Etiología y patogenia.
La angina de pecho aparece cuando el trabajo cardíaco y la demanda miocárdica de O2
sobrepasan la capacidad del sistema arterial coronario para aportar sangre oxigenada. Se
considera que el dolor de la angina de pecho es una manifestación directa de la isquemia
miocárdica y de la acumulación consiguiente de metabolitos provocados por la hipoxia.
Los determinantes principales del consumo de O2 miocárdico son la frecuencia cardíaca, la
tensión sistólica o PA y la contractilidad. Cualquier incremento de estos factores, en situación
de flujo coronario disminuido, puede inducir angina.En la mayoría de los pacientes, la angina
de pecho se debe a una obstrucción crítica de las arterias coronarias secundaria a
aterosclerosis.
Síntomas y signos.
El dolor de la angina de pecho, muy variable, suele ser retrosternal. Puede presentarse como
una molestia vaga apenas incómoda, o bien evolucionar con rapidez hasta una sensación de
compresión precordial intensa y grave. Con frecuencia los pacientes no perciben la sensación
de malestar como dolor auténtico. El dolor puede irradiarse hacia el hombro izquierdo y
descender por la región medial del brazo izquierdo, incluso hasta los dedos. También puede
irradiarse hacia espalda, garganta, mandíbula, dientes y, de forma esporádica, brazo
derecho. También puede sentirse el dolor anginoso localizado en el abdomen superior.
La angina de pecho aparece de forma característica durante la actividad física, habitualmente
no se prolonga más de algunos minutos y se alivia con el reposo. Por lo general, la respuesta
al esfuerzo es previsible, aunque algunas personas pueden tolerar un determinado ejercicio
un día y al siguiente presentar angina con el mismo esfuerzo. La angina se agrava con el
ejercicio efectuado después de las comidas. También empeora en clima frío, de forma que el
ejercicio soportado sin manifestar síntomas durante el verano puede inducir angina durante
el invierno.
ETIOPATOGENIA:
La angina de pecho se atribuye a la hipoxia del músculo cardiaco. Por consiguiente, puede
producirse cuando el corazón se ve obligado a realizar mayor trabajo y el enfermo es incapaz
de aumentar el riego sanguíneo del miocardio. Un menor aporte de oxígeno ocurre en el
curso de una hipoxemia, durante el shock o una disminución del riego coronario.
Probablamente la angina se desarrolla a consecuencia del estrechamiento provocado por el

JOHEMAN URBINA.
"espasmo" de una arteria coronaria enferma. El dolor se atribuye a la liberación de
sustancias como la calicreína.
De ordinario, la angina de pecho es precedida por una excitación física o emocional u,
ocasionalmente, una comida abundante. En nuestro medio el conducir un automóvil,
especialmente durante las horas de tráfico intenso, puede precipitar un ataque. Suele
también ocurrir durante el ejercicio en un ambiente frío. Algunos pacientes experimentan
alivio casi inmediato al pasar, caminando, de una habitación fría a otra caliente.
El dolor de la angina de pecho es realmente breve. Se dice comúnmente que el malestar
dura de 1 a 15 minutos, pero generalmente no sobrepasa los 5 minutos.
Se reconocen cuatro tipos de angina:
1. Angina estable (angina de esfuerzo). Por lo general es desencadenada por el ejercicio,
comidas abundantes o problemas emocionales; duros más de 1 minuto y mejora con el
reposo o con la nitroglicerina. La semiología dolorosa sugiere la existencia de una obstrucción
coronaria fija.
2. Angina inestable. Es la condición intermedia entre la angina estable y el infarto agudo
del miocardio. Se presenta en reposo sin ningún factor desencadenante evidente, y es debida
a un cambio en la anatomía de las arterias coronarias como puede ser la ruptura de la placa
de ateroma, la que a su vez causa hemorragia intramural, agregación plaquetaria y
formación de trombo con liberación de sustancias vasoactivas y vasoespasmo.
3. Insuficiencia coronaria aguda. El dolor dura más de 20 minutos, lo que sugiere el
diagnóstico probable de infarto de miocardio. Si no se comprueba la existencia de éste, el
cuadro se denomina angina pre-infarto.
4. Angina de Prinzmetal (variante). Es la angina episódica en reposo, a menudo con
buena tolerancia al ejercicio. Usualmente ocurre durante la noche, y empeora temprano en la
mañana. Se debe al vasoespasmo coronario, aunque suele ocurrir en sujetos con
aterosclerosis coronaria obstructiva.
LABORATORIO Y ECG
Enzimas séricas. La elevación de la creatinfosfocinasa (CPK) no es específica de infarto agudo
del miocardio. Algunos casos de angina inestable suelen presentar una elevación, aunque
nunca mayor de dos veces el valor normal. Se solicitan exámenes como cuadro hemático,
glicemia y electrolitos séricos, puesto que la angina se exacerba por anemia, hipoglicemia,
hipertensión grave o infección.
Electrocardiograma. En ausencia de dolor, en un porcentaje considerable el trazo es normal.
Durante el episodio doloroso se pueden observar, en forma aislada o combinada, los
siguientes cambios:
1. Alteraciones del segmento ST: infra o supradesnivel (lesión subendocárdica o
subepicárdica). Este cambio sugiere isquemia transmural secundaria a vasoespasmo (angina
de Prinzmetal).
2. Alteraciones de la onda T: negativa, simétrica y profunda de isquemia subepicárdica;
positiva, simétrica y acuminada de isquemia subendocárdica; seudonormalización en donde
se observa onta T previamente negativa, que se hace positiva durante el evento isquémico.
De ser posible, siempre debe hacerse la comparación con ECG, previos. La región cardíaca
comprometida se define según la alteración en las derivaciones.

JOHEMAN URBINA.
OTROS ESTUDIOS:
La radiografía de tórax casi siempre es normal. El examen de los campos pulmonares puede
demostrar causas posibles de dolor torácico (neumotórax, infiltrados). Es probable que haya
datos de calcificación de las válvulas aórtica o mitral. El diagnóstico definitivo de la
cardiopatía isquémica se lleva a cabo mediante angiografía coronaria. Este método es
relativamente seguro, con tasa muy baja de mortalidad, del orden de 0,1-0,2%. Además,
esta técnica proporciona información pronóstica, ya que la mortalidad se correlaciona con el
número de vasos coronarios significativamente obstruídos y el funciona-miento del ventrículo
izquierdo.
TRATAMIENTO:
El tratamiento de la angina debe individualizarse, aconsejar al paciente modificar los factores
de riesgo y las situaciones desencadenantes. El dejar de fumar, la reducción de peso, el
ejercicio, la dieta y/o el tratamiento medicamentoso de la hiperlipidemia, así como la
eliminación de los estímulos físicos y emocionales, suelen contribuir a la supervivencia.
Angina estable. La nitroglicerina, eficaz agente que mejora el flujo en la circulación
coronaria, utilizada por vía sublingual constituye el fundamento del tratamiento
farmacológico cuando se inicia el dolor. También se administra en forma profiláctica minutos
antes de aquellas actividades que suelen producir angina en el paciente. El principal efecto
antianginoso de este fármaco consiste en una aumento de la distansibilidad venosa, que
conduce a una reducción del volúmen ventricular y de la presión y a una mejoría en la
perfusión subendocárdica. La dilatación coronaria, la mejoría del flujo colateral y la
disminución de la precarga potencian este efecto principal. La nitroglicerina en dosis de 0,3
mg sublinguales hace desaparecer el dolor y mejora el cuadro clínico. El mononitrato y el
dinitrato de isosorbide se encuentran en comprimidos de 5 mg sublinguales, que se disuelven
en 20 segundos y dan protección durante 3 horas.
Angina inestable, angina pre-infarto y angina de Prinzmetal. Se administra oxígeno, 5 litros
por minuto, mediante mascarilla o cánula nasal. El paciente debe ser hospitalizado de
inmediato, se repite el ECG y se miden los niveles enzimáticos (LDH y CPK).
Se administra morfina, 2 a 3 mg por vía IV cada 10 minutos, para aliviar el dolor prolongado.
Se monitoriza la presión arterial y la frecuencia cardíaca. Se prescribe mono o dinitrato de
isorbide, 5 mg sublinguales cada 3 a 4 horas. Puede utilizarse como substituto la
nitroglicerina en discos que proporcionan una liberación constante y controlada de la droga
sobre un área de la piel (0,2 mg por hora).
Si el dolor reaparece, se añaden beta-bloqueadores como el propanolol, en dosis de 10 mg
por VO. La dosis puede incrementarse hasta 20 mg cada 6 horas, cuando la respuesta no es
satisfactoria.
Es aconsejable el uso de la aspirina (300 mg/día), pues reduce en un 50% la frecuencia del
infarto y la tasa de muerte También puede ser útil la heparinización con una dosis inicial de
5.000 unidades seguidas de 1.000 U/hora.
Debe tenerse en cuenta las contraindicaciones de los beta-bloqueadores, como son la
insuficiencia cardíaca, el bloqueo A-V, bradicardia y el síndrome de Wolff-Parkinson-White
con flutter o fibrilación.

JOHEMAN URBINA.
Un fármaco útil en las anginas inestables de pecho, son los anticálcicos,
especialmente el diltiazem en dosis de 60 mg cada 8 horas, por el efecto que ejercen a
través de su acción sobre la fibra lisa vascular.
En todo paciente con angina se debe considerar la arteriografía, como elemento valioso en
cuanto a determinar indicación de angioplastia o de cirugía derivativa de urgencia en las
coronarias.