Unidad II. Alcanos y Cicloalcanos
-
Upload
mervin-molina-hernandez -
Category
Documents
-
view
1.722 -
download
2
Transcript of Unidad II. Alcanos y Cicloalcanos
Unidad N 2. Alcanos y Cicloalcanos
2.1.- INTRODUCCIN Los alcanos son una familia de compuestos formados nicamente por enlaces sencillos, que tienen la frmula emprica general CnH2n+2, donde n representa el nmero de tomos de carbono en la cadena molecular. Estos compuestos tambin son llamados Parafinas (del Latn: poca reactividad) debido a su inercia qumica. Tambin son conocidos como hidrocarburos saturados, debido a que en ellos, los tomos de carbono estn saturados con el mximo nmero posible de tomos de hidrgeno. Cuando forman cadenas lineales se denominan alcanos normales o nalcanos. Los cuatro primeros miembros de la serie son: Metano (CH 4), Etano (C2H6), Propano (C3H8) y Butano (C4H10).
2.1.1.- Usos de los Alcanos Pueden emplearse como disolventes para sustancias poco polares como grasas, aceites y ceras. El gas de uso domstico es una mezcla de alcanos, principalmente propano. El gas de los encendedores es butano. El principal uso de los alcanos es como combustibles debido a la gran cantidad de calor que se libera en esta reaccin. Ejemplo:
UNEFA
Unidad N 2. Alcanos y Cicloalcanos2.1.2.- Estructura de los AlcanosLa estructura molecular de los alcanos afecta directamente sus caractersticas fsicas y qumicas. Se deriva de la configuracin electrnica del carbono, que tiene cuatro electrones de valencia. Los tomos de carbono en los alcanos siempre tienen hibridacin sp3, lo que quiere decir que los electrones de valencia estn en cuatro orbitales equivalentes, derivados de la combinacin del orbital 2s y los orbitales 2p. Estos orbitales, que tienen energas idnticas, estn orientados espacialmente en la forma de un tetraedro, con un ngulo de 109.5 entre ellos.
2.1.3.- Anlisis de Hibridacin
Los alcanos presentan hibridacin sp3 con una geometra molecular tetradrica y ngulos de enlace de 109.5.
UNEFA
Unidad N 2. Alcanos y Cicloalcanos2.2.- NomenclaturaLos alcanos son compuestos hidrocarbonados de frmula molecular general CnH2n+2. El nombre de un alcano est compuesto de dos partes, un prefijo que indica el nmero de carbonos de la cadena seguido del sufijo ano que caracteriza este tipo de compuestos, (met(prefijo)-ano(sufijo), etano, prop-ano, but-ano).
Para hidrocarburos que tienen ms de cuatro tomos de carbono se utilizan como races los numerales griegos o latinos:
UNEFA
Unidad N 2. Alcanos y CicloalcanosReglas segn el Sistema IUPAC (Unin Internacional de Qumica Pura y Aplicada, por las siglas en ingles)
1.- Se escoge como cadena principal la cadena continua ms larga de tomos de carbono. 2.- La numeracin se inicia por el extremo ms cercano a una ramificacin. En caso de encontrar dos ramificaciones a la misma distancia, se empieza a numerar por el extremo ms cercano a la ramificacin de menor orden alfabtico. Si se encuentran dos ramificaciones del mismo nombre a la misma distancia de cada uno de los extremos, se busca una tercera ramificacin y se numera la cadena por el extremo ms cercano a ella. 3.- Si se encuentran dos o ms cadenas con el mismo nmero de tomos de carbono, se selecciona la que deje fuera los radicales alquilo ms sencillos. En los ismeros se toma los lineales como ms simples. El n-propil es menos complejo que el isopropil. El ter-butil es el ms complejo de los radicales alquilo de 4 carbonos. 4.- Cuando en un compuestos hay dos o ms ramificaciones iguales,no se repite el nombre, se le aade un prefijo numeral. Los prefijos numerales son:
Nmero 2 3 4 5 6
Prefijo di bi Tri Tetra Penta hexa
UNEFA
Unidad N 2. Alcanos y Cicloalcanos5.- Se escriben las ramificaciones en orden alfabtico y el nombre del alcano que corresponda a la cadena principal, como una sola palabra junto con el ltimo radical. Al ordenar alfabticamente, los prefijos numerales y los prefijos n-, sec- y ter- no se toman en cuenta. 6.- Por convencin, los nmeros y las palabras se separan mediante un guin, y los nmeros entre s, se separan por comas.
UNEFA
Unidad N 2. Alcanos y CicloalcanosEjemplos de nomenclatura: 1)
Buscamos la cadena de carbonos continua ms larga y numeramos por el extremo ms cercano a un radical, e identificamos los que estn presentes.
La cadena continua ms larga tiene 7 carbonos y se empez la numeracin por el extremo derecho porque es el ms cercano a un radical. Identificamos los radicales y el nmero del carbono al que estn unidos, los acomodamos en orden alfabtico e indicamos el nombre de la cadena. 4-ETIL-2-METIL-HEPTANO
UNEFA
Unidad N 2. Alcanos y Cicloalcanos2)
Buscamos la cadena de carbonos continua ms larga, numeramos por el extremo ms cercano al primer radical, que en este caso es del lado izquierdo. Nombramos los radicales con su respectivo nmero en orden alfabtico e indicamos el nombre de la cadena.
3-METIL-5-PROPIL-OCTANO
UNEFA
Unidad N 2. Alcanos y Cicloalcanos3)
Selecciona la cadena continua de carbonos ms larga. Al tratar de numerar observamos que a la misma distancia de ambos extremos hay un radical etil, entonces nos basamos en el siguiente radical, el butil para empezar a numerar.
5-BUTIL-4,7-DIETIL-DECANO
2.3.- IsmerosLos ismeros son molculas que tienen la misma frmula molecular pero distinta disposicin de los enlaces, y por ende diferente estructura. Los ismeros poseen propiedades fsicas y qumicas distintas. Ejemplo: existen dos compuestos de formula molecular C4H10.
UNEFA
Unidad N 2. Alcanos y CicloalcanosLos Ismeros Estructurales se clasifican en ismeros de cadena, posicin y funcin. Ismeros de cadena Se distinguen por la diferente estructura de las cadenas carbonadas. Un ejemplo de este tipo de ismeros son el butano y el 2-metil-propano.
Ismeros de posicin El grupo funcional ocupa una posicin diferente en cada ismero. El 2pentanol y el 3-pentanol son ismeros de posicin.
Ismeros de funcin El grupo funcional es diferente. El 2-butanol y el dietil ter presentan la misma frmula molecular, pero pertenecen a familias diferentes -alcohol y ter- por ello se clasifican como ismeros de funcin.
UNEFA
Unidad N 2. Alcanos y CicloalcanosLibre rotacin del enlace simple C-C Los enlaces simples entre tomos tienen simetra cilndrica y permiten la rotacin de los grupos que unen. Las diferentes disposiciones espaciales que adoptan los tomos como consecuencia de la rotacin en torno al enlace se llaman conformaciones.
Anlisis Conformacional del Etano El etano es el alcano ms sencillo que puede existir en diferentes conformaciones. De las infinitas conformaciones que se pueden obtener por giro del enlace carbono-carbono, destacan por su importancia las conformaciones alternada y eclipsada. Conformacin alternada del etano
Como puede observarse en la figura, la conformacin alternada tiene los hidrgenos del primer carbono situados entre los hidrgenos del segundo carbono, no existen hidrgenos enfrentados.
En esta conformacin los enlaces carbono-hidrgeno de ambos carbonos se encuentran alejados, formando ngulos de 60. La conformacin alternada es la ms estable de las conformaciones del etano. Es decir, la de menor
UNEFA
Unidad N 2. Alcanos y Cicloalcanosenerga.
Conformacin eclipsada del etano
La segunda conformacin se llama eclipsada. En ella los enlaces carbono-hidrgeno de ambos carbonos quedan enfrentados (eclipsados). Los campos electrnicos de los hidrgenos enfrentados sufren importantes repulsiones (eclipsamientos) que desestabilizan la conformacin. La conformacin eclipsada del etano es la de mayor energa. Es decir, la ms inestable.
La rotacin en torno a un enlace simple carbono-carbono no es completamente libre, debido a las diferencias de energa entre las conformaciones alternadas y eclipsadas. Para que la rotacin tenga lugar es necesario superar una barrera energtica que viene dada por la energa de la conformacin eclipsada (energa de activacin). En el etano esta barrera energtica es pequea, unas 2,9 Kcal/mol (12 KJ/mol), y permite que los confrmeros se interconviertan a elevada velocidad.
UNEFA
Unidad N 2. Alcanos y Cicloalcanos Diagrama de energa potencial
Un diagrama de energa potencial nos permite entender cmo cambia la energa potencial del sistema durante la rotacin. En estos diagramas se representa la energa potencial de la molcula frente al ngulo girado.
Para el etano tiene la siguiente forma:
Anlisis Conformacional del Butano Vamos a considerar el enlace C2-C3 del butano. Los giros de 60 en torno a este enlace generarn las posibles conformaciones del butano. Existen tres conformaciones de especial importancia llamadas; butano sin, butano anti y butano Gauche que representamos en los siguientes modelos.
La conformacin anti del butano es la de menor energa. Los metilos estn a lados opuestos minimizndose las repulsiones. UNEFA
Unidad N 2. Alcanos y Cicloalcanos
En la conformacin gauche, la proximidad de los metilos da lugar a una interaccin repulsiva, llamada interaccin gauche. Esta repulsin entre metilos es de unas 3,2 Kcal/mol.
La conformacin sin es la de mayor energa. Los metilos quedan enfrentados y las repulsiones (interacciones eclipse) hacen que esta conformacin tenga una energa de 25 KJ/mol superior a la conformacin anti.
UNEFA
Unidad N 2. Alcanos y CicloalcanosEl diagrama de energa potencial frente al ngulo girado para el butano nos queda:
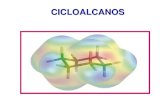
2.4.- CicloalcanosLos Cicloalcanos son hidrocarburos cclicos (la cadena se cierra sobre s misma formando un anillo) y su frmula molecular general es CnH2n. Los Cicloalcanos monocclicos no sustituidos se nombran agregando el prefijo ciclo al nombre del alcano lineal con el mismo nmero de tomos de carbono. Ejemplos:
UNEFA
Unidad N 2. Alcanos y CicloalcanosLas reglas IUPAC para nombrar Cicloalcanos son muy similares a las estudiadas en los alcanos.
Regla 1.- En cicloalcanos con un solo sustituyente, se toma el ciclo como cadena principal de la molcula. Es innecesaria la numeracin del ciclo.
Si la cadena lateral es compleja, puede tomarse como cadena principal de la molcula y el ciclo como un sustituyente. Los cicloalcanos como sustituyentes se nombran cambiando la terminacin ano por ilo.
Regla 2.- Si el cicloalcano tiene dos sustituyentes, se nombran por orden alfabtico. Se numera el ciclo comenzando por el sustituyente que va antes en el nombre.
Regla 3.- Si el anillo tiene tres o ms sustituyentes, se nombran por orden alfabtico. La numeracin del ciclo se hace de forma que se otorguen los localizadores ms bajos a los sustituyentes.
UNEFA
Unidad N 2. Alcanos y Cicloalcanos
En caso de obtener los mismos localizadores al numerar comenzando por diferentes posiciones, se tiene en cuenta el orden alfabtico.
2.5.- Propiedades Fsicas de Alcanos y Cicloalcanos
2.5.1.- Puntos de ebullicin.
El punto de ebullicin aumenta con el tamao del alcano porque las fuerzas intermoleculares atractivas (fuerzas de van der Waals y de London) son ms efectivas cuanto mayor es la superficie de la molcula.
En el caso de los alcanos ramificados, stos presentan un punto de ebullicin ms bajo que el del los lineales con el mismo nmero de tomos de carbono. Esta diferencia se debe a que los alcanos ramificados son ms UNEFA
Unidad N 2. Alcanos y Cicloalcanoscompactos, con menos rea superficial para las interacciones por fuerzas de London.
Puntos de fusin.
El punto de fusin tambin aumenta con el tamao del alcano por la misma razn. Los alcanos con nmero de carbonos impar se empaquetan peor en la estructura cristalina y poseen puntos de ebullicin un poco menores de lo esperado.
El hecho de que una cadena est ramificada tambin afecta al punto de fusin del alcano. Un alcano ramificado generalmente funde a una temperatura ms alta que la del n-alcano con el mismo nmero de tomos de carbono. La ramificacin de un alcano da lugar a una estructura UNEFA
Unidad N 2. Alcanos y Cicloalcanostridimensional slida ms compacta en la que las molculas pueden empaquetarse ms fcilmente, incrementando el punto de fusin.
Solubilidad y densidad.
Los alcanos son apolares, por lo que se disuelven en disolventes orgnicos apolares o dbilmente polares. Se dice que son hidrofbicos (repelen el agua) ya que no se disuelven en agua. En lo que se refiere a la densidad, cuanto mayor es el nmero de carbonos las fuerzas intermoleculares son mayores y la cohesin intermolecular aumenta, resultando en un aumento de la proximidad molecular y, por tanto, de la densidad. Ntese que en todos los casos es inferior a uno.
Los Cicloalcanos presentan mayores puntos de fusin y ebullicin, y densidades mayores que los correspondientes alcanos de igual nmero de carbonos. La rigidez del anillo permite un mayor nmero de interacciones intermoleculares, que es necesario romper mediante la aportacin de energa, para pasar las molculas a fase gas. UNEFA
Unidad N 2. Alcanos y Cicloalcanos2.6.- Mtodos de preparacin de Alcanos y Cicloalcanos
2.6.1.- Hidrogenacin de alquenos
El principal mtodo para la obtencin de alcanos es la hidrogenacin de alquenos.
El catalizador puede ser Pt, Pd, Ni. (PtO2, Pd/C) Ejemplos: a)
b)
c)
UNEFA
Unidad N 2. Alcanos y Cicloalcanos 2.6.2.- Hidrlisis de los reactivos de Grignard
(La R denota los grupos alquilos: metil. Etil, entre otros)
Ejemplo:
a)
b)
2.6.3.- Obtencin de Ciclopropano (Wurtz) El Cicloalcano ms simple, formado por tres tomos de carbono, es el Ciclopropano. Se genera por la Reaccin de Wurtz intramolecular a partir de 1,3-dibromopropano con sodio o zinc. Se trata de una sustancia muy inestable y reactiva debido a la elevada tensin del anillo.
UNEFA
Unidad N 2. Alcanos y Cicloalcanos2.7.- Reacciones Qumicas de AlcanosLa poca reactividad qumica de los alcanos a temperatura ambiente di origen al nombre de parafinas, derivado del latn PARUM AFFINIS que significa poca afinidad. Los alcanos no son atacados por cidos o bases fuertes, tampoco por agentes oxidantes o reductores. Sin embargo, los alcanos si reaccionan en condiciones severas y constituyen productos de gran utilidad comercial. Tipos de carbonos segn la sustitucin
2.7.1.- Halogenacin fotoqumica
Los alcanos reaccionan con los halgenos, en presencia de luz solar o ultravioleta desde 250C hasta 400 C, produciendo derivados halogenados al sustituir uno o ms hidrgenos por tomos del halgeno. Estas reacciones son una importante ruta industrial para los hidrocarburos halogenados. Los experimentos han mostrado que toda Halogenacin produce una mezcla de todos los ismeros posibles, indicando que todos los tomos de hidrgeno son susceptibles de reaccionar. Sin embargo, la mezcla producida no es una mezcla estadstica: los tomos de hidrgeno,
UNEFA
Unidad N 2. Alcanos y Cicloalcanossecundarios y terciarios son reemplazados preferentemente debido a la mayor estabilidad de los radicales secundarios y terciarios. REACCIONES DE ALCANOS 1. Halogenacin. Estudiada en las secciones 3.19 a 3.22.C H + X2 250-400C, o luz C X + HX
Generalmente una mezcla Reactividad X2: CI2 H: 3 Ejemplo: CH3 CH3 CI2 CI CH3 CH CH3 CH CH CH2CI + CH3 C CH3 250-400C 2 3 CH3CH2 CI CH3CH3 luz, 25C de isobutilo Isobutano Cloruro CI p.e. 13C Etano Cloruro de t-butilo Cloroetano 2. Combustin. Estudiada en la seccin 3.30. Cloruro de etilo CI2 CnH2n + 2 + exceso O 2 llama nCO2 + (n + 1)H 2O H=calor de combustion CH3CH2CH3 CH3CH2CH2 CI + CH3CHCH3 luz 25C CI p.e. 47C Propano Ejemplo: p.e. 36C 1-Cloropropano llama n-C5H12 + 8 OCloruro de5CO2 + 6H 22-Cloropropano kcal 2 H=-845 n-propilo O Br2 Cloruro de isopropilo CH345 3 CH % CH CH Br luz, 1273.31. 3 55 2 C % 3. Pirlisis (cracking). Estudiada en la seccin Etano CI2 CH3CH2CH2400-600C con o sinCH2CH2CH2 CI menores + alquenos alcano CH3 luz 25C CH3 H2 + alcanos + CH3CH2CHCH3 catalizadores 2 Br + CH3CHCH3 CH3CH2CH3 CH3CH2CH2Br CI luz, 127 C n-Butano Propano p.e. 78,5 C 3 % Br p.e. 68 C 1-Clorobutano 2-Clorobutano 97 % Cloruro de n-butilo Cloruro de sec-butilo 72 % Br2 28 % CH3CH2CH2CH3 CH3CH2CH2CH2Br + CH3CH2CHCH3 luz, 127 C n-Butano Br 2% CH3 CH3 98 % CH3 CI2 CH3 CH3 CH3 CH3CHCH3 luz 25C CH3CHCH2 CI + CH3CCH3 Br2 CH3CHCH2Br + CH3CCH3 CH3CHCH CI Isobutano 3 luz, 127 C 69C p.e. Isobutano trazas Br p.e. 51 C 1-Cloro-22-Cloro-2metilpropano sobre 99 % metilpropano Cloruro de isobutilo Cloruro de t-butilo 64 % UNEFA 36 % CH3 Br2 2 1 CH3 H
Unidad N 2. Alcanos y Cicloalcanos 2.7.2. Combustion
Todos los alcanos reaccionan con oxgeno en una reaccin de combustin, si bien se torna ms difcil de inflamar al aumentar el nmero de tomos de carbono. La ecuacin general para la combustin completa es v
En ausencia de oxgeno suficiente, puede formarse monxido de carbono, es decir una combustin parcial o incompleta, como se muestra a continuacin:
UNEFA












![Alcanos y Cicloalcanos [Modo de Compatibilidad]](https://static.fdocuments.ec/doc/165x107/55cf97d9550346d03393f783/alcanos-y-cicloalcanos-modo-de-compatibilidad.jpg)