Ud 10. metabolismo celular. catabolismo
-
Upload
martabiogeo -
Category
Education
-
view
419 -
download
0
Transcript of Ud 10. metabolismo celular. catabolismo
Índice 1. Características del
metabolismo.
1. Catabolismo y anabolismo
2. ATP
3. Tipos
2. El control del metabolismo. Catalizadores.
3. Enzimas. 1. Características generales.
2. Actividad enzimática yCentro activo.
3. Especificidad.
4. Cinética enzimática.
5. Factores que afectan a la actividad enzimática.
6. Coenzimas y vitaminas.
7. Clasificación.
4. Características del catabolismo. 1. Producción de energía
2. Reacciones redox
3. Liberación de energía
4. Tipos de catabolismo
5. Catabolismo por respiración.
1. Catabolismo de glúcidos. 1. Glucolisis
2. Ciclo de krebs
3. Cadena de transporte de electrones
6. Catabolismo por fermentación 1. Fermentación alcohólica
2. Fermentación láctica.
7. Catabolismo de lípidos.
8. Catabolismo de proteínas
1. Características del metabolismo celular
• Metabolismo: Conjunto de reacciones químicas que suceden en el interior de las células y que conducen a la transformación de unas moléculas en otras con el fin de obtener materia y energía.
– Materia para crecer, desarrollarse y renovar las estructuras celulares
– La energía, se almacena en los enlaces químicos de moléculas de reserva o se transforma en diversos tipos de energía (calor, energía eléctrica o luminosa)
• Vías metabólicas: Reacciones químicas del metabolismo.
• Metabolitos: sustancias que intervienen en las reacciones químicas.
• Todas las reacciones metabólicas están reguladas por enzimas (proteínas), son especificas para cada sustrato o tipo de transformación.
1.2. Adenosin – trifosfato (ATP)
• Nucleótido, que actúa en el metabolismo celular almacenando y cediendo energía, en sus enlaces éster – fosfóricos
• Síntesis de ATP: – Fosforilación a nivel de sustrato:
Energía liberada de una biomoléculas al romperse alguno de sus enlaces ricos en energía. – Reacción enzimática con ATP – sintetasa: Enzimas que sintetizan ATP cuando su interior es atravesado por un flujo de protones (H+ )
• ATP: “moneda energética”: Almacena energía de uso inmediato • Si la energía no se usa de forma inmediata, la energía se almacena en moléculas de reserva, capaces de almacenar mucha más energía: almidón, glucógeno o triacilglicéridos. 1.3. Tipos de metabolismo • Autótrofo: Fuente de C es el CO2 atmosférico. (C inorgánico) • Heterótrofo: Fuente de C, son moléculas orgánicas. (C orgánico) • Fotosíntesis: Si fuente de energía es la E. luminosa • Quimiosíntesis: La fuente de energía es la energía química desprendida en reacciones
químicas.
3. Las enzimas 3.1. Características generales de las
enzimas. • Biocatalizadores: Catalizadores de las
reacciones biológicas
• Función: Rebajar la energía de activación de la reacciones biológicas. De esta manera aumentan la velocidad de reacción y la aceleran, sin necesidad de aumentar la temperatura.
• Similitudes y diferencias con catalizadores no biológicos: – Similitudes:
• Aceleran la reacción: Se consigue la misma cantidad de producto en menos tiempo
• No se consumen durante la reacción: Al finalizar la reacción la cantidad de enzimas es la misma.
– Diferencias:
• Alta especificidad: Actúan en una sola reacción
• Actúan a la temperatura del ser vivo
• Alta actividad y masa molecular muy elevada
• Naturaleza química de las enzimas (excepto ribozimas: ARN): Proteínas globulares, solubles. En la cadena polipeptídica de las enzimas se distinguen tres tipos de aminoácidos:
– Aminoácidos estructurales: No establecen enlaces químicos con los sustratos
– Aminoácidos de fijación y catalizadores: Son los que se van a unir, mediante enlaces químicos al sustrato y lo van a transformar.
• Según su estructura
– Enzimas estrictamente proteicas. Solo cadenas polipeptídicas
– Holozimas
• Apoenzima: Fracción proteica
• Cofactor:
– Cofactor iónico: Iones metálicos (Mg2+, Zn2+ )
– Cofactor orgánico o Coenzima (ATP, NADP, NAD, FAD, CoA)
3.2. Centro activo y mecanismo de acción enzimática
• El centro activo de una enzima es la región de la enzima que se une al sustrato
• Características:
– Parte muy pequeña del volumen de la enzima
– Estructura tridimensional, que facilita que el sustrato encaje
– Formado por dos tipos de aminoácidos:
• De fijación: Establecen enlaces débiles con el sustrato y se fijan a él.
• Catalizadores: Establecen enlaces con el sustrato y provocan la ruptura de alguno de sus enlaces. Son los responsables de la transformación del sustrato en producto
– Esos aminoácidos presentan afinidad química con el sustrato, lo atraen y se forman los enlaces entre el centro activo de la enzima y el sustrato
3.3. Especificidad de las enzimas • Sólo se fijan a las enzimas los sustratos que pueden formar enlaces con los aminoácidos
del centro activo. Sólo aquellos sustratos, con enlaces susceptibles de ruptura próximos a los aminopácidos catalizadores, pueden ser alterados.
• Tipos de especifidad:
– Especificidad absoluta o de sustrato: La enzima solo actúa sobre un sustrato (la sacarasa, que hidroliza la sacarosa.)
– Especificidad de grupo: La enzima reconoce un grupo de moléculas.
– Especificidad de clase o de acción: La actuación de la enzima depende del tipo de enlace. (Fosfatasas – separan los grupos fosfatos de cualquier molécula; las lipasas que hidrolizan los enlaces éster en los lípidos)
• Modelos de especifidad
Llave - cerradura La enzima y el sustrato
modifican su forma La enzima modifica su
forma
Inhibidores: Sustancias que disminuyen la actividad de una enzima o impiden su actuación. Se trata de moléculas que se unen a la enzima impidiendo que ésta actúe sobre el substrato. Pueden causar efectos perjudiciales (venenos) o beneficiosos (fármacos). Ej. Penicilina, inhibe las enzimas encargadas de la síntesis de la pared bacteriana.
• Inhibición Irreversible:
– El inhibidor se fija mediante enlaces covalentes al centro activo de la enzima modificando su estructura terciaria.
– La enzima pierde su funcionalidad.
– En este tipo se incluyen muchos venenos y otras sustancias tóxicas
– Ejemplos:
• Penicilina: Inhibe la síntesis de la pared bacteriana.
• Aspirina: Inhibe la síntesis de Prostaglandinas.
• Antitumorales
• Gases nerviosos: Inhiben neurotransmisores
• Insecticidas
• Inhibición reversible competitiva – Cuando el inhibidor se une al
centro activo de la enzima impidiendo que el sustrato se una a él.
– Se trata de una inhibición que depende de la concentración de sustrato y de inhibidor.
– Ejemplos: • Antibióticos: sulfamidas:
Compiten con una sustancia necesaria para la síntesis de ADN bacteriano.
• Estatinas: Inhiben a una enzima relacionada con la síntesis de colesterol
• Inhibición reversible no competitiva: – Cuando el inhibidor se une
reversiblemente a un punto diferente del centro activo pero con su actuación lo modifica lo suficiente para que, aunque se puedan unir la enzima y el sustrato, la catálisis no se produzca o la velocidad de ésta disminuya. Este tipo de inhibición no depende de la concentración de sustrato.
– Ejemplo:
• Inhibidores de la transcriptasa inversa, utilizado para combatir el SIDA
• Inhibición reversible alostérica: – El inhibidor se une también
reversiblemente a un punto diferente al centro activo, pero con su actuación lo modifica de tal manera que impide la unión de la enzima y el substrato.
• Los activadores.
– Son sustancias que se unen a la enzima, que se encuentra inactiva, cambiando su estructura espacial activándola.
• Es frecuente que el inhibidor sea el
propio producto de la reacción enzimática o el producto final de una cadena de reacciones. Cuando se trata del producto final. recibe el nombre de retrorregulación o feedback.
3.6. Coenzimas y vitaminas • Actúan como transportadores de grupos químicos. Las coenzimas sí se modifican en la
reacción al aceptar o perder átomos.
• La unión Coenzima – apoenzima es temporal.
• Muchas son vitaminas o derivan de ellas.
• No son especificas de un tipo de apoenzima
• Tipos (en función de los grupos que transportes)
– Coenzimas de oxidación – reducción: Transportan H + y e -. Las más comunes son FAD, NAD+, NADP+
– Coenzimas de transferencia: Transportan radicales. Las más importantes: ATP (Transporta grupos fosfato) y Coenzima A (Transporta grupos acetilo C –O –CH3)
• Vitaminas con función de coenzima
– Vitaminas del complejo B.
• Vitamina B1: TPP: metabolismo de glúcidos y lípidos
• Vitamina B2 o riboflavina FAD, FMN: Ciclo de Krebs y cadena transportadora de electrones.
• Vitamina B3 o niacina: NAD, NADP: Actúan en la oxidación de glúcidos y proteínas y fotosíntesis, respectivamente.
• Vitamina B5 o ácido pantoteico: Coenzima A: Cataliza el metabolismo de ácidos grasos y el ácido pirúvico.
– Vitamina C: Síntesis de colágeno: Reacciones de hidroxilación de prolina a hidroxiprolina
3.7. Clasificación de las enzimas
• Oxidoreductoras: Reacciones “redox”
• Transferasas: Transfieren radicales de un sustrato a otro
• Hidrolasas: Rompen enlaces por la adición de una molécula de agua (Aporta un grupo –OH a una parte y un -H a otra
• Liasas: Separan grupos sin intervención dela agua y originan dobles enlaces o añaden CO2
• Isomerasas: Cambio de posición de algún grupo en la misma molécula.
• Ligasas y sintetasas: Unen moléculas o grupos con la energía del ATP
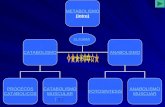
4. Características del Catabolismo
• Catabolismo: fase degradativa del metabolismo en la cual se obtiene energía.
• Las moléculas iniciales son transformadas en otras más pequeñas, hasta convertirse en los productos finales del catabolismo (productos de excreción)
• La energía liberada es almacenada en los enlaces del ATP y será utilizada para las actividades celulares o para sintetizar moléculas complejas en las que se almacene esta energía sobrante (anabolismo)
4.1.Producción de energía en el catabolismo
4.2.Reacciones “redox” • Reacciones de transferencia de electrones:
– Si una sustancia se oxida (pierde electrones), hay una sustancia que se reduce (gana electrones)
– Agente oxidante: Sustancia que provoca que otra pierda electrones.
– Agente reductor: Sustancia que provoca que otra gane electrones.
• En el catabolismo la energía se libera de forma gradual y como energía química. Queda almacenada en los enlaces químicos del ATP.
• Esta liberación gradual es posible gracias a:
– Reacciones sucesivas, cada una de ellas, regulada por una enzima diferente.
– Transporte de Hidrógenos: Los e- y los H+ pasan a una coenzima (NAD+) que actúa como transportador de H.
– Cadena transportadora de electrones: La coenzima NADH no cede directamente sus e- al oxígeno, sino que los cede a una cadena de transporte, constituida por proteínas (citocromo) que están englobadas en la membrana interna de las mitocondrias. En esa cadena los e- pasan a niveles de menor energía de una proteína a la siguiente. Esta energía que van perdiendo se utiliza para la fosforilación del ADP
4.3. Liberación gradual de energía
4.4. Tipos de catabolismo • Respiración: Interviene la cadena
de transporte de electrones. Los electrones se transfieren desde una molécula orgánica hasta un compuesto inorgánico (aceptor final).
– Respiración aerobia: El aceptor final de electrones es el O2. Por tanto es el agente oxidante. Al aceptar los e- y H+ el O2 se reduce y forma H2O
– Respiración anaerobia: El agente oxidante no es el O2. Pueden ser otros iones como en NO-
3
• Fermentación: No interviene la cadena de transporte de e- El producto final es un compuesto orgánico.
• Glucolisis
– Nueve etapas: en cada una se transforman intermedios fosforilados desde la glucosa hasta el ácido pirúvico.
– Dos fases: • Primera fase o fase de consumo de
energía: Por cada glucosa se consumen dos ATP y se obtienen dos gliceraldehído 3- fosfato .
• Segunda fase o fase de produccion de energía: Por cada gliceraldehído 3- fosfato se obtiene 2ATP, 1 NADH+H+ y un ácido pirúvico.
– Balance final:
CARACTERÍSTICAS Y SIGNIFICADO BIOLÓGICO DE LA GLUCOLISIS
• Se realiza tanto en procariotas como en eucariotas.
• En los eucariotas se realiza en el citosol (o hialoplasma).
• Se trata de una degradación parcial de la glucosa.
• Es un proceso anaerobio (no necesita oxígeno)que permite la obtención de energía a partir de los compuestos orgánicos en ausencia de oxigeno.
• Vía común en respiración aerobia y fermentaciones.
• La cantidad de energía obtenida por cada molécula de glucosa es escasa (2 ATP).
• La glucolisis fue, probablemente, uno de los primeros mecanismos para la obtención de energía a partir de sustancias orgánicas en la primitiva atmósfera sin oxígeno de la Tierra.
5.1.2. Ciclo de Krebs • En condiciones aeróbicas (O2) el ácido pirúvico obtenido en glucolisis ,entra en la
mitocondria, mediante transporte activo. Ahí un conjunto de enzimas denominado sistema piruvato deshidrogenasa lo transforma en acetil – CoA.
• El ácido pirúvico sufre dos reacciones: primero una descarboxilación (pierde un CO2) y
segundo una oxidación, por acción del NAD+. Además interviene el coenzima A
Animación ciclo de krebs
El acetil CoA se
incorpora al ciclo de
Krebs, transfiriendo el
grupo acetilo al ácido
oxalacético que se
transforma en ácido
cítrico. A partir de
aquí suceden una
serie de
transformaciones en
las que se degrada
completamente el
grupo acetilo en dos
moléculas de CO2 e
Hidrógenos y al final
se regenera el ácido
oxalacético.
5.1.3. Cadena de transporte de electrones
• Ver video de funcionamiento de la cadena transportadora
• En esta etapa las coenzimas reducidas obtenidas en las fases anteriores (NADH y FADH) se van a oxidar y la energía obtenida se va a utilizar para sintetizar ATP
• Se pueden diferenciar tres procesos: – Transporte de electrones
– Quimiosmosis
– Fosforilacion oxidativa
• Transporte de electrones: – Constituida por una serie de proteínas englobadas en las membrana interna de
mitocondrias.
– Cada una de estas moléculas acepta electrones de la anterior (se reduce) y los transfiere a la siguiente (se oxida). Esto es posible porque los electrones pasan a ocupar en la siguiente molécula una posición de menor energía.
– Los electrones proceden de los NADH y del FADH obtenidos en las etapas anteriores. Estos coenzimas ceden además H+ convirtiéndose de nuevo en coenzimas oxidados NAD+ y FAD +
• Quimiósmosis: – La energía que pierden los electrones es utilizada para bombear H+ desde la matriz al
espacio intermembranoso.
– Cuando su concentración es elevada regresan a la matriz a través de unos canales internos con enzimas ATP – sintetasas.
• Fosforilación oxidativa: – Cuando los H+ atraviesan el canal de las ATP – sintetasas, esta sufre cambios en su
conformación produciendo la unión entre el ADP y un P, generando un ATP.
Otro vídeo que explica todo esto
• En la cadena de transporte de electrones por cada NADH+H+
que entra se sintetizan 3 ATP.
• Por cada FADH2 se sintetizan 2ATP.
Actividad: Calcula el balance total de ATP obtenidos de la
degradación de un molécula de glucosa
6. Las fermentaciones • Fermentación: Proceso catabólico en el que no interviene la cadena
respiratoria.
• Características:
– Proceso anabólico: No utiliza el O2 como aceptor final de electrones y protones.
– El aceptor final es un compuesto orgánico.
– La síntesis de ATP ocurre a nivel de sustrato: No interviene las ATP – sintetasas, baja producción energética.
• La realizan microorganismos: levaduras y bacterias. También en tejido muscular de animales si no les llega suficiente oxígeno.
– Anaerobio facultativo: Organismos que en presencia de O2 realizan la respiración y en ausencia de este la fermentación. Ej: Lactobacillus y Streptococcus
– Anaerobio estricto: Siempre realizan la fermentación. Ej: levaduras del género Saccharomyces
• Según la naturaleza del producto final: – Fermentación alcohólica: alcohol etílico.
– Fermentación láctica: ácido láctico
– Fermentación butírica: ácido butírico
– Fermentación pútrida: productos orgánicos y malolientes
• β – Oxidación de los ácidos grasos – Sucede en la matriz mitocondrial. Para atravesar la membrana de la
mitocondria, se unen a una Coenzima A, utilizando la energía del ATP. Este proceso se denomina activación del ácido graso.