CATABOLISMO DEGLI SCHELETRI CARBONIOSImeduniupo1.altervista.org/wp-content/uploads/2018/... · Nel...
Transcript of CATABOLISMO DEGLI SCHELETRI CARBONIOSImeduniupo1.altervista.org/wp-content/uploads/2018/... · Nel...
87
CATABOLISMODEGLISCHELETRICARBONIOSISi distinguono amminoacidi chetogenici e glucogenici. Gli amminoacidi glucogenici formanoossalacetato che il fegato usa in gluconeogenesi; gli amminoacidi chetogenici sono convertiti inacetil-CoA. Alcuni amminoacidi sono sia chetogenici che glucogenici come il triptofano o latreonina.La cellula può possedere due vie metaboliche per ossidare lo scheletro carboniosodell’amminoacido.Unamminoacidocomeiltriptofanopuòpresentareatomidicarboniochedannoorigineaglucosioeaicorpichetonici.Porzionidiversedellamolecolahannodestinidiversi.È importantesapere ilpunto di ingresso degli amminoacidi nel ciclo di Krebs per classificarli come chetogenici oglucogenici.
Nel metabolismo degli amminoacidi, sia nel catabolismo sia nell’anabolismo, hanno un ruoloimportanteicoenzimideltrasportodiunitàmonocarboniose:labiotina,iltetraidrofolatoelaS-adenosilmetionina.Labiotinapartecipaaltrasferimentodiunitàdicarbonionellostatopiùossidato,sottoformadiCO2.
37/71
39/71
Trasferimento di CO2
88
Il tetraidrofolato partecipa al trasferimento di unità monocarboniose in uno stato più ridotto,rispettoallabiotina,sottoformadialdeide,gruppometilicoegruppometilenicoCH2OH.Ècostituitoda3porzioni:6metilpterina,p-aminobenzoatoeglutammato.Idueatomicheservonopersvolgerelasuafunzionedicatalisisonoidueatomidiazoto(5e10della6metilpterina).
Persintetizzarequestocompostosipartedallavitaminaacidofolico.L’acido folico deve essere ridotto da una diidrofolato reduttasi, consumando NADPH, prima adiidrofolatoepoiatetraidrofolato.Quest’ultimopartecipaaunaseriedimetabolismi.Iltetraidrofolatoprevalentementetrasportaunitàcarbonioseinformadialdeideemetilene.Pochesonolereazioniall’internodellequaliriesceatrasferireilgruppometilico.Cisonoduereazionichecaricanosultetraidrofolatoleunitàmonocarboniose:
1. L’enzimaserinaidrossimetiltransferasiusacomecofattoreilpiridossalfosfatopertrasferirela serina sul tetraidrofolato che si lega all’azoto 5 e 10. Il carbonio entra a far partedelcoenzimaeilgruppoalcolicoèliberatosottoformadiH2O.Laserinadiventaglicina.SiformailN5,N10metilene-tetraidrofolato.AttraversounareazioneirreversibilecatalizzatadalN5,N10metilene-tetraidrofolatoreduttasi,conimpiegodiNAD+,sipuòottenerelaformachetrasportacarboniopiùridotto,ilN5metil-tetraidrofolato.
40/71
Trasferimento di -CHO, -CH2OH, -CH3
43/71
Trasporto di unità monocarboniose sul H4-FOLATO
89
2. Recupera l’unità monocarboniosa dal formiato con consumo di ATP. L’enzima N10 -formiltetraidrofolato sintetasi carica un gruppo formile sull’azoto 10 del tetraidrofolatoformandol’N10-formil-tetraidrofolato.UnacicloidrolasisuccessivamentelotrasformainN5,N10metenil-tetraidrofolato(formaintermedia),conliberazionediunH2OchepuòesseretrasformatoinN5-formimino-tetraidrofolatodaunaciclodeaminasitramitel’aggiuntadiunNH4
+.L’ N5, N10 metenil-tetraidrofolato può inoltre essere convertito in N5,N10 metilene-tetraidrofolato da una N5, N10metilene-tetraidrofolato deidrogenasi; oppure può essereconvertito in N5-formil-tetraidrofolato da una cicloidrolasi (via minoritaria). Questocomposto può ritornare indietro, in quanto tutte queste reazioni sono reversibili, conl’enzimaN5,N10metenil-tetraidrofolatoeATP.
Se manca acido folico nella dieta, diminuisce la concentrazione di tetraidrofolato, le reazioniprecedentisonocompromesse.
44/71
90
LaS-adenosilmetioninapartecipaaltrasferimentodi-CH3.E’formatadall’adenosinacheèlegatacovalentementealozolfodellametionina.
NellacellulavienesintetizzataapartiredametioninaeATP.Èunareazionerarissimainquantovienerottoillegameesterico.L’ATPperdetuttietreigruppifosfato.LasintesidiS-adenosil-metioninaècatalizzatadall’enzimametioninaadenosiltransferasi.Lozolfoacquistaunacaricapositivanetta.Ilgruppometilicocheilcoenzimacedeèl’ultimo.
LaS-adenosil-metiotinapartecipaaunaseriedireazioniedèusatadaglienzimimetiltransferasi.UnavoltachehacedutoilgruppometilicositrasformainS-adenosil-omocisteina.Lacellulaorapuòeliminare S-adenosil-omocisteina e si rigenera S-adenosil-metionina partendo da metionina eadenosina (processo molto costoso) oppure può rigenerare S-adenosil-metionina partendo daSadenosilomocisteina(processoprivilegiato).
41/71
Trasferimento di -CH3
46/71
47/71
91
Comesiriciclal’S-adenosil-metionina?L’omocisteina può essere substrato di una idrolasi che rimuove l’adenosina, liberando acqua, eformalaS-adenosil-omocisteina.Puòdiversamenteesseremetilata ricevendoungruppometilicodal tetraidrofolato in formaN5-metiltetraidrofolatoconl’interventodelcoenzimaB12edell’enzimametioninasintasi.DegradazionedegliamminoacidiaPIRUVATOGliamminoacidichevengonodegradatiapiruvatosonolatreonina,iltriptofano,l’alanina,laglicina,laserinaelacisteina.
- Iltriptofano:nontuttiisuoicarbonivannoaformarepiruvato,masoloquellodelgruppocarbossilico,ilcarbonioαeilprimocarboniodellacatenaR.Essivengonorimossiattraverso4reazionidall’anelloaromaticoesiformainalanina.
- L’alanina: viene trasformata inpiruvato tramite l’alaninaaminotransferasi che rimuove ilgruppoamminicoesiottienel’αchetoacido.
- La cisteina: per convertirla in piruvato bisogna rimuovere il gruppo tiolico (-SH) tramiteun’idrolasieilgruppoamminico(NH2)tramiteunaamminotransferasi.
- Laserina:lecellulehannounaserinadeidratasi,cheèunenzimacheusaPLP,edèunodeipochiamminoacidichenelsuocatabolismoperdeilgruppoamminicodirettamentecomeioneammonio.Laserinadeidratasicatalizzadueeventi:larimozionedelgruppoamminicochesitrasformaingruppochetonicoelarimozionedelgruppoossidrilico.Cosìfacendoitrecarbonidiventanopiruvato.
50/71
Via secondaria nell'uomo
Degradazione a PIRUVATO
92
- Laglicina:subiscetrediversereazioni,duedellequaliportanoallaformazionedipiruvatoelaterzaportaallaformazionediunaltrocomposto.
1. LaglicinavieneconvertitainserinaaggiungendoCH2OHtramitel’enzimaserinaidrossimetil transferasi ed è un enzima che trasferisce il gruppometilenico, aspese del tetraidrofolato, sullo scheletro della glicina trasformando in serinausandoPLP.
2. L’enzima di clivaggio della glicina utilizza NADP+, rompe la glicina in gruppocarbossilicochevieneliberatoinCO2eingruppoamminicoliberatocomeioneammonioeungruppometilenicochevienetrasferitosultetraidrofolato.
3. La terzia via di degradazione della glicina porta alla formazione di ossalatoattraverso la formazionedell’intermedio gliossalato attraverso l’enzima aminoacidoossidasi(afunzionemista)cheusaossigenomolecolareeliberailgruppoamminicodellaglicinacomeNH3ocomeNH4
+.
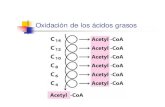
DegradazionedegliamminoacidiaACETILCOAGliamminoacidichevengonodegradatiaacetilCoAsonoiltriptofano, la lisina, lafenilalanina, latirosina,laisoleucinaelaleucina.
- Iltriptofano,attraversovariereazioni,vienetrasformatoinalaninacheproducepiruvato.Iquattrocarboniinrosaentranoafarpartedell’αchetoadipato(intermedioincuivengonotrasformati anche 4 atomi di lisina) che poi viene ossidato a glutarilCoA che vienedecarbossilatoacetilCoA.
- La fenilalanina deve essere essere convertita in tirosina. Servono molte reazioni perrompere l’anello aromatico, una strutturaparticolarmente stabile. Quasi tutti gli enzimicoinvoltinelladegradazionedellafenilalaninasonoritrovatimutatiinunaseriedireazionimetabolicheimportanti:fenilchetunuria,tirosinemiaI,II,IIIealcaptonuria.
1. La fenilalanina viene degradata e la tirosina viene sintetizzata: la fenilalaninaviene convertita in tirosina tramite l’enzima fenilalanina idrossilasi che devericorrereaduecoenzimi,ilNADHelatetraidrobiopterina.Latetraidrbiopterinaha la funzione di raccogliere gli equivalenti riducenti dal NADH e cederli allafenilalanina idrossilasi che inserisce un ossigeno nell’anello della tirosina e unossigenoinveceèusatoperdiventareacqua.
2. La tirosina viene deaminata da una tirosina amminotransferasi e il gruppoamminicodellatirosinavienepassatosulglutammato.Ilcompostoottenutoèilp-idrossifenilpiruvato.
3. Avvienedunqueunadeidrogenazione:usandoossigenomolecolaresiintroduceunsecondogruppoossidrilicosull’anelloaromatico.IlgruppocarbossilicovieneeliminatosottoformadiCO2econtemporaneamenteilcarboniochetonicovieneossidatoagruppocarbossilico.Lamolecolaottenutaèl’omogentisato
53/71
93
4. L’omogentisato è substrato di un’altra diossigenasi che permette l’aperturadell’anelloaromatico.Siottiene ilmaleilacetoacetato.Questocompostohaundoppiolegamecischedevediventaretransattraversoleisomerasi.
5. Siottieneilfumarilacetoacetato.Unaliasi,ilfumarilacetoacetasi,rompeilKrebs,mentrel’acetoacetatodiventeràacetoacetilCoA.
- La leucina:puòprodurreacetoacetatochediventapoiacetoacetil-CoAepoiacetil-CoAopuòprodurredirettamenteacetilCoA.
- L’isoleucina:produceacetil-CoAepropionil-CoA.
59/71
55/71
Degradazione ad ACETIL-CoA
94
DegradazionedegliamminoacidiaαCHETOGLUTARATOGliamminoacidichevengonodegradatiaαchetoglutaratosonol’arginina,l’istidina,ilglutammato,laglutammina.
- L’arginina: nel fegato essa sfrutta l’enzima del circolo dell’urea, l’arginasi. Quando è ineccesso per il ciclo dell’urea viene degradata. Il primo passaggio della degradazionedell’ornitina è la rimozione del gruppo amminico in posizione δ. L’enzima δ amminotransferasiusal’αchetoglutaratocomeaccettoreegeneraglutammato.Ilcarbonio5vieneossidatoediventaaldeide.Sièformatocosìlaglutammatoγ-semialdeide.Questoprodottovieneossidatoaglutammatodallaglutammatodemialdeidedeidrogenasiconl’impiegodiNADPoNAD.
- Laprolina:tramiteduereazionigiungeall’intermedioglutammatoγ-semialdeide.- L’istidina: attraversoquattro reazioni giunge a glutammato.Nella prima viene rimosso il
gruppo -NH2,nella secondaenella terza vengonoaggiunteduemolecoledi acqua,nellaquartavienetrasferitoilgruppoformimminicosultetraidrossifolato.
- Laglutammina:vieneconvertitainglutammatotramitel’enzimaglutaminasi.- Ilglutammato:vieneconvertitoinαchetoglutaratodall’enzimaglutammatodeidrogenasi.
66/71
Degradazione ad a-Chetoglutarato
95
DegradazionedegliamminoacidiaSUCCINILCOAGli amminoacidi che vengono degradati a succinilCoA sono la metionina, treonina, valina eisoleucina.
DegradazionedegliamminoacidiacatenaramificataGli amminoacidi a catena ramificata sono la valina, l’isoleucina e la leucina. Essi sonoprincipalmentemetabolizzati nel fegato. Le vie extraepatiche sonodiverse: l’amminotransferasispecificatrasformaquestiamminoacidiinαchetoacidi;ladeidrogenasiinsiemeallapiruvatoeallaαchetoglutarato deidrogenasi usa NAD, aggiunge CoA e decarbossila. Questo complesso usa icoenzimiTPP, lipoatoe FAD.Mutazioni a caricodiquestadeidrogenasi: la suaassenza causa lamattiaurinedasciroppod’acero.
67/71
Degradazione a SUCCINIL-CoA
70/71
Degradazione degli amminoacidi a catena ramificata
Tessuti extraepatici
96
DegradazionedegliamminoacidiaOSSALACETATOGliamminoacidichevengonodegradatiaossalacetatosonol’asparaginael’aspartato.L’asparaginavienetrasformatainaspartatodallaasparaginasi.L’aspartatopoivienetrasformatoinossalacetatodall’aspartatoaminotranferasi.
71/71
Degradazione ad Ossalacetato
97
BIOSINTESIDEICOMPOSTIAZOTATIEnzimi essenziali glutammina sintetasi e glutamminaammidotransferasi. I donatori diN sono laglutammatoinreazioniamminotransferasicheelaglutamminainreazioniammidotransferasiche.La glutammina sintetasi, enzimamultimerico, si trova al centro delle vie di degradazioni degliamminoacidiedellaviacheportaallasintesiditutiicompostiazotati.Laquantitàdiglutamminapresentedeveessereregolatainmododasoddisfaretutteleesigenzedell’organismo.Esistonoduetipidiregolazione:
- Allosterica: con ampia serie di composti che agiscono come modulatori regolativi sullaglutamminasintetasi.Èadditiva:sesonotuttipresenti,l’enzimaèfermo,secenesonounooduel’enzimarisultainibitoefunzionapiùlentamentemanonècompletamentospento.Regola in maniera fine la sintesi della glutammina. I regolatori allosterici sono alcuniamminoacidi come la glicina, l’alanina, l’istidina, il triptofano, l’AMP e CTP, laglucosammina6-fosfato(unglucosamminoglicani),ilcarbamoilfosfato.Ilcarbamoilfosfatoèpresentenellacellulainduepool:unoèilpuntodipartenzadelciclodell’urea,unoèilpuntodipartenzadellasintesidellepirimidine.
4/46
REGOLAZIONE ALLOSTERICA
98
- Covalente: la glutammina sintetasi viene adenilato, ovvero viene aggiunto un AMPall’enzima.Questamodificazioneinfluiràsullastrutturatridimensionaledell’enzimaequindisulla suaattività.Anche l’adenilazionedeveessere regolata: l’enzimaviene inattivatodaun’adenilazione, viene poi attivato tramite una deanilazione. Questo processo vienecatalizzatodall’adeniltransferasi(AT),cheesisteinassociazioneconunaproteinaPII.AsuavoltaPIIpuòpresentareunostatosenzamodificazionecovalenteequandoilcomplessoAT-PIIèformatopromuovel’adenilazionedell’enzimabersaglio.NellacellulailcomplessoAT-PIIpuòveniruridilato, ovveroPIIpuòessere coniugato conUMP.Quando il complessoèuridilato,l’enzimarimuovel’adenilazionedellaglutamminasintetasi.Esisteunenzima, l’uridiltransferasi, cheè responsabiledellauridilazionediPII.Se l’uridiltransfersi èattivo si ha l’adenilazione dellaproteina, seè inattivonon funziona. L’uridiltransferasi è inibita da fosfato inorganico eglutammina, che sono i prodotti finali dellasintesidellaglutammina.L’uridilazione è invece attivata dai precursori dell’intero processo, ovvero ATP eαchetoglutarato(precursoreamontedellasintesidelglutammato).Noinonpossiamoconservareformedicompostiazotati.
6/46
REGOLAZIONE COVALENTE
99
MeccanismocataliticoLa glutammina cede il suo azoto ammidico durante le reazioni attraverso le glutamminaammidotransferasi.Essesidifferenzianoinbaseallaspecificitàperilsubstrato.Laglutamminacedeil gruppoNH2 cheviene liberato sotto formadiNH3equandovieneaccettatodaidonatoripuòessereaccettatosiacomegruppoamminicochecomegruppoimminicooammidico.Ilprimodominocataliticoèilsitodilegameperlaglutammina,ilsecondodominioèspecificoperiltipodisubstratocheaccetteràilgruppoamminicodellaglutammina.Ledueporzionidelsitoattivosono legatedaun canaleper l’ammoniaca. La secondaporzioneè specificaper il substrato cheaccetteràl’azoto.
All’internodelprimositoattivo(quelloilcuisilegalaglutammina),l’amminoacidofondamentaleèunacisteinachefunzionaconunmeccanismodicatalisicovalente.Siformaunlegamecovalentetra ilcarbonioammidico inγdellacatenaRe iltiolo fornitodallacisteina.Si forma il legameecontemporaneamentegrazieall’ingressodiunprotoneesceammoniaca.Sonoentratiidonatoriel’ammoniaca attraversa il canale e si sposta nella seconda parte del sito attivo dove avviene lareazionetral’ammoniacaeilsubstrato.Siformerannoleammineoleimmine.Abbiamol’ingressodell’acquanelsitoattivochepermettel’idrolisidellegametioestereliberandoilglutammato.Dalsitoattivosiliberailprodottoottenuto.
7/46
GLUTAMMINAAMMIDOTRANSFERASI
Meccanismocatalitico
100
Meccanismod’azionedellafamigliadelleglutamminaammidotransferasi
8/46
1
Meccanismo d’azione della famiglia delleglutammina ammidotransferasi (almeno 12 membri)
Specificità diversa: diversi amminoacidi prodotti
9/46
2
10/46
3
11/46
4
101
BIOSINTESIDEGLIAMMINOACIDIDei20amminoacidicheservonoperlasintesiproteica,l’uomonesintetizzasolamente11.Glialtrisono detti essenziali e sono introdotti con l’alimentazione: lisina, isoleucina, leucina, treonina,valina, triptofano, fenilalanina, metionina e istidina. A seconda delle condizioni fisiologichedell’organismosipossonoaggiungerealtrinonessenziali.I carboni sono forniti da una serie di composti: il ribosio 5-fosfato fornisce istidina, il 3-fosfoglicerato fornisce i carboniper laserina chepoiportaalla sintesidiglicinaecisteina, il3-fosfogliceratopuòdiventareeritrosio4-fosfatodalqualesiottengonoglischeletriperiltriptofano,lafenilalaninaelatirosina.Ilpiruvatoèusatoperlasintesidialanina,valina,leucinaeisoleucina.L’αchetoglutaratofornisceloscheletroperilglutammatodacuisiottieneglutammina,prolinaearginina.L’ossalacetatofornisceaspartatochedàasparagina,metionina,treoninaelisina.
14/46
Fonte di atomi di Carbonio per la sintesi di amminoacidi I
15/46
Fonte di atomi di Carbonio per la sintesi di amminoacidi II
102
SintesidiserinaIl 3-fosfoglierato viene ossidato dalla fosfoglicerato deidrogenasi, producendo un NADH, e siottiene il 3 fosfoidrossipiruvato. Su questo αchetoacido una fosfoserina amminotransferasitrasferisceilgruppoamminico,presodalglutammato,esiottiene3-fosfoserina.Perottenerelaserinabisognadefosforilareil3-fosfoserinaattraversounafosfoserinafosfatasi.
SintesidiglicinaLa glicina si ottienedalla serina tramiteuna serina idrossimetiltransferasi. La glicina si ottienerimuovendolacatenalateraledellaserinatrasferitaaltetraidrofosfatoinformametilenica.
Esisteancheunaviaalternativaperlasintesidellaglicinacheavvienenelfegato.QuestaviapartedallaCO2,dall’NH3edalgruppometilenicoformatodaltetraidrofolato.
18/46
19/46
19/46
103
SintesidellacisteinaLacisteinavienesintetizzatatramiteduereazioniapartiredallacondensazionediomocisteinaeserina.Dallacondensazionediquesteduemolecolesiformalacistationina,unomosolfuro.L’enzimacistationinaγliasiportaavantiduereazioni:l’idrolisidellacistationina,cherompeillegametrazolfoeilcarboniodell’omocisteina,esiottienelacisteina;vieneeliminatoilgruppoamminicoliberato sotto forma di NH4
+ e si forma l’αchetobutirrato. L’omοcisteina proviene dall’Αdomet.L’αchetobutirratopuòessereossidatodallaβossidazioneedentrarenelciclodiKrebs.
L’αchetoglutaratofornisceatomidicarboniopersintetizzareilglutammatotramitetransaminasi.Dalglutammatosipuòsintetizzareglutammina,prolinaearginina.SintesidiprolinaLaprolinaèunimminoacido.Perazionediunaglutammatochinasiilglutammatovienefosforilatoesiproduceγ-glutamilfosfato.Essovienedeidrogenatodaunaglutammatodeidrogenasi:vieneridotto il gruppo carbossilico, in posizione γ appena fosforilato, in un aldeide e il fosfato vieneliberatocomeinorganico.Siformalaγ-semialdeide.Questocompostoèmoltoinstabile,reagiscesubitoesiformalaΔ1pirrolina-5-carbossilatoconundoppio legame. Questa struttura viene ridotta a prolina tramite l’enzimapirrolina carbossilatoriduttasi.PuòanchequiusaresiaNADHcheNADPH.
21/46
Sintesi della Cisteina
23/46
Sintesi della PROLINA
23/46
Sintesi della PROLINA
104
SintesidiargininaPuò essere sintetizzata partendo dalla glutammato γ semialdeide che può essere substratodell’enzima ornitina δ-amminotransferasi. Questo enzima recupera il gruppo amminico delglutammatoelolegainposizioneδallaγsemialdeideottenendol’ornitina.L’ornitinaportaallasintesidiargininaattraversoilciclodell’urea.Questasintesiavverràsoprattuttonelfegato.
L’argininapuòessereanchesintetizzatatramiteunoscambiodiintermeditracelluledell’intestinoe celluledei tubuli renali: le celluledell’intestinousandoammoniaca libera,bicarbonato eATPpossono produrre carbamil fosfato che produce a sua volta la citrullina; oppure possonointraprenderelaviametabolicachedaglutammatoproduceornitinaepoicitrullina.Lacitrullinavienemessaincircoloerecuperatadallecelluledeitubulirenalichelatrasformanoadarginina.Lecellulerenalimancanodiarginasi,quindil’argininavienemessaincircoloadisposizionedeglialtritessutiovieneusatadalrenestesso.
24/46
Sintesi Arg attraverso il ciclo dell'ureaSintesi Arg attraverso il ciclo dell'urea
Prolina
25/46
Sintesi di arginina tra intestino e rene
105
L’ossalacetato produce l’aspartato che a sua volta dà origine ad altri amminoacidi quali lametionina, la lisina, la treonina e l’asparagina. Nell’uomo però l’aspartato produce solamentel’asparaginainquantoglialtriamminoacidisonoessenziali.Ilpiruvatodàorigineall’alanina,lavalina,laleucina,laisoleucina.Nell’uomovieneusatonell’uomosoloperlasintesidialanina.
SintesidialaninaL’enzimaalaninaamminotransferasipartendodaglutammatoepiruvatoperottenerealaninaeαchetoglutarato.
26/46
27/46
CH3CH3
Alanina Piruvato
Sintesi di alanina
106
SintesidiaspartatoSiottienepertransaminazioneusandol’aspartatoamminotransferasi.IlgruppoNH3
+ècedutodalglutammatoperfareaspartatoeαchetoglutarato.SintesidiasparaginaIl gruppo amminico dell’asparagina è donato dalla glutammina. L’asparagina si ottienedall’aspartatotramitel’asparaginasisintetasi.SintesiditirosinaLa tirosina si ottienedalla fenilalanina che viene introdotta con l’alimentazione. La fenilalaninavienedegradataatirosinadallafenilalaninaidrossilasicheusailtetraidropiobterina.COMPOSTIDERIVANTIDAGLIAMMINOACIDISintesidicreatinaLacreatinasvolgeunruoloimportantenell’omeostasidelmuscoloscheletrico.Puòesisterenellasuaformafosforilatacheconservaenergianelmuscolosottoformadifosfocreatina.Persintetizzarelacreatinasipartedallaglicinaedall’arginina.Laglicinaforniscetuttiisuoiacidi,l’arginina fornisce solo l’urea (gruppo guanidinico). Attraverso l’amidinotransferasi si forma laguanidinoacetatoinquantol’enzimaprendel’ureadall’argininaelalegaalgruppoamminicodellaglicina.Introducendoungruppo-CH3tramitemetilazioneconl’enzimametiltransferasisiottienelacreatina.Ilgruppometilicoèfornitodall’Sadenosilmetionina.La creatina può essere fosforilata, a livello del substrato, dalla creatina chinasi e diventarefosfocreatina.QuestereazioneèreversibileinbaseallapresenzamaggiorediATPoADP.Lacreatinavieneeliminatacomecreatininaevienefiltratacompletamentealivellorenale.
33/46 34/46 35/46
107
Sintesidiglutatione(γglutamilcistinilglicina)La sintesi di glutatione avviene soprattutto nel globulo rosso. Il glutatione elimina i radicalidell’ossigeno.Ilglutationeèformatodallaγ-glutammato,dallacisteinaedallaglicina.Sipartedalglutammatoetramite l’enzimaγ-glutammil cistein sintetasi si uniscono ilglutammato e la cisteina. Il gruppocarbossilicoinγdelglutammatosilegaalgruppoamminicoinαdellacisteina(siformaunlegameammidico).Siottienecosìlaγ-gluamil-cisteina.Suquestocomposto laglutationesintetasi inserisce laglicinaper formare ilglutatione finale. Illegamepeptidicosiformatrailgruppocarbossilicoinαdellacisteinaeilgruppoamminicoinαdellaglicina.
Nellecelluleilglutationepartecipaalciclodelγglutammileedèutilizzatonelreneperiltrasportodegli amminoacidi. Esiste la γ-glutamiltranspeptidasi, un enzima di membrana, che prende ilglutationesullatocitosolicoeunamminoacidosullatoextracellulareetrasferisceilγglutammiledal glutatione all’amminoacido formando un γ-glutamil amminoacido e una cisteinilisina. Lacisteinilisinasiseparasuccessivamenteincisteinaelisina;mentreilγ-glutamilamminoacidovienetrasportatonellacellulatramiteuntrasportatorediamminoacidi.Quando l’amminoacido arriva nella cellula, viene rimosso il γ-glutammile sotto forma di 5-idrossiprolinaevienericonvertitoinglutammatochevienepoiusatodallecelluleperrisintetizzareilglutatione.Questotrasportoèimportantealivellorenalepertrasportaregliamminoacidi.
36/46
Sintesi di glutatione
38/46
Ciclo del γ-glutammile per il trasporto degli amminoacidi nel rene
108
BIOSINTESIAMMINEBIOATTIVELe ammine bioattive sono ammine che hanno una funzione nel nostro organismo e sono ladopamina, la noradrenlaina, l’adrenalina, il GABA, l’istamina, la serotonina, lamelatonina el’ossidonitrico.Sintesididopamina,norepinefrinaeepinefrinaLaviametabolicacheportaallalorosintesièunica.Sonosintetizzatiinsequenzaunodopol’altroapartiredall’amminoacidotirosina.
1. Latirosinavieneidrossilatadall’enzimatirosinaidrossilasi,un’ossigenasimistacheusalatetraidrobiopterina e l’ossigeno molecolare come coenzimi. Si aggiunge un gruppoossidrilicosull’anelloaromaticoesiottieneladopa.
2. Ladopavienedecarbossilatatramitel’enzimadecarbossilasi,specificopergliamminoacidi,aromatici e usa il piridossalfosfato (PLP) come coenzima. Si ottiene la dopamina coneliminazionediunaCO2.Unamalattiadegenerativa,comeilmorbodiParkinson,ècausatodalladiminuzionedelladopaedelladopamina.
3. Avviene un’altra idrossilazione grazie all’enzima è β idrossilasi. Questo enzima èun’ossigenasi a funzione mista che impiega l’ascorbato e ossigeno molecolare comecoenzimi. Viene inserito un gruppo -OH sul carbonio β. Si ottiene la norepinefrina onoradrenalina.
4. L’ultima reazione che porta alla sintesi di epinefrina (o adrenalina) è unametilazione alivello del gruppo amminico attraverso l’enzima feniletanolammina N-metiltransferasi. Ildonatoredelgruppometilicoèl’S-adenosilmetionina.Questeduemolecolesonoprodotteerilasciatedallamidollaredelsurrene.Lanorepinefrinaèunneurotrasmettitore.
40/46
Sintesi di DopaminaNoradrenalinaAdrenalina
41/46
109
SintesidiGABA(acidoγamminobutirrico)Vieneprodottodalglutammatochevienedecarbossilatodall’enzimaglutammatodecarbossilasicheusaPLP.Vienerimossoilgruppocarbossilicoinαdell’amminoacido.
SintesidiistaminaVieneprodottaapartiredall’istidinachevienedecarbossilatadall’enzima istidinadecarbossilasicheimpiegaPLPcomecofattore.Vienerimossoilgruppocarbossilicoinαesiottienel’istamina.L’istaminaèprodottadurantelereazioniallergiche.
43/46
Sintesi di GABA
44/46
Sintesi di Istamina
110
SintesidiserotoninaemelatoninaLaserotoninaèl’ormonedellafelicità.Lamelatoninaservearegolareiritmicircadiani(ciclosonno-veglia).
1. L’anelloaromaticodeltriptofanovieneidrossilatodallatriptofanoidrossilasicheimpiegacome cofattori l’ossigeno molecolare e la tetraidrobiopterina. Si ottiene il 5-idrossi-triptofano.
2. Il 5-idrossi-triptofano viene decarbossilato da una decarbossilasi specifica per gliamminoacidiaromaticiesiottienelaserotina.
3. Laserotinavieneacetilataattraversoattraversol’acetilCoAformandoN-acetilserotonina.4. Ilgruppoossidrilico inseritoprecedentementedeveesseremetilato. Ilgruppometilicoè
cedutodallaS-adenosinmationinaadoperadellaS-adenosinmetioninatransferasi.Siformacosìlamelatonina.
45/46
Sintesi di Serotonina e Melatonina
45/46
Sintesi di Serotonina e Melatonina
45/46
Sintesi di Serotonina e Melatonina
111
SintesidiNO(ossidonitrico)L’ossidonitricoèunormonesintetizzatoapartiredall’arginina.Glienzimiimpiegatinellasuasintesisonogliossidonitricosintasi.
1. Il gruppo NH2+ dell’arginina viene rimosso e il suo azoto darà origine all’azoto del NO.
Avviene l’ossidazione dell’azoto e del carbonio. Il donatore di equivalenti riducenti è ilNADPHel’ossigenomolecolareèutilizzatoperinserireatomidiossigeno.
2. Siformal’idrossiargininasucuiagisceNADPHperformarecitrullinaeNO(haunelettronespaiato,èunradicale).IlNOentraperdiffusionenellecellulebersaglio.
46/46
Sintesi di NO