TFIII Naproxeno T1
-
Upload
ravenom-wagner -
Category
Documents
-
view
298 -
download
8
description
Transcript of TFIII Naproxeno T1

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
PRINCIPIO ACTIVOPropiedades generales1
Fórmula desarrollada:
Fórmula condensada: C14H14O3
Nombre genérico: NaproxenoNombre químico: Ácido D-2-(6-metoxi-2-naftil)propiónico.Masa molecular: 230.26
Propiedades físicas1
Polvo cristalino de color blanco a blanquecino. Sabor amargo.
Propiedades químicas1, 2
Los factores que afectan la estabilidad del principio activo son: la hidrólisis catalizada por ácidos y la luz en presencia de oxígeno.Puede ser afectado por la luz.Almacenar a 25ºC.Preservar en contenedores herméticos.
Propiedades fisicoquímicas1 Prácticamente insoluble en agua a pH 2, libremente soluble en agua a pH 8 o más. Soluble en 25 partes de etanol (96%), en 20 partes de metanol, en 15 partes de cloroformo y en 40 partes de éter.Punto de fusión entre 154°C y 158°CAparente pKa de 4.15.
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 1 DE 20
Éter
Ácido carboxílicoNaftaleno

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
Densidad de 1.20 g/cm
Espectro de IR
Espectro UV
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 2 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
De acuerdo con los ensayos preliminares realizados con el fármaco en cada uno de los sistemas buffer, se determinó que el máximo de
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 3 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
absorción (λmáx) para el Naproxeno en buffer pH 1,2 fue de 229 nm y en buffer pH 7,4 de 262 nm.3
Propiedades biológicas4, 5
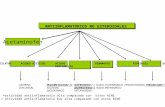
La acción farmacológica del naproxeno es similar a la de otros antiinflamatorios no esteroideos (AINE). Presenta actividad antiinflamatoria, analgésica y antipirética. El naproxeno actúa por inhibición central y periférica de la enzima ciclooxigenasa, interrumpiendo de esta manera la síntesis de prostaglandinas, importantes mediadores del dolor, fiebre e inflamación.En los pacientes tratados crónicamente con terapia AINE en cualquier momento puede ocurrir toxicidad gastrointestinal severa, como sangrado, ulceración y perforación, con o sin síntomas de advertenciaSe absorbe rápida y completamente en el tracto gastrointestinal después de la administración oral. El naproxeno tiene un volumen de distribución de 0.16 L/kg. Se une más del 99% a las proteínas plasmáticas a dosis terapéuticas normales.El naproxeno se metaboliza ampliamente en el hígado a 6-0-desmetil-naproxeno.Aproximadamente el 95% del naproxeno se excreta en la orina, principalmente como naproxeno (menos del 1%), 6-o-desmetil-naproxeno (menos del 1%) o sus conjugados (66 al 92%). En menor cantidad, menos del 3% es excretado en las heces.Dosis y vía de administración5
En la población pediátrica, la dosificación es la siguiente: Dosis de inicio de 10 mg/kg seguida por 2.5 a 5 mg/kg cada 8 horas. La dosis no deberá exceder de 15 mg/kg al día después del primer día de tratamiento.Migraña: La dosis recomendada es de 750 mg al primer síntoma de un episodio inminente de migraña. Se puede administrar una dosis adicional de 250 a 500 mg durante el día de ser necesario, pero no antes de media hora de la dosis inicial. Para la profilaxis de migraña, se recomienda una dosis de 500 mg dos veces al día. De no haber mejoría en 4 a 6 semanas, el tratamiento debe ser interrumpido.Condiciones agudas: Analgésico / dismenorrea / afecciones musculosqueléticas agudas / estados de dolor agudo con un componente inflamatorio: La dosis recomendada de naproxeno es de 500 mg seguido por 250 mg cada 6 a 8 horas según se requiera.
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 4 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
Episodio agudo de Gota: Se recomienda iniciar con 750 mg seguido por 250 mg cada 8 horas hasta que remita el ataque de gota.
Presentaciones comerciales
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 5 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
FORMA FARMACÉUTICAGeneralidades6
Forma sólida que contiene el o los fármacos y aditivos, obtenida por compresión, de forma y de tamaño variable.Puede estar recubierta por una película compuesta por mezclas de diversas sustancias tales como: polímeros, colorantes, ceras y plastificantes, entre otros; este recubrimiento no modifica su forma original y no incrementa significativamente el peso de la tableta (generalmente del 2 a15 %).O bien, puede estar recubierta con varias capas de una preparación compuesta principalmente por azucares y otros aditivos como colorantes, saborizantes, ceras, entre otros, que incrementan significativamente el peso del núcleo.
Vía de administración: oral, bucal, sublingual, vaginal.
Consideraciones de uso: De liberación prolongada, de liberación retardada, masticables, efervescentes, dispersabIes, para solución, para suspensión.
Ventajas•Forma de dosificación exacta, ligera y compacta.•Costo relativamente bajo.•Fácil transporte.•Fácil administración.•Estabilidad química, mecánica y microbiológica.•Enmascara olores, sabores, atenúa colores.•Pueden tener sabor, esencia y color.•Pueden transformarse en otra forma farmacéutica.•Posibilidad de identificación con punzones grabados.
Desventajas•Algunos fármacos no resisten la compactación (amorfos, flóculos o de baja densidad)•Fármacos pobres de hidratación, baja disolución, absorción pobre en el tracto gastrointestinal•Principios activos de sabor amargo, olores desagradables o sensibles a la oxidación o humedad•No pueden ser ingeridas por niños, personas inconscientes o con problemas de deglución.
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 6 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
Métodos de fabricación Hay tres procesos de fabricación fundamentales para la obtención de comprimidos: Compresión directa, compresión previa granulación vía húmeda y granulación por compresión (doble compresión).La granulación vía húmeda es el método más antiguo y convencional, mientras que la compresión directa se ha desarrollado más modernamente sobre todo por el avance de los excipientes capaces de ser comprimidos directamente, con alta proporción de principio activo y dando comprimidos de considerable dureza. La selección del mejor proceso de compresión está determinada por las propiedades del principio activo, su nivel de dosificación y los requerimientos económicos de la operación. En el desarrollo de una nueva formulación deben de ser incluidos tanto procesos en seco como de vía húmeda. Sin embargo la granulación vía húmeda debe descartarse cuando el medicamento es sensible a la humedad y/o a la temperatura, cuando la separación del solvente es difícil o por la economía del proceso. La compresión directa resultará problemática cuando el principio activo se incluye en altas proporciones y fluye mal o es muy cohesivo.
Compresión directaEl proceso de compresión directa requiere un excipiente aglutinante efectivo. Debe de tener buenas propiedades cohesivas en estado seco y ser capaz de unirse a otros materiales para dar una masa compacta con baja presión de la máquina de comprimir.Deben de ser consideradas cuidadosamente las características físicas del principio activo para la selección del excipiente. Así en niveles altos de dosificación las características de flujo y compresibilidad del principio activo, influirán sobre el excipiente a utilizar.
Granulación vía húmedaLa granulación vía húmeda es el método más clásico para convertir un polvo en gránulos, dándole un flujo y una cohesividad adecuados para ser comprimidos.
Doble compresiónEs un método, al igual que la compresión directa, vía seca. Son requeridos dos procesos de compresión: compactación y compresión definitiva.
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 7 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
Se realiza este proceso cuando no es posible utilizar ni la vía húmeda ni la compresión directa por las propiedades físicas y químicas del principio activo. Los principios activos que van altamente dosificados en los comprimidos, polvos muy finos que se aglomeran, con poco flujo o con propiedades cohesivas , lábiles a la humedad y/o al calor, son los candidatos para el proceso de granulación vía seca o doble compresión.
Estados de la granulación
ExcipientesLa mayoría de los materiales utilizados en farmacia no pueden ser comprimidos directamente debido a su escaso flujo y propiedades cohesivas. Por lo tanto hay que desarrollar formulaciones que satisfagan los siguientes requerimientos: •Adecuado flujo en la tolva de la máquina de comprimir que proporcione un llenado uniforme de la matriz.• Suficiente cohesividad para formar un comprimido adecuado al aplicarle una fuerza determinada.
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 8 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
•Propiedades lubrificantes adecuadas para prevenir la adherencia a los elementos mecánicos. •Uniformidad de contenido en principio activo en cada comprimido. •Liberación adecuada del componente activo después de la administración del comprimido. •Posibilidad de ser procesados en equipos de alta velocidad. Generalmente, para conseguir estos requisitos, las sustancias activas requieren ser mezcladas con otros materiales.Los excipientes de comprimidos tienen diferentes funciones y de acuerdo a estas son clasificados en:Diluyente o diluenteSustancia inerte que se agrega para aumentar el volumen, con el propósito de que el comprimido tenga un tamaño útil para la compresión. Se agregan cuando la cantidad del ingrediente activo es pequeña o se dificulta la compresión. Le da cuerpo a la forma farmacéutica. Ejemplo: Fosfato dicálcico, sulfato de calcio, lactosa, celulosa, caolín, manitol, cloruro de sodio, almidón seco y azúcar en polvo.AglutinanteOtorgan a las formulaciones de los comprimidos una cohesividad que asegura que éstos permanezcan intactos después de la compresión, pero también mejoran las cualidades de libre flujo. Ejemplo: Gelatina, azúcar, metilcelulosa, carboximetilcelulosa, carbapol, etcétera.LubricantePrevienen la adhesión del material de los comprimidos a la superficie de las matrices y los punzones. Reducen la fricción entre las partículas. Facilitan la eyección de los comprimidos de la cavidad de la matriz y pueden mejorar la velocidad de flujo de la granulación del comprimido. Ejemplos: Estearato de calcio, ácido fumárico, palmitoestearato de glicerilo, laurilsulfato de magnesio, talco, ácido estéarico, estearato de magnesio. Porcentaje de uso: 0.1%-5%DeslizanteEs una sustancia que mejora las características de flujo de una mezcla de polvos. Se agregan en el estado seco, justo antes de la compresión (durante la lubricación).
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 9 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
Ejemplos: Silicato de calcio, silicato de calcio, celulosa polvo, carbonato de magnesio, óxido de magnesio, dióxido de silicio coloidal, almidón, talcoDesintegranteSustancia, o mezcla de ellas, agregada a un comprimido para facilitar su ruptura o desintegración después de su administración. Ejemplos: Ácido algínico, celulosa microcristalina, carboximetilcelulosa cálcica, glicolato sódico de almidón.
Algunos excipientes pueden cumplir más de una función, por lo tanto no todos ellos deben de estar presentes en un comprimido. Es esencial determinar la incompatibilidad química y física del principio activo con los excipientes elegidos para realizar la formulación definitiva, mediante estudios de preformulación.
Pruebas de control de calidad•Descripción.•Ensayo de identidad.•Peso promedio.•Variación de peso.•Uniformidad de dosis.•Desintegración.•Disolución.•Dureza.•Resistencia a la abrasión (friabilidad).•Contenido de principio activo por tableta.
Problemas en la fabricación
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 10 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
Referencias1.- Loyd V. Allen. Remington: The Science and Practice of Pharmacy. 22 Ed. Philadelphia: Pharmaceutical Press, 2013.2.- Trifonova E, Vistel M, Lemus M, Nápoles R. Naproxeno tabletas. Un nuevo producto de la industria farmacéutica nacional. MEDISAN 1997; 1(2). Disponible en: http://bvs.sld.cu/revistas/san/vol1_2_97/san07297.pdf (Acceso 31 de agosto de 2015).3.- Mora C, Tello M, Martínez F. Validación de una metodología analítica para la cuantificación de naproxeno en estudios de reparto líquido/líquido mediante espectrofotometría ultravioleta. Rev. Col. Cienc. Quím. Farm 2006; 35 (1). Disponible en: http://www.scielo.org.co/pdf/rccqf/v35n1/v35n1a05.pdf (Acceso 31 de agosto de 2015).
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 11 DE 20

FACULTAD DE ESTUDIOS SUPERIORES ZARAGOZA
TECNLOGÍA FARMACÉUTICA III
DESARROLLO DE LA FORMULACIÓN DE TABLETAS DE NAPROXENO BASE POR GRANULACIÓN HÚMEDA
4.- P.R. Vademecum. La nueva era de la prescripción médica: Naproxeno. Disponible en: http://mx.prvademecum.com/producto.php?producto=2145 (Acceso 31 de agosto de 2015).5.- UNAM, Facultad de Medicina. Naproxeno. Disponible en: http://www.facmed.unam.mx/bmnd/gi_2k8/prods/PRODS/Naproxeno.htm (Acceso 31 de agosto de 2015).6.- Secretaría de Salud. Farmacopea de los Estados Unidos Mexicanos. 11 Ed. México: Comisión Permanente de la Farmacopea de los Estados Unidos Mexicanos, 2014.7.- Ríos Morales D. Aglomeración de sólidos finos fluidizados. Tesis doctoral. Distrito Federal, Universidad Autónoma Metropolitana Unidad Iztapalapa, 2013.8.- Rowe R, Sheskey P, Weller P. Handbook of pharmaceutical excipients. 6 Ed. Washington, DC: American Pharmaceutical Association.9.- Sanz M. Estudio de la formulación y estabilidad de comprimidos de lobuprofeno. Tesis doctoral. Madrid, Universidad Complutense de Madrid.
EMITIÓCirce Areli Camarena Juárez
Aldo Portillo RomeroVentura González Marcos
Yoav
REVISÓLuis Daniel Cortés
Pérez
VO. BO. ASESORM. en F. Ma. De
Lourdes Cervantes Martínez
FECHA DE ENTREGA01/09/2015
HOJA 12 DE 20