Reporte Pruebas Bioquímicas a Una Muestra de Agua
-
Upload
enviromental-lab -
Category
Documents
-
view
55 -
download
6
description
Transcript of Reporte Pruebas Bioquímicas a Una Muestra de Agua

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 1/17
ÁREA DE SUSTENTABILIDAD PARA EL DESARROLLO
PROGRAMA ACADÉMICO DE QUÍMICA
ESPECIALIDAD TECNOLOGIA AMBIENTAL
GRUPO
QU-304
MATERIA
MICROBIOLOGIA AMBIENTAL
TITULO
AISLAMIENTO E IDENTIFICACIÓN DE MICROORGANISMOS
DE LA MATRIZ AMBIENTAL: AGUA
ASESORA
Dra. ROSA RICO MATA
DATOS DE IDENTIFICACIÓN DE LOS ANALISTAS
Fecha de inicio del análisis: 30 de junio de 2015
Fecha de término: 09 de julio de 2015
Nombre Cargo
Ilse Verónica Ávila Araujo Responsable
María Guadalupe Gómez Navarro Administrador
Janet Valeria Guerra Navarro Laboratorista 1
Reyna María Guadalupe Rendón Delgado Laboratorista 2
GENERACIÓN: 2014-2016

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 2/17
DATOS DEL SITIO EN ESTUDIO
1.- Breve descripción del estatus ambiental del sitio de estudio: Es un lugar húmedo debido a la presencia de agua, existe vegetación como pasto y arboles a los alrededores de la planta además de haber retención de agua en el suelo y olores desagradables.
SITIO DE MUESTREO
Nombre Ubicación /coordenadas GPS
Imagen de mapa satelital
Planta de tratamiento de aguas residuales de la
Universidad Tecnológica de León
N:21,06°30’17’’
O: -121.58°,27’71’’
2. Evidencia fotográfica del sitio Fecha: 02/07/15 Hora: 3:21 pm Fecha: 02/07/15 Hora: 3:21 pm
DATOS DE LAS MUESTRAS A ANALIZAR
1. Identificación
Matriz ambiental: agua Hora de toma de muestra: 12:15 pm Hora de siembra: 1:33 pm
Punto de Muestreo (ubicación /coordenadas GPS): UTL N:21,06°30’17’’ O: -121.58°,27’71’’
Tiempo de exposición (aplica solo para muestra de aire)
Nombre del/ los analistas que tomaron la muestra:
Martínez Chiquito Josué Neftalí de Jesús Felipe Florido Mauricio Iván
Nombre del/ los analistas que sembró la muestra:
Martínez Chiquito Josué Neftalí de Jesús Felipe Florido Mauricio Iván
2.Parámetros Fisicoquímicos
Color: Café Temperatura (oC) ambiental: 28°C pH:7.6
Olor: Desagradable Describir condiciones climatológicas: Nublado
3. Evidencia fotográfica del sitio de toma de muestra

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 3/17
AISLAMIENTO DE MICROORGANISMOS
1. Justificación del proceso para la identificación bacteriana
Es necesario identificar la morfología de la bacteria para conocer sus características físicas, lo cual, permite la descripción presuntiva de su taxonomía. Por otro lado el metabolismo de las bacterias es importante porque a través de ella se especifican las condiciones óptimas en las que se desarrolla, permitiéndonos conocer bacterias benéficas para el ambiente que ayudan a remover los contaminantes existentes en las matrices de agua, suelo y aire. Todo esto se logra siguiendo una serie de pruebas bioquímicas en las que se detectan características del metabolismo como la presencia de enzimas específicas para sustratos específicos, generación de compuestos finales a través de reacciones químicas que se llevan a cabo en las reacciones catabólicas, también se observa la producción de diferentes tipos de gases como el ácido sulfhídrico (H2S), dióxido de carbono (CO2) y oxígeno (O2), así como la generación de cambios de color en los medios de cultivo los cuales indican acidez o alcalinidad debidas a los compuestos que se generan de la degradación de sustratos orgánicos por las bacterias. Es así como se logra identificar el tipo de familia a la que pertenece.
2. Dos medios de siembra (Nombre y Composición)
1. (Medio 1) Agar Mac Conkey Fórmula (en gramos por litro)
Peptona 17.0
Pluripeptona 3.0
Lactosa 10.0
Mezcla de sales biliares 1.5
Cloruro de sodio 5.0
Agar 13.5
Rojo neutro 0.03
Cristal violeta 0.001
2. (Medio 2) Agar Eosina y Azul de Metileno Fórmula (en gramos por litro)
Peptona 10.0
Lactosa 5.0
Sacarosa 5.0
Fosfato dipotásico 2.0
Agar 13.5
Eosina 0.4
Azul de metileno 0.065
Morfología Colonial (Medio 1) Morfología Colonial (Medio 2)
Descripción
En agar Mac Conkey son colonias de tamaño mediano, de forma circular, con elevación convexa, bordes redondeados, lactosa positivas lo que les da coloración rosada.
Descripción
Son colonias aisladas, de tamaño mediano, de forma circular, con elevación convexa, color morado y contorno verde-metálico, bordes redondeados.

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 4/17
Dos Medios selectivos de resiembra (Nombre y receta)
Salmonella Shigella Agar (Medio 1) Agar XLD (Medio 2)
Fórmula (en gramos por litro)
Pluripeptona 5.0
Extracto de carne 5.0
Lactosa 10.0
Mezcla de sales biliares 8.5
Citrato de sodio 8.5
Tiosulfato de sodio 8.5
Citrato férrico 1.0
Agar 13.5
Verde brillante 0.00033
Rojo neutro 0.025
Fórmula (en gramos por litro)
Lactosa Monohidrato 7.5
Sacarosa 7.5
Tiosulfato sódico 6.8
Cloruro Sódico 5
L-Lisina 5
Xilosa 3.5
Extracto de Levadura 3
Desoxicolato sódico 2.5
Citrato Férrico de Amonio 0.8
Rojo Fenol 0.08
Agar Bacteriológico 13.5
Morfología Colonial (Medio 1) Morfología Colonial (Medio 2)
Descripción
Colonias color rosadas o rojas sobre un fondo rojizo, algunas colonias son transparentes, de forma puntiforme y con margen entero.
Descripción
Colonias de forma Puntiforme, Incoloras, algunas de centro negro que se presentan solas o en cadena.

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 5/17
4. Procedimiento de Aislamiento (describir detalladamente la cantidad de materiales y los pasos a seguir)
Materiales/Reactivos/Medios de cultivo/ Equipo a utilizar
Materiales Equipo Medios de cultivo
2 caja Petri 1 balanza analítica Agar Mac Conkey
1 mechero Fisher 1 incubadora
1 matraz Erlenmeyer de 250 mL
1 refrigerador
1 charola de aluminio 1 campana de flujo laminar
1 probeta de 100 mL 1 autoclave
1 asa de nicromo
1 piseta
1 gradilla
2 hisopos
1 espátula
Preparación de medios de cultivo:
Pesar en la charola de aluminio 3 g de Agar Mac Conkey.
Adicionar 60 mL de agua destilada
Esterilizar a 120° C por 15 minutos.
Distribuir en la campana de flujo laminar 30 mL de medio a cada caja Petri.
Dejar solidificar el agar.
Reservar en el refrigerador.
Pasos para el aislamiento del microorganismos (siembra, selección de la colonia y resiembra):
Siembra
Tomar en un frasco muestreador con ayuda de una cuerda, una muestra aproximada de 5 mL de agua de la planta de agua residual para el análisis.
Sacar una placa con el medio de cultivo ya solidificado del refrigerador.
Dentro de la campana de flujo laminar en condiciones de esterilidad, tomar 1 mL de muestra de agua residual con una jeringa.
Verterla cuidadosamente en el centro de la placa.
Homogenizar la muestra haciendo 5 movimientos de la placa a la izquierda y a la derecha de arriba abajo.
Finalmente meter a incubar la placa por 24 h a 35° C.

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 6/17
Selección de la colonia
Según la morfología de la colonia que se espera encontrar, seleccionar de la placa sembrada una colonia aislada que cumpla con las características de dicha morfología.
Posteriormente con un marcador indeleble, localizar las colonias seleccionadas y marcarlas dentro de un círculo.
Resiembra
Tomar del refrigerador una placa con el medio de cultivo Agar Mac Conkey preparado y solidificado para resembrar la bacteria deseada.
Encender un mechero Fisher, y detrás de la flama abrir la placa 2 que contenga el medio de cultivo de resiembra.
De la placa 1 sembrada anteriormente, tomar con un asa de nicromo pasada previamente por la flama del mechero, la colonia antes identificada.
Resembrar en la placa 2 en forma estriada como se muestra en la imagen 1
Por ultimo cerrar la caja y meterla a la incubadora por 24 h a una temperatura aprox. de 35°C
Nota: Es importante el uso de cubre-bocas y guantes durante todo el proceso.
Imagen 1 Modo de resiembra

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 7/17
5. Esquema del Perfil bioquímico (metabólico ) para la identificación del microorganismo seleccionado
Bacteria a
identificar
Características
Gram
Positiva Negativa
Cápsula
Positiva Negativa
Movilidad
Positiva Negativa
F. de Lactosa
Positiva Negativa
Sacarosa
Positiva Negativa
H2
Positiva Negativa
Degradación de Citrato
Positiva Negativa
H2S
Positiva Negativa
Indol
Positiva Negativa
Morfología
Bacilos Cocos

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 8/17
5. Esquema del Perfil bioquímico (metabólico ) para la identificación del microorganismo seleccionado
Continuación
Ácido mixto
Positiva Negativa
Catalasa
Positiva Negativa

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 9/17
RESULTADOS DEL AISLAMIENTO E IDENTIFICACIÓN
1. EVIDENCIA FOTOGRAFICA DEL CULTIVO DE LA MUESTRA (SIEMBRA EN AGAR MAC CONKEY)
2. MORFOLOGÍA COLONIAL OBSERVADA Tipo de colonia 1: Descripción
En esta imagen se observa una colonia circular, color rosado, elevación plana, borde entero, poco aislada de las demás bacterias, por ellos se tomó para resiembra.
Tipo de colonia 2: Descripción
Se observan dos UFC de color negro, puntiformes, circulares, de superficie convexa y borde entero.
Tipo de colonia 3: Descripción
Se observan colonias con borde lobulado color rosado, elevación convexa y forma granular.

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 10/17
3. EVIDENCIA FOTOGRAFICA DEL CULTIVO PURO ( RESIEMBRA) Foto 1 (Agar Mac Conkey)
FOTO 2 (Agar Mac Conkey)
4. MORFOLOGIA COLONIAL OBSERVADA
Descripción
Colonias pequeñas, color blanquecino, algunas de forma puntiforme, circulares, convexas, de borde redondeado. Crecimiento en poca cantidad.
FOTO 1 (Agar Mac Conkey)
FOTO 2 (Agar Mac Conkey)
FOTO 3 (Agar Mac Conkey)

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 11/17
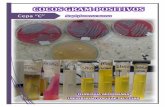
5. EVIDENCIA FOTOGRÁFICA DEL RESULTADO DEL PERFIL BIOQUÍMICO
Nombre de la prueba Medio de cultivo utilizado
Resultado obtenido (positivo/negativo) Evidencia fotográfica
1. Tinción de Gram
N/A Negativa
Fundamento de la prueba
El fundamento de la técnica se basa en las diferencias entre las paredes celulares de las bacterias Gram positivas y Gram negativas. La pared celular de las bacterias Gram positivas posee una gruesa capa de péptido glucano, además de dos clases de ácidos lipoteicoicos: Anclado en la cara interna de la pared celular y unido a la membrana plasmática, se encuentra el ácido lipoteicoico, y más en la superficie, el ácido lipoteicoico que está anclado solamente en el péptido glucano (también conocido como mureína). Por el contrario, la capa de péptido glucano de las Gram negativas es delgada, y se encuentra unida a una segunda membrana plasmática exterior (descomposición distinta a la interna) por medio de lipoproteínas. Tiene una capa delgada de péptido glicano unida a una membrana exterior por lipoproteínas. La membrana exterior está hecha de proteína, fosfolípido y polisacárido. Por lo tanto, ambos tipos de bacterias se tiñen diferencialmente debido a estas diferencias constitutivas de su pared. La clave es el péptido glucano, ya que es el material que confiere su rigidez a la pared celular bacteriana, y las Gram positivas lo poseen en mucha mayor proporción que las Gram negativas.
2. Tinción de
capsula
N/A Positivo
Fundamento de la prueba
También conocida como: tinciones negativas/tinta china No es una tinción como tal. Se llama así porque lo que realmente se tiñe es el fondo del portaobjetos en el que están los microorganismos, apareciendo estos después sin teñir. Para ver la cápsula a través del microscopio, se emplea tinta china (suspensión coloidal de carbono o nigrosina) ya que las partículas de carbono no penetran la célula bacteriana sino que tiñen su entorno y la bacteria puede ser observada como un cuerpo refractil sin teñir.

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 12/17
3. Prueba de
movilidad Agar SIM Positivo
Fundamento de la prueba
En esta prueba lo que se detecta son la presencia de cilios y flagelos y por eso se mueve, el medio semisólido lo permite. Cuando el medio se enturbie es porque se difunde la bacteria.
4. Fermentación
de glucosa (Prueba de Voges Proskauer)
Caldo MR-VP Negativo
Fundamento de la prueba
En el medio de cultivo, la pluripeptona aporta los nutrientes necesarios para el desarrollo bacteriano y la glucosa es el hidrato de carbono fermentable. La glucosa puede ser metabolizada por los microorganismos, a través de distintas vías metabólicas. Según la vía utilizada, se originarán productos finales ácidos (ácido láctico, ácido acético, ácido fórmico), o productos finales neutros (acetil metil carbinol). Esta diferencia en el metabolismo bacteriano, podría ser reconocida por la adición de un indicador como rojo de metilo, para revelar la presencia de productos ácidos, y por la adición de alfa naftol e hidróxido de potasio para evidenciar la presencia de productos finales neutros. Glucosa Fermentación Butilenglicolica Acetil-Metil-Carbonil (Acetoina) 2-3 Butanodiol, Etanol, H2 y CO2
5. Fermentación
sacarosa
Agar Triple Sugar Iron
Positivo

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 13/17
Fundamento de la prueba
La sacarosa añadida permite la exclusión de determinados organismos coliformes y algunas especies como Proteus, que pueden atacar la sacarosa , pero no la lactosa, en un período de incubación de 24 – 48 h. También, esta puede suprimir los mecanismos enzimáticos responsables de la producción del sulfuro de hidrógeno. Si la bacteria problema fermenta sacarosa, acidifica el medio en su superficie volviéndolo de color amarillo, mientras que si no lo es, la superficie del medio continuará de color rojo.
6. Fermentación de
Glucosa
Agar inclinado Triple Azúcar y Hierro T.S.I
Positivo
Fundamento de la prueba
Primero los microorganismos empiezan a fermentar la glucosa, produciendo ácidos y virando totalmente el medio a color amarillo. Como solamente utilizan la glucosa, no pueden usar la sacarosa ni la lactosa, cuando la glucosa que se halla en baja concentración se consume (antes de las 24hs) los microorganismos comienzan a utilizar la peptonas con producción de amoníaco que alcaliniza el medio dando un color rojo, pero solamente en el pico, quedando el fondo ácido de color amarillo
7.-Producción de CO2 Agar inclinado Triple Azúcar y Hierro T.S.I
Positiva
Fundamento de la prueba
Es una prueba usada para la fermentación de la glucosa, lactosa y sacarosa y la producción de H2S por parte de la bacteria sumándole también que puede producir gas (CO2).
La presencia de burbujas que rompen el medio al fermentar los hidratos de carbono presentes tienden a expulsarlo lo cual indica presencia de gas como producto final de la fermentación.
8. Degradación de
Citrato por la enzima citrato permeasa
Agar Citrato de Simmons
Negativa

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 14/17
Fundamento de la prueba
En el medio de cultivo, el fosfato mono-amónico es la única fuente de nitrógeno y el citrato de sodio es la única fuente de carbono. Ambos componentes son necesarios para el desarrollo bacteriano. Las sales de fosfato forman un sistema buffer, el magnesio es cofactor enzimático. El cloruro de sodio mantiene el balance osmótico, el azul de bromotimol es el indicador de pH, que vira al color azul en medio alcalino y el agar es el agente solidificante.
El medio de cultivo es diferencial en base a que los microorganismos capaces de utilizar citrato como única fuente de carbono usan sales de amonio como única fuente de nitrógeno, con la consiguiente producción de alcalinidad.
El metabolismo del citrato se realiza, en aquellas bacterias poseedoras de citrato permeasa, a través del ciclo del ácido tricarboxílico. El desdoblamiento del citrato genera progresivamente, oxalacetato y piruvato. Este último, en presencia de un medio alcalino, da origen a ácidos orgánicos que al ser utilizados como fuente de carbono, producen carbonatos y bicarbonatos alcalinos. El medio entonces vira al azul y esto es indicativo de la producción de citrato permeasa. Prueba de citrato Citrato Piruvato CO2 + Na + H2O Na2CO3 Azul de Bromotimol
9. Producción de
ácido sulfhídrico Medio SIM Negativo
Fundamento de la prueba
La actividad de las bacterias sobre aminoácidos que contienen azufre, frecuentemente producen la liberación de sulfhídrico, lo cual se demuestra empleando sales de metales pesados como el hierro. El sulfhídrico reacciona con tales metales dando una coloración oscura al medio de cultivo. Para detectar la capacidad de producir el H2S, el tiosulfato de sodio que contiene el medio, es el sustrato necesario para la producción de ácido sulfhídrico, el sulfato de hierro y amonio, es la fuente de iones Fe3+, los cuales se combinan con el ácido sulfhídrico y producen sulfuro de hierro El tiosulfato de sodio que se reduce a sulfuro de hidrógeno reacciona luego con una sal de hierro proporcionando el típico sulfuro de hierro de color negro. Dicha reacción es llevada a cabo por enzimas, como: cisteína, desulfhidrasa y latiosulfato reductasa que son las encargadas de liberar al azufre.
10. Prueba de
producción de Indol
Medio SIM Positivo

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 15/17
Fundamento de la prueba
El triptófano es un aminoácido constituyente de muchas peptonas, y particularmente de la tripteína, que puede ser oxidado por algunas bacterias para formar indol. En el proceso interviene un conjunto de enzimas llamadas triptofanasa. El indol producido se combina con el aldehído del reactivo de Kovac’s o de Erlich, para originar un compuesto de color rojo. Las cepas móviles pueden apreciarse en este medio, por la turbidez que producen alrededor de la punción de siembra, mientras que aquellas cepas productoras de sulfhídrico se distinguen por la formación de un precipitado negro de sulfuro de hierro a partir del tiosulfato siempre que el medio se mantenga a un pH mayor a 7.2. Prueba de Indol H2O + TRIPTOFANO Indol + Ac. Piruvico + NH3
11. Prueba Ácido mixto (rojo de
metilo) Caldo MR-VP Positivo
Fundamento de la prueba
En el medio de cultivo, la pluripeptona aporta los nutrientes necesarios para el desarrollo bacteriano y la glucosa es el hidrato de carbono fermentable. La glucosa puede ser metabolizada por los microorganismos, a través de distintas vías metabólicas. Según la vía utilizada, se originarán productos finales ácidos (ácido láctico, ácido acético, ácido fórmico), o productos finales neutros (acetil metil carbinol).
Esta diferencia en el metabolismo bacteriano, podría ser reconocida por la adición de un indicador como rojo de metilo, para revelar la presencia de productos ácidos, y por la adición de alfa naftol e hidróxido de potasio para evidenciar la presencia de productos finales neutros. Prueba de Rojo de Metilo Glucosa Fermentación Acida Mixta Ácidos láctico, Acético y Succinico + CO2, H2 y etanol Producción de Rojo de Metilo
12. Prueba de la
catalasa
N/A Positivo
Triptofanasa

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 16/17
Fundamento de la prueba
El peróxido de hidrógeno es el producto final del metabolismo oxidativo de carbohidratos, a esta vía metabólica recibe el nombre de metabolismo aerobio-oxidativo. La acumulación del peróxido es muy toxico por lo que la mayoría de las bacterias aerobias y anaerobias facultativas exceptuando a Streptococcus sp. Producen una enzima llamada catalasa que degrada el peróxido de hidrógeno obteniendo agua y oxigeno gas.
IDENTIFICACIÓN DEL MICROORGANISMO AMBIENTAL
EN LA MATRIZ DE ESTUDIO: Agua
1.- Nombre científico del o los microorganismo identificado de acuerdo a los resultados del perfil bioquímico planteado ( género y especie)
Escherichia coli
2. Taxonomía del o los microorganismo identificados
Dominio: Bacteria Filo: Proteobacteria
Clase: Gamma proteobacteria Orden: Enterobacteriales
Familia: Enterobacteriaceae Género: Escherichia
Especie: E. coli
3. Características generales
Se trata de una enterobacteria que se encuentra generalmente en los intestinos animales, y por ende en las aguas negras, pero se lo puede encontrar en todos lados, dado que es un organismo ubicuo. Es necesaria para el funcionamiento correcto del proceso digestivo, además de producir las vitaminas B y K. Es un bacilo que reacciona negativamente a la tinción de Gram (gramnegativo), es anaerobio facultativo, móvil por flagelos peritricos (que rodean su cuerpo), no forma esporas, es capaz de fermentar la glucosa y la lactosa y su prueba de IMVIC es ++--. Es una bacteria utilizada frecuentemente en experimentos de genética y biología molecular. La Escherichia coli, en su hábitat natural, vive en los intestinos de la mayor parte de los mamíferos sanos. Es el principal organismo anaerobio facultativo del sistema digestivo. En individuos sanos, es decir, si la bacteria no adquiere elementos genéticos que codifican factores virulentos, la bacteria actúa como un comensal formando parte de la flora intestinal y ayudando así a la absorción de nutrientes. En humanos, la Escherichia coli coloniza el tracto gastrointestinal de un neonato adhiriéndose a las mucosidades del intestino grueso en el plazo de 48 horas después de la primera comida. Tiene un ancho variable.
4. Ciclo(s) biogeoquímicos en el(los) que intervienen
Fosforo Azufre
Carbono Nitrógeno

M I C R O B I O L O G Í A A M B I E N T A L U T L A S E S O R A :
Página 17/17
5. La función que juegan en la transformación de la materia orgánica a través de los ciclos biogeoquímicos
La función que juegan en la transformación de la materia orgánica a través de los ciclos biogeoquímicos es que funge como bacteria fosfatizante pasando el fósforo inorgánico a fósforo orgánico a manera de biomoléculas, participa en la degradación de los compuestos orgánicos de los organismos que alguna vez estuvieron vivos, y utilizando esta degradación como fuente de energía ATP, fija el Nitrógeno en los mantos acuíferos y ayuda mediante su metabolismo a convertir los nitratos en nitritos. E.coli posee una gran capacidad para adaptarse al medio en el que vive regulando la expresión de sus genes y acoplándose a las condiciones del entorno. Solo sintetiza las proteínas que necesita y no aquellas que no van a ser utilizadas. Cuando E. coli crece en un medio que contiene glucosa como fuente de carbono y energía posee unos niveles muy bajos de las enzimas que intervienen en la utilización de otros azucares, por ejemplo lactosa. Si a E. coli se le hace crecer en un medio con lactosa como fuente de carbono y energía induce la síntesis coordinada de tres proteínas relacionadas con la utilización o el catabolismo de la lactosa, en especial la B-galactosidasa, que aumenta unas 1.000 veces por célula de cuando crece en glucosa. Liberan moléculas como bióxido de carbono y minerales que son reutilizados por los productores, degradan el aminoácido triptófano, utiliza el citrato de sodio como única fuente de carbono para su metabolismo y crecimiento, producen ácido y gas a partir de la glucosa, la arabinosa, y habitualmente de la lactosa y otros azúcares.
6. Conclusión parcial sobre las interacciones bacterianas en la matriz estudiada y la importancia de la microbiología en el área ambiental
El estudio de la microbiología aparte de ser una amplia gama de estudio es de suma importancia por estar presente en las matrices del área ambiental (agua, suelo y aire), y de las cuales podemos obtener y comprender el comportamiento e interacción de los microorganismos existentes, así como los daños y beneficios que pueden causar al ambiente, y a partir de ello se pueden elegir diferentes tipos de bacterias de acuerdo a su metabolismo para realizar remediaciones, degradaciones, fermentaciones entre otras con el fin de mejorar la calidad ambiental. Durante esta práctica se adquirieron conocimientos como: toma de la muestra, métodos de siembra, resiembra y técnicas de estriado, preparación de agares y montaje de las pruebas bioquímicas las cuales sirvieron para observar su comportamiento y parte de su metabolismo a partir de una serie de reacciones químicas como lo son: producción de gas, fermentación de lactosa, degradación de citrato, producción de ácido sulfhídrico (H2S) entre otras, tomando en cuenta los resultados obtenidos en las pruebas y con ayuda de un esquema bioquímico previamente hecho, se logra obtener su identificación. Al inicio de la marcha bioquímica se esperaba encontrar el perfil de la bacteria Pseudomona Aeruginosa, pero algunas pruebas mostraban resultados contrarios, por lo que se tuvo que buscar a la bacteria que correspondiera a los resultados de las pruebas, después de una serie de investigaciones la bacteria que se aisló y que coincidía con los resultados era la bacteria de Escherichia. Coli. Aislar un microorganismo en específico, puede resultar un tanto trabajoso pues se requiere prestar atención en conocer las características específicas del microorganismo que se está buscando, y de acuerdo con ello seleccionarlo adecuadamente en la placa de siembra para después poder resembrarlo en otra placa cuyo agar sea el adecuado para su crecimiento. Normalmente las bacterias se encuentran en comunidades, sin embargo lo más importante de aislar una bacteria es saber seleccionarla adecuadamente.