gastritis etc y cancer estomago.pdf
-
Upload
nena-guadalupe -
Category
Documents
-
view
1.106 -
download
20
description
Transcript of gastritis etc y cancer estomago.pdf
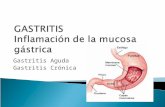
ANATOMÍA PATOLÓGICA
1
INTRODUCCION:
La gastritis es una enfermedad frecuente e importante que afecta una gran cantidad de la
población y puede clasificarse desde el punto de vista clínico, endoscópico e histológico.
La gastritis puede aparecer súbitamente (gastritis aguda), o puede irse desarrollando con
el tiempo (gastritis crónica). En la mayoría de los casos, la gastritis puede mejorar
rápidamente con el tratamiento adecuado, pero en ocasiones puede ser el origen de
úlceras gástricas e incluso de cáncer. Dos formas principales de gastritis se describen:
aguda, por lo general de corta duración con infiltración predominante de los neutrófilos, y
crónica, donde la inflamación consiste en principalmente de los linfocitos. Esta forma de
gastritis tiene su relevancia por la patogenicidad de H. pylori, ya que se ha comprobado la
existencia de H. pylori en el 90% de los pacientes. En el Occidente, la prevalencia de
cambios histológicos indicadores de gastritis crónica en las décadas tardías de la vida
supera el 50%.La prevalencia de infección por H. pylori varía de 19 a 57% en países
desarrollados y este porcentaje es mayor en los países en vías de desarrollo. El riesgo a
largo plazo de cáncer gástrico en los pacientes con gastritis autoinmune es de 2 al 4%
considerablemente mayor que el de la población normal
En México, la prevalencia de infección por H. pylori es de 66%. Varios autores han
reportado la presencia de H. pylori en la cavidad oral y han propuesto que ésta podría ser
la fuente de la infección y de la reinfección del estómago después de la terapia, así como
de la transmisión a otras personas. Por otra parte, para valorar la erradicación del germen,
se utilizan procedimientos de laboratorio como: pruebas rápidas de ureasa, serología y
pruebas de aliento marcadas con carbón 13. Esta última es la más utilizada con
sensibilidad y especificidad del 97 y 95%, respectivamente14.
El pronóstico de que se erradique la bacteria conjuntamente con la cicatrización de la
ulcera causada por las cepas de esta misma, es en el 70% tarada con un triple esquema
terapéutico14, siendo de relevancia que sea tratada con oportunamente, reduciendo así
notablemente el riesgo de un carcinoma gástrico.
ANATOMÍA PATOLÓGICA
2
RESUMEN
La gastritis es la inflamación del revestimiento mucoso del estómago. Según las
manifestaciones clínicas de la gastritis las dos formas principales que son entidades
clínicas muy diferentes, son: la gastritis aguda y la gastritis crónicaLa gastritis crónica es
una entidad histológica, caracterizada por inflamación de la mucosa gástrica y grados
variables de atrofia glandular. Según el grado de actividad de estos cambios estructurales,
se pueden distinguir dos patrones histológicos: la gastritis crónica activa y la gastritis
atrófica. Causadas por los hábitos alimenticios, por el estilo de vida y asociado a
enfermedades con tratamientos antiinflamatorios y antineoplásicos
La mucosa del estómago resiste la irritación y habitualmente puede soportar un alto
contenido ácido. Sin embargo, puede irritarse e inflamarse por diferentes motivos.La
inflamación del revestimiento estomacal súbita y severa se llama gastritis aguda.
La inflamación que dura desde hace mucho tiempo se llama gastritis crónica, puede ser
secundaria a irritantes como los fármacos especialmente la aspirina (AINE), a la
enfermedad de Crohn, a infecciones bacterianas, víricas (h. pylori), en personas que
abusan del alcohol, en fumadores.
Con este tipo de gastritis se pueden producir hemorragias. Sin embargo, la gastritis
crónica es un factor de riesgo para la enfermedad de úlcera péptica, pólipos gástricos, los
tumores benignos y malignos de gástricos. Los síntomas son: dolor o molestia en el
epigastrio, náuseas, vómito, anorexia
El tratamiento para la gastritis consiste en:
Histamina 2 (H2) bloqueadores, tales como famotidina (Pepcid AC) y ranitidina (Zantac
75), Bloqueadores H2 disminuyen la producción de ácido, como el omeprazol (Prilosec,
Zegerid), lansoprazol (Prevacid), pantoprazol (Protonix). Disminuir la producción de ácido
más eficazmente que los bloqueadores H2.
El diagnóstico por lo general se realiza por endoscopia, biopsia. En la mayoría de los
casos, un tratamiento efectivo puede evitar las complicaciones.
ANATOMÍA PATOLÓGICA
3
ANTECEDENTES
En 1822 Se empezó a estudiar La gastritis crónica, luego cayó en desuso
En 1868 con el advenimiento de la endoscopia Gastroscopio rígido de Kussmaul se concretó el
concepto gastritis, permitió conocer los diversos procesos inflamatorios del estómago consecutivos
a una causa definida y con la comprobación histopatológica de los fenómenos que suceden en los
diferentes tipos y grados de esta enfermedad
En 1920 Uno de los primeros en observar los cambios de la mucosa gástrica fue Beaumotn,
estudió en un soldado, Alexis St. Martin, que tenía una herida en el estómago, la presencia de
ácido clorhídrico en el jugo gástrico por exceso de alcohol
En 1930 Tuvo su auge de nuevo el estudio de la gastritis crónica con la introducción del
gastroscopio por Schindler. Este dividió en gastritis superficiales, atrófica, hipertrófica y
anastomótica, o sea, la que ocurría en el que se soinetía a una intervención quirúrgica (que fue
aceptada y que se tuvo como inconmovible hasta el año de 1949)
En 1947 Schindler publicó su trabajo, en el describía la gastritis hipertrófica en la cual había una
hipertrofia de todas las capas, es decir, de la mucosa, submucosa y hasta de la muscular,
viéndose a través del gastroscopio, los pliegues grandes y verrugosos.
En 1948 apareció el gastroscopio operatorio de Benedict, que fue ideado el 1948. Entonces se vió
lo siguiente: que la gastritis superficial existía como tal, es decir, que si se tomaban biopsias de la
mucosa gástrica, el estudio histológico correspondía a lo que los gastroscopistas describían:
persistía la mucosa atrófica o sea el borramiento de los pliegues, se veían los vasos a través de la
mucosa.
Pero, en cuanto a la gastritis hipertrófica, ésta no existía, porque los pliegues que se veían
aumentados de tamaño, de grosor, en número y formando verrugas, cuando se hacía el examen
ANATOMÍA PATOLÓGICA
4
histológico de la biopsia gástrica, se veía que no había tal inflamación
(Ustedes saben que para que haya inflamación tiene que haber infiltración plasmo-linfocitaria,
etc.). Así pues éste término de gastritis hipertrófica, a partir de esta época de 1949, se ha
desechado. Esta era la clasificación antigua, o sea la clasificación cuando no se hacía biopsia
gástrica por aspiración.
En 1949 cuando Wood en Australia, ideó el tubo de biopsia gástrica por aspiración, que fue
modificado después por Woo- lder y hoy se llama tubo de Wood-lder. 1982 Un concepto más real
de la enfermedad, se logró cuando se pudieron aplicar técnicas especiales de histoquímica,
estudios inmunológicos y de proliferación celular.
En 1982 H. pylori es de muy reciente conocimiento, se identificó por primera ocasión, a parir del
material gástrico e un paciente en gastritis
En 1983 Warren y Marsshall reportaron la presencia de bacterias espirales sobre la mucosa
gástrica de pacientes con gastritis crónica. A este microorganismo se le nombro inicialmente
Campylobacter pylori, posteriormente al encontrarse diferencias genotípicas y fenotípicas
importantes con otros tipos de capylobacter, se creó un nuevo género: Helicobacter. Warren y
colaboradores demostraron que Helicobacter pylori producía gastritis aguda.
Correa en 1988 (34) propuso una clasificación clínicopatológica de las gastritis crónicas definiendo
cinco grupos: 1. Gastritis Crónica Superficial (GCS); 2. Gastritis Difusa Antral (GDA), equivalente a
la Gastritis Crónica Hipersecretora de Lambert; 3. Gastritis Postgastrectomía o Gastritis por
Reflujo; 4. Gastritis Atrófica Corporal Difusa (GACD), concordante con la gastritis Tipo A o
autoinmune de Strickland yMackay; y 5. Gastritis Atrófica Alimentaria o Multifocal (GAM).
Como respuesta a la “clasificación de Sydney”, en 1994 se realizó en Houston (Texas) un
consenso mundial de expertos liderado por los Dr. Pelayo Correa y John H. Yardley cuyo objetivo
fue la propuesta de una clasificación de las gastritis crónicas que resultase más aceptable y
reproducible. Hasta la fecha se incluyen en este género son: Helicobater pylori, Helicobacter
cinaedi, Helicobacter fennelliae y Helicobacter mustelae.
ANATOMÍA PATOLÓGICA
5
DEFINICION
Inflamación de la mucosa gástrica, que puede ser predominantemente aguda, con
infiltración neutrofilica, o crónica, con predominio de linfocitos o células plasmáticas.
Imagen 03 de epitelio gástrico, donde se observa
lesión a la mucosa, por Hp y AINEs
Tomada de
http://www.revistaamiga.com/Mujer/10798111301
3.htm
Imagen 02 de anatomía del estomago
Tomada de
http://www.revistaamiga.com/Mujer/10798111301
3.htm
Imagen 04 de epitelio gástrico, donde se observa
lesión ulcerosa sangrante
Tomada de
http://www.revistaamiga.com/Mujer/10798111301
3.htm
ANATOMÍA PATOLÓGICA
6
ETIOLOGIA
Alimentaria y térmica
Alcohólica.
Infecciosa corrosiva.
Por radiación.
Por estrés.
Los salicilatos.
la fenilbutazona.
la indometicina.
En general los AINES.
La cafeína.
Antibióticos.
Sulfas.
Vitamina C a grandes dosis.
Pos quirúrgicos
Intento de suicidio con ácidos o álcalis.
Enfermedades granulomatosas (Crohn)
Alimentos condimentados
Imagen 05 que muestra la ingesta inadecuada de
AINE.
Tomada de:
http://www.infogastro.es/1033262/
Imagen 06 que la combinación perfecta para
desarrollar gastritis
Tomada de:
http://theprincenightmare.blogspot.com/
GASTRITIS
ANATOMÍA PATOLÓGICA
7
CLASIFICACION
Se han utilizado varias clasificaciones que en general se basan en:
Carácter agudo o crónico de las manifestaciones clínicas.
Las características histológicas de las lesiones.
La distribución anatómica de la gastritis.
La patogenia propuesta para cada una de las formas principales de la gastritis
crónica.
Los distintos tipos de gastritis tienen caracteres histológicos diferentes que permiten
clasificarlos de acuerdo con la existencia o ausencia de atrofia de la mucosa gástrica7.
Imagen 07 de clasificación d la gastritis según el agente causal,
alimenticios, bacterianos estrés.
Tomada de:
http://www.darmspiegelung-berlin.de/html/gastritis.html
ANATOMÍA PATOLÓGICA
8
Clasificación según Correa
Aguda
Estrés
Aines
Alimentos condimentados
Alcoholismo
Tabaquismo
Crónica
No especifica
No atróficas
Superficial: simple
Difusa antral:
Hipersecretora.
tipo B.
atróficas
corporal difusa
multifocal
Especifica
Gastritis linfocítica
Gastritis eosinofilica
Gastritis crónicas infecciosas
Enfermedad de menetrier
ANATOMÍA PATOLÓGICA
9
GASTRITIS AGUDA
DEFINICION
Es un proceso inflamatorio agudo de la mucosa, en general de naturaleza transitoria. La
inflamación se puede acompañar de hemorragia aguda a la mucosa y en los casos más
graves, desprendimiento de la mucosa superficial (erosión de la mucosa) y es una causa
importante de hemorragia intestinal aguda.
La más espectacular forma de gastritis aguda es la gastritis aguda hemorrágica o gastritis
aguda erosiva. La hemorragia procedente de la mucosa y la pérdida de integridad de la
mucosa (erosión) que acompaña a la lesión inflamatoria. El estudio microscópico
demuestra edema, friabilidad de la mucosa, erosiones y puntos sangrantes con
extravasación hemática en la mucosa y en la luz del estómago. Las erosiones y los
puntos sangrantes pueden distribuirse de una forma difusa por toda la mucosa o pueden
localizarse en el cuerpo o antro gástricos. A menudo están situados linealmente sobre las
crestas de los pliegues gástricos.
El estudio histológico de la mucosa gástrica revela la infiltración de la lámina propia por
células mononucleares y polimorfonucleares con extravasación de sangre en la mucosa,
que distorsiona la estructura de la glandular. En las glándulas pueden existir exudados
proteicos con leucocitos polimorfonucleares. Las erosiones gástricas se limitan por
definición, a la mucosa sin sobrepasar la muscularis mucosa. La gastritis aguda erosiva
puede ir acompañada de lesiones focales más profundas que representan ulceras agudas
y que pueden afectar a todas las capas de la pared gástrica.
Imagen 08 de gastritis aguda La inflamación puede implicar toda la
cámara gástrica (pangastritis) o una región del estómago por ejemplo el antro.
Tomada de:
http://www.gastrointestinalatlas.com/Espanol/Estomago/Gastritis/gastritis.html
ANATOMÍA PATOLÓGICA
10
ETIOPATOGENIA
La gastritis aguda erosiva suele asociarse con enfermedades graves o con la
administración de algunos fármacos. Se ha calculado que aparece hasta en un 80 a 90%
de los pacientes hospitalizados en estado crítico. Es más frecuente en enfermos médicos
o quirúrgicos ingresados en unidades de cuidados intensivos con traumas graves,
intervenciones quirúrgicas importantes, insuficiencia hepática, renal o respiratoria, shock,
quemaduras masivas o infecciones graves con septicemia. La gastritis que se asocia a
estas graves enfermedades recibe el nombre de gastritis por estrés.
Entre los factores más importantes: la isquemia de la mucosa, la existencia de ácido en la
luz gástrica son elementos claramente fundamentales en la etiopatogenia de la gastritis de
estrés. El pH de la mucosa desciende bruscamente cuando se introduce HCL en la luz del
estómago, lo que produce graves lesiones hemorrágicas. El descenso del pH intramural es
de la difusión de los iones de hidrogeno procedentes de la luz, lesionan la mucosa
gástrica. Si se hace una irrigación con un pH neutro, la caída del pH intramural es mucho
menos acusada y las lesiones gástricas son mínimas. Se ha demostrado que
contrarrestando los efectos del ácido mediante un tratamiento enérgico y manteniendo con
antiácidos o inhibiendo la secreción con antagonistas de los receptores H-2 se consigue
reducir las complicaciones hemorrágicas de las gastritis en los pacientes críticamente
enfermos.
Se conocen varios agentes que son capaces de lesionar la mucosa gástrica. Entre ellos se
encuentran los AINEs, los ácidos biliares, las enzimas proteolíticas y el etanol
AINE significa un fármaco antiinflamatorio no esteroide. Incluyen los medicamentos de
venta libre Naprosyn, Motrin, Advil e ibuprofeno, así como muchas medicinas de artritis de
la prescripción como Voltaren, Feldene, Lodine y Relafen. Junto con la aspirina, reducen
una sustancia protectora en el estómago llamado prostaglandina. Estos medicamentos
usualmente no causan ningún problema cuando se toman a corto plazo. Sin embargo, el
uso regular puede conducir a una gastritis, así como una enfermedad más grave de la
úlcera.
ANATOMÍA PATOLÓGICA
11
Estos agentes interrumpen la barrera mucosa gástrica (a pesar y en contra del enorme
gradiente de concentración de H+). La causa más frecuente e importante de la gastritis
aguda asociada por la ingestión de fármacos es la toma de aspirina u otros AINE. Ya que
como se indicó antes, inhiben la actividad ciclooxigenasa de la mucosa gástrica,
reduciendo con ello la síntesis y por lo tanto los niveles en los tejidos de las
prostaglandinas endógenas, que desempeñan un papel muy iportante en la defensa de la
mucosa. Esta reducción de las prostaglandinas es una de las causas de la lesión a la
mucosa gástrica.
La aspirina puede lesionar la mucosa de las paredes, inhibiendo la prostacilina o la
síntesis de tromboxano por las plaquetas. Otro mecanismo es a través de los efectos del
salicilato sódico, producto circulante del metabolismo de la aspirina.
El alcohol y ciertos otros productos químicos pueden causar inflamación y lesiones en el
estómago. Generalmente no se necesita una gran cantidad de alcohol para provocar la
gastritis, aunque el alcohol estimula el estómago para producir una mayor secreción de
ácido. La ingestión de ácidos o álcalis fuertes depende de la sustancia y del tiempo de
acción de las mismas, puede cursar desde gastritis superficial hasta lesiones profundas
con perforación posterior.
La lesión que causa el etanol se asocia sobre todo con hemorragias subepiteliales con
edema adyacente y solo un moderado de células inflamatorias en la mucosa. Pues el
alcohol con sus propiedades lipófilas y lipoliticas interrumpen la barrera mucosa gástrica o
una lesión directa a los pequeños vasos sanguíneos
Por irradiación y quimioterapia, la mucosa gástrica se encuentra frágil, edematosa y
ulcerada y pueden llegar a producir fenómenos hemorrágicos. Llega a haber anaclorhidria,
por el efecto sobre las células parietales.
Por estrés juega un papel muy importante la hipersecreción. Hay casos en los cuales
hay hipersecreción de ácido interviene al sistema nervioso central, el sistema nervioso
autónomo, las alteraciones circulatorias del estómago, metabólicas y del catabolismo
celular con inhibición en la producción de prostaglandinas, originándose un
desequilibrio en los factores de defensa.
ANATOMÍA PATOLÓGICA
12
FISIOPATOLOGIA
Causa una secreción aumentada de ácido con difusión retrograda, producción disminuida
de tapón bicarbonato, disminución del flujo sanguíneo, alteración de la capa de moco
adherente y daño directo al epitelio. De forma no sorprendente, las lesiones de la mucosa
pueden tener efectos sinérgicos. Así la lesión isquémica empeora los efectos de la difusión
retrograda de hidrogeniones. Se han identificado otras lesiones a la mucosa, como
regurgitación de ácidos biliares, detergentes y lisolectinas desde el duodeno proximal, y
síntesis de la mucosa inadecuada de prostaglandinas.
Los AINES destruyen la barrera mucosa, lo que origina penetración de hidrogeniones en el
tejido con salida de sodio y de potasio. La salida de hidrogeniones estimula los mastocitos
y las células enterocromafines dando lugar a la formación de histamina, esta y los
hidrogeniones lesionan los vasos sanguíneos originando hemorragias intersticiales. La
aspirina disminuye la agregación plaquetario lo que retarda la coagulación, actúan a través
de la circulación inhibiendo la producción de prostaglandinas, lo que trae como
consecuencia la disminución en la producción de moco, bicarbonato y de la renovación
celular.
Imagen 09 de gastritis aguda donde se
observa enrojecimiento y edema de los
pliegues gástricos
Tomada de:
http://www.gastrointestinalatlas.com/Espanol/
Estomago/Gastritis/gastritis.html
Imagen 10 de gastritis aguda de antro
donde se observan pequeñas maculas.
Tomada de:
http://www.gastrointestinalatlas.com/Espan
ol/Estomago/Gastritis/gastritis.html
ANATOMÍA PATOLÓGICA
13
CUADRO CLÍNICO
Cuando se trata de gastritis debidas a la ingestión de alcohol, aspirina (AINE), el dolor
puede presentarse poco después de la ingestión de los mismos.
El dolor es de intensidad: desde una sensación dolor manifestada a nivel de epigastrio
hasta un dolor intenso y persistente que generalmente aumenta con la ingestión de
alimentos irritantes, condimentados, cafeína, vitamina c a grandes dosis. Entre los
síntomas más frecuentes son: el dolor epigástrico, o abdominal alto, náuseas vómito,
generalmente hay anorexia.
La manifestación clínica principal es la hemorragia gastrointestinal aguda. Los pacientes
con gastritis, acompañada a infección aguda como: salmonella o intoxicación por
alimentos con estafilococo, pueden sufrir molestias epigástricas, anorexia, náuseas y
vomito. Estos síntomas tal vez se deban a la estimulación de los nervios viscerales
eferentes, que es independiente de las alteraciones de la mucosa gástrica.
Durante los episodios de gastritis aguda es posible observar hipoclorhidria o aclorhidria
por radiodifusión de H+ a través de la mucosa dañada, a la exploración la mucosa tiene
aspecto edematoso e hiperémico, con erosiones superficiales y hemorrágicas, es
importante diferenciar las lesiones de la gastritis aguda de las erosiones pequeñas que
pueden resultar de la aspiración de la mucosa hacia los orificios para toma de material, de
una sonda nasogástrica
Imagen 11 donde se muestra dolor causado
por gastritis
Tomada de:
http://www.medservice.com.co/pagina/index.
php?option=com_content&view=category&la
yout=blog&id=3&Itemid=161&limitstart=5
Imagen 12 donde se muestra los síntomas
de gastritis dolor y nauseas
Tomada de:
http://www.esmas.com/salud/enfermedades/infecciosas/435025.html
ANATOMÍA PATOLÓGICA
14
MÉTODO DE DIAGNÓSTICO
La mejor forma de establecer un diagnóstico es:
la endoscopia.
Los estudios de barrera de la mucosa gástrica H
Secreción.
Radiográficos.
Biopsia de la mucosa.
Imagen 13 de endoscopia gástrica inferior y superior
Tomada de:
http://www.obstetrix.com/blank.cfm?xyzpdqabc=0&id=1146&action=detail&A
EArticleID=100162&AEProductID=Adam2004_102&AEProjectTypeIDURL=
APT_7
Imagen 14 Se observa el endoscopio con sus lentes, canal de biopsia,
lente que conduce la luz y se observan los dos hilos que previamente se
observaban cuatro.
Tomada de:
http://www.google.com.mx/imgres?imgurl=http://metododelpinal.com/image
H7E.JPG&imgrefurl=http://metododelpinal.com/Adenocarcinoma.gastrico2.
html&usg=__q5YU5SnwdwxqkWSXypTanDAx8oE=&h=419&w=705&sz=3
3&hl=es&start=176&zoom=1&tbnid=0j3pe-
A4TuuUlM:&tbnh=106&tbnw=179&prev=/images%3Fq%3Dbiopsia%2Bde
%2Bestomago%26um%3D1%26hl%3Des%26biw%3D1041%26bih%3D43
ANATOMÍA PATOLÓGICA
15
Para el diagnóstico de H. pylori
Serología
Detección de antígeno en heces
Reacción en cadena de polimerasa
Test de bicarbonato con carbono 13 marcado
Pruebas invasivas
Test de ureasa en tejido gástrico biopsiado
Cultivo
Los estudios de secreción gástrica pueden proporcionar información cuantitativa que
refleje la cantidad de células parietales de la mucosa gástrica; con estimulación secretoria
máxima , la secreción de ácido es proporcional al volumen de células parietales gástricas,
se refleja por disminución en la cantidad de células parietales de la mucosa gástrica ;
normalmente, el epitelio de la superficie es relativamente impermeable de la a iones
hidrógeno, pero cuándo una lesión aguda de la mucosa rompe esta barrera a la difusión
del ión, habrá retrodifusión de ácido desde la luz gástrica y se observarán en un jugo
gástrico concentraciones más altas de iones de potasio y de líquido intersticial y de las
células de la mucosa, con cantidades variables de proteínas de plasma y hemátides.
Los estudios radiológicos proporcionan datos limitados en pacientes de gastritis.
En los enfermos de gastritis hipertrófica puede observarse engrosamiento de los pliegues
de la mucosa y una disminución relativa de los mismos quizá refleje atrofia de la mucosa,
pero estas alteraciones radiográficas deben interpretarse con precaución y confirmarse
con otros estudios.
ANATOMÍA PATOLÓGICA
16
TRATAMIENTO
NO FAMACOLOGICOS
Cambios dietéticos,
Abandonar el tabaquismo (en caso de ser fumador),
Evitar el consumo de alcohol,
No consumir medicamentos antiinflamatorios no esteroideos (AINE)
Evitar el estrés
Modificación del estilo de vida
FARMACOLOGICOS
Antiácidos antihistamínicos H2
Cimetidina 800mg 2 veces al día,
ranitidina 400mg 4 veces al día
nizatidina 150mg 2 veces al día
Inhibidores de la bomba de protones
Omeprazol 20 a 40mg/d durante 4 a 8 semanas
Esomeprazol 20 a 40 mg/día durante 4 a 8 semanas
Pantoprazol 40mg/día por 8 semanas
Misoprostol 100-200micro g v.o 4 veces al día (Si se muestra o sospecha lesión de
la mucosa)
Contraindicaciones: hipersensibilidad, conocida o sospechada. El misorpistol está
contraindicado en embarazo y lactancia.
Precauciones: si se prescribe bismuto, se debe advertir a l paciente acerca del color
negro de las heces. Los inhibidores de la bomba de protones deben tomarse solo
durante 8 a12 semanas debido a la falta de control a largo plazo.
Interacciones: algunos fármacos, como la cimetidina, presentan múltiples
interacciones; debe controlarse toda la medicación del paciente.
ANATOMÍA PATOLÓGICA
17
Fármacos alternativos: en pacientes con infección con H. pylori se recomienda una
combinación de bismuto con u antibiótico (metronidazol 250mg cada 6 horas,
tertaciclina 500mg cada 6h o amoxicilina 500mg cada 8horas), durante 2 semanas.
También puede ser útil un tratamiento de 4 semanas con claritromicina y omeprazol o
citrato bismutico de ranitidina.
MANEJO
Control del paciente: hábitos de vida saludables. Se recomienda repetir gastroscopia
a las 6 semanas, si existe una erosión gástrica e importante. En las medidas generales
incluyen dieta blanda, protectores de la mucosa gástrica y pueden usarse, estos
últimos en aquellas gastritis que cursen con hipersecreción de ácido clorhídrico
llegando a ser muy útiles.
Prevención/evitación: reducción de los factores de riesgo modificables.
Posibles complicaciones: dolor crónico, ulceras y perforación.
Resultado esperados: normalmente hubo alivio sintomático pero normalmente se
requiere tratamiento a largo plazo.
Consideraciones en el embarazo: sin efectos en el embrazo, aunque las gastritis
crónica puede afectar a la nutrición materna.
ANATOMÍA PATOLÓGICA
18
GRASTRITS CRÓNICA
La presencia de cambios inflamatorios mucosos crónicos, que pueden conllevar atrofia
mucosa y metaplasia intestinal, generalmente en usencia de erosiones. Los cambios
epiteliales se pueden convertir en displasicos y proporcionar la base para el desarrollo de
carcinoma.
Imagen 16 donde se observa cortes histológico de
gastritis crónica
Tomada de:
http://www.solunetti.fi/en/patologia/kroo
ninen_mahatulehdus_40x/
Imagen 15 donde se observa lesión en la mucosa de
gastritis crónica
Tomada de:
http://www.rdnattural.es/enfermedades/a
fecciones-diversas/gastritis/
ANATOMÍA PATOLÓGICA
19
La asociación etiológica más importante con diferencia de la gastritis crónica es la
infección por el bacilo H. pylori.
El infiltrado inflamatorio de la gastritis crónica consta de células inflamatorias crónicas
entra los que predominan: linfocitos y las células plasmáticas, puede también haber un
pequeño número de polimorfonucleares y eosinofilos
Principales asociaciones de la gastritis crónica son:
Infección crónica por H. pylori
Origen inmunológico (autoinmune) en asociación con anemia perniciosa.
Tóxicos como el del alcohol
El consumo de cigarros
Posquirúrgicas sobre todo después de enterectomia con gastroenterostomía y
reflujo de secreciones biliares duodenales.
Motora y mecánica, lo que incluye obstrucción, bezoares y atonía gástrica
Radiación
Procesos granulomatosos ej.: enfermedad de Crohn
Procesos diversos: amiloidosis, enfermedad de injerto contra el huésped, uremia.
Imagen 17 de Gastritis
crónica causada por H.
pylori
Tomada de
http://estomagomedicina
c.blogspot.com/2009/04/
danos-que-puede-sufrir-
el-estomago.html
ANATOMÍA PATOLÓGICA
20
Enfermedad de Menetrier
Se caracteriza por un aumento de tamaño de los pliegues de la mucosa, particularmente
en el área fúndica. Cuando este raro proceso es extenso se producirá una reducción del
número de células parietales y principales, que son remplazadas por glándulas mucosas la
secreción acida gástrica se encuentra reducida y las proteínas plasmáticas filtran a través
de la mucosa. Se manifiesta por anorexia, dolor epigástrico, pérdida de peso, edema en
extremidades inferiores (por hipoalbuminemia) y diarrea. La histología muestra hiperplasia
foveolar marcada o atrofiada de la porción galndular, cambios quísticos en las glandula
que llegan a extenderse hasta la mucosa. Estos pascientes pierden proteínas a travez de
de la mucosa gástrica y tienen alteraciones en la motilidad de este órgano. El diagnostico
se lleva a cabo mediante un estudio radiológico contrastado con varios del tracto
gastrointestinal superior que demuestra la presencia de pliegues mucosos de gran
tamaño.
Gastritis autoinmune
Esta forma de gastritis representa menos del 10% de los casos de gastritis crónica. Se
debe a la presencia de anticuerpos contra componentes de las células parietales
productora de ácido H, K – ATPasa²7, contra el receptor de la gastrina y contra el factor
intrínseco. La destrucción glandular y la atrofia mucosa conducen a la pérdida del producto
del factor intrínseco, lo que conduce a la anemia perniciosa. Esta forma infrecuente de
gastritis se encuentra en asociación con otros trastornos autoinmunes, como la tiroides de
Hashimoto, la enfermedad de adición y la Diabetes tipo 1. Los pacientes con gastritis
autoinmune experimentan un riesgo significativo de desarrollar carcinoma gástrico y
tumores endocrinos (tumor carcinoide).
Se caracteriza por la destrucción autoinmune de las células parietales productoras de
acido localizadas en el cuerpo gástrico proximal y fundus. A este proceso también se le
conoce como gastritis corporal difusa, gastritis cronica fundica, gastritis crónica tipo A. las
características endoscópicas incluyen borramiento de pliegues gástricos.
ANATOMÍA PATOLÓGICA
21
Al menos el 20% de los casos se observan pólipos hiperplasicos o inflamatorios,
presentan bajo nivel de sercrecion de pesinogeno, el 100% de los pascientes presentan
anticuerpos circulanes contra ATPasa H/K localizados localizados en la membrana
plasmática de la celula parietal. Un 15% tiene anticuerpos dirigidos contra el factor
intrinceco que interfiere con la absorción de B12, este es un síndrome denominado anemia
perniciosa y es de origen autoinmune, aparece en pocos pacientes con atrofia fundica. La
destrucción inmunológica de las glándulas productoras de acido conlleva a la aotrfia
progresiva de la mucosa oxintica que es sustituido por epitelio metaplasico. La metaplasia
intestinal de la gastritis autoinmune puede evolusionar a displasia y se estima ue el 10%
de los pascientes desarrolla adenocarcnoma gastrio. La hipergastrinemia secundaria a la
aclorhidria produce desarrollo posterior de adenocarinoma.
Imagen18 de corte histológico de gastritis autoinmune. Tomada del artículo n
o 11
ANATOMÍA PATOLÓGICA
22
FORMAS ESPECIALES DE GASTRITIS
GASTRITIS EOSINOFILA
Es un trastorno idiopático generalizado caracterizado por infiltrado eosinofilo predominante
de la mucosa, la pared de la mucosa o todas las capas del estómago, especialmente en la
región antral o pilórica. El trastorno afecta en los casos típicos de las mujeres de edad
media, y el síntoma primario es el dolor abdominal, aunque la inflamación del píloro puede
producir obstrucción de la desembocadura gástrica. Puede presentarse en asociación con
enteritis eosinofila y acompañada con frecuencia eosinofilia periférica. Suele ser efectivo el
tratamiento con esteroides.
GASTROPATIA ALERGICA
Es un trastorno pediátrico que puede producir síntomas de diarrea, vómito y fracaso del
crecimiento. En general, las biopsias de antro muestran un infiltrado de eosinofilos limitado
a la mucosa.
GASTRITIS LINFOCITICA
Es un proceso en el cual los linfocitos se acumulan en la capa epitelial de la superficie
mucosa y las fosas gástricas, y se extienden a la lámina propia. Los linfocitos
intraepiteliales son exclusivamente de tipo T, siendo la mayor parte CD8+. La gastritis se
limita en general al cuerpo del estómago. Este trastorno produce síntomas inespecíficos,
como dolor abdominal, anorexia, náuseas y vómitos. Aunque de naturaleza idiopática. Por
tanto, se considera probable una patogenia mediada por mecanismos inmunes.
Imagen 19 donde se muestra gastritis crónica profunda con infiltración linfocitica Tomada de:
http://sisbib.unmsm.edu.pe/
bvrevistas/gastro/vol_22n3/g
astritis_cr%C3%B3nicas.htm
ANATOMÍA PATOLÓGICA
23
GASTRITIS GRANULOMATOSA
La presencia de granulomas epiteloides intramucosos se puede atribuir en general a
enfermedad de Crohn, sarcodiosis, infección (tuberculosis, histoplasmosis, antisquiasis),
vasculitis sistémica o una reacción a materiales extraños. Gastritis granulomatosa es el
termino reservado para los pacientes con procesos coexistentes. Este trastorno idiopático
es clínicamente benigno. La anomalía patológica predominante es el estrechamiento y
rigidez del antro gástrico por inflación granulomatosa transmural.
ENFERMEDAD DE INGERTO CONTRA EL HUESPED
La gastritis asociada con el EICH se puede encontrar en el contexto de trasplante de
medula ósea. Desde el punto de vista histológico existe un infiltrado linfocitico relevante
leve en la lámina propia y apoptosis de las células glandulares, en particular de las células
mucosas del cuello.
El término gastropatía designa un grupo de trastornos que cursan a cambios histológicos
mucosos característicos que pueden incluir: hiperplasia foveolar con pérdida de mucina y
cambios regenerativos glandulares, edema de la mucosa, y fibras musculares lisas que se
extienden en la lámina propia entre las glándulas. La clave para la identificación para esta
entidad es a ausencia de inflamación activa (neutrófilos) del epitelio. La gastropatía
reactiva es bastante común.
Imagen 20 de gastritis granulomatosa Tomada de: http://www.flickr.com/photos/16961364@N00/260326601/
ANATOMÍA PATOLÓGICA
24
GASTRITIS ATROFICA
La gastritis atrófica es una enfermedad de especial importancia, donde, además de la
inflamación, un grado variable de atrofia, incluye la pérdida de tejido glandular y
remodelación de los elementos que forman el marco de la mucosa12.
En particular, la gastritis atrófica, (ABG), anteriormente conocido como de tipo A,
representa una gastritis crónica, sin síntomas de la mucosa fúndica, que a menudo tiene
una enfermedad patógena autoinmune, participa en carcinogénesis gástrica, y se
relaciona estrechamente a la aparición de microcítica anemia. Los resultados de el
examen de gastroscopia, con evaluación histológica del tejido de la biopsia, confirmó la
presencia de ABG en los 22 pacientes (19 mujeres y 3 hombres) con hipergastrinemia, y
su puntuación media de la lesión gástrica varió de leve a moderada. Los niveles medios de
la gastrina, pico estimulado la producción de ácido, y la producción basal de ácido así
como la calificación de la gastritis, de acuerdo con la puntuación de Sydney, el 25 de de
los pacientes con ABG. 7
Imagen 21 de corte histológico de gastritis atrófica. Tomada del artículo n
o 6
ANATOMÍA PATOLÓGICA
25
ETIOPATOGENIA
La gastritis crónica puede afectar a diferentes regiones del estómago y causar con grados
variables de daño mucoso difuso del cuerpo y del fondo, con daño antral menos intenso o
ausente, probablemente debido a autoanticuerpos contra las células parietales. La mucosa
suele aparecer enrojecida y con textura más grosero de lo normal. El infiltrado inflamatorio
puede crear una mucosa con pliegues engrosados, que imitan a las lesiones infiltrantes
iniciales. Alternativamente, en la enfermedad atrófica de larga evolución la mucosa puede
aparecer fina y aplanada. Existe un infiltrado inflamatorio de linfocitos y células
plasmáticas dentro de la lámina propia. La inflamación activa se caracteriza por la
presencia de neutrófilos dentro de la capa epitelial glandular y superficial, con frecuencia
se observan agregaciones linfoides, algunos con centros germinales dentro de la mucosa.
Imagen 22 de gastritis crónica donde se observa daño a todo el epitelio de la mucosa gástrica.
Tomada de: http://i-feb.com/gastritis/
ANATOMÍA PATOLÓGICA
26
La gastritis crónica se asocia con un riesgo cinco veces mayor de cáncer gástrico, y la
infección por Helicobacter pylori tiene un riesgo de 2,9 veces para cáncer gástrico. H.
pylori está estrechamente vinculada con el desarrollo de CAG.
La gastritis crónica es un potencial factor de riesgo vascular, estableciéndose los
siguientes pasos para entender dicha situación:
1) Gastritis crónica (por Helicobacter pylori o autoinmune).
2) déficit de vitamina B12.
3) hiperhomocisteinemia o hipertensión arterial.
4) daño vascular.
En este esquema la hipertensión arterial seguiría a la hiperhomocistinemia y,
paralelamente, ambas determinarían el daño vascular15.
En particular, la gastritis, (ABG), anteriormente conocido como de tipo A, representa una
gastritis crónica, sin síntomas de la mucosa fúndica, que a menudo tiene una enfermedad
patógena autoinmune, participa en carcinogénesis gástrica, y se relaciona estrechamente
a la aparición de microcítica anemia, y PA.8, 9, ABG, y su prevalencia puede ser
sustancialmente diferente de la que anteriormente se evaluó sólo por la evidencia indirecta
(Es decir, la presencia de estos anticuerpos [APCAb] y / o PA)7.
Se ha demostrado que la gastritis atrófica implica cualquier área de la glándula oxínticas,
dando lugar a hipergastrinemia y hipopepsinogenemia, difundiendose hacia la mucosa
antral (DAG) o la mucosa gástrica entera (gastritis atrófica multifocal MAG) limitando con
anticuerpos contra células oxinticas y/o factor intrínseco (gastritis atrófica metaplasica
AMAG). 12
ANATOMÍA PATOLÓGICA
27
La etiología guarda relación con la lesión química por inhibición de ciclooxigenasa
(aspirina y AINE) o reflujo biliar, y por traumatismo de la mucosa a causa de poroplasto del
antro gástrico induce a una lesión característica, conocida como ectasia vascular antral
gástrica. La endoscopia muestra tiras longitudinales de mucosa eritematosa edematosa
que alternan con la mucosa menos alterada (estomago de sandía. imagen 06). En el
estudio histológico la mucosa antral muestra una gastropatía reactiva y capilares dilatados
que contiene trombos de fibrina7.
Imagen 23 de estómago en sandia gastritis Crónica tomada de: http://lamedicinanaturaloalternativa.blogspot.c
om/2010/07/aparatologia-estetica-mujer-de-65-anos.html
Imagen 24 de estómago en sandia, gastritis Crónica tomada de:
http://www.gihealth.com/html/education/p
hoto/printable/printGastritis.html
ANATOMÍA PATOLÓGICA
28
Infección por Helicobacter pylori
Es una bacteria de muy reciente conocimiento, cosmopolita, sin diferencias en relación
con épocas del año. Así como el contagio en niños, las mayores tasa provienen en países
en desarrollo, más que en industrializados, la frecuencia aumenta con la edad sin
diferencia entre sexos, la adquisición es predominante en la juventud.
Imagen 108 de H. pylori Tomada de
Imagen 25 de gastritis crónica por infección de H. pylori
Crónica tomada de:
http://www.gihealth.com/html/education/p
hoto/printable/printGastritis.html
Imagen 26 corte histologico de gastritis Crónica tomada donde se muestra la colonización de las cepas H. pylori.
Tomada de:
http://www.gihealth.com/html/education/photo/printable/printGastritis.html
ANATOMÍA PATOLÓGICA
29
Este microorganismo tiene forma de bastón curvo, con cuatro flagelos unipolares que le
dan gran movilidad, es microaerofilio, catalasa y oxidasa positiva. Entre sus características
tiene pH gástrico y así sobrevivir en este medio. Esto es debido a la potente actividad
enzimática de la ureasa que contiene, la cual degrada la urea en amonio y bicarbonato, lo
que genera un microambiente alcalino en la capa mucosa. Otra capacidad permite
introducirse en la pared del tubo digestivo, por medio de `un movimiento espiral, para
después adherirse a la pared mediante sus adhesinas. Se sabe que una vez que la
bacteria se ha fijado en la pared del estómago o duodeno, se multiplica y el huésped
responde con un proceso inflamatorio, mediante células leucocitarias. Los mecanismos
patogénicos del Hp son múltiples y variables. La expresión de ellos como su intensidad,
dependen de la diversidad de cepas (cagA y vacA), de su interacción relativa en la
heterogeneidad poblacional del Hp en un solo huésped e incluso de la interacción con
mecanismos inmunológicos del propio huésped, que provocan gastritis en la mayoría y
sólo en pocos casos de úlcera péptica.14
Se incluyen en este género: Helicobater pylori, Helicobacter cinaedi, Helicobacter
fennelliae y Helicobacter mustelae.
Imagen 27 de H. pylori Tomada de http://vitae.ucv.ve/?module=articulo&rv=94&n=297&m=2&e=457
Imagen 28 de H. pylori invadiendo la mucosas gástrica
Tomada de http://s99.middlebury.edu/BI330A/STUDENTS/KASSIS/kassis/helicobacter_pylori.htm
ANATOMÍA PATOLÓGICA
30
FISIOPATOLOGIA
Existen cambios histológicos característicos:
Cambio regenerativo: La respuesta proliferativa a la lesión epitelial es un dato constante
en la gastritis crónica, las figuras mitóticas están aumentadas en la región del cuello de las
glándulas gástricas. Las células epiteliales de la superficie, mucosa y en menor extensión
de las glándulas, muestran núcleos agrandados hipercromaticos y una elevada relación
núcleo-citoplasma. Las vacuolas de moco están disminuidas o faltan en las células
superficiales. Cuando los cambios regenerativos son intensos, especialmente en caso de
inflamación activa y continuada, puede ser difícil diferenciar entre cambios regenerativo y
displasia. La infamación activa se caracteriza por la presencia de neutrófilos dentro de la
capa epitelial glandular y superficial. La inflamación activa puede ser prominente o faltar.
Con frecuencia se observan agregados linfoides, algunos con centros germinales, dentro
de la mucosa. Existen otros cambios histológicos característicos o adicionales.
Metaplasia: la mucosa del antro, del cuerpo y del fondo puede estar parcialmente
sustituida por células columnares con capacidad de absorción y células caliciformes de
morfología intestinal, a lo largo del epitelio superficial y en las glándulas rudimentarias. En
ocasiones pueden aparecer proyecciones similares a vellosidades. Aunque predominan
las características del intestino delgas y a veces existen características del epitelio del
colon.
Atrofia: el cambio de atrofia se manifiesta por una marcada perdida de estructuras
glandulares, es muy común que la cause H. pylori. En particular las células parietales
pueden faltar de forma autoinmune. Es frecuente que las glándulas que persisten
experimenten dilatación quística. Una característica particular es la hiperplasia de células
G responsable de la gastrinemia aumentada, que estimula la hiperplasia de las células de
tipo cromafin en el cuerpo gástrico.
Displasia: en la gastritis crónica de larga evolución, el epitelio desarrolla alteraciones
citológicas, variación del tamaño, la forma y la orientación de las células epiteliales,
agrandamiento nuclear y atipia. Se puede convertir en tan intensas como para constituir un
carcinoma insitu.
ANATOMÍA PATOLÓGICA
31
Patogénesis de Helicobacter pylori
El contagio se da de persona a persona, aunque no se ha demostrado categóricamente.
Helicobacter pylori se localiza en el epitelio del estómago. Secreta ureasa, que produce
amonio y bicarbonato, con lo que neutraliza el pH acido. Además, secreta peptidasa,
lipasa, fosforilasa A, lo que le permite penetrar en la capa protectora, y tiene otros factores
de virulencia como una proteasa, el factor estimulador de gastrina y citotoxinas que
vacuolizan las células del epitelio. (imagen110)
La infección con Helicobacter pylori induce a una respuesta inflamatoria, con la presencia
de neutrófilos y células mononucleares. Esta bacteria se une a la superficie gástrica de la
mucosa con formación de un pedestal, similar a lo observado con Escherichia coli, en las
células intestinales hoy se considera Helicobacter pylori como agente causal de la
enfermedad de ácido péptica. Esto se debe a que han realizado muchos estudios a nivel
experimental que han demostrado la erradicación de la bacteria desaparece el problema.
Una vez que la bacteria llega al estómago se va hacia la pared, genera una gran cantidad
de ureasa, con lo que se produce un ambiente de amoniaco que logra que la bacteria se
proteja ante la acidez gástrica. Después, la bacteria atraviesa la mucosa gástrica a la
porción de musinasa y a continuación se adhiere a la pared del estómago donde se
multiplica. El huésped responde y se genera un proceso inflamatorio, con infiltrados
celulares a nivel de la lámina propia, con predominio de leucocitos mononucleares. La
infección inicial con Helicobacter pylori puede ser asintomática o producir un episodio de
gastritis aguda auto limitada. Permanece colonizando la mucosa antral del estómago por
muchos años, desarrollándose gastritis crónica. Una parte de ellos se desarrolla ulcera
gástrica y, por último, en algunos caso ocurre atrofia y cáncer gástrico. Los factores
determinan la evolución de la infección por Helicobacter pylori a uno y otro cuadro podría
depender de la dieta, el abuso de drogas, alcoholismo, tabaco y/o la predisposición
genética.
Helicobacter pylori es un patógeno que causa gastritis crónica y úlcera péptica y es
considerado un factor de riesgo temprano para el desarrollo de adenocarcinoma gástrico.
Se ha estimado que 50% de la población mundial se encuentra infectada por H. pylori. La
prevalencia de infección varía de 19 a 57% en países desarrollados y este porcentaje es
mayor en los países en vías de desarrollo. En México, la prevalencia de infección por H.
ANATOMÍA PATOLÓGICA
32
pylori es de 66%. Varios autores han reportado la presencia de H. pylori en la cavidad oral
y han propuesto que ésta podría ser la fuente de la infección y de la reinfección del
estómago después de la terapia, así como de la transmisión a otras personas. Se han
descrito diferentes factores de virulencia de H. pylori, entre los cuales los alelos del gen
vacA (vacuolization) associated gen) y el gen cagA (Cytotoxin associated gene) juegan un
papel importante en la infección.
Gen vacA y gen cagA de H. pylori
El gen vacA está presente en todas las cepas de H. pylori y varía en dos regiones, la
región s (la secuencia de la señal) que existe como los tipos alélicos s1 o s2 y la región m
(región media) presente como los tipos alélicos m1 om2. Las cepas de H. pylori que
presentan las variantes alélicas s1/m1 producen altos niveles de la citotoxina.
Aproximadamente 50 a 70% de las cepas de H. pylori posee el gen cagA, el cual es un
marcador de una isla de patogenicidad (cag PAI) constituida por 31 genes.
Las cepas de H. pylori que presentan el gen cagA han sido asociadas con ulceración
péptica y con cáncer gástrico.
Si consideramos la importante carga genética bacteriana detectada (vacA y cagA). De tal
manera que el gen vacA que codifica la citotoxina vacuolizante vacA, causa degeneración
vacuolar de las células gástricas epiteliales y ulceración de la mucosa gástrica y el gen
cagA presente en las cepas de H. pylori han sido asociadas con la ulceración duodenal,
gastritis atrófica, adenocarcinoma y recientemente se ha demostrado que producen una
profunda inflamación con una densidad bacteriana en el antro gástrico de alrededor de
cinco veces más que la inducida por cepas que no presentan el gen cagA.14
Algunas cepas de H. pylori CagA, tienen factor de virulencia que juega un papel
importante al inducir la liberación de varias citocinas , a la vez que conduce a la
proliferación de las células B y el desarrollo de agregados linfoides y los folículos. La
infección por H. pylori también provoca la interacción con una adhesión (addressin) a
células de la mucosa a una molécula (MAdCAM-1), un sistema de mediación homing o
reclutamiento de linfocitos. Helicobacter pylori es adquirida en su mayor parte en la
infancia, y el GN con frecuencia ha sido encontrado en los niños sometidos a endoscopia8.
ANATOMÍA PATOLÓGICA
33
En la actualidad Hp es reconocido como el causante más frecuente de gastritis crónica y
úlcera gastroduodenal, así como precursor del adenocarcinoma gástrico distal y linfoma
gástrico. Se sabe que Hp produce una reacción inflamatoria crónica con infiltración de
linfocitos, macrófagos y plasmocitos, lo que condicionad eficiencia de las células parietales
para producir ácido clorhídrico. Las partes más afectadas son la porción distal del
estómago y el bulbo duodenal. Los mecanismos patogénicos del Hp son múltiples y
variables. La expresión de ellos como su intensidad, dependen de la diversidad de cepas,
de su interacción relativa en la heterogeneidad poblacional del Hp en un solo huésped e
incluso de la interacción con mecanismos inmunológicos del propio huésped, que
provocan gastritis en la mayoría y sólo en pocos casos de úlcera péptica.
La gastritis crónica es una entidad histológica, caracterizada por inflamación de la mucosa
gástrica y grados variables de atrofia glandular. Según el grado de actividad de estos
cambios estructurales, se pueden distinguir dos patrones histológicos: la gastritis crónica
activa y la gastritis atrófica.
En el examen histológico, la gastritis por Hp se caracteriza inicialmente por gastritis
crónica activa superficial; posteriormente la inflamación mononuclear se extiende a todo el
grosor de la mucosa y puede originar el daño glandular, que conducirá a lo largo de
décadas a la atrofia y metaplasia intestinal.
Por otra parte, para valorar la erradicación del germen, se utilizan procedimientos de
laboratorio como: pruebas rápidas de ureasa, serología y pruebas de aliento marcadas
con carbón 13. Esta última es la más utilizada con sensibilidad y especificidad del 97 y
95%, respectivamente.14
Imagen 30 de H. pylori donde se observa como invade la mucosa gástrica y provocando una ulcera Tomada de: http://vitae.ucv.ve/?module=articulo&rv=94&n=297&m=2&e=457
Imagen 29 gen cAga y vacA de H. pylori Tomada de: http://idibam.blogspot.com/2008_01_01_archive.html
ANATOMÍA PATOLÓGICA
34
CUADRO CLINICO
La gastritis crónica puede causar poco síntomas. Son posibles las náuseas, los vómitos y
la sensación de molestia en el abdomen superior. Los individuos con gastritis avanzada
por H. pylori y otras causas medioambientales presentación con frecuencia hipoclorhidria,
a causa del daño de las células parietales y la atrofia de la mucosa del cuerpo y el fondo
gástricos.
Por H. pylori presenta con dolor abdominal, predominante de localización epigástrica,
cuadro clínico recurrente, distención abdominal, molestias variables según el tipo de
alimentos y bebidas que se ingieran y, en los casos muy severos, disminución de la
consistencia de heces.
Sin embargo, puesto que las células parietales nunca experimentan destrucción completa,
estos pacientes no desarrollan aclorhidria ni anemia perniciosa. Los niveles séricos de
gastrina suelen estar dentro de los límites normales o solos estar algo elevado. Cuando se
produce una perdida intensa de células parietales en el contexto de gastritis autoinmune,
característicamente existen hipoclorhidria o aclorhidria e hipergastrinemia.
Se pueden detectar autoanticuerpos circulantes frente a una gama diversa de antígenos
de células parietales. Un pequeño subconjunto de esos pacientes pueden (10%)
desarrollar anemia perniciosa franca después de un periodo de años. Está bien
demostrada la afectación familiar por la anemia perniciosa; también se encuentra una
prevalencia alta de anticuerpos gástricos en familiares asintomáticos de pacientes con
anemia perniciosa. La distribución sugiere que la herencia de la gastritis autoinmune es la
autosómica dominante. La mayor importancia tiene la relación entre la gastritis crónica y el
desarrollo de la ulcera péptica y de carcinoma de estómago. La mayoría de los pacientes
presenta una ulcera péptica y carcinoma de estómago. El riesgo a largo plazo de cáncer
gástrico en los pacientes con gastritis autoinmune es de 2 al 4% considerablemente mayor
que el de la población normal.
ANATOMÍA PATOLÓGICA
35
Imagen 32 de biopsia de la mucosa gástrica Tomada de: http://www.portalesmedicos.com/publicaciones/articles/1855/4/Proctocolitis-Cronica-por-Radiacion.-Presentacion-de-un-Caso-Clinico-%96-Endoscopico
Imagen 31 deestudio endoscópico del estomago Tomada de: http://www.hospitalsiriolibanes.org.br/espanol/medicos_profisionales_salud/centro_diagnostico/endoscopia.asp
Imagen 33 de endoscopia Tomada de
http://healthcaretipsguide.blogspot.com/2009/07/health-care-tips-facts-gastritis.html
METODO DE DIAGNOSTICO
El conocimiento actual de la gastritis de basa principalmente en estudios de la estructura y
función de la mucosa gástrica. Aunque muchos síntomas gastrointestinales se han
atribuido a gastritis, hoy en día es obvio que las lesiones difusas de la mucosa gástrica no
suelen originar síntomas; en consecuencia, los clínicos debe basarse en estudios de:
Los estudios de barrera de la mucosa gástrica H
Secreción.
Radiográficos.
Endoscópicos.
Biopsia de la mucosa.
ANATOMÍA PATOLÓGICA
36
Para definir las lesiones de la misma.
Los estudios de secreción gástrica pueden proporcionar información cuantitativa que
refleje la cantidad de células parietales de la mucosa gástrica; con estimulación secretoria
máxima , la secreción de ácido es proporcional al volumen de células parietales gástricas,
se refleja por disminución en la cantidad de células parietales de la mucosa gástrica ;
normalmente, el epitelio de la superficie es relativamente impermeable de la a iones
hidrógeno, pero cuándo una lesión aguda de la mucosa rompe esta barrera a la difusión
del ión, habrá retrodifusión de ácido desde la luz gástrica y se observarán en un jugo
gástrico concentraciones más altas de iones de potasio y de líquido intersticial y de las
células de la mucosa, con cantidades variables de proteínas de plasma y hemátides.
Los estudios radiológicos proporcionan datos limitados en pacientes de gastritis.
En los enfermos de gastritis hipertrófica puede observarse engrosamiento de los pliegues
de la mucosa y una disminución relativa de los mismos quizá refleje atrofia de la mucosa,
pero estas alteraciones radiográficas deben interpretarse con precaución y confirmarse
con otros estudios.
Imagen 34 de estudio radiológico Tomada de: http://www.clinicachicamocha.com/imaginologia.htm
ANATOMÍA PATOLÓGICA
37
El diagnóstico de la infección por H. pylori
Para el diagnóstico de H. pylori
Serología
Detección de antígeno en heces
Reacción en cadena de polimerasa
Test de bicarbonato con carbono 13 marcado
De laboratorio
Cultivo
Pruebas invasivas
Test de ureasa en tejido gástrico biopsiado
Imagen 37 de cultivo H. pylori Tomada de
http://www.med.nyu.edu/medicine/labs/blaserlab/v1-sld_H-pylori.html
Imagen 38 test de ureasa Tomada de http://lima.olx.com.pe/analizador-del-test-del-aliento-helicobacter-pilori-6-900-dolares-iid-43195997
Imagen 36 Reacción en Cadena de Polimerasa http://www.dnsffaa.gub.uy/GCU/biologia%20molecular.htm
Imagen 35 Reacción en Cadena de Polimerasa Tomada de http://www.biotech.bioetica.org/docta62.htm
ANATOMÍA PATOLÓGICA
38
Una infección por H. pylori se diagnostica sobre la base de un test de ureasa
positivo, el hallazgo de un organismo de la biopsia muestras por tinción de Giemsa,
o ambos.
Dos pruebas fueron equívocos, una prueba de aliento C13-ureasa fue utilizado.
La erradicación de la infección por H. pylori se definió como la ausencia de
microorganismos en cortes de tejido y un negativo CLO prueba de 2 meses
después de la interrupción del tratamiento8.
Imagen 39 de prueba de C13
Tomada de http://blogs.lainformacion.com/futuretech/2010/06/11/latro-la-lampara-de-algas-que-funciona-con-aliento-humano/
ANATOMÍA PATOLÓGICA
39
TRATAMIENTO
El Consejo Español para la Erradicación de H.pylori, apoyando en diversos estudios
aleatorizados, recomienda el uso de un inhibidor de bomba:
Omeprazol.
lanzoprazol o pantoprazol.
más dos antibióticos, de preferencia:
claritromicina más amoxicilina.
Con este esquema las tasas de erradicación oscilan entre 80% con tratamiento de siete
días y en 96% con 14 días.
Otro esquema recomendado quizá como de segunda línea es:
Ranitidina, citrato de bismuto, más dos antibióticos.
Imagen 40 de omeprazol, lanzoprazol, esomeprazol pantoprzol http://zonasenior.blogspot.com/2010/09/los-antiacidosl-y-sus-efectos-en-la.html
Imagen 41 de amoxicilina http://www.dipromed.com.mx/
catalogo/index.php?page=sho
p.product_details&flypage=fly
page.tpl&product_id=81&cate
gory_id=45&option=com_virtu
emart&Itemid=71
ANATOMÍA PATOLÓGICA
40
Existen otros estudios en relación con el tratamiento, en que se han empleado una
cuádruple terapia con IBP, sales de bismuto, tetraciclina y metronidazol durante siete días,
la cual se utiliza cuando existen fracasos con el esquema de primera línea: IBP,
amoxicilina y claritromicina.
Las dosis del anterior esquema son:
Omeprazol 20 mg.
Lanzoprazol 30 mg o pantoprazol 40 mg cada 12 hrs.
Subnitrato de bismuto 120 mg cada 6 hrs.
Tetraciclina500 mg cada 6 hrs.
Metronidazol 500 mg cada 8 hrs.
Tanto los esquemas triples como los cuádruples han obtenido tasas de erradicación de
más de 95%, por lo que son las terapias más socorridas14
Imagen 42 de avapena Tomada de
http://www.google.com.mx/imgres?imgurl=http://www.medi-express.com.mx/catalog/images/ANT0010.jpg&imgrefurl=http://www.medi-express.com.mx/catalog/index.php&usg=__PuRDD2mGzD7YypC_8zghq9ckgAU=&h=222&w=509&sz=18&hl=es&start=0&zoom=1&tbnid=bwY_VZjr-XkwwM:&tbnh=87&tbnw=200&prev=/images%3Fq%3Davapena%26um%3D1%26hl%3Des%26biw%3D1174%26bih%3D456%26tbs%3Disch:1&um=1&itbs=1&iact=hc&vpx=277&vpy=109&dur=717&hovh=148&hovw=340&tx=165&ty=92&ei=Z93uTIGTBpS6sAPPzZCYDA
Imagen 43 de metronidazol Tomada de
http://www.google.com.mx/imgres?imgurl=http://pp.centramerica.com/pp/imgs/prodsmall/1432.jpg&imgrefurl=http://www.gb-pharma.com/categoria_menu.asp%3Fid%3D494%26clc%3D108&usg=__Uf_DvHbuOL8aicf4b3dQBVkTvzE=&h=336&w=448&sz=14&hl=es&start=35&zoom=1&tbnid=sWOx1anfxeNtiM:&tbnh=139&tbnw=177&prev=/images%3Fq%3Dmetronidazol%26um%3D1%26hl%3Des%26biw%3D11
Imagen 44 de metronidazol Tomada de
http://www.lookfordiagnosis.com/mesh_info.php?term=Omeprazol&lang=2XkwwM:&tbnh=87&tbnw=200&prev=/images%3Fq%3Davapena%26um%3D1%26hl%3Des%26biw%3D1
ANATOMÍA PATOLÓGICA
41
PRONOSTICO
Los cuadros muy agudos pueden producir dolores severos que pueden confundirse con
una úlcera gástrica y que el médico analizará cuidadosamente, realizando pruebas
diagnósticas si es preciso. Junto con una mejora en la gastritis y la gastritis con actividad
folicular. Las gastritis crónicas de origen inmunológico precisan vigilancia por el riesgo de
degeneración tumoral.
En la gastritis asociada a Helicobacter Pylori el riesgo de degeneración es menor. Los
síntomas por infección de H. pylori mejora con el tratamiento. El seguimiento es muy
importante, porque el H. pylori bacterias puede aumentar el riesgo de cáncer de estómago.
La erradicación de H. pylori se asocia con una disminución en el número de linfoides
folículos, probablemente, con resolución o mejora de la GN y una disminución en la
prevalencia de folículos linfoides en un número considerable de los pacientes, apoyando el
concepto de que el fenotipo nodular de la gastritis por H. pylori es aquella en la que los
folículos linfoides son particularmente prominentes8.
La mayoría de casos mejoran rápidamente una vez ha iniciado el tratamiento.
ANATOMÍA PATOLÓGICA
42
CONCLUSIÓN
Podemos concluir que la gastritis es una irritación de la mucosa del estómago por exceso
de secreción ácida , por consumir alimentos irritantes o condimentados, alcohol, tabaco,
haber ingerido medicamentos antiinflamatorios, en un gran porcentaje de los casos existe
una infección por bacterias, siendo hoy en día es una de las enfermedades más comunes,
puesto que la mayoría de las personas al menor síntoma se automedica o pasa
desapercibida la enfermedad, la cual evoluciona rápidamente a un estado crónico.
Por esta razón el 70 % de la población Mexicana padece esta enfermedad, esto se
puede deber también a que estamos continuamente bajo estrés, y esto es una de los
grandes causantes de la gastritis de igual forma que la mala alimentación, es por esto que
debemos tomar conciencia y tratar de alimentarnos debida y sanamente. En el 80%de los
pacientes que presenta gastritis progresa con la edad y consecuente mente se vuelve un
problema que puede desencadenar en ulceraciones graves con metaplasia gástrica y
hasta el 30% de los casos desarrollar carcinoma gástrico, ya que los síntomas de la
enfermedad muchas veces aunque pueden ser molestos no se atienden.
La presencia de gastritis en el 90% de los casos es causada por la infección por H. pylori,
bacteria que puede desencadenar una infección crónica y degenerativa de la mucosa,
provocando ulceraciones en el epitelio estomacal por su alta patogenicidad de las cepas y
su peculiar forma de penetrar la mucosa gástrica con movimientos espirales y se cubre
con una capa de ureasa que la hace resistente a los medicamentos, comenzando a
erosionar , por esta razón es importante que se diagnostique cual es la causa de la
gastritis, con los métodos diagnostico como biopsia de la mucosa gástrica, test de Ureasa
o la prueba del carbono 13, los que detectan si existe presencia de H. pylori o si la causa
de la gastritis es por causas de alimentación, estilo de vida, de esta manera se le podrá
administrar al paciente el medicamento adecuado para la erradicación de H. pylori y así
mismo se pueda regenerar la mucosa gástrica, o el tratamiento con antiácidos y dieta
adecuada en caso de que no se presente H.pylori, normalmente la gastritis se puede tratar
y curar siguiendo las indicaciones adecuadas del tratamiento, aunque las recaída pueden
ser muy comunes si se descuida la dieta y se recae en malos hábitos alimenticios o vicios
ya mencionados en la etiología.
ANATOMÍA PATOLÓGICA
43
BIBLIOGRAFIA
Artículos
1.- Massimo Rugge Md, Robert M. Genta MD Sataging and garding of chronic gastritis.
Human Patology (2005)September-november 36, 228-233
2.- Piazuel, M.B, Camargo M. C., M. Mera, G. Delgado A, M. Peek, Jr, Correa, H., G.
Schneider., A. Sicinschi. Eosinophilis and mast cell in chronic gastritis: posible implications
in carcinogenesis. Human pathology (2008) Elservier 28 junary 2008, 39, 1360-1369
3.-Harris P. Wrigth. W, Serrano. C, Riera. F, Duarte. I, Torres. J, Peña. A, Rollan. A,
Viviani. P, Guiraldes. E, Schmitz. J. et al. Helicobacter pylori gastritis in children ir
Associated with a regulatory T-Cell response. Gastroenterology. 2008;134(2): 491-492.
4.- Yeh Lee Y. · Raj M. Hassan S. Abdul Aziz S. Hayati Othman N · Singh Mutum S.
Ventakesh R. N. Chronic atrophic antral gastritis and risk of metaplasia and dysplasia in an
area with low prevalence of Helicobacter pylori. Indian J Gastroenterol 2009(March–
April):28(2):49–52
5.- Goldstein Neal S., MD. Chronic Inactive Gastritis and Coccoid Helicobacter pyloriin
Patients Treated for Gastroesophageal Reflux Diseaseor With H pylori Eradication
Therapy. Anatomic Pathology American Society for Clinical Pathology Am J Clin Pathol
2002; 118:719-726
6.- C. Jhala N. , MD; Montemor M., MD; Jhala D., MD; Lu Lin, MD; Talley L., PhD; M.
Haber M., MD; Lechago J., MD, PhD. Pancreatic Acinar Cell Metaplasia in Autoimmune
Gastritis. Arch Pathol Lab Med. Vol 127, July 2003: 554-557
7.- C. Marco, MD; M. I. Massimo., MD; Lucilla G., MD; Vito D. Corleto, MD; Alessandro C.,
MD; Gianfranco D. Fave, MD; Andreoli M., MD; Bruno A., MD. Atrophic Body Gastritis in
Patients With Autoimmune Thyroid Disease. An Underdiagnosed AssociationArch Intern
Med. 1999;159:1726-1730
ANATOMÍA PATOLÓGICA
44
8.- Chen Ming-Jen, Shih Shou-Chuan, Wang Tsang-En, Chan Yu-Jan, Chen Chih-Jen.
Chang Wen-Hsiung. Endoscopic Patterns and Histopathological Features after Eradication
Therapy in Helicobacter pylori-Associated Nodular Gastritis. Springer Science+Business
Media, LLC 2007. Received: 11 May 2007 / Accepted: 27 October 2007 / Published online:
13 December 2007Dig Dis Sci (2008) 53:1893–1897 DOI 10.1007/s10620-007-0097-6
9.- Tomaszewska A., Muszynski J., Biernacka D., , Moskalewski S.. Relationship between
mast cells/parietal cells and maximal/basal acid output ratio in chronic gastritis. Research
in espriemental medicine Springer-Verlag 2000. Res Exp Med (2000) 200:35–41
10.- Mizuno S • Miki I • Ishida T • Yoshida M • Onoyama M • Azuma T • Habu Y • Inokuchi
H • Ozasa K • Miki K • Watanabe Y. Prescreening of a High-Risk Group for Gastric Cancer
by Serologically Determined Helicobacter pylori Infection and Atrophic Gastritis. Springer
Dig Dis Sci (2010) 55:3132–3137 DOI 10.1007/s10620-010-1154-0.
11.- Kakehasi A. M., Rodrigues C. B. Carvalho A. V. Barbosa A. J. A. Chronic Gastritis
and Bone Mineral Density in Women. Received: 18 March 2008 / Accepted: 18 June 2008 /
Published online: 7 August 2008_ Springer Science+Business Media, LLC 2008
12.- Rembiasz K., Md, Konturek P. C., Md, Karcz D., Md, Konturek S. J., Md, Wl_ Adysl_
Aw Ochmanski, Md, Wladyslaw Bielanski, Phd, Andrzej Budzynski, Md, And Jerzy
Stachura, Md. Biomarkers in Various Types of Atrophic Gastritis and Their Diagnostic
Usefulness. Digestive Diseases and Sciences, Vol. 50, No. 3 (March 2005), pp. 474–482
(C _ 2005) DOI: 10.1007/s10620-005-2461-8
13. - Hideki N, Ohyama S., Yoshihiro S , Ohta K, Yamaguchi T., Muto T, Yamaguchi A.
The endoscopic evaluation of gastritis, gastric remnant residue, and the incidence of
secondary cancer after pylorus-preserving and transversegastrectomies. 2004 by
International and Japanese Gastric Cancer Associations Gastric Cancer (2004) 7: 54–59
DOI 10.1007/s10120-004-0269-4.
ANATOMÍA PATOLÓGICA
45
14.- Sánchez H. J., Mejía L. S., Zapata I. L, Rodríguez M. A., García R. E. Tres esquemas
terapéuticos para erradicar Helicobacter pylori, en un grupo de pacientes con gastritis
crónica y dispepsia. Sánchez Hernández J y cols. Helicobacter pylori en pacientes con
gastritis crónica y dispepsia Rev Hosp Jua Mex 2006; 73(1):16-21.
15.- Suárez O. S, Melado S. P., Redondo M. E, López B. J., José Marín E. D, Guerra M. de
L. C., La gastritis crónica como potencial factor de riesgo vascular, Rev Mex Patol Clin,
Vol. 53, Núm. 1, pp. 62-66 • Enero - Marzo, 2006
IMÁGENES
01.- http://www.ferato.com/wiki/index.php/Gastritis
02.- http://www.revistaamiga.com/Mujer/107981113013.htm
03.- http://www.revistaamiga.com/Mujer/107981113013.htm
04.- http://www.revistaamiga.com/Mujer/107981113013.htm
05.- http://www.infogastro.es/1033262/
06.- http://theprincenightmare.blogspot.com/
07.- http://theprincenightmare.blogspot.com/
08.- http://www.darmspiegelung-berlin.de/html/gastritis.html
09.- http://www.gastrointestinalatlas.com/Espanol/Estomago/Gastritis/gastritis.html
10.- http://www.gastrointestinalatlas.com/Espanol/Estomago/Gastritis/gastritis.html
11. - http://www.medservice.com.co/pagina/index.php?option=com_content&view=
category&layout=blog&id=3&Itemid=161&limitstart=5
12. - http://www.esmas.com/salud/enfermedades/infecciosas/435025.html
13. - http://www.obstetrix.com/blank.cfm?xyzpdqabc=0&id=1146&action=
detail&AEArticleID=100162&AEProductID=Adam2004_102&AEProject
TypeIDURL=APT_7
14.http://www.google.com.mx/imgres?imgurl=http://metododelpinal.
com/imageH7E.JPG&imgrefurl=http://metododelpinal.com/Adenocarcinoma.gastrico2.html
&usg=__q5YU5SnwdwxqkWSXypTanDAx8oE=&h=419&w=705&sz=33&hl=es&start=176&
zoom=1&tbnid=0j3peA4TuuUlM:&tbnh=106&tbnw=179&prev=/images%3Fq%3Dbiopsia%
2Bde%2Bestomago%26um%3D1%26hl%3Des%26biw%3D1041%26bih%3D434%26tbs%
3Disch:10%2C5297&um=1&itbs=1&biw=1041&bih=434&iact=rc&dur=452&ei=pending&oei
=HWIBTbLrA5SC4QaYy43pBA&esq=3&page=18&ndsp=10&ved=1t:429,r:4,s:176&tx=118
&ty=52
ANATOMÍA PATOLÓGICA
46
15. - http://www.rdnattural.es/enfermedades/afecciones-diversas/gastritis/
16. - http://www.solunetti.fi/en/patologia/krooninen_mahatulehdus_40x/
17. - http://estomagomedicinac.blogspot.com/2009/04/danos-que-puede-sufrir-el-
estomago.html
18.- artículo no 11
19.- http://sisbib.unmsm.edu.pe/bvrevistas/gastro/vol_22n3/gastritis_cr%C3%B3nicas.htm
20.- http://www.flickr.com/photos/16961364@N00/260326601/
21.- Tomada del artículo no 6
22.- Tomada de: http://i-feb.com/gastritis/
23.- http://lamedicinanaturaloalternativa.blogspot.com/2010/07/aparatologia-estetica-mujer-
de-65-anos.html
24.- http://www.gihealth.com/html/education/photo/printable/printGastritis.html
25.- http://www.gihealth.com/html/education/photo/printable/printGastritis.html
26.- http://www.gihealth.com/html/education/photo/printable/printGastritis.html
27.- http://www.gihealth.com/html/education/photo/printable/printGastritis.html
28.- http://vitae.ucv.ve/?module=articulo&rv=94&n=297&m=2&e=457
29.- http://s99.middlebury.edu/BI330A/STUDENTS/KASSIS/kassis/helicobacter_pylori
30.- http://idibam.blogspot.com/2008_01_01_archive.html
31.- http://vitae.ucv.ve/?module=articulo&rv=94&n=297&m=2&e=457
32.-http://www.portalesmedicos.com/publicaciones/articles/1855/4/Proctocolitis-Cronica-
por-Radiacion.-Presentacion-de-un-Caso-Clinico-%96-Endoscopico
33.- http://www.clinicachicamocha.com/imaginologia.htm
34.- http://www.dnsffaa.gub.uy/GCU/biologia%20molecular.htm
35.- http://www.biotech.bioetica.org/docta62.htm
36.- http://www.dnsffaa.gub.uy/GCU/biologia%20molecular.htm
37.- http://www.med.nyu.edu/medicine/labs/blaserlab/v1-sld_H-pylori.html
38.- http://lima.olx.com.pe/analizador-del-test-del-aliento-helicobacter-pilori-6-900-dolares-
iid-43195997
39.- http://blogs.lainformacion.com/futuretech/2010/06/11/latro-la-lampara-de-algas-que-
funciona-con-aliento-humano/
40.- http://zonasenior.blogspot.com/2010/09/los-antiacidosl-y-sus-efectos-en-la.html
41.-http://www.dipromed.com.mx/catalogo/index.php?page=shop.product_details&flypage=
flypage.tpl&product_id=81&category_id=45&option=com_ virtuemart&Itemid=71
ANATOMÍA PATOLÓGICA
47
42.-http://www.google.com.mx/imgres?imgurl=http://www.mediexpress.com.mx/catalog/
images/ANT0010jpg&imgrefurl.
43.- http://www.google.com.mx/imgres
?imgurl=http://pp.centramerica.com/pp/imgs/prodsmall/1432.jpg&imgrefurl=http://www.gbp
harma.com/categoria_menu.asp%3Fid%3D494%26clc%3D108&usg=__Uf_DvHbuOL8aicf
4b3dQBVkTvzE=&h=336&w=448&sz=14&hl=es&start=35&zoom=1&tbnid=sWOx1anfxeNti
M:&tbnh=139&tbnw=177&prev=/images%3Fq%3Dmetronidazol%26um%3D1%26hl%3Des
%26w%3D1174%26bih%3D456%26tbs%3Disch:1&um=1&itbs=1&iact=rc&dur=405&ei=t7
uTNfzIYqisAOtvs3sCw&oei=pd7uTIjEDJO6sQPtkZChDA&esq=18&page=4&ndsp=12&ved
=1t:429,r:6, s:35&tx=125&ty=83
44. - http://www.lookfordiagnosis.com/mesh_info.php?term=Omeprazol&lang=2XkwwM:
&tbnh=87&tbnw=200&prev=/images%3Fq%3Davapena%26um%3D1%26hl%3Des%26biw
%3D1174%26bih%3D456%26tbs%3Disch:1&um=1&itbs=1&iact=hc&vpx=277&vpy=109&d
ur=717&hovh=148&hovw=340&tx=165&ty=92&ei=Z93uTIGTBpS6sAPPzZCYDA&oei=Z93
uTIGTBpS6sAPPzZCYDA&esq=1&page=1&ndsp=10&ved=1t:429,r:1,s:0
LIBROS
1. Muñoz L. F. Gastroenterología, Gastritis Crónica y Gastropatía hiperplasica Capitulo
44, Editorial Panamericana 2009, PP. 263-267
2. Netter, P. Smith R.: obstetricia ginecología y salud de la mujer. Gastritis. editorial
masson 2000. PP. 501-503.
3. Pérez V. J.J, Sánchez O. E., Rivera E., Reynoso G. S., Reynoso S., Ángeles A. A.
Gastritis y Ulcera Péptica provocada por H. pylori , Gastroenterología, , Mendez
Editorial 2000, PP. 250-261.
4. Pérez J.V. Gastritis, Principios de Gastroenterología, Editorial. Año, PP. 353-367.
5. Romero, C.R, Microbiología y Parasitología humana basases etiológicas de las
enfermedades infecciosas y parasitarias 3ª Edición, Editorial Panamericana S.A de
C.V. 2007, 483-485
6. Netter H.F, Netter Medicina Interna, gastritis, Editorial Masson Doyma México S.A,
2004-2005 PP. 181-183
7. Hogge A., Baer A., Gastritis, Robbins y Cotran Patologia Estructural y Funcional 7ª
edición, Editorial Elsevier 2009, PP. 826-820
8. Petersdor R. G. Gastritis, Principios de Medicina Interna, , McGraw-Hill 17a edición
2009, PP.208-210
ANATOMÍA PATOLÓGICA
48
INTRODUCCIÓN
ÚLCERA PÉPTICA. Según la OMS: La enfermedad ulcerosa está causada por la ulceración
péptica que afecta al estómago, duodeno y la parte baja del esófago. Se deben promover
medidas generales y baratas, como introducir estilos de vida saludables, dejar de fumar y
tomar antiácidos. La posibilidad de enfermedad maligna se debe considerar en todos los
pacientes mayores de 40 años con sospecha de úlcera.
La enfermedad ulcerosa es relativamente benigna, con una mortalidad global inferior al
2%, fundamentalmente debida a las complicaciones de la enfermedad y por causas
inherentes a la cirugía.
La infección por H. pylori es cosmopolita, y su contagio se da de persona a persona. No
se ha demostrado contagio por transmisión sexual. La infección es más prevalente en
grupos de bajo nivel socio-económico.
La prevalencia de infección por H. pylori aumenta considerablemente en la población
geriátrica.
La mortalidad es más elevada en enfermos de más de 60 años que toman AINEs de forma
crónica y en fumadores.15
Anteriormente se creía que era una enfermedad propia del adulto porque la incidencia en
los niños era desconocida, debido a que las manifestaciones clínicas en ellos son
inespecíficas, sin embargo con el advenimiento de la endoscopía, actualmente se sabe
que también se presenta en la infancia y a medida que transcurre el tiempo se descubre
un mayor número de casos por año.
En EUA aproximadamente 4 millones de personas tienen úlceras pépticas (duodenales y
gástricas) y cada año se diagnostican 350,000 casos nuevos.
Son hospitalizados alrededor de 180,000 pacientes; aproximadamente 5 000 personas
fallecen cada año como resultado de la enfermedad ulcerosa péptica.
ANATOMÍA PATOLÓGICA
49
El predominio de úlcera mundial son las úlceras duodenales que dominan en poblaciones
Occidentales mientras que las úlceras gástricas son más frecuentes en Asia, sobre todo
en Japón. Aunque la frecuencia de la enfermedad de úlcera péptica en países
Occidentales ha disminuido durante los 100 años pasados. 2
La úlcera péptica se encuentra en el 5 a 10 % de la población, lo cual explica que sea una
enfermedad de observación frecuente en las salas de hospitales, así como en las
consultas externas. 1
La probabilidad de desarrollar a lo largo de la vida una úlcera péptica es de alrededor del
10% para los hombres norteamericanos y del 4% para las mujeres.
La relación de hombres: mujeres es de aproximadamente 3:1 para las úlceras duodenales
y de 2:1 para las úlceras gástricas; las mujeres se afectan con mayor frecuencia a partir de
la menopausia.
La úlcera duodenal (UD) tiene su pico de incidencia a los 45 años, y es unas 3-4 veces
más frecuente que la úlcera gástrica (UG). Esta última tiene un incidencia del 0.03 – 0.4 %
por cada 1.000 habitantes, con un pico de incidencia entre los 55 y 65 años.11
El 90 % de las úlceras recurren, con predominio de las duodenales, que lo pueden hacer
tres a cuatro veces en el primer año de tratamiento. Si se da tratamiento de
mantenimiento, la recurrencia baja al 25-50%, cifra que casi desaparece al erradicar el
Helicobacter pylori.
Entre las complicaicones de la úlcera duodenal, la hemorragia se presenta en el 2-3 % de
los pacientes por año, mientras que la perforacion y obstrucción suceden en menos del
5% de los pacientes durante toda su vida.
En cuanto a las úlceras gastricas , se tiene una estrecha relacion con el cancer gastrico;
hasta un 3% de ellas, con apariencia de benignidad son carcinomas y su diagnostico
temprano conduce a una sobrevida hasta del 50% a cinco años.
ANATOMÍA PATOLÓGICA
50
RESUMEN
La úlcera péptica se desarrolla en cualquier parte del tubo digestivo expuesto a la acción
de la pepsina actuando en un medio ácido.
Dicha acción digestiva se produce en un área circunscrita de la mucosa que ha perdido su
resistencia natural a la agresión acido péptica.
El concepto de úlcera péptica exige dos hechos morfológicos importantes: la pérdida de
sustancia debe profundizar más allá de la muscularis mucosae y su duración debe
alcanzar un mínimo de 15 días, tiempo necesario para que se pueda curar mediante la
formación de un tejido de granulación.Se suele presentar entre los 30 y 50 años.
Típicamente se localiza en la curvatura menor del estómago, cerca del píloro y la primera
porción del duodeno, esta localización puede deberse a factores locales, determinados por
gastropatía ocasionada por la ingestión de sustancias químicas agresivas o a las lesiones
causadas por la infección por Helicobacter pylori.
El Helicobacter pylori es el causante de la mayor parte de las úlceras pépticas.
La colonización de la mucosa gástrica por H. pylori ha tenido que ver con gastritis crónica,
enfermedad de úlcera péptica, y cáncer gástrico.5
El equilibrio entre los factores agresivos: ácido clorhídrico, pepsina y los defensores de la
integridad de la mucosa, pueden verse alterados por diferentes factores de tipo: ambiental,
genético, alimentario, endocrino y constitucional; por lo tanto se considera una enfermedad
multifactorial.
Las úlceras provocan dolor (las bebidas alcohólicas los ácidos, el tabaco y algunos
medicamentos pueden provocar el dolor), indigestión y, en ocasiones algunas
complicaciones como hemorragia, perforación, penetración y obstrucción. Las úlceras
pueden reaparecer luego de su curación, especialmente si la persona sufre una infección
por H. pylori (una infección que puede durar toda la vida si no se la trata).
ANATOMÍA PATOLÓGICA
51
Los antibióticos para el H. Pylori ofrecen un beneficio pequeño en el tratamiento inicial de
úlceras pépticas y un beneficio significativo en la prevención de la recurrencia tanto de las
úlceras duodenales como gástricas, una vez que se logró la cicatrización.
Las indicaciones para cirugía de la úlcera péptica son las complicaciones mencionada y la
rebeldía al tratamiento medico
Sin embargo, la úlcera péptica ha dejado de ser una afección quirúrgica programada
desde la introducción de la ranitidina primero, el omeprazol después y últimamente los
antibióticos contra el Helicobacter pilory, pero continúa siendo frecuente el tratamiento de
urgencia de sus complicaciones.1
ANATOMÍA PATOLÓGICA
52
ANTECEDENTES
Imagen. 1
fuente: http://www.unanuevamaneradeopinar.com/index.php/page/2/
TEORÍA PSICOSOMÁTICA DE LA ÚLCERA PÉPTICA.
Existen tres suposiciones principales para una teoría psicosomática general de la etiología
de la úlcera péptica:
a) Los pacientes con úlcera péptica están expuestos a un conflicto psíquico
de larga duración o ansiedad, tensión emocional o ambos.
b) Con un estado de tensión emocional crónico se predispone a la formación
de una úlcera al estimular la secreción de acido y pepsina o disminuir la
resistencia de la mucosa.
c) Tiene que ver una situación precipitante que acentúan las suposiciones
anteriores, y ellos va seguido, por lo general en cuatro a siete días, del
inicio de un cráter de úlcera y sus síntomas.
ANATOMÍA PATOLÓGICA
53
La teoría no predice que todos los que tienen tensión emocional grave, desarrollaran
úlcera péptica. Es decir, estos pacientes están predispuestos a la úlcera, pero existen
otros factores, como el grado de resistencia de la mucosa, la salud, cantidad y reactividad
de las células parietales, presencia o ausencia de un hecho precipitante que será la causa
o no de que se desarrolle o no úlcera péptica.
En el sentido psicosomático, tensión significa, un hecho que causa ansiedad depresión.
Por lo tanto, se piensa, que lo definitivo en términos de la patogenia de una úlcera no es el
hecho o la circunstancia real, sino la forma en que se percibe y se trata, así como la
ansiedad, temor, irritación, que se provocan.
La teoría psicosomática, no implica que la tensión sea factor importante en todos los
pacientes con úlcera, sino un agente causal en muchos de estos casos.
Si la teoría psicosomática es correcta para un número determinado de pacientes y la
tensión emocional predispone y precipita una úlcera a través de las vías vagales, ellos
entrañan que el “tono vagal” esta aumentado en este grupo de pacientes ulcerosos y que
la vagotomía debe curar la úlcera, pero su curación no debe influir en el trastorno
psicológico.
Descripción psiquiátrica de los pacientes con úlcera.
Muchos investigadores sospecharon la relación causal entre la emoción y la úlcera
péptica.
Alexander, en 1984 constituye el inicio de una teoría psicosomática específica. Analizo
junto con sus colaboradores un pequeño número de pacientes de úlcera, y al contrario de
las opiniones populares, no encontraron un tipo de personalidad característico común para
los ulcerosos. Más bien se pensó que la anormalidad básica en pacientes con úlcera era
una marcada dependencia, y se suponía que el deseo de permanecer en la situación de
dependencia infantil, ser amados y cuidados, estaban en conflicto con el orgullo del ego
del adulto. Entonces se considero que el conflicto que resultaba de la dependencia intensa
era básico para el carácter de los pacientes de úlcera péptica.
ANATOMÍA PATOLÓGICA
54
Alexander propuso que cuando los deseos de dependencia no encuentran recompensa en
las relaciones humanas, se crea un estimulo emocional crónico que causa secreción de
acido, aumento de la motilidad gástrica y mayor flujo sanguíneo de la mucosa del
estómago. Es decir en términos psicosomáticos, si el deseo de recibir, ser amado y
depender de otros no se realiza, entonces se deberá usar una salida regresiva para la
dependencia. Entonces el deseo de ser amado se convierte en deseo de ser alimentado,
y el estómago responde como si recibiera comida.
Mittelmann y Wolff, pensaron que el dato constante en pacientes de úlcera péptica era un
conflicto psíquico, relacionado con un conflicto de dependencia.
Stine e Ivy encontraron opiniones unánimes de que todos los pacientes tenían un conflicto
grave relacionado con una dependencia.
Los críticos no aceptaron este concepto porque en casi todas las personas es posible
encontrar caracteres de dependencia de cierto grado, así que en un individuo esto puede
resaltarse o quietarle importancia.
Kapp y colaboradores, dividieron sus pacientes ulcerosos en tres grupos:
I. Grupo A: Estos pacientes eran demasiado dependientes, de acciones rígidas y
tenían éxito.
II. Grupo B: Este grupo manifestaba abiertamente deseos de dependencia hacia su
madre o algún otro familiar. Los pacientes tenían poco éxito, pero eran
notablemente dóciles, tímidos y con frecuencia afeminados.
III. Grupo C: Los pacientes en este grupo presentaban un trastorno grave de carácter.
La mayoría eran alcohólicos, y muchos tenían caracteres psicopáticos, como
jugadores de azar, delincuencia o incapacidad para subsistir. Tenían impulsos
egoístas y eran abiertamente parásitos de amigos, esposas y la sociedad.
ANATOMÍA PATOLÓGICA
55
La mayor parte de los estudios psiquiátricos y analíticos de la úlcera péptica se han
llevado a cabo en hombres, pero Kezur y colaboradores, estudiaron 25 mujeres, de las
cuales 4 presentaban úlcera duodenal y 21 úlcera gástrica. En cada paciente había
pruebas graves de un trastorno de personalidad. La úlcera tendía a desarrollarse cuando
la paciente era rechazada por una persona importante para ella, casi siempre el esposo o
padre. En general, estas mujeres se adaptaban mal a su medio ambiente.
Pruebas que apoyaban la validez de la Teoría Psicosomática
Suposición A:
Afirma que los pacientes de úlcera han estado expuestos a conflictos psíquicos,
ansiedad, tensión emocional, o ambos, por mucho tiempo antes de desarrollarse la úlcera.
Davies y Wilson: encontraron que en los ulcerosos era mucho más notable la inestabilidad
emocional que en los pacientes con hernia inguinal.
Eberhard utilizó pruebas psicológicas y entrevistas para valorar la personalidad de
gemelos monocigotos, en los que al menos uno tuviera úlcera. Las pruebas se
interpretaron sin saber cuál de los gemelos la padecía. Aunque el autor sabia cual de los
gemelos tenia úlcera cuando los entrevisto; un según examinador, que no lo conocía, hizo
un análisis separado de la personalidad y factores de agresión con el material que le
remitió el autor.
Los resultados mostraron que los gemelos con úlcera, o el que la había manifestado en
época más temprana, si ambos la padecían, tenían mayor sensibilidad a la agresión y
alteración de los mecanismos de defensa estadísticamente importantes, en comparación
con los gemelos sin úlcera o en los que se había iniciado en época más tardía, si ambos la
padecían.
Rutter, intento valorar en qué grado se relacionan las variables psicológicas con el
resultado a corto plazo de la úlcera duodenal y gástrica. Encontró que las alteraciones
psiquiátricas, principalmente ansiedad y depresión, se correlacionaban al principio del
episodio de la enfermedad. Concluye que los factores psiquiátricos y sociales causan o no
ANATOMÍA PATOLÓGICA
56
úlcera péptica, pero también la ansiedad y la depresión son muy importantes al precipitar
las complicaciones e impedir la curación.
Alp y colaboradores, a través de un cuestionario de escala de neurocismo, concluyeron
que un gran porcentaje de pacientes presentan ulcera gástrica, a estos se les denomino
“obtenidos”, debido a que se cree es un carácter que se desarrolla por una experiencia
temprana, y “sumisos”, que al parecer es un carácter hereditario.
Suposición B:
Señala que existe un estado emocional crónico que predispone a la formación de la
úlcera al estimular la secreción de ácido y pepsina y disminuir la resistencia de la mucosa.
Beaumont y Wolf, demostraron que las emociones conscientes pueden afectar la
secreción gástrica, motilidad y el riesgo de la mucosa. Es decir, los sentimientos de
ansiedad y agresividad suelen aumentar la actividad gástrica, en tanto que el temor y la
depresión, por lo general tienen efecto opuesto.
Margolin, estudió los efectos de la emoción inconsciente sobre la función gástrica de una
mujer. Observó que la secreción puede aumentar o disminuir con las emociones
conscientes de enojo, culpa o ansiedad.
Mittelmann y Wolff, analizaron los efectos de las diversas emociones en la secreción y
motilidad gástrica de pacientes de úlcera. Aquí la ansiedad, frustración, resentimiento y la
culpa, se acompañan de aumento de la motilidad y acidez gástrica.
Mirsky, observó un paciente en el que se estimo la secreción gástrica en serie, midiendo
las concentraciones urinarias de pepsinógeno, que aumentaron en forma impresionante
cuando la relación de dependencia que el paciente había establecido con su esposa sufría
alguna amenaza. El paciente no desarrollo úlcera, pero este estudio sugiere que la tensión
emocional de tipo común en pacientes de úlcera puede estimular la secreción gástrica.
ANATOMÍA PATOLÓGICA
57
Crawshaw y sus colaboradores demostraron que, después de un periodo de latencia de 10
a 20 minutos, aumentaba en forma precisa la secreción gástrica de ácido cuando
estudiantes de medicina normales pensaban, veían, u olían comida apetecible.
Al atormentarlos con comida, aumentaba la secreción de acido de menos de 1 a 3.5meq
por hora. Entonces concluyeron que la estimulación psíquica con alimento aumenta la
secreción gástrica de ácido.
Suposición C:
Esta se asocia con el hecho de que supuestamente causa el cráter de una úlcera.
Davies y Wilson encontraron que pacientes de úlcera tenían antecedentes de alguna
situación de agresión. El hecho ocurrió por lo general 5 a 6 días antes del inicio de la
úlcera. En el grupo de ulcerosos, los hechos más comunes se relacionaban con:
a. Cambio de trabajo.
b. Dificultades económicas.
c. Enfermedad o desgracia en un miembro de la familia.
Estos autores resaltaban que estos hechos eran reales, y no problemas imaginarios, y que
se relacionaban en gran parte con responsabilidad, seguridad e independencia. Es de
interés que este estudio se haya publicado en 1937 y aun siga siendo el único controlado
sobre la frecuencia con que un hecho precede al inicio de síntomas de úlcera.
Mittelmann y Wolff analizaron los datos psicológicos y clínicos en forma independiente en
un grupo de pacientes con úlcera y elaboraron en seguida cuadros de la vida de cada
paciente.
La frecuencia de admisiones por úlcera perforada en hospitales de Londres aumento de
22 a 35 casos por mes durante los ataques aéreos de 1940 a 1944. Este cambio fue
estadísticamente importante y sugiere que el “stress” intenso puede aumentar esta
complicación de la úlcera péptica aunque, obviamente, durante los ataques deben haber
ocurrido otros cambios del medio ambiente además de la agresión psíquica.
ANATOMÍA PATOLÓGICA
58
En los primeros años de la década de 1930, se observo que los pacientes de úlcera
secretaban grandes cantidades de acido por la noche, y que ellos podría constituir un gran
problema terapéutico. Pronto se difundió la medición de la secreción nocturna de 12 horas
y se pensó que los resultados reflejaban el grado del tono vagal.
Winkelstein fraccionó la secreción nocturna de 12 horas en valoraciones cada hora y
encontró que la máxima ocurría a la una de la mañana.
En fecha más reciente, Moore y Englert, han estudiando la secreción basal durante 24
horas.
Ivy y sus colaboradores, encontraron que la secreción basal de una hora proporciona casi
con exactitud los mismos resultados promedio que la secreción nocturna de 12 horas.
En años pretéritos se usaron muchas diversas comidas de prueba, entre ella se incluían la
de carbohidratos, la de atole, de cafeína y las de alcohol. Estas pruebas se llevan a cabo
tomando una pequeña muestra del contenido gástrico a intervalos múltiples después de
ingerir una comida y determinar la concentración del ion de hidrogeno. Los resultados de
estas pruebas no solo dependen de la secreción de acido sino también vaciamiento y
neutralización del acido secretado por la comida de prueba en sí.
Estas pruebas han demostrado que en pacientes de úlcera duodenal el promedio de
acidez es más alto que en las personas normales.
Littman ha confirmado que la prueba de cafeína permite separar bien a los grupos de
ulcera duodenal.
El primer caso registrado de perforación por úlcera péptica data de 1670, y fue la hija de
Carlos I, de Inglaterra. La primera operación practicada a un paciente con esta
complicación la realizó Mickulics en 1888, pero el primer reporte del tratamiento quirúrgico
de la úlcera péptica perforada se inicia con el primer cierre simple, en 1894, realizado por
W. Bennett y por Dean HP.
Después de que Mickulics realizó la primera operación a un paciente perforado, la cual
ANATOMÍA PATOLÓGICA
59
constituyó un éxito, la mortalidad se mantuvo elevada, hasta que Graham, en 1937,
publicó su trabajo donde añadía al proceder de Mickulics, una plastia de epiplón y mostró
una supervivencia de un 94 %. 1
Durante más de un siglo, el tratamiento para la enfermedad de úlcera péptica era a
menudo el manejo quirúrgico.
En los años 1970 los fármacos más eficaces para la supresión de la secreción acida
gástrica comenzó con la introducción de H2-receptor de histamina antagonistas (H2RAs)
que dejo resultado clínicos enormemente mejorados.
Durante los años 1980 la opción por la cirugía de úlcera péptica disminuyó en el 85 %,
que puede ser principalmente atribuido al uso del H2Ras como claritromicina y ranitidina.2
En 1980 el desarrollo de los inhibidores de bomba del protones (IBPs) mejoraron la
inhibición de la secreción ácida gástrica, disminuyendo la necesidad de cirugía de úlcera.10
En 1979, Warren observó gérmenes en la mucosa gástrica a los que denominó
Campylobacter like organism y en unión de Marshall inició un estudio prospectivo a 100
pacientes que iban a ser sometidos a gastroscopia, y señaló la posible importancia clínica
de esta observación en 1983.
En el contexto del 13 Congreso Internacional de Gastroenterología, celebrado en Roma,
en septiembre de 1988, el profesor Tytgat mantuvo la interrogante ¿Es la úlcera péptica
una enfermedad infecciosa? El eminente investigador encontró un bacilo gram negativo
conocido como Campilobacter pylori en más del 90 % de los pacientes con úlcera
duodenal y en más del 75 % de las úlceras gástricas, sin embargo, el reservorio natural
del Campilobacter pylori era desconocido.
Dada la importancia de este microorganismo en las enfermedades gastrointestinales y por
sus características microbiológicas diferentes con las bacterias del género Campilobacter,
se ha creado un género nuevo para incluirlo, el género Helicobacter.
El género Campylobacter se caracteriza por bacilos Gram negativos, en espiral, con un
único flagelo polar, microaerofílicos y no tienen la enzima ureasa. El género Helicobacter
ANATOMÍA PATOLÓGICA
60
difiere en que en la observación directa predominan las formas espirales y en cultivo no,
son más bacilares, tienen de 3 a 6 flagelos unipolares y presentan la enzima ureasa.
Aunque los primeros trabajos que comunican la presencia de bacterias espirales en
estómagos humanos datan ya de hace más de un siglo, fue hasta 1983 cuando el estudio
de Robin Warren y Barry J. Marshall estableció una relación entre la infección por H. pylori
y la presencia clínica de trastornos gastrointestinales.15
En 1984, Marshall y Warren descubrieron la presencia de un agente infeccioso en biopsias
antrales de pacientes con gastritis y úlceras pépticas. Desde entonces, se ha implicado al
Helicobacter pylori en la patogenia de la entidad. 1
Síndrome de Zollinger – Ellison (GASTRINOMA)
En 1955, Zollinger y Ellison describieron el síndrome que lleva sus nombres y que consiste
en una enfermedad ulcerosa de la parte superior del tubo digestivo con importante
aumento de la secreción ácida del estómago y tumores de los islotes pancreáticos de
células no beta.
Zollinger – Ellison, en su trabajo original sobre el síndrome sugerían que la enfermedad
ulcerosa de estos pacientes era el resultado de la liberación de un secretagogo por parte
del tumor, que llegaría a la sangre y que justificaría los índices de secreción a menudo
enormemente aumentados del ácido gástrico.
Su idea se confirmó como acertada cuando en 1960 se demostró que los extractos de los
tumores de Zollinger- Ellison estimulaban la secreción ácida del estómago.
Posteriormente se observó que estos tumores de los islotes pancreáticos contenían
gastrina y que en la circulación existían grandes cantidades de esta hormona que eran las
responsables de las características fisiopatológicas del síndrome. Por lo tanto, en la
actualidad estos tumores que contienen gastrina reciben el nombre de gastrinomas.
ANATOMÍA PATOLÓGICA
61
DEFINICIÓN
El síndrome ulceroso es un conjunto de manifestaciones clínicas originadas por una
solución de continuidad de la mucosa gástrica o duodenal, que sobrepasa generalmente la
muscularis mucosae y que se extiende con profundidad variable
Las úlceras pépticas son lesiones crónicas, la mayoría de la veces únicas, que ocurren en
cualquier porción del tracto gastrointestinal expuestas a la acción agresiva de los jugos
ácidos/pépticos.
Las úlceras pépticas suelen ser lesiones menores de 4 cm de diámetro.
Imagen. 3
Imagen.2
Izquierda. Mucosa gástrica con intenso infiltrado inflamatorio agudo y un
foco de erosión con pérdida de epitelio superficial y glandular.
Derecha. Ulcera péptica con las características capas de Ascanazzi:
(superficie con necrosis y detritus celulares). Tejido de granulación
subyacente con infiltrado inflamatorio agudo. Zona de inflamación crónica.
Base de la úlcera con fibrosis de la pared intestinal.
Se observa una ulcera duodenal
Fuente:
www.cvsanfermin.com/.../fotos-cirugias.html
ANATOMÍA PATOLÓGICA
62
CLASIFICACIÓN
La úlcera péptica puede clasificarse de varias maneras:
Por su localización:
a. Gástrica
Imagen.4
b. Duodenal
Imagen.5
c. Esofágica
Imagen.6
ÚLCERA GASTRICA CRONICA:
A mayor acercamiento, se observa el borde nítido hiperémico y el fondo
grisáceo (fibrina y detritus).
Fuente:
http://escuela.med.puc.cl/paginas/cursos/tercero/
anatomiapatologica
/imagenes_ap/patologia461-466.htm
En la imagen se observa el aspecto de la mucosa del duodeno
cuando se realiza una endoscopia digestiva en un paciente
con úlcera duodenal asociada a H. pylori.
Fuente: http://www.helicobacterspain.com/fotos/ulceduo.jpg
Imagen donde se identifica úlceras
en el tercio distal del esófago.
Fuente: http://endoscopia-
gastrointestinal.blogspot.com/2010...
ANATOMÍA PATOLÓGICA
63
d. Marginal.
Imagen.7
e. En un divertículo de Meckel.
Imagen.8
La Úlcera Gástrica a su vez se clasifica, según, Johnson:
TABLA. 1
GRADO I
Lesión en incisura angular
Úlcera de localización en la curvatura menor. (Relacionada con un gasto de
ácido normal, constituye del 50 al 60% de las úlceras gástricas).
GRADO II
Asociada con úlcera duodenal
Úlcera de localización gástrica y duodenal (Relacionada con un gasto de ácido
normal, constituye el 20% de las úlceras gástricas).
En estas imágenes se pueden observan distintas ulceras marginales
Fuente:
www.cursosparamedicos.com/atlas/esto_2.htm
Corte sagital de íleon donde se aprecia el divertículo de Meckel el cual se encuentra hemorrágico y perforado en su base. Y el divertículo ileal adyacente.
Fuente: www.scielo.org.mx/scielo.php?script=sci_artte...
ANATOMÍA PATOLÓGICA
64
GRADO III
Prepilórica o antral Úlcera de localización prepilórica
(Relacionada con un gasto de ácido normal, constituye el 20% de las úlceras
gástricas).
GRADO IV
Lesión del fondo gástrico
Úlcera en el fondo gástrico o alta de la curvatura menor.
(Ulceras con una frecuencia igual o menor al 10%)
GRADO V
Úlceras múltiples
Úlcera Secundaria al uso prolongado de AINE.
(Úlcera con alto riesgo de perforación y hemorragia, habitualmente
asintomática).
Sin referencia
ANATOMÍA PATOLÓGICA
65
Según su actividad, se usa la clasificación de Sakita.
TABLA. 2
1) Lesión activa
2) Lesión en fase de cicatrización
3) Cicatriz de úlcera (blanca o roja)
A su vez la clasificación de Sakita se subclasifica en:
A1.-mucosa periférica sin epitelio de regeneración. A2.-edema menor, epitelio de regeneración al margen halo rojo.
H1.-tendencia a ser lineal con inicio de pliegues confluentes, halo rojo
y borde nodular.
H2.-úlcera con halo puntiforme.
S1.-úlcera roja edema leve.
S2.-úlcera blanca con epitelio de regeneración maduro halo rojo.
Sin referencia
ANATOMÍA PATOLÓGICA
66
ETIOPATOGENIA
La úlcera péptica tiene etiología multifactorial. Hasta fechas recientes se sabe que la
ulcera péptica se considera como una situación de por vida. Este concepto surgió por el
reconocimiento de que dos factores ambientales son de gran importancia en la mayoría
de las personas con este trastorno:
1) Helicobacter pylori.
Imagen.9
2) Uso de ácido acetilsalicílico (AAS) también llamada Aspirina, o de
antiinflamatorios no esteroideos (AINE). 11
Imagen.10
Microfotografía con microscopio de barrido
mostrando la presencia de Hp en la superficie.
Fuente:http://2.bp.blogspot.com/_B4lWWKY6kX0/Sbgomo
C5zQI/AAAAAAAAAAc/rQtHzY3Rass/S700/1596006.jpg
En la imagen se muestran algunas figuras sobre AINEs.
Fuente:http://2.bp.blogspot.com/_B4lWWKY6kX0/SbgomoC5zQI/AAAAA
AAAAAc/rQtHzY3Rass/S700/1596006.jpg
ANATOMÍA PATOLÓGICA
67
Los mecanismos de lesión para producir una úlcera péptica son:
Los medicamentos antiinflamatorios (B): tanto por vía oral como por otra vía llegan a la mucosa gástrica y
hacen perder los recubrimientos exteriores de protección (C).
La infección por la bacteria Helicobacter Pylori (A) que se acantona en la mucosa gástrica.
Imagen.11
Fuente : www.albelda.info/salud/ulcera_gastroduodenal.htm
Pacientes que toman aspirina de dosis bajas para la prevención de un acontecimiento
cardiovascular, tal como infarto al miocardio y trombosis; es un riesgo aumentado para
una herida gastrointestinal y complicaciones.2
El riesgo anual de amenazas de complicaciones por la úlcera es del 1 a 4% en pacientes
que usan AINEs a largo plazo; con pacientes más viejos el más alto riesgo responsable
de aproximadamente de la mitad de úlceras perforadas, es la toma de aspirina u otro
AINEs para enfermedad cardiovascular. 9
El riesgo de las complicaciones se acentúa debido a los efectos analgésicos de los AINEs,
lo que da una apariencia engañosa en los primeros síntomas de las ulceras. Estos efectos
analgésicos son la causa de la baja prevalencia de síntomas en usuarios de AINE que
tienen ulceras clínicamente importantes o complicadas.
Otros factores identificados como el tabaquismo, interactúan con el H. pylori y la lesión por
AINE, para aumentar el riesgo de úlcera péptica. Se estima que los fumadores tienen dos
veces más posibilidad de padecerla que la población control; posiblemente porque
ANATOMÍA PATOLÓGICA
68
presentan una disminución de prostaglandinas en la mucosa gástrica y duodenal, y la
secreción de bicarbonato por la mucosa duodenal que estimula el ácido se encuentra
inhibida.
El fumar aumenta el riesgo de perforación de ulcera y reduce la curación.9
imagen.12
Es el sexo masculino el que más se afecta con esta enfermedad. La explicación al
fenómeno y en correspondencia con lo que afirman otros autores, se basa en la mayor
secreción de ácido en el sexo masculino por una mayor masa de células parietales en el
estómago en relación con las que se haya en la mujer (180 millones).
En otras series de estudios se señala la tendencia en los últimos años a la igualación en
los dos sexos, a causa de los cambios en el hábito de fumar, la mayor incorporación
laboral, la infección por Helicobacter pylori y al uso elevado de AINE.
Se encontró que en algunos países se ha notado un incremento de las perforaciones en
los ancianos como consecuencia de la prolongación de la vida y del empleo masivo de
terapias con AINE y anticoagulantes.1. 12
Es más frecuente el consumo de AINEs entre las mujeres, pero se sugiere cómo el sexo
masculino modifica el efecto de los AINEs, incrementando varias veces la oportunidad de
úlcera péptica.12
Representación de lo que puede desencadenar el hábito de fumar.
Fuente: www.infogastro.es/1028607/
ANATOMÍA PATOLÓGICA
69
Un factor posible, es la dieta. Los coreanos tienen proteínas bajas, realizan comidas de
pocas calorías, y su dieta de sal alta con poco consumo de frutas frescas y verduras.6
Existen otros muchos factores posiblemente implicados en la etiopatogenia, y en muchos
pacientes el desarrollo de una úlcera péptica será el resultado de la interacción de varios
de ellos. Hay datos que sugieren una predisposición hereditaria en la úlcera péptica. En
los pacientes con úlcera péptica es relativamente frecuente la presencia de historia
familiar, ya que es más frecuente entre gemelos monocigotos que en los dicigotos.11
En una minoría de pacientes con ulcera péptica, otros factores, como los estados
hipersecretores (síndrome de Zollinger- Ellison), la infección de la mucosa por virus como
el herpes simple y citomegalovirus; el uso de la cocaína o “crack” ; el estrés emocional o
psiquiátrico, enfermedad de Crohn, cirrosis hepática, insuficiencia renal; todo esto tiene un
papel etiológico importante.9 Se ha visto que la prevalencia de una enfermedad ulcerosa
parece estar aumentada en pacientes con cirrosis hepática con etiología alcohólica o no.
Algunos estudios modernos todavía sugieren que el estrés contribuye a causar esta
enfermedad. El estrés emocional podría ser un factor de riesgo, por tanto es posible que
los factores psíquicos influyan en su percepción sintomática, pero no parece claro que lo
hagan en su causalidad; según Seyle, los sobrestímulos actúan en el hipotálamo posterior,
donde se libera una hormona que actúa sobre la pituitaria anterior, libera ACTH (Hormona
Adrenocorticotropa) que actúa sobre las suprarrenales y libera corticosteroides que
finalmente aumenta la secreción del acido clorhídrico y la pepsina.
Basta que la erradicación del H. pylori cure la enfermedad, aunque persistan situaciones
de estrés emocional. Erradicar la infección por H pylori casi siempre significa la curación
de la úlcera páptica no asociada al consumo de AINE y reduce muy significativamente la
tasa de recurrencias obviando generalmente el tratamiento antisecretor de mantenimiento.
Los inhibidores de la bomba de protones son el tratamiento de elección de la úlcera
péptica asociada al consumo de AINE. No existe suficiente evidencia para recomendar o
no la erradicación de la infección por H. pylori en los pacientes con úlcera péptica
asociada al consumo de AINEs.
ANATOMÍA PATOLÓGICA
70
En años recientes se ha logrado grandes avances para conocer la formación de la úlcera
péptica por infección causada por H. pylori o ingestión de AINEs. Dada la elevada
prevalencia de ulceras pépticas asintomáticas en la población general, los enfermos con
úlceras ocultas llegan a tener lesiones de importancia clínica cuando se les da algún AINE
debido a los factores adversos sobre la hemostasia, así como en la reparación y
cicatrización de la ulcera.
Los informes originales sugirieron que más del 90% de las úlceras gástricas y duodenales
que se veían en sujetos que no usaban AINEs, se presentaban en los que tenían gastritis
crónica activa recurrente por infección debida a H. pylori.
Helicobacter pylori, es una bacteria gram(-) que coloniza la mucosa gástrica, desempeña
un papel fundamental en el desarrollo de diversas enfermedades digestivas, como la
gastritis crónica y la úlcera péptica. Su prevalencia mundial es de 20% en la población
adulta, porcentaje que aumenta con la edad.15
La úlcera duodenal esta típicamente asociada con el antro gástrico o precedida de la
gastritis, que tiene que ver con un aumento de la secreción acida. Y la úlcera gástrica así
como el tipo intestinal del cáncer gástrico, típicamente tiene que ver con la gastritis
extensa y metaplasia intestinal extendida.6
Imagen.13
Representación en la que se observa
como el H. pylori causa un daño
epitelial, penetrando después a la
muscular de la mucosa.
Fuente:lasupergalaxia.wordpress.com/.../
ANATOMÍA PATOLÓGICA
71
La úlcera duodenal aparece en una edad más temprana, y cáncer gástrico aparece más
tarde en la vida cuando las únicas manifestaciones de la enfermedad de úlcera duodenal
previa son la historia médica o la presencia de una cicatriz típica en el bulbo duodenal.6
Estas conclusiones sugieren que la úlcera duodenal y el cáncer gástrico son
enfermedades mutuamente exclusivas de hechos finales de la infección de H. pylori.6
La ulcera gástrica está relacionada con el consumo de alcohol, AINES, así como la
infección por H. pylori.
La ulcera duodenal es un trastorno que predomina en personas jóvenes,
de extracción urbana.
Otros factores:
Alcohol: altera la barrera mucosa cuando se ingiere en grandes cantidades y por
tiempo prolongado.
Alteraciones en la motilidad gástrica y en vaciamiento: puede producir estasis y
prolongar el daño del ácido y la pepsina: o provoca reflujo de contenido biliar
duodenal al estomago.
Sistema Nervioso central: formación de ulceraciones asociadas a lesiones
diencefálicas, atribuidas a alteraciones en los centros nerviosos autónomos del
hipotálamo que producirán hiperactividad, específicamente en el núcleo del vago.
Factores Hormonales: las hormonas sexuales pudieran jugar un papel, pues se ha
observado que la menstruación agrava los síntomas ulcerosos y el embarazo los
mejora. La úlcera aparece con mayor frecuencia cuando se inicia la menopausia, lo
que puede estar en relación con una actividad hormonal aumentada o alterada.
Tendencia familiar: la úlcera péptica no es hereditaria; pero se puede heredar la
predisposición a ella.
ANATOMÍA PATOLÓGICA
72
Imagen.14
Fuente: http://gsdl.bvs.sld.cu/collect/enfermeria/index/assoc/HASH0199.dir/fig3.26g.png
Síndrome de Zollinger- Ellison ( GASTRINOMA)
Gastrinoma duodenal después duodenotomy (flechas) b | Cystic gastrinoma pancreático después duodenectomy (flechas).
Imagen.15
Fuente: www.nature.com/.../nrclinonc.2009.82_F3.html
Los gastrinomas se han descrito a menudo dentro del páncreas. El tamaño de los
gastrinomas puede variar desde 1mm a más de 20 cm de diámetro.
ANATOMÍA PATOLÓGICA
73
Es frecuente encontrar múltiples tumores primarios. Entre la mitad y las dos terceras
partes de los pacientes presentan gastrinomas múltiples situados en el páncreas.
Los gastrinomas duodenales, de los que aproximadamente el 50% son solitarios, se
encuentran habitualmente en la submucosa de la primera y segunda porción del duodeno.
Aproximadamente el 90% de los gastrinomas se encuentran dentro de un triángulo
anatómico (el triángulo del gastrinoma) que está compuesto por: arriba por la unión de los
conductos cístico y colédoco; por abajo, por la unión de la segunda y tercera porciones
duodenales; y medialmente por la unión del cuerpo y cuello pancreáticos.
Imagen.16
Casi dos terceras partes de los gastrinomas son histológica y biológicamente malignos.
Se calcula que en un 20 a 60% de los pacientes con síndrome de Zollinger – Ellison, el
gastrinoma es un componente de una neoplasia endocrina múltiple I (MEN I), una
enfermedad autosómica dominante con un alto grado de penetración y una gran
variabilidad en su expresividad. El locus de MEN I está en el cromosoma 11. Los
pacientes con MEN I clínicamente reconocidos pueden tener hiperplasia, adenomas o
carcinomas que afectan a las glándulas paratiroides, islotes pancreáticos e hipófisis.
En la mayoría de los gastrinomas, un 80 a 95% de la gastrina se encuentra en forma de
heptadecapéptido (G-17) y en casi todos los restantes en forma de G-34.
La imagen ilustra la región anatómica conocida como el triángulo
gastrinoma.
Fuente: radiographics.rsna.org/content/27/1/237.full
ANATOMÍA PATOLÓGICA
74
Puede aparecer a cualquier edad, pero sus manifestaciones iniciales son más
frecuenteentre los 30 y los 60 años de edad.
TABLA. 3
Sin referencia
Etiología de la úlcera
Péptica
Etiologías más frecuentes
Helicobacter pylori.
Antiinflamatorios no
Esteroideos.
Úlcera por estrés.
Etiologías más raras
Hipersecreción ácida
Gastrinomas
Mastocitosis sistémica
Hiperplasia/hiperfunción de las células G antrales
Síndromes mieloproliferativos con basofilia
Infecciones virales
Virus herpes simple tipo 1
Citomegalovirus
Obstrucción duodenal (anillo congénito, páncreas anular)
Insuficiencia vascular (crackcocaína)
Radiación
Quimioterapia (vía arteria hepática)
Amiloidosis tipo III
Síndrome de Neuhause (tremor-nistagmo-úlcera)
Porfiria cutánea tarda (forma familiar)
Idiopática
ANATOMÍA PATOLÓGICA
75
TABLA. 4
Sin referencia
FACTORES AGRESORES
FACTORES QUE SON
DE DEFENSA
FACTORES QUE SON DE
REPARACIÓN
Ácido Clorhídrico.
Pepsina
AINE
Helicobacter pylori
Bicarbonato
Flujo sanguíneo
Moco
Uniones celulares
Resistencia apical
Restitución,
reparación y
renovación celular
activa.
Capa mucoide.
Proliferación.
Factores de
crecimiento.
ANATOMÍA PATOLÓGICA
76
PATOGENIA
La infección por H. pylori es un factor muy importante en la patogenia de la ulcera péptica.
En algunos lugares de EE.UU. el 80% de los pacientes con úlcera duodenal y el 60% de
los portadores de úlcera gástrica están infectados por el microorganismo.
El Helicobacter pylori es una bacteria de muy reciente conocimiento. Este microorganismo
tiene forma de bastón curvo, con cuatro flagelos unipolares, que le dan gran movilidad.
Imagen.17
Imagen. 18
A nivel microbiológico se resaltan los siguientes aspectos: HELICOBACTER PYLORI .
Fuente: ddc-hpylori.blogspot.com/
Una célula de H.pylori. La forma curva de la célula, y sus flagelos que le permiten moverse por la mucosidad que cubre las células del estómago. (Crédito de Imagen: doctor Charles Penn, universidad de Birmingham)
Fuente: www.sciencecodex.com/prehistoric_origins_of_s...
ANATOMÍA PATOLÓGICA
77
Las especies del género Helicobacter se dividen en las que viven en el estómago y las que
viven en el intestino, tanto del ser humano como de animales.15
Entre sus características tiene la capacidad de producir ureasa, que le permite nivelar el
pH gástrico y así sobrevivir en este medio. Otra capacidad destacada es su poder de
penetración a la mucosa, que le permite introducirse en la pared del tubo digestivo, para
después adherirse a su pared mediante sus adhesinas.15 Una vez que la bacteria se ha
fijado a la pared del estomago o duodeno, se multiplica y el huésped responde con un
proceso inflamatorio, mediante células leucocitarias.
Imagen. 19
Proceso de infección de H. pylori Fuente: http://www.biologia.edu.ar/bacterias/figbac/Bacter1.jpg
ANATOMÍA PATOLÓGICA
78
H. pylori no posee capacidad invasiva pues no se observa en forma intracelular, pero es
capaz de provocar daño epitelial. El mantenimiento de la integridad de la mucosa gástrica
es un proceso biológico que depende del equilibrio entre proliferación y muerte celular
programada, o apoptosis. La apoptosis es un proceso codificado genéticamente, irre-
versible, activo y fisiológico que se caracteriza por distintos cambios morfológicos y
bioquímicos en la célula. Durante la apoptosis, la célula activa un mecanismo intrínseco
que la transforma mediante cambios morfológicos y bioquímicos característicos, como
translocación de fosfolípidos (fosfatidilserina) desde la superficie interna a la externa de la
membrana plasmática, agregación de la cromatina, condensación citoplasmática y
nuclear, y formación de cuerpos apoptóticos que contienen ribosomas, mitocondria
morfológicamente intacta y material nuclear. Los macrófagos o células epiteliales
adyacentes reconocen y fagocitan con rapidez estos cuerpos apoptóticos.
H. pylori induce apoptosis e incrementa la proliferación de células epiteliales gástricas.
Diversos estudios sugieren que la inducción de apoptosis tal vez no sólo dependa de la
presencia bacteriana y sus enzimas, sino también de la respuesta inflamatoria asociada.
Imagen. 20
Proceso apoptótico, en el que se puede observar la intervención de H. pylori
Fuente: www.nature.com/.../v2/n1/fig_tab/nrc703_F3.html
ANATOMÍA PATOLÓGICA
79
Los mediadores inflamatorios interferón-g (IFN-g) y factor de necrosis tumoral-a (TNF-a)
aumentan la apoptosis inducida por H. pylori.
Otras señales potenciales desde H. pylori o desde la respuesta inflamatoria para inducir
apoptosis son amonio, ureasa, radicales oxígeno y ceramida15
imagen. 21
Resumen de los posibles mecanismos por los que H. pylori puede producir alteraciones en la secreción gástrica. D, célula de somatostatina; ECL, tipo enterocromafín; G, célula G; IFN, interferón; IL, interleucina; P, célula parietal; SMS, somatostatina; TNF, factor de necrosis tumoral.
Fuente: Libro de Harrison
Esta bacteria secreta ureasa, que produce amonio y bicarbonato, lo cual proporciona un
pH casi neutro a la periferia de la bacteria y le permite evadir las propiedades bactericidas
del ácido clorhídrico.15 Además secreta peptidasa, lipasa, fosfolipasa A, lo que le permite
penetrar en la capa protectora. La proteasa, el factor estimulador de gastrina y citotoxinas,
vacuolizan las células del epitelio.
ANATOMÍA PATOLÓGICA
80
Imagen. 22
Las fosfolipasas hidrolizan las membranas celulares bacterianas al liberar lisolecitinas, las
cuales constituyen un factor ulcerogénico.15
Imagen. 23
La infección por H. pylori se considera como el agente causal del desencadenamiento de
la enfermedad ácido péptica. También se ha demostrado que la erradicación de la
bacteria, desaparece el problema.
H. pylori evade el ataque por el anfitrión inmune sistema y causa inflamación crónica,
indolente por varios mecanismos. El H. pylori puede dañar el sistema de defensa mucosal
reduciendo el grosor de la capa de gel de mucosidad, disminuyendo flujo de sangre de la
Representación esquemática de los pasos implicados en la síntesis de prostaglandina E2 (PGE2) y de prostaciclina (PGI2). Se muestran también las características y la distribución de las enzimas ciclooxigenasa (COX) 1 y 2. TXA2, tromboxano A2.
Fuente: libro de Harrison
Determinantes de patogenicidad
Fuente: vitae.ucv.ve/?module=articulo&rv=14&n=297...
ANATOMÍA PATOLÓGICA
81
mucosa, y relacionándose con el epitelio gástrico en todas partes de todas las etapas de la
infección. 2
Imagen. 24
Una vez que la bacteria llega al estomago se va hacia la pared, genera una gran cantidad
de ureasa, con lo que produce un ambiente de amoniaco que logra que la bacteria se
proteja frente a la acidez gástrica. Después, la bacteria atraviesa la mucosa gracias a la
producción de mucinasa; a continuación se adhiere a la pared del estomago, donde se
multiplica. Por otro lado, los tetrapéptidos bacterianos ejercen un importante efecto
quimiotáctico sobre eosinófilos y neutrófilos, los cuales, al activarse, provocan la liberación
de citocinas y favorecen así una respuesta inflamatoria, la cual lesionará aún más la
mucosa gástrica mediante la liberación de mediadores inflamatorios, como los metabolitos
del ácido araquidónico, radicales libres y factores activadores de plaquetas. Todos estos
metabolitos, junto con la presencia de la bacteria, inducen la liberación de interleucina 1 y
factores de crecimiento celular.15
En esta imagen se observan las distintas capas, asi como las sustancias o células que se encuentran en cada una de ellas. Así como tambien se observa el flujo disminuido de la mucosa, a causa de una falta de continuidad de la misma.
Fuente: Libro de harrison
ANATOMÍA PATOLÓGICA
82
La infección por H. pylori puede ser asintomática o producir un episodio de gastritis aguda
autolimitada. Puede permanecer colonizada la mucosa antral del estomago por muchos
años, desarrollándose una gastritis crónica. Una parte de esta colonización desarrolla
metaplasia epitelial duodenal de tipo gástrico y úlcera duodenal. Otra parte desarrolla
ulcera gástrica, y por ultimo en algunos casos ocurre atrofia y cáncer gástrico.
Parece que el modo de transmisión es persona-persona gastro-oral en forma de saliva,
vómitos o a través de instrumental como endoscopios, sondas gástricas, en los países
desarrollados; y feco-oral o a través de aguas contaminadas en los que están en vías de
desarrollo.
Imagen. 25
Fuente : http://edant.clarin.com/diario/2005/10/04/sociedad/s-03001.htm
ANATOMÍA PATOLÓGICA
83
Imagen.26
Esta imagen muestra los procesos por los que pasa la bacteria H. pylori, desencadenando una gastritis, una úlcera péptica o un adenocarcinoma gástrico.
Fuente: Netter Frank.H . Atlas de Anatomía Humana.
ANATOMÍA PATOLÓGICA
84
La mayor o menor agresividad de la infección por H. pylori y sus repercusiones clínicas
vienen determinadas por un lado por la citotoxicidad de la cepa bacteriana, y por otro por
la respuesta inmune desarrollada por el huésped, que podría estar determinada
genéticamente. El gen CagA (asociado a citotoxina) que está presente en la mayoría de
las cepas, codifica una proteína vacuolizante e incrementa la capacidad citotóxica. Todas
las cepas poseen el gen VacA que codifica para la proteína vacuolizante; pero sólo la
mitad de las cepas contienen la proteína que es la responsable de la vacuolización de la
célula epitelial. Se ha sugerido que la expresión de VacA estaría modulada por el gen
CagA.15
Mas del 80% de los pacientes con úlceras duodenales están infectados por cepas
positivas para el antígeno asociado con la citotoxina (CagA), la cual actúa como marcador
del islote de patogenicidad Cag, un fragmento de ADN que codifica 31 genes, algunos de
ellos participantes en los efectos proinflamatorios y tisulares dañinos de H. pylori. Por lo
tanto la infección por cepas Cag positivas se asocia con un mayor número de gérmenes
en el tejido, daño epitelial más intenso, inflamación aguda y crónica más intensa; mayor
probabilidad de ulcera péptica así como un riesgo aumentado de tener cáncer gástrico.
Uno de los genes importantes regulados por el CagA es el de la toxina vacuolante (VacA);
el gen CagA es esencial para la expresión de VacA. La toxina causa lesión celular
(caracterizada por la formación de vacuolas) in vitro y daño del tejido gástrico in vivo. El
VacA se comporta como un transportador pasivo de la urea, al aumentar la permeabilidad
del epitelio para la urea.
Las tensiones de H. pylori de vacA señalan la secuencia de tipo s1a que tiene que ver
con más inflamación gástrica; y la ulceración duodenal es el tipo de s1b. Las tensiones de
VacAs2 tienen que ver con menor inflamación y una prevalencia menor de ulcera.5
ANATOMÍA PATOLÓGICA
85
Imagen. 27
Proceso de ataque de H. pylori, mediante sus agentes citotóxicos ( CagA y VacA)
Fuente: Vaira D, Holton J, Menegatti M, et al., 2000. Review article: invasive and noninvasive tests for Helicobacter pylori infection. Alimentary Pharmacology and Therapeutics. 214:13–22.
ANATOMÍA PATOLÓGICA
86
Imagen. 28
En esta imagen se observa el origen de la bacteria H. pylori, así el cómo produce la ulcera péptica mediante las citotoxinas. Fuente : http://edant.clarin.com/diario/2005/10/04/sociedad/s-03001.htm
Por lo tanto se ha dedicado mucho interés a los posibles mecanismos por los que ese
diminuto germen espiral inclina el equilibrio en contra de las defensas mucosas. Algunas
posibilidades comprenden:
a) Aunque H, pylori no invade los tejidos induce una intensa respuesta
inflamatoria e inmune. Esta aumentada la producción de citocinas
proinflamatorias como (IL)-1, IL-6, factor de necrosis tumoral (TNF) y
sobretodo IL-8. Esta citocina es producida por las células epiteliales de la
mucosa, y recluta y activa los neutrófilos.
ANATOMÍA PATOLÓGICA
87
b) Varios productos de genes bacterianos participan en la lesión de las
células epiteliales y la inducción de la inflamación. H. pylori segrega una
ureasa que descompone la urea para formar sustancias tóxicas, como
cloruro de amonio y monocloramina. Los gérmenes elaboran también
fosfolipasas que dañan las células epiteliales superficiales, las proteasas
y las fosfolipasas bacterianas descomponen los complejos glucoproteína
lípido en el moco gástrico, lo que debilita la primera línea de la defensa
mucosa.
c) H. pylori aumenta la secreción del ácido gástrico y afecta la producción
del bicarbonato en el duodeno, con el que reduce el pH luminal en el
duodeno. Este ambiente alterado favorece la metaplasia gástrica
proporcionando areas para la colonización por H. pylori.
d) Varias proteínas de H. pylori provocan una respuesta inmune fuerte en la
mucosa.
e) La oclusión trombótica de los capilares superficiales es favorecida por un
factor bacteriano activador de las plaquetas.
f) Otros antígenos reclutan células inflamatorias hacia la mucosa; la
mucosa con inflamación crónica es más susceptible a la lesión por ácido.
Se cree que el daño de la mucosa permite la fuga de nutrientes tisulares hacia el
microambiente superficial, lo que proporciona sustento al bacilo.
Las ulceras pépticas son producidas por un desequilibrio entre los mecanismos defensivos
de la mucosa gastroduodenal y las fuerzas dañinas, en particular el acido gástrico y la
pepsina.
La ulcera gástrica tiene mayor probabilidad de recaer, en comparación con la ulcera
duodenal.
La ulcera recurrente tiende a repetirse en el sitio de la ulceras originales.7
ANATOMÍA PATOLÓGICA
88
La hiperacidez gástrica, cuando existe, puede ser fuertemente ulcerogénica. La
hiperacidez puede proceder de la masa aumentada de células parietales, el aumento a la
sensibilidad de estímulos secretores, o la alteración de la inhibición de los mecanismos
estimuladores, como la liberación de gastrina. El ejemplo clásico es el Síndrome de
Zollinger- Ellison, que cursa con múltiples ulceras pépticas en el estómago, el duodeno, e
incluso en el yeyuno, debido a la secreción de un exceso de gastrina por un tumor, y, en
consecuencia, producción excesiva de ácido gástrico.
El uso crónico de AINEs suprime la síntesis de prostaglandinas en la mucosa; la aspirina
también es un irritante directo.
Imagen. 29
El humo del tabaco altera el flujo sanguíneo y la capacidad de cicatrización de la mucosa.
No se ha demostrado que el alcohol cause directamente úlcera péptica, pero la cirrosis
alcohólica se asocia con aumento de la incidencia de tales ulceras.
En algunos pacientes con úlcera duodenal, el vaciamiento gástrico es demasiado rápido,
con lo que la mucosa duodenal es expuesta a una carga ácida excesiva.
Mecanismos por los cuales los AINEs producen lesión de la mucosa.
Fuente: libro de harrison
ANATOMÍA PATOLÓGICA
89
La úlcera duodenal también es más frecuente en pacientes con cirrosis alcohólica, EPOC,
insuficiencia renal crónica e hiperparatiroidismo.
La hipercalcemia estimula la producción de gastrina y por tanto la secreción de ácido.
Pese que el H. pylori y los AINE inician el daño por diferentes mecanismos, las
consecuencias clínicas tienen estrecha correlación con la cantidad de ácido (pH) y el
grado de activación del pepsinógeno en la luz del estomago.
La supresión de la secreción ácida con agentes farmacológicos aumenta el pH
intragástrico e inactivación del pepsinógeno, lo que facilita la cicatrización de la mucosa, la
reducción del sangrado y la disminución de otras complicaciones de la úlcera.
Hasta fechas recientes, se vio que los medicamentos supresores del ácido eran la piedra
angular del tratamiento antiulceroso, y los antiácidos, los protectores de la mucosa y la
cirugía, tenían funciones menores. El hecho de que la cicatrización de la ulcera se
presentaba después de la acidez, validaba el dictado de Schwartz: “sino hay ácido, no hay
úlcera”.
Se puede decir que casi todas la úlceras son manifestación de un padecimiento infeccioso,
gastritis por H. pylori.
Efectos del AAS y los AINE:
El AAS y la mayor parte de los AINE contribuyen a las manifestaciones de la úlcera
péptica de diversas maneras.
Dosis bajas de estos medicamentos (30 a 80 mg/día de AAS) originan disfunción
plaquetaria que incrementa el riesgo de sangrado de cualquier lesión del intestino.
Dosis algo mayores ocasión erosiones gástricas agudas, por lo general superficiales, que
producen hemorragias gástricas que suele ser oculta o de menor importancia, salvo en
sujetos con alteraciones en la coagulación.
Dosis mayores (14 a 21 tabletas de AAS por semana) tomadas durante mucho tiempo
originan ulceras crónicas.
ANATOMÍA PATOLÓGICA
90
Los efectos de AINE se deben a inhibición de la síntesis de prostaglandinas; éstas son
mediadores importantes de los mecanismos de defensa que protegen a la mucosa
gastroduodenal del ácido y de otros agentes dañinos.
Las prostaglandinas estimulan la secreción del moco y bicarbonato, aumentando la
hidrofobicidad de la superficie, con lo que hace que la mucosa se vuelva resistente a la
penetración del ácido.
ANATOMÍA PATOLÓGICA
91
FISIOPATOLOGÍA
Interviene una serie de factores en la producción de acido y en la defensa de la mucosa
que deben conocerse para comprender la Fisiopatología.
La mucosa gástrica es la encargada de producir la secreción gástrica, y de ella la capa
glandular es la más importante. Las glándulas gástricas son: cardiales, que secretan
exclusivamente moco y pepsinógeno; oxínticas situadas en el antro y también contienen
células G productoras de gastrina, así como células productoras de moco, serotonina y
hormonas digestivas.
Imagen. 30
En esta imagen se observa las sustancias que producen las distintas estructuras de una Glándula Gástrica
Fuente: www.dfarmacia.com/farma/ctl_servlet?_f=13...
ANATOMÍA PATOLÓGICA
92
Imagen. 31
Representación esquemática de la glándula oxíntica gástrica
Fuente: libro de Harrison
El epitelio de superficie es capaz de producir bicarbonato, necesario en la función de la
barrera mucosa gástrica. La lámina propia también contribuye a la fisiología gástrica, ya
que en su interior se encuentran los mastocitos productores de histamina y las células D
productoras de somatostatina, hormona reguladora de la secreción gástrica.
El jugo gástrico está constituido por agua, electrolitos, acido clorhídrico, factor intrínseco y
pepsina.
El acido clorhídrico es el responsable de la acidez del jugo gástrico y es secretado por las
células parietales, gracias a la acción de la bomba de protones, al parecer exclusiva de
estas células. Se conoce diferentes receptores en la membrana de las células parietales,
siendo los más estudiados los receptores para histamina (receptores H2), para gastrina y
para acetilcolina (receptores muscarínicos). Estos receptores, al reaccionar con sus
ANATOMÍA PATOLÓGICA
93
respectivos estimulantes promueven cambios intracelulares que dan como resultado la
producción de ácido clorhídrico.
Otra substancias capaces de estimular la producción de ácido son el calcio, bombesina y
encefalinas, presumiblemente por estimulo de la secreción de gastrina.
Dentro de las substancias con efecto inhibitorio de la secreción acida se encuentran la
somatostatina, calcitonina y dopamina.
El factor intrínseco es una glucoproteína producida por las células parietales, que se
encarga de transportar a la vitamina B12 de la dieta y se adhiere a los receptores ubicados
en el íleon terminal, permitiendo la absorción de la cobalamina.
Las células principales son responsables de la secreción de pepsinógenos, los cuales son
precursores inactivos de las pepsinas. La conversión de pepsinógenos a pepsinas se
realiza en medio ácido por escisión de algunos péptidos del pepsinógeno, siendo el
responsable de ello el ácido clorhídrico.
La pepsina es una enzima proteolítica potente que participa de manera importante en la
digestión de las proteínas de la dieta.
El moco gástrico se produce por las células mucosas de las glándulas gástricas y por las
células de revestimiento. Se trata de una capa que reviste la mucosa y está compuesta
por agua y glucoproteinas que participan en la barrera mucosa gástrica, a la que también
contribuyen el bicarbonato y las prostaglandinas.
Imagen. 32
Representación esquemática de la glandula gástrica, en donde se observa las distintas divisiones de cuello, cuerpo y fundus, así como las células y las sustancias que estas producen.
Fuente:gastrina.blogspot.com/
ANATOMÍA PATOLÓGICA
94
La secreción gástrica se puede dividir en dos fases:
Secreción basal: es la que se produce por efecto de estímulos endógenos,
dependiendo de un estímulo vagal constante denominado “tono vagal”
Secreción estimulada: tiene tres subfases
Cefálica: debida al estimulo vagal y que se desencadena por estímulos
olfatorios, gustativos y visuales.
Gástrica: tiene dos modalidades, el estimulo mecánico producido por la
distensión gástrica, que a través de reflejos nerviosos aumenta la secreción
de acido y el estimulo químico debido a la presencia en la luz del estomago
de los alimentos y que constituye el estimulo más potente de la secreción
gástrica. Otras substancias como el calcio, café y tabaco son estímulos
potentes para la secreción de acido.
Intestinal: es la menos conocida de todas, siendo, al parecer, de carácter
inhibitorio, principalmente por la llegada del jigo gástrico acido al duodeno y
la consecuente liberación de secretina por las células S localizadas en la
mucosa de este órgano.
En la fisiopatología de la enfermedad de úlcera péptica se presenta la secreción de ácido
gástrico y pepsina. Hoy, la secreción hipergástrica está asociada con gastrinoma
(síndrome Zollinger–Ellison), hiperplasia de células G, un aumento de la masa de células
parietales y un desequilibrio fisiológico entre las hormonas gástricas antagonistas como la
gastrina y somatostatina las cuales son una importante cuestión en la enfermedad de
úlcera péptica.2
Los mecanismos de la herida se diferencian claramente entre úlceras duodenales y
gástricas. La úlcera duodenal es esencialmente una enfermedad relacionada con H. pylori
y es causado principalmente por un aumento del ácido, carga de pepsina, y metaplasia
ANATOMÍA PATOLÓGICA
95
gástrico. La úlcera Gástrica, al menos es común en países del Occidente, países que más
comúnmente tienen que ver con la ingesta de AINE.
La gastritis de atrofia predomina en pacientes con úlceras gástricas, puede tener que ver
con la ulceración mucosal. En ambas condiciones, la úlcera tiene que ver con un
desequilibrio entre los factores protectores y agresivos, o con inflamación que es una
conducción causa de este desequilibrio.2
Se sabe que la acetilcolina es el mediador inicial en la vía nerviosa que se libera en las
fibras posganglionares en la mucosa gástrica como respuesta al estimulo vagal. Sin
embargo existen otros múltiples transmisores que desempeñan un papel fisiológico
importante.
El primer transmisor endocrino es la gastrina. Es esencial el papel de la histamina que por
vía paracrina va actuar sobre los receptores H2 de la célula parietal.
Las células productoras de histamina y de somatostatina tienen receptores para la gastrina
y la acetilcolina. Los mastocitos son las células productoras de la histamina.
Los receptores de gastrina pueden estimular la secreción de acido en las células
productoras de histamina. Sin embargo, la gastrina también induce elevación de la
somatostatina que tiene acción inhibidora sobre la secreción de ácido.
Los estímulos colinérgicos estimulan a la célula parietal e induce la elevación de
histamina, este estímulo inhibe también la elevación de somatostatina, lo que trae como
consecuencia mayor producción de ácido.
Imagen. 33
Regulación gástrica de la secreción
de ácido clorhídrico (HCl).
Fuente:
gsdl.bvs.sld.cu/cgi-bin/library?e=d-l0000-00-...
ANATOMÍA PATOLÓGICA
96
Imagen. 34
Regulación de la secreción de ácido gástrico a nivel celular. Fuente: libro de harrison
Sitio de acción de los antisecretores:
Los anticolinérgicos inhiben la secreción de ácido bloqueando a la célula parietal, a la
histamina y a los receptores de somatostatina o de muscarina.
El estimulo de la histamina se lleva a cabo activando la adenilciclasa. La acción
antisecretora de las prostaglandinas parece estar medida por una inhibición a nivel de la
adenilciclinasa.
Resistencia de la Mucosa a los agentes agresores
Como ya se menciono las células epiteliales superficiales secretan moco y bicarbonato. El
bicarbonato se secreta por debajo de la capa del moco creando un pH capaz de
neutralizar el ácido que penetra dicha capa mucosa.
ANATOMÍA PATOLÓGICA
97
Las células de la mucosa gastrina tienen la capacidad de resistir la retrodifusión del acido
de la luz gástrica tolerando un pH de alrededor de 2.
Existe un factor de crecimiento que es secretado por las glándulas salivales y que se
encuentra presente en el jugo gástrico a concentraciones elevadas y que une la
resistencia de esta capa superficial epitelial actuando por medio de receptores del factor
epidérmico de crecimiento.
El flujo sanguíneo de la mucosa normal moviliza al ácido si ha logrado penetrar en la
mucosa comprometida. Las células epiteliales superficiales continúan renovándose
rápidamente para restablecer la integridad de la mucosa. Las prostaglandinas aumentan la
resistencia de la mucosa a la agresión, estimulando la secreción de moco, la secreción de
bicarbonato, manteniendo la circulación sanguínea y favoreciendo la renovación celular.
Patogénesis de la enfermedad ulcerosa
La actividad acido péptica del jugo gástrico es suficiente apara digerir la mayor parte de
los tejidos y los agentes nocivos capaces de dañar la mucosa.
No ácido, no úlcera... la úlcera es péptica
Aproximadamente una tercera parte de las ulceras duodenales, pero no la gástrica,
secretan un exceso de ácido gástrico.
En la mayoría de estas úlceras duodenales hipersecretoras existe un aumento en la masa
de células parietales secretoras de ácido. La pepsina es secretada como un miembro de
la familia de los pepsinógenos, el cuela actúa solamente en un medio ácido.
La actividad proteólitica se reduce por arriba de un pH de 3.5 perdiéndose su actividad,
puede ser irreversible si se presenta un pH por arriba de 6.
ANATOMÍA PATOLÓGICA
98
Gastritis antral, Helicobacter pylori y úlcera gástrica.
La gastritis se ha encontrado en una alta proporción de pacientes con úlcera gástrica.
El Helicobacter pylori se ha encontrado en el antro en más del 95% de los pacientes con
úlcera duodenal, en cerca del 95% de los pacientes con úlcera gástrica.
Por otra parte la ocurrencia de H. pylori aumenta con la edad.
Fisiopatología de la úlcera por antiinflamatorios no esteroideos
Estos pueden producir alteraciones importantes en la mucosa y ulceración.
El mecanismo por el cual se producen estas ulceraciones es múltiple. Las aspirina puede
producir daño directo local por lesión de la mucosa, alteración de pH. Lo mismo sucede
con antiinflamatorios no esteroideos o con la administración rectal de los mismos; y la
explicación es que se produce una inhibición de las prostaglandinas.
Papel del ácido en los antiinflamatorios no esteroideos
Los inhibidores de los receptores H2 son menos efectivos que las prostaglandinas
sintéticas para prevenir la úlcera gástrica, pero no la ulcera duodenal.
Los pacientes con úlcera duodenal muestran una secreción ácida basal mas elevada que
la normal y una mayor secreción basal con relación a la secreción ácida máxima. Existen
datos que indican que la excitación del nervio vago determina la secreción de acido y la
sección de dicho nervio se acompaña de una reducción de dicha secreción.
Hipergastrinemia Basal:
Existen siete causas poco comunes de hipergastrinemia asociada con la úlcera duodenal:
Gastrinoma: es un tumor que libera grandes cantidades de gastrina que
traen como consecuencia una secreción ácida excesiva y una enfermedad
ANATOMÍA PATOLÓGICA
99
ulcerosa severa. La reducción de la secreción ácida a menudo puede
lograrse mediante la administración de antagonistas de los receptores H2
(cimetidina, ranitidina). El tumor debe ser extirpado en la medida de lo
posible, pero solamente es posible en un 10% de los pacientes.
Hipercalcemia: estimula un incremento de la secreción de gastrina y de
ácido gástrico.
Resección amplia del intestino delgado: se asocia con una hipergastrinemia
y un incremento de la acidez gástrica, más probablemente como
consecuencia de la perdida de enterogastrona, una hormona intestinal que
inhibe la liberación de gastrina y la secreción ácida gástrica.
Insuficiencia Renal: debido a una disminución de la gastrina a nivel de los
riñones.
Obstrucción al flujo gástrico de salida.
Hiperplasia de las células G antrales.
Síndrome del antro excluido: una porción del antro se encontrara excluido
del ácido producido por el estomago, ya que la continuidad intestinal se
restablece mediante una gastroyeyunostomía.
Varias sustancias además de la gastrina pueden estimular o inhibir la secreción ácida.
La histamina, actúa localmente para estimular la secreción ácida.
ANATOMÍA PATOLÓGICA
100
Acetilcolina: potencia un efecto de la gastrina y de la histamina sobre la
secreción ácida. El vago es principalmente un nervio colinérgico y su
sección reduce la secreción ácida.
Bombesina: libera gastrina mediante una activación directa sobre la
célula G.
Colecistoquinina: potencia la secreción pancreática de bicarbonato
estimulada por la secretina y retarda el vaciamiento gástrico. El
bicarbonato pancreático neutraliza el ácido en el duodeno y la velocidad
de vaciamiento gástrico gobierna la oferta de ácido al duodeno. La
reducción de los niveles de CCK podría entonces contribuir a la
formación de úlcera al permitir un vaciamiento acelerado de ácido en el
duodeno y disminuir la secreción de bicarbonato.
Secretina: inhibe la liberación de gastrina estimulada por las comidas.
Estimula la secreción pancreática del bicarbonato. La acidificación
duodenal excesiva usualmente se asocia con un aumento de los niveles
de secretina.
Péptido inhibitorio gástrico: inhibe la secreción ácida en respuesta a
muchos estímulos; los niveles de este aumentan en cada comida.
Péptido Intestinal vasoactivo: inhibe la secreción acida gástrica y
estimula la secreción pancreática.
Somatostatina: inhibe la liberación de gastrina y la secreción ácida
gástrica en respuesta a prácticamente cualquier estímulo
ANATOMÍA PATOLÓGICA
101
CUADRO CLÍNICO
Imagen. 35
TABLA. 5
En la imagen se observan algunos síntomas de la úlcera péptica: dolor en el epigastrio, nauseas
Fuente :www.infogastro.es/1028607/
TIPO DE ÚLCERA
DATOS CLINÍCOS
Úlcera Duodenal
Imagen. 36
Se observa una úlcera duodenal.
Fuente: www.fluvium.org/textos/vidahumana/vid129.htm
Es posible que no haya síntomas o sean vagos y
atípicos. En los casos típicos el dolor se describe
como ardoroso, tipo cólico, corrosivo, molesto o
pirosis. Suele ser leve a moderado. Localizado
en una área pequeña epigástrica, cerca de la
línea media y xifoides. Puede irradiarse abajo en
los bordes costales, hacia la espalda, o rara vez
al hombro derecho. Es posible que haya
náuseas, vómito de pequeñas cantidades de jugo
gástrico muy ácido. La molestia suele ocurrir 45 a
60 minutos después de una comida, casi nunca
antes del desayuno; empeora a medida que
transcurre el día y puede ser más grave entre las
12 de la noche y las 2 de la madrugada. Lo típico
del dolor por úlcera duodenal es su ritmicidad, es
decir, que se mejora con la ingestión de
alimentos, leche o antiácidos Los signos incluyen
hipersensibilidad epigástrica superficial y
profunda, defensa muscular voluntaria y
ANATOMÍA PATOLÓGICA
102
espasmo unilateral.
Úlcera Gástrica
Imagen. 37
Ulcera gástrica con bordes poco marcados.
Fuente: www.zonamedica.com.ar/.../ulcerapeptica.htm
Es posible que no haya síntomas o solo sean
vagos o atípicos. Existe molestia epigástrica que
se describe como corrosiva, ardorosa, adolorida,
o “ardores de hambre”, que se refieren en
ocasiones al área subcostal izquierda. Los
episodios suelen ocurrir 45 a 60 minutos
después de una comida y se alivian con
alimentos alcalinos o vomitando. Es común que
haya pérdida de peso y fatiga.
Por este motivo los pacientes con ulcera
gástrica evitan comer, reduce la ingestión y baja
de peso.
El dolor de la ulcera gástrica también se
presenta en la noche, pero es menos común que
en la ulcera duodenal. El dolor se irradia hacia
atrás y a veces al cuadrante superior izquierdo.
Úlcera del Estroma
(Marginal) (Úlcera yeyunal)
Imagen. 38 En la imagen se observa varias
ulceras duodenales
Fuente: www.cursosparamedicos.com/atlas/esto_2.htm
El dolor abdominal es ardoroso o corrosivo. Se
localiza en la parte baja del epigastrio, incluso
más abajo del ombligo, y con frecuencia a la
izquierda. Suele cubrir un área amplia e
irradiarse a la espalada. El ritmo de alimento y
dolor suele ocurrir antes de una hora. Es común
que haya náuseas, vómito y pérdida de peso.
Puede palparse un masa inflamatoria. Es
frecuente que haya anemia y sangre oculta en
heces.
ANATOMÍA PATOLÓGICA
103
Síntomas y Signos:
A. Presentación Típica:
El síntoma principal de la úlcera péptica es el dolor epigástrico o dispepsia, que ha
menudo se describe como “urente” o “quemante”, “molestia continua” o “hambre con
dolor”. 9 imagen. 41
Imagen. 40
Síndrome de Zollinger- Ellison (Gastrinoma)
Imagen. 39
El dolor es de la variedad típica de ulcera
péptica, pero más difícil de controlar. Puede
haber diarrea secundaria a la hipersecreción o
por inactivación de la lipasa cuando disminuye el
pH del intestino delgado debajo de 6.5,
interfiriendo así en la digestión de grasas. Es
común que haya hemorragias, perforación y
obstrucción.
Se observa un gastrinoma después de una duodenotomía
Fuente: www.nature.com/.../nrclinonc.2009.82_F3.html
Dolor en el epigastrio a causa de la úlcera péptica, por lo regular, este dolor tiende a presentarse por las nochces.
Fuente: revista.consumer.es/.../20030401/salud/58875.php
Representación del dolor epigástrico, que se describe como “quemante”
Fuente:
http://www.expofarmacia.com.ar/actualidad.php?id=236
ANATOMÍA PATOLÓGICA
104
La otra característica del dolor por la ulcera es su periodicidad, es decir, lo síntomas
ulcerosos tienden a reaparecer a intervalos de semanas o meses. Durante los periodos de
exacerbación el dolor se presenta todos los días por un periodo de semanas y luego
remite hasta la siguiente recurrencia.
En la ulcera gástrica o duodenal, un incremento marcado de la intensidad del dolor o la
irradiación a todo el abdomen, puede indicar que la ulcera se ha perforado.
Las úlceras pépticas crónicas en estomago o duodeno llegan a producir cicatrices que
impiden el vaciamiento gástrico, a esto se le conoce como obstrucción al vaciamiento
gástrico. Esto origina náuseas y vómito, lo que hace que disminuya el dolor o la molestia.
El vomito de la obstrucción al vaciamiento gástrico se presenta poco después de haber
comido o hasta varias horas más tarde.
Los síntomas de reflujo gastroesofágico ácido, como pirosis (sensación de ardor que sube
desde el estómago hasta la faringe) o regurgitación, son frecuentes en los pacientes con
úlcera. Sin embargo lo que produce la pirosis es el reflujo gastroesofágico y no la ulcera
péptica.
Imagen. 42 imagen. 43
En esta imagen se observa un estómago que presenta un cierre normal después del paso del bolo alimenticio en comparación con un estómago que presenta reflujo.
Fuente:
doctorfelipeluna.blogspot.com/2007/12/reflujo...
En esta imagen se puede observar la diferencia de un esófago normal, en comparación con un esófago que presenta un reflujo gastroesofágico.
Fuente: http://www.intramed.net/contenidover.asp?contenidoID=40063
ANATOMÍA PATOLÓGICA
105
Generalmente el dolor es de poco o mediana intensidad y depende del sitio, tamaño,
penetración de la lesión, así como del umbral doloroso del paciente.
B. Presentación Atípica:
Las presentación atípicas de la ulcera péptica son frecuentes.
Aquí muchas veces los pacientes pueden ser asintomáticos o quejarse de “indigestión” o
tener algunos otros síntomas dispépticos vagos, que son muy inespecíficos, y en la
mayoría de los pacientes, no se deben a ulcera.
Menos del 1% de las ulceras duodenales se relacionan con un trastorno hipersecretor,
como el Síndrome de Zollinger- Ellison, mastocitosis sistémica, leucemia granulocítica o
hiperparatiroidismo, o se presenta después de una resección de intestino delgado. Los
datos clínicos que indican la existencia de este trastorno son diarrea, pérdida de peso y pH
gástrico cercano a 1.0 constantemente.
La ulcera péptica frecuentemente obedecen a múltiples complicaciones y una de las más
graves es la perforación libre a la cavidad, lo cual ocurre entre un 2 y 5 % de los pacientes
con enfermedad ulcerosa, superado únicamente por la hemorragia, que precisa de
tratamiento quirúrgico urgente.1
Un cuadro peritoneal por perforación de una ulcera gástrica o duodenal puede ser la
primera manifestación de una “ulcera silenciosa”. Este tipo de ulceras pueden encontrarse
en una endoscopia de rutina.
Los cuadros de hipoglucemia acompañados de sensación de hambre dolorosa puede
simular al síndrome doloroso.
Fenómenos que calman o exacerban el dolor:
Los antiácidos cuando no hay complicación de la úlcera hacen, con frecuencia que
desaparezca el dolor. También los inhibidores de los receptores H2 hace que la intensidad
del dolor de la ulcera desaparezca.
Los alimentos que aumentan la intensidad del dolor son los cítricos, las bebidas
alcohólicas; la aspirina, los salicilatos y antirreumáticos.
ANATOMÍA PATOLÓGICA
106
Otras manifestaciones clínicas de la enfermedad ulcerosa
El apetito generalmente se conserva, pero cuando disminuye se debe pensar en estenosis
pilórica con retención. En la úlcera gástrica la pérdida del apetito debe hacer pensar en la
posibilidad de carcinoma.
Náusea y Vómito:
Son más frecuentes en los enfermos con úlcera gástrica. Generalmente la presencia de
vómito implica la iniciación o la presencia de complicaciones, tales como edema,
penetración, o estenosis. Si el vomito es ácido y no hay restos de alimentos, se debe
pensar en aumento de la actividad ulcerosa y penetración. Si hay restos de alimentos
debe pensarse en estenosis pilórica.
Imagen. 44
Esta imagen es una representación de las malestares que
produce la úlcera péptica; presenta nauseas.
Fuente
: http://radio.capital.com.pe/informativocapital/2010/05/23/la-gastritis/
Pérdida de peso:
Se manifiesta principalmente en los enfermos de úlcera gástrica , en los cuales hay
estenosis pilórica.
ANATOMÍA PATOLÓGICA
107
Las complicaciones de la ulcera péptica son hemorragia, perforación, penetración y
obstrucción.
En ausencia de tratamiento, la curación de una ulcera duodenal o gástrica tarda una
media de 15 años.
La exploración física puede ser totalmente normal o haber tan sólo dolor a la palpación
profunda en el epigastrio.9 Es de interés la búsqueda de signos de enfermedades
asociadas, en especial cardíacas, respiratorias o hepáticas. En ocasiones la exploración
revela alguna de las posibles complicaciones, como palidez cutáneo-mucosa en caso de
hemorragia, abdomen en tabla con signos de irritación peritoneal si hay perforación, o la
presencia de bazuqueo gástrico en ayunas que sugiera estenosis pilórica
Anemia, hematemesis, melena,vómitos sugiere la obstrucción; anorexia o pérdida de peso
sugiere el cáncer; persistencia superior abdominal el dolor que irradia a la espalda sugiere
la penetración; y severo, extendiéndose superior abdominal el dolor sugiere la perforación.
Pacientes más viejos que55 años y aquellos con síntomas despertadores debería ser
mandado para la pronta endoscopia superior.9
ANATOMÍA PATOLÓGICA
108
MÉTODOS DIAGNÓSTICOS
El diagnóstico de la enfermedad de úlcera péptica es por lo general basado en rasgos
clínicos y específico de las pruebas.9
El diagnóstico de la infección por H. pylori puede realizarse mediante métodos directos
(endoscópicos) o métodos indirectos (no endoscópicos). Los métodos diagnósticos
directos incluyen la histología, el cultivo, la tinción de Gram y el test de la ureasa.
Los métodos diagnósticos indirectos incluyen la serología, la prueba del aliento y la
detección de antígenos de H.pylori en heces. Los dos métodos más utilizados son el test
de la ureasa y la prueba del aliento, basados ambos en la capacidad de H.pylori de
producir grandes cantidades de ureasa.11
GABINETE
Estudios radiológicos:
Imagen. 45
Representación de estudios radiológicos
Fuente: www.publiespacios.net/.../radiologia.htm
Las radiografías simples de abdomen son de poca utilidad en el diagnóstico de la ulcera
péptica a menos que se sospeche de perforación. En tal caso, las radiografías de pie o en
decúbito lateral mostrarán aire libre en cavidad.
ANATOMÍA PATOLÓGICA
109
Los médicos que sospechen una úlcera, deben considerar la realización de una serie
gastroduodenal con bario, con contraste único o de preferencia con doble contraste. La
serie gastroduodenal es un estudio no invasivo, seguro y la información que proporciona
por lo general conduce a un diagnóstico preciso de enfermedades del esófago, estómago
y duodeno. En ocasiones su eficacia es limitada y puede ser necesario realizar estudios
adicionales como la tomografía computada.
La serie gastroduodenal consiste en revestir o llenar el tubo digestivo superior con un
medio de contraste llamado bario, es un elemento que se ve blanco brillante en las
radiografías y que se ingiere antes del estudio; algunos pacientes deben tomar además
cristales de bicarbonato de sodio para producir gas, por lo que se obtienen radiografías
más nítidas, a este procedimiento se le llama de doble contraste. El bario líquido sabe a
gis, pero a menudo se le agrega sabor a fresa o chocolate. Si le dan cristales para
producir gas, es posible que le den deseos de eructar, pero es necesario retener este gas
para obtener imágenes adecuadas.
Para realizar el estudio se requiere ayuno por lo menos de 3 horas, aunque lo ideal es que
sean 8. Tampoco se debe mascar chicle ni fumar porque estas actividades pueden
aumentar las secreciones del estómago y afectar la calidad del estudio. Una vez que está
revestido con bario, se toman radiografías en diferentes posiciones, el examen por lo
general se hace en 20 minutos.
Después del examen, el paciente puede reanudar su dieta normal y tomar sus
medicamentos orales. El bario al eliminarse puede hacer que las heces sean blancas o
grises por 2 ó 3 días además en ocasiones producen estreñimiento temporal, que
habitualmente se trata con un laxante.
La serie gastroduodenal es un estudio no invasivo, seguro y la información que
proporciona por lo general conduce a un diagnóstico preciso de enfermedades del
esófago, estómago y duodeno. En ocasiones su eficacia es limitada y puede ser necesario
realizar estudios adicionales como la tomografía computada.
ANATOMÍA PATOLÓGICA
110
Imagen.46
Estómago normal
Úlcera gástrica
Úlcera duodenal
Radiografías que muestran un estómago normal, en comparación con un estomago que presenta una úlcera gástrica y otro que muestra una úlcera duodenal.
Fuente: www.drscope.com/.../generales/radiologia/f8.html
ANATOMÍA PATOLÓGICA
111
Imagen. 47
Radiografía en la que se muestra una úlcera duodenal
Fuente: http://www.smiba.org.ar/revista/smiba_01/abdome2.htm
Imagen. 48
Gran nicho de aspecto péptico, estudio radiológico y endoscópico. Biopsias múltiples
demostraron su etiología péptica. El control endoscópico tras 4 semanas de tratamiento con
antisecretores permitió ver una pequeña cicatriz residual
Fuente: http://www.smiba.org.ar/revista/smiba_01/abdome2.htm
ANATOMÍA PATOLÓGICA
112
Endoscopia:
Imagen. 49
Representación del procedimiento endoscópico ( un método diagnóstico para la exploración de una úlcera péptica)
Fuente:
http://www.medicoscolombia.com/medicosecuador/espanol/articulos/140.htm
La endoscopia gastroduodenal alta se ha convertido en el “estándar de oro” para el
diagnostico de las ulceras pépticas, aunque está por debajo de ser perfecta.
La endoscopia es esencial para un diagnóstico exacto y diagnóstico diferencial de la
enfermedad de úlcera péptica y sus complicaciones (p. ej una ulcera gástrica también se
le puede realizar una biopsia para tener tejido y excluir la malignidad por H. pylori, esto
realizado por medio de una endoscopia).2
En la mayor parte de las series, más del 90% de las lesiones se diagnostica con
endoscopia.
ANATOMÍA PATOLÓGICA
113
Pueden pasar inadvertidas algunas ulceras o cráteres gástricos cuando los pliegues del
estomago son muy prominentes, secreciones abundantes o hay coágulos en el estomago,
así como cuando las ulceras están en la parte alta del estomago, en el fondo o en una
hernia hiatal.
Consiste en una revisión sistemática y dirigida que en poco tiempo localiza el sitio, aspecto
y tamaño de cualquier lesión, permite obtener muestras de tejido para análisis
histopatológico.
Los genotipos de CLOtests positivo de H. pylori son desarrollados para determinar los
genotipos vacA y estado cagA de úlcera duodenales y para uso rutinario. Las ventajas de
usar el CLOtests sería una reducción del número de biopsias tomadas durante la
endoscopia y el aseguramiento de la presencia de los genotipos de H. pylori.5
Básicamente, en Japón, los pacientes son perseguidos sin la prescripción de cualquier
medicina de antiúlcera y se someten a la endoscopia complementaria una vez al año.7
Imagen. 50
Endoscopia digestiva alta. Ulcera gástrica angular, callosa, de 3 cm de
diámetro. Fuente :
http://seram2006.pulso.com/modules/posters/files/figura20_recidivamu2_ax.jpg
Indicaciones generales para la realización de la endoscopia:
o Para realizar el diagnóstico de úlcera duodenal o gástrica, y obtención de
biopsias para determinar H. Pylori (si está indicado) y/o excluir la presencia
de células malignas.
ANATOMÍA PATOLÓGICA
114
o Comprobación de la cicatrización completa en la úlcera gástrica después de
8-12 semanas de tratamiento farmacológico.
o Persistencia de la sintomatología en la úlcera duodenal después de 8
semanas de tratamiento farmacológico.
o Presencia de síntomas y signos de alarma.
o Historia previa de úlcera gástrica (más de 15-20 años).
o Cirugía gástrica previa.
o Radiología barritada sospechosa.
o Para realizar el diagnóstico etiológico de la estenosis pilórica.
o Sintomatología dispéptica en un paciente con historia familiar de primer
grado de neoplasia gástrica.
Imagen. 51
Representación donde se aprecia los sitios de las úlceras pépticas
fuente: http://163.178.103.176/CasosBerne/4dCardiovascular/Caso161/HTMLC/CasosB2/Hema/Ulcera1.htm
ANATOMÍA PATOLÓGICA
115
Imagen. 52
CICATRIZ DE ULCERA DUODENAL ANTIGUA
Al ingresar al bulbo duodenal, investigando una dispepsia ; nos hemos encontrado con esta
cicatriz (línea blanca visible) que forma el contorno de un divertículo duodenal (parte superior
de la foto). En estos casos siempre se debe tomar biopsia antral para descartar la presencia de
Helicobacter Pylori.
Imagen. 53
Endoscopia donde se muestra una cicatriz de úlcera duodenal antigua
Fuente :http://endoscopiaenlapractica.blogspot.com/2010/06/cicatriz-de-ulcera-duodenal-antigua.html
Imagen de endoscopía baja, múltiples úlceras.
fuente: http://www.univalle.edu/publicaciones/revista_salud/revista04/pagina10.htm
ANATOMÍA PATOLÓGICA
116
LABORATORIO
Serología:
Existen pruebas de anticuerpos cualitativas y cuantitativas. Las cuantitativas, permite la
cuantificación del título de anticuerpos. Las pruebas cualitativas utilizan suero o sangre
total obtenida por punción digital para identificar la presencia o ausencia de anticuerpo de
inmunoglobulina G (Ig G) a la infección por H. pylori.
Las pruebas de anticuerpos son atractivas por su bajo costo y gran disponibilidad.las
pruebas cualitativas son menos precisas que las pruebas cuantitativas.
La prueba de la ureasa es rápida y sencilla: se basa en la capacidad del H. pylori de
producir ureasa. Se realiza con una biopsia del antro gástrico, tomada durante la endos-
copía, que se coloca en un tubo con urea y un indicador. Si la muestra contiene ureasa
aumenta el pH y cambia el color de la solución. Pueden producirse resultados falsos
negativos si la cantidad de bacterias en el estómago es pequeña y en casos de
hemorragia digestiva.15
Pruebas de ureasa no endoscópicas:
Las pruebas de ureasa en aliento o sangre son no invasivas, e identifican solo a los
pacientes con infección activa por H. pylori.
Estas pruebas dependen de la producción de grandes cantidades de ureasa bacteriana
producida por H. pylori.
El test de aliento con 13C-urea se basa en la capacidad de la ureasa producida por H.
pylori para hidrolizar una solución ingerida de urea marcada con 13C y liberar CO2. El
CO2 marcado se absorbe, difunde a la sangre, se transporta a los pulmones y de allí se
excreta a través del aire espirado. El 13C es un isótopo no radioactivo, por lo que se
puede repetir la prueba tantas veces como sea necesario, incluso en niños y
embarazadas.15
ANATOMÍA PATOLÓGICA
117
Imagen. 54
Representación de la prueba de aliento o determinación de urea marcada con C13.
fuente: wwwemerlab.blogspot.com/
Prueba de antígeno fecal:
Utiliza anticuerpos policlonales anti H. pylori de captura absorbidos en pozos
microscópicos.
Esta prueba identifica enfermos con infección activa por H. pylori.
Los estudios preliminares muestran que la prueba de antígeno fecal es útil como medida
para establecer si ha habido una curación con el tratamiento antimicrobiano.
Después de la colección, las muestras de heces se almacenan a 2 a 8°C por tres días y a
-20° C por tiempo indefinido.
Los aspectos que han impedido el uso generalizado de esta prueba son la incomodidad
inherente relacionada con el manejo y almacenamiento de la muestra fecal.
Biopsia:
En pacientes con ulcera péptica diagnosticada por endoscopia, pueden tomarse biopsias
para buscar datos de infección por H. pylori. Las técnicas principales por las cuales se
puede diagnosticar H. pylori en el momento de la endoscopia son la prueba rápida de
ureasa, estudio histológico y cultivo.
ANATOMÍA PATOLÓGICA
118
Imagen. 55
imagen.56
Imagen donde se puede observar el método diagnóstico
de Biopsia para la toma de un fragmento de úlcera péptica
Fuente:
http://www.endoscopiacurso.com.br/FotosEndoscopia_esp.htm
Úlcera duodenal con sangrado tipo Forrest . Vasocontricción con adrenalina.
fuente: scielo.sld.cu/scielo.php?pid=S0138-6557200700...
ANATOMÍA PATOLÓGICA
119
Imagen. 57
ULCERA DUODENAL: Gran úlcera ovalada de la primera porción del duodeno, de borde nítido y fondo hemorrágico (La úlcera está perforada al páncreas).
Prueba rápida de ureasa: utilizan una tira reactiva que contiene urea y un
indicar sensible al pH. Las biopsias de mucosa obtenidas durante la
endoscopia se colocan en la tira reactiva. Si hay H. pylori, la ureasa hace
que se eleve el pH ambiental. Se recomienda tomar dos biopsias, una
del cuerpo y otra del antro del estomago. Su costo es relativamente bajo
y, por lo tanto, es la manera más costo – eficacia de establecer la
presencia de infección por H. pylori.
Esta prueba solo brinda información de la presencia o ausencia de H.
pylori, mas no permite identificar alguna neoplasia gástrica.
Histología: La tinción común de hematoxilina y eosina permite la
identificación del microorganismo. El hallazgo de polimorfonucleares en
tejido gástrico inflamado es muy sugestivo de gastritis por H. pylori.
El estudio histológico y la tinción con hematoxilina y eosina o giemsa es
una de las pruebas más comunes por su sencillez, rapidez y bajo costo.
Es una prueba de alta sensibilidad (93 a 96%) y especificidad (98 a
99%).15
Esta imagen representa un tipo de biopsia de pieza de una úlcera péptica.
fuente: http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica/imagenes_ap/patologia467-471.html%7F
ANATOMÍA PATOLÓGICA
120
Imagen. 58 imagen.59
Corte Histológico, en el que se observa una úlcera subaguda.
Fuente: Netter Frank.H . Atlas de Anatomía Humana.
Imagen.60
Corte Histológico en donde se observa la descontinuidad de la mucosa, originando asi una úlcera crónica. Presenta una tinción con Hematoxilina – eosina.
Fuente: Netter Frank.H . Atlas de Anatomía Humana.
Fuente: Netter Frank.H . Atlas de Anatomía Humana.
ANATOMÍA PATOLÓGICA
121
Imagen.61 imagen.62
Imagen.63
Gastritis Aguda, La mucosa cerca de una úlcera gástrica muestra gastritis superficial con hiperplasia foveolar y hemorragia ( Atlas de Enfermedades del Tracto gastrointestinal superior ExecutiveeditorsOttenjam- Elster,pg. 129 Fig 3(13)
fuente: http://www.facmed.unam.mx/deptos/anatomia/computo/Estomago/Image223.gif
Corte histológico donde se presenta una úlcera duodenal .
Fuente: Netter Frank.H . Atlas de Anatomía Humana.
.
ULCERA GASTRICA CRONICA ACTIVA: Corte a bajo aumento, que muestra pared
gástrica con una úlcera profunda: hay interrupción de la mucosa, submucosa y túnica
muscular. El fondo de la úlcera está ubicado a nivel de la subserosa. Se reconoce en
él una delgada banda amarillo-negruzca (formada por fibrina, polinucleares y restos
nucleares); por debajo, el callo de la úlcera, formado por tejido granulatorio con
fibrosis, en el espesor del cual se observan vasos sanguíneos y acúmulaciones
redondeadas de linfocitos, de color negro. Nótese que los cabos de la túnica muscular
propia están traccionados hacia arriba, acercándose a la mucosa. (tinción de Van
Gieson).
fuente: http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica/imagenes_ap/patologia467-471.html%7F
ANATOMÍA PATOLÓGICA
122
Imagen.64
Regeneración patológica atípica. Mucosa gástrica en regeneración sobre cicatriz de úlcera. Al centro, mucosa en regeneración, muy delgada; a los lados, algo menos delgada, con formaciones a manera de papilas. H-E, 32x
fuente: http://escuela.med.puc.cl/paginas/Cursos/tercero/patologia/fotosRegeneracion.html
Imagen.65
ULCERA GASTRICA CICATRIZADA: Corte histológico de pared gástrica, a muy bajo aumento. En la zona central, una cicatriz de úlcera, revestida por mucosa regenerada, más delgada e irregular que la mucosa normal. En la zona de la cicatriz se observa la interrupción de la muscular de la mucosa y de la muscular propia, que tienden a acercarse. Hay fibrosis de la subserosa. En el tejido adiposo del epiplón hay tres ganglios linfáticos.
fuente: http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica/imagenes_ap/patologia467-471.html%7F
Imagen.66
Representación donde se observa un corte histológico de úlcera péptica. Los bordes se encuentran limitados por tejido necrótico
fuente : http://escuela.med.puc.cl/paginas/publicaciones/anatomiapatologica/04digestivo/4estomago_1.html
ANATOMÍA PATOLÓGICA
123
Izquierda. Mucosa gástrica con intenso infiltrado inflamatorio agudo y un foco de erosión con pérdida de epitelio superficial y glandular.
Derecha. Ulcera péptica con las características capas de Ascanazzi: (superficie con necrosis y detritus celulares). Tejido de granulación subyacente con infiltrado
inflamatorio agudo. Zona de inflamación crónica. Base de la úlcera con fibrosis de la
paredtestinal.
Imagen.67
Cultivo : Es posible cultivar H. pylori de biopsias gástricas, pero el
proceso es muy lento, complicado y costoso. Por todo esto pocas veces
se recurre al cultivo. La ventaja principal del cultivo es la posibilidad de
determinar la sensibilidad de los aislados de H. pylori a los antibióticos.
Imagen.68
H. pylori crece en medios de cultivo artificiales con suplemento de sangre o derivados, después de 3 a 5 días de incubación en atmósfera microaerofílica y a 35ºC. fuente: www.helicobacterspain.com/imagenes/placa2.htm
ANATOMÍA PATOLÓGICA
124
La presencia de H. pylori puede sea confirmado con un suero (ELISA), aliento de la
prueba de urea, prueba de antígeno de taburete, o biopsia endoscópica. El Suero ELISA
es la prueba menos exacta y sólo es útil para diagnosticar la infección inicial.9
ANATOMÍA PATOLÓGICA
125
COMPLICACIONES
Imagen.69
En esta imagen se representa de forma general las complicaciones de las úlcera pépticas
fuente: http://www.lifespan.org/adam/spanishhealthillustratedencyclopedia/6/19235.html
Existen varias complicaciones persistentes o irreversibles, algunas se presentan a
continuación:
Hemorragia:
Las guías de las ASGE consideran tres categorías en el sangrado gastrointestinal
superior:
1) Hemorragia Activa: puede ser torrencial o menos severa, que usualmente se
manifiesta por hematemesis o contenido rojo o rosado por la sonda nasogástrica.
Requiere de múltiples trasfusiones y la evidencia de hipovolemia es frecuentemente
observada.
2) Hemorragia Aguda: Pérdida sanguínea autolimitada, y se establece la cesación del
sangrado por estabilidad hemodinámica y la no evidencia de sangrado fresco.
ANATOMÍA PATOLÓGICA
126
3) Sangrado Cónico, de semanas o meses. Las manifestaciones son por sangrado
oculto o anemia ferropénica.
Imagen.70
Ulcera gástrica con sangrado activo
La endoscopia muestra un estomago lleno de sangre y un gran coagulo junto a un sangrado activo en zona prepilorica.
fuente: http://www.solociencia.com/videos/online/Ulceras%20estom
ago/
Imagen. 71
Obstrucción:
La obstrucción al vaciamiento gástrico es una complicación frecuente de la enfermedad
ulcerosa péptica, que ocasiona retención gástrica, por lo que aquí la endoscopia es
importante para excluir otras lesiones, y para la colocación de un balón de dilatación que
alivie la obstrucción.
En esta imagen se puede apreciar una úlcera péptica con hemorragia.
fuente:
http://www.flickr.com/photos/75466669@N00/4747784818/
ANATOMÍA PATOLÓGICA
127
Penetración:
Esta se sospecha cuando el dolor se torno persistente e intenso; cuando hay penetración
al páncreas, existe irradicación al dorso y a demás es nocturno y no responde al
tratamiento médico.
Estas ulceras pueden llegar a salvar o perforarse libremente.
Perforación:
En estos casos debe llevarse a cabo cirugía de urgencia. El diagnostico puede
establecerse por la intensidad y la persistencia del dolor, por los datos de resistencia
muscular y dolor en la pared abdominal; por la existencia de aire libre y desaparición de la
matidez hepática, por el estado de choque .
Imagen. 72
Se presenta las diversas capas del estómago, presentándose en ellas una erosión (úlcera).
Fuente:
http://ulceraduodenalug.blogspot.com/
ANATOMÍA PATOLÓGICA
128
Imagen. 73
Representación de un estomago que presenta diversas perforaciones.
Fuente: www.infogastro.es/1028607/
Imagen. 74
Estenosis: cuando la cicatriz que se produce en úlceras antiguas provoca una estrechez
del intestino y dificulta el paso del alimento.
Representación de cómo afecta un AINEs al estomago , pudiendo provocar ulceraciones y posteriormente perforaciones
Fuente: www.infogastro.es/1028607/
ANATOMÍA PATOLÓGICA
129
TRATAMIENTO
Imagen.75
La extirpación de H. pylori y/o terapias antisecretoras son el pilar de estrategias para el
tratamiento de hoy.2
Para poder dar un tratamiento es conveniente conocer el tipo y actitud psicológica del
paciente, su profesión o tipo de trabajo, el tipo y horario de alimentación, sus hábitos
relacionados habitualmente con el tabaquismo, alcoholismo, ingestión de medicamentos,
principalmente AINEs, así como la ingestión de medicamentos antiulcerosos, para conocer
su efecto previo o para ver si el paciente lo ha estado tomando en forma adecuada
Lo que siempre se debe lograr con el tratamiento es lo siguiente:
a) Aliviar el dolor.
b) Lograr la cicatrización de la lesión.
c) Tratar de curar la enfermedad conociendo las causas que lo originaron.
d) Evitar las complicaciones.
Imagen que representa los tratamientos
fuente: www.infogastro.es/1028607/
ANATOMÍA PATOLÓGICA
130
Para aplicar un medicamento en el tratamiento de la úlcera péptica es necesario:
1) Que exista un fundamento farmacológico y fisiológico para su empleo.
2) Que se haya demostrado en animales su eficacia en la prevención del
desarrollo de la ulcera experimental.
3) Que de acuerdo a su poca toxicidad o falta de esta, con mínimos
efectos colaterales o ausencia de los mismos, pueda ser aplicado en el
hombre.
4) Que en el hombre se haya llevado estudios estrictos, demostrando su
efectividad.
Para que un medicamento sea considerado verdaderamente ideal en el tratamiento de la
úlcera péptica deberá tener:
Que inhiba en forma importante y sostenida el estímulo de la acidez gástrica a nivel
de todos los receptores.
Que aumente en forma selectiva la protección de la mucosa gástrica y duodenal,
así como que favorezca su restitución.
Que su efecto se prolongue de 8 a 24 horas.
Que no tenga efectos colaterales.
Que sea fácil de administrarse.
Que no tenga costo elevado.
Que ayude a la eliminación de H. pylori.
En la etapa de la infección por H. pylori, el tratamiento ha pasado del control de la úlcera
péptica con terapia antisecretora de largo plazo, a la curación de la úlcera una vez
erradicado el microorganismo causante.
En la revisión de otros estudios se hace referencia a que el incremento de la utilización de
los inhibidores de la bomba de protones (IBP), fármacos con una acción antisecretora
gástrica aún más potente, como el omeprazol, y más recientemente la introducción de las
ANATOMÍA PATOLÓGICA
131
nuevas terapias contra la infección por H. pylori, han reducido el número de perforaciones,
pero que paradójicamente se ha incrementado el uso de otros medicamentos, como los
AINEs, los cuales han elevado la incidencia de esta complicación sobre todo en los países
desarrollados.1
El tratamiento con IBPs (Inhibidores de la bomba de potasio) consecuentemente reduce la
incidencia de una nueva hemorragia después de un episodio de la hemorragia de úlcera y
también reduce la exigencia para cirugía.4
Combinado el tratamiento con la terapia antisecretora y antibióticos durante 1–2 semanas
es el opción de primera línea para terapia de extirpación de H. pylori. Para pacientes en
peligro de desarrollar complicaciones de úlcera, es importante elegir con cuidado qué
medicinas antiinflamatorias, AINEsse deben usar, basado en una evaluación de riesgo del
paciente, sobre todo si el paciente tiene un riesgo elevado también requiere la aspirina.
Las pruebas para erradicar la infección de H. pylori en pacientes es recomendado antes
de comenzar la terapia deAINEs.2
Los tratamientos tradicionales para la enfermedad “acidopéptica”, siguen siendo útiles
pero, ahora para el manejo de la enfermedad por reflujo gastroesofágico.
El tratamiento de la úlcera péptica se comentan de la siguiente manera:
1) Tratamiento de los pacientes positivos para H. pylori.
2) Tratamiento de usuarios de AAS o AINE, negativos para H. pylori.
3) Tratamiento de sujetos negativos para H. pylori y que no están usando
AAS ni AINEs.
A. Tratamiento de la ulcera péptica infectada con H. pylori
La extirpación de la infección de píloros H. es ahora el pilar de tratamiento por enfermedad
de úlcera péptica, y ha causado la curación de úlcera muy alta y los precios de repetición
que se han caído dramáticamente, sobre todo para individuos con a úlcera duodenal.11
ANATOMÍA PATOLÓGICA
132
Los pacientes positivos para H. pylori que tienen una úlcera activa se tratan con
antibacterianos para erradicarla y con antiulcerosos tradicionales. Como serian los
antiácidos, bloqueadores de receptores H2, inhibidores de bomba de protones de
sucralfato para promover la cicatrización de la úlcera activa.
Tratamiento Bacteriano: los tratamientos exitosos para H. pylori
constan de 3 a 4 medicamentos administrados por 7 a 14 días.
Factores que influyen en la eficacia del tratamiento: un factor
importante para la erradicación de H. pylori es la presencia de
resistencia primaria a los antibióticos.
Consideraciones en pacientes que siguen infectados después del
tratamiento: En la actualidad son muy pocos los datos que
comentan sobre el manejo de los pacientes que no logran la
erradicación de la infección por H. pylori en el primer intento.
Tratamientos antiulcerosos tradicionales: los antagonistas de los
receptores de histamina 2 (ARH2) siguen siendo opciones
populares para la curación de la ulcera péptica. Son cuatro los
disponibles: cimetidina, ranitidina, famotidina y nizatidina. Todos
inhiben el efecto agonista secretor de la histamina sobre la celula
parietal. Imagen. 77
Imagen. 76 Anti- histaminico
fuente:
http://exploradorass.blogspot.com/2010_03_01_archive.html
Anti- histaminico
fuente: http://www.efarma.ro/products.php?id=721
ANATOMÍA PATOLÓGICA
133
B. Tratamiento de úlcera péptica por AAS o AINE con H. pylori negativo.
La forma de tratar las ulceras negativas a H. pylori en usuarios de AINE depende de la
situación en la que se hayan encontrado. Si se descubren en un caso no de urgencia, el
tratamiento es antiulceroso tradicional, salvo que no se requiera tratamiento de
erradicación. Los inhibidores de la bomba de protones son los medicamentos de elección.
Los estudios han demostrado que la cicatrización de una ulcera es más rápida cuando se
suspende el AINE que cuando se continua.
imagen.78
C. Tratamiento de la ulcera péptica no relacionada con H. pylori no con AAS o AINE.
Solo un pequeño número de pacientes con ulcera (5 a 10%) no tiene infección por H.
pylori, no antecedente de uso de AINE. Las causas de ulceras en estos pacientes son
síndrome de Zollinger- Ellison esporádico, neoplasia endocrina multiple tipo I,
hiperparatiroidismo primario o secundario,mastocitosis sistemática.
Imagen representativa de los Inhibidores de la Bomba de
Potasio
fuente:
http://geooranitidiaomeprazol.blogspot.com/2009_03_01_archive.html
ANATOMÍA PATOLÓGICA
134
Dieta
Se recomienda una dieta blanda sin alimentos irritantes, con horario fijo y adecuado; en la
ulcera gástrica se recomienda una dieta fraccionada para que no haya distensión del antro
con producción en la gastrina.
En relación con la dieta debe tomarse en cuenta lo siguiente:
Que sea agradable y equilibrada
Que sea fraccionada fundamentalmente en pacientes con ulcera gástrica.
Que contenga cantidad normal de fibra.
Que se administre con horario fijo y adecuado.
Se debe evitar el consumo de vinagre, bebidas alcohólicas, café, té y tabaco.
El alcohol, té y café aumentan la secreción gástrica.
Antiácidos
Se requieren dosis de 30 ml una y tres horas después de los alimentos. A dosis de 30ml
cinco a seis veces al día producen diarrea.
Imagen. 79
Imagen representativa de Antiácidos
fuente: http://www.colombiapack.com/gotuplas.htm
ANATOMÍA PATOLÓGICA
135
Anticolinégicos
Son medicamentos que están contraindicados en la ulcera gástrica debido a que provocan
hipotonía del estomago.
Antimuscarínicos
La pirenzepina tiene un efecto inhibidor de la secreción gástrica favoreciendo la
cicatrización de la ulcera duodenal, al bloquear M1 y M2.
Sucralfato
Es un medicamento a base de sacarosa sulfatada. Ha demostrado su eficacia en el
tratamiento de la ulcera tanto duodenal como gástrica, a dosis de 1g. una hora antes de
las comidas y otro al acostarse. Favorece la cicatrización, e inhibe la actividad péptica por
absorción de pepsina.
Imagen. 80
fuente: http://www.facmed.unam.mx/bmnd/gi_2k8/imgprod/TECNOFARMA/index.html
Inhibidores de los receptores H2.
Cimetidina.
Los niveles de cicatrización varían, después de un periodo de tratamiento de 4 a 6
semanas en 75 hasta 90%
La cimetidina se ha utilizado en diferentes esquemas:
a) 300mg después de cada comida y 300 al acostarse.
b) 600mg después del desayuno y la cena.
c) 400mg después del desayuno y 400 después de la cena.
d) 800mg por la noche, exclusivamente.
Imagen. 81
ANATOMÍA PATOLÓGICA
136
Ranitidina
Es 2 a 4 veces más potente que la cimetidina, por lo que se administra a menor dosis: 300
a 400mg de cimetidina corresponden aproximadamente a 150 mg de ranitidina. Los
índices de cicatrización van del 71 al 95% en periodos de tratamiento de 4 semanas.
Imagen. 82
Famotidina
Este medicamento es 6 a 8 veces mas potente que la ranitidina y 20 a 30 veces más que
la cimetidina. Por lo mismo se administra en dosis menores.
El medicamento puede administrarse a la dosis de 20mgcada 12 horas o 40 mg por la
noche. Se han obtenido índices de cicatrización que van del 75 al 95% en 4 semanas.
En casos de ulcera rebelde al tratamiento se recomienda dosis de 40mg 2 veces al día.
Imagen. 83
fuente:
http://www.megavitbolivia.com/web/index.php?page=shop.product_details&product_id=50&flypage=flypage.tpl&pop=0&option=com_virt
uemart&Itemid=9&vmcchk=1&Itemid=9
fuente:
http://www.ceguel.com.ni/home.php?id=3&indice=21&tipo=ifc
fuente:
http://www.bioquifar.com/institucional/ranitidina.html
ANATOMÍA PATOLÓGICA
137
Prostaglandinas
Se considera que el mecanismo por el cual las prostaglandinas inhiben la secreción
gástrica es a través de su acción sobre el sistema adenilciclasa / AMPc.
Su efecto antisecretor es superior al de los anticolinérgicos.
Reduce la acidez gástrica en un 80%; también inhibe la producción de pepsina. Su acción
principal es proteger a la mucosa gástrica y duodenal contra el efecto de los
antiinflamatorios no esteroideos. Las prostaglandinas ejercen su efecto a través de los
siguientes mecanismos:
Inhiben la secreción de ácido.
Aumentan la calidad y cantidad de mucosa.
Aumentan la producción de bicarbonato.
Aumentan la circulación y oxigenación.
Aumenta la restitución de las células destruidas.
Inhibidores de la bomba de protones
El tratamiento con fármacos inhibidores de la bomba de protones (IBP) constituye la
terapia médica de elección, ya que disminuye el riesgo de recidiva hemorrágica debido a
la potente inhibición de la secreción ácida que produce su administración.8
Esta constituido básicamente por el omeprazol, que es un benzimidazol que inhibe la
secreción ácida a nivel de la H/K/ATPasa. Su efecto terapéutico es más rápido el de los
inhibidores de los receptores H2. La dosis que se recomienda es de 20mg una al día, de
preferencia con el desayuno para el omeprazol. En los casos de ulceras rebeldes al
tratamiento médico es de 40mg una vez al día.
La inhibición ácida máxima de la secreción ácida gástrica mediante bolo e infusión
continua de pantoprazol no ofrece resultados superiores al tratamiento con dosis
convencionales en el episodio hemorrágico agudo.8
ANATOMÍA PATOLÓGICA
138
Imagen.84
fuente: http://zonasenior.blogspot.com/2010/09/los-antiacidosl-y-sus-efectos-en-la.html
Sales de Bismuto
Protegen a la mucosa de la acción del ácido y estimula la producción del moco.
Cuando existe H. pylori destruyen la bacteria e impiden su reproducción. En la ulcera
gástrica se han encontrado índices de cicatrización del 80 al 85% con tratamiento de 4 a 6
semanas. Esta sustancia es eliminada fundamentalmente por material fecal, origina color
negro en la lengua y en los excrementos. Debe darse una hora antes o una hora después
de los alimentos para que no se interfiera con su absorción.
Imagen. 85
fuente:
http://www.lisancr.com/images/products/subigastrol.jpg&imgrefurl
ANATOMÍA PATOLÓGICA
139
TABLA. 6
Tratamiento antisecretor
Los antihistamínicos-H2 (anti-H2) y los IBP son los principales fármacos antisecretores.
Los anti-H2 inhiben la secreción gástrica de ácido desencadenada por la histamina, la
gastrina, los alimentos y otros factores3 7. Entre los anti-H2 se incluyen la cimetidina, la
ranitidina, la famotidina, la nizatidina y la roxatidina3 7. Los IBP causan una inhibición
irreversible de la bomba de protones de las células parietales gástricas, reduciendo la
secreción gástrica de ácido en más del 95%, más intensamente que los anti-H2.11
RECOMENDACIONES PARA LA ERRADICACIÓN DE
HELICOBACTER PYLORI
Pauta de elección: IBP + claritromicina (500 mg/12 horas) +
amoxicilina (1 g/12 horas)
Pauta de elección:Ranitidina (300 mg/12 horas) +
subcitrato de bismuto (120 mg/6 horas) +
claritromicina(500 mg/12 horas) + amoxicilina
(1 gramo/12 horas)
Alergia a penicilinas:IBP + claritromicina (500 mg/12 horas) +
metronidazol (500 mg/12 horas)
Pauta de rescate: IBP + subcitrato de bismuto (120 mg/6
horas) +
tetraciclina (500 mg/6 horas) + metronidazol (500 mg/8 horas)
IBP (inhibidor de la bomba de protones): omeprazol (20 mg/12 horas),
lansoprazol (30 mg/12 horas) o pantoprazol (40 mg/12 horas).
Todas las pautas se administran durante 7 días.
ANATOMÍA PATOLÓGICA
140
Tratamiento a largo plazo:
Este estaría indicado fundamentalmente en los casos de:
En aquellos en los cuales ha habido una frecuencia de la lesión ulcerosa.
En aquellos individuos que han tenido como primera manifestación fenómeno
hemorrágico.
En aquellos pacientes que están sujetos a tensión o estrés.
Úlcera rebelde al tratamiento médico
A una úlcera se le considera rebelde al tratamiento médico cuando después de seguir un
tratamiento óptimo, durante un tiempo razonable, no cicatriza la lesión ulcerosa.
Se distingue entre un paciente rebelde al tratamiento médico y este es cuando no se
apega al tratamiento prescrito.
También se debe tomar en cuenta factores psicológicos que originan la lesión o hacen que
esta persista. Fundamentalmente los estados de estrés hacen que persista o que
reaparezca la lesión ulcerosa rebelde al tratamiento médico.
En relación con la ulcera rebelde al tratamiento médico debe indagarse si el paciente
recibe un tratamiento adecuado, si existe hiperacidez gástrica que quiera una dosis mayor
de los inhibidores de dicha acidez; o si existe un tumor de las células parietales o un
síndrome de Zollinger- Ellison.
Hay que tomar en cuenta si el paciente ingiere medicamentos que tienen acción
ulcerogénica como AINE, si el paciente es fumador o ingiere bebidas alcohólicas.
En una úlcera rebelde al tratamiento médico, el dolor es persistente y nocturno, esto
puede ser porque ya existe una penetración. La reaparición del dolor, poco tiempo
después de suspendido el tratamiento médico, se debe pensar en reaparición o
persistencia de la lesión.
ANATOMÍA PATOLÓGICA
141
La endoscopia permite apreciar tanto la lesión ulcerosa como la resistencia de retención
gástrica, resistencia de gastritis antral, que se observa cuando existe H. pylori.
En aquellas lesiones ulcerosas que no han cicatrizado con un tratamiento adecuado por 4
semanas, entonces se debe dar tratamiento por 6 semanas y después observar su
evolución de la lesión desde el punto de vista endoscópico. El tratamiento debe
prolongarse por 8 a 12 semanas, repitiendo el estudio endoscópico y administrando la
cantidad adecuando de medicamento. En los casos en los que no se encuentre respuesta
adecuada, se puede doblar la dosis y repetir el estudio endoscópico después de 8
semanas de tratamiento.
Cuando ya se han hecho los estudios necesarios para apreciar la persistencia de la
enfermedad, se ha llevado a cabo los tratamientos adecuados en la ulcera rebelde; y sino
se obtiene curación de la misma, entonces se debe considerar el tratamiento quirúrgico
para resolver este problema.
Antes de calificar una ulcera como rebelde al tratamiento médico hay que hacer las
siguientes consideraciones:
Si el paciente ha estado sujeto a tratamiento insuficiente o inadecuado.
Si existen factores que hagan que se presente el proceso ulceroso como; estrés,
angustia o depresión.
Existencia de H. pylori.
Hábitos inadecuados:
Tabaquismo
Ingestión de café o té.
Medicamentos, fundamentalmente AINE o aspirina.
Complicaciones de la úlcera:
Penetración
Estenosis pilórica.
Enfermedades:
Cirrosis
Insuficiencia renal crónica.
ANATOMÍA PATOLÓGICA
142
EPOC
Estados de hipersecreción gástrica:
Gastrinoma
Adenomas endocrinos múltiples
Hiperparatiroidismo.
TABLA. 7
PACIENTES REBELDES AL TRATAMIENTO MÉDICO
Falta de apego al tratamiento médico.
Tabaquismo y alcoholismo intensos.
Medicamentos concomitantes.
Factores psicológicos.
Cuadro 7 . Villalobos, Valdovinos, Olivera. Principios de Gastroenterología. Segunda Edición. 2004. Impreso en México
TABLA. 8
ÚLCERA DUODENAL REBELDE AL TRATAMIENTO MÉDICO
Tratamiento inadecuado.
Hiperacidez gástrica.
Gastritis y Helicobacter pylori.
Ingestión de medicamentos ulcerogénicos.
Tabaquismo.
Factores psicológicos.
Hiperparatiroidismo.
Complicaciones de la úlcera.
Sx. de ZollingerEllison.
Cuadro 8 . Villalobos, Valdovinos, Olivera. Principios de Gastroenterología. Segunda Edición. 2004. Impreso en México
ANATOMÍA PATOLÓGICA
143
TABLA. 9
ÚLCERA GÁSTRICA REBELDE AL TRATAMIENTO MÉDICO
Localización.
Hipotonía.
Estenosis pilórica o duodenal.
Medicamentos.
Tabaquismo.
Enfermedad de Crohn.
Malignidad.
Cuadro 9 . Villalobos, Valdovinos, Olivera. Principios de Gastroenterología. Segunda Edición. 2004. Impreso en México
Tratamiento Quirúrgico:
Imagen. 86
Úlcera Péptica Perforada
Tomada de:
http://medicosdeelsalvador.com/Detailed/Im_genes_M_dicas/Cirug_a_General/Im_genes_de_procedimientos_1236.html
La cirugía es indicada si las complicaciones se desarrollan o si la úlcera es insensible a
medicaciones. La sangría es la indicación más común para la cirugía.9
Complicaciones de la ulcera péptica e indicadores para su tratamiento quirúrgico.
ANATOMÍA PATOLÓGICA
144
El tratamiento quirúrgico debe estar plenamente indicado ya que en ocasiones puede
haber síntomas post- operatorios que pueden llevar al paciente a una situación
incapacitante o cuando menos, muy molesta.
La ulcera péptica frecuentemente obedecen a múltiples complicaciones y una de las más
graves es la perforación libre a la cavidad, lo cual ocurre entre un 2 y 5 % de los pacientes
con enfermedad ulcerosa, superado únicamente por la hemorragia, que precisa de
tratamiento quirúrgico urgente.1
Hay que tomar en cuenta que la cirugía implica ciertos riesgos; la mortalidad es menos del
1% en la cirugía sin complicaciones.
Puede haber efectos colaterales post- operatorios tales como síndrome de vaciamiento
rápido, alteraciones en la movilidad gastrointestinal o cuadros diarreicos transitorios o
persistentes.
Indicaciones para la cirugía
1) Complicaciones persistentes o irreversibles.
2) Rebeldía al tratamiento médico.
Con estas indicaciones se debe operar de emergencia o de forma electiva.
La cirugía de emergencia es la que se requiere en aquellos casos en los cuales existe una
situación urgente, como hemorragia persistente o perforación.
La cirugía electiva está indicada en aquellos casos en los cuales hay estenosis pilórica o
duodenal; persistencia de la enfermedad ulcerosa; hemorragias recurrentes o penetración.
La cirugía de la úlcera péptica tiene como objetivo fundamental controlar la disposición
ulcerosa, de tal forma que dé como resultado la cicatrización de la úlcera y evite la
recurrencia mínima, con el tratamiento eficaz y adecuado, sin efectos colaterales
indeseables y con mínima mortalidad.
ANATOMÍA PATOLÓGICA
145
Una variante efectiva es la vagotomía troncular posterior y superselectiva anterior, que no
necesita drenaje gástrico y que evita la potencial necrosis gástrica por sección de la arteria
coronaria estomática.1
La vagotomía troncular consiste en la división de todas las estructuras vagales a nivel del
esófago inferior; si solo se seccionan dos troncos, el resultado será vagotomía incompleta
en el 75% de los casos. Se aconseja efectuar la disección de ambos nervios vagos hasta
6 o 7 cm por arriba del esófago.
La vagotomía selectiva consiste en seccionar todas las ramas gástricas y las que se
desprenden de ambos troncos vagales a nivel del esófago abdominal en un espacio de 6 a
8 cm por arriba del diafragma. Con esta técnica se conserva la rama hepática y la rama
celiaca.
La vagotomía gástrica proximal secciona solamente las ramas que van del cuerpo al fondo
del estomago. Esta operación es también llamada vagotomía de células parietales o
vagotomía súper- selectiva. Imagen. 87
Vagotomía laparoscopica para una ulcera péptica
Tomada de:
http://www.websurg.com/ref/Antrectom%C3%ADa_y_vagotom%C3%ADa_laparosc%C3%B3pica_
para_una_%C3%BAlcera_p%C3%A9ptica_benigna_pil%C3%B3rica_esten%C3%B3tica-vd01es2492.htm
ANATOMÍA PATOLÓGICA
146
La vagotomía de Hill-Barker es una modificación de la vagotomía ultraselectiva clásica, en
la cual se realiza una vagotomía ultraselectiva anterior con una vagotomía troncular
posterior. Al realizarse esta técnica por vía laparoscópica, la sección de toda la hoja
anterior del ligamento gastrohepático se complementa con la colocación de grapas de
titanic, en los vasos que se encuentran en dicho trayecto antes de ser seccionados.
Imagen. 88
Fig. 1 Clip de titano observados en el
fondo de la lesión ulcerosa
Fig. 2 Endoscopía realizadas 4 días
después
Imagen. 89
Fig. 3 Retirada del clip con asa de
polipectomía
Fig. 4 Cicatrización de lesión ulcerosa
ANATOMÍA PATOLÓGICA
147
Imagen. 90
Fuente: http://sisbib.unmsm.edu.pe/bvrevistas/gastro/vol_17n1/migracion.htm
El factor más importante en la etiopatogenia de la úlcera péptica de localización gástrica
es una alteración a nivel de la barrera mucosa. El tratamiento quirúrgico casi siempre va
encaminado a extirpar el área lesionada de la pared gástrica.
Las complicaciones post-operatorias más frecuentes se encuentran relacionadas, donde
podemos observar que la infección en el sitio de la operación es la más encontrada1
En sí la cirugía es indicada en pacientes que son intolerantes de las medicaciones o no
cumplen con regímenes de medicación, y aquellos en riesgo alto de complicaciones (p. ej,
trasplante recientes, pacientes dependientes de AINEs, con úlcera gástrica o duodenal
gigantesca, con las úlceras que dejan de curarse con el tratamiento adecuado). La cirugía
también debería ser considerada para pacientes que tienen una recaída durante el
tratamiento de mantenimiento o quiénes han tenido múltiple cursos de medicaciones.9
Entonces, ¿qué enfermos con ulcera péptica deben ser operados?
Úlcera Duodenal:
Cuando hay estenosis pilórica.
En casos de hemorragia grave de repetición o en personas mayores de
5 años.
Las úlceras penetradas.
Las ulceras perforadas.
Casos rebeldes al tratamiento médico.
Figura 5 vagotomía de Hill-Baker
lapaoscópiaca
ANATOMÍA PATOLÓGICA
148
Úlcera gástrica:
Úlceras penetradas, por riesgo a hemorragia o perforación.
Úlceras gigantes o deformación por la cicatrización y dificultad al
vaciamiento.
Úlceras que no responden al tratamiento médico en 3 o 4 semanas.
Úlceras gástricas recidivantes.
TABLA. 10
INDICACIONES PARA CIRUGÍA EN ÚLCERA PÉPTICA
Hemorragia persistente o grave.
Perforación.
Penetración.
Estenosis.
Úlcera rebelde al tratamiento médico.
Cuadro10 . Villalobos, Valdovinos, Olivera. Principios de Gastroenterología. Segunda Edición. 2004. Impreso en México
TABLA. 11
INDICACIONES PARA EL TRATAMIENTO QUIRÚRGICO DE LA ÚLCERA
DUODENAL
De Urgencia:
Perforación.
Hemorragia.
De elección:
Hemorragia.
Penetración.
Estenosis pilórica o duodenal.
Rebeldía al tratamiento.
Gastrinoma.
Enfermedad de Crohn.
Otras.
Cuadro 11 . Villalobos, Valdovinos, Olivera. Principios de Gastroenterología. Segunda Edición. 2004. Impreso en México
ANATOMÍA PATOLÓGICA
149
TABLA.12
INDICACIONES PARA EL TRATAMIENTO QUIRÚRGICO DE LA ÚLCERA
GÁSTRICA.
De urgencia:
Perforación.
Hemorragia.
De elección:
Malignidad o sospecha (anacidez)
Hemorragia.
Penetración.
Estenosis.
Rebeldía al tratamiento.
Recurrencia.
Cuadro 12 . Villalobos, Valdovinos, Olivera. Principios de Gastroenterología. Segunda Edición. 2004. Impreso en México
ANATOMÍA PATOLÓGICA
150
PRONÓSTICO
La úlcera gástrica en la mayoría de los casos y con tratamiento adecuado evoluciona
hacia la curación en semanas o meses. Cuando no se trata y está en actividad se inflama
la mucosa, orada a las paredes y puede penetrar hasta un vaso dando una hemorragia
cuya magnitud estará relacionada con el calibre del vaso lesionado. Si no hay adherencias
del estomago a otros órganos se perfora la pared y se abre a la cavidad libre mientras que
si se encuentra cerca del píloro puede desencadenar el síndrome pilórico.
Se debe descartar la teoría que la úlcera se transforma en cáncer, ya que dicha
transformación es una excepción y seguramente se trata de un cáncer de aspecto
ulcerado.
La úlcera péptica no complicada tiene un excelente pronóstico para la vida y para la
función por ser una enfermedad benigna con un tratamiento muy eficiente.
Las complicaciones de la enfermedad tienen un pronóstico que depende de la
complicación, la gravedad de la misma y los factores propios del paciente, pero una
perforación o una hemorragia pueden llevar a la muerte.
La apariencia endoscópica también ha sido estudiada como factor pronostico de
cicatrización y/o recurrencia. En el duodeno las úlceras cicatrizan más lentamente.
Una proporción desconocida de úlceras benignas endoscópica e histológicamente, puede
presentar un tumor maligno ulcerado.
De acuerdo a las recomendaciones alemanas, todo paciente con úlcera gástrica benigna
macroscópica e histológica, debe regresar para seguimiento después de cuatro semanas
de tratamiento o hasta que la cicatrización haya ocurrido.
Las úlceras gástricas, por tanto, requieren múltiples biopsias para excluir un carcinoma, y
se debe realizar seguimiento para garantizar la cicatrización.
Las úlceras duodenales no complicadas responden al tratamiento y no requieren control
endoscópico; a diferencia de las refractarias, que si lo requieren para descartar si es
úlcera refractaria o síntomas refractarios secundarios.
ANATOMÍA PATOLÓGICA
151
CONCLUSIÓN
Se dice que las úlceras pépticas son un padecimiento, pero son más que eso y en realidad
son consideradas básicamente como un síndrome debido a los síntomas y signos que
suelen presentarse.
Este síndrome resulta algo particular, ya que su etiología es multifactorial, pero sobresalen
dos de sus factores de riesgo; el primero, infección por H. pylori, el cual ataca
principalmente al estómago y duodeno, infiltrándose por citotoxicidad hacia todas sus
capas. El segundo, uso excesivo de Antiflamatorios no esteroideos (AINEs), como el acido
acetilsalicilico (aspirina).
Respecto a este síndrome en la antigüedad se le relacionaba con situaciones de estrés
excesivos, por lo tanto se pensaba que se trataba de una enfermedad meramente
psicológica, la cual posteriormente no fue descartada del todo, pero si se identifico que el
estrés es uno de los mucho factores que influyen para la aparición de una úlcera péptica.
A manera realista no se trata de un síndrome que pueda causar muerte, ya que los
principales estragos que causa se deben básicamente a sus complicaciones; que aunque
el índice de mortalidad por esta causa a nivel global no es tan elevado, aun permanece la
posibilidad de que un paciente sufra consecuencias graves. Es a partir de aquí su
importancia.
El tratamiento de elección en la úlcera péptica perforada es quirúrgico de urgencia. El
tiempo de evolución de la perforación influye en el tipo de intervención a realizar, pero lo
que determina son las condiciones locales en que se encuentre.
También debe considerarse que existe tratamientos de elección como IBP + claritromicina
+ amoxicilina, pero se debe también tomar en cuenta que esta pauta no es recomendable
para todas las personas debido a que pueden ser alérgicos a la penicilina.
Es importante también determinar que existe un alto índice de casos sin diagnóstico
etiológico.
ANATOMÍA PATOLÓGICA
152
El presente trabajo es de gran utilidad para la ampliación de nuevos conocimientos, ha
sido un trabajo que me ha dejado gran enseñanza en distintos aspectos desde saber
comprender a mis compañeros de equipo, así como aprender de cada uno de ellos.
Desde mi punto de vista este tema me parece de gran importancia debido a sus
manifestaciones que suelen presentarse, así como a los factores de riesgo que suelen
desencadenarla, por lo tanto , durante la realización de este trabajo, aprendí , no solo del
tema investigado sino también de otros temas relacionados con la úlcera péptica.
Finalmente de ahora en adelante, recordaré las características de la bacteria de
Helicobacter pylori, así como sus agentes de patogenicidad y citotoxicidad.
Este trabajo de investigación me gustaría terminarlo con la siguiente frase:
“Recuerda que el hombre permanece en el rincón de la oscuridad por temor a que la luz
de la verdad le deje ver cosas que derrumbarían sus conjeturas”.
ANATOMÍA PATOLÓGICA
153
BIBLIOGRAFÍAS
BIBLIOGRAFÍAS DE ARTÍCULOS
1. Dr. Bejerano García R.J. Perforación gastroduodenal por úlcera péptica: estudio de
99 pacientes operados. Rev. Cubana Cir 2007; 46 (3):1-8.
2. Yuhong Yuan, Ireneusz T Padol, Richard H Hunt. Peptic ulcer disease today. Nature
Clinical Practice Gastroenterology & Hepatology. Febrero 2006;3(2):80-89.
3. Kuck H. F., Censur Z., Kurt N., Ozkan Z., Kement M., Kaptanoglu L., Oncel M. The
effect of Ramadan fasting on duodenal ulcer perforation: a retrospective analysis.
Indian J Surg. Mayo 2005;67(4):195-198.
4. Grigoris I., Virender K., Colin W. Howden. Proton Pump Inhibitor Therapy for Peptic
Ulcer Bleeding:Cochrane Collaboration. Meta-analysis of Randomized Controlled
Trials. Mayo Clinic Proceedings. Marzo 2007;82(3):286-296.
5. Mattar R., Laudanna A.A. Helicobacter pylori genotyping from positive clotests in
patients with duodenal ulcer. Rev. Hosp. Clín. Fac. Med. S. Paulo Septiembre
2000;55(5):155-160.
6. Hala M. T., El-Zimaity., Oscar Gutierrez., Jong G. Kim, Taiji Akamatsu, Inanc E.
Gu¨rer, et. al. Geographic Differences in the Distribution of Intestinal Metaplasia in
Duodenal Ulcer Patients. The American Journal of Gastroenterology. Marzo
2001;96(3):666-672.
7. Miwa H., Sakaki N., Sugano K., et. al. Recurrent Peptic Ulcers in Patients Following
Successful Helicobacter pylori Eradication: A Multicenter Study of 4940 Patients.
Blackwell Publishing. 2004;9(1):9-16.
8. Garrido A., Giráldez A., Trigo C., Leo E., Guil A., Márquez J.L. Inhibidores de la
bomba de protones por vía intravenosa en la hemorragia por úlcera péptica: ¿es
ANATOMÍA PATOLÓGICA
154
necesaria la supresión ácida máxima para disminuir el resangrado? Rev Esp
Enferm Dig (Madrid).2008;100(8):466-469.
9. Ramakrishnan K., Salinas R. C. Peptic Ulcer Disease. The American Family
Physician. 2007;76(7):1005-1012.
10. Sarosi G. A., Kshama R. J., Nwariaku F.E., et. al. Surgical therapy of peptic ulcers
in the 21st century: more common than you think. The American Journal of
Surgery. Julio 2005;190:775–779.
11. Calvo J. M., Lima E. M. Tratamiento de la úlcera péptica. MEDIFAM. Mayo
2002;12(5):314-318.
12. Bejarano M., Méndez F., Interacción de los factores asociados a enfermedad úlcero
péptica. Rev. Col. Gastroenterol. 2006; 21(1):25-32.
13. Bittencourt P., Rocha G., Penna F., Queiroz D. Gastroduodenal peptic ulcer and
Helicobacter pylori infection in children and adolescents. Rev. Journal de Pediatría.
2006;82(5):325-334.
14. Natan J., Marcruz. F., Hashimoto C., Zimberg E., Laudanna A.A. Therapeutic
efficacy of ranitidine bismuth citrate with clarithromycin for seven days in the
eradication of Helicobacter pylori in Brazilian peptic ulcer patients. Revista Medical
Journal, Sao Paulo. 2003; 121(1): 15-18.
15. Vallejos C., Enríquez M.A., López M. R., et. al. Helicobacter pylori en pacientes de
la tercera edad atendidos en un Hospital de Puebla. Enfermedades Infecciosas y
Microbiología. Diciembre 2009; 29(4): 131-134.
ANATOMÍA PATOLÓGICA
155
BIBLIOGRAFÍAS DE LIBROS
1.- Diagnóstico y Tratamiento de Gastroenterología.
Friedman Mc Quaid Grendell.
Segunda Edición.
Editorial. Manual Moderno.
México, 2007.
P.p.345-364.
2.- Introducción a la Gastroenterología.
Dr. Villalobos Pérez José de Jesús.
Tercera edición.
Méndez Editores.
México, 2000.
P.p. 269-343.
3.-Tratado de Gastroenterología.
Sleisenger Marvin H.
Nueva editorial Internacional.
México, 2000.
P.p.149-157, 159-170, 173-176.
4.-Microbiología y Parasitología.
Romero Cabello Raúl.
Tercera Edición.
Editorial. Médica Panamericana.
México, 2007.
P.p.483-485.
5.-Diagnóstico Microbiológico Texto y Atlas color.
Koneman Elmer W.
Quinta edición.
Editorial Panamericana.
P.p. 67-70.
ANATOMÍA PATOLÓGICA
156
6.- HARRISON´S. Principios de Medicina Interna.
Kasper Dennis L., Braunwald Eugene, Fauci Antony S., Longo Stephen.
Capítulo 274.
16° edición en español.
Editorial: McGraw- Hill.
P.p. 9405- 9472.
7.- Gastroenterología
Netter Frank H.
Capitulo 55 - 60
Segunda edición.
Editorial: Masson
México, 2006.
P.p. 210-228
BIBLIOGRAFÍAS DE ARTÍCULOS DE BASE
1.- Moreira V. F., San Román A. Úlcera Péptica. Revista Española de
Enfermedades Digestivas. Enero 2004; 96(1):1-4.
2.- Sainz R., Cabrerizo J.L., et. al. Úlcera péptica: manejo general y
extrahospitalario. Medicine. 2008;10(3):33-40.
3.- Bernal S.F. Úlcera Péptica. Guías Diagnósticas de Gastroenterología. P.p. 32-
36.
4.- Avendaño J.M., Jaramillo H. J., Rodríguez M. Inhibidores de la secreción ácida
gástrica para profilaxis de úlceras por estrés. Indicaciones apropiadas e
inapropiadas y su impacto económico en un hospital de segundo nivel en Mexicali.
Med Int Mex 2010;26(5):431-436.
5.- Alvarado J., Hani A.c., Rodríguez A., Archila P.E., Beltrán O. Enfermedad Ácido
Péptica. Asociación Colombiana de Facultades de Medicina. P.p. 1- 57.
ANATOMÍA PATOLÓGICA
157
BIBLIOGRAFÍAS DE LAS IMAGENES
1.- Imagen. 1. Antecedentes. Fuente:
http://www.unanuevamaneradeopinar.com/index.php/page/2/
2.- Imagen. 2. Definición. Úlcera gástrica y erosión gástrica. Fuente:
http://www.unanuevamaneradeopinar.com/index.php/page/2/
3.- Imagen. 3. Definición. Úlcera Duodenal. Fuente: www.cvsanfermin.com/.../fotos-
cirugias.html.
4.- Imagen. 4. Clasificación. Úlcera gástrica crónica. Fuente:
http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica
/imagenes_ap/patologia461-466.htm.
5.- Imagen. 5. Clasificación. Úlcera Duodenal Fuente:
http://www.helicobacterspain.com/fotos/ulceduo.jpg.
6.- Imagen. 6. Clasificación. Úlcera esofágica. Fuente: http://endoscopia-
gastrointestinal.blogspot.com/2010...
7.- Imagen. 7. Clasificación. Úlcera Marginal. Fuente:
www.cursosparamedicos.com/atlas/esto_2.htm.
8.- Imagen. 8. Clasificación. Úlcera en el Diverticulo de Meckel. Fuente:
www.scielo.org.mx/scielo.php?script=sci_artte....
9.- Imagen. 9. Etiopatogenia. Helicobacter pylori. Fuente:
http://2.bp.blogspot.com/_B4lWWKY6kX0/Sbgomo
C5zQI/AAAAAAAAAAc/rQtHzY3Rass/S700/1596006.jpg
ANATOMÍA PATOLÓGICA
158
10.-Imagen. 10. Etiopatogenia. AINEs. Fuente:
http://2.bp.blogspot.com/_B4lWWKY6kX0/SbgomoC5zQI/AAAAAAAAAAc/rQtHzY3Rass/S
700/1596006.jpg
11.-Imagen. 11. Etiopatogenia. Mecanismos para producir una úlcera péptica. Fuente:
www.albelda.info/salud/ulcera_gastroduodenal.htm
12.-Imagen. 12. Etiopatogenia. Hábito de fumar. Fuente: www.infogastro.es/1028607/.
13.-Imagen.13. Etiopatogenia. Daño por Helicobacter pylori. Fuente.
lasupergalaxia.wordpress.com/.../.
14.-Imagen. 14. Etiopatogenia. Mecanismo por los que se presentan las úlceras pépticas.
Fuente: http://gsdl.bvs.sld.cu/collect/enfermeria/index/assoc/HASH0199.dir/fig3.26g.png
15.-Imagen.15. Etiopatogenia. Síndrome de Zollinger- Ellison (Gastrinoma).Fuente:
www.nature.com/.../nrclinonc.2009.82_F3.html
16.- Imagen.16. Etiopatogenia. Triángulo del gastrinoma. Fuente:
radiographics.rsna.org/content/27/1/237.full
17.-Imagen.17. Patogenia. Microbiología de Helicobacter pylori. Fuente: ddc-
hpylori.blogspot.com/
18.-Imagen.18. Patogenia. Célula de Helicobacter pylori. Fuente:
www.sciencecodex.com/prehistoric_origins_of_s...
19.- Imagen.19. Patogenia. Proceso de infección de H. pylori. Fuente:
http://www.biologia.edu.ar/bacterias/figbac/Bacter1.jpg.
20.-Imagen.20. Patogenia. Proceso apoptotico por H. pylori. Fuente:
www.nature.com/.../v2/n1/fig_tab/nrc703_F3.html.
ANATOMÍA PATOLÓGICA
159
21.-Imagen.21. Patogenia. Mecanismos de H. pylori por los que produce alteraciones.
Fuente: Harrison´s.
22.-Imagen.22. Patogenia. Acido araquidónico. Fuente. Harrison´s.
23.-Imagen.23. Patogenia. Determinantes de Patogenicidad. Fuente:
vitae.ucv.ve/?module=articulo&rv=14&n=297....
24.-Imagen.24. Patogenia. Flujo disminuido por la mucosa a causa de la falta de
continuidad de la misma. Fuente: Harrison´s.
25.-Imagen.25. Patogenia. Mecanismos de alteraciones, mediante sus factores
citotóxicos. Fuente: http://edant.clarin.com/diario/2005/10/04/sociedad/s-03001.htm
26.-Imagen. 26. Patogenia. Procesos por los que pasa H. pylori desencadenando gastritis,
úlcera péptica o adenocarcinoma gástrico. Fuente: Netter Frank.H . Atlas de Anatomía
Humana.
27.-Imagen.27. Patogenia. Proceso de ataque de H. pylori, mediante sus agentes
citotóxicos. Fuente: Vaira D, Holton J, Menegatti M, et al., 2000. Review article: invasive
and noninvasive tests for Helicobacter pylori infection. Alimentary Pharmacology and
Therapeutics. 214:13–22.
28.- Imagen.28. Patogenia. Origen de la bacteria H. pylori. Fuente:
http://edant.clarin.com/diario/2005/10/04/sociedad/s-03001.htm.
29.-Imagen.30. Patogenia. Mecanismo por los que los AINEs, producen lesión de la
mucosa. Fuente: Harrison´s.
30.-Imagen.30. Fisiopatología. Glándula gástrica. Fuente:
www.dfarmacia.com/farma/ctl_servlet?_f=13...
31.-Imagen.31. Fisiopatología. Glándula oxíntica gástrica. Fuente: Harrison´s .
ANATOMÍA PATOLÓGICA
160
32.-Imagen.32. Fisiopatología . diversas partes de la Glándula Gástrica. Fuente:
gastrina.blogspot.com/
33.-Imagen.33. Fisiopatología. Regulacion gástrica de las secreción HCl. Fuente:
gsdl.bvs.sld.cu/cgi-bin/library?e=d-l0000-00-...
34.-Imagen.34. Fisiopatología. Regulación de la secreción de ácido gástrico. Fuente:
Harrison´s.
35.-Imagen.35. Cuadro Clínico. Representación de los síntomas de la úlcera péptica.
Fuente: www.infogastro.es/1028607/.
36.-Imagen.36. Cuadro Clínico. Úlcera Duodenal. Fuente:
www.fluvium.org/textos/vidahumana/vid129.htm.
37.-Imagen.37. Cuadro Clínico. Úlcera Gástrica. Fuente:
www.zonamedica.com.ar/.../ulcerapeptica.htm.
38.-Imagen.38. Cuadro Clínico. Úlcera Marginal. Fuente:
www.cursosparamedicos.com/atlas/esto_2.htm.
39.-Imagen.39. Cuadro Clínico. Gastrinoma. Fuente:
www.nature.com/.../nrclinonc.2009.82_F3.html.
40.-Imagen.40. Cuadro Clínico. Dolor “quemante”. Fuente:
http://www.expofarmacia.com.ar/actualidad.php?id=236.
41.-Imagen.41. Cuadro Clínico. Dolor en el epigastrio. Fuente:
revista.consumer.es/.../20030401/salud/58875.php.
42.-Imagen.42. Cuadro Clínico. Reflujo Gastroesofagico. Fuente:
http://www.intramed.net/contenidover.asp?contenidoID=40063.
ANATOMÍA PATOLÓGICA
161
43.-Imagen.43. Cuadro Clínico. Estomago que presenta cierre normal y otro con reflujo.
Fuente: doctorfelipeluna.blogspot.com/2007/12/reflujo....
44.-Imagen.44. Cuadro Clínico. Malestares como nauseas. Fuente:
http://radio.capital.com.pe/informativocapital/2010/05/23/la-gastritis/.
45.-Imagen.45. Métodos Diagnósticos. Estudios radiológicos. Fuente:
www.publiespacios.net/.../radiologia.htm.
46.-Imagen.46. Métodos Diagnósticos. Radiografías. Fuente:
www.drscope.com/.../generales/radiologia/f8.html.
47.-Imagen.47. Métodos Diagnósticos. Radiografías de úlcera duodenal. Fuente:
http://www.smiba.org.ar/revista/smiba_01/abdome2.htm.
48.-Imagen.48. Métodos Diagnósticos. Estudio radiológico y endoscópico. Fuente:
http://www.smiba.org.ar/revista/smiba_01/abdome2.htm
49.-Imagen.49. Métodos Diagnósticos. Proceso de Endoscopia. Fuente:
http://www.medicoscolombia.com/medicosecuador/espanol/articulos/140.htm.
50.-Imagen.50. Métodos Diagnósticos. Endoscopia digestiva alta. Fuente:
http://seram2006.pulso.com/modules/posters/files/figura20_recidivamu2_ax.jpg.
51.-Imagen.51. Métodos Diagnósticos. Endoscopia de Úlcera pépticas. Fuente:
http://163.178.103.176/CasosBerne/4dCardiovascular/Caso161/HTMLC/CasosB2/Hema/Ul
cera1.htm.
52.-Imagen.52. Métodos Diagnósticos. Endoscopia de una cicatriz de úlcera duodenal
antigua. Fuente: http://endoscopiaenlapractica.blogspot.com/2010/06/cicatriz-de-ulcera-
duodenal-antigua.html.
ANATOMÍA PATOLÓGICA
162
53.-Imagen.53. Métodos Diagnósticos. Endoscopia baja. Fuente:
http://www.univalle.edu/publicaciones/revista_salud/revista04/pagina10.htm.
54.-Imagen.54. Métodos Diagnósticos. Prueba de aliento marcada con C13. Fuente:
wwwemerlab.blogspot.com/.
55.-Imagen.55. Métodos Diagnósticos. Biopsia de úlcera duodenal. Fuente:
scielo.sld.cu/scielo.php?pid=S0138-6557200700....
56.-Imagen.56. Métodos Diagnósticos. Biopsia de úlcera péptica. Fuente:
http://www.endoscopiacurso.com.br/FotosEndoscopia_esp.htm.
57.-Imagen.57. Métodos Diagnósticos. Pieza de úlcera duodenal. Fuente: :
http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica/imagenes_ap/patolog
ia467-471.html%7F
58.-Imagen.58. Métodos Diagnósticos. Corte histológico de úlcera crónica. Fuente: Netter
Frank.H . Atlas de Anatomía Humana.
59.-Imagen.59. Métodos Diagnósticos. Corte histológico de úlcera subaguda. Fuente:
Netter Frank.H . Atlas de Anatomía Humana.
60.-Imagen.60. Métodos Diagnósticos. Corte histológico de úlcera péptica.Fuente:Netter
Frank.H . Atlas de Anatomía Humana.
61.-Imagen.61. Métodos Diagnósticos. Corte histológico de úlcera duodenal.Fuente: Netter
Frank.H . Atlas de Anatomía Humana.
62.-Imagen.62. Métodos Diagnósticos. Corte histológico de úlcera gástrica con gastritis
aguda. Fuente:
http://www.facmed.unam.mx/deptos/anatomia/computo/Estomago/Image223.gif.
ANATOMÍA PATOLÓGICA
163
63.-Imagen.63. Métodos Diagnósticos. Corte histológico de úlcera gástrica crónica activa.
Fuente:
http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica/imagenes_ap/patolog
ia467-471.html%7F.
64.-Imagen.64. Métodos Diagnósticos. Corte histológico de ulcera péptica cicatrizada.
Fuente:http://escuela.med.puc.cl/paginas/Cursos/tercero/patologia/fotosRegeneracion.html
65.-Imagen.65. Métodos Diagnósticos. Corte histológico de úlcera gástrica cicatrizada.
Fuente:
http://escuela.med.puc.cl/paginas/cursos/tercero/anatomiapatologica/imagenes_ap/patolog
ia467-471.html%7F
66.-Imagen.66. Métodos Diagnósticos. Corte Histológico de úlcera péptica. Fuente:
http://escuela.med.puc.cl/paginas/publicaciones/anatomiapatologica/04digestivo/4estomag
o_1.html.
67.-Imagen.67. Métodos Diagnósticos. Cortes histológicos de úlcera gástrica y erosión
gástrica. Fuente: http://www.unanuevamaneradeopinar.com/index.php/page/2/
68.-Imagen.68. Métodos Diagnósticos. Cultivo de H. pylori. Fuente:
www.helicobacterspain.com/imagenes/placa2.htm.
69.-Imagen.69. Complicaciones. Complicaciones de la úlcera péptica. Fuente:
http://www.lifespan.org/adam/spanishhealthillustratedencyclopedia/6/19235.html.
70.-Imagen.70. Complicaciones. Úlcera gástrica con sangrado activo. Fuente:
http://www.solociencia.com/videos/online/Ulceras%20estomago/.
71.-Imagen.71. Complicaciones. Úlcera péptica con hemorragia. Fuente:
http://www.flickr.com/photos/75466669@N00/4747784818/.
ANATOMÍA PATOLÓGICA
164
72.-Imagen.72. Complicaciones. Capas de la úlcera duodenal. Fuente:
http://ulceraduodenalug.blogspot.com/
73.-Imagen.73. Complicaciones. Perforación de la úlcera péptica. Fuente:
www.infogastro.es/1028607/.
74.-Imagen.74. Complicaciones. Perforación por AINEs. Fuente:
www.infogastro.es/1028607/.
75.-Imagen.75. Tratamiento. Representación de los tratamientos. Fuente:
www.infogastro.es/1028607/.
76.-Imagen.76. Tratamiento. Ranitidina. Fuente: fuente:
http://exploradorass.blogspot.com/2010_03_01_archive.html.
77.- Imagen.77. Tratamiento. Famotidina. Fuente:
http://www.efarma.ro/products.php?id=721.
78.-Imagen.78. Tratamiento. Inhibidores de la bomba de protones. Fuente:
http://geooranitidiaomeprazol.blogspot.com/2009_03_01_archive.html.
79.-Imagen.79. Tratamiento. Antiácidos. Fuente:
http://www.colombiapack.com/gotuplas.htm.
80.-Imagen.80. Tratamiento. Sucralfato. Fuente:
http://www.facmed.unam.mx/bmnd/gi_2k8/imgprod/TECNOFARMA/index.html.
81.-Imagen.81. Tratamiento. Cimitidina. Fuente:
http://www.ceguel.com.ni/home.php?id=3&indice=21&tipo=ifc.
82.-Imagen.82. Tratamiento. Ranitidina. Fuente:
http://www.bioquifar.com/institucional/ranitidina.html.
ANATOMÍA PATOLÓGICA
165
83.-Imagen.83. Tratamiento. Famotidina. Fuente:
http://www.megavitbolivia.com/web/index.php?page=shop.product_details&product_id=50
&flypage=flypage.tpl&pop=0&option=com_virtuemart&Itemid=9&vmcchk=1&Itemid=9.
84.-Imagen.84. Tratamiento. Inhibidores de la bomba de protones. Fuente:
http://zonasenior.blogspot.com/2010/09/los-antiacidosl-y-sus-efectos-en-la.html.
85.-Imagen.85. Tratamiento. Sales de Bismuto. Fuente:
http://www.lisancr.com/images/products/subigastrol.jpg&imgrefurl.
86.-Imagen.86. Tratamiento. Úlcera péptica perforada. Fuente:
http://medicosdeelsalvador.com/Detailed/Im_genes_M_dicas/Cirug_a_General/Im_genes_
de_procedimientos_1236.html.
87.-Imagen.87. Tratamiento. Vagotomía de úlcera péptica. Fuente:
http://www.websurg.com/ref/Antrectom%C3%ADa_y_vagotom%C3%ADa_laparosc%C3%
B3pica_
para_una_%C3%BAlcera_p%C3%A9ptica_benigna_pil%C3%B3rica_esten%C3%B3tica-
vd01es2492.htm.
88.-Imagen.88. Tratamiento. Vagotomía de Hill-Barker. Fuente:
http://sisbib.unmsm.edu.pe/bvrevistas/gastro/vol_17n1/migracion.htm.
89.-Imagen.89. Tratamiento. Vagotomía de Hill- Barker. Fuente:
http://sisbib.unmsm.edu.pe/bvrevistas/gastro/vol_17n1/migracion.htm.
90.-Imagen.90. Tratamiento. Vagotomía de Hill- Barker. Fuente:
http://sisbib.unmsm.edu.pe/bvrevistas/gastro/vol_17n1/migracion.htm .
ANATOMÍA PATOLÓGICA
166
INTRODUCCIÓN:
El cáncer es un problema de salud pública.
La OMS calcula que cada año hay alrededor de 10 millones de casos nuevos. En México,
la mortalidad por tumores malignos se ha incrementado de 9.7% en 1990 a 12.9% en
2006. Debido al proceso de transición demográfica y epidemiológica actual, se prevé un
predominio en adultos mayores en las próximas décadas, con el consecuente incremento
del número de casos de cáncer y una mayor presión económica y demanda de servicios
médicos
Las lesiones gástricas son causa frecuente de enfermedad clínica. El carcinoma es el más
importante y frecuente (90 al 95%) de los tumores malignos del estómago, lo que lo lleva a
ser el segundo tumor maligno más frecuente en todo el mundo. Le siguen en frecuencia
los linfomas (4%), los carcinoides (3%) y los tumores mesenquimales (2%).
Su incidencia varia de forma alta en países como Japón, Chile, Costa Rica, Colombia,
China, Portugal, Rusia y Bulgaria, mientras que resulta entre cuatro a seis veces menor en
Estados Unidos, Reino Unido, Canadá, Australia, Nueva Zelanda, Francia y Suecia. Es
más frecuente en los grupos socioeconómicos inferiores y presenta una relación
hombres:mujeres alrededor de 2:1.
Los tumores gástricos primarios menos frecuentes son los de las células del estroma
gastrointestinal (GIST).
A pesar de que en México y en el mundo se realizan cada año un mayor número de
endoscopias, los pacientes con este tipo de lesiones se presentan habitualmente en
etapas clínicas muy avanzadas. El retraso en el diagnóstico ocurre debido a que el
paciente tarda en solicitar atención médica, o el médico trata al paciente por síntomas
dispépticos sin realizar una evaluación adecuada, o el endoscopista no tiene la
experiencia suficiente para diagnosticar lesiones tempranas.
En las estadísticas de mortalidad de la República Mexicana, el cáncer gástrico ocupa el
primer lugar dentro de los del aparato digestivo.
ANATOMÍA PATOLÓGICA
167
RESUMEN:
El cáncer es una enfermedad cuya existencia es conocida desde tiempos muy antiguos. El
cáncer de estómago es el primero dentro de los tumores de tubo digestivo. Es un tipo de
crecimiento tisular maligno producido por la proliferación contigua de células anormales.
La OMS calcula que cada año hay alrededor de 10 millones de casos nuevos. En México,
la mortalidad por tumores malignos se ha incrementado de 9.7% en 1990 a 12.9% en
2006. En las estadísticas de mortalidad de la República Mexicana, el cáncer gástrico
ocupa el primer lugar dentro de los del aparato digestivo.
Su incidencia varía de forma alta en países como Japón, Chile, Costa Rica, Colombia,
China, Portugal, Rusia y Bulgaria, entre otros.
Existen varias clasificaciones del cáncer de estómago: la de Jarvy y Lauren que es
microscópica, la de Borrmann que es macroscópica y la de la American Joint Commissión
on Cancer (AJCC ó TNM).
Entre los factores de riesgo están los siguientes: la infección por Helicobacter pylori, sexo
masculino, la dieta, gastritis crónica atrófica, edad entre 50 y 60 años, etc. Se suele
presentar dentro del cuadro clínico de manera característica la metástasis de ganglios a
nivel supraclavicular izquierdo (ganglio de Virchow), presión retroesternal, pérdida de
peso, regurgitaciones, náusea, vómito, disfagia, anorexia, pirosis, anemia perniciosa, entre
muchos otros síntomas.
Su manejo es quirúrgico y en casos avanzados, se acompaña de radiación y
quimioterapia.
ANATOMÍA PATOLÓGICA
168
ANTECEDENTES:
El cáncer es una enfermedad cuya existencia es conocida desde tiempos muy antiguos,
pero ha comenzado a tener importancia a lo largo del siglo XX por la magnitud de las
cifras de mortalidad que ocasiona.
Hipócrates (460-370 a. C), cuyo nombre es sinónimo de la profesión médica a lo largo de
un buen trecho de la historia humana, crea los conceptos de enfermedad natural y
describe, basándose en la observación del enfermo, tumores de piel, mama, estómago,
cérvix y recto. Con su escuela contribuyó al conocimiento humano inicial acerca del cáncer
y su clasificación, creando los términos “carcinos”, “carcinoma” y metástasis.
Galeno (130-200 d. C) formuló una teoría humoral sobre el cáncer cuya influencia persistió
durante un milenio, y fue quien describió el cáncer gástrico y el de esófago.
La importante contribución del mundo árabe a la cultura también trascendió al saber
médico sobre el cáncer, y quedó personalizada en Avicena (980-1037 d. C), en Bagdad,
que describió cómo un cáncer aumenta de tamaño progresivamente, invade y destruye los
tejidos contiguos y, finalmente, los mata y elimina la sensibilidad en la parte afectada.
También fue cordobés Avenzoar (1070-1162 d. C), quien describió los rasgos clínicos de
los cánceres de esófago y estómago y recomendaba usar sondas de dilatación para
tratarlos; con éste procedimiento también confirmaba el diagnóstico.
El desarrollo de la anatomía en el siglo XVI facilitó la aparición de personajes como
Falopio (1523-1562 d. C), discípulo de Vesalio, profesor de anatomía que describió
valiosas observaciones anatómicas de diferentes variedades de cánceres y que trataba los
casos avanzados con pastas a partir de arsénico, que hoy se sabe que es carcinógeno
para el hombre.
El descubrimiento del sistema linfático, a través del cual se diseminan la mayor parte de
los cánceres, ha sido un punto clave, sin embargo, se tardó mucho tiempo en aplicar éste
conocimiento a la práctica. Su descubrimiento se atribuye a Gaspare Aselli (1581-1625 d.
C).
ANATOMÍA PATOLÓGICA
169
Henri Fraҫois Le Dran (1685-1770 d. C), hizo una descripción novedosa del cáncer: creía
que comienza por una lesión local, posteriormente se disemina por los vasos linfáticos
hasta los ganglios linfáticos regionales y luego alcanza la circulación general.
Los estudios morfológicos de los tumores alcanzan su plenitud histórica con el alemán
Virchow, quien vivió casi todo el siglo XIX, y logró darle un tinte morfológico, incluso
excesivo, al conocimiento de los cánceres. En 1863 expuso la hipótesis de que el origen
del cáncer se hallaba en las áreas de inflamación crónica, basado en la idea de que la
irritación, el daño tisular y la inflamación favorecían la proliferación celular.
Así, mientras que el daño tisular puntual y la reacción inflamatoria aguda que se genera es
un proceso autolimitado, el daño crónico o la inflamación mantenida en el tiempo conduce
a una proliferación tisular sostenida que predispone al desarrollo de neoplasias.
El nacimiento de una serie de organismos internacionales ha conseguido aunar los
esfuerzos de todos los países del mundo para luchar contra esta enfermedad. La aparición
de la UICC (Unión Internacional Contra el Cáncer), con sede en Ginebra, facilitó la
unificación de una clasificación internacional de los tumores por su estadio evolutivo
(clasificación TNM).
La primera clasificación para cáncer de estómago se hizo en 1966 por la Unión
Internacional Contra el Cáncer (UICC).
A principios de los años 70 Pelayo Correa y sus colaboradores proponen la conocida
secuencia carcinogénica de inflamación, atrofia, metaplasia, displasia y carcinoma. Esta
hipótesis, conocida como "cascada de Correa", surge a partir de estudios epidemiológicos
en los que se identifican factores de riesgo de CG. Estos factores incidirían tanto en
procesos de naturaleza autoinmune (anemia perniciosa), como de naturaleza ambiental.
Hasta 1988 el adenocarcinoma de estómago era la causa principal de muerte a nivel
mundial por cáncer en los años 80; se hizo una estimación de 670, 000 nuevos casos/año.
En Estados Unidos de Norteamérica hasta hace 60 años aproximadamente, era el
carcinoma más frecuente dentro de las afecciones al aparato digestivo; pero su frecuencia
ha venido disminuyendo gradualmente hasta ocupar el tercer lugar, después del
carcinoma de colon y de páncreas.
ANATOMÍA PATOLÓGICA
170
En un estudio prospectivo realizado durante 15 años en 6 instituciones hospitalarias de la
ciudad de México, el carcinoma gástrico ocupó el primer lugar en el Hospital General de la
Secretaría de Salud, en el Hospital Juárez de la misma Secretaría, y lo ocupó hasta su
desaparición en el Instituto Nacional de la Nutrición “Salvador Zubirán”.
En el centro hospitalario 20 de Noviembre del ISSSTE inicialmente durante los 2 primeros
años, la frecuencia del carcinoma de colon fue mayor que la del carcinoma gástrico; pero
en los últimos 12 años el carcinoma gástrico ocupó el primer lugar (éste hospital se abrió a
2 millones de derechohabientes de bajo nivel económico). En el Hospital Español durante
todos estos años el carcinoma de colon ha ocupado el primer lugar seguido del carcinoma
gástrico.
Durante 15 años de estudio se ha venido observando que el carcinoma gástrico ha venido
disminuyendo paulatinamente en los últimos años, en el Instituto Nacional de la Nutrición y
en el Hospital General de la Secretaría de Salud. Por otra parte se ha observado un cierto
aumento en la frecuencia del carcinoma colorrectal. Lo anterior atribuido a que el
mexicano no sigue comiendo lo que comía previamente, ya que la ciudad de México ha
crecido mucho y mucha gente come fuera de su casa, sustituyendo la comida tradicional
mexicana por comida más abundante en grasas y, probablemente, un poco más de
proteínas pero con menor proporción de fibra.
Esta variación en la frecuencia del carcinoma gástrico en diversos países y en las
poblaciones de varias instituciones hospitalarias de la ciudad de México, hacen considerar
que lo más probable es que exista una variación y una diferencia en cuanto a la
alimentación y al ambiente que establecen las diferencias mencionadas.
ANATOMÍA PATOLÓGICA
171
DEFINICIÓN:
El cáncer de estómago o cáncer gástrico es el primero dentro de los tumores de tubo
digestivo. Es un tipo de crecimiento tisular maligno producido por la proliferación contigua
de células anormales con capacidad de invasión y destrucción de otros tejidos y órganos.
CLASIFICACIÓN:
Existen varias clasificaciones del cáncer de estómago.
Por su histología se utiliza la clasificación de Jarvy y Lauren (de Finlandia) que divide a
los carcinomas gástricos en dos tipos:
Difuso: se caracteriza por células mal diferenciadas que se acumulan en
hojas o nódulos y que carecen de estructuras en forma de glándulas. De
prevalencia endémica. No se relaciona con lesiones precursoras del
estómago, y es más frecuente en mujeres y personas jóvenes.
Intestinal: se caracteriza por la formación de glándulas y es de aspecto
parecido al carcinoma de colon. De prevalencia epidémica. Se relaciona con
gastritis atrófica y metaplasia intestinal, y es más frecuente en varones y
ancianos.
A B
Figura 1: Imágenes microscópicas: A es de tipo intestinal y la B de tipo difuso (Tomadas de Bullard.G, Cancino.V, Rojas.D, “Cáncer Gástrico”, presentación).
ANATOMÍA PATOLÓGICA
172
De acuerdo con su morfología macroscópica Borrmann los clasifica en cuatro tipos:
Tipo I: es de aspecto polipoide, circunscrito con crecimiento hacia la luz del
estómago.
Tipo II: es el ulcerado, circunscrito de bordes bien limitados y con poca
infiltración en su base.
Tipo III: es el ulcerado, no bien circunscrito con infiltración en la base de la
lesión.
Tipo IV: es el carcinoma infiltrante difuso que abarca varias zonas de la
pared gástrica
Figura 2: Clasificación macroscópica de Borrmann. (Tomada de Bullard.G, Cancino.V, Rojas.D, “Cáncer Gástrico”, presentación).
ANATOMÍA PATOLÓGICA
173
La clasificación American Joint Commissión on Cancer (AJCC ó TNM), 1988, modificada
2002, para cáncer de estómago es la siguiente:
Tumor primario
TX El tumor primario no puede ser evaluado
T0 No hay evidencia de tumor primario
Tis Carcinoma in situ
T1 El tumor invade la lámina propia o la submucosa
T2 El tumor invade la propia muscular
T3 El tumor invade la adventicia
T4 El tumor invade estructuras adyacentes
Ganglios linfáticos regionales
NX Los ganglios linfáticos regionales no pueden ser evaluados
N0 No hay metástasis de ganglios linfáticos regionales
N1 Metástasis del o los ganglios linfáticos perigástricos dentro de los 3 cm con
respecto al borde del tumor primario
N2 Metástasis del o los ganglios linfáticos perigástricos más allá de 3 cm del borde del
tumor primario, o en ganglios linfáticos a lo largo de las arterias gástrica izquierda,
común hepática, esplénica o celíaca.
Metástasis a distancia
MX La presencia de metástasis a distancia no puede ser evaluada
M0 No hay metástasis a distancia
M1 metástasis a distancia
ANATOMÍA PATOLÓGICA
174
ESTADIFICACIÓN (De la AJCC ó TNM):
CLASIFICACIÓN DE GRADO
Estadio 0 Tis, N0, M0
Estadio IA T1, N0, M0
Estadio IB T1, N1, M0
T2, N0, M0
Estadio II T1, N2, M0
T2, N1, M0
T3, N0, M0
Estadio IIIA T2, N2, M0
T3, N1, M0
T4, N0, M0
Estadio IIIB T3, N2, M0
T4, N1, M0
Estadio 0 T4, N2, M0
Cualquier T, cualquier N, M1
ANATOMÍA PATOLÓGICA
175
FACTORES DE RIESGO:
El cáncer tiene un origen multifactorial y su desarrollo depende de la interacción de los
genes del organismo con el medio ambiente.
Dieta: el descenso del carcinoma gástrico en E.U.A. (que fue del 70% entre 1930 y
1970), se atribuye fundamentalmente a la ingestión de vitamina C, ya sea en forma
de cítricos o en forma suplementaria, al uso de la refrigeración que eliminó gran
parte de los alimentos salados utilizados para su conservación y a la disminución de
ingesta de alimentos ahumados. Se considera que los tomates, zanahorias,
lechuga, y sobre todo las frutas y legumbres con alto contenido de vitamina C y
beta-carotenos tienen un factor protector contra el desarrollo del cáncer evitando la
nitrosaminación de los alimentos.
Nitritos y nitratos: favorecen el desarrollo del cáncer gástrico. Se considera que la
alta concentración de nitritos y nitratos se debe al uso de fertilizantes con estas
substancias que se transforman en nitrosaminas y nitrosamidas que tienen
capacidad mutagénica.
Lesiones precancerosas: el carcinoma gástrico nunca se desarrolla en un estómago
sano, siempre existe una lesión precursora del mismo.
Metaplasia intestinal: esta lesión (cambio en la estructura de un tejido maduro a otro
tejido maduro distinto) junto con gastritis atrófica se encontraron en alta proporción
y se consideraron precursores del carcinoma gástrico, y se pueden considerar
como una etapa del desarrollo del mismo.
Gastritis atrófica: se ha señalado como uno de los precursores de los pólipos y del
carcinoma gástrico, y se le ha considerado en dos tipos: la de tipo A es difusa y
ANATOMÍA PATOLÓGICA
176
tiene anticuerpos para las células parietales y con frecuencia se asocia a procesos
autoinmunes con desarrollo de tiroiditis y otras endocrinopatías; el tipo B que
parece asociarse con mayor frecuencia al desarrollo de carcinomas gástricos
Anemia perniciosa: la gastritis crónica de la anemia perniciosa está clasificada
como de tipo A (autoinmune) y afecta al cuerpo y fondo del estómago, más que el
antro.
Pólipos: los pólipos hiperplásicos son más frecuentes que los adenomatosos que
tienen alto riesgo de malignidad.
Úlcera gástrica: se considera que menos del 5% de las úlceras gástricas pueden
malignizarse. Es importante distinguir entre una úlcera gástrica benigna y un cáncer
gástrico ulcerado y esto se precisa por medio del estudio endoscópico con tomas
de múltiples biopsias en los bordes de la lesión.
Herencia: presentar un tipo de grupo sanguíneo A (que está señalado como el tipo
más común asociado con cáncer gástrico) y tener un antecedente de cáncer
gástrico familiar de primer grado.
Helicobacter pylori: se ha encontrado una frecuencia significativamente mayor de
Helicobacter pylori en pacientes con carcinoma gástrico que en sujetos normales.
Dicha frecuencia es más grande en el carcinoma de tipo intestinal que en el difuso.
Sexo masculino: proporción hombres – mujeres es de 2 a 1.
Edad entre 50 y 60 años en adelante (puede aparecer en personas más jóvenes).
Estómago operado: se ha descrito mayor frecuencia de cáncer gástrico en los
pacientes operados por gastrectomía, señalándose una proporción de hasta 6
veces mayor que en los grupos control. Se ha considerado que se debe al
desarrollo de gastritis atrófica, y se considera que el reflujo biliar puede ser otro
factor.
ANATOMÍA PATOLÓGICA
177
EBV: el virus del Epstein-Barr daña el tejido epitelial del estómago de manera
directa y constante, quizás a través de la reacción inflamatoria a la infección. 13
Figura 3: Helicobacter Pylori, forma basilar, con la presencia de flagelos bipolares. (Tomada de un archivo pdf sobre H. pylori en www.google.com).
Figura 4: Pólipos gástricos en unión antroduodenal. (Tomada de muestras laparoscópicas de www.google.com).
ANATOMÍA PATOLÓGICA
178
PATOGENIA:
Por su comportamiento biológico y diferencias epidemiológicas, el cáncer gástrico ha sido
dividido en proximal y distal. La incidencia de las lesiones distales ha disminuido de
manera importante en los últimos 50 años, por lo contrario las lesiones proximales han
aumentado, sobre todo en pacientes menores de 40 años.
El tumor de cáncer gástrico inicia como una lesión localizada que con el paso del tiempo
se disemina para invadir estructuras adyacentes, linfáticas y hematógenas. Las metástasis
a distancia son a hígado, peritoneo, región periumbilical (nódulo de la hermana Mary
Joseph), ovarios (Tumor de Krukenberg), al fondo de saco (Tumor de Blumer), de
intestino delgado, de mama, etc.
El cáncer gástrico temprano o incipiente se refiere a todo adenocarcinoma (más frecuente
90%) con invasión en profundidad hasta la mucosa, submucosa o ambas hasta la lámina
propia del estómago y es también llamado “cáncer gástrico superficial”
independientemente de su tamaño, de la presencia de metástasis a distancia. La
frecuencia con que se diagnostica ha aumentado como resultado de mejores evaluaciones
endoscópicas. Sin embargo en países de baja frecuencia sólo se diagnostica en 5 a 10%
de los casos y en los de alta frecuencia donde se realizan estudios de escrutinio (Test de
Screening) como Japón donde se diagnostica en más de 35% de los casos.
Los tumores del estómago diferentes del carcinoma son poco frecuentes en relación con
éste. Desde el punto de vista de sus células de origen las neoplásias gástricas se dividen
en tres grandes grupos:
De origen linfoide
De origen mesenquimal
De origen epitelial
Los tres patrones de crecimiento macroscópico del carcinoma gástrico se pueden poner
de manifiesto tanto en las fases tempranas como avanzadas:
1.- Exofítico, con protrusión de una masa tumoral hacia la luz
ANATOMÍA PATOLÓGICA
179
2.- Plano o infiltrante, en el que no existe una masa tumoral obvia dentro de la
mucosa
3.- Excavado, con un cráter erosivo, superficial o profundo, en la pared del
estómago.
Los tumores exofíticos se identifican con facilidad mediante técnicas radiográficas y en la
endoscopía, y pueden contener porciones de un adenoma. En contraste, la lesión maligna
plana puede pasar por alto incluso al examinador experto, excepto por borrado regional
del patrón mucoso superficial normal. Los cánceres excavados pueden imitar muy bien, en
tamaño y aspecto, a las úlceras péptica crónicas. En los casos avanzados los cráteres
cancerosos se pueden identificar por sus márgenes sobresalientes, arrosariados, y bases
desgarradas, necróticas así como por el tejido neoplásico franco que se extiende en la
mucosa y pared adyacentes. Rara vez una región amplia de la pared gástrica o el
estómago entero está extensamente infiltrado por la lesión maligna para crear una
configuración en “bota de cuero”, rígida y gruesa, lo que se conoce como linitis plástica.
Figura 5: Patrones de crecimiento macroscópico del cáncer gástrico. (Tomada de Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición).
ANATOMÍA PATOLÓGICA
180
TUMORES GÁSTRICOS MENOS COMUNES
LINFOMA GÁSTRICO
El aparato digestivo es el sitio más frecuente de desarrollo de los linfomas no Hodgkin de
células B. La mayoría se diagnostican en el estómago pero solo ocupan 5% de las
neoplasias malignas del mismo. Su origen se ha visto relacionado con la infección por
Helicobacter pylori, a enfermedades autoinmunes o deficiencias del sistema inmune
(incluyendo VIH).
En 1961, Dawson y cols descubrieron al linfoma gástrico primario como una lesión gástrica
maligna con ausencia de linfadenopatías superficiales y mediastinales al momento de su
presentación, fórmula blanca normal, y al momento de la laparotomía solo enfermedad
ganglionar adyacente y sin enfermedad tumoral en hígado y bazo. Afecta con mayor
frecuencia al hombre en relación 1.5:1 y ocurre habitualmente en la quinta y sexta
décadas de la vida.
El linfoma MALT o MALToma la lesión inicia con infección por H. Pylori que provoca
gastritis crónica antral, metaplasia intestinal y un cúmulo de folículos linfoides organizados,
posteriormente displasia y carcinoma o linfoma.
El linfoma gástrico aparece habitualmente en la mucosa o en la submucosa superficial. En
el linfoma MALT, un infiltrado linfocítico monomórfico de la lámina propia rodea las
glándulas gástricas, infiltradas de forma masiva por linfocitos atípicos, determinando su
destrucción (la lesión “linfoepitelial”). Rara vez el linfoma de Burkitt, el linfoma asociado
con el sida (sarcoma de kaposi) y el linfoma de Hodgkin pueden ocurrir en el estómago.
TUMORES DEL ESTROMA GASTROINTESTINAL O GIST:
Son los más frecuentes y se cree que provienen de las células intersticiales de Cajal, que
controlan el peristaltismo gastrointestinal. Estos tumores tienen un fenotipo especial, ya
que el 95% de ellos se tiñen con anticuerpos contra c-KIT, y alrededor del 70% se tiñen
para CD 34. Los GIST muestran patrones histológicos diferentes, y pueden ser
ANATOMÍA PATOLÓGICA
181
subclasificados en un tipo fusiforme y otro epiteloide. Los tumores que muestran
características de diferenciación de plexo entérico (llamados tumores de los nervios
autonómicos gastrointestinales o GANT), se clasifican con frecuencia entre los GIST. Rara
vez los GIST gástricos forman parte de un síndrome tumoral, como la triada de Carney
(GIST gástrico, paraganglioma y condroma pulmonar) o la neurofibromatosis tipo 1.
Los GIST pueden ser solitarios o múltiples. El tumor puede protruir hacia la luz,
aplanamiento subyacente de la mucosa. La superficie de corte del tumor es oscura y suele
carecer del patrón arremolinado del musculo liso, de los leiomiomas o de los
leiomiosarcomas. Varía desde ligeramente firme a blando y son comunes los cambios
hemorrágicos. La necrosis o los cambios quísticos se pueden ver en los tumores de gran
tamaño. Microscópicamente, está formado por células fusiformes. La mayoría de los
tumores son muy celulares y la actividad mitótica resulta variable. La mayor parte de las
células tumorales son positivas para c-KIT (CD117), según se demuestra por la tinción
inmunohistoquímica positiva.
La identificación de mutaciones de c-KIT y del receptor del factor de crecimiento derivado
de plaquetas α (PDGFRA) en esos tumores constituye un progreso significativo en la
comprensión de la patogenia de los GIST. El c-KIT es el receptor del factor de la célula
madre, y el PDGFRA es un receptor del factor de crecimiento derivado de las plaquetas
(PDGF).
Se sabe que el 85% de los GIST tienen mutaciones de c-KIT, y el 35% de los GIST con c-
KIT normal contienen mutaciones de PDGFRA. Tanto el c-KIT como el PDGFRA tienen
tirosincinasas citoplásmicas que activan vías intracelulares similares. Las mutaciones
conducen a la activación constitutiva de señales tirosincinasa, lo que favorece la
proliferación celular e inhibe la apoptosis. Las mutaciones de c-KIT y las de PDGFRA
parecen ser mutaciones excluyentes.
Se ha demostrado que un inhibidor de la tirosincinasa diseñado recientemente (el STI571)
es efectivo contra este tumor; tal hecho demuestra la aplicación de una estrategia
terapéutica dirigida para el tratamiento de neoplasias malignas humanas.
ANATOMÍA PATOLÓGICA
182
TUMORES DE CÉLULAS NEUROENDÓCRINAS (CARCINOIDES) GÁSTRICOS.
La mayoría de las células ECL están en la mucosa antral en las glándulas oxínticas. El
tumor puede aparecer en un contexto de la gastritis atrófica crónica, del síndrome de
neoplasia endócrina múltiple tipo 1 (MEN 1) o del síndrome de Zollinger-Ellison. Es
probable que la patogenia subyacente esté relacionada con un estado hipergastrinémico
que conduce a una presunta anomalía pretumoral, la hiperplasia de las células ECL. Es
menos frecuente el carcinoma gástrico esporádico, sin un estado de hipergastrinemia, del
que no se conoce la patogenia. Los tumores carcinoides gástricos presentan
características histológicas similares a las de otros carcinoides.
LEIOMIOMAS:
Son los tumores más comunes que se originan en el musculo liso del estómago. No tienen
predominio de sexo, su tamaño oscila entre 0.5 y 20 cm, son generalmente submucosos,
su sitio de localización es el cuerpo gástrico en la mayoría de los casos. Histológicamente
están compuestos de células en huso, con núcleos rodeados por retículo.
Los leiomioblastomas se presentan en edades tardías y están formados por células
poligonales claras y con aspecto epiteloide.
El leiomiosarcoma es un tumor maligno, constituye el 13% en forma global y el 17.3 % de
los de músculo liso a nivel gástrico. Se describe como una masa bien limitada y con un
área central de necrosis, lo que le confiere el aspecto de cráter. La edad promedio de
presentación es de 57 años, la relación entre hombre/mujer es de 2.4:1.8.
TUMORES DE ORIGEN EPITELIAL
Son una variedad de neoplasias, su significado real se debe a la potencialidad maligna
que poseen. La apariencia macroscópica es de lesiones polipoides sésiles o
pedunculadas. Los tumores pueden ser aislados o acompañar a síndromes de poliposis
como el de Gardner, el de Peutz jeghers, la poliposis juvenil, y el de Cronkite-Canada.
Los pólipos no adenomatosos, es decir los hiperplásicos y los inflamatorios carecen
completamente de potencial maligno.
ANATOMÍA PATOLÓGICA
183
Los pólipos pediculados menores de 3 cm pueden extirparse en su totalidad, los mayores
o de naturaleza sésiles o con difícil acceso por su localización deben ser biopsiados en
forma múltiple, realizándose además cepillado para examen citológico en forma
simultánea.
Si el pólipo es adenomatoso, es importante precisar si la extirpación fue total, con el fin de
establecer con certeza la naturaleza de la lesión y su extensión.
LIPOMAS:
Son neoplasias benignas del tejido adiposo, generalmente localizadas en la submucosa.
CÁNCER METASTÁSICO:
La afectación metastásica del estómago es inusual. Las fuentes más comunes de
metastásis gástricas son los linfomas sistémicos. Las metástasis de melanoma maligno y
las de los carcinomas tienden a ser múltiples y pueden desarrollar ulceración central. El
carcinoma de mama y el de pulmón pueden imitar al carcinoma gástrico difuso, y producir
infiltración generalizada de la pared gástrica para generar linitis plástica.
Figura 7: Cáncer ulcerativo. (Tomada de www.google.com).
Figura 6: Cáncer gástrico avanzado (Borrmann II). (Tomada de www.google.com).
ANATOMÍA PATOLÓGICA
184
A
B
Figura 8: A. imagen de pólipos gástricos en la unión antroduodenal. B. imagen de un leiomioma. (Tomada de Netter.F, “Gastroenterología”, 2006).
Figura 9: Tumor gástrico primario (tomada de www.google.com).
ANATOMÍA PATOLÓGICA
185
Figura 10: Carcinoma gástrico: A, el tipo intestinal muestra formación glandular por células malignas, que están invadiendo la pared muscular del estómago. B, el tipo difuso muestra células de carcinoma en anillo de sello. (Tomada de Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición).
Figura 11: Linfoma MALT gástrico. Nótese las lesiones linfoepiteliales (flechas). (Tomada de Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición).
ANATOMÍA PATOLÓGICA
186
Figura 12: Fotografía macroscópica del tumor, originado en la musculatura propia de la pared gástrica. (Tomada de Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición).
Figura 13: B imagen microscópica del tumor GIST muestra células fusiformes. C, la tinción inmunohistoquímica muestra células tumorales c-KIT positivas. (Tomada de Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición).
ANATOMÍA PATOLÓGICA
187
Figura 14: En la parte superior se encuentra al agente causal: Helicobacter pylori, se observa dentro del estómago imágenes de un linfoma de células B, y MALT con sus correspondientes imágenes microscópicas, además en la parte inferior se observan imágenes de los estadios. (Tomada de Netter.F, “Gastroenterología”, 2006).
ANATOMÍA PATOLÓGICA
188
Figura 15: Se muestran imágenes sobre el carcinoma gástrico con sus respectivas micrografías (Tomada de Netter.F, “Gastroenterología”, 2006).
ANATOMÍA PATOLÓGICA
189
FISIOPATOLOGÍA:
Varios estudios de casos- control han señalado una asociación entre la infección por
Helicobacter pylori y el cáncer gástrico con linfomas del estómago y adenocarcinomas del
intestino y del tipo difuso.
En el cáncer de tipo intestinal, la lesión casi siempre está localizada en un solo foco y
cursa a través de una serie de lesiones del epitelio diversas: gastritis superficial, gastritis
atrófica, metaplasia, displasia y cáncer (secuencia de Correa). Por lo regular, el CG difuso
se distribuye en varios puntos del estómago y no se le ha atribuido algún tipo de lesión
atrófica inicial que favorezca su desarrollo. La infección por H. Pylori se vincula con la
aparición de CG intestinal y difuso y sobre todo con el cáncer distal más que el cardias.
Helicobacter pylori y cáncer gástrico.
H. Pylori es una bacteria que infecta a más de la mitad de la población mundial, de
manera primordial en países en vías de desarrollo. La colonización del epitelio gástrico por
esta bacteria causa gastritis asintomática en la mayoría de los individuos infectados. Sin
embargo, la distribución, gravedad y cronicidad de la gastritis inicial condicionan la apari-
ción de daños más notorios en el epitelio, que pueden propiciar el desarrollo del
adenocarcinoma gástrico. La infección por H. Pylori favorece el establecimiento de un
cuadro inflamatorio crónico posiblemente causante del daño del epitelio gástrico que
progresa al cáncer. La evolución de la infección por H. Pylori es muy variable; la mayoría
de los individuos infectados permanece asintomática y sólo 10 a 20% progresa a la
gastritis atrófica; de ellos, menos de 3% desarrolla CG. Las razones que explican esta
evolución se desconocen, pero se sabe qué factores relacionados con la bacteria (factores
de virulencia), el hospedador (predisposición genética, reacción inflamatoria adjunta) y el
medio ambiente (dieta y estilo de vida) influyen en grado considerable.
Debido a evidencias epidemiológicas que relacionan H. Pylori con el CG, en 1994 la
Agencia Internacional para la Investigación sobre el Cáncer (IARC) clasificó la bacteria
como carcinógeno tipo 1.
ANATOMÍA PATOLÓGICA
190
Factores de virulencia de la bacteria:
La secuencia del genoma completo de H. Pylori, el desarrollo de modelos animales y
mutantes isogénicos, así como el estudio de aislados clínicos de las diferentes afecciones,
han permitido identificar genes que participan en la patogenicidad de la bacteria y su nexo
con el CG. Dentro de estos genes se encuentran los que codifican a las adhesinas, las
cuales posibilitan una adherencia bacteriana a la célula epitelial más estable. OipA es uno
de los factores principales que inducen la secreción de IL-8 por la célula epitelial, suceso
clave en el inicio de la reacción inflamatoria.
El gen cagA reside dentro de la isla de patogenicidad cag (cagPAI), que es una región del
cromosoma que codifica 27 a 31 proteínas que participan en la formación de un sistema
de secreción tipo IV. Este sistema funciona como una jeringa molecular que inyecta CagA,
lipoproteínas y otros productos bacterianos a la célula epitelial y modula la respuesta
inflamatoria. CagA se sitúa en la cara interna de la membrana citoplasmática donde la
fosforilan cinasas Src en residuos de tirosina. CagA participa en la señalización celular,
sobre todo a partir de la activación de las vías de PI3K, PLCγ y Ras, lo que da lugar a
cambios en el patrón de expresión génica de mediadores inflamatorios. También se han
documentado cambios en la estructura del citoesqueleto que modifican la configuración
del epitelio, al afectar sobre todo las uniones apicales. Esto podría utilizarlo la bacteria
para liberar nutrientes dentro de la célula. Las reconfiguraciones del citoesqueleto in vitro
producen cambios en la forma celular, hacia una forma alargada conocida como el
fenotipo de colibrí. Junto con Oip, a cagPAI se le atribuye la inducción de secreción de IL-8
por la célula epitelial.
Las cepas de H. Pylori que carecen de cagA y vacA s1m1 se consideran comensales.
ANATOMÍA PATOLÓGICA
191
Figura 16: Factores de Virulencia de Helicabacter Pylori. (Tomada de www.google.com).
Virus de Epstein-Barr y cáncer gástrico.
Se conocen dos mecanismos directos de transformación a partir de la infección viral. El
primero se debe a la expresión de oncogenes virales que alteran diferentes vías de
señalización celulares o inactivan genes supresores de tumores; el segundo supone la
inserción del genoma viral en sitios críticos del genoma celular. En ambos casos se
afectan sobre todo la capacidad de proliferación y la apoptosis celular.
EBV es un virus del herpes de DNA lineal de doble cadena de 173 kb y es el carcinógeno
biológico conocido más potente. La perpetuación in vitro de células B con EBV es el
suceso de transformación más estudiado, por lo cual EBV se clasifica como un
carcinógeno tipo I, al igual que H. Pylori. Más de 95% de la población mundial adulta se
encuentra infectada por EBV.
ANATOMÍA PATOLÓGICA
192
El virus se transmite de forma bucal, a través del epitelio de la bucofaringe; con
posterioridad infecta a los linfocitos B que transitan por la membrana basal del epitelio,
donde permanece en forma latente. El virus experimenta tropismo por células epiteliales y
en ambos casos se relaciona con procesos cancerosos. Está documentada la relación
causal EBV/cáncer en el linfoma de Burkitt y Hodgkin y los carcinomas del epitelio de la
nasofaringe, estómago y mama.
En estado latente, EBV expresa las siguientes proteínas: EBNA-2, EBNA-3 y EBNA-LP
(factores de transcripción); LMP1 y LMP2A (proteínas de señalización); y EBNA-1 (factor
de segregación cromosómica). Estas proteínas juegan un papel muy importante en la
transformación celular; LMP1 es una proteína integral de membrana y pertenece a la
familia de los receptores TNF (factor de necrosis tumoral). Actúa como un activador
constitutivo del factor de transcripción NF-κB y cinasas de MAP. LMP2A confiere
características transformadoras cuando se expresa en células epiteliales en cultivo, por lo
que podría ser un factor importante en la oncogenicidad de EBV relacionada con cáncer
gástrico. EBNA-1 promueve inestabilidad genómica, actividad que podría explicar la
translocación myc-BCR que caracteriza al linfoma de Burkitt vinculado con EBV.
Debido a que EBV establece una infección persistente que daña el epitelio del tubo
digestivo y respiratorio de forma constante, se ha propuesto que de forma análoga a H.
Pylori, la reacción inflamatoria a la infección contribuye al cáncer. Sin embargo, los
elementos de la respuesta inflamatoria que participan en este proceso se comprenden en
menor medida.
Reacción inflamatoria por agentes infecciosos y desarrollo de cáncer.
La respuesta inflamatoria a agentes infecciosos se caracteriza por la expresión local de
citocinas, quimiocinas y moléculas de adhesión, las cuales regulan el reclutamiento
secuencial de leucocitos y estimulan a fibroblastos y células endoteliales para dividirse y
producir componentes de remodelación de tejido y neovascularización. Esta reacción la
regula en particular la vía NF-κB que activa la trascripción de factores de crecimiento,
genes antiapoptóticos y otras proteínas, como ciclooxigenasa 2 (COX2), sintasa de óxido
ANATOMÍA PATOLÓGICA
193
nítrico inducible (iNOS), citocinas proinflamatorias, moléculas de adhesión, quimiocinas y
metaloproteinasa 9 (MMP9).
En condiciones normales, una reacción inflamatoria se autolimita a través de la
disminución de factores proinflamatorios e incremento de antiinflamatorios. Las células
inmunitarias sufren apoptosis y son fagocitadas, además de que se revierten los cambios
vasculares que facilitaron su conjunción. Se conoce poco acerca del mecanismo de
resolución de la inflamación y de qué forma se evade en infecciones persistentes. Sin
embargo, se observa que la permanencia de los leucocitos es una de las principales
características de la inflamación crónica.
La inflamación inicia con el reconocimiento de ligandos por células del sistema inmunitario
innato, con la utilización de receptores localizados en la superficie celular, en
compartimientos intracelulares o secretados a la circulación, los denominados PRR
(receptores de reconocimiento patrón). Los más importantes son los receptores tipo Toll
(TLR) y los NOD (dominio de oligomerización de unión a nucleótidos). Los NOD son
receptores citoplásmicos y su activación se inicia cuando los peptidoglucanos
internalizados o de microorganismos intracelulares son reconocidos, con lo cual se lleva a
cabo la activación de NF-κB, que a su vez induce la expresión de citocinas
proinflamatorias. Los TLR son proteínas de membrana tipo I, con un dominio extracelular
que reconoce los ligandos y un dominio intracelular Toll/IL-1R (TIR), transductor de
señales. Estos receptores son proteínas altamente similares; hasta la fecha se han
identificado 11 en seres humanos (TLR1 a TLR11) y se expresan en células del sistema
inmunitario y epitelial. Las células epiteliales del estómago expresan TLR2, TLR4, TLR5 y
TLR9. Dentro de las principales funciones de estos receptores figura la activación de la
reacción inflamatoria y la inducción de apoptosis. Estos receptores reconocen estructuras
invariables en los microorganismos, las llamadas PAMP (patrones moleculares
relacionados con patógenos), en los que se encuentran polisacáridos, proteínas y ácidos
nucléicos. También se activan por ligandos endógenos, como proteínas de choque térmico
y otros productos de daño celular. Los ligandos endógenos proporcionan vigilancia
inmunitaria en sitios de inflamación y funcionan como señales de peligro. La activación
sostenida por dichos ligandos favorece la inflamación crónica.
ANATOMÍA PATOLÓGICA
194
La interacción entre los PAMP y TLR produce la activación de células inflamatorias,
dirigida a eliminar a los agentes infecciosos. Sin embargo, puede haber una eliminación
inadecuada del patógeno, una persistencia de las señales proinflamatorias y defectos en
los mecanismos antiinflamatorios, lo que puede llevar a un estado de inflamación crónica y
con ello al desarrollo y progresión del cáncer. La activación de los TLR puede incrementar
el desarrollo del tumor a través de la producción de citocinas y quimiocinas inflamatorias.
El TNF-α es angiogénico e induce la expresión de moléculas de adhesión participantes en
el aumento de la motilidad y comportamiento invasivo-metastásico de las células
tumorales. Las concentraciones elevadas de TNF-α en plasma de pacientes con cáncer se
vinculan con un mal pronóstico. Sin embargo, la activación de TLR4 también puede inducir
la producción de interferones (IFN) α y β, citocinas con efectos antitumorales. Por
consiguiente, mientras algunos factores inflamatorios incrementan el crecimiento y la
sobrevivencia de las células tumorales, otros inducen la regresión del tumor. El resultado
final depende del equilibrio que existe entre los diferentes componentes inflamatorios.
En el microambiente del tumor, la interacción entre varios tipos celulares determina el
efecto de las citocinas sobre el desarrollo y progresión de éste. Las citocinas como IL-23,
TGF-β, IL-6, IL-17 y TNF-α pueden tener efectos directos sobre el crecimiento, la
sobrevivencia y las propiedades invasivas de las células tumorales, pero también pueden
dirigir las funciones de células del sistema inmunitario que infiltran el tumor. TNF-α, IL-6 e
IL-10 pueden funcionar en una forma autocrina y paracrina.
La importancia de la inflamación en el cáncer queda de manifiesto por la presencia de
polimorfismos específicos en la población. Por consiguiente, los polimorfismos de TLR,
NOD, citocinas y quimiocinas representan factores de riesgo o protección en el desarrollo
de diferentes enfermedades, incluido el cáncer. En consecuencia el polimorfismo D299G
de TLR4 se relaciona con un mayor riesgo de desarrollar cáncer gástrico distal y linfoma
MALT (mucosa-associated lymphoid tissue). Estudios de este grupo de investigación
demuestran que los polimorfismos en TLR4 D299G y T399I son más frecuentes en
individuos con cáncer gástrico y su reacción inflamatoria está modificada de forma notable,
lo que puede propiciar la persistencia de la infección y la progresión del tumor. De manera
ANATOMÍA PATOLÓGICA
195
adicional, los polimorfismos en IL-1β, IL-8 y TNF-α se han relacionado con la progresión al
cáncer gástrico.
Entre los marcadores genéticos se han estudiado los polimorfismos de una sola base
(SNPs), los cuales son el tipo más común de polimorfismo en el genoma humano, con una
frecuencia aproximada de uno por cada kilobase. Un buen ejemplo de los SNPs es un
polimorfismo bialélico en la posición -31 en el promotor del gen de la IL-1, el cual ha sido
asociado con el desarrollo de cáncer gástrico en pacientes caucásicos, asiáticos,
portugueses y mexicanos. Esta asociación se ha explicado principalmente porque la IL-1
es un potente inhibidor de la secreción de ácido en el estómago, lo cual promueve el
desarrollo de condiciones preneoplásicas y/o cáncer gástrico. Una de las razones por las
que es importante determinar el papel de estos polimorfismos en cáncer gástrico es
porque se ha reportado que la incidencia de cáncer gástrico en México va en aumento.
Actualmente existen varios métodos disponibles para la genotipificación de SNPs:
métodos basados en las propiedades fisicoquímicas de los alelos, métodos basados en la
hibridación, amplificación o ligación de una sonda alelo específica y métodos basados en
la secuenciación o minisecuenciación de un iniciador adyacente al sitio del SNP, tal como
el método de pirosecuenciación.
La pirosecuenciación es una técnica que no requiere de la elaboración de un gel y que se
basa en la incorporación interactiva de nucleótidos específicos durante la extensión por
una polimerasa guiada por un iniciador de secuenciación. Empleando una mezcla de
cuatro enzimas, el método se basa en la detección luminométrica de pirofosfato que es
liberado una vez que se incorpora un nucleótido, con señales de luz proporcionales al
número de nucleótidos incorporados. 1
La enzima metilentetrahidrofolato reductasa (MTHFR) interviene en el metabolismo de los
folatos. Esta enzima tiene un papel importante en el aporte de grupos metilo para la
reducción de 5, 10-metilen-tetrahidrofolato a 5- metil-tetrahidrofolato, la cual es la forma
predominante de folato circulante y sirve como substrato para la metilación de
homocisteína a metionina con producción de S-adenosilmetionina. Esta última es
considerada como el donador universal de grupos metilos requeridos para la metilación del
ADN. Los niveles bajos de folatos plasmáticos interfieren con la síntesis y reparación del
ANATOMÍA PATOLÓGICA
196
ADN, produciendo hipometilación del ADN, la cual se ha involucrado en la carcinogénesis
gástrica, ya que se asocia con activación de oncogenes y con pérdida de la función de
genes supresores de tumores. Los portadores homocigotos del polimorfismo 5,10-
(MTHFR) 677CT presentan 30% de actividad enzimática con respecto al polimorfismo
nativo mientras que los heterocigotos MTHFR 677CT preservan 65% de la actividad.5 Los
portadores homocigotos del polimorfismo MTHFR TT han sido asociados con cáncer de
mama en pacientes premenopáusicas, cáncer colorrectal, displasia cérvico-uterina y
adenocarcinoma gástrico proximal.
Se ha estudiado el papel del polimorfismo C677T del gen MTHFR como un factor de
riesgo para el desarrollo de cáncer gástrico distal en una población mexicana, pero sólo se
ha podido encontrar que el genotipo 677TT MTHFR es frecuente en la población Mexicana
y se proporciona evidencia de que no hay asociación entre el polimorfismo MTHFR C677T
y el desarrollo de cáncer gástrico distal. 8
La disminución de la expresión de la cadherina epitelial (CDH1) de genes en los casos de
cáncer gástrico difuso puede dar cuenta de las diferencias morfológicas entre intestinal y
difuso variantes. La cadherina epitelial es una glicoproteína transmembrana y desempeña
un papel importante en la arquitectura epitelial, la adhesión celular, y la invasión celular.
CDH1 se asoció primero con cáncer gástrico cuando las mutaciones somáticas fueron
identificadas en muestras de cáncer gástrico difuso. Desde entonces, las mutaciones en la
línea germinal CDH1 se han encontrado en las familias con la susceptibilidad autosómica
dominante con el cáncer gástrico difuso hereditario (HDGC). En un síndrome autosómico
dominante de la susceptibilidad al cáncer, CGDH tiene un promedio de edad de inicio de
38 años para el cáncer gástrico difuso clínicamente detectable. Múltiples mutaciones
germinales CDH1 se encuentran en 30% a 40% de las familias clínicamente definida con
CGDH de diferentes orígenes étnicos. El espectro de mutación CDH1 es heterogéneo e
incluye mutaciones puntuales, pequeñas delesiones e inserciones distribuidas a lo largo
de toda la secuencia de codificaciones. 18
En los carcinomas gástricos, HER-2 (oncogén localizado en cromosoma 17) de
amplificación se encuentra en el 7% al 27% de los tumores.
ANATOMÍA PATOLÓGICA
197
HER-2 sobre-expresión en el carcinoma gástrico se ha informado que se asocia
significativamente con una menor supervivencia. HER-2 es a menudo coamplificado con la
topoisomerasa (TOP2A), el blanco molecular de antraciclinas. La amplificación de HER-2
es asociado significativamente con tumores de tipo histológico (mayormente de tipo
intestinal). 2
Reacción inflamatoria a H. pylori:
H. Pylori induce infiltración en la mucosa gástrica de leucocitos polimorfonucleares,
macrófagos, linfocitos T y B y estimula la secreción de IL-8. Además, se detectan
concentraciones elevadas de TNF-α, IL-6, IL-1β, IL-12, IL-10 e IFNγ. Esta respuesta
provoca cambios importantes en la fisiología del estómago, por daño directo a las células
o regulación de la proliferación celular y la apoptosis. Los neutrófilos y macrófagos liberan
especies reactivas de oxígeno y nitrógeno que pueden inducir cambios irreversibles en el
genoma de las células de la mucosa gástrica. Los niveles de estas especies químicas
disminuyen cuando se elimina la infección por H. Pylori. La infección crónica con H. Pylori
incrementa la expresión de TLR4 y MD-2 (myeloid differential protein-2) en células
epiteliales gástricas y el LPS de H. Pylori aumenta la activación de NF-κB. El TLR4 se
expresa en la zona apical y basolateral de las células epiteliales gástricas en la forma de
gastritis y tiene una distribución homogénea y difusa durante la transformación celular al
cáncer; esto se expresa de manera notoria en células tumorales del carcinoma gástrico.
Es posible que la expresión de Cox-2 y PGE2 en el cáncer gástrico de individuos
infectados con H. Pylori se relacione con la señalización de TLR4, ya que en el cáncer de
colon su expresión la regula este receptor. Más aún, TLR2 y TLR9 intervienen en la
sobrerregulación de Cox-2 a través de activación de Src y NF- κB en mucosa infectada
con H. Pylori. TLR2 y TLR9 también favorecen la invasión y angiogénesis de las células
gástricas.
En adición a los TLR, Nod1 detecta el peptidoglucano de H. Pylori e induce producción de
IL-8 dependiente de NF-κB. Existe un aumento significativo de la carga bacteriana de H.
Pylori de ratones deficientes de Nod1.
ANATOMÍA PATOLÓGICA
198
Además del adenocarcinoma gástrico, H. Pylori se ha vinculado con el linfoma en el
estómago de tipo MALT (tejido linfoide relacionado con la mucosa). Aun cuando la función
de los TLR en la patogenia del linfoma MALT no se ha analizado, la reacción inmunitaria a
la estimulación antigénica crónica por la infección con H. Pylori induce la activación de NF-
κB, lo que da lugar probablemente al desarrollo de este linfoma.
La gastritis atrófica es la lesión inicial y se caracteriza por la muerte de las células
parietales, con pérdida del epitelio glandular que recubre la mucosa del estómago. En este
proceso participan tanto el agente infeccioso como la reacción inmunitaria, el primero al
dañar el tejido, como se explicó en el apartado anterior. De esa forma se reclutan células
del sistema inmunitario en el sitio de infección y median la muerte celular, de tal modo que
se perpetúa el daño.
En fecha reciente se informó que las células troncales de médula ósea también concurrían
en el sitio de infección/inflamación con el objetivo de reconstituir el tejido dañado a partir
de su diferenciación in situ. En un modelo murino de cáncer gástrico, a partir de la
infección con Helicobacter felis, se encontró que el origen de la célula tumoral era la célula
troncal. Esto es muy importante porque permite explicar diferentes capacidades del
proceso canceroso antes no entendidas. Por ejemplo, se sabe de la capacidad ilimitada de
división de la célula tumoral y su plasticidad para formar diferentes estirpes celulares
dentro del tumor son consistentes con la naturaleza pluripotencial de la célula troncal y no
de la célula epitelial del estómago altamente diferenciada. La célula troncal se divide de
modo asimétrico, esto es, una de las células hijas permanece en estado quiescente y por
lo tanto insensible al tratamiento con fármacos que habitualmente se dirigen a las células
en proliferación. La célula troncal quiescente porta la lesión genética que originó el cáncer
y, al entrar de nueva cuenta al ciclo de proliferación, tiene la capacidad de reformar el
tumor, lo cual explica la elevada frecuencia de reincidencia.
El origen del cáncer en células troncales también explica el papel primario y múltiple que la
reacción inflamatoria juega en su aparición. Por un lado, la respuesta inflamatoria
contribuye al daño tisular a través de los radicales libres de N2 y O2. Éstos pueden contribuir
a la mutagénesis de las células troncales durante la regeneración del tejido afectado. Este
ANATOMÍA PATOLÓGICA
199
proceso permite la aparición de clonas resistentes a la muerte celular, o con mayor
capacidad proliferativa, lo que marca el inicio del cáncer.
Durante la gastritis atrófica y la metaplasia gástrica hay reclutamiento de células troncales,
si bien el daño al tejido es reversible y la erradicación de H. Pylori restablece la integridad
de la mucosa. En la etapa de displasia hay progresión al cáncer gástrico a pesar de que el
paciente reciba tratamiento, probablemente debido a que la célula troncal ya porta
alteraciones genéticas irreversibles que guían la progresión del cáncer de forma
independiente a la infección.13
La metaplasia intestinal se define como el remplazo del epitelio normal del estómago por
epitelio de tipo columnar parecido al del intestino delgado o colon. Se han descrito tres
tipos de metaplasia intestinal según criterios morfológicos y de histoquímica de mucina:
Tipo I: se caracteriza por criptas rectas con células en copa y para absorción bien
desarrolladas. Las células en copa contienen sialomucinas, y las células para
absorción no son secretoras.
Tipo II: se caracterizan por epitelio de intestino delgado menos bien diferenciado
Tipo III: se caracteriza por criptas tortuosas con células columnares inmaduras y
células en copa que contienen sulfomucinas. Varios estudios han demostrado que
ésta se relaciona con cáncer gástrico por lo general de tipo intestinal.
La aneuploidía se define como la cantidad anormal de DNA por células y se detecta por
citometría de flujo en muestras frescas o fijadas en formol. Varios estudios han
determinado que se encuentra aneuploidía en 40 a 70% de los adenocarcinomas
gástricos. La aneuploidía se relaciona con un mayor estado patológico y peor
sobrevivencia.
Las alteraciones cromosómicas comprenden deleciones frecuentes de porciones de los
cromosomas 5q, 17p y 18q, que son los sitios de los genes supresores de tumores APC Y
ANATOMÍA PATOLÓGICA
200
MCC, p53, y DCC, respectivamente. Se encuentran anormalidades en estos genes
supresores en 40 a 60% de los tumores gástricos. En el cáncer gástrico avanzado se
encuentra con mayor frecuencia una alteración de p53 lo que se acompaña de un peor
pronóstico
Se han descrito varias alteraciones en los oncogenes de acción dominante en los
adenocarcinómas gástricos. Con frecuencia los oncogenes relacionados con el factor de
crecimiento de fibroblastos (hst-1/ int -2) y los receptores del factor de crecimiento de
fibroblastos (k-sam) están implicados o sobreexpresados la amplificación o sobreexpresión
de HER 2/neu (erbB-2, un receptor relacionado con el receptor del factor de crecimiento
epidérmico) se acompaña de metástasis a ganglios linfáticos y peor pronóstico. A
diferencia de los adenocarcinomas del colon son raras las mutaciones o la sobreexpresión
de la familia ras de los oncogenes en los adenocarcinomas gástricos
Las lesiones precursoras, como gastritis superficial o displasia gástrica, también llegan a
tener alteraciones genéticas, como expresión alterada del receptor met del factor de
crecimiento de cinasa de tirosina, de los oncogenes ras y de p53, sin embargo no se ha
definido por completo la relación con las anormalidades genéticas específicas ni con las
etapas progresivas de la carcinogénesis gástrica.15
ANATOMÍA PATOLÓGICA
201
Figura 17: Etiología y patogenia por Helicobacter pylori. (Tomada de Netter.F, “Gastroenterología”, 2006).
ANATOMÍA PATOLÓGICA
202
CUADRO CLÍNICO:
El carcinoma gástrico tiene la más amplia gama sintomática, que va desde aquellos que
son asintomáticos a los que presentan:
Dolor posprandial inmediato: con sensación de distención abdominal o malestar a
nivel del epigástrio (sensación de llenura al estar comiendo).
Síndrome ulceroso: se observa en forma de dolor posprandial tardío, lo que hace
pensar en lesión ulcerosa y obliga a llevar a cabo estudio endoscópico o radiológico
que permite determinar el diagnóstico, que debe comprobarse por medio de la
gastroscopia y la biopsia
Síntomas de obstrucción pilórica: las presencia de malestar intestinal posprandial
inmediato.
Náusea
Vómito
Disfagia ligera principalmente con sólidos
Dolor u opresión retroesternal baja
Regurgitaciones
Pérdida de peso
ANATOMÍA PATOLÓGICA
203
Anorexia
Eructos
Pirosis
Cuadros diarreicos o constipación por la pobre ingestión de alimentos
Astenia
Hematemesis y melena
Masa palpable a nivel del epigástrio
Ganglios metastásicos a nivel supraclavicular izquierdo (ganglio de Virchow) o
axilares o metástasis pulmonares y metástasis de hígado.
Anemia generalmente hipocrómica.
ANATOMÍA PATOLÓGICA
204
DIAGNÓSTICO:
Pruebas de laboratorio:
Cualquier dato de anemia por deficiencia de hierro indica la necesidad de evaluar el tracto
gastrointestinal, incluso con endoscopia alta y baja del tubo digestivo. Si estos estudios
fuesen negativos, se harán radiografías del intestino delgado con bario. Las alteraciones
de las pruebas de funcionamiento hepático señalen metástasis del hígado. La endoscopia
del tubo digestivo alto es método sensible y específico para diagnosticar tumores del
estómago en un 95% de los casos cuando se toman biopsias de una lesión específica. La
precisión diagnóstica aumenta a 98% cuando se toman 7 biopsias y se hace cepillado o
aspirado citológico.
Los estudios de laboratorio en pacientes con enfermedad temprana son habitualmente
normales, en enfermedad avanzada se encuentra anemia por sangrado crónico y
desnutrición de moderada a grave.
Pruebas de gabinete:
Las pruebas de gabinete tradicionales para realizar el diagnóstico son la serie
esofagogastroduodenal (SEGD) en donde se pueden observar defectos de llenado
positivos, negativos o ambos, lesiones obstructivas o infiltrantes y la endoscopia. En los
últimos años la endoscopia ha sustituido a la SEGD, ya que ofrece mayor sensibilidad
diagnóstica con un 70 a 98% y ofrece la posibilidad de tomar muestras para estudio
histológico, diagnóstico de infección por helicobacter pylori, y en casos de obstrucción
parcial. La posibilidad de colocar una sonda nasoyeyunal para alimentación enteral o una
prótesis intestinal para paliar la ictericia.
Una vez diagnosticado el tumor es de gran importancia conocer la extensión tumoral para
determinar el manejo y el tipo de resección a realizar. El objetivo de la evaluación es
identificar todas las lesiones, determinar si existe invasión a órganos adyacentes,
ANATOMÍA PATOLÓGICA
205
enfermedad ganglionar, metástasis a distancia o a ambas, y si la lesión podrá ser
resecada.
La tomografía computarizada (TC) permite evaluar el grosor y morfología de la pared
gástrica, con la administración oral de 400 a 600 ml de agua se pueden diferenciar las
lesiones tempranas de las localmente avanzadas, también se puede evaluar a los ganglios
linfáticos para ver si hay metástasis en ellos o a hígado, ovarios (tumor de krukenberg) o a
pulmones y serosa.
El ultrasonido endoscópico (USE) tiene mejores resultados para determinar la profundidad
de la infiltración tumoral a la pared gástrica, y presencia o no de enfermedad ganglionar
peritumoral.
La laparoscopia permite la evaluación macroscópica de la cavidad peritoneal
Figura 18: Laparoscopias de cánceres gástricos donde se puede apreciar (en la flecha, el cáncer de estómago a nivel de la mucosa. (Tomada de www.google.com).
Figura 19: A) Carcinoma. Estadio avanzado, se aprecia el tumor gástrico (estrella) y la presencia de adenopatías perigástricas y no perigástricas (flechas). B y C) Linfoma. Engrosamiento parietal homogéneo por LG con múltiples adenopatías a más de 3 cm del tumor (no perigástricas). (Tomada de diagnostico en cáncer gástrico pdf).
ANATOMÍA PATOLÓGICA
206
Figura 20: Adenocarcinoma. A) Corte axial que muestra engrosamiento parietal localizado de la pared gástrica en la curvatura mayor (flecha corta), con compromiso del tejido adiposo perigástrico (flecha larga). Se identifican adenopatías perigástricas (cabezas de flechas). B muestra tres focos hipermetabólicos (flechas): uno en la pared gástrica y dos correspondientes a adenopatías. (Tomada de diagnostico en cáncer gástrico pdf).
Figura 21: Linfoma no Hodgkin: reconstrucción multiplanar “desplegando” la curvatura menor que muestra un extenso sector con marcado aumento de diámetro (flechas cortas) y escaso o ningún compromiso del tejido adiposo perigástrico (flechas largas). (Tomada de diagnostico en cáncer gástrico pdf).
Marcadores:
De los marcadores tumorales hasta ahora descritos, el antígeno carcinoembrionario (ACE)
y el CA 72-4 se encuentra frecuentemente elevados en pacientes con enfermedad
avanzada, y pueden ser utilizados para monitorizar la progresión tumoral durante el
tratamiento. Los niveles elevados de CA 72-4 manifiestan mal pronóstico en pacientes con
cáncer gástrico. Se ha considerado que la expresión del c-erb-B2 puede ser utilizada
como marcador para identificar lesiones de mayor agresividad, lo que puede ayudar a
definir tratamientos.
ANATOMÍA PATOLÓGICA
207
MANEJO/ TRATAMIENTO:
Quirúrgico:
La resección es hasta la fecha el único tratamiento potencialmente curativo para el
cáncer gástrico localizado. El tipo de cirugía a realizar dependerá de los hallazgos de la
evaluación preoperatoria e intraoperatoria ya que solo se recomienda utilizar
laparotomía en pacientes que los estudios de extensión se determine que la lesión será
extirpada en su totalidad.
Para lesiones proximales se recomienda realizar gastrectomía total más esplenectomía
en lesiones que invaden por arriba de la capa muscular, gastrectomía proximal sin
esplenectomía para lesiones limitadas a la mucosa o submucosa. Para lesiones
distales la gastrectomía subtotal es el procedimiento quirúrgico de mayor aceptación
siempre y cuando sea factible dejar un margen de 3 cm desde el borde proximal del
tumor en lesiones de tipo intestinal y de 5 cm para lesiones de tipo difusas. Este
procedimiento tiene menor morbilidad operatoria ya que la fístula de la anastomosis
esofagoyeyunal es una complicación peligrosa que aparece después de la
gastrectomía total, hasta en 8.2% de los casos y va en relación con la agresividad en
que se aplique el procedimiento quirúrgico.
Técnica quirúrgica:
Se debería realizar una incisión bilateral o una incisión abdominal medial para obtener
una adecuada exposición del abdomen superior. Debe ser llevada a cabo una
cuidadosa estadificación intraoperatoria del proceso. También debe realizarse una
meticulosa inspección de zonas alejadas del estómago, para detectar la presencia de
ascitis, diseminación peritoneal, implantes peritoneales o afectación ovárica (tumor de
Krukenberg). En el abdomen superior se debe dirigir la atención hacia el hígado, el
omento mayor, raíz del mesenterio bajo el colon transverso y la presencia de
adenopatía periaórtica. El estómago debe ser inspeccionado para valorar la
localización y extención del tumor. Puede ser necesaria una cuidadosa palpación en
tumores grandes para determinar si hay invación directa a estructuras adyacentes tales
ANATOMÍA PATOLÓGICA
208
como el páncreas. La extensión de la resección gástrica será dictada por el tamaño y la
localización del proceso primarioy se puede llevar a cabo una linfadectomia D-2 para
tumores potencialmente curables.
La gastrectomía subtotal D-2 comienza con la movilización del omento mayor desde el
colon transverso. Es normalmente más fácil continuar dividiendo el ligamento
gastroesplénico tan lateral y superiormente como sea posible. Despúes de mocilizar el
omento, la hoja peritoneal anterior del mesocolon transverso se incide a lo largo del
borde más bajo del colon hacia la cabeza del páncreas y con una combinación de
disecciones punzantes y meticulosas se levanta del mesocolon y de la superficie
anterior del páncreas hacia el nivel de la arteria esplénica. Esto puede resultar una
maniobra tediosa pero teóricamente aporta una protección adicional contra la
propagación serosa del tumor hacia la superficie peritoneal local.
Los ganglios linfáticos infrapilóricos son disecados y se liga el origen de la arteria y
vena gastroepiploicas derechas. A continuación, se palpa el pulso de la arteria hepática
en el ligamento hepatoduodenal y el peritoneo de cobertura es incidido a lo largo de la
arteria hepática hacia el tronco celíaco. El ligamento gastrohepático se divide cerca del
hígado a la altura de la unión gastroesofágica. La arteria gástrica derecha es
identificada y ligada. El tejido que sustenta los ganglios linfáticos y que cubre la arteria
gastroduodenal, por encima del duodeno, se moviliza. En este punto, algunos prefieren
separar el duodeno distal del píloro y exponer el estómago y el omento anterior.
Comenzando cerca del hilio esplénico y procediendo en sentido medial, se disecan los
ganglios linfáticos a lo largo de la arteria esplénica; se puede conseguir homeostasis
por medio de múltiples clips. Se lleva a cabo una disección similar a lo largo de la
arteria hepática en dirección hacia el tronco celíaco. Una vez cerca de este, se diseca
el tejido que sustenta los ganglios linfáticos hasta que se ve la arteria gástrica
izquierda, procediendo entonces a la sección del mismo en su lugar de origen. Las
adherencias peritoneales proximales del estómago y del esófago distal pueden ser
seccionadas procediendo a determinar el borde de resección proximal. Después de
extirpar el tumor se evaluaría la magnitud de la disección retroperitoneal.
A pesar de que el hecho de que todo el flujo sanguíneo del estómago ha sido
interrumpido, el muñón proximal del estómago mostrará una buena vascularización
ANATOMÍA PATOLÓGICA
209
procedente de la arcada distal del esófago. La mayoría de los cirujanos prefieren una
anastomosis del yeyuno con el estómago frente al esófago ya que técnicamente es
más fácil y presenta una excelente cicatrización. Ha sido descrita una gran variedad de
técnicas para la reconstrucción, siendo una elección personal la elección de las
mismas.
Billroth I (Gastroduodenostomia)
Billroth II (Gastroyeyunostomia) Roux
Hoffmann
Figura 22: Técnicas quirúrgicas. (Tomadas de Bullard.G, Cancino.V, Rojas.D, “Cáncer
Gástrico”, presentación).
ANATOMÍA PATOLÓGICA
210
Figura 23: Imágenes de los diversos tipos de tratamiento quirúrgico en cáncer de estómago (Tomada de Netter.F, “Gastroenterología”, 2006).
ANATOMÍA PATOLÓGICA
211
Extensión de la linfadenectomía:
Existe una importante controversia acerca de las ventajas de la disección ganglionar
radical de los ganglios del segundo nivel (D-2) con respecto a la linfadenectomía
limitada a los ganglios linfáticos perigástricos (resección D-1).
Hace aproximadamente 30 años la JRSCG (Japanese Research Society for Gastric
Cancer) propuso una resección estándar D-2 para pacientes con gastrectomía curativa.
Como la cirugía radical para el cáncer gástrico ha llegado a ser uniformemente
aceptada, el índice de mortalidad operatoria con la resección D-2 ha disminuido y ha
mejorado la supervivencia a 5 años después de resección curativa. Se han
comunicado los resultados de más de 20,000 casos procedentes de un registro
nacional, divididos en tres periodos: 1963 – 1966, 1969 – 1973, 1971 – 1985. La
mortalidad operatoria en los primeros 30 días disminuyó de un 3,8% en el primer
periodo a un 1% en el último. Cuando se estratificó a los pacientes con respecto al
estadio, invasión en profundidad, presencia de la invasión de la serosa y metástasis
ganglionares N1 o N2, hubo una mejor supervivencia hubo más supervivencia en el
último periodo comparado en el primero. Sin embargo, la resección radical (D-2) no
mejoró la supervivencia en pacientes con diseminación extraganglionar tales como
metástasis peritoneales, metástasis ganglionar distal, o carcinomas infiltrativos difusos
(linitis plástica). También se llevo a cabo la disección ganglionar linfática extensa
(ELD), cuyo efecto terapéutico fue mayor en pacientes con invasión serosa o con
metástasis ganglionares linfáticas.
Se demostró que el tamaño del tumor y la invasión en profundidad estaban
directamente relacionados con la incidencia de metástasis linfoganglionares y que la
presencia de metástasis satélites era menor al 1%. Las lesiones T1-2 presentaban
metástasis limitadas a ganglios linfáticos perigástricos en un 15 a 40% de los
pacientes, sugiriéndose que en casos de cáncer gástrico precoz la linfadenenctomía
extensa puede erradicar toda la afectación ganglionar. En uno de los estudios, el
tamaño de los ganglios linfáticos metastásicos en 370 pacientes sometidos a la
gastrectomía D-2, era de 7mm, y otros han constatado que los cirujanos pueden
diagnosticar correctamente la implicación metastásica por examinación intraoperativa
macroscópica en solo un 20% de los pacientes. Se ha comunicado que aunque hay
ANATOMÍA PATOLÓGICA
212
una correlación directa entre el tamaño de la adenopatía y la probabilidad de
metástasis, el 30% de todas las adenopatías metastásicas presentan un tamaño
inferior a 3mm. Por consiguiente es poco probable que la linfadenectomía selectiva
basada en la apariencia macroscópica de los ganglios linfáticos, sea fiable o apropiada.
La gastrectomía total D-3, es la omentectomía, esplenectomía, pancreatectomía distal,
linfadenectomía del tronco celiaco y a nivel de la porta hepática, y ha sido realizada en
pacientes con cáncer antral.
Análisis retrospectivos indican que la utilización rutinaria de la linfadenectomía extensa
para cáncer gástrico potencialmente curable puede ser llevada a cabo de manera
segura y puede resultar en un incremento en la supervivencia comparado con la
resección limitada D-1. Datos procedentes de estudios aleatorizados en dos pequeñas
instituciones sobre un limitado número de pacientes no apoya la utilización rutinaria de
la gastrectomía extensa D-2. El grado avanzado de la enfermedad en el momento de la
cirugía en la mayoría de los pacientes supone un factor determinante para la
supervivencia y la presencia de metástasis peritoneal, hepática o ganglionar
inoperables presagia un pronóstico sombrío, a pesar de la resección D-2. La aplicación
rutinaria de la linfadenectomía está siendo actualmente evaluada en varios estudios
aleatorizados en Europa.
Figura 24: Grupos ganglionares (presentación cagas1cancer estomago) (Tomada de Bullard.G, Cancino.V, Rojas.D, “Cáncer Gástrico”, presentación).
ANATOMÍA PATOLÓGICA
213
COMPLICACIONES POST-GASTRECTOMÍA: GASTRECTOMÍA PARCIAL
ULCERACIÓN RECURRENTE:
Las úlceras marginales o úlceras yeyunales son infrecuentes, pero pueden aparecer en
menos del 1% de los pacientes. Habitualmente están motivadas por una inhibición
inadecuada del ácido.
SÍNDROME DEL ASA AFERENTE:
El síndrome del asa aferente se produce únicamente en pacientes a los que se les ha
practicado gastroyeyunostomía. El asa del duodeno, que discurre hasta la
gastroyeyunostomía, puede obstruirse. La obstrucción es parcial o intermitente. Con
frecuencia crea el síntoma de plenitud epigástrica o de dolor abdominal alto, el cual se
alivia únicamente al vomitar. En la mayoría de los casos el vómito es bilis para aliviar la
obstrucción. Ésta puede estar causada por una cicatrización o por adherencias o por una
torsión del asa intestinal. Se establece el diagnóstico cuando se establece el asa dilatada
en el estudio radiológico. La endoscopía puede o no ser útil, pero se requiere para evaluar
la presencia de estenosis o neoplasia. El tratamiento del síndrome del asa eferente es la
cirugía con conversión de la gastroyeyunostomía a una configuración Billroth 1, o en Y de
Roux.
SÍNDROME DE DUMPING Y DIARREA POST-VAGOTOMÍA:
El síndrome de Dumping y la diarrea post-vagotomía pueden ser las complicaciones más
frecuentes de la gastroyeyunostomía, y pueden aparecer en hasta el 5 al 10% de la
técnicas quirúrgicas. Se producen inmediatamente después de comer y los síntomas son
variados y van de malestar epigástrico y una sensación vaga de opresión, episodios
súbitos de sudoración profusa, taquicardia y temblor. Los pacientes suelen sentir alivio al
acostarse en decúbito supino.
El Dumping (vaciado gástrico acelerado) acostumbra a desencadenarse por una
distensión yeyunal al penetrar el contenido gástrico hipertónico rápidamente en el intestino
delgado. En este estado el paciente suele estar hiperglusémico y que es considerado
como último aspecto del síndrome de Dumping.
ANATOMÍA PATOLÓGICA
214
El tratamiento consiste en una dieta estricta que incluye la supresión de los carbohidratos
simples y raciones pequeñas.
GASTRITIS POR REFLUJO DE BILIS:
Cuando la bilis refluye fácilmente de la gastroyeyunostomía hacia el muñón gástrico,
puede provocar una inflamación significativa en el resto del revestimiento gástrico. Los
pacientes pueden desarrollar síntomas y experimentar dolor o vómitos ocasionales. Se
trata de una complicación infrecuente, no obstante suele requerir en casos aislados una
reconversión quirúrgica con una técnica en Y de Roux. El diagnostico debe hacerse
mediante endoscopía y debe demostrarse claramente que la bilis es la causante de la
gastritis.
Conservador: Figura 25: Complicaciones post-gastrectomia: gastrectomía parcial. (Tomada de Netter.F, “Gastroenterología”, 2006).
ANATOMÍA PATOLÓGICA
215
La quimioterapia posoperatoria no ha demostrado mejorar la supervivencia de los
pacientes resecados. Se utiliza la combinación de 5-fluorouracilo (5-FU) (350 mg/m2/día),
adriamicina (40 mg/m2) y mitomicina C (80 mg/m2) principalmente.
La quimioterapia preoperatoria es especialmente útil en pacientes localmente avanzados,
ya que puede disminuir el tamaño tumoral, lo que incrementará las posibilidades de
resección completa. Los medicamentos que más se usan son etopósidos, doxorrubicina,
cisplatino, y 5-FU.
Radioterapia:
En pacientes con cáncer gástrico avanzado se puede administrar una dosis de
aproximadamente 4.000 cGy o terapia combinada con 5-FU como radiosensibilizador (5-
FU durante 3 días, 15 mg/kg/d en bolus). También se puede administrar radioterapia con
quimioterapia con 5-FU, adriamicina, y mitomicina C.
Técnica de radiación:
La presencia de tejidos sanos cerca de la masa tumoral limita la dosis de radiación que
pueda ser administrada sin peligro. La columna vertebral, riñones, intestino delgado, e
hígado están muy próximos y no se pueden evitar en su totalidad. El estómago por sí
mismo es radiosensible y a altas dosis (más de 5.000 cGy) sobre un estómago funcional
producenuna incidencia significativa de ulceración y hemorragia.
Al irradiar el abdomen superior, pueden aparecer efectos secundarios entre los que se
incluyen náuseas, pérdida de peso y fatiga. Con campos de irradiación apropiadamente
planificados, la náusea generalmente no es severa, pero un tratamiento prolongado y en
especial en pacientes con mal estado nutricional, puede ocasionar más perjuicios que
beneficios. Normalmente la combinación de antieméticos, pequeñas dosis de comida y
suplementos nutricionales, serán suficientes, pero en ocasiones las sondas de
alimentación pueden ser útiles. Si el paciente es incapaz de mantener su peso antes de la
iniciación de la radioterapia, la probabilidad de efectos adversos se incrementa. Otros
efectos secundarios agudos son relativamente menores y fáciles de manejar. Los posibles
efectos secundarios tardíos que deben ser considerados, incluyen daño en la columna
vertebral, hígado y riñones.
ANATOMÍA PATOLÓGICA
216
Insuficiencias hepáticas o renales o una mielitis transversa, son complicaciones de un
exceso de radiación, pero una apropiada protección de estas estructuras durante la
planificación del tratamiento, hace que dichas complicaciones sean muy raras en la
práctica clínica diaria. La dosis de tolerancia del estómago por sí mismo, es del orden de
5.000 cGy, por lo que dosis superiores suponen un riesgo renal para la aparición de úlcera
gástrica.
Normalmente, es preciso que un riñón quede expuesto a dosis superiores a 3.000 cGy,
para producirse un fallo ranal importante, habitualmente el riñón izquierdo. Estudios han
demostrado que un paciente con función renal basal normal, el tratamiento de un riñón con
altas dosis de radioterapia no produce habitualmente un fallo renal, que suponga un
deterioro de la calidad de vida del paciente. La hipertrofia compensatoria del riñón no
irradiado. Mantiene una adecuada función renal y el riesgo de hipertensión renovascular
es muy bajo. Si el equivalente de un riñón queda fuera del campo de irradiación y el
paciente comienza con un aclaramiento de cratinina normal, debería tolerar un ciclo de
irradiación en lo que a función renal se refiere. Las dosis de tolerancia estándar de
radiación deberían ser examinadas para los otros tejidos mencionados anteriormente.
Si se utiliza la radioterapia como tratamiento adyuvante o curativo, el patrón de
diseminación del tumor debe ser considerado en la planificación del campo.
Contrariamente a otras localizaciones tumorales, un campo de radiación estándar es con
frecuencia inapropiada para el tratamiento de esta enfermedad, porque las formas de
propagación están relacionadas con la localización de origen y la expansión halladas en
estudios preoperatorios de imagen o en el acto quirúrgico. El patrón de diseminación
linfático ha sido previamente discutido y esto influye enormemente sobre los campos de
radiación apropiados. Aunque normalmente se desee abarcar la mayoría del estómago (o
el lecho gástrico) para muchos tumores que se originan y permanecieron limitados en el
antro gástrico, no es necesario irradiar el cardias entero ni extender el campo de radiación
para abarcar el esófago inferior, pero si es necesario tratar los ganglios linfáticos
periduodenales. De forma similar, para tumores originados del cardias es esencial que el
campo se extienda hasta el esófago, para conseguir una total cobertura del lecho del
cardias gástrico y del fundus, pero se puede evitar irradiar los ganglios periduodenales.
Con frecuencia puede aparecer una recibida local de cáncer gástrico procedente de una
ANATOMÍA PATOLÓGICA
217
extensión posterior del tumor principal sobre el páncreas y en otros tejidos
retroperitoneales. Por ello es esencial la cobertura de estas áreas de invasión posterior.
Los campos de irradiación son principalmente anteroposteriores, aunque los campos
laterales y oblicuos pueden ser útiles en la sobreimpresión final. Si los campos laterales se
utilizan en la radiación principal, entonces se debe evitar el tratamiento de grandes
segmentos de hígado a dosis superiores de 2.000 a 2.500 cGy.
La dosis total de radiación que puede ser utilizada se determina principalmente por la
tolerancia de los tejidos sanos mencionados anteriormente. Generalmente una dosis de
4.500 cGy administrada a 180 cGy/d no produce de forma significativa complicaciones
tardías. A dosis mayores de 5.000 cGy, el riesgo de complicaciones tardías de incrementa,
y dosis mayores que éstas deberán ser limitadas a volúmenes muy pequeños.
Inmunoterapia:
Implica el uso de una proteína con polisacárido (PSK) solo a combinado con la
quimioterapia después de la gastrectomía. La PSK es un polisacárido extraído de coriolus
versicolor cuyo mecanismo de acción no es del todo conocido. Se utilizó un extracto del
citoesqueleto de la pared celular de Nocardia rubra como inmunoterapia y quimioterapia a
base de mitomicina, fluorouracilo y ara-c; también se ha utilizado inmunoterapia con OK-
432 (5.0 Klinishe Einheit) más quimioterapia con mitomicina y fluorouracilo. Se sugiere
que la quimioterapia más un agente inmunoterapéutico pudiera ser beneficiosa en el
tratamiento de pacientes con cáncer gástrico localmente avanzado.
El OK-432, es una vacuna inactivada de una preparación liofilizada de una cepa de baja
virulencia de Streptococcus pyogenes del grupo A, que se desarrollo por Okamoto et al.
Se sugiere que los efectos de OK-432 son que ejerce antineoplásicos por un efecto
citotóxico directo o inhibidor de tumores celulares.7
ANATOMÍA PATOLÓGICA
218
Paliativo:
Otros procedimientos menores son recomendados para paliar la obstrucción, la
perforación, o la hemorragia en pacientes con enfermedad avanzada con la introducción
de prótesis autoexpansibles (PAE). Estos dispositivos en forma de malla tienen la
característica de poderse plagar para favorecer su inserción. Existen prótesis plásticas de
silicona, prótesis de materiales bioabsorbibles y prótesis metálicas de nitinol (más
utilizadas en enfermedad avanzada), que permiten mitigar un poco el dolor y que el
paciente puede ingerir líquido para hidratarse y papillas para nutrirse. Aumenta el
pronóstico de vida en 30 días aproximadamente.20
El uso de la radioterapia paliativa parece estar limitado a la paliación de síntomas tales
como hemorragia o control secundario del dolor por infiltración local. Anque hay datos
mínimos disponibles, la radioterapia parece ser bastante efectiva para controlar la
hemorragia. Esto puede lograr con frecuencia a dosis relativamente bajas de radiación. El
dolor secundario a invasión local del tumor también puede ser paliado aunque las dosis
requeridas son mayores (4.000 cGy).
Figura 26: Prótesis autoexpansibles de diferentes características con su respectivo mecanismo de liberación. (Tomada de Rueda, V,E, “Paliación endoscópica de cáncer gástrico”, Universidad Javeriana, Bogotá Colombia).
ANATOMÍA PATOLÓGICA
219
Tabla No.1: Combinaciones de fármacos utilizadas
TERAPIA SUPERVIVENCIA
MEDIANA
MeCCNU-FU
56 meses
Mitomicina C
No alcanzado
Mitomicina C-UFT 2,3 años
Mitomicina C-FU
Mitomicina C-FU CMFV
16 meses
Mitimicina C-FU-AraC >5 años
Mitomicina C-UFT-AraC >5años
FAM NS
FA 32
Figura 27: Prótesis liberada a través de la unión Gastroesofágica. (Tomada de Rueda, V,E, “Paliación endoscópica de cáncer gástrico”, Universidad Javeriana, Bogotá Colombia).
ANATOMÍA PATOLÓGICA
220
Fármaco Tasa de respuestas (%)
ANTIMETABOLITOS
5- fluorouracilo 21
Carmofur (oral) 19
Florafur (oral) 27
Metrotexato 11
Trimetrexato 19
Triazinato 15
Hidroxiurea 19
ANTIBIÓTICOS
Mitomicina C 30
Doxorrubicina 17
Epirrubicina 19
METALES PESADOS
Cisplatino 19
Carboplatino 5
AGENTES ALQUILANTES
BCNU 18
Metil- CCNU 8
Clorambucil 17
MISCELÁNEOS
Uracil (oral) 27
Etopósido 12
Amsacrina 0
Diazicuona 0
Razoxano 0
Brisantreno 4
Mitoguazona 3
Tabla 2: Fármacos utilizados en tratamiento del cáncer gástrico
ANATOMÍA PATOLÓGICA
221
PRONÓSTICO:
El pronóstico de esta neoplasia en países de baja incidencia es desalentador, ya que la
mayoría de los casos son detectados en etapas avanzadas, y la supervivencia promedio a
5 años oscila entre 5 y 15%. Por otro lado en países con mayor incidencia donde las
lesiones tempranas son diagnosticadas con mayor frecuencia la supervivencia global se
acerca a 45%. Sin embargo, se han identificado factores independientes que influyen
negativamente en el pronóstico como la pobre diferenciación histológica, el tamaño
tumoral que sea mayor de 10 cm, tumores de localización proximal, tipo Borrrmann IV, tipo
difuso, tumores irresecables, presencia de tumor residual, en el lecho quirúrgico y de
metástasis ganglionares.
Los tumores diagnosticados en etapas clínicas tempranas tienen posibilidades de curación
de hasta el 60%. De 85 a 95% de los pacientes con cánceres gástricos precoces
sobreviven más de 5 años, tomando en cuenta el parámetro ganglionar, en los casos que
fueron ganglios negativos (N0), la supervivencia a 5 años fue mayor de 90%, aquellos con
ganglios positivos sólo sobrevivieron 35%.
Los sitios más frecuentes de recurrencia son regionales en peritoneo, ganglios linfáticos y
metástasis hepáticas. El pronóstico en pacientes con linfomas es mejor, y en ellos la
profundidad de la lesión y el tamaño tumoral son los factores pronósticos de mayor
importancia.
ANATOMÍA PATOLÓGICA
222
CONCLUSIONES:
Se considera que el cáncer de estomago ya es un problema de salud pública, aunque su
incidencia ha disminuido, en la antigüedad no se registraba la cantidad de afecciones que
se presentaban en la población y que no era identificada porque no había experiencia en
el tema.
En la actualidad se sabe que uno de los principales factores de riesgo para desarrollar
cáncer de estómago es presentar la gastritis debido a la infección por Helicobacter Pylori,
considerado como el carcinógeno número uno, al estrés, entre otros factores del medio
ambiente y hábitos alimenticios.
Es importante conocer los factores de riesgo, cuadro clínico y los métodos de diagnóstico
para poder obtener un diagnóstico correcto y poder ayudar a los pacientes que presentan
la afección, mediante la administración adecuada del tratamiento y tener en cuenta las
complicaciones que puedan presentarse.
Es impresionante el conocer que la gastritis y la úlcera péptica van de la mano para el
desarrollo del cáncer y que éste a su vez puede dar metástasis hacia los ovarios y que es
conocido con el nombre de Tumor de Krukenberg, puede expandirse hacia mamas, fondo
de saco donde se le conoce como tumor de Blumer y esto puede propiciar un diagnóstico
erróneo.
El buscar la información nos ayuda a comprender la magnitud del problema, conocer la
manera en que actúa y sus consecuencias, además adquieres un conocimiento sobre los
principales medicamentos usados en su tratamiento.
ANATOMÍA PATOLÓGICA
223
BIBLIOGRAFÍA:
Artículos
1. Pérez.P.G.I, Portal.C.C, Bosuqes.P.F.J, Garza.G.E, “Desarrollo de un protocolo de
pirosecuenciación para la tipificación del polimorfismo -31 del gen de la interleucina-
1β en el estudio del riesgo al desarrollo de cáncer gástrico”, Rev Gastroenterol Mex, (72,
Núm. 1), 2007, 14 de febrero de 2007, Pp: 10-14, www.medigraphic.com.
2.- Marx.M.A.H, Tharum.L, Muth.J, Dancau.A.M, Simon.R, et al, “HER-2 amplification is
highly homogeneus, in gastric, cáncer”, 26 november 2008, Human Pathology (2009) 40,
769-777, www, elsevier.com/locate/humpath.
3.- Kim.R.Y, Kim.M.K, Yoo.J.N, Lee.H.S, “Mutational analysis of CASP 1,2,3,4,5,6,7,8,9,10
and 14 genes in gastrointestinal stromal tumors”, 7 de November 2008, Human Pathology
(2009) 40, 868-871, www. elsevier.com/locate/humpath.
4.- Ohtawa.Y, Naomoto.Y, Shirakawa.Y, Takaoka.M, et al, “The close relationship between
heparanase and cyclooxygenase-2 expressions in signet-ring cell carcinoma of the
stomach”, 4 de abril 2006, Human Pathology (2006) 37, 1145-1152.
www.elsevier.com/locate/humpath.
5.- Leys.M.C, Nomura.S, Rudzinski.E, Montgomery.E, et al, “Expression of Pdx-1 in human
gastric metaplasia and gastric adenocarcinoma”, 5 abril 2006, Human Pathology (2006) 37,
1162-1168. www.elsevier.com/locate/humpath.
ANATOMÍA PATOLÓGICA
224
6.- Adán.M.L, Gómez.S.S, Suárez.J, et al, “Adenocarcinoma gástrico en adultos jóvenes;
estudio comparativo con pacientes mayores”, Revista de gastroenterología de México
2010; 3(75):253-260, artículo original,14 de junio de 2010, www.elsevier.es.
7.- Si-Young.K, Ho.C.P, Choong.Y, Hwi.J.Y, Yong.M.C, Kyung.S.C, “OK-432 and 5-
Fluorouracil, Doxorubicin, and Mitomycin C (FAM-P) versus FAM Chemotherapy in
Patients with Curatively Resected Gastric Carcinoma”, 13 abril, 1998, © 1998 American
Cancer Society, Pp: 2054-2059.
8.- Zúñiga.N.J.R, Velazco.C.M.R, Rodríguez.A.A, Martínez.V.L, Garza.G.E,
Maldonado.G.H.J, Bosques.P.F.J, “Polimorfismo C677T del gen MTHFR y el riesgo al
desarrollo de cáncer gástrico distal en una población mexicana”, Rev Gastroenterol Mex,
(72, Núm. 4), 2007, 10 de marzo de 2008, Pp: 355-358, www.medigraphic.com.
9.- Mohar,A, Ley,C, Guarner,J, Herrera,G,R, Sánchez,L, Halperín, D, Parsonnet, J, “Alta
frecuencia de lesiones precursoras de cáncer gástrico asociadas a Helicobacter pylori y
respuesta al tratamiento, en Chiapas, México”, Gac Méd Méx Vol. 138 No. 5, 2002, 01 de
Noviembre de 2001, Derechos reservados, Copyright © 2002: Academia Nacional de
Medicina de México, A.C, Pp: 405-410.
10.- Vaira,D, Zullo,A, Vakil,N, Gatta,L, et al, “Sequential Therapy versus Standard Triple-
Drug Therapy for Helicobacter pylori Eradication”, Ann Intern Med. 2007;146:556-563,
ClinicalTrials.gov registration number: NCT00403364, © 2007 American College of
Physicians, 17 April 2007 Annals of Internal Medicine Volume 146 • Number 8, Pp:556-
563. www.annals.org
ANATOMÍA PATOLÓGICA
225
11.- Bessa.X.S.A, Alameda.F, Munné.A, Gallen.M, et al, “Role of Helicobacter pylori in
stomach cancer after partial gastrectomy for benign ulcer disease”, REV. ESP .ENFERM
DIG (Madrid), Vol. 97. N.° 11, pp. 778-785, 2005, 1130-0108/2005/97/11/778-775
REVISTA ESPAÑOLA DE ENFERMEDADES DIGESTIVAS
Copyright © 2005 ARÁN EDICIONES, S. L, Pp: 778-782.
12.- Kasamatsu.E, Bravo.E.L, Bravo.J.C, García.A.J, et al, “Reproducibilidad del
diagnóstico histopatológico de lesiones precursoras del carcinoma gástrico en tres países
latinoamericanos”, Salud pública de México, (52), No 5, septiembre-octubre de 2010, Pp:
386-389.
13.- Ezequiel Fuentes-Pananá, Ph, Pamorlinga.P.M, Maldonado.B.C, “Infección,
inflamación y cáncer gástrico”, Artículo de revisión, Unidad de Investigación Médica en
Enfermedades Infecciosas y Parasitarias, Hospital de Pediatría, CMN S XXI, IMSS.
México, DF, salud pública de méxico / (51, no. 5), septiembre-octubre de 2009, Pp: 427-
433.
14.- Rodríguez.A, Alvarado.J, Sandler.S.R, Hani.C.A, Sanmiguel.C.P, Gómez.G,
“Asociación entre Infección por Helicobacter Pylori y Cáncer Gástrico en Colombia”,
Artículos originales, Acta Médica Colombiana 2000; 25: 112-116.
15.- Lars-E.H, Olof.N, Ann.W.H, Reinhold.B, et al, “The risk of stomach cancer in patients
with gastric or duodenal ulcer disease”, The New England Journal of Medicine, July 25,
1996, Downloaded from www.nejm.org at HARVARD UNIVERSITY on October 2, 2008 ,
Copyright © 1996 Massachusetts Medical Society.
ANATOMÍA PATOLÓGICA
226
16.- Bruckner.W.H, Lavin.T.P, Plaxe.C.S, Storch.A.J, Livston.M.E, “Absolute Granulocyte,
Lymphocyte, and Monocyte Counts”, Feb 19,1982, (247), No 7, Downloaded from
www.jama.com, Pp: 1004-1006.
17.-Cullinan.A.S, Moertel.G.C, Fleming.R.T, Rubi.R.J, Krook.E.J, Everson.K.L,
Windschitl.E.H, et al, “A Comparison of Three Chemotherapeutic Regimens in the
Treatment of Advanced Pancreatic and Gastric Carcinoma, Fluorouracil vs Fluorouracil
and Doxorubicin vs Fluorouracil, Doxorubicin, and Mitomycin”, abril 12, 1985, (253), No.
14, Pp: 2061-2067.
18.- Kaurah.P, MacMillan. A, Boyd.N, Senz.J, De Luca.A, Chun.N, Suriano.G, et al,
“Founder and Recurrent CDH1 Mutations in Families With Hereditary Diffuse Gastric
Cancer”, junio 6, 2007, (297, No. 21), ©2007 American Medical Association, Pp:2360-
2372.
19.- Caselli.B, Cabrera.J, Molina H, “Analisis de supervivencia en gastrectomía subtotal
por cáncer gástrico. Concepción Chile”, Departamento de cirugía, Facultad de Medicina
Universidad de Concepción, Hospital clínico regional de Concepción, Chile, 15 de
diciembre de 2006, CIMEL, (11), No. 2, Pp: 56-61.
20.- Rueda.V.E, “Paliación endoscópica de cáncer gástrico”, Universidad Javeriana,
Bogotá Colombia, 26 de febrero, © 2010 Asociaciones Colombianas de Gastroenterología,
Endoscopia digestiva, Coloproctología y Hepatología, Pp: 62-67.
Bibliografía de libros consultados:
Friedman, McQuaid, Grendell, “Diagnóstico y tratamiento en gastroenterología”, 2a edición,
3a reimpresión, editorial manual moderno S.A.de C.V, 2007, Capitulo 24, Pp: 417-430.
ANATOMÍA PATOLÓGICA
227
PAC. Gastroenterología, programa de actualización continua en gastroenterología 2,
intersistemas S.A de C.V, México, DF, Abril 2005, Pp 79
Vincent, T,D, “Cáncer, principios y práctica de Oncología”, Volumen 1, 5ª edición, editorial
médica panamericana, Pp: 1021-1049.
Villalobos, P, J,J, “Introducción a la gastroenterología”,3ª edición, Méndez editores,
México, 2000, Pp:345-367.
Senra.V, “El cáncer: etiología, epidemiología diagnóstico y prevención”, año 2002, Pp: 1-
4, Consultado en www.google.com/libros.
Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición, Coordinación y
producción editorial: EDIDE,S.L., Impreso en España por grafos, S,A. arte sobre papel,
copyright © MMVElsevier, Inc., an Elsevier Imprint.
Netter.F, “Gastroenterología”, Editor: Floch.H.M, 2006,MASSON,S.A.
Bibliografía de imágenes:
Imagen de la portada tomada de www.google.com
Figura 1: Bullard.G, Cancino.V, Rojas.D, “Cáncer Gástrico”, presentación.
Figura 2: Bullard.G, Cancino.V, Rojas.D, “Cáncer Gástrico”, presentación.
Figura 3: Helicobacter Pylori, tomada de un archivo pdf sobre H. pylori en
www.google.com
Figura 4: Pólipos gástricos, tomada de muestras laparoscópicas de www.google.com
Figura 5: Crecimiento macroscópico del cáncer, tomada de Robbins.L.S, Contran.S.R,
“Patología Estructural y Funcional”, 7ª edición, Coordinación y producción editorial:
EDIDE,S.L., Impreso en España por grafos, S,A. arte sobre papel, copyright ©
MMVElsevier, Inc., an Elsevier Imprint.
ANATOMÍA PATOLÓGICA
228
Figura 6: Cáncer gástrico avanzado (Borrmann II), tomada de www.google.com
Figura 7: Cáncer ulcerativo, tomada de www.google.com
Figura 8: Pólipos y linfoma, tomada de Netter.F, “Gastroenterología”, Editor: Floch.H.M,
2006,MASSON,S.A.
Figura 9: Tumor gástrico primario, tomada de www.google.com
Figura 10: Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición,
Coordinación y producción editorial: EDIDE,S.L., Impreso en España por grafos, S,A. arte
sobre papel, copyright © MMVElsevier, Inc., an Elsevier Imprint.
Figura 11: Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición,
Coordinación y producción editorial: EDIDE,S.L., Impreso en España por grafos, S,A. arte
sobre papel, copyright © MMVElsevier, Inc., an Elsevier Imprint.
Fifura 12: Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición,
Coordinación y producción editorial: EDIDE,S.L., Impreso en España por grafos, S,A. arte
sobre papel, copyright © MMVElsevier, Inc., an Elsevier Imprint.
Figura 13: Robbins.L.S, Contran.S.R, “Patología Estructural y Funcional”, 7ª edición,
Coordinación y producción editorial: EDIDE,S.L., Impreso en España por grafos, S,A. arte
sobre papel, copyright © MMVElsevier, Inc., an Elsevier Imprint.
Figura 14: Netter.F, “Gastroenterología”, Editor: Floch.H.M, 2006,MASSON,S.A.
Figura 15: Netter.F, “Gastroenterología”, Editor: Floch.H.M, 2006,MASSON,S.A.
Figura 16: Factores de Virulencia de Helicabacter Pylori, tomada de www.google.com
Figura 17: Netter.F, “Gastroenterología”, Editor: Floch.H.M, 2006,MASSON,S.A.
Figura 18: Laparoscopias de cánceres gástricos, tomada de www.google.com
Figura 19: Imágenes de tomografías donde se muestra cáncer gástrico tomada de
diagnostico en cáncer gástrico pdf.
Figura 20: Imágenes de tomografías donde se muestra cáncer gástrico tomada de
diagnostico en cáncer gástrico pdf.
ANATOMÍA PATOLÓGICA
229
Figura 21: Imágenes de tomografías donde se muestra cáncer gástrico tomada de
diagnostico en cáncer gástrico pdf.
Figura22: Técnicas quirúrgicas tomadas de Bullard.G, Cancino.V, Rojas.D, “Cáncer
Gástrico”, presentación.
Figura 23: Procedimientos quirúrgicos, tomada de Netter.F, “Gastroenterología”, Editor:
Floch.H.M, 2006,MASSON,S.A.
Figura 24: Grupos ganglionares tomada de Bullard.G, Cancino.V, Rojas.D, “Cáncer
Gástrico”, presentación.
Figura 25: Complicaciones post-gastrectomia : gastrectomía parcial, tomada de Netter.F,
“Gastroenterología”, 2006.
Figura 26: Prótesis autoexpansibles, tomada de artículo: Rueda, V,E, “Paliación
endoscópica de cáncer gástrico”, Universidad Javeriana, Bogotá Colombia, 26 de febrero,
© 2010 Asociaciones Colombianas de Gastroenterología, Endoscopia digestiva,
Coloproctología y Hepatología, Pp: 62-67.
Figura 27: Prótesis liberada, tomada de artículo:Rueda, V,E, “Paliación endoscópica de
cáncer gástrico”, Universidad Javeriana, Bogotá Colombia, 26 de febrero, © 2010
Asociaciones Colombianas de Gastroenterología, Endoscopia digestiva, Coloproctología y
Hepatología, Pp: 62-67.
Tablas 1y2, tomadas del libro: Vincent, T,D, “Cáncer, principios y práctica de Oncología”,
Volumen 1, 5ª edición, editorial médica panamericana, Pp: 1021-1049.