Bioquimica
-
Upload
niyeredrinconsastoque -
Category
Documents
-
view
15 -
download
2
description
Transcript of Bioquimica
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
PROYECTO FINAL
Presentado por:
NIYERED RINCN SASTOQUE CDIGO: 1 112 228 960
DIEGO ALEJANDRO GONZALES CDIGO: 1116257448
ADIELA TULANDE CDIGO: 1.115.062.815
SANDRA PATRICIA GAUSASOY JIMENEZ CDIGO: 1113629176
NATALIA LIBREROS CDIGO:
Presentado a:
ALBERTO GARCA
Tutor.
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD
ESCUELA DE CIENCIAS BSICAS, TECNOLOGA E INGENIERA
BIOQUMICA GRUPO 201103_61
DICIEMBRE DE 2014
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
INTRODUCCIN
El siguiente trabajo hace referencia a la relacin y recopilacin de los trabajos
colaborativos 1 y 2, en donde la principal idea hace referencia acerca del ADN y
todo lo que est relacionado biolgicamente con l, como son las funciones, la
estructura y las diferentes reacciones que presenta. Se puede decir que el ADN
es esencial para el desarrollo y funcionamiento de todos los seres vivos y algunos
virus, y es responsable de su transmisin hereditaria. El ADN es comparado con
un cdigo, ya que contiene las instrucciones necesarias para construir otros
componentes de las clulas, como son las protenas y las molculas de ARN. Est
compuesto por muchas unidades simples conectadas entre s, donde se puede
encontrar un nucletido, una base nitrogenada y un grupo fosfato.
Para el desarrollo de este trabajo la metodologa utilizada fue realizar un trabajo
grupal en donde cada uno de los integrantes realizaba su aporte en el espacio
asignado llamado foro. El trabajo final tuvo como objetivo recopilar cierta
informacin de los anteriores trabajos colaborativos y complementar con nueva
informacin como son las reacciones presentes en los aminocidos y la
determinacin de valores por regla de chargaff.
Con la realizacin de este trabajo se culmina el curso de bioqumica, investigando
puntos ms complejos acerca de los aminocidos y la presencia de protenas en
insumos y alimentos.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
OBJETIVOS
Objetivo general:
Afianzar los conocimientos obtenidos durante el desarrollo del curso de
Bioquimica.
Objetivos especficos:
Conocer y aprender acerca de la estructura y funciones del ADN
Aprender acerca de los aminocidos y la presencia de protenas en
insumos y alimentos.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
PROYECTO FINAL
ACTIVIDAD 1:
a. Los estudiantes analizaran como los 20 aminocidos proteicos
pueden combinarse en un nmero casi infinito de formas.
Existen 20 aminocidos diferentes sus mltiples combinaciones posibles dan lugar
a una infinidad de protenas resultantes, se pueden mencionar 2 tipos que son:
aminocidos esenciales y aminocidos no esenciales.
Hay mltiples y diversas protenas, en funcin de las diferentes combinaciones de
aminocidos. Dentro de las combinaciones de las protenas se dice que las
protenas entre los qumicos ms importantes para toda la vida, en el planeta la
estructura de las protenas puede variar ampliamente ya que cada protena est
hecha por muchos de los diferentes aminocidos, similar a las letras en el
alfabeto, el orden de los aminocidos en una protena juegan un papel importante
en como funcionara la estructura final.
Como se determina la secuencia de aminocidos tal vez tengas la idea general de
que el ADN es la base gentica para todo lo que eres. La nica funcin del ADN
es determinar el orden de los aminocidos que van en las protenas, el ADN es
simplemente cadenas largas de 4 nucletidos repetidas una y otra vez. Estos
nucletidos son adenina, timina, guanina y citosina y son comnmente
representadas por las letras ATGC. No importa que tan largo sea el ADN, el
cuerpo lee estos nucletidos codificando un aminocido especfico. Por lo tanto
una secuencia de 300 nucletidos dar el cdigo para una protena larga de 100
aminocidos. Por ltimo el ADN hace copias pequeas de s mismas, conocido
como mensajero ARN O MARN, que se encuentra en los ribosomas de tus clulas
donde se hacen las protenas, el ARN utiliza los mismos nucletidos que el ADN
pero utiliza un qumico llamado uracilo en lugar de la timina, de acuerdo a las
letras y los grupos existen 64 posibles combinaciones con orden distinto. Cada
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
grupo de tres es conocido como codn, los cientficos han desarrollado una tabla
que permite que se vea que codn especfico para cada aminocido.
Las protenas pueden ser simplemente una cadena de aminocidos, pero algunas
protenas complicadas son de hecho mltiples cadenas de aminocidos juntas,
adicionalmente las protenas son de diferente longitudes ya que pueden ser solo
un par de aminocidos o ms de 100. Ms aun, no todas las protenas utilizan los
20 aminocidos, una protena puede ser posiblemente tener una longitud de 100
aminocidos y solo utilizar 8 o 10 diferentes.
La secuencia de aminocidos que jams es ramificada en una protena, se
denomina: secuencia primaria. Para conocer la secuencia de aminocidos en la
protena se requiere la aplicacin de muchas tcnicas experimentales. Conocer la
estructura primaria es muy importante porque muchas enfermedades genticas
residen en protenas que poseen una secuencia de aminocidos anormal. Si el
cambio en la secuencia de aminocidos es muy drstico entonces la estructura
tridimensional de la protena mutante (modificada), ser diferente y, por tanto, su
funcin no se llevar acabo de manera adecuada o bien, no se llevar a cabo. Si
se conocen la estructura primaria de la protena normal y la mutada, esta
informacin puede ser utilizada para diagnosticar o bien estudiar a los diferentes
padecimientos. Utilizando mtodos analticos ideados al inicio del decenio de
1950, algunos investigadores determinaron la secuencia exacta de los
aminocidos que constituyen una molcula de protena. La insulina, hormona
secretada por el pncreas, que se utiliza en el tratamiento de la diabetes, fue la
primera protena cuya secuencia de aminocidos en la cadena poli peptdica pudo
determinarse. La insulina contiene 51 unidades de aminocidos unidos en dos
cadenas enlazadas. La estructura de las protenas determina la actividad biolgica
de stas. De ntrelas innumerables conformaciones tericamente posibles de una
protena, generalmente hay una que predomina. Esta conformacin es
generalmente la ms estable y en ese caso se dice que la protena se encuentra
en estado nativo (protena nativa).La actividad biolgica de una protena puede ser
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
afectada por cambios en la secuencia de aminocidos o en la conformacin de la
protena. Cuando ocurre una mutacin (cambio qumico en un gen) que ocasiona
un cambio en la secuencia de aminocidos de la hemoglobina, puede producirse
un trastorno: anemia de clulas falciformes. Las molculas de hemoglobina en una
persona con anemia de clulas falciformes tienen el aminocido valina, en vez de
cidoglutmico en la posicin 6, es decir, el sexto aminocido del extremo terminal
de la cadena beta. La sustitucin de la valina con una cadena lateral sin carga
porglutamato con una cadena lateral con carga hace que la hemoglobina sea
menos soluble y ms propensa a formar estructuras en forma de cristal, lo que
provoca un cambio en la forma de los glbulos rojos. Los cambios en la estructura
tridimensional de una protena tambin alteran su actividad biolgica. Cuando una
protena se calienta o se trata con algunas sustancias qumicas, su estructura
terciaria se distorsiona y la cadena peptdica en espiral se desdobla para dar lugar
a una conformacin ms al azar. Este desdoblamiento se acompaa de una
prdida de su actividad biolgica; por ejemplo de su capacidad de actuar como
enzima. Este cambio en la forma de la protena y la prdida de su actividad
biolgica se Llama desnaturalizacin. En general, la desnaturalizacin no puede
revertirse; sin embargo, en determinadas condiciones, algunas protenas que han
sido desnaturalizadas recuperan su forma original y su actividad biolgica cuando
se restauran las condiciones normales del medio.
El grado de tolerancia a los cambios depende del grado de alteracin de la
geometra que presente la estructura proteica, as como del comportamiento
qumico que tiene la cadena lateral del aminocido sustituido (polar, no polar,
bsico o cido).
b. Existen ms aminocidos fuera de los proteicos? y cul es la
aplicacin bioqumica en los seres vivos y en la industria?
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
Existen otros aminocidos no proteicos que aparecen en ciclos pero no forman
parte de la estructura proteica, algunos aminocidos no proteicos actan como
precursores en el metabolismo por ejemplo de algunas vitaminas, otros
aminocidos no proteicos son precursores de aminocidos proteicos como es el
caso de la citrulina y ornitina que son precursores de la sntesis de la arginina.
En la A. gamma-amino-butrico actan como agentes qumicos para la transmisin
de los impulsos nerviosos (neurotransmisores), en la azaserina actan como
antibiticos y son utilizados en medicina los de tipo D-aminocidos forman parte
de las paredes bacterianas y se supone que la toxicidad es para la defensa de la
bacteria, lo que permiten a las mismas resistir ms fcilmente ante el ataque de
las peptidasas.
La melanina es la sustancia que sintetizan los melanocitos la cual oscurece la piel,
pero tambin se encuentra en algunas neuronas de nuestro cerebro, estas
substancias no seran posibles sin la sntesis del aminocido
Los hongos y plantas superiores poseen una gran variedad de estos aminocidos
algunos de los cuales poseen estructuras muy curiosas.
Las funciones metablicas de la mayor parte de estos aminocidos de las plantas
no se han comprendido todava, sin embargo algunos aminocidos no proteicos
como la canavanina el cido dyenclico y la beta-cianoalanina resultan ser txicos
para otras formas de vida.
c. Explique las variaciones que se dan por los grupos amino y carboxilo de
una protena, al encontrarse en una solucin resiste a cambios en la acidez o
alcalinidad. Cmo se clasifican en los aminocidos las propiedades de sus
cadenas laterales?
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
Los aminocidos puestos en una solucin de pH neutro se comportan como iones
dipolares. Esta es la forma en que se comportan en el pH celular. El grupo amino
(-NH2) acepta un protn hasta convertirse en -NH3 + y el grupo carboxilo dona un
protn convirtindose en -COO- disociado. Segn se mencion, la solucin de un
cido y su base conjugada sirve de amortiguador y resiste cambios en el pH
cuando se agrega un cido o una base. Gracias a los grupos amino y carboxilo de
una protena, al encontrarse sta en una solucin, resiste cambios en la acidez o
alcalinidad y, por lo tanto, desempea las funciones de un importante
amortiguador biolgico. El carbono alfa de un aminocido es un carbono
asimtrico. Por tanto, cada aminocido puede presentarse en dos enantimeros
distintos, o imgenes en espejo. Ambas imgenes se Llaman L-ismero y D-
ismero. Cuando se sintetiza un aminocido en el laboratorio se produce una
mezcla de ismeros L y D. Sin embargo los de los seres vivos son casi
exclusivamente L-ismeros. Una excepcin seran los pocos aminocidos D
presentes en los antibiticos producidos por los hongos.
Los aminocidos cidos tienen cadenas laterales con un grupo carboxilo. En el pH
celular, el grupo carboxilo se disocia de manera que el grupo R tiene una carga
negativa. Los aminocidos bsicos tienen carga positiva debido a la disociacin
del grupo amino en su cadena lateral. Las cadenas laterales cidas o bsicas son
inicas y por tanto, son hidrfilas. Adems de los veinte aminocidos conocidos,
algunas protenas contienen otros aminocidos menos comunes. Estos se
producen por la modificacin de aqullos, al formar parte de una protena. Por
ejemplo, la lisina y la Prolina pueden convertirse en hidroxilisina e hidroxiprolina
respectivamente despus de incorporarse al colgeno. Estos aminocidos dan
origen a enlaces cruzados entre las cadenas peptdicas del colgeno. Dichos
enlaces aportan la firmeza y la fuerza de las molculas del colgeno, que es uno
de los principales componentes del cartlago, del hueso y de otros tejidos
conectivos.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
Los aminocidos proteinogenos se denominan tambin aminocidos estndar sus
denominaciones comunes se derivan a menudo de la fuente que fueron aislados
por primera vez; as, por ejemplo la Asparagina de los esprragos. A menudo los
aminocidos se representan con una abreviatura; el denominado cdigo de tres
letras acostumbra a formarse a partir de las tres primeras letras de la
denominacin comn.
En funcin de su cadena lateral, los aminocidos se diferencian en tamao, forma,
polaridad elctrica o carga y reactividad qumica; esta variedad en los
constituyentes contribuye de forma decisiva a la diversidad de la protena,
dependiendo de la polaridad de su cadena los aminocidos se clasifican en tres
grandes grupos, la mitad (diez) de todos los aminocidos estndar disponibles de
una cadena lateral apolar.
Estos aminocidos laterales apolares se disuelven bastante mal en agua debido al
denominado efecto hidrofobico tienden a su agregacin, que a su vez desempea
un papel considerable en el plegamiento proteico.
La glicina como enano dentro de los aminocidos ocupan un lugar especial: si
hay un espacio estrecho, en una estructura proteica se deja a menudo para este
resto, que es el mnimo posible, la Alanina, valina y leucina, la isoleucina, la
metionina y la Prolina, son cadenas laterales apolares alifticas. La alanina, la
valina y la leucina se diferencian por el nmero de tomos de C de su cadena
lateral. La leucina y la Isoleucina son ismeros de constitucin. Esta variedad
tamao de las cadenas laterales hidrofbicas permiten rellenar de forma exacta el
espacio interior de las protenas.
La metionina lleva un grupo tioter apolar en la cadena lateral. La prolina es el
nico aminocido que contiene el grupo secundario (-NH-); en este
grupo, la cadena lateral se cierra formando heterociclo pirrolidinico. Esto restringe
la libertad de conformacin de la prolina, hecho que a su ve tiene efecto sobre el
plegamiento de la protena. La fenilamina, la tirosina y el triptfano llevan grandes
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
cadenas laterales aromticas con anillos cerrados, la tirosina y el triptfano son
claramente menos hidrofobico que la fenilalanina debido al grupo hidroxilo y al
tomo de nitrgeno, respectivamente, los sistemas de estos
aminocidos absorben la luz ultravioleta en la zona de aproximadamente 280 nm;
esto es importante para analizar las protenas durante el proceso de purificacin.
El quinteto formado por la serina y la Treonina, la cistena, la asparagnina, y la
glutamina, tienen cadenas laterales hidrofilias polares; sus grupos funcionales
forman puente de H con el agua que la rodea, la serina y trionina llevan un grupo
hidroxilo en la cadena lateral de diferente longitud.
ACTIVIDAD 2
Alimentos, Insumos que
tienen Protena
Tipo de Protena
Descripcin
Importancia
Bioqumica
Algodn en Ropa
celulosa
Tambin es un polmero de la glucosa, y es natural.
Los seres vivos no podran existir sin polmeros: toda planta y animal requiere de ellos.
Cuero para
Zapatos
Colgeno
Comprende aproximadamente un 30 a un 35 % de protena, que en su mayor parte es colgeno, siendo el resto agua y grasa.
Es una protena, es el elemento bsico de la piel, huesos, ligamentos, tendones y cartlagos, incluidos los de las articulaciones. Est constituido por largas cadenas de
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
aminocidos que forman las fibras. Estas aportan resistencia y flexibilidad a los tejidos.
Ciruela pasa
aminocidos
cido asprtico, cido glutmico, alanina, arginina, cistina, Fenilalanina, glicina, histidina, isoleucina, leucina, lisina, metionina, Prolina, serina, tirosina, treonina, triptofano y valina. Estos aminocidos se combinan para formar las protenas de las ciruelas pasas.
Nuestro cuerpo
usa las
protenas de
las ciruelas
pasas para
construir los
tejidos que
forman nuestros
msculos. Estas
protenas
tambin son
tiles y
necesarias para
mantener
nuestros
msculos.
Queso
parmesano
beta-lattoglobuline
y alfa-
lactoalbmina
Que se agrupan
bajo el nombre
comn de
protena de
suero de la
leche.
El contenido en protenas de la leche de vaca incluye diferentes tipos de protenas. El ms abundante, denominada casena (del latn Caseus queso)
Gelatina Protena Fibrosa (Elastina, colgeno)
Proteccin y soportes de los tejidos como las uas y la piel.
Sirven como sostn de organismo.
Panes Protena Permiten los Captura los
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
Vegetal(Glutelinas) panes sean esponjosos
gases fermentados
Algas Espirulina Complemento nutricional
Excelente reforzante y constituyente
ACTIVIDAD 3
a. Estructura del ADN:
NUCLETIDO COMPONENTES Nucletidos que forman parte del
ADN
Son molculas
orgnicas
formadas por la
unin covalente
de un
monosacrido de
cinco carbonos
(pentosa), una
base nitrogenada
y un grupo
fosfato. Tambin,
son los
monmeros de
los cidos
nucleicos (ADN y
ARN) en los
cuales forman
cadenas lineales
de miles o
Un grupo fosfato,
una base
nitrogenada y un
azcar, la
desoxirribosa.
Bases nitrogenadas: derivan de
compuestos heterocclicos aromticos,
la purina y la pirimidina.
Bases nitrogenadas purnicas: son la
adenina (A) y la guanina (G). Ambas
entran a formar parte del ADN y del
ARN.
Bases nitrogenadas pirimidnicas: son
la timina (T), citosina (C) y uracilo (U).
La timina y la citosina intervienen en la
formacin del ADN. En el ARN
aparecen la citosina y el uracilo.
Pentosa: el azcar de cinco tomos de
carbono puede ser ribosa (ARN) o
desoxirribosa (ADN).
cido fosfrico: de frmula H3PO4.
Cada nucletido puede contener uno
(monofosfato: AMP), dos (difosfato:
GDP) o tres (trifosfato: ATP) grupos de
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
millones de
nucletidos, pero
tambin realizan
funciones
importantes
como molculas
libres (por
ejemplo, el ATP o
el GTP).
cido fosfrico.
Los nucletidos, por razn de sus
grupos de fosfato, son fuentes
preferidas en las clulas para la
transferencia de energa. Los
nucletidos se encuentran en un
estado estable cuando poseen un solo
grupo de cido fosfrico. Cada grupo
de fosfato adicional que posea un
nucletido se encuentra en un estado
ms inestable y el enlace del fosfato
tiende a romperse por hidrolisis y
liberar la energa que lo une al
nucletido. Las clulas poseen
enzimas cuya funcin es precisamente
hidrolizar nucletidos para extraer el
potencial energtico almacenado en
sus enlaces. Por tal razn un
nucletido de trifosfato es la fuente
preferida de energa en la clula. De
ellos, el ATP (un nucletido de adenina
con tres grupos de fosfato), es el
predilecto en las reacciones celulares
para la transferencia de la energa
demandada. UTP (uracilo + tres
fosfatos) y GTP (Guanina y tres
fosfatos) tambin complacen las
demandas de energa de la clula en
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
reacciones con azcares y cambios de
estructuras proteicas,
respectivamente.
B. La regla de Chargaf determina cantidades iguales de T y A o de C y G que
se encuentran en el DNA, Cmo se puede calcular estos valores? Explique.
Por qu se dice que el ADN se compone de bases complementarias?
La Ley de Chargaff se basa en la relacin cuantitativa de los Nucletidos que
forman la doble hlice del ADN, establece que la cantidad de Adenina( A) es igual
a la cantidad de Timina( T), y la cantidad de Guanina(G) es igual a la cantidad de
Citosina(C), es decir, el n total de bases purinas es igual al n total de bases
pirimdinas( A+G= C+T).
La proporcin de adenina (A) es igual a la de timina (T). A = T. La relacin entre
adenina y timina es igual a la unidad (A/T = 1).
La proporcin de guanina (G) es igual a la de citosina (C). G = C. La relacin
entre guanina y citosina es igual a la unidad (G / C = 1).
La proporcin de bases puncas (A + G) es igual a la de las bases pirimidnicas (T
+ C). (A + G) = (T +
-g C). La relacin entre (A + G) y (T + C) es igual a la unidad (A + G) / (T +
C) = 1.
Segn estas reglas, en un mismo ADN habr la misma cantidad de adenina que
de timina, y la misma cantidad de guanina que de citosina; el 50% de las bases
sern pricas (A + G), y el otro 50% ser de bases pirimidnicas (C + T).
Se dice que el ADN se compone de bases complementarias stas son
compuestos heterocclicos y aromticos con dos o ms tomos de nitrgeno, y,
dentro de las bases mayoritarias, se clasifican en dos grupos: las bases pricas o
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
purinas (adenina y guanina), derivadas de la purina y formadas por dos anillos
unidos entre s, y las bases pirimidnicas o bases pirimdicas o pirimidinas (citosina
y timina), derivadas de la pirimidina y con un solo anillo.25 En los cidos nucleicos
existe una quinta base pirimidnica, denominada uracilo (U), que normalmente
ocupa el lugar de la timina en el ARN y difiere de sta en que carece de un grupo
metilo en su anillo. El uracilo no se encuentra habitualmente en el ADN, slo
aparece raramente como un producto residual de la degradacin de la citosina por
procesos de desaminacin oxidativa.
Las cuatro bases nitrogenadas mayoritarias que se encuentran en el ADN son la
adenina (A), la citosina (C), la guanina (G) y la timina (T). Cada una de estas
cuatro bases est unida al armazn de azcar-fosfato a travs del azcar para
formar el nucletido completo (base-azcar-fosfato).
c. En una tabla, presentar la siguiente informacin: tipo de ARN, funcin
biolgica.
El azcar presente en el ARN es la ribosa. Esto indica que en la posicin 2' del
anillo del azcar hay un grupo hidroxilo (OH) libre. Por este motivo, el ARN es
qumicamente inestable, de forma que en una disolucin acuosa se hidroliza
fcilmente.
En el ARN las bases nitrogenadas purinas son la Adenina y la Guanina, las
pirimdinas son la Citicina y Uracilo, por eso, una de las diferencias fundamentales
entre el ADN y el ARN es la diferencia entre una de las bases nitrogenasas,
Timina en el ADN y Uracilo en el ARN.
TIPOS DE ARN FUNCIN
RNA MENSAJERO (RNAm) Se sintetiza sobre un molde de ADN
por el proceso de transcripcin por el
cual se copia el ARN a partir del
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
molde del ADN, pasa al citoplasma y
sirve de pauta para la sntesis de
protenas (traduccin).
RNA RIBOSMICO (RNAr) El RNA ribosmico (RNAr) est
presente en los ribosomas, orgnulos
intracelulares implicados en la sntesis
de protenas. Su funcin es leer los
RNAm y formar la protena
correspondiente.
RNA DE TRANSFERENCIA Son cadenas cortas de una estructura
bsica, que pueden unirse
especficamente a determinados
aminocidos.
d. Investiguen sobre transcripcin inversa y la importancia del ARN en este
proceso.
La transcripcin inversa, transcriptasa reversa o retrotranscriptasa es una enzima
de tipo ADN-polimerasa, que tiene como funcin sintetizar ADN de doble cadena
utilizando como molde ARN monocatenario, es decir, catalizar la retrotranscripcin
o transcripcin inversa. Esta enzima se encuentra presente en los retrovirus. Su
nombre obedece a que el proceso normal de la transcripcin, la que se puede
llamar "directa", codifica el ARN a partir de la secuencia inicial de ADN, y no al
revs. Una forma sencilla de sntesis de ADN de doble cadena a partir de
transcriptasa inversa, tambin llamada ADN/ARN-polimerasa dirigida, sera partir
de un cebador cola de poli-T que establecera bases complementarias con la cola
de poli-A del ARN transcrito de la hebra que se va a sintetizar, lo que forma un
hbrido ARN/ADN. Dicho hbrido podra separarse mediante ribonucleasas, y
despus, con la accin de una ADN-polimerasa y un nuevo cebador, ser
completada la hebra de ADN de doble cadena. En la biologa molecular y la
bioqumica, la transcriptasa inversa, tambin conocida como ADN polimerasa
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
dependiente de ARN, es una enzima ADN polimerasa que transcribe una sola
cadena de ARN en una sola cadena de ADN. Tambin ayuda en la formacin de
una doble hlice de ADN una vez que el ARN ha experimentado una transcripcin
inversa en una sola cadena de cDNA. La transcripcin inversa implica la sntesis
de ADN a partir del ARN.
ACTIVIDAD 4
TRANSAMINACION
La transaminacin es una reaccin qumica entre dos molculas. Uno de ellos es
un aminocido, que contiene un grupo amina. El otro es un cido ceto, que
contiene un grupo ceto. En transaminacin, el grupo NH2 en una molcula se
intercambia con el grupo = O en la otra molcula. El aminocido se convierte en
un ceto-cido, y el cido ceto se convierte en un aminocido.
Transaminacin en bioqumica se logra mediante enzimas llamadas
transaminasas o aminotransferasas. Este proceso es un paso importante en la
sntesis de algunos aminocidos no esenciales. La quiralidad de un aminocido se
determina durante la transaminacin. Esta reaccin usa la coenzima PLP, y se ha
demostrado que es una reaccin cinticamente perfecta. El producto de las
reacciones de transaminacin dependen de la disponibilidad de los cidos alfa-
ceto. Los productos son por lo general ya sea alanina, aspartato o glutamato, ya
que sus correspondientes cidos alfa-ceto se producen a travs del metabolismo
de los combustibles.
La lisina y la treonina son los nicos dos aminocidos que no siempre se someten
a transaminacin y en vez utilizan serina o treonina deshidrogenasa.
El segundo tipo de reaccin de transaminacin, que puede ser descrito como una
sustitucin nuclefila de una amina o anin amida en una amina o sal de amonio.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
Por ejemplo, el ataque de una amina primaria por un anin amida primaria se
puede utilizar para preparar aminas secundarias:
RNH2 R'NH-? RR'NH NH2-
Aminas secundarias simtricas se pueden preparar usando nquel Raney. Y, por
ltimo, sales de amonio cuaternario se pueden desalquilar usando etanolamina:
R4N NH2CH2CH2OH? R3N RN H2CH2CH2OH
LA DESAMINACIN OXIDATIVA
La desaminacin o la remocin del grupo alfa amino de los aminocidos es el
primer paso en su catabolismo. Se trata de una reaccin catablica
irreversible que ocurre en el hgado, aunque el rin tambin puede realizarla. La
reaccin es catalizada por la enzima aminocido deshidrogenasa (o aminocido oxidasa),
la cual es flavina dependiente, o sea, que acta acoplada al FAD. Tal parece que este
proceso no le ocurre a todos los aminocidos, sino especialmente al cido glutmico
mediante la enzima glutmico deshidrogenasa, que est bastante distribuida en todos
los tejidos, as como en el hgado y el rin.
Segn estos criterios, los aminocidos originaran cido glutmico
por transaminacin y este sera desaminado oxidativamente por la
glutmico deshidrogenasa ,los productos finales de la desaminacin son: material
reductor, un cetocido y el NH3 . El material reductor puede ser bien en forma de
NADH, o de FADH, segn ocurre en uno u otro caso, su destino ser la cadena
respiratoria, que es oxidada por el oxgeno y aporta energa para la sntesis de
ATP.
El cetocido generalmente es metabolizado por medio del ciclo tricarboxlico y
por esta va puede oxidarse totalmente a CO2 y H2O o convertirse en
carbohidratos o grasas, siendo esta una fuente principal para la sntesis de
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
glucgeno por la va de gluconeognesis. Si puede sintetizar carbohidratos, se
clasifica como glucogentico ; si algunos de estos cetocidos son convertidos en
beta cetobutrico o acetil CoA pueden tambin originar cuerpos cetnicos y se
clasifican como cetogenticos. Este cetocido tambin puede volver a convertirse en
aminocido por transaminacin. El NH3 removido de los aminocidos es eliminado del
organismo en su mayor parte como urea.
Este compuesto es, por tanto, el producto final del catabolismo proteico. Parte de este
amonaco puede ser excretado en forma de sal de amonio, sobre todo en los casos de
acidosis. Tambin por amidacin del cido glutmico (reaccin catalizada por la
glutamina sintetasa) puede ser fijado parte de ese amoniaco, sobre todo en el
sistema nervioso central.
Esto es esencial puesto que pequeas cantidades de NH3 son muy txicas para el
encfalo, por lo que se utiliza cido glutmico sintetizado a partir del
cetoglutrico por transaminacin para, la glutamina formada sera hidrolizada
despus en el rin por la glutaminasa.
DESCARBOXILACION
Los AA se descarboxilan y forman aminas bigenas, ellas o sus derivados tienen
muy importantes funciones biolgicas (hormonas, neurotransmisores,
inmunomoduladores, etc): histamina, etanolamina, serotonina, feniletilamina, etc.
Desde la TYR, por descarboxilacin y otras reacciones, se producen la familia de
las catecolaminas: dopamina, noradrenalina y adrenalina. El TRP se descarboxila
a triptamina y sta se convierte en serotonina.
Los aminocidos sufren descarboxilacin a aminas; un ejemplo particular sera la
descarboxilacin de la histidina a histamina.Un aminocido tiene un grupo
carboxilo (en rojo en la imagen) que puede ser descarboxilado. Existe una enzima
descarboxilasa para cada aminocido. En las bacterias, la descarboxilacin es la
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
responsable de la putrefaccin, as transforman la lisina (C6H14N2O2)
en cadaverina (C5H14N2), la ornitina (C5H12N2O2) en putrescina (C4H12N2), etc.
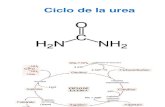
CICLO DE LA UREA
El ciclo de la urea comienza en el interior de las mitocondrias de los hepatocitos.
1. El primer grupo amino que ingresa al ciclo proviene del amonaco libre
intramitocondrial. El amonaco producido en las mitocondrias, se utiliza junto con
el bicarbonato (producto de la respiracin celular), para producir carbamoil-fosfato.
Reaccin dependiente de ATP y catalizada por la carbamoil-fosfato-sintetasa
I. Enzima alostrica y modulada (+) por el N-acetilglutamato.
2. El carbamoil-fosfato cede su grupo carbamoilo a la ornitina, para formar
citrulina y liberar Pi. Reaccin catalizada por la ornitina transcarbamoilasa. La
citrulina se libera al citoplasma.
3. El segundo grupo amino procedente del aspartato (producido en la mitocondria
por transaminacin y posteriormente exportado al citosol) se condensa con la
citrulina para formar argininosuccinato. Reaccin catalizada por la
argininosuccinato sintetasa citoplasmtica. Enzima que necesita ATP y produce
como intermediario de la reaccin citrulil-AMP.
4. El argininosuccinato se hidroliza por la arginino succinato liasa, para formar
arginina libre y fumarato.
5. El fumarato ingresa en el ciclo de Krebs y la arginina libre se hidroliza en el
citoplasma, por la arginasa citoplasmtica para formar urea y ornitina.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
6. la ornitina puede ser transportada a la mitocondria para iniciar otra vuelta del
ciclo de la urea.
En resumen, el ciclo de la urea consta de dos reacciones mitocondriales y cuatro
citoplasmticas
b. Describa el ciclo de nitrgeno en medio ambiente y en los seres vivos.
Los seres vivos requieren tomos de nitrgeno para la sntesis de molculas
orgnicas esenciales como las protenas, los cidos nucleicos, el ADN, por lo tanto
es otro elemento indispensable para el desarrollo de los seres vivos.
El nitrgeno, al igual que el carbono, es un elemento bsico de la vida y est
presente en determinadas reacciones qumicas e intercambios entre la atmsfera,
suelos y seres vivos, que se realizan en la naturaleza de forma cclica (ciclo
biogeoqumico del carbono). Intervienen fundamentalmente en este ciclo los
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
vegetales y las bacterias fijadoras del nitrgeno. En ese proceso, el nitrgeno es
incorporado al suelo, que ser absorbido por los organismos vivos antes de
regresar de nuevo a la atmsfera.
Los organismos vivos no pueden utilizar directamente el nitrgeno que se
encuentra en la atmsfera en forma gaseosa, y que supone el 71% del total; para
ello, debe ser transformado previamente en nitrgeno orgnico (nitratos o
amoniaco). Esto se consigue, fundamentalmente, mediante la fijacin biolgica,
aunque tambin las radiaciones csmicas y la energa que producen los rayos en
la atmsfera intervienen en este proceso en menor medida combinando nitrgeno
y oxgeno que una vez transformado es enviado a la superficie terrestre por las
precipitaciones.
En la fijacin biolgica intervienen bacterias simbiticas que viven en las races de
las plantas, sobre todo leguminosas como el guisante, trbol o la alfalfa, pero
tambin determinadas algas, lquenes, etc. Las bacterias se alimentan de estas
plantas, pero a cambio le entregan abundantes compuestos nitrogenados. Es muy
comn en agricultura cultivar leguminosas en determinados terrenos pobres en
nitrgeno, o que han quedado agotados por otras cosechas, para permitir rotar los
sembrados en el mismo lugar.
Cuando el nitrgeno ha quedado fijado en las races de las plantas, ya puede ser
absorbido por stas e incorporarlo a los tejidos en forma de protenas vegetales.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
Desde aqu, el nitrgeno ya entra en la cadena alimentaria mediante
los animales herbvoros y carnvoros.
Cuando las plantas y animales mueren, mediante la descomposicin se produce
una transformacin qumica de los compuestos nitrogenados, convirtindose en
nitrgeno amoniacal (actividad denominada amonificacin), ltima etapa de la
mineralizacin del nitrgeno que est contenido en la materia orgnica del suelo.
Este amoniaco vuelve a ser en parte recuperado por las plantas, pero el resto
alcanza el medio acutico o simplemente permanece en el suelo, donde ser
convertido en nitrgeno ntrico por los microorganismos, en un proceso que se
denomina nitrificacin y que es aprovechado de nuevo por las plantas. Los nitratos
pueden volver a la atmsfera mediante la desnitrificacin, o ser eliminado del
suelo por lixiviacin (disolucin en el agua) y posterior arrastrado a los ros y
lagos.
Los humanos influyen en el ciclo del nitrgeno y pueden sobrecargarlo. Esto
puede ser observado en los cultivos intensivos (que obligan a aadir fertilizantes
nitrogenados para fertilizar las tierras) y la tala de rboles, que hacen descender el
contenido de nitrgeno de los suelos.
El contrapunto a esta caresta de nitrgeno por exceso de cultivo, se encuentra en
las tierras que han sido demasiado fertilizadas; la lixiviacin del nitrgeno de estas
tierras aaden un extra indeseable a los ecosistemas acuticos cuando es
arrastrado por las aguas fluviales. Este exceso de nitrgeno se agrava con la
emisin a la atmsfera del dixido de nitrgeno de las centrales trmicas y los
automviles; una vez descompuesto en la atmsfera es capaz de reaccionar con
otros productos contaminantes, generando el conocido smog fotoqumico, que
puede observarse sobre el cielo de muchas grandes ciudades con problemas de
contaminacin ambiental.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
c. Del catabolismos de los aminocido destaque que ocurre con el
grupo amino y carboxilo y como se utiliza el resto de la estructura
como fuente energtica.
Los aminocidos se denominan as, porque cada molcula contiene un grupo
cido carboxilo (COOH) y un grupo amino (NH2), adems, cada aminocido tiene
una cadena lateral conocida como grupo R, los tres grupos estn unidos al mismo
tomo de carbono conocido como el carbono alfa, la glicina tiene un grupo R que
consta de un solo tomo de hidrgeno, otros grupos R de aminocido vara, en un
grupo amino y un grupo carboxilo los aminocidos tienen la propiedad de ser
anfteros, lo que es muy importante al hablar de su estructura, al tener una zona
bsica y una zona acida, el grupo carboxilo cede el protn que ser captado por el
grupo amino en una solucin acuosa donde la forma no inica y la forma dipolar
se encuentran en un equilibrio, aunque aparecen cargas tanto en el grupo amino
como en el grupo carboxilo el aminocido posee una carga neta de cero cuando
los aminocidos experimentan un catabolismo, el primer paso es la eliminacin del
grupo amino de la molcula, una vez que el grupo amino se elimina, el esqueleto
de carbono restante del aminocido se convierte en energa o se almacena como
grasa y el grupo amino representa el exceso de nitrgeno, que se debe eliminar
del cuerpo.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
El grupo amino es un grupo qumico funcional que forma parte de todos los
aminocidos y consiste en un tomo de nitrgeno enlazado covalentemente a dos
tomos de hidrgeno, el grupo amino tiene un electrn de valencia adicional en el
tomo de nitrgeno, que permite que este grupo molecular se enlace con otro
tomo.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
CONCLUSIONES
Con la realizacin de este proyecto llegamos a la conclusin que las protenas son
sustancias complejas formadas por la unin de ciertas sustancias ms simples
llamadas aminocidos, los aminocidos son materia prima de las protenas ya que
cumplen diferentes funciones en nuestro organismo, existen variedades distintas
de protenas en el cuerpo, cada una encargada de realizar diferentes funciones,
las podemos encuentran en el algodn, en la ropa, en el queso parmesano, en la
gelatina, en las algas, en la leche, en los huevos y en toda clase de semillas, como
tambin en plantas y en los animales.
-
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD Escuela de Ciencias Bsicas, Tecnologa e Ingeniera
BIOQUMICA GRUPO 201103_61
BIBLIOGRAFA
TORRES, M. (2013). In UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
(Ed.), BIOQUIMICA 201103[Bioqumica] (cuarta ed.). Curso virtual bioqumica:
UNAD. Consultado, 03 de Diciembre del 2014.
Limn, I. (2010). COMPOSICION QUIMICA DE LOS SERES VIVOS. CURSO DE
BIOQUIMICA BASICA. Retrieved 04/19, 2014,
http://www.uv.mx/personal/ilimon/files/2010/11/CURSO-BQ.pdf Consultado, 03 de
Diciembre del 2014.
Wikimedia (7 nov 2014) recuperado de:
http://es.wikipedia.org/wiki/Amino%C3%A1cido, Consultado, 03 de Diciembre del
2014.
Mnica Gonzlez, Cadena lateral en aminocidos (26 de agosto de 2010)
recuperado de: http://quimica.laguia2000.com/conceptos-basicos/cadena-lateral-
en-aminoacidos, Consultado, 03 de Diciembre del 2014.
http://alimentos-proteinas.com/alimentos-lacteos-que-contienen-proteinas/
http://www.infocarne.com/bovino/alimentos_concentrados.asp
http://www.webs.ulpgc.es/nutranim/tema3.htm
http://books.google.com.co/books?id=SQLNJOsZCIwC&pg=PA252&dq=componen
tes+del+nucle%C3%B3tido&hl=es
http://profesores.elo.utfsm.cl/~tarredondo/info/soft-comp/Bio-Intro/tiposarn.htm







![TEMAS DE BIOQUIMICA TEMA I: INTRODUCCION A LA BIOQUIMICA BIOQUIMICA [Tomo I].pdf · 1 TEMAS DE BIOQUIMICA TEMA I: INTRODUCCION A LA BIOQUIMICA Generalidades Concepto de materia, cuerpo,](https://static.fdocuments.ec/doc/165x107/5a7707fe7f8b9a9c548dbcf5/temas-de-bioquimica-tema-i-introduccion-a-la-bioquimica-bioquimica-tomo-ipdfaa.jpg)