71 Circulacion coronaria
Click here to load reader
-
Upload
migdalia-rojas-tiburcio -
Category
Documents
-
view
199 -
download
0
Transcript of 71 Circulacion coronaria

Funcionamiento del Organismo 2005
71. CIRCULACIÓN CORONARIA Dr. Fernando D. Saraví
Además de su importancia fisiológica, el riego sanguíneo del miocardio es un tema central de la medicina moderna debido a la enorme incidencia que sus defectos (cardiopatía isquémica) tienen sobre la morbilidad y mortalidad en adultos (la mortalidad mundial es de aprox. 7 millones por año).
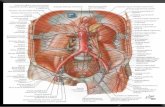
Las arterias coronarias derecha e izquierda transcurren sobre el epicardio y se dividen, dando en su trayecto ramas que penetran el espesor del miocardio en grado variable antes de capilarizarse. Hay 3000 a 4000 capilares/mm2 (10 veces más que en músculo esquelético) o aprox. 1 capilar por fibra miocárdica. La red capilar es más profusa en el endocardio. El 85 % del drenaje venoso se realiza por el seno coronario. El caudal sanguíneo coronario (CSC) en reposo es aprox. 0,8 mL/min/g de tejido. Para un corazón de 300 g, es de 240 mL/min o 5 % del gasto cardíaco. Por g de masa, el corazón recibe 10 veces más que el promedio del cuerpo (5000 mL/min para 70 kg ~ 0,07 mL/min/g). En el ejercicio el CSC aumenta hasta 5 veces. A pesar de lo dicho, el CSC es apenas suficiente para aportar el O2 que el corazón necesita. Esto significa que si aumenta la demanda de O2, el único modo de satisfacerla es mediante un aumento del CSC. Con el sujeto en reposo, el miocardio activo consume aprox. 100 µL O2/min/g, ó 30 mL/min para 300 g. Los 240 mL de sangre arterial contienen aprox. 45 mL de O2 , de los que 2/3 deben ser extraidos. La extracción medida es de 75 %, es decir, el triple que el promedio del cuerpo (la sangre venosa mezclada tiene 25 % menos O2 que la arterial). Cada mL de O2 proporciona energía equivalente a 20 J. El patrón de flujo coronario está dado por la interrelación entre la presión efectiva de perfusión y la resistencia hemodinámica del circuito. Esta última no depende, como en otros órganos, sólo de la resistencia vascular, sino también de la propia contracción cardíaca que cíclicamente estira los grandes vasos
epicárdicos y comprime los vasos intra-murales, medianos y pequeños. En ausencia de contracción, la presión efectiva de perfusión sería la diferencia entre la presión aórtica y la presión auricular derecha. No obstante, la contracción añade en cada sístole una compresión extrínseca a los vasos que reduce su calibre (ver Fig. a la izquierda). La contracción reduce el flujo arterial y aumenta (por expresión) el flujo venoso. La variable principal es el esfuerzo σ (N/m2) realizado por el miocardio durante la sístole. Como las presiones del ventrículo derecho son siempre menores que la aórtica, en aquél el CSC sigue aprox. la forma de la curva de presión aórtica. En cambio, en el ventrículo izquierdo el CSC es mínimo en el período isovolumétrico sistólico, bajo durante la sístole y máximo durante la diástole. Como la región subendocárdica desarrolla mayor esfuerzo que la subepicárdica, la reducción
sistólica del CSC es mayor en aquélla (pese a que la resistencia vascular subendocárdica es menor). Autorregulación. La presión aórtica media es mantenida aprox. constante mediante el reflejo barorreceptor. Para un nivel de trabajo dado, el CSC se mantiene aprox. constante para presiones de perfusión entre 60 y 140 mmHg. Esto ocurre porque las fluctuaciones en la presión de perfusión de los vasos miocárdicos causan cambios recíprocos en su resistencia. Esta autorregulación, depende fundamentalmente de la demanda metabólica (consumo de O2 = QO2) que, junto con factores neurógenos y endoteliales, regulan el CSC. Determinantes del QO2. El 20 % del QO2 miocárdico es basal (20 µL/min/g) para mantener vivas sus células. Sólo 1 % del total depende de la actividad eléctrica. El resto, casi 80 % en reposo, se debe al trabajo mecánico. El porcentaje varía según 1) el nivel de actividad y 2) la eficiencia mecánica EM = 100 x Trabajo realizado/Energía consumida (por encima de la basal). En reposo, los ventrículos realizan por min un trabajo externo de aprox. 80 J y consumen 480 J; EM = 100. 80/480 = 17 %. No obstante, la EM es variable. P.ej., aumenta durante el ejercicio y con fármacos como los antagonistas β-adrenérgicos.

Funcionamiento del Organismo 2005
Las principales determinantes del QO2 son la frecuencia cardíaca y el esfuerzo (σσ)) realizado por la pared. Este último depende de la precarga durante la diástole y de la postcarga durante la sístole. El σ en la sístole depende principalmente de la presión sistólica y en menor medida del volumen sistólico, es decir del grado de acortamiento de las fibras durante la contracción. De la ecuación σ = (∆P.r)/2 δ (ver Mecánica Cardíaca) surge que σ varía linealmente con ∆P pero es proporcional a la raíz cúbica del volumen V ( = r3 π 4/3). El
estado contráctil (inotropismo) modifica la demanda de oxígeno: a mayor contractilidad, mayor QO2.En condiciones anormales es importante el espesor δ de la pared. Una pared adelgazada (dilatación) aumenta la demanda, pues desarrolla mayor σσ para igual ∆P. Una pared engrosada (hipertrofia) reduce proporcionalmente el aporte, pues el número de capilares no aumenta proporcionalmente a la masa ventricular. El acoplamiento entre la demanda de O2 y la resistencia vascular coronaria se debe principalmente a la adenosina. Cuando baja la presión de O2 se reduce la formación de ATPy aumenta el ADP y AMP . El AMP es transformado por una 5’nucleotidasa del sarcolema en adenosina. Ésta difunde fuera del cardiomiocito y produce dilatación, sobre todo de arteriolas, por: 1) aumento de la síntesis de cAMP en el músculo liso y 2)
desinhibición de canales de K+ regulados por ATP. Además de la adenosina, la propia hipoxia, y el aumento de presión de CO2 y de [K+] y [H+] extracelulares contribuyen a la regulación metabólica del CSC. Regulación neurógena. Las coronarias poseen receptores de tipo α (vasoconstrictores) y β (vasodilatadores). La descarga simpática de noradrenalina causa cambios directos e indirectos sobre el CSC. El principal efecto directo, sobre todo en arterias grandes y medianas, es vasoconstrictor (en arteriolas de 450 µm y menores predomina el efecto β). El efecto indirecto es vasodilatador, por el incremento en frecuencia cardíaca y volumen sistólico causado por las catecolaminas. Normalmente predomina el efecto dilatador. El papel de la estimulación parasimpática (vagal) sobre el CSC es menos claro. Regulación endotelial. El endotelio arterial produce continuamente óxido nítrico (NO) en respuesta a las fuerzas de roce producidas por el flujo normal. El NO es un poderoso vasodilatador y antiagregante plaquetario. Sustancias circulantes, como la acetilcolina, la bradikinina y la serotonina, y otras de producción local, como el ADP, facilitan la liberación de NO. La prostaciclina producida por el endotelio también tiene efecto dilatador y antiagregante. Un tercer factor vasodilatador es el factor hiperpolarizante derivado del endotelio (EDHF). En menor medida, el endotelio también produce endotelina, un péptido vasoconstrictor cuyo papel en la circulación coronaria no es claro.
Reserva coronaria e isquemia miocárdica. Se denomina reserva coronaria al aumento del CSC que puede obtenerse por vasodilatación para una ∆P constante. Dado que la extracción de O2 es muy elevada en reposo, un mayor QO2 debe ser satisfecho por aumento del CSC. Ocurre insuficiencia coronaria (isquemia) cuando la demanda excede al aporte. En el corazón normal, aprox. 50 % de la resistencia al flujo coronario está determinada por las arteriolas de 100 a 450 µm de diámetro, y la mayor parte del resto por arteriolas menores. Por eso estos vasos son los efectores predominantes de la autorregulación. Una estenosis localizada (p.ej. aterosclerosis) en una arteria principal (epicárdica) funciona como una resistencia agregada en serie, de modo que parte de la ∆P total cae allí. Sin embargo, la resistencia total puede mantenerse constante al ser compensada por vasodilatación arteriolar distal a la obstrucción. Por ello, el CSC puede mantenerse constante con estenosis que reducen hasta 75 % la luz de la arteria. Obstrucciones mayores (transitorias o fijas) no pueden ser totalmente compensadas y causan isquemia (angina de pecho o infarto).
La isquemia debe definirse no sólo en términos de un nivel crítico de flujo, sino también relacionada con la demanda metabólica. Según la ley de Poiseuille, la ∆P a través de la resistencia depende directamente del caudal Q: ∆P = Q.R. Cuando el CSC se incrementa, la importancia relativa de la estenosis en determinar la caída de presión aumenta mucho. Por ejemplo, durante el ejercicio la demanda de O2 crece el CSC hasta 4 a 5 veces; el CSC tiende a aumentar, y la caída de presión en una estenosis aumenta proporcionalmente. En estas condiciones, basta una obstrucción de sólo 45 % de la luz de una arteria para causar manifestaciones de isquemia. Este hecho explica la angina de esfuerzo (dolor isquémico precipitado por la actividad física) y también la sensibilidad de las pruebas ergométricas para detectar lesiones coronarias que son asintomáticas en reposo.