UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE …2.1.9. Recuento bacteriano de unidades formadoras de...
Transcript of UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE …2.1.9. Recuento bacteriano de unidades formadoras de...
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE ODONTOLOGÍA
CARRERA DE ODONTOLOGÍA
Nivel de contaminación bacteriana en esponjeros endodónticos de
aluminio, plástico común y plástico autoclavable, de los
estudiantes de la clínica integral de la FOUCE
Autora: Cárdenas Vinueza Victoria Alejandra
Tutora: Dra. Alexie Elizabeth Izquierdo Bucheli
Quito, 2019
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE ODONTOLOGÍA
CARRERA DE ODONTOLOGÍA
Nivel de contaminación bacteriana en esponjeros endodónticos de
aluminio, plástico común y plástico autoclavable, de los
estudiantes de la clínica integral de la FOUCE
Trabajo de titulación presentado como requisito previo a la obtención del Título
de Odontóloga
AUTORA: Cárdenas Vinueza Victoria Alejandra
TUTORA: Dra. Alexie Elizabeth Izquierdo Bucheli
Quito, 2019
ii
DERECHOS DE AUTOR
Yo, Victoria Alejandra Cárdenas Vinueza en calidad de autora y titular de los
derechos morales y patrimoniales del trabajo de Titulación NIVEL DE
CONTAMINACIÓN BACTERIANA EN ESPONJEROS ENDODÓNTICOS DE
ALUMINIO, PLÁSTICO COMÚN Y PLÁSTICO AUTOCLAVABLE, DE LOS
ESTUDIANTES DE LA CLÍNICA INTEGRAL DE LA FOUCE, modalidad
Proyecto de Investigación, de conformidad con el Art. 114 del CÓDIGO
ORGÁNICO DE LA ECONOMÍA SOCIAL DE LOS CONOCIMIENTOS,
CREATIVIDAD E INNOVACIÓN, concedo a favor de la Universidad Central
del Ecuador una licencia gratuita, intransferible y no exclusiva para el uso no
comercial de la obra, con fines estrictamente académicos. Conservo a mi favor
todos los derechos de autor sobre la obra, establecidos en la norma citada.
Así mismo, autorizó a la Universidad Central del Ecuador para que realice la
digitalización y publicación de este trabajo de titulación en el repositorio virtual,
de conformidad a lo dispuesto en el Art. 144 de la Ley Orgánica de Educación
Superior.
La autora declara que la obra objeto de la presente autorización es original en su
forma de expresión y no infringe el derecho de autor de terceros, asumiendo la
responsabilidad por cualquier reclamación que pudiera presentarse por esta causa
y liberando a la Universidad de toda responsabilidad.
Firma:
Victoria Alejandra Cárdenas Vinueza
172108054-5
Dirección Electrónica: [email protected]
iii
APROBACIÓN DEL TUTOR DEL TRABAJO DE TITULACIÓN
Yo, Dra. Alexie Elizabeth Izquierdo Bucheli en mi calidad de tutor del trabajo de
titulación, modalidad Proyecto de Investigación, elaborado por VICTORIA
ALEJANDRA CÁRDENAS VINUEZA, cuyo título es: NIVEL DE
CONTAMINACIÓN BACTERIANA EN ESPONJEROS ENDODÓNTICOS DE
ALUMINIO, PLÁSTICO COMÚN Y PLÁSTICO AUTOCLAVABLE, DE LOS
ESTUDIANTES DE LA CLÍNICA INTEGRAL DE LA FOUCE, previo a la
obtención del Grado de Odontólogo: considero que el mismo reúne los requisitos
y méritos necesarios en el campo metodológico y epistemológico, para ser
sometido a la evaluación por parte del tribunal examinador que se designe, por lo
que lo APRUEBO, a fin de que el trabajo sea habilitado para continuar con el
proceso de titulación determinado por la Universidad Central del Ecuador.
En la ciudad de Quito, a los 26 días del mes de Marzo de 2019.
Dra. Alexie Elizabeth Izquierdo
DOCENTE-TUTOR
C.C: 1711533057
iv
APROBACIÓN DE LA PRESENTACIÓN ORAL/TRIBUNAL
El Tribunal constituido por: Dr. Eduardo Garrido (Presidente del tribunal), y Dra.
Erika Espinosa (Vocal de tribunal), Luego de receptar la presentación oral del
trabajo de titulación previo a la obtención del título de Odontóloga presentado por
la Señorita Victoria Alejandra Cárdenas Vinueza. Con el título: NIVEL DE
CONTAMINACIÓN BACTERIANA EN ESPONJEROS ENDODÓNTICOS DE
ALUMINIO, PLÁSTICO COMÚN Y PLÁSTICO AUTOCLAVABLE, DE LOS
ESTUDIANTES DE LA CLÍNICA INTEGRAL DE LA FOUCE.
Emite el siguiente veredicto: ______________________________
Fecha: Miércoles 15 de Mayo de 2019
Para constancia de lo actuado firman:
Nombre y Apellido Calificación Firma
Presidente: Dr. Eduardo Garrido ____________ ______________
Vocal: Dra. Erika Espinosa ____________ ______________
v
DEDICATORIA
El presente trabajo lo dedico a Dios por darme la fortaleza, el
apoyo y la convicción. Y a mis queridos padres Alberto y Carmita,
por constituirse en mis pilares fundamentales y el mejor ejemplo de
superación, motivándome día a día para cristalizar en una
hermosa realidad mis sueños.
Mi gratitud a mi esposo Byron y a mis hijos Julián, Luis y Adriana
que con su paciencia y apoyo incondicional se han convertido en
el motor de este proyecto de vida.
Mi reconocimiento a mi estimada tutora y a mis hermanos por el
cariño, la dedicación y el empuje que supieron brindarme en todo
momento.
vi
AGRADECIMIENTOS
El sentimiento de estima y reconocimiento es valioso para todo ser
humano y en especial para aquellas personas que en la vida de un
estudiante se convierten en pilares fundamentales, guías y
horizontes invaluables para el cumplimiento de metas conseguidas
con esfuerzo, sacrificio y emprendimiento.
Dios, tu amor y tu bondad no tiene límites, me permitiste sonreír
ante todos mis logros que son el resultado de tu ayuda, me
levantaste cuando caí, me pusiste a prueba con mis errores y hoy
pones en mí esta bendición.
Gracias a mis padres por todo el esfuerzo, apoyo incondicional y
por confiar en mis capacidades ya que con su cariño me motivaron
a no rendirme ante las adversidades que se presentan en el camino
pre-profesional.
A mi tutora Alexie, quiero expresarle mi profundo sentimiento de
gratitud y estima por convertirse en mi mentora y amiga en este
largo proceso de mi vida estudiantil.
Gracias de corazón.
vii
ÍNDICE DE CONTENIDOS
DERECHOS DE AUTOR ...................................................................................... ii
APROBACIÓN DEL TUTOR DEL TRABAJO DE TITULACIÓN ................... iii
APROBACIÓN DE LA PRESENTACIÓN ORAL/TRIBUNAL ......................... iv
DEDICATORIA ..................................................................................................... v
AGRADECIMIENTOS ......................................................................................... vi
ÍNDICE DE CONTENIDOS ................................................................................ vii
LISTA DE TABLAS ............................................................................................ xii
LISTA DE FIGURAS .......................................................................................... xiv
LISTA DE GRÁFICOS ....................................................................................... xvi
LISTA DE ANEXOS .......................................................................................... xvii
RESUMEN ......................................................................................................... xviii
ABSTRACT ......................................................................................................... xix
INTRODUCCIÓN .................................................................................................. 1
CAPÍTULO I ........................................................................................................... 2
1. PROBLEMA ................................................................................................... 2
1.1. Planteamiento del Problema .......................................................................... 2
1.2. Justificación ................................................................................................... 3
1.3. Objetivos ........................................................................................................ 4
1.3.1. Objetivo general ........................................................................................ 4
1.3.2. Objetivos específicos ................................................................................ 4
1.4. Hipótesis ........................................................................................................ 5
1.4.1. Hipótesis de investigación, Hi. ................................................................. 5
1.4.2. Hipótesis nula, Ho. .................................................................................... 5
CAPÍTULO II ......................................................................................................... 6
viii
2. MARCO TEÓRICO (REVISIÓN BIBLIOGRÁFICA).................................. 6
2.1. Riesgo biológico ............................................................................................ 6
2.1.1. Generalidades ............................................................................................ 6
2.1.2. Microorganismos ...................................................................................... 7
2.1.3. Mecanismos de transmisión ...................................................................... 7
2.1.3.1. Mecanismos de transmisión según los factores ...................................... 7
2.1.3.2. Tipos de mecanismos de transmisión ..................................................... 8
2.1.4. Agentes biológicos .................................................................................. 11
2.1.5. Clasificación de los microorganismos .................................................... 11
2.1.5.1. Bacterias ............................................................................................... 12
2.1.6. Enfermedades producidas por bacterias.................................................. 18
2.1.6.1. Faringoamigdalitis ................................................................................ 18
2.1.6.2. Infecciones inespecíficas en la piel ...................................................... 19
2.1.7. Identificación bacteriana ......................................................................... 19
2.1.7.1. Recolección de muestras ...................................................................... 19
2.1.7.2. Transporte de muestras ......................................................................... 20
2.1.7.3. Medios de cultivo ................................................................................. 20
2.1.7.4. Siembra o inoculación .......................................................................... 24
2.1.7.5. Técnicas de aislamiento de los microorganismos................................. 25
2.1.7.6. Identidad bacteriana .............................................................................. 26
2.1.8. Pruebas bioquímicas ............................................................................... 28
2.1.8.1 Manitol ................................................................................................. 29
2.1.9. Recuento bacteriano de unidades formadoras de colonia mediante placas
Petrifilm para aerobios totales y coliformes.......................................................... 29
2.1.9.1. Las placas Petrifilm para recuento de aerobios (Aerobic Count AC) ......
.............................................................................................................. 29
ix
2.1.9.2. Las Placas Petrifilm para el Recuento de Coliformes (ColiformCount,
CC) .............................................................................................................. 30
2.2. Esponjero endodóntico (clean stand) ........................................................... 30
2.2.1. Características físicas .............................................................................. 31
2.2.1.1. Plástico común (Polietileno) ................................................................. 31
2.2.1.2. Plástico autoclavable (Polipropileno) ................................................... 32
2.2.1.3. Aluminio ............................................................................................... 32
2.2.2. Usos del Esponjero Endodóntico ............................................................ 32
2.3. Asepsia ......................................................................................................... 33
2.3.1. Desinfección ........................................................................................... 33
2.3.1.1. Clasificación de los desinfectantes ....................................................... 33
2.3.2. Esterilización........................................................................................... 34
2.3.2.1. Técnicas de esterilización ..................................................................... 34
2.4. Medidas de bioseguridad en la práctica odontológica ................................. 37
CAPÍTULO III ...................................................................................................... 39
3. METODOLOGÍA ......................................................................................... 39
3.1. Diseño de la investigación ........................................................................... 39
3.2. Población en estudio .................................................................................... 39
3.3. Selección y tamaño de la muestra ................................................................ 39
3.4. Criterios de inclusión y exclusión................................................................ 40
3.4.1. Criterios de inclusión .............................................................................. 40
3.4.2. Criterios de exclusión ............................................................................. 40
3.5. Conceptualización de variables ................................................................... 40
3.6. Operacionalización de variables .................................................................. 41
3.7. Estandarización ............................................................................................ 42
3.7.1. Prueba Piloto ........................................................................................... 42
x
3.7.1.1. Procedimiento ....................................................................................... 42
3.7.1.2. Resultados de la Prueba Piloto ............................................................. 42
3.8. Materiales y Métodos .................................................................................. 43
3.8.1. Método de recolección de datos .............................................................. 43
3.8.2. Equipos, instrumentos, materiales y sustancias ...................................... 44
3.9. Procedimientos y técnicas............................................................................ 45
3.9.1. Obtención de muestras ............................................................................ 45
3.9.2. Transporte de muestras ........................................................................... 46
3.9.3. Cultivo..................................................................................................... 47
3.9.4. Siembra ................................................................................................... 48
3.9.5. Identificación de microorganismos ......................................................... 50
3.9.5.1. Tinción Gram ........................................................................................ 50
3.9.5.2. Vitek Compact 2® ................................................................................ 52
3.9.6. Observación de los resultados ................................................................. 54
3.9.7. Eliminación de desechos ......................................................................... 55
3.10. Resultados de las pruebas de laboratorio. .................................................... 56
3.11. Aspectos bioéticos ....................................................................................... 60
3.11.1. Beneficencia ............................................................................................ 60
3.11.2. Confidencialidad ..................................................................................... 60
3.11.3. Riesgos potenciales de la Investigación .................................................. 60
3.11.4. Beneficios potenciales de la Investigación ............................................. 60
3.11.4.1. Directos ................................................................................................. 60
3.11.4.2. Indirectos .............................................................................................. 61
3.11.5. Idoneidad ética y experticia del estudio .................................................. 61
3.11.6. Conflicto de interés ................................................................................. 61
CAPÍTULO IV ...................................................................................................... 62
xi
4. ANÁLISIS E INTERPRETACIÓN DE RESULTADOS............................. 62
4.1. Técnicas para procesamiento y análisis estadísticos de datos ..................... 62
4.2. Discusión ..................................................................................................... 80
CAPÍTULO V ....................................................................................................... 84
5. CONCLUSIONES Y RECOMENDACIONES ............................................ 84
5.1. Conclusiones ................................................................................................ 84
5.2. Recomendaciones ........................................................................................ 85
BIBLIOGRAFÍAS ................................................................................................ 86
ANEXOS .............................................................................................................. 90
xii
LISTA DE TABLAS
Tabla 1. Clasificación de los desinfectantes ......................................................... 34
Tabla 2. Cruce de variables UFC*muestras (total) ............................................... 62
Tabla 3. Prueba de chi-cuadrado del Cruce de variables UFC*muestras (total) .. 63
Tabla 4. Índice de Shannon-Wiener ...................................................................... 63
Tabla 5. Cruce de variables UFC*muestras esponjero endodóntico estéril .......... 64
Tabla 6. Prueba de chi-cuadrado de variables UFC*muestras esponjero
endodóntico estéril ................................................................................................ 64
Tabla 7. Cruce de variables UFC*esponjero endodóntico no estéril .................... 66
Tabla 8. Prueba de chi-cuadrado de variables UFC*esponjero endodóntico no
estéril ..................................................................................................................... 66
Tabla 9. Cruce de variables aerobios totales *muestras (total) ............................. 68
Tabla 10. Prueba de chi-cuadrado de variables aerobios totales *muestras (total) 68
Tabla 11. Cruce de variables aerobios totales *muestras esponjero endodóntico
Estéril .................................................................................................................... 69
Tabla 12. Prueba de chi cuadrado de variables aerobios totales *muestras
esponjero endodóntico Estéril ............................................................................... 69
Tabla 13. Cruce de variables aerobios totales *muestras esponjero endodóntico no
estéril ..................................................................................................................... 70
Tabla 14. Prueba de chi-cuadrado de variables aerobios totales *muestras
esponjero endodóntico no estéril ........................................................................... 70
Tabla 15. Cruce de variables enterobacterias * muestras (total) ........................... 71
Tabla 16. Prueba de chi-cudrado de variables enterobacterias * muestras (total) 71
Tabla 17. Cruce de variables enterobacterias * muestras esponjero endodóntico
estéril ..................................................................................................................... 72
Tabla 18. Prueba de chi-cuadrado de variables enterobacterias * muestras
esponjero endodóntico estéril ................................................................................ 72
Tabla 19. Cruce de variables enterobacterias * muestras esponjero endodóntico no
estéril ..................................................................................................................... 73
Tabla 20. Prueba de chi-cuadrado de variables enterobacterias * muestras
esponjero endodóntico no estéril ........................................................................... 73
xiii
Tabla 21. Cruce de variables identificación bacteriana vitek compact® 2 *
muestras (total) ...................................................................................................... 74
Tabla 22. Cruce de variables identificación bacteriana vitek compact® 2 *
muestras esponjero endodónticoestéril ................................................................. 76
Tabla 23. Cruce de variables identificación bacteriana vitek compact® 2 *
muestras esponjero endodóntico no estéril ........................................................... 77
xiv
LISTA DE FIGURAS
Figura 1. Clasificación de los Microorganismos .................................................. 12
Figura 2. Clasificación de las Bacterias ................................................................ 13
Figura 3. Morfología y agrupaciones bacterianas (cocos) .................................... 13
Figura 4. Morfología y agrupaciones bacterianas (bacilos) .................................. 15
Figura 5. Esquema de procedimiento tinción gram .............................................. 17
Figura 6. Disposición de la pared celular de las bacterias Gram negativas y
Grampositivas ....................................................................................................... 18
Figura 7. Clasificación por criterios de los medios de cultivo .............................. 20
Figura 8. Técnica de siembra e inoculación .......................................................... 25
Figura 9. Manitol positivo (S. aureus) y manitol negativo(S. epidermidis) .......... 29
Figura 10. Placas petrifilm aerobios totales .......................................................... 30
Figura 11. Placas petrifilm coliformes .................................................................. 30
Figura 12. Esponjeros endodónticos de cada material a) plástico común b) plástico
autoclavable c) aluminio ....................................................................................... 31
Figura 13. Autoclave (calor Húmedo) .................................................................. 35
Figura 14. Horno Pasteur (calor seco)................................................................... 36
Figura 15. Toma de muestras. A) Esponjero plástico común, B) Esponjero plástico
autoclavable, C) Esponjero de aluminio. D) muestras con su respectiva etiqueta 46
Figura 16. Muestras etiquetadas y selladas en el contenedor isotérmico para
realizar el transporte .............................................................................................. 47
Figura 17. Muestras con caldo de enriquecimiento en incubación 24 horas ........ 47
Figura 18. Preparación placas petrifilm. A)Placaspetrifilm aerobios totales y
coliformes, B-C) Toma de 2ml para colocar en las placas, D-E) Colocación de 1
ml en cada placa respectivamente, F) delimitación de la muestra, G) Placas listas
para incubar ........................................................................................................... 48
Figura 19. Siembra de Agar. A) Tubos con caldo de cultivo, B) agar sangre y agar
Mac Conkey, C) agares identificados, D) descarga inicial con hisopo, E)
esterilización del asa, F) siembra por estría cruzada, G) siembra realizada H)
agares listos para incubación I) agares sangre en campana- estufa y agares Mac
Conkey en estufa para incubación 48 horas .......................................................... 49
xv
Figura 20. A) Agar sangre con crecimiento de microorganismos B) Agar Mac
Conkey con crecimiento de Microorganismos ...................................................... 50
Figura 21. Proceso de tinción Gram ...................................................................... 51
Figura 22. Observación de Gram positivos y Gram negativos ............................. 52
Figura 23. Proceso de identificación Sistema Vitek Compact 2 ........................... 53
Figura 24. 1) Placas petrifilm aerobios totales con presencia de colonias, 2) Placas
petrifilm coliformes con presencia de colonias ..................................................... 54
Figura 25. 1) Sistema Vitek Compact 2, 2) tarjeta vitek después de la
identificación ......................................................................................................... 54
Figura 26. Área de desechos ................................................................................. 55
xvi
LISTA DE GRÁFICOS
Gráfico 1. Cruce de variables UFC*muestras (total) ............................................ 63
Gráfico 2. Cruce de variables UFC*muestras esponjero endodóntico estéril ....... 65
Gráfico 3. Cruce de variables UFC*esponjero endodóntico no estéril ................. 67
Gráfico 4. Cruce de variables aerobios totales *muestras (total) .......................... 68
Gráfico 5. Cruce de variables aerobios totales *muestras esponjero endodóntico
Estéril .................................................................................................................... 69
Gráfico 6. Cruce de variables aerobios totales *muestras esponjero endodóntico
no estéril ................................................................................................................ 70
Gráfico 7. Cruce de variables enterobacterias * muestras (total) .......................... 71
Gráfico 8. Cruce de variables enterobacterias * muestras esponjero endodóntico
estéril ..................................................................................................................... 73
Gráfico 9. Cruce de variables enterobacterias * muestras esponjero endodóntico
no estéril ................................................................................................................ 74
Gráfico 10. Cruce de variables identificación bacteriana vitek compact® 2 *
muestras (total) ...................................................................................................... 75
Gráfico 11. Cruce de variables identificación bacteriana vitek compact® 2 *
muestras esponjero endodónticoestéril ................................................................. 76
Gráfico 12. Cruce de variables identificación bacteriana vitek compact® 2 *
muestras esponjero endodóntico no estéril ........................................................... 78
xvii
LISTA DE ANEXOS
Anexo A. Certificado de aprobación SEISH – UCE............................................. 90
Anexo B. Certificado URKUND .......................................................................... 91
Anexo C. Solicitud de autorización para el uso de equipos del laboratorio de
microbiología del Hospital Gineco-Obstétrico Isidro Ayora ................................ 92
Anexo D. Certificado de realización del estudio y uso de equipos del laboratorio
de microbiología del Hospital Gineco-Obstétrico Isidro Ayora ........................... 93
Anexo E. Solicitud de autorización para el ingreso a clínicas de la Facultad de
odontología de la Universidad Central del Ecuador. ............................................ 94
Anexo F. Autorización para el ingreso a clínicas de la Facultad de odontología de
la Universidad Central del Ecuador. ..................................................................... 95
Anexo G. Tablas de recolección de datos. ............................................................ 96
Anexo H. Guía del Manejo de desechos del laboratorio de microbiología del
Hospital Gineco-Obstétrico Isidro Ayora. ............................................................ 97
Anexo I. Certificado de idoneidad ética y experticia del Tutor. ......................... 101
Anexo J. Certificado de idoneidad ética y experticia del Estudiante. ................. 102
Anexo K. Carta de confidencialidad. .................................................................. 103
Anexo L. Declaración de conflictos de Interés del Tutor. .................................. 104
Anexo M. Declaración de conflictos de Interés del Estudiante. ......................... 105
Anexo N. Certificado de renuncia al trabajo estadístico. .................................... 106
Anexo O. Certificado de traducción del resumen. .............................................. 107
Anexo P. Autorización de publicación en el repositorio..................................... 108
Anexo Q. Certificado de autenticidad del tema otorgado por la biblioteca. ....... 110
Anexo R. Aceptación de tutoría. ......................................................................... 111
Anexo S. Inscripción del Tema. .......................................................................... 112
Anexo T. Resultados de Laboratorio .................................................................. 115
xviii
TEMA: Nivel de contaminación bacteriana en esponjeros endodónticos de
aluminio, plástico común y plástico autoclavable, de los estudiantes de la clínica
integral de la FOUCE
Autora: Victoria Alejandra Cárdenas Vinueza
Tutora: Dra. Alexie Izquierdo Bucheli
RESUMEN
El esponjero endodóntico es un material de importancia, debido a que en él se realiza la
limpieza de las limas que son utilizadas durante la fase de instrumentación del conducto
radicular, pero puede ser un medio contaminante si no ha recibido previo a su uso un
protocolo adecuado de desinfección y/o esterilización. El objetivo de esta investigación
fue determinar in vitro el nivel de contaminación de esponjeros endodónticos previo a su
uso en la práctica clínica. Se tomaron 30 muestras con hisopo estéril que se distribuyeron
en tres grupos: Grupo A: 9 muestras de esponjeros de plástico común, y una muestra
control, Grupo B: 9 muestras de esponjeros de plástico autoclavable y una muestra
control, Grupo C: 9 muestras de esponjeros de aluminio y una muestra control. Las
muestras fueron transportadas en 3ml de tioglicolato, y se incubaron por 24 horas a
36°C. Transcurrido el tiempo se realizaron 2 procesos: Primero, para el conteo de
unidades formadoras de colonias (UFC), se tomó 1ml de cultivos in dilución y se colocó
en las placas petrifilm aerobios totales y 1ml en las placas petrifilm coliformes; Segundo,
para identificar el crecimiento bacteriano por cada grupo se realizó la siembra en 10 cajas
petri con agar sangre y 10 cajas con agar Mac Conkey, y se incubó las placas y los agares
por 48 horas a 36°C. Posteriormente se aisló los grupos bacterianos y se realizó la tinción
Gram de cada placa en la que hubo crecimiento y con el lente de 100X se identificó
bacterias Gram + y Gram– Finalmente se procedió a la identificación de microorganismos
mediante el lector vitek 2® Compact con tarjetas de identificación vitek GP (Gram
positivos) y vitek GN (Gram negativos), en un lapso de 8 horas. Se detectaron los
siguientes grupos: Staphylococcus, bacilos ambientales, aerococcus, enterobacterias y
neisserias y se pudo determinar el nivel de carga bacteriana mediante la escala de
unidades formadoras de colonias las cuales presentan mayor prevalencia en los
esponjeros endodónticos de aluminio y plástico común, frente al esponjero endodóntico
de plástico autoclavable, el cuál al presentar la menor contaminación se considera el más
recomendable para el uso clínico.
Este estudio representa un aporte para la comunidad odontológica al determinar el nivel
de contaminación presente en los esponjeros endodónticos y tomar normas de
bioseguridad, que faciliten la prevención de riesgos biológicos.
Palabras clave: MICROORGANISMOS/ ESPONJERO ENDODÓNTICO/
AEROBIOS TOTALES/ COLIFORMES/ AGAR
xix
TOPIC: Level of bacterial contamination in the aluminum, common plastic and
autoclavable plastic endodontic sponges of the students of the integral clinic of
FOUCE
Author: Victoria Alejandra Cárdenas Vinueza
Tutor: Dr. Alexie Izquierdo Bucheli
ABSTRACT
The endodontic sponge is a material of great importance, because the cleaning of the files
that are used during the instrumentation phase of the root canal is performed on it, but as
well, it can be a contaminating medium if it has not received an adequate disinfection and
sterilization protocol prior to its use. The objective of this research is to determine with an
in vitro microbiological study, the level of contamination that endodontic sponges have
before their use in clinical practice. 30 samples with sterile swab were taken and divided
into three groups: Group A: 9 samples of plastic autoclavable sponges, and a control
sample, Group B: 9 samples of common plastic sponges and one control sample, Group
C: 9 samples of aluminum sponges and a control sample. The samples were transported in
test tubes in 3ml of thioglycolate, and incubated for 24 hours at at 36°C. After this time, 2
processes were carried out. Firstly, for counting colony-forming units (CFU), 1 mm of
culture without dilution was placed in the petrifilm total aerobic dishes and 1 mm in the
petrifilm coliform dishes. Secondly, to identify bacterial growth for each group, sowing
was done in 10 petri dishes with blood agar and 10 boxes with Mac Conkey agar, and the
dishes and agars were incubated for 48 hours at 36°C. Subsequently, the bacterial groups
were isolated and the Gram stain procedure of each dish in which there was growth was
performed and with the 100X lens Gram + and Gram– bacteria were identified. Finally,
the identification of microorganisms was carried out using the vitek 2® Compact reader
with vitek GP identification cards, vitek GP (positive Gram) and vitek GN (negative
Gram), in a period of 8 hours. The following groups were detected: Staphylococcus,
environmental bacilli, aerococcus, enterobacteria and neisseries and the level of bacterial
load was possible to determine through the scale of colony-forming units which have a
higher prevalence in endodontic sponges of aluminum and plastic, compared to the
autoclavable plastic endodontic sponge, which as presents the least contamination is
considered the most recommended for clinical use.
This study will represent a contribution to the dental community when determining the
level of contamination present in endodontic sponges and to take biosecurity rules to ease
prevention of biological risks.
KEY WORDS: MICROORGANISMS / ENDODONTIC SPONGE / TOTAL
AEROBES / COLIFORMS / AGAR
1
INTRODUCCIÓN
En el accionar clínico endodóntico es indispensable la utilización de materiales e
instrumentos que hayan sido sometidos a un protocolo fiable de desinfección y
esterilización, previo al uso en el paciente, porque el objetivo del tratamiento es
disminuir la carga bacteriana en cada fase del procedimiento, hasta limpiar de
forma integral el conducto radicular. Durante la práctica clínica endodóntica se
usan diversos instrumentos y materiales con estructuras heterogéneas; para lograr
una eficiente asepsia se debe jerarquizar en forma selectiva los materiales.
Uno de los materiales auxiliares es el esponjero endodóntico, comercialmente se
presenta en 3 tipos de componentes como: plástico común, plástico autoclavable y
aluminio; que son de gran importancia en el procedimiento de endodoncia,
permitiendo la limpieza de las limas en la fase de instrumentación del conducto
radicular.
El presente estudio tuvo como finalidad valorar los niveles de contaminación
bacteriana en los esponjeros endodónticos manipulados por los estudiantes de la
Facultad de Odontología de la Universidad Central del Ecuador, previo al
contacto con el paciente. Adicionalmente permitió reconocer los grupos de
bacterias que se pueden presentar en cada uno de los materiales más comunes de
composición del esponjero endodóntico (plástico autoclavable, plástico común y
aluminio). Según los resultados de la investigación se podrá sugerir un material
adecuado para el uso clínico, asistido con técnicas de asepsia apropiadas que
garanticen una disminución del nivel de carga bacteriana, para generar impacto en
la prevención de riesgos biológicos.
2
CAPÍTULO I
1. PROBLEMA
1.1. Planteamiento del Problema
El esponjero endodóntico es un material auxiliar de gran importancia en el
accionar clínico, en él se realiza la limpieza de las limas que son utilizadas durante
la fase de instrumentación del conducto radicular; una norma básica es realizar el
proceso de desinfección y esterilización adecuados, previo a su utilización y de
esta manera procurar que la terapia sea exitosa disminuyendo los riesgos externos
existentes en el proceso de descontaminación del conducto.
Los datos obtenidos durante la aplicación del estudio piloto, realizado en el
laboratorio de bacteriología del Hospital Gineco-Obstétrico Isidro Ayora
evidenciaron altos niveles de contaminación bacteriana en los esponjeros
endodónticos, con estos resultados se determinó la necesidad de investigar si
existe un manejo óptimo del protocolo de asepsia utilizado en clínica integral de
la FOUCE.
Se conoce que el esponjero endodóntico se presenta en 3 tipos de material que
son: plástico común, plástico autoclavable y aluminio; cada uno de estos
materiales tienen cualidades de resistencia ante ciertas sustancias químicas
utilizadas en el proceso.
En relación a lo antes expuesto se formula la siguiente interrogante: ¿Los
materiales de los esponjeros endodónticos utilizados por los alumnos en la clínica
integral de pregrado de la FOUCE permiten la contaminación bacteriana y se
utilizan contaminados antes de un procedimiento endodóntico?
3
1.2. Justificación
Se pretende demostrar con este estudio investigativo, que en el proceso
endodóntico no todos los materiales cumplen con los parámetros requeridos de
asepsia, que exige este tipo de terapia. Los esponjeros endodónticos son
fabricados con materiales como: el aluminio, plástico común y plástico
autoclavable, estos materiales pueden determinar diferentes niveles de
contaminación.
Los esponjeros endodónticos al estar estructurados por diversos materiales
sensibles a sustancias químicas y el sometimiento continuo a estos agentes pueden
deteriorarlos y convertirse en un elemento contaminante con un elevado número
de las colonias bacterianas. Para evitar infecciones cruzadas es necesaria la
utilización de un protocolo de asepsia, que permita disminuir la carga bacteriana
como mecanismo de prevención de riesgos biológicos.
Evidenciado en el proceso investigativo de campo en los laboratorios del hospital
Gineco-Obstétrico Isidro ayora se pudo demostrar, que en la mayoría de
materiales de endodoncia se hospedan bacterias, desde su diseño, empaque y
comercialización; además en el proceso de uso y de rutina estos materiales se
contaminan, por la inadecuada técnica de desinfección y esterilización, con estos
antecedentes resulta importante el desarrollo de un trabajo de investigación, que
permitirá dar a conocer los grupos de bacterias que se pueden alojar en los tres
tipos de materiales más comunes de composición de los esponjeros endodónticos
y de esta manera sugerir un material óptimo para el uso clínico.
Con esta investigación se plantea recalcar la importancia de un protocolo que
englobe un conjunto de técnicas de asepsia apropiadas que garantice una
depreciación de microorganismos, garantizando un servicio integral con un
potencial de satisfacción.
4
1.3. Objetivos
1.3.1. Objetivo general
Establecer el nivel de contaminación bacteriana y los grupos bacterianos presentes
en esponjeros endodónticos de aluminio, plástico común y plástico autoclavable
previo al uso en el paciente, de los estudiantes de la clínica integral de la FOUCE,
periodo 2018-2019.
1.3.2. Objetivos específicos
• Determinar si existe contaminación bacteriana en los esponjeros
endodónticos de plástico común, plástico autoclavable y aluminio
mediante la valoración de UFC.
• Reconocer según el sistema vitek compact 2®, los grupos bacterianos de
aerobios y coliformes presentes en los esponjeros endodónticos.
• Comparar los niveles de contaminación entre los materiales de los
esponjeros endodónticos: plástico común, plástico autoclavable y
aluminio.
5
1.4. Hipótesis
1.4.1. Hipótesis de investigación, Hi.
El material de los esponjeros endodónticos que usan los estudiantes en la clínica
integral de pregrado de la FOUCE puede presentar un alto nivel de contaminación
bacteriana.
1.4.2. Hipótesis nula, Ho.
El material de los esponjeros endodónticos que usan los estudiantes en la clínica
integral de pregrado de la FOUCE puede presentar un bajo nivel de
contaminación bacteriana.
6
CAPÍTULO II
2. MARCO TEÓRICO (REVISIÓN BIBLIOGRÁFICA)
2.1. Riesgo biológico
2.1.1. Generalidades
El riesgo biológico es la posibilidad de transmitir un patógeno en la actividad
laboral, este tipo de riesgo proviene de la manipulación o exposición a elementos
contaminantes, que existen en todos los ambientes, con mayor magnitud en
hospitales y centros de investigación biomédica (1).
La obligación del profesional de prevenir el riesgo biológico en el medio laboral,
consiste en tomar medidas para evadir problemas de salud, originados por agentes
biológicos con capacidad infecciosa, presentes en el entorno, aplicando principios
de acción preventiva.
Los agentes biológicos con capacidad infecciosa pueden ser diversos (virus,
bacterias, parásitos, hongos o esporas, toxinas, endotoxinas, cultivos celulares)
etc. Para que este contacto se produzca debe existir una vía de transmisión, que
permita que el agente entre en contacto con el órgano provocando alteraciones y
daño a la salud.
La susceptibilidad propia de cada individuo, explica porqué algunos se complican
cuando entran en contacto con un agente biológico, mientras que otros no, esto
significa que va en función de su inmunización previa y otras características
personales (2).
7
2.1.2. Microorganismos
Los microorganismos son seres vivos diminutos, que no pueden ser observados a
simple vista, en el pasado no se conocía su existencia, hasta que en el siglo XVI se
dio un paso importante con el descubrimiento del microscopio por Anton Van
Leeuwenhoek reconocido como el padre de la Microbiología, fue el primero en
observar este tipo de fenómenos microscópicos (bacterias, hongos, protozoos y
algas).
Pocos microorganismos son patógenos, el conocimiento práctico de los mismos es
importante en medicina y otras ciencias relacionadas con la salud, para prevenir la
propagación de enfermedades (3).
2.1.3. Mecanismos de transmisión
Los mecanismos de trasmisión son el conjunto de estrategias que utilizan los
microorganismos para ponerse en contacto con el huésped. En la práctica clínica
odontológica las vías de transferencia de enfermedades se producen, por contacto
directo a través de heridas de la piel, sangre, fluidos corporales y por contacto
indirecto a través de aerosoles, la contaminación de agua, por medio del aire,
equipos de protección individual y los instrumentos en uso (4).
2.1.3.1. Mecanismos de transmisión según los factores
A. Por vía de eliminación: esta transmisión depende de la habilidad que tenga el
microorganismo para su eliminación de forma natural o no.
B. Resistencia en el medio exógeno: No todos los microorganismos tienen la
capacidad de sobrevivir si no se alojan en un medio apropiado.
C. Según la vía de entrada: Podemos encontrar puertas de entrada accesibles
para los microorganismos.
D. Según la cantidad de agente infectante: Cuando la transmisión no requiere de
una cantidad muy grande para infectar logra hacerlo a través de las manos, si
8
necesita una cantidad mayor utilizará vías de diseminación, como el agua y
los alimentos (4).
2.1.3.2. Tipos de mecanismos de transmisión
Transmisión por vía directa
La vía de transmisión del agente patógeno de una persona infectada a otra por
contacto directo, se adquiere por medio de fluidos corporales infectados en
contacto con las superficies de los tejidos, a través de una puerta de entrada, como
una herida; también se produce por inoculación cutánea al utilizar objetos corto
punzantes que estén contaminados, otra vía de acceso son las salpicadura de
sangre, saliva u otro fluido corporal (5).
Transmisión por vía indirecta
La transmisión por vía indirecta requiere de un vehículo, este sirve como
intermediario en la trasmisión del agente infeccioso como: instrumentos de alta y
baja velocidad e instrumental contaminado utilizados en pacientes infectados,
instrumentos, vestimenta que no hayan sido sometidos a un adecuado proceso de
desinfección o esterilización (5).
La contaminación es un medio de transmisión por vía indirecta, por ello
hablaremos de este tema a continuación como parte de nuestro estudio.
• Contaminación
La contaminación es conocida como el principal causante de alterar o dañar el
estado de equilibrio de un medio u objeto, mediante la transmisión y propagación
de gases tóxicos a la tierra, atmósfera y el agua, de igual forma la acumulación de
polvos y gérmenes microbianos que provienen de los desechos generados por la
actividad del ser humano” (6).
9
• Tipos de contaminación
Existen tipos de contaminación en diferentes medios, generados por diversas
fuentes que son: biológica, ambiental, del suelo y del agua; sin embargo, en la
práctica odontológica es de vital importancia conocer y prevenir la contaminación
biológica por ser el principal causante de las infecciones transmisibles (7).
Se reconoce la existencia de 2 tipos de contaminación de microorganismos en el
ser humano los cuales son: biológica y cruzada. Estos 2 tipos de contaminación
provocan alteraciones en el equilibrio normal de la persona.
a. Contaminación biológica
La contaminación biológica consiste en la presencia de microorganismos
patógenos en el ambiente, los cuales son los responsables de provocar infecciones
en el ser humano a través del agua y los alimentos (8).
a.1 Fuentes de contaminación biológica en odontología
a.1.1 Profesional
El profesional en la rama odontológica, es considerado uno de los principales
depósitos de microorganismos patógenos, principalmente cuando esté posea algún
tipo de enfermedad infecciosa o haya sido infectado por un paciente con quien
entró en contacto (9).
a.1.2 Paciente
Todo paciente en la consulta odontológica es considerado potencialmente
infeccioso, este puede ocultar su padecimiento para no ser objeto de
discriminación o ser portador de una enfermedad no diagnosticada; en
odontología, el profesional al estar en contacto constante con la boca del paciente
10
se convierte en un huésped susceptible a la contaminación de microorganismos
que este posee (9).
a.1.3 Instrumental
Todo instrumental, artículo y material que se encuentre en el ambiente
odontológico tiene la capacidad de albergar y diseminar microorganismos, por
esta razón se debe tomar medidas de bioseguridad y aplicar protocolos de
desinfección y esterilización adecuados. En el campo de la odontología se debe
precautelar la salud del paciente, del profesional odontólogo y de toda persona
involucrada en este medio (9).
Negroni (2009), acotó que los objetos inanimados como: paredes con presencia de
insectos, techos, y aerosoles, son capaces de transportar y retener
microorganismos en todo el ambiente, esto implica brindar un mantenimiento de
limpieza integral en forma diaria y en algunos casos semanal o mensual (10).
b. Contaminación cruzada
Higashida (2009), concluye que la contaminación cruzada, es la trasmisión de un
agente infeccioso entre 2 personas, por medio de un objeto, instrumento o material
contaminado. Esta forma de contaminación genera en las involucradas
alteraciones en su salud. Los entendidos en este tema afirman que la
contaminación cruzada se clasifica en dos tipos: directa e indirecta (11).
b.1 Tipos de contaminación cruzada
b1.1 Contaminación cruzada directa
La transferencia de contaminación cruzada directa es inmediata, ocasionada por
un agente infeccioso a través de una puerta de entrada receptiva por donde iniciará
11
la enfermedad, facilitando la contaminación por medio de: dispersión de
microgotas al toser, estornudar o habla, hasta un metro o menos (12).
b.1.2 Contaminación cruzada indirecta
Se produce por medio de vehículos de transmisión, a través de objetos o
materiales contaminados, en estos se encuentran los productos biológicos,
incluidos sangre, suero, plasma, tejidos, órganos y cualquier sustancia que sirva
de intermediario (12).
2.1.4. Agentes biológicos
Se consideran agentes biológicos a las bacterias, virus, hongos, parásitos, una
toxina u otro material biológico con capacidad de afectar de manera adversa a los
humanos por poseer algunas propiedades de consideración como: poder
antigénico, virulencia y patogenicidad (11).
2.1.5. Clasificación de los microorganismos
La presencia de microorganismos en las clínicas odontológicas, es uno de los
problemas básicos que afronta el ámbito de la salud, porque la gran cantidad de
virus, bacterias, hongos y levaduras entran en contacto fácilmente con el cuerpo,
por medio de heridas, mucosas de la boca, nariz, ojos, ingestión e inhalación (9).
12
Figura 1. Clasificación de los Microorganismos
Fuente: Montoya. 2008. Microbiología básica para el área de la salud y afines (13).
Múltiples factores propician la generación y propagación de microorganismos
patógenos, causantes de distintas enfermedades; para sanear esta dificultad, la
única medida preventiva es una adecuada aplicación de normas de bioseguridad,
en la relación con los pacientes, el manejo del instrumental y materiales que son
parte del dinamismo odontológico (9).
En este estudio investigativo se encuentra únicamente presencia de bacterias que
se las detalla a continuación.
2.1.5.1. Bacterias
Se definen como: microorganismos unicelulares anucleados y sinorgánulos
metabólicos, rodeados por una membrada conformada por fosfolípidos que les
permite alimentarse y sobrevivir; estas se ubican en un huésped que proporciona
un ambiente óptimo (14).
Las bacterias tienen la siguiente clasificación:
13
Figura 2. Clasificación de las Bacterias
Fuente: Villacrés. 2015. Grado de Contaminación de los teléfonos celulares de docentes y
estudiantes que realizan actividades en la clínica integral de la Facultad de Odontología de la
Universidad Central del Ecuador, periodo 2015 (15).
2.1.5.1.1 Clasificación por agrupamiento y forma
Cocos
Células con forma redondeada; frecuentemente estas bacterias pueden agruparse
de dos en dos (diplococos), en cadenas (estreptococos), en forma de racimos
(estafilococos), en forma de cubos (sarcina) o de cuatro en cuatro (tétradas) (3).
Figura 3. Morfología y agrupaciones bacterianas (cocos)
Fuente: Porres y Ruiz. 2018. Microbiología clínica (3).
14
a. Estreptococos
Son bacterias Gram positivas esféricas, se presentan en cadenas y están
consideradas como las causantes principales de padecimientos y dolencias con
relación a otras bacterias. La causa principal de su patogenicidad se debe a la
producción de sustancias extracelulares que destruyen a los fagocitos que los
ingieren. Algunos estreptococos son perjudiciales para el huésped porque pueden
digerir el tejido contaminado; provocando necrosis o muerte celular; sin embargo,
otras clases de estreptococos no son peligrosas como los usados en la elaboración
de derivados de la leche (16).
De acuerdo a su apariencia con base a los cultivos en Agar sangre se puede
clasificar a los estreptococos en beta-hemolíticos y no beta- hemolíticos, siendo
los primeros en presentar una zona clara de hemolisis en el agar producido por el
Streptococcus pyogenes promotor de alteraciones como: laerisipela, faringitis y
fiebre reumática (16).
En los beta no hemolíticos encontramos el Streptococus pneumoniae causante de
la neumonía, este agente forma colonias de color verde, por la destrucción parcial
de los glóbulos rojos y por el peróxido de hidrógeno producido por la bacteria;
otro tipo es el Streptococus mutans causante de la caries dental (16).
• Staphylococcus
Los staphylococcus son bacterias en forma de racimos, que se encuentran
presentes en la piel y mucosas. El Sthaphylococus aureus es el principal agente
causante de afecciones gastrointestinales y cutáneas; esta bacteria ha revelado
resistencia en ciertas ocasiones a la penicilina; lo que constituye un peligro
evidente en las personas que contraen este microorganismo (17).
15
• Bacilos
Los bacilos son células con forma de bastón alargado, su morfología es
característica al agruparse formando filas de dos denominados diplobacilos o filas
más largas llamadas estreptobacilos (3).
Figura 4. Morfología y agrupaciones bacterianas (bacilos)
Fuente: Porres y Ruiz. 2018. Microbiología clínica (3).
2.1.5.1.2 Clasificación de por tinción
Tinción Gram
La técnica de tinción Gram se emplea en la identificación bacteriana, permitiendo
la observación de bacterias que se tiñen con las sustancias utilizadas en el
proceso; de esta forma se clasifican en 2 grupos de importancia que son: Gram
positivos y Gramnegativos (3).
16
1. Procedimiento esquematizado de Tinción Gram
a.1 Cristal violeta
Se realiza un extendido de la muestra sobre una placa y se procede a fijar por
calor, aplicar el colorante cristal violeta cubriendo el extendido, dejar a
temperatura ambiente por un tiempo aproximado de 20 segundos y lavar con agua
destilada.
a.2 Lugol (yodo)
Adicionar solución de yodo para formar un complejo con el cristal violeta que
permitirá la unión de este a la pared de las bacterias Gram positivas, dejar 20
segundos a temperatura ambiente, lavar con agua destilada.
a.3 Alcohol / acetona
Añadir solución decolorante de alcohol / acetona en fracción 1:1 que permitirá la
eliminación de cristal violeta exclusivamente de las bacterias gram negativas,
debido a la estructura molecular de su pared bacteriana, dejar actuar 10 segundos
y lavar con agua destilada.
a.4 Safranina
Agregar safranina como colorante de contraste, que matizará de color rosa
únicamente a las bacterias Gramnegativas. Dejar actuar por 20 segundos a
temperatura ambiente, lavar bien con agua destilada y colocar el porta objetos
sobre una toalla de papel. Dejar secar al ambiente.
Una vez realizada la tinción la muestra se observará al microscopio óptico con el
objetivo de inmersión (objetivo 100X) (3).
17
Figura 5. Esquema de procedimiento tinción gram
Fuente: Porres y Ruiz. 2018. Microbiología clínica (3).
Gram positivo
Las bacterias Gram positivas se caracterizan por presentar una envoltura celular
uniforme y gruesa, que se pigmenta de color azul o violeta por la tinción de Gram,
estas no se decoloran al agregar alcohol / cetona por la pared de peptidoglicanos
que posee, la cual al contener pocos lípidos dificulta el ingreso del alcohol que
pudiera extraer el colorante (18).
Gram negativo
Las bacterias Gram negativas se diferencian de las Gram positivas por presentar
una coloración rosácea ocasionada por la estructura celular que posee, se
caracteriza por una doble membrana lipídica, lo cual permite el ingreso del
alcohol / cetona y al disolver los lípidos dilata los poros de la pared celular y
arrastra el tinte del interior de la célula, por lo cual la bacteria se decolora,
posteriormente se puede pigmentar con un matiz de contraste como la safranina o
la fucsina básica (19).
18
Figura 6. Disposición de la pared celular de las bacterias Gram negativas y Grampositivas
Fuente: Porres y Ruiz. 2018. Microbiología clínica (3).
2.1.6. Enfermedades producidas por bacterias
En la consulta clínica odontológica podemos encontrar diversos tipos de bacterias
que pueden provocar enfermedades por dos mecanismos elementales: la
invasividad, que es la habilidad para diseminarse en el huésped y la toxicidad, que
es la habilidad para eliminar sustancias químicas llamadas toxinas, que degeneran
los tejidos del huésped.
A estas enfermedades bacterianas se las denomina como enfermedades infecciosas
o contagiosas, porque se dispersan con facilidad entre una población.
Entre las más importantes tenemos:
2.1.6.1. Faringoamigdalitis
La faringoamigdalitis es la inflamación de las amígdalas y la faringe, se
caracteriza por causar dolor a nivel de la garganta, principalmente producida en
niños, la etiología está dada por el Streptococcus pyogenes transmitido por
contacto directo, esta afección produce sintomatología como: fiebre, presencia de
pus en la garganta y malestar general, requerirá de un tratamiento con cobertura
19
antibiótica y recomendaciones generales como aplicar hábitos de higiene, lavarse
las manos y el uso de productos desinfectantes (20).
2.1.6.2. Infecciones inespecíficas en la piel
La bacteria causante de esta alteración es el Staphylococcus aureus que se aloja en
la piel, un tercio de la población está contaminada por este microorganismo, para
su tratamiento es indispensable el uso de antibióticos más agresivos como
aminoglucósidos o cefalosporinas ya que en algunos casos presenta resistencia a
la penicilina (9).
2.1.7. Identificación bacteriana
La identificación bacteriana es observar características de importancia de las
bacterias como: la morfología, desarrollo, propiedades metabólicas y químicas; el
método más fiable es mediante cultivos, los cuales deben cumplir parámetros que
permitan el correcto desarrollo del medio y las condiciones óptimas de
incubación, esto posteriormente facilitará aislar los microorganismos para su
identificación (21).
2.1.7.1. Recolección de muestras
La recolección y transporte de muestras se debe realizar con normas de
bioseguridad pertinentes, para evitar la contaminación de las mismas y proteger al
personal encargado. El uso de hisopos es indispensable para la recolección de
especímenes, los mismos que están compuestos de materiales como: algodón y
alginato; los más utilizados en estos procesos son los hisopos estériles de algodón,
utilizados en superficies inertes regulares e irregulares. Los hisopos con las
muestras son colocados en recipientes de vidrio con tapa hermética, estéril y
rotulado (22).
20
2.1.7.2. Transporte de muestras
El envío de la muestra debe realizarse inmediatamente, es recomendado por los
expertos tener un límite de 2 horas; desde la recolección serán colocados en
contenedores isotérmicos con gel refrigerante, para mantener la cadena de frio
adecuada debe ser no mayor a 10°C, hasta el ingreso para la incubación en el
laboratorio. Con este proceso se evita riesgo contaminación de las muestras
brindando confiabilidad al resultado (23).
2.1.7.3. Medios de cultivo
Negroni (2009), explica que el medio de cultivo es una solución equilibrada
nutritiva para el crecimiento, desarrollo y multiplicación de los microorganismos
que son observados a simple vista y permite aislar e identificar las diferentes
especies para realizar estudios complementarios. Los medios de cultivo se
clasifican según diferentes criterios de referencia y utilidades (10):
Figura 7. Clasificación por criterios de los medios de cultivo
Fuente: Negroni. 2008. Microbiología Estomatológica Fundamentos y guía práctica (10).
21
2.1.7.3.1 Por su estado físico
a. Líquidos: Contienen nutrientes, a los que se adiciona una sustancia capaz de
mantener el pH apropiado; entre los más utilizados están: el caldo nutritivo y
el caldo de peptona
b. Sólidos: Se consiguen añadiendo agar (sustancia polisacárida e inactiva,
obtenida de algas marinas del género Gellidium),en una concentración de 1,5
al 2%, en un medio líquido determinado. Esta solución correctamente
esterilizada, se coloca en un tubo de ensayo o en una caja petri, luego se
puede evidenciar la formación de colonias aisladas, siempre y cuando la
cantidad inoculada este suficientemente diluida.
c. Semisólidos: Son muy afines a los medios sólidos, con la divergencia que a
estos se les disminuye la concentración de agar agregando un 0.5%; Son
utilizados para la preservación de cepas bacterianas y su posterior
observación utilizando un registro para evidenciar bacterias móviles (13).
2.1.7.3.2 Por su origen
a. Naturales: Son medios de cultivo preparados a partir de sustancias
encontradas en la naturaleza, estas pueden ser de origen animal o vegetal,
tienen una composición heterogénea. Ejemplo: el suero, la leche, la papa, etc.
b. Sintéticos: Son medios de cultivo combinados con productos químicos
conocidos: como el agar, usados para estudios metabólicos. Ejemplo: agar
nutritivo, agar blando, agar eosina azul de metileno, caldo nutritivo, etc (13).
22
2.1.7.3.2 Por su Utilidad
a. Comunes: Estos medios de cultivo conservan requisitos nutricionales
mínimos, que permiten el crecimiento bacteriano en general. Ejemplo: agar
nutritivo, caldo nutritivo, etc.
b. Enriquecidos: son medios simples o comunes a los que se les añade ciertos
componentes como sangre, suero, líquido ascítico, huevo, glucosa, vitaminas,
entre otros, permiten el aporte de factores de crecimiento o sustancias que
neutralizan agentes inhibidores de crecimiento. Ejemplo: Agar sangre, medio
de löwesteinjennsen, etc (13).
b .1 Agar sangre
Este medio de cultivo es diferencial, porque realiza una hemolisina bacteriana
permitiendo diversificar las especies no hemolíticas de las hemolíticas; en las
primeras se observa a su alrededor colonias de formación tipo halos(transparente
hemólisis total, corresponde a especies beta hemolítica; Ejemplo: Estreptococos
del grupo A y del grupo D, etc). (Verdoso que denota una hemólisis parcial,
corresponde las especies alfa hemolítica; ejemplo Estreptococos no pertenecientes
al grupo A, Neumococos, etc), al géneros de las no hemolíticas se las conoce
como: gama hemolíticas o anhemolíticas (24).
Este agar e puede ejecutar con sangre desfibrinada de carnero, conejo o humana;
la sangre humana se adquiere de los remanentes del Banco de Sangre, después de
ser sometidos a estudios, negativos por virus Hepatitis B y HIV. Para la
utilización esta sangre debe llenar ciertas condiciones, entre ellas ser lo más fresca
posible, no tener coágulos, ni estar hemolisada, ser estéril y no haber estado
sometida a cambios de temperatura bruscos.
El medio de cultivo debe ser esterilizado mediante calor húmedo(técnica de
autoclavado), y enfriado entre 45 y 50°C, solo el tiempo necesario. Para luego se
23
colocado en las placas petri lo más pronto posible, en una cantidad por caja que no
supere los 4mm (24).
c. Selectivos: Se consiguen añadiendo al agar nutritivo, compuestos químicos
que son perjudiciales para ciertas bacterias, su crecimiento es irrelevante y
alteran las condiciones físicas del medio. El cristal violeta por ejemplo impide
el crecimiento de bacterias Gram positivas sin afectar a las Gram negativas;
entre ellos tenemos al agar Mac Conkey, Thayer Martin, etc (13).
c.1 Agar Mac Conkey
Medio de cultivo frecuentemente empleado para separar bacterias fermentadoras
de lactosa de aquellas que no la fermentan, resultantes de aguas, alimentos y
muestras clínicas; contienen sales biliares y cristal violeta, que inhabilitan el
crecimiento de bacterias Gram positivas y algunas Gram negativas que no
pertenecen a la familia Enterobacteriacea.
Este agar tiene en su composición lactosa como único carbohidrato y rojo neutro
como indicador de pH, su ámbito de viraje tiene una escala entre pH 8 (amarillo)
y pH 6,8 (rojo).
Las bacterias fermentadoras de lactosa originan colonias que se transforman en
tono rojo, y las no fermentadoras de lactosa producen colonias incoloras, es decir
se tornan ligeramente amarillas, porque estas bacterias utilizan peptonas y
transforman al medio de cultivo en alcalino (24).
d. Diferenciales: Se adiciona a estos medios de cultivo, sustancias para que
únicamente crezcan determinadas bacterias. Estas al actuar sobre algunas de
las sustancias agregadas, permitirán la una observación macroscópica de
ciertas propiedades de crecimiento, que ayuden a diferenciar unas colonias de
otras. Ejemplo: agar eosina azul de metileno (13).
24
2.1.7.4. Siembra o inoculación
Inocular o sembrar es introducir de forma artificial una fracción de muestra
(inoculo) en un medio apropiado, con el fin de formar un cultivo microbiano. Para
realizar una siembra en microbiología, es obligatorio mantener un área de trabajo
exclusiva sin corrientes de aire y estar junto a la flama del mechero (no más de 15
cm. de distancia entre el agar y el mechero); otra forma de trabajo es bajo
campana, o flujo laminar, previa esterilización con luz Ultra Violeta.
La siembra se realiza en medio líquido, semisólido o sólido, utilizando ansa de
inoculación, hilo, hisopo o pipeta estéril. Se debe esterilizar en la flama el ansa o
hilo hasta que el filamento se haya puesto al rojo vivo, posteriormente se enfría
antes y después de realizada la siembra (25).
Para la transferencia de microorganismos, se recomienda:
a) De medio líquido a medio líquido: usar pipeta Pasteur o graduada, ansa o
hilo de inoculación.
b) De medio líquido a sólido: se debe utilizar pipeta Pasteur o graduada, hilo
o ansa de inoculación, e hisopo.
c) De medio sólido a medio sólido: se manejará ansa o hilo de inoculación.
d) Medio sólido a medio líquido: se usará ansa o hilo de inoculación.
Luego de realizar la siembra, se procederá a incubar el medio de cultivo a una
temperatura adecuada para el crecimiento de 36°C a 37°C (25).
25
Figura 8. Técnica de siembra e inoculación
Fuente: Mezomo. 1997. Rehabilitación Oral para el clínico (25).
2.1.7.5. Técnicas de aislamiento de los microorganismos
Aislar es separar un microorganismo de una población heterogénea; en hábitats
naturales ocasionalmente encontramos microorganismos de un solo tipo en una
muestra, por lo cual, es preciso hacer un procedimiento de aislamiento, afín de
separar e identificar los distintos grupos de microorganismos presentes.
El objetivo de aislar es obtener colonias diferenciadas (se forman a partir de una
sola unidad formadora de colonias), consiguiendo un cultivo puro; con los
cultivos puros se podrá observar las características macroscópicas, microscópicas,
fisiológicas, etc. Se debe tomar en consideración que siempre el aislamiento se da
en un medio sólido.
Los medios líquidos utilizados sirven para enriquecer, pero no para aislar; se
puede lograr el aislamiento de forma directa a partir de una muestra, cuando los
microorganismos están en un equilibrio adecuado. Cuando se desea aislar e
identificar una muestra y esta se encuentra en baja proporción, se realizará un
procedimiento de enriquecimiento o etapa de aumento del número de
microorganismos para el estudio de la colonia que se desea investigar.
26
En seguida se procede al aislamiento por el método de estría transversal o de
dilución para posteriormente identificar (26).
Para aislar se usarán los siguientes procedimientos:
2.1.7.5.1 Métodos generales
Los métodos generales para aislar son: La mezcla y la dispersión en superficie
mediante agotamiento de ansa, depósito y posterior quemado y dilución (26).
2.1.7.5.2 Métodos especiales
Los métodos especiales se usan para aislar un microorganismo, que posea una
particularidad especial (por temperatura de incubación, calentamiento, cambios en
el pH, agregado de álcali o ácido y presencia de sales o colorantes) (26).
2.1.7.6. Identidad bacteriana
En 1840 el médico patólogo Henle, marco la necesidad de reconocer que la base
primordial para la identificación de bacterias como agentes patógenos es el
aislamiento en cultivo puro, una colonia de cultivo puro aislada se compone por
un solo tipo de microorganismos procedente de una única célula. Para facilitar la
identificación bacteriana se realizará en cultivos puros. Es posible una
identificación previa al aislamiento de bacterias con base a las características
simples que una célula puede presentar.
Una vez aisladas las bacterias por medio del cultivo correspondiente, sea este
común o selectivo; el paso para identificar las características ambientales de su
crecimiento óptimo son: forma, elevación, bordes, dimensión, color, olor, tipo de
superficie, espesor, consistencia, incrustación en el medio de cultivo; además
crecimiento en sábana y su comportamiento frente a los diferentes sustratos
agregados al medio de cultivo (utilización de sales, hemólisis, fermentación de
27
azúcares); el comportamiento de las colonias frente a los colorantes de los
individuos bacterianos, junto a su morfología y modo de agruparse (27).
2.1.7.6.1 Método de identificación sistema Vitek 2 compact®
Es un sistema de tarjetas con reactivos colorimétricos, que son inoculadas con la
suspensión de Mc Farland al 0.5% y los resultados son interpretados de manera
automática; la tarjetas tiene 64 pozos, cada uno con un sustrato de prueba
individual. Estos sustratos miden varias actividades metabólicas como: desarrollo
en presencia de sustancias inhibidoras, acidificación, hidrólisis enzimáticas y
alcalinización. Las tarjetas están selladas en los dos lados por una película
transparente que impide el contacto entre las diversas mezclas sustrato-
microorganismo, permite a la vez la transmisión del nivel de oxígeno adecuado.
Cada tarjeta contiene un tubo de transferencia pre-insertado para inocular; estas
tarjetas presentan un código de barras con información sobre el tipo de producto,
número de lote, fecha de caducidad y un identificador que es ligado a la muestra,
antes o después de cargar la tarjeta al sistema (28).
Comercialmente encontramos 4 tipos de tarjetas reactivas que sirven para la
identificación de diferentes tipos de microorganismos:
1. GP - Cocos y bacilos no formadores de esporas Gram positivos
2. GN – Bacilos Gram negativos fermentadores y no fermentadores.
3. BCL – Bacilos formadores de esporas Gram positivos.
4. YST – Levaduras y organismos levaduriformes
Preparación del espécimen
1. Preparar el inóculo a partir de un cultivo puro, según las buenas prácticas de
laboratorio
28
2. Colocar en un tubo de ensayo de plástico transparente (poliestireno) de 12 x
75 mm., 3,0 ml de solución salina estéril (NaCl acuoso al 0,45 – 0,50%, con
un pH de 4,5 a 7,0).
3. Utilizar un hisopo o asa estéril, para transferir un número suficiente de
colonias morfológicamente similares al tubo con solución salina.
4. Preparar la suspensión homogénea de organismo con una densidad
equivalente a un patrón McFarland 0.5 utilizando el DensiCHEK™ Plus
VITEK® compact calibrado y previamente controlado con los viales de
concentración McFarland estandar. El tiempo de suspensión no debe superar
los 30 minutos antes de inocular la tarjeta.
5. 1 tubo con la preparación de 0,5 Mc Farland.
6. Colocar el tubo más la tarjeta de identificación en el casette del Vitek,
colocarlos saltando una posición en el casette:
- Tarjeta GN para la identificación de Bacilos Gram-negativos.
- Tarjeta GP para la identificación de Cocos Gram-positivos
7. revisar los resultados de 8 a 10 horas posteriores (28).
2.1.8. Pruebas bioquímicas
Las pruebas bioquímicas son actividades enzimáticas ampliamente utilizadas, que
permite diferenciar a las bacterias, incluso cuando estas están estrechamente
relacionadas, se podrán separar en especies diferentes a través del empleo de
pruebas bioquímicas. Igualmente, podrán proporcionar datos acerca del nicho de
la especie en el ecosistema (21).
29
2.1.8.1 Manitol
Esta prueba bioquímica sirve para detectar si los gérmenes son capaces de
fermentar el manitol, por que libera sustancias ácidas las cuales serán detectadas
gracias al indicador rojo de fenol que cambiara al color amarillo; Esta prueba sirve
para diferenciar bacterias de importancia clínica como: Staphylococcus aureus (+)
de Staphylucoccus epidermidis (-) (29).
Figura 9. Manitol positivo (S. aureus) y manitol negativo(S. epidermidis)
Fuente: Cavallini et al. 2016. Bacteriología General. Principios y prácticas de laboratorio (24).
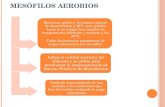
2.1.9. Recuento bacteriano de unidades formadoras de colonia mediante
placas Petrifilm para aerobios totales y coliformes
2.1.9.1. Las placas Petrifilm para recuento de aerobios (Aerobic Count AC)
Estas placas son un medio de cultivo listo para ser empleado, contiene nutrientes
del Agar Standard Methods (agente gelificante soluble en agua fría, y un tinte
indicador de color rojo), que facilitará el cálculo de las colonias. Las Placas
Petrifilm AC, se usan para el recuento de la población total existente de bacterias
aerobias en productos y superficies, etc (30).
30
Figura 10. Placas petrifilm aerobios totales
Fuente: 3M Microbiology. 2006. Manual de uso Placas petrifilm (30).
2.1.9.2. Las Placas Petrifilm para el Recuento de Coliformes (ColiformCount,
CC)
Este tipo de placa contiene nutrientes de Bilis Rojo Violeta (agente gelificante que
se disuelve en agua fría, más un indicador tetrazolium), que facilita el recuento de
las colonias; la película superior atrapa el gas emanado por los coliformes
fermentadores de lactosa, el gas atrapado alrededor de las colonias rojas de
coliformes confirma su presencia (30).
Figura 11. Placas petrifilm coliformes
Fuente: 3M Microbiology. 2006. Manual de uso Placas petrifilm (30).
2.2. Esponjero endodóntico (clean stand)
Es un material auxiliar usado en procedimientos endodónticos, sirve como un
pequeño organizador útil tanto para limpiar, esterilizar o transferir instrumental
31
del asistente al Odontólogo durante el tratamiento, además se lo utiliza para
recoger de modo ordenado las limas, ensanchadores, etc. después de su uso (31).
2.2.1. Características físicas
Se presenta en 3 tipos de material:
• Plástico común (polietileno)
• Plástico Autoclavable (polipropileno esterilizable)
• Aluminio
A B
C
Figura 12. Esponjeros endodónticos de cada material a) plástico común b) plástico
autoclavable c) aluminio
Fuente: 3M Microbiology. 2006. Manual de uso Placas petrifilm (30).
2.2.1.1. Plástico común (Polietileno)
El polietileno o polieteno (PE), es el plástico más común; se utiliza
principalmente en embalajes (bolsas, láminas y películas de plástico, contenedores
y botellas etc), el polietileno como material es conocido con la fórmula química
(C2H4) nH2. El polieteno es habitualmente una mezcla de compuestos orgánicos
(32).
32
2.2.1.2. Plástico autoclavable (Polipropileno)
El polipropileno (PP) esparcialmente cristalino y termoplástico, se obtiene de la
polimerización del propileno (propeno), perteneciente al grupo de las poliolefinas,
es usado en una amplia diversidad de aplicaciones como: equipos de laboratorio,
empaques de alimentos, componentes automotrices, tejidos y películas
transparentes; poseen gran resistencia frente a diversos solventes químicos, álcalis
y ácidos (32).
2.2.1.3. Aluminio
El aluminio es el metal más importante después del hierro, resalta por su bajo
peso y conductividad eléctrica y térmica, es muy reactivo químicamente y, tan
pronto se expone al aire, en su superficie se forma una capa de óxido adherente
compacto; este óxido resiste a un gran número de ambientes corrosivos y hace de
barrera anticorrosiva protegiendo al aluminio subyacente (32).
2.2.2. Usos del Esponjero Endodóntico
Es utilizado especialmente en la fase de instrumentación del conducto radicular y
en algunos procesos similares, que impliquen la correcta desinfección de
materiales que van a ingresar en la zona interna del órgano dentario, por ejemplo:
limas, conos de gutapercha, fresas peso largo, fresas Gates y pernos anatómicos o
metálicos.
Es importante que el esponjero endodóntico previo a su utilización sea sometido a
un adecuado proceso de desinfección y esterilización.
33
2.3. Asepsia
Es la ausencia total de microorganismos infecciosos, en los tejidos vivos o en un
objeto; este término se aplica habitualmente para designar las técnicas que
impiden el acceso de microorganismos no deseables al área de trabajo.
El odontólogo requiere una técnica aséptica significativa e integral, para
conseguirlo deben utilizarse diferentes procedimientos como la desinfección y la
esterilización (10).
2.3.1. Desinfección
La desinfección es un proceso que determina la eliminación de agentes
infecciosos o contaminantes, generalmente no asegura la disipación de todos los
organismos patógenos, ni de las esporas presentes en materiales inertes. Es un
proceso menos eficiente que la esterilización, porque utiliza agentes químicos que
no siempre tienen la capacidad de eliminar los microorganismos en su totalidad
(10).
2.3.1.1. Clasificación de los desinfectantes
a. Grado alto: Eliminan toda clase de microorganismos excepto esporas
bacterianas.
b. Grado medio: Destruyen micobacterias, bacterias, la mayoría de los virus y
hongos.
c. Grado bajo: Devastan la mayor parte de bacterias, algunos hongos y algunos
virus (19).
34
Tabla 1. Clasificación de los desinfectantes
DESINFECTANTES POR SU GRADO DE ACCIÓN
Nivel alto Nivel medio y bajo
Glutaraldehído Compuestos clorados
Formaldehído Alcohol (60 – 90%)
Ácido peracético (0.001 a 0.2%) Compuestos fenólicos
Peróxido de hidrógeno Iodóforos
Clorhexidina Compuestos de amonio cuaternario
(CAC)
Fuente: Romero. 2007. Microbiología y Parasitología Humana (19).
2.3.2. Esterilización
El proceso de esterilización logra la muerte de todas las formas de vida
microbiana, incluyendo virus, bacterias, hongos y sus esporas altamente
resistentes, mediante la pérdida inalterable de la capacidad de reproducción del
microorganismo (10).
2.3.2.1. Técnicas de esterilización
Existen procedimientos físicos y químicos, este último ya ha sido examinado, al
estudiar los desinfectantes; los procedimientos físicos se clasifican en mecánicos y
energéticos, en este se encuentra: el calor y las radiaciones y en el segundo la
filtración (10).
2.3.2.1.1 Destrucción de microorganismos a través de calor:
La forma más efectiva de esterilización es a través de la energía térmica, esta
utiliza el calor húmedo y seco.
a. Calor húmedo: El mecanismo de acción del calor húmedo es destruir a los
microorganismos en forma gradual, sumado a diversos eventos que van
35
sucediendo a medida que aumenta la temperatura; el resultado final de la
esterilización a 121ºC es el cambio estructural y coagulación de las proteínas;
existen otros mecanismos de destrucción, mediante la utilización de calor
húmedo a temperaturas inferiores (10).
Figura 13. Autoclave (calor Húmedo)
Fuente: Romero. 2007. Microbiología y Parasitología Humana (19).
a.1 Las temperaturas a la cual puede usarse el calor húmedo son:
• Inferior a 100ºC Pasteurización
• Promedio de 100ºC Ebullición y Tindalización
• Sobre los 100ºC Autoclavado
a.1.1 Pasteurización: Se usa en la eliminación de gérmenes patógenos que
presentan resistencia térmica similar o inferior a Mycobacterium tuberculosis,
Salmonella y Brucella. Este es un método de desinfección, que no se destruye
esporas y virus no lipídicos; existen dos métodos de pasteurización: durante 30' a
65ºC o durante 15´ a 72ºC; posteriormente las dos muestras se enfrían 10ºC; esta
técnica es utilizada en la purificación de la leche (19).
a.1.2 Ebullición: Es someter a 100°C a un objeto o sustancia por un período de
30', destruyendo la mayoría de las formas bacterianas, hongos y virus lipídicos
36
(Ej.: HIV y Herpes virus); no es eficiente para la destrucción de esporas y virus no
envueltos; repetir este proceso durante tres días consecutivos, constituye la
Tindalización. Este estudio se fundamenta por la destrucción de las formas
vegetativas durante el período de ebullición, admitiendo que las esporas germinen
durante el reposo, tornándose susceptibles al siguiente calentamiento,
comprobando que no existe total esterilización (19).
a.1.3 Autoclavado: Usa vapor de agua a 121ºC durante 15'a 20'. Esta temperatura
se logra obteniendo dos atmósferas absolutas, porque el aumento de la presión
provoca acrecimientos proporcionales en el punto de ebullición del agua, siendo el
mecanismo de destrucción microbiana más efectivo, bien utilizado asegura la
esterilización (19).
b. Calor seco: El calor seco (o desecación en general) produce un cambio en la
estructura de las proteínas, efectos tóxicos por elevados niveles de electrolitos
y lesiones por oxidación; la acción mortal del calor seco se genera por el
contacto de los microorganismos con el calor que producen los materiales y
no por el aire caliente que los envuelve; existen otras formas de esterilización
por calor seco como: incineración flambeado y mediante el horno Pasteur
(19).
Figura 14. Horno Pasteur (calor seco)
Fuente: Romero. 2007. Microbiología y Parasitología Humana (19).
37
b.1 Horno pasteur o poupinell: Es un contenedor metálico con doble pared
aislante y una puerta; la fuente de calor es eléctrica y tiene un ventilador que
facilita la circulación del aire caliente, para nivelar la temperatura y un
termómetro (con alcance mínimo de 200ºC). El calor seco generado por este
horno esteriliza materiales como: instrumentos quirúrgicos, vidrios, materiales
inyectables, objetos metálicos, aceites, vaselinas y polvos (19).
2.4. Medidas de bioseguridad en la práctica odontológica
En el accionar clínico odontológico se requiere de la aplicación de normas de
bioseguridad necesarias para evitar la propagación de microorganismos que
puedan originar enfermedad poniendo en riesgo la vida de los pacientes y
profesionales de esta rama. Por esa razón, a continuación, se presentan las
medidas de bioseguridad más importantes (33):
• Elaborar una historia clínica del paciente para la detección de posibles
enfermedades infecto - contagiosas.
• Utilizar guantes de manejo en cualquier procedimiento o tratamiento
odontológico, los cuales serán desechados inmediatamente; se utilizará un par
nuevo por cada paciente.
• Usar mascarillas de un material absorbente que permita neutralizar la
propagación de bacterias, verificando que la cavidad oral se encuentre
cubierta por completo.
• Utilizar gafas de protección tanto el profesional como el paciente.
• Usar batas y gorros descartables, la bata debe ser de manga larga y cuello
alto, en caso de utilizar uniforme de tela este deberá ser periódicamente
desinfectado.
• Las áreas que se destinan para colocar instrumentos y materiales de uso
clínico deberán estar protegidas con barreras para evitar un posible contacto
con fluidos salivales y sangre.
• El uso de sobreguantes es indispensable para evitar contaminaciones
cruzadas.
38
• El profesional odontólogo obligatoriamente deberá lavarse las manos en cada
intervalo de pacientes.
• El uso de materiales desechables es importante, estos deben ser almacenados
siguiendo protocolos y normas de asepsia.
• Es necesario lavar, desinfectar y esterilizar de forma constante y obligatoria
los instrumentos y materiales utilizados en la actividad odontológica (33).
39
CAPÍTULO III
3. METODOLOGÍA
3.1. Diseño de la investigación
Se trató de una investigación Experimental e In vitro.
• Experimental: Es experimental porque se van a utilizar tres grupos de 10
muestras, de los tres tipos de material del que están compuestos los
esponjeros endodónticos para realizar distintos ensayos experimentales,
llegando a determinar qué grupo es el que presenta un nivel alto de
contaminación.
• In vitro: Este proyecto es de tipo in vitro, porque se realizará fuera de un
ser vivo, en un laboratorio con un ambiente completamente controlado.
3.2. Población en estudio
La investigación se realizará en la Clínica Integral de la Facultad de Odontología
de la Universidad Central del Ecuador, tomando 10 muestras de los 3 tipos de
material (total 30) del que están compuestos los Esponjeros Endodónticos, las
mismas que serán divididas en tres grupos: Grupo A: n=9, muestras obtenidas de
Esponjeros de plástico común (polietileno) y 1 muestra control, Grupo B: n=9
muestras obtenidas de Esponjeros de plástico Autoclavable (polipropileno) y 1
muestra control; y un grupo C: n=9 muestras obtenidas de Esponjeros de
Aluminio y 1 muestra control.
3.3. Selección y tamaño de la muestra
La muestra es de tipo no probabilístico, por conveniencia en base a estudios
previos como el realizado por Saeed y Koller (2017) (32).
40
3.4. Criterios de inclusión y exclusión
3.4.1. Criterios de inclusión
• Esponjeros endodónticos de plástico común (polietileno).
• Esponjeros endodónticos de plástico autoclavable (polipropileno).
• Esponjeros endodónticos de aluminio.
• Esponjeros endodónticos de los alumnos de la clínica integral.
• Esponjeros endodónticos previo al uso clínico.
• Esponjeros endodónticos estériles o no estériles.
3.4.2. Criterios de exclusión
• Esponjeros Endodónticos deteriorados o rotos.
3.5. Conceptualización de variables
VARIABLE CONCEPTO
Dependiente
Nivel de contaminación de los
Esponjeros Endodónticos
Es un proceso provocado por una
inadecuada aplicación de protocolos de
desinfección y esterilización en los
materiales e instrumentos utilizados en la
práctica clínica odontológica (8).
Independiente
Esponjeros Endodónticos:
Plástico común
Plástico autoclavable
aluminio
Material auxiliar que se usa como un
pequeño organizador, útil para limpiar,
esterilizar o transferir instrumental del
asistente al odontólogo durante el proceso
de endodoncia; también para recoger de
modo ordenado limas, ensanchadores, etc.,
después de su uso (31).
41
3.6. Operacionalización de variables
VARIABLE DEFINICIÓN
OPERACIONAL
TIPO CLASIFICACIÓN INDICADOR
CATEGÓRICO
ESCALAS DE MEDICIÓN
Esponjero
endodóntico de
plástico común
Esponjero
endodóntico de
plástico
autoclavable.
Esponjero
endodóntico de
aluminio.
Esponjero
endodóntico de
plástico común,
plástico
autoclavable y
aluminio utilizado
en la fase de
instrumentación
manual en el
tratamiento
endodóntico.
Independiente
Cualitativa Esponjero endodóntico de
plástico común
Esponjero endodóntico de
plástico autoclavable.
Esponjero endodóntico de
aluminio.
Grupo estudio A
• Estéril A1
• No estéril A2
Grupo estudio B
• Estéril B1
• No estéril B2
Grupo estudio C
• Estéril C1
• No estéril C2
Nivel de
contaminación
El nivel de
contaminación
bacteriana que
presentan los
esponjeros
endodónticos
previa a la
actividad clínica
Dependiente Cualitativa Nominal
Cualitativa
Aerobios totales
Enterobacterias.
UFC
Identificación Bacteriana
Ausencia: 0
Presencia: 1
Ausencia: 0
Presencia: 1
0 sin crecimiento: 0
De 1 a 24 colonias, nivel bajo de contaminación: 1
De 25 a 250 colonias, nivel medio de contaminación:
2
De 251 a 560 colonias, nivel alto de contaminación:
3
> a 560 colonias, grupo MNPC nivel de
contaminación muy alto: 4
Nombres específicos identificados sistema vitek.
42
3.7. Estandarización
3.7.1. Prueba Piloto
Para determinar la metodología que se llevó a cabo en esta investigación se realizó
un estudio piloto dividido en 2 fases: la primera para establecer el medio de
transporte. Se utilizó medio de Stuart y el uso de medios de cultivo agar sangre y
agar chocolate, en los cuales no se obtuvo un resultado significativo, por esta
razón se evaluó otro medio de transporte con caldo de tioglicolato y medios de
cultivo agar sangre y agar Mac Conkey, obteniéndose resultados positivos por lo
que se escogió este medio. Posteriormente se tomaron muestras de esponjeros
endodónticos de alumnos de la clínica integral de la FOUCE distribuidos de la
siguiente manera: Grupo A: esponjeros de plástico autoclavable; Grupo B:
esponjeros de plástico común; Grupo C: esponjeros de aluminio; Grupo D:
esponjero muestra control.
3.7.1.1. Procedimiento
Se procedió a recolectar 7 muestras. Con la ayuda de un hisopo estéril se tomó la
muestra en la zona interna (fondo y paredes) de los esponjeros endodónticos, y se
transportó en tioglicolato, y se procedió a incubar por 24 horas. Luego se realizó
la siembra en agar sangre y agar Mac Conkey y se procedió a incubar por 48 horas
más, posteriormente se aisló los grupos bacterianos y se realizó la tinción gram,
una vez identificados los grupos Gram negativos y Gram positivos se procedió a
identificar los microorganismos mediante el Sistema Vitek compact 2® con
tarjetas vitek GP y vitek GN.
3.7.1.2. Resultados de la Prueba Piloto
De las 6 muestras obtenidas de esponjeros endodónticos que usan los estudiantes
en la clínica integral se evidencia contaminación en la totalidad de muestras, las
mismas se encontraban estériles y no estériles e identificamos grupos como:
43
Staphylococcus epidermidis, Enterobactercloacae, Escherichia coli,
Staphylococcus aureus. Por otro lado, el grupo control que recibió un protocolo de
desinfección y esterilización manejado con normas de bioseguridad no presentó
crecimiento bacteriano.
En base a la prueba piloto se estableció el método, las muestras fueron tomadas en
tres grupos: Grupo A:9 muestras obtenidas de esponjeros de plástico común
(polietileno) y 1 muestra control, Grupo B 9 muestras obtenidas de esponjeros de
plástico autoclavable (polipropileno)y 1 muestra control; Grupo C, 9 muestras
obtenidas de esponjeros de aluminio y 1 muestra control. Estos tres grupos de
muestras fueron analizados en el Laboratorio de Bacteriología del Hospital
Gineco-obstétrico Isidro Ayora.
La investigadora fue entrenada en los procedimientos durante una semana
mediante una capacitación teórico-práctica, se enseñó el proceso de obtención de
muestras, se supervisó el progreso y aprobó los resultados, asegurando muestras y
resultados confiables.
Los equipos e instrumentos de laboratorio que fueron utilizados en el proceso de
almacenamiento, siembra y cultivo de las muestras, disponen de la revisión y
calibración anual obligatoria, lo que asegura un resultado fiable del estudio.
3.8. Materiales y Métodos
3.8.1. Método de recolección de datos
Para la elaboración del proyecto se realizó solicitudes dirigidas a la Dra. Alexie
Izquierdo (ANEXO R), docente de pregrado de la Facultad de Odontología de la
Universidad Central del Ecuador, para aceptar la dirección del proyecto de
investigación.
44
Luego se generó la solicitud para la aprobación del uso del laboratorio de
microbiología del Hospital Gineco-obstétrico Isidro Ayora a la Lic. Karla
Landívar, responsable del Área de microbiología. (ANEXO C)
Además, se realizó la solicitud para la autorización del ingreso a las clínicas de los
tres niveles de la Facultad de Odontología de la Universidad Central del Ecuador,
la cual está dirigida a la Dra. Dona Marina, coordinadora de esta entidad.
(ANEXO E)
Las muestras se procesaron en el laboratorio del Hospital Gineco-obstétrico Isidro
Ayora y se recopilaron los resultados en la hoja de recolección de datos. (ANEXO
G)
3.8.2. Equipos, instrumentos, materiales y sustancias
Equipos
• Incubadora
• Microscopio
• VITEK 2® compact
• Estufa
• DensiCHEK Plus VITEK
• Vortex
Instrumentos
• Asa de inoculación
• Pinza anatómica
• Mechero
45
Materiales
• Esponjeros Endodónticos de aluminio, plástico común y plástico
autoclavable
• Placas petrifilm aerobios totales y coliformes
• Tarjetas VITEK GP y GN
• Tubos de ensayo estériles
• Hisopos estériles
• Gradilla
• Cajas petri (agar sangre y gar Mac Conkey)
• Toallas de papel
• Placas portaobjetos
• Bioseguridad: guantes, gorro, mascarilla, gafas y mandil.
• Jeringuillas 5ml
• Caja isotérmica con gel frío
Sustancias
• Tioglicolato
• Cristal violeta
• Safranina
• Lugol
• Alcohol cetona
• Aceite de inmersión
3.9. Procedimientos y técnicas
3.9.1. Obtención de muestras
Para la recolección de muestras fue necesario usar todo el equipo de protección
que consta de: mascarilla, gorro, gafas, mandil y guantes estériles para prevenir la
contaminación de la muestra y del operador.
46
Las muestras fueron obtenidas de los esponjeros endodónticos (fondo y paredes
internas) que usan los estudiantes en la clínica integral de la Facultad de
Odontología de la Universidad Central del Ecuador; se recogieron tres grupos de
muestras: Grupo A:9 muestras obtenidas de esponjeros de plástico común y una
muestra control; Grupo B: 9 muestras obtenidas de esponjeros de plástico
Autoclavable y una muestra control; y un grupo C: 9 muestras obtenidas de
esponjeros de aluminio y una muestra control; estas muestras se tomaron previo
al uso clínico, antes de la colocación de cualquier tipo de sustancia química
(hipoclorito de sodio al 2.5% o clorhexidina) y al instante que el estudiante
colocó el esponjero endodóntico en su mesa de trabajo.
Para la recolección de las muestras se utilizó hisopo estéril y las muestras fueron
puestas en tubos de ensayo que contenían 3 ml de caldo de tioglicolato como
medio de trasporte, los cuales fueron sellados y rotulados.
A B C D
Figura 15. Toma de muestras. A) Esponjero plástico común, B) Esponjero plástico
autoclavable, C) Esponjero de aluminio. D) muestras con su respectiva etiqueta
Fuente y elaboración: Autora
3.9.2. Transporte de muestras
Concluida la recolección de muestras, se comprobó que todos los tubos de ensayo
se encuentren sellados, se los colocó en gradillas y se los guardó en un contenedor
de plástico herméticamente cerrado, a una temperatura de 7ºC. Posteriormente se
47
procedió a traspórtalo al laboratorio de microbiología del Hospital Gineco-
Obstétrico Isidro Ayora.
Figura 16. Muestras etiquetadas y selladas en el contenedor isotérmico para realizar el
transporte
Fuente y elaboración: Autora
3.9.3. Cultivo
Una vez que las muestras ingresaron al laboratorio; fueron llevadas a la estufa
para la incubación en su mismo caldo de enriquecimiento por 24 horas a 36°C
para la determinación de turbidez formada.
Figura 17. Muestras con caldo de enriquecimiento en incubación 24 horas
Fuente y elaboración: Autora
48
A
3.9.4. Siembra
Con la turbidez formada en la muestra después de 24 horas, se tomó 1 ml para
colocar en las placas petrifilm aerobios totales y 1 ml para las placas petrifilm
coliformes y se procedió a incubar en la estufa por 48 horas a 36°C.
Figura 18. Preparación placas petrifilm. A)Placas petrifilm aerobios totales y coliformes, B-
C) Toma de 2ml para colocar en las placas, D-E) Colocación de 1 ml en cada placa
respectivamente, F) delimitación de la muestra, G) Placas listas para incubar
Fuente y elaboración: Autora
B C
D E F
G
49
Posteriormente se realizó la siembra en cajas petri con Agar Sangre y cajas petri
con agar Mac Conkey, se hizo la descarga inicial con hisopos estériles de cada
cultivo, acto seguido se realizó una siembra por estría cruzada y se incubó por 48
horas a 36ºC.
A B
C
D E F
G H I
Figura 19. Siembra de Agar. A) Tubos con caldo de cultivo, B) agar sangre y agar Mac
Conkey, C) agares identificados, D) descarga inicial con hisopo, E) esterilización del asa, F)
siembra por estría cruzada, G) siembra realizada H) agares listos para incubación I) agares
sangre en campana- estufa y agares Mac Conkey en estufa para incubación 48 horas
Fuente y elaboración: Autora
50
A las 48 horas posteriores se procedió a observar la existencia o no de crecimiento
de microorganismos en los agares.
A
B
Figura 20. A) Agar sangre con crecimiento de microorganismos B) Agar Mac Conkey con
crecimiento de Microorganismos
Fuente y elaboración: Autora
3.9.5. Identificación de microorganismos
3.9.5.1. Tinción Gram
Se usó hisopos estériles para tomar la muestra, luego se procedió a colocar en
forma de V sobre el portaobjetos una porción de la misma, se fijó con el mechero
de Bunsen y se procedió a colorear, a un tiempo de 20 segundos con cristal
violeta, 20 segundos con lugol, 10 segundos con alcohol cetona y finalmente 20
segundos con safranina, luego dejamos secar sobre una toalla de papel al
ambiente.
52
Observamos en el microscopio con lente de 100X (aceite de inmersión), las placas
preparadas con la tinción Gram para la diferenciación de gram positivos y gram
negativos.
Figura 22. Observación de Gram positivos y Gram negativos
Fuente y elaboración: Autora
3.9.5.2. Vitek Compact 2®
Una vez identificadas las bacterias Gram positivas y gram negativas, tomamos
una muestra con hisopo estéril de cada cultivo en el que hubo crecimiento,
colocamos en el tubo de ensayo y realizamos la disolución de Mc Farland hasta
llegar a 0,5; posteriormente colocamos los tubos y las tarjetas Vitek GP (Gram
Positivos) y Vitek GN (Gram Negativos) en la porta placas e ingresamos al
equipo de 8 a 10 horas.
53
1
2
3
4
5
6
7
Figura 23. Proceso de identificación Sistema Vitek Compact 2
Fuente y elaboración: Autora
54
3.9.6. Observación de los resultados
A las 48 horas posteriores se realizó el conteo de colonias en las placas petrifilm
de aerobios totales y de coliformes.
1 2
Figura 24. 1) Placas petrifilm aerobios totales con presencia de colonias, 2) Placas petrifilm
coliformes con presencia de colonias
Fuente y elaboración: Autora
Finalmente se revisó los resultados digitales, que fueron proporcionados por el
sistema Vitek® compact 2 y todos estos resultados se registraron en la hoja de
recolección conlas características que presentaron para su identificación.(ANEXO
G)
1 2
Figura 25. 1) Sistema Vitek Compact 2, 2) tarjeta vitek después de la identificación
Fuente y elaboración: Autora
55
3.9.7. Eliminación de desechos
Al concluir el proceso de identificación bacteriana en el laboratorio de
microbiología del Hospital Gineco Obstétrico Isidro Ayora, se procedió a la
eliminación de desechos generados durante la investigación. Las cajas Petri se
eliminaron en una funda plástica de desechos color rojo que corresponde a
desechos infecciosos, los tubos de ensayo con el caldo de cultivo sobrante se
eliminaron en un recipiente de objetos cortopunzantes, para su eliminación como
desechos cortopunzantes y finalmente las tarjetas Vitek se eliminaron en un cartón
con funda amarilla rotulado como desechos especiales. (ANEXO H)
Figura 26. Área de desechos
Fuente y elaboración: Autora
56
3.10. Resultados de las pruebas de laboratorio.
CÓ
DIG
O D
E M
UE
ST
RA
S
ESPONJERO
ENDODÓNTI
CO ESTÉRIL /
NO ESTÉRIL
NIVEL DE
CONTAMINACIÓN
GRUPO A
PLÁSTICO
COMÚN
UFC
GENERA
L
UFC
ESTÉRI
L
UFC
NO
ESTÉRIL
AEROBI
OS
TOTALES
GENERA
L
AEROBI
OS
TOTALES
ESTÉRIL
AEROBI
OS
TOTALES NO
ESTÉRIL
ENTEROBACTERI
AS GENERAL
ENTEROBACTERI
AS ESTÉRIL
ENTEROBACTERI
AS NO ESTÉRIL
IDENTIFICACIÓN BACTERIANA VITEK
COMPACT 2
1 A2 2 1 1 1 1 1 Enterobactercloacaedissol
vens
2 A1 0 0 0 0 0 0 Ninguno
3 A2 3 3 1 1 0 0 Aerococcus viridans
4 A2 2 2 1 1 0 0 Staphylococcus aureus
5 A1 2 2 1 1 0 0 Bacilos ambientales
6 A2 4 4 1 1 0 0 Bacilos ambientales
7 A2 1 1 1 1 1 1 Escherichia Coli
8 A1 1 1 1 1 1 1 Neisseria spp.
9 A1 0 0 0 0 0 0 Ninguno
contr
ol
A1 0 0 0 0 0 0 Ninguno
57
CÓ
DIG
O D
E M
UE
ST
RA
S
ESPONJERO
ENDODÓNTIC
O ESTÉRIL /
NO ESTÉRIL
NIVEL DE
CONTAMINACIÓN
GRUPO
B
PLÁSTICO
AUTOCLAVABLE
UFC
GENERA
L
UFC
ESTÉRI
L
UFC
NO
ESTÉRIL
AEROBIO
S
TOTALES GENERA
L
AEROBIO
S
TOTALES ESTÉRIL
AEROBIO
S
TOTALES NO
ESTÉRIL
ENTEROBACTERI
AS GENERAL
ENTEROBACTERI
AS ESTÉRIL
ENTEROBACTERI
AS NO ESTÉRIL
IDENTIFICACIÓ
N
BACTERIANA
VITEK COMPACT 2
1 B1 0 0 0 0 0 0 Ninguno
2 B2 2 2 1 1 0 0 Staphylococcus
hominis
3 B2 0 0 0 0 0 0 Ninguno
4 B2 2 2 1 1 0 0 Staphylococcus
epidermidis
5 B1 0 0 0 0 0 0 Ninguno
6 B2 0 0 0 0 0 0 Ninguno
7 B1 0 0 0 0 0 0 Ninguno
8 B1 0 0 0 0 0 0 Ninguno
9 B2 1 1 1 1 0 0 Staphylococcus epidermidis
contro
l
B1 0 0 0 0 0 0 Ninguno
58
CÓ
DIG
O D
E
MU
ES
TR
AS
ESPONJERO
ENDODÓNTI
CO ESTÉRIL /
NO ESTÉRIL
NIVEL DE
CONTAMINACIÓN
GRUPO C
ALUMINIO
UFC
GENER
AL
UFC
ESTÉRI
L
UFC
NO
ESTÉRIL
AEROBI
OS
TOTALES
GENERA
L
AEROBI
OS
TOTALES
ESTÉRIL
AEROBI
OS
TOTALES NO
ESTÉRIL
ENTEROBACTER
IAS GENERAL
ENTEROBACTER
IAS ESTÉRIL
ENTEROBACTER
IAS NO ESTÉRIL
IDENTIFICACIÓN BACTERIANA VITEK
COMPACT 2
1 C1 2 2 1 1 0 0 Staphylococcus
epidermidis
2 C2 3 3 1 1 0 0 Staphylococcus
epidermidis
3 C2 4 4 1 1 1 1 Sphingomonapaucimo
bilis
4 C1 0 0 0 0 0 0 Ninguno
5 C2 4 4 1 1 0 0 Bacilos ambientales
6 C2 3 3 1 1 1 1 Pantoea Agglomerans
7 C1 2 2 1 1 0 0 Staphylococcus
epidermidis
8 C2 1 1 1 1 0 0 Bacilos ambientales
9 C1 0 0 0 0 0 0 Ninguno contr
ol C1 0 0 0 0 0 0 Ninguno
59
SIGNIFICADO DE DATOS
Esponjero endodóntico de plástico común
Esponjero endodóntico de plástico autoclavable.
Esponjero endodóntico de aluminio.
Grupo estudio A
• Estéril A1
• No estéril A2
Grupo estudio B
• Estéril B1
• No estéril B2
Grupo estudio C
• Estéril C1
• No estéril C2
Aerobios totales
Enterobacterias.
UFC
Presencia Bacteriana
Ausencia : 0
Presencia : 1
Ausencia: 0
Presencia :1
0 sin crecimiento: 0
De 1 a 24 colonias, nivel bajo de contaminación: 1
De 25 a 250 colonias, nivel medio de contaminación: 2
De 251 a 560 colonias, nivel alto de contaminación :3
> a 560 colonias, grupo MNPC nivel de contaminación muy alto :4
Identificación de bacterias (nombres específicos) Sistema Vitek Compact 2
60
3.11. Aspectos bioéticos
Este estudio se realizará sobre los esponjeros endodónticos que usan los
estudiantes de la clínica integral de la Facultad de Odontología de la Universidad
Central del Ecuador para determinar el nivel de contaminación bacteriana. (Anexo
E)
3.11.1. Beneficencia
Con el presente estudio se identificará el nivel de carga bacteriana en cada
material del que está compuesto el esponjero endodóntico y se recomendará el que
presente menor riesgo de contaminación para el uso clínico.
3.11.2. Confidencialidad
Durante la recolección de muestras se utilizará tubos que contienen tioglicolato
identificados con códigos numéricos respectivamente lo cual garantiza la
confidencialidad de la muestra en el estudio. (Anexo G)
3.11.3. Riesgos potenciales de la Investigación
No existe riesgos y el manejo de las muestras se realizará bajo el protocolo de
bioseguridad y manejo de desechos del laboratorio de microbiología del Hospital
Gineco Obstétrico Isidro Ayora (Anexo H), que se basa en el establecido por el
Ministerio de Salud Pública del Ecuador.
3.11.4. Beneficios potenciales de la Investigación
3.11.4.1. Directos
Los beneficios que nos proporciona el estudio es dar a conocer información de
importancia a los estudiantes y personal docente, para que a través de resultados
61
científicos se conozca la presencia de bacterias en los esponjeros endodónticos
manipulados por los profesionales en la práctica clínica previo al uso en el
paciente, y tomar las medidas necesarias para evitar contaminaciones cruzadas.
3.11.4.2. Indirectos
Los pacientes contarán con elementos clínicos debidamente desinfectados y
esterilizados, lo cual evitará infecciones cruzadas.
3.11.5. Idoneidad ética y experticia del estudio
Declaración de Idoneidad ética y experticia (Anexo I- J)
3.11.6. Conflicto de interés
Declaración de conflictos de interés. (Anexo L- M)
62
CAPÍTULO IV
4. ANÁLISIS E INTERPRETACIÓN DE RESULTADOS
4.1. Técnicas para procesamiento y análisis estadísticos de datos
Para la determinación del nivel de contaminación bacteriana de los esponjeros de
aluminio, plástico común y plástico autoclavable, realizó la identificación de
bacterias mediante el sistema vitek compact 2® y el conteo de colonias mediante
UFC (unidades formadoras de colonias) en 10 muestras por grupo de las cuales 27
fueron tomadas de los esponjeros que usan los estudiantes en la clínica integral de
la FOUCE y 3 muestras control. Estos resultados se organizaron en una base de
datos en el programa SPSS 22, gracias al cual se procedió al cálculo de valores
estadísticos descriptivos e inferenciales con el fin de comprobar la hipótesis
planteada en esta investigación.
Tablas cruzadas para análisis de contaminación bacteriana.
Para el análisis de UFC se establecen 5 categorías:
UFC SIGNIFICADO VALOR
0 Sin crecimiento 1
1-24 Crecimiento Bajo 2
25-250 Crecimiento Medio 3
251-560 Crecimiento Alto 4
>560 Crecimiento Muy alto 5
Tabla 2. Cruce de variables UFC*muestras (total)
MUESTRAS
UFC GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
sin crecimiento 2 22,2% 6 66,7% 2 22,2% 10 37,0%
nivel bajo de contaminación 2 22,2% 1 11,1% 1 11,1% 4 14,8%
nivel medio de contaminación 3 33,3% 2 22,2% 2 22,2% 7 25,9%
nivel alto de contaminación 1 11,1% 0 0,0% 2 22,2% 3 11,1%
nivel de contaminación muy
alto 1 11,1% 0 0,0% 2 22,2% 3 11,1%
Total 9 100,0% 9 100,0% 9 100,0% 27 100,0%
Elaborado por: Ing. Jaime Molina
63
Tabla 3. Prueba de chi-cuadrado del Cruce de variables UFC*muestras (total) Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 7,986 8 0,435
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,435) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a el nivel de UFC.
(POCOS DATOS)
Tabla 4. Índice de Shannon-Wiener
Índice de Shannon-Wiener
ESTÉRILES + NO ESTÉRILES A B C
Tamanho da Amostra 9 9 9
Número de Categorias 5 5 5
Índice de Shannon-Wiener 0.6614 0.3686 0.6867
Máxima diversidade 0.699 0.699 0.699
Homogeneidade 0.9463 0.5273 0.9824
Heterogeneidade 0.0537 0.4727 0.0176
En el análisis de esponjeros endodónticos estériles y no estériles se encontró que
todos los grupos presentaron UFC. No existió diferencia significativa según el
análisis estadístico.
Gráfico 1. Cruce de variables UFC*muestras (total)
22
.2%
66
.7%
22
.2%
22
.2%
11
.1%
11
.1%
33
.3%
22
.2%
22
.2%
11
.1%
0.0
%
22
.2%
11
.1%
0.0
%
22
.2%
GRUPO A GRUPO B GRUPO C
UFC * MUESTRASsin crecimiento nivel bajo de contaminación
64
GRUPO A: el 22,2% de las muestras esta sin crecimiento, el 22,2% están con
nivel bajo de contaminación, el 33,3% están con nivel medio de contaminación, el
11,1% están con nivel alto de contaminación y el 11,1% están con nivel de
contaminación muy alto.
GRUPO B: el 66,7% de las muestras esta sin crecimiento, el 11,1% están con
nivel bajo de contaminación, el 22,2% están con nivel medio de contaminación, el
0,0% están con nivel alto de contaminación y el 0,0% están con nivel de
contaminación muy alto.
GRUPO C: el 22,2% de las muestras esta sin crecimiento, el 11,1% están con
nivel bajo de contaminación, el 22,2% están con nivel medio de contaminación, el
22,2% están con nivel alto de contaminación y el 22,2% están con nivel de
contaminación muy alto
El grupo B presenta los mayores porcentajes de muestras sin crecimiento.
Tabla 5. Cruce de variables UFC*muestras esponjero endodóntico estéril
MUESTRAS
UFC GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
sin crecimiento 2 50,0% 4 100,0% 2 50,0% 8 66,7%
nivel bajo de contaminación 1 25,0% 0 0,0% 0 0,0% 1 8,3%
nivel medio de
contaminación 1 25,0% 0 0,0% 2 50,0% 3 25,0%
Total 4 100,0% 4 100,0% 4 100,0% 12 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 6. Prueba de chi-cuadrado de variables UFC*muestras esponjero endodóntico estéril
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 5,000 4 0,287
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,287) es superior a 0,05 (95% de confiabilidad), luego los
65
porcentajes entre los grupos son similares con relación a el nivel de UFC en los
estériles. (POCOS DATOS)
Índice de Shannon-Wiener
Estériles A B C
Tamanho da Amostra 4 4 4
Número de Categorias 5 5 5
Índice de Shannon-Wiener 0.4515 0 0.301
Máxima diversidade 0.699 0.699 0.699
Homogeneidade 0.646 0 0.4307
Heterogeneidade 0.354 1 0.5693
Gráfico 2. Cruce de variables UFC*muestras esponjero endodóntico estéril
GRUPO A: el 50,0% de las muestras esta sin crecimiento, el 25,0% están con
nivel bajo de contaminación y el 25,0% están con nivel medio de contaminación.
GRUPO B: el 100,0% de las muestras esta sin crecimiento, el 0,0% están con
nivel bajo de contaminación y el 0,0% están con nivel medio de contaminación.
GRUPO C: el 50,0% de las muestras esta sin crecimiento, el 0,0% están con
nivel bajo de contaminación y el 50,0% están con nivel medio de contaminación.
El grupo B presenta los mayores porcentajes de muestras sin crecimiento.
50.0%
100.0%
50.0%
25.0%
0.0% 0.0%
25.0%
0.0%
50.0%
GRUPO A GRUPO B GRUPO C
ESTERIL: UFC * MUESTRAS
sin crecimiento nivel bajo de contaminación
nivel medio de contaminación
66
Tabla 7. Cruce de variables UFC*esponjero endodóntico no estéril
MUESTRAS
UFC GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
sin crecimiento 0 0,0% 2 22,2% 0 0,0% 2 7,4%
nivel bajo de contaminación 1 11,1% 1 11,1% 1 11,1% 3 11,1%
nivel medio de contaminación 2 22,2% 2 22,2% 0 0,0% 4 14,8%
nivel alto de contaminación 1 11,1% 0 0,0% 2 22,2% 3 11,1%
nivel de contaminación muy
alto 1 11,1% 0 0,0% 2 22,2% 3 11,1%
Total 5 55,6% 5 55,6% 5 55,6% 15 55,6%
Elaborado por: Ing. Jaime Molina
Tabla 8. Prueba de chi-cuadrado de variables UFC*esponjero endodóntico no estéril
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 10,000 8 0,265
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,265) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a el nivel de UFC en los
NO estériles. (POCOS DATOS)
Índice de Shannon-Wiener
NO ESTERIL A B C
Tamanho da Amostra 5 5 5
Número de Categorias 5 5 5
Índice de Shannon-Wiener 0.5786 0.4581 0.4581
Máxima diversidade 0.699 0.699 0.699
Homogeneidade 0.8277 0.6555 0.6555
Heterogeneidade 0.1723 0.3445 0.3445
En el análisis de esponjeros no esterilizados se encontró que todos los grupos
presentaron UFC. No existió diferencia significativa según el análisis estadístico.
Sin embargo, en el grupo B fue el único que dio resultados negativos (22,2%) en
el grupo sin crecimiento (0).
67
Gráfico 3. Cruce de variables UFC*esponjero endodóntico no estéril
GRUPO A: el 0,0% de las muestras esta sin crecimiento, el 11,1% están con
nivel bajo de contaminación, el 22,2% están con nivel medio de contaminación, el
11,1% están con nivel alto de contaminación y el 11,1% están con nivel de
contaminación muy alto.
GRUPO B: el 22,2% de las muestras esta sin crecimiento, el 11,1% están con
nivel bajo de contaminación, el 22,2% están con nivel medio de contaminación, el
0,0% están con nivel alto de contaminación y el 0,0% están con nivel de
contaminación muy alto.
GRUPO C: el 0,0% de las muestras esta sin crecimiento, el 11,1% están con
nivel bajo de contaminación, el 0,0% están con nivel medio de contaminación, el
22,2% están con nivel alto de contaminación y el 22,2% están con nivel de
contaminación muy alto.
El grupo B presenta los mayores porcentajes de muestras sin crecimiento.
0.0%
22.2%
0.0%
11.1% 11.1% 11.1%
22.2% 22.2%
0.0%
11.1%
0.0%
22.2%
11.1%
0.0%
22.2%
GRUPO A GRUPO B GRUPO C
NO ESTERIL: UFC * MUESTRAS
sin crecimiento nivel bajo de contaminación
nivel medio de contaminación nivel alto de contaminación
nivel de contaminación muy alto
68
Tabla 9. Cruce de variables aerobios totales *muestras (total)
MUESTRAS
AEROBIOS TOTALES GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
ausencia 2 22,2% 6 66,7% 2 22,2% 10 37,0%
presencia 7 77,8% 3 33,3% 7 77,8% 17 63,0%
Total 9 100,0% 9 100,0% 9 100,0% 27 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 10. Prueba de chi-cuadrado de variables aerobios totales *muestras (total)
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 5,082 2 0,079
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,079) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a la ausencia o presencia
de aerobios totales. (POCOS DATOS)
Gráfico 4. Cruce de variables aerobios totales *muestras (total)
GRUPO A: el 22,2% de las muestras tiene ausencia y el 77,8% tiene presencia
GRUPO B: el 66,7% de las muestras tiene ausencia y el 33,3% tiene presencia
GRUPO C: el 22,2% de las muestras tiene ausencia y el 77,8% tiene presencia
El grupo B presenta los mayores porcentajes de muestras con ausencia.
22.2%
66.7%
22.2%
77.8%
33.3%
77.8%
GRUPO A GRUPO B GRUPO C
AEROBIOS TOTALES * MUESTRAS
ausencia presencia
69
Tabla 11. Cruce de variables aerobios totales *muestras esponjero endodóntico Estéril
MUESTRAS
AEROBIOS TOTALES GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
ausencia 2 50,0% 4 100,0% 2 50,0% 8 66,7%
presencia 2 50,0% 0 0,0% 2 50,0% 4 33,3%
Total 4 100,0% 4 100,0% 4 100,0% 12 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 12. Prueba de chi cuadrado de variables aerobios totales *muestras esponjero
endodóntico Estéril
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 3,000 2 0,223
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,223) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a la ausencia o presencia
de aerobios totales en los estériles. (POCOS DATOS)
Gráfico 5. Cruce de variables aerobios totales *muestras esponjero endodóntico Estéril
GRUPO A: el 50,0% de las muestras tiene ausencia y el 50,0% tiene presencia.
GRUPO B: el 100,0% de las muestras tiene ausencia y el 0,0% tiene presencia.
50.0%
100.0%
50.0%50.0%
0.0%
50.0%
GRUPO A GRUPO B GRUPO C
ESTERIL: AEROBIOS TOTALES *
MUESTRAS
ausencia presencia
70
GRUPO C: el 50,0% de las muestras tiene ausencia y el 50,0% tiene presencia.
El grupo B presenta los mayores porcentajes de muestras con ausencia, GRUPO
A y el GRUPO C son muy similares.
Tabla 13. Cruce de variables aerobios totales *muestras esponjero endodóntico no estéril
MUESTRAS
AEROBIOS TOTALES GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
ausencia 0 0,0% 2 40,0% 0 0,0% 2 13,3%
presencia 5 100,0% 3 60,0% 5 100,0% 13 86,7%
Total 5 100,0% 5 100,0% 5 100,0% 15 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 14. Prueba de chi-cuadrado de variables aerobios totales *muestras esponjero
endodóntico no estéril
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 4,615 2 0,099
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,099) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a la ausencia o presencia
de aerobios totales en los NO estériles. (POCOS DATOS)
Gráfico 6. Cruce de variables aerobios totales *muestras esponjero endodóntico no estéril
0.0%
40.0%
0.0%
100.0%
60.0%
100.0%
GRUPO A GRUPO B GRUPO C
NO ESTERIL: AEROBIOS TOTALES *
MUESTRAS
ausencia presencia
71
GRUPO A: el 0,0% de las muestras tiene ausencia y el 100,0% tiene presencia.
GRUPO B: el 40,0% de las muestras tiene ausencia y el 6,0% tiene presencia.
GRUPO C: el 0,0% de las muestras tiene ausencia y el 100,0% tiene presencia.
El grupo B presenta los mayores porcentajes de muestras con ausencia, GRUPO
A y el GRUPO C son muy similares.
Tabla 15. Cruce de variables enterobacterias * muestras (total)
MUESTRAS
ENTEROBACTERIAS GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
ausencia 6 66,7% 9 100,0% 7 77,8% 22 81,5%
presencia 3 33,3% 0 0,0% 2 22,2% 5 18,5%
Total 9 100,0% 9 100,0% 9 100,0% 27 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 16. Prueba de chi-cudrado de variables enterobacterias * muestras (total)
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 3,436 2 0,179
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,179) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a la ausencia o presencia
de ENTEROBACTERIAS. (POCOS DATOS)
Gráfico 7. Cruce de variables enterobacterias * muestras (total)
72
GRUPO A: el 66,7% de las muestras tiene ausencia y el 33,3% tiene presencia.
GRUPO B: el 100,0% de las muestras tiene ausencia y el 0,0% tiene presencia.
GRUPO C: el 77,8% de las muestras tiene ausencia y el 22,2% tiene presencia.
El grupo B presenta mayores porcentajes de ausencia.
Tabla 17. Cruce de variables enterobacterias * muestras esponjero endodóntico estéril
MUESTRAS
ENTEROBACTERIAS GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
ausencia 3 75,0% 4 100,0% 4 100,0% 11 91,7%
presencia 1 25,0% 0 0,0% 0 0,0% 1 8,3%
Total 4 100,0% 4 100,0% 4 100,0% 12 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 18. Prueba de chi-cuadrado de variables enterobacterias * muestras esponjero
endodóntico estéril
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 2,182 2 0,336
Elaborado por: Ing. Jaime Molina
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,336) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a la ausencia o presencia
de ENTEROBACTERIAS en los estériles. (POCOS DATOS)
66.7%
100.0%
77.8%
33.3%
0.0%
22.2%
GRUPO A GRUPO B GRUPO C
ENTEROBACTERIAS * MUESTRAS
ausencia presencia
73
Gráfico 8. Cruce de variables enterobacterias * muestras esponjero endodóntico estéril
GRUPO A: el 75,0% de las muestras tiene ausencia y el 25,0% tiene presencia.
GRUPO B: el 100,0% de las muestras tiene ausencia y el 0,0% tiene presencia.
GRUPO C: el 100,0% de las muestras tiene ausencia y el 0,0% tiene presencia.
El GRUPO B y el GRUPO C presentan los mayores porcentajes de muestras con
ausencia.
Tabla 19. Cruce de variables enterobacterias * muestras esponjero endodóntico no estéril
MUESTRAS
ENTEROBACTERIAS GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
ausencia 3 60,0% 5 100,0% 3 60,0% 11 73,3%
presencia 2 40,0% 0 0,0% 2 40,0% 4 26,7%
Total 5 100,0% 5 100,0% 5 100,0% 15 100,0%
Elaborado por: Ing. Jaime Molina
Tabla 20. Prueba de chi-cuadrado de variables enterobacterias * muestras esponjero
endodóntico no estéril
Pruebas de chi-cuadrado
Valor gl Sig. asintótica (2 caras)
Chi-cuadrado de Pearson 2,727 2 0,256
Elaborado por: Ing. Jaime Molina
75.0%
100.0% 100.0%
25.0%
0.0% 0.0%
GRUPO A GRUPO B GRUPO C
ESTERIL: ENTEROBACTERIAS *
MUESTRAS
ausencia presencia
74
Prueba Chi cuadrado de Pearson, el valor del nivel de significación (Sig.
asintótica (2 caras) = 0,256) es superior a 0,05 (95% de confiabilidad), luego los
porcentajes entre los grupos son similares con relación a la ausencia o presencia
de ENTEROBACTERIAS en los NO estériles. (POCOS DATOS)
Gráfico 9. Cruce de variables enterobacterias * muestras esponjero endodóntico no estéril
GRUPO A: el 60,0% de las muestras tiene ausencia y el 40,0% tiene presencia.
GRUPO B: el 100,0% de las muestras tiene ausencia y el 0,0% tiene presencia.
GRUPO C: el 60,0% de las muestras tiene ausencia y el 40,0% tiene presencia.
El GRUPO A y el GRUPO C presentan los mayores porcentajes de muestras con
presencia, el grupo B tiene los mayores porcentajes de ausencia.
Tabla 21. Cruce de variables identificación bacteriana vitek compact® 2 * muestras (total)
MUESTRAS IDENTIFICACIÓN
BACTERIANA VITEK
COMPACT 2
GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
Aerococcus viridans 1 11,1% 0 0,0% 0 0,0% 1 3,7%
Bacilos ambientales 2 22,2% 0 0,0% 2 22,2% 4 14,8%
Enterobactercloacaedissolvens 1 11,1% 0 0,0% 0 0,0% 1 3,7%
Escherichia Coli 1 11,1% 0 0,0% 0 0,0% 1 3,7%
Neisseria spp. 1 11,1% 0 0,0% 0 0,0% 1 3,7%
Ninguno 2 22,2% 6 66,7% 2 22,2% 10 37,0%
60.0%
100.0%
60.0%
40.0%
0.0%
40.0%
GRUPO A GRUPO B GRUPO C
NO ESTERIL: ENTEROBACTERIAS *
MUESTRAS
ausencia presencia
75
PantoeaAgglomerans 0 0,0% 0 0,0% 1 11,1% 1 3,7%
Sphingomonapaucimobilis 0 0,0% 0 0,0% 1 11,1% 1 3,7%
Staphylococcus aureus 1 11,1% 0 0,0% 0 0,0% 1 3,7%
Staphylococcus epidermidis 0 0,0% 2 22,2% 3 33,3% 5 18,5%
Staphylococcus hominis 0 0,0% 1 11,1% 0 0,0% 1 3,7%
Total 9 100,0% 9 100,0% 9 100,0% 27 100,0%
Elaborado por: Ing. Jaime Molina
Gráfico 10. Cruce de variables identificación bacteriana vitek compact® 2 * muestras (total)
GRUPO A: el 11,1% de las muestras tienen Aerococcus viridans, el 22,2% tienen
Bacilos ambientales, el 11,1% tienen Enterobactercloacaedissolvens, el 11,1%
tienen Escherichia Coli, el 11,1% tienen Neisserias pp., el 22,2% no tienen
Ninguno, el 0,0% tienen Pantoea Agglomerans, el 0,0% tienen
Sphingomonapaucimobilis, el 11,1% tienen Staphylococcus aureus, el 0,0%
tienen Staphylococcus epidermidis y el 0,0% tienen Staphylococcus hominis.
GRUPO B: el 0,0% de las muestras tienen Aerococcus viridans, el 0,0% tienen
Bacilos ambientales, el 0,0% tienen Enterobactercloacaedissolvens, el 0,0%
tienen Escherichia Coli, el 0,0% tienen Neisseria spp., el 66,7% no tienen
Ninguno, el 0,0% tienen Pantoea Agglomerans, el 0,0% tienen
11
.1%
0.0
%
0.0
%
22
.2%
0.0
%
22
.2%
11
.1%
0.0
%
0.0
%
11
.1%
0.0
%
0.0
%
11
.1%
0.0
%
0.0
%
22
.2%
66
.7%
22
.2%
0.0
%
0.0
%
11
.1%
0.0
%
0.0
%
11
.1%
11
.1%
0.0
%
0.0
%
0.0
%
22
.2% 3
3.3
%
0.0
%
11
.1%
0.0
%GRUPO A GRUPO B GRUPO C
IDENTIFICACIÓN BACTERIANA VITEK
COMPACT 2 * MUESTRAS
Aerococcus viridans Bacilos ambientalesEnterobacter cloacae dissolvens Escherichia ColiNeisseria spp. NingunoPantoea Agglomerans Sphingomona paucimobilisStaphylococcus aureus Staphylococcus epidermidisStaphylococcus hominis
76
Sphingomonapaucimobilis, el 0,0% tienen Staphylococcus aureus, el 22,2%
tienen Staphylococcus epidermidis y el 11,1% tienen Staphylococcus hominis.
GRUPO C: el 0,0% de las muestras tienen Aerococcus viridans, el 22,2% tienen
Bacilos ambientales, el 0,0% tienen Enterobactercloacaedissolvens, el 0,0%
tienen Escherichia Coli, el 0,0% tienen Neisserias pp., el 22,2% no tienen
Ninguno, el 11,1% tienen PantoeaAgglomerans, el 11,1% tienen
Sphingomonapaucimobilis, el 0,0% tienen Staphylococcus aureus, el 33,3%
tienen Staphylococcus epidermidis y el 0,0% tienen Staphylococcus hominis.
Tabla 22. Cruce de variables identificación bacteriana vitek compact® 2 * muestras
esponjero endodónticoestéril
MUESTRAS IDENTIFICACIÓN
BACTERIANA VITEK
COMPACT 2
GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
Bacilos ambientales 1 25,0% 0 0,0% 0 0,0% 1 8,3%
Neisseriaspp. 1 25,0% 0 0,0% 0 0,0% 1 8,3%
Ninguno 2 50,0% 4 100,0% 2 50,0% 8 66,7%
Staphylococcus epidermidis 0 0,0% 0 0,0% 2 50,0% 2 16,7%
Total 4 100,0% 4 100,0% 4 100,0% 12 100,0%
Elaborado por: Ing. Jaime Molina
Gráfico 11. Cruce de variables identificación bacteriana vitek compact® 2 * muestras
esponjero endodónticoestéril
25.0%
0.0% 0.0%
25.0%
0.0% 0.0%
50.0%
100.0%
50.0%
0.0% 0.0%
50.0%
GRUPO A GRUPO B GRUPO C
ESTERIL: IDENTIFICACIÓN BACTERIANA
VITEK COMPACT 2 * MUESTRAS
Bacilos ambientales Neisseria spp. Ninguno Staphylococcus epidermidis
77
GRUPO A: el 25,0% tienen Bacilos ambientales, el 25,0% tienen Neisseria spp.,
el 50,0% no tienen Ninguno y el 0,0% tienen Staphylococcus epidermidis.
GRUPO B: el 0,0% tienen Bacilos ambientales, el 0,0% tienen Neisseria spp., el
100,0% no tienen Ninguno y el 0,0% tienen Staphylococcus epidermidis.
GRUPO C: el 0,0% tienen Bacilos ambientales, el 0,0% tienen Neisseria spp., el
50,0% no tienen Ninguno y el 50,0% tienen Staphylococcus epidermidis.
Tabla 23. Cruce de variables identificación bacteriana vitek compact® 2 * muestras
esponjero endodóntico no estéril
MUESTRAS IDENTIFICACIÓN
BACTERIANA VITEK
COMPACT 2
GRUPO A GRUPO B GRUPO C Total
Cant % Cant % Cant % Cant %
Aerococcusviridans 1 20,0% 0 0,0% 0 0,0% 1 6,7%
Bacilos ambientales 1 20,0% 0 0,0% 2 40,0% 3 20,0%
Enterobactercloacaedissolvens 1 20,0% 0 0,0% 0 0,0% 1 6,7%
EscherichiaColi 1 20,0% 0 0,0% 0 0,0% 1 6,7%
Ninguno 0 0,0% 2 40,0% 0 0,0% 2 13,3%
PantoeaAgglomerans 0 0,0% 0 0,0% 1 20,0% 1 6,7%
Sphingomonapaucimobilis 0 0,0% 0 0,0% 1 20,0% 1 6,7%
Staphylococcusaureus 1 20,0% 0 0,0% 0 0,0% 1 6,7%
Staphylococcusepidermidis 0 0,0% 2 40,0% 1 20,0% 3 20,0%
Staphylococcus hominis 0 0,0% 1 20,0% 0 0,0% 1 6,7%
Total 5 100,0% 5 100,0% 5 100,0% 15 100,0%
Elaborado por: Ing. Jaime Mo
78
Gráfico 12. Cruce de variables identificación bacteriana vitek compact® 2 * muestras
esponjero endodóntico no estéril
GRUPO A: el 20,0% de las muestras tienen Aerococcus viridans, el 20,0% tienen
Bacilos ambientales, el 20,0% tienen Enterobactercloacaedissolvens, el 20,0%
tienen EscherichiaColi, el 0,0% no tienen Ninguno, el 0,0% tienen
PantoeaAgglomerans, el 0,0% tienen Sphingomonapaucimobilis, el 20,0% tienen
Staphylococcus aureus, el 0,0% tienen Staphylococcus epidermidis y el 0,0%
tienen Staphylococcus hominis.
GRUPO B: el 0,0% de las muestras tienen Aerococcusviridans, el 0,0% tienen
Bacilos ambientales, el 0,0% tienen Enterobactercloacaedissolvens, el 0,0%
tienen Escherichia Coli, el 40,0% no tienen Ninguno, el 0,0% tienen
PantoeaAgglomerans, el 0,0% tienen Sphingomonapaucimobilis, el 0,0% tienen
Staphylococcus aureus, el 40,0% tienen Staphylococcus epidermidis y el 0,0%
tienen Staphylococcus hominis
GRUPO C: el 0,0% de las muestras tienen Aerococcusviridans, el 40,0% tienen
Bacilos ambientales, el 0,0% tienen Enterobactercloacaedissolvens, el 0,0%
tienen Escherichia Coli, el 0,0% no tienen Ninguno, el 20,0% tienen
20
.0%
0.0
%
0.0
%
20
.0%
0.0
%
40
.0%
20
.0%
0.0
%
0.0
%
0.0
%
40
.0%
0.0
%
0.0
%
40
.0%
20
.0%
0.0
%
20
.0%
0.0
%
GRUPO A GRUPO B GRUPO C
NO ESTERIL: IDENTIFICACIÓN BACTERIANA VITEK
COMPACT 2 * MUESTRAS
Aerococcus viridans Bacilos ambientales Enterobacter cloacae dissolvens
Escherichia Coli Ninguno Pantoea Agglomerans
Sphingomona paucimobilis Staphylococcus aureus Staphylococcus epidermidis
Staphylococcus hominis
79
PantoeaAgglomerans, el 20,0% tienen Sphingomonapaucimobilis, el 0,0% tienen
Staphylococcus aureus, el 20,0% tienen Staphylococcus epidermidis y el 0,0%
tienen Staphylococcus hominis.
80
4.2. Discusión
Los resultados de este estudio determinan que puede existir contaminación
bacteriana en los esponjeros antes de su utilización. Las bacterias aerobias y
coliformes que se encontraron en este estudio mediante el sistema Vitek
Compact® 2 son: Staphylococcus, bacilos ambientales, aerococcus,
enterobacterias y neisserias, y el nivel de contaminación bacteriana se determinó
mediante unidades formadoras de colonias las cuales presentan mayor prevalencia
en los esponjeros endodónticos de aluminio y plástico común, frente al esponjero
endodóntico de plástico autoclavable, el cuál al presentar la menor contaminación
se considera el más recomendable para el uso clínico.
De la revisión bibliográfica realizada no se encuentra un estudio in vitro análogo
al nuestro, sin embargo estudios similares como el realizado por el Saeed y cols.
(2017), afirman que los insumos endodónticos comúnmente usados como las GP
(gutaperchas), RDs (diques de goma), PMPs (almohadillas de papel para
mezclas), y los EISs (esponjas endodónticas), cuando fueron tomados de un
empaque recién abierto, estaban ya contaminados. Estos al ser abiertos y
almacenados durante los tratamientos endodónticos, podrían generar un
incremento en el nivel de contaminación. Se encontró que los géneros más
comunes en la contaminación de materiales endodónticos son Propionibacterium,
Staphylococcus y Micrococcus (32). En nuestro estudio se observan grupos
bacterianos que discrepan con la presente investigación, coincidiendo únicamente
en los Staphylococcus que en la muestra fue el de mayor presencia permitiendo
establecer un grado referencial entre los dos estudios.
Zambrano (2013), determinó que entre los géneros bacterianos más frecuentes en
los ambientes de centros odontológicos se encuentra el Staphylococcus. Este
género bacteriano es un componente de la microbiota normal del hombre,
encontrándose en la piel y secreciones corporales (34). En nuestro estudio el
género Staphylococcus fue el que se presentó mayoritariamente, como el S.
epidermidis, S. aureus y S. hominis de los cuales se debe considerar que géneros
81
como el aureus son de importancia por ser la bacteria responsable de muchas
enfermedades como la neumonía.
Factores como los aerosoles constituyen una fuente importante de emisión de
microorganismos, por esta razón Bustamante (2014), señala que existe una gran
cantidad y diversidad de microorganismos presentes en los aerosoles generados
durante los procedimientos odontológicos en los que se usa turbina, permitiendo
que estos microorganismos se depositen posteriormente en diversas superficies
que brinden los medios adecuados para su desarrollo (35), haciendo del esponjero
endodóntico por sus características estructurales, materiales idóneos para la
acumulación de bacterias; lo cual se confirma con los resultados de esta
investigación ya que los microorganismos presentes son similares a los que
nosotros encontramos como: Staphylococcus epidermidis en mayor cantidad,
neisserias, bacillus y difieren en la presencia de streptococcus y corynebacterium
que estuvieron ausentes en nuestro estudio.
Las bacterias Gram negativas influyen en la calidad del ambiente de las zonas
clínicas cerradas. Zambrano (2007), en el estudio realizado en superficies y
ambientes de la clínica odontológica, encontró una baja prevalencia de estos
grupos bacterianos, considerados oportunistas ya que se adaptan fácilmente a
ambientes húmedos con amplios rangos de temperatura; tienen la capacidad de
adquirir resistencia a desinfectantes (34). En nuestra investigación la presencia de
bacterias Gram negativas (enterobacterias) es representativa discrepando del
estudio de Zambrano en el que determina que a nivel de ambiente la incidencia de
estas es baja pero en los esponjeros se encuentra en un nivel medianamente
importante los cuál se debería a una inadecuada manipulación por parte de los
estudiantes.
Suárez y cols. (2010), determinaron que el aluminio tiende a atacarse localmente
en medios que contienen cloruros, en particular en resquicios o en áreas de
estancamiento, haciendo que desaparezca la pasividad del mismo formando una
capa blanquecina de sílice fuertemente adherida (36). Concuerda con lo observado
82
en la presente investigación donde se evidenció que el esponjero endodóntico de
aluminio posee mayor contaminación lo cual se daría por la colocación de
hipoclorito de sodio en su contenedor, esto provoca una capa blanquecina
haciendo de esta manera una zona susceptible al acumulo de bacterias.
Según el estudio realizado por Uyana (2018), en el cuál se determinó el grado de
contaminación del hilo retractor previo al uso en el paciente, concluyó que las
muestras de este material manipuladas por los estudiantes presentan un grado de
contaminación del 100%, frente a los materiales entregados por el personal de
materiales dentales con un 25% de contaminación (37). Los esponjeros
endodónticos siendo un material sensible a la contaminación y manipulados
estrictamente por los estudiantes, evidencian niveles de contaminación por un
inadecuado manejo de protocolos de asepsia.
Por este motivo, Gutiérrez y cols. (2008) el cuál evalúa tres agentes
desinfectantes frente a superficies susceptibles a contaminación bacteriana de uso
continuo determina que el hipoclorito es el segundo agente desinfectante con
buena acción bactericida por esta razón podemos decir que el uso de hipoclorito
de sodio al 2% aplicado a los materiales que se usan en odontología, permiten
aminorar el nivel de carga bacteriana, disminuyendo de esta manera el potencial
de contaminación (38), por lo cual se recomienda el uso de este agente
desinfectantes en el contenedor del esponjero endodóntico para disminuir la carga
bacteriana presente en los mismos mediante un protocolo óptimo que se pueda dar
a conocer en el grupo de prevención de riesgos biológicos.
Véliz y cols. (2017), da a conocer la importancia del proceso de limpieza y
desinfección de superficies críticas en el servicio dental, el mismo que nos
determina que la capacitación que se brinda a todo el personal participe de la
atención odontológica mejora las condiciones de prevención logrando que la
contaminación este bajo el rango establecido (39), por tal motivo se propondrá un
protocolo de asepsia del esponjero endodóntico que sea viable para la
manipulación y limpieza del mismo.
83
Como se ha podido constatar en los párrafos anteriores, existen estudios que
respaldan y elevan la trascendencia y veracidad de nuestros resultados ya que los
mismos cumplen con el propósito de la investigación.
Se puede aseverar que el estudio realizado es relevante y constituye un valioso
aporte en cuanto a conocimientos para la prevención de riesgos biológicos dentro
de la atención clínica de nuestros pacientes.
84
CAPÍTULO V
5. CONCLUSIONES Y RECOMENDACIONES
5.1. Conclusiones
Después de realizar la presente investigación se concluye:
1. El esponjero endodóntico (aluminio, plástico común y plástico
autoclavable), presenta contaminación bacteriana previo a su uso.
2. Se detectaron mediante el sistema Vitek compact 2 los siguientes grupos
bacterianos: Staphylococcus, bacilos ambientales, aerococcus,
enterobacterias y neisserias.
3. Al comparar cualitativamente por UFC los niveles de contaminación en
cada uno de los materiales de composición del esponjero endodóntico se
evidenció mayor incidencia bacteriana en los esponjeros endodónticos de
aluminio y plástico común, frente al esponjero endodóntico de plástico
autoclavable, el cuál presenta la menor contaminación. Sin embargo, en el
análisis cuantitativo no se evidenció diferencia estadística, probablemente
por el pequeño tamaño de la muestra.
85
5.2. Recomendaciones
Después de realizar la presente investigación se recomienda:
1. El uso de esponjeros endodónticos de un material que permita realizar
protocolos adecuados de asepsia (desinfección y esterilización), sin alterar
su estructura.
2. El uso de barreras de protección (guantes, mascarilla, gafas, etc.), al
momento de preparar su mesa de trabajo, para disminuir la incidencia de
bacterias.
3. Aplicar obligatoriamente protocolos de asepsia sobre los esponjeros
endodónticos y material en general, antes y después del uso clínico como
parte de su ética profesional lo cual permitirá disminuir riesgos biológicos
en general.
4. Realizar un estudio con un número mayor de muestras que permitan
determinar rangos más precisos de contaminación utilizando una
metodología similar para compararlo con el presente estudio.
86
BIBLIOGRAFÍAS
1. Álvarez F, Valderrama E. Riesgos Biológicos y Bioseguridad. 2nd ed.
Bogotá: Ecoe; 2010.
2. Instituto Nacional de Seguridad e Higiene en el Trabajo. Guía técnica para la
evaluación y prevención de los riesgos relacionados con la exposición a
agentes biológicos. Madrid: INSHT; 2014.
3. Porres N, Ruiz E. Microbiología clínica. 1st ed. Madrid: Ediciones Paraninfo,
S.A; 2018.
4. Cortesi V. Manual Práctico para el Auxiliar de Odontología. 1st ed.
Barcelona: Elsevier Masson; 2008.
5. Leivers M. Uniform contamination in the dental environment. Canadian
Journal of Dental Hygiene. 2012; 46(1): p. 50-56.
6. Williams G, Denyer S, Hosein I, Hill D, Maillard J. The development of a
new three-step protocol to determine the efficacy of disinfectant wipes on
surfaces contaminated with Staphylococcus aureus. J Hosp Infect. 2012
Octubre; 67(4): p. 329-35.
7. Chaher R. Contaminación. In Editor EC, editor. Contaminación. Buenos
Aires- Argentina; 2009. p. 29.
8. Campos P. Biología Editores N, editor. México D.F: Limusa; 2003.
9. Palma A, Sánchez F. Técnicas de ayuda odontológica y Estomatológica. 2nd
ed. Madrid: Paraninfo; 2013.
10. Negroni M. Microbiología Estomatológica: Fundamentos y Guía Práctica.
Segunda ed. Buenos Aires: Médica Panamericana; 2009.
11. Higashida B. Odontología Preventiva. 1st ed. México D.F: Mc Graw- Hill
Interamericana ; 2009.
12. Comité Nacional de Bioseguridad en Salud Pública. Bioseguridad en la
práctica bucodental. Normas técnicas y manual de procedimientos. [Online].;
2006 [cited 2018 Enero 6. Available from:
http://www.minsa.gob.pa/sites/default/files/publicaciones/bioseguridad_buco
87
dental.pdf.
13. Montoya H. Microbiología básica para el área de la salud y afines. 2nd ed.
Antioquia-Colombia: Universidad de Antioquia; 2008.
14. Kotcher J. Instrumentación Quirúrgica: teoría, técnicas y procedimientos. 4th
ed. México D.F: Ed. Médica Panamericana; 2009.
15. Villacrés D. Grado de Contaminación de los teléfonos celulares de docentes y
estudiantes que realizan actividades en la clínica integral de la Facultad de
Odontología de la Universidad Central del Ecuador, periodo 2015. Quito:
UCE; 2015.
16. Tortora G, Funke B, Case C. Introduccion a la Microbiología. 9th ed. Madrid:
Editorial Médica Panamericana; 2007.
17. Prats G. Microbiología Clínica. 1st ed. Buenos Aires: Ed. Médica
Panamericana; 2005.
18. Forbes B, Sahm D, Weissfeld A. Bayle & Scott´s. Diagnóstico
Microbiológico. 12th ed. Madrid: Editorial Médica Panamericana; 2009.
19. Romero R. Microbiología y Parasitología Humana México: Editorial Médica
Panamericana; 2007.
20. García J. Microbiología médica Madrid: Tres Cantos; 1998.
21. Fernández O. Procedimientos en microbiología clínica Madrid: Seimc; 2010.
22. Instituto de Higiene. Higiene. [Online].; 2006 [cited 1018 Febrero 15.
Available from: http://www.higiene.edu.uy/cefa/cefaed2006.htm.
23. El Diario el Peruano. Higiene. [Online].; 2007 [cited 2018 Febreo 5.
Available from: http://extwprlegs1.fao.org/docs/pdf/per72441anx.pdf.
24. Cavallini E, Gamboa M, Hernández F, García J. Bacteriología General.
Principios y prácticas de laboratorio. 2nd ed. San José-Costa Rica:
Universidad de Costa Rica; 2016.
25. Mezomo E. Rehabilitación Oral para el clínico. 1st ed. Sao Paulo: Santos;
1997.
26. Carvajal J. Prótesis Fija. 1st ed. Santiago de Chile: Ed. Mediterráneo; 2001.
27. Gobernado M. Enfermedades Infecciosas y Microbiología Clínica. 3rd ed.
88
Buenos Aires: Médica Panamericana; 2005.
28. Mancero Y. Manual Uso tarjetas vitek compact 2. In ; 2018; Quito.
29. U.S. Food and Drug Administration. Departamento de salud y servicios de
salud - FDA. [Online].; 1998 [cited 2018 Febrero 4. Available from:
https://www.fda.gov.
30. 3M Microbiology. Manual de uso Placas petrifilm. México D.F: 3M; 2006.
31. Dentsplay Sirona Endodontics. Manual de uso Esponjero endodóntico. New
York: Dentsplay Sirona ; 2014.
32. Saeed M, Koller G, Niazi S, Patel S, Mannocci F, Bruce K, et al. Bacterial
Contamination of Endodontic Materials before and after Clinical Storage. J
Endod. 2017; 43(11): p. 1852-1856.
33. Garza A. Control de infecciones y bioseguridad en odontología. 2nd ed.
Morales S, editor. Madrid; 2016.
34. Zambrano-Gari C, Luna-Fontalvo J. Diversidad microbiana presente en el
ambiente de la clínica odontológica de la Universidad del Magdalena.
Intropica. 2013; 1(1): p. 61 - 68.
35. Bustamante M, Herrera J, Ferreira R, Riquelme D. Contaminación Bacteriana
Generada por Aerosoles en Ambiente Odontológico. Int. J. Odontostomat.
2014; 8(1): p. 99-105.
36. Suárez-Peña B, Asensio-Lozano J, Vander-Voort G. Metalografía a color en
aleaciones Al-Si comerciales. Optimización de las técnicas de caracterización
microestructural mediante microscopía óptica de reflexión. Revista de
Metalurgia. 2010; 46(5).
37. Uyana G. Grado de contaminación del hilo retractor previo al uso en el
paciente, en la clínica de la Facultad de Odontología de la Universidad
Central del Ecuador, perido 2018. Quito: UCE; 2018.
38. Gutierrez S, Dussán D, Leal S, Sánchez A. Evaluación microbiológica de la
desinfección en unidades odontológicas (estudio piloto). Rev. Colomb. Cienc.
Quím. Farm. 2008; 37(2): p. 4-9.
39. Véliz E, Vergara T, Pearcy M, Dabanch J. Importancia del proceso de
89
limpieza y desinfección de superficies críticas en un servicio dental. Impacto
de un programa de intervenciónal. Rev Chilena Infectol. 2018; 35(1): p. 88-
90.
92
Anexo C. Solicitud de autorización para el uso de equipos del laboratorio de
microbiología del Hospital Gineco-Obstétrico Isidro Ayora
93
Anexo D. Certificado de realización del estudio y uso de equipos del
laboratorio de microbiología del Hospital Gineco-Obstétrico Isidro Ayora
94
Anexo E. Solicitud de autorización para el ingreso a clínicas de la Facultad de
odontología de la Universidad Central del Ecuador.
95
Anexo F. Autorización para el ingreso a clínicas de la Facultad de
odontología de la Universidad Central del Ecuador.
96
Anexo G. Tablas de recolección de datos.
HOJA DE RECOLECCIÓN DE DATOS C
ÓD
IGO
DE
MU
ES
TR
AS
ESPONJERO
ENDODÓNTI
CO ESTÉRIL /
NO ESTÉRIL
NIVEL DE
CONTAMINACIÓN
GRUPO
B PLÁSTICO
AUTOCLAVABL
E
UFC GENERA
L
UFC ESTÉRI
L
UFC NO
ESTÉRI
L
AEROBIOS
TOTALE
S GENERA
L
AEROBIOS
TOTALE
S ESTÉRIL
AEROBIOS
TOTALE
S NO ESTÉRIL
ENTEROBACTERIAS GENERAL
ENTEROBACTERIAS ESTÉRIL
ENTEROBACTERIAS NO ESTÉRIL
IDENTIFICACI
ÓN BACTERIANA
VITEK
COMPACT 2
1
2
3
4
5
6
7
8
9
contr
ol
Elaborado por: Victoria Cárdenas V.
97
Anexo H. Guía del Manejo de desechos del laboratorio de microbiología del
Hospital Gineco-Obstétrico Isidro Ayora.
115
Anexo T. Resultados de Laboratorio
CÓ
DIG
O D
E M
UE
ST
RA
S ESPONJERO
ENDODÓNTICO
ESTÉRIL / NO
ESTÉRIL
NIVEL DE
CONTAMINACIÓN
TO
TA
L
IDE
NT
IFIC
AC
IÓN
BA
CT
ER
IAN
A V
ITE
K
CO
MP
AC
T 2
GRUPO
C
ALUMINIO
CONTAMINADO
/ NO
CONTAMINADO
GRAM +
GRAM
-
AEROBIOS
TOTALES
ENTEROBACTERIAS
UFC
1 0 0 0 0 0 0 0 0 Ninguno
2 0 1 1 0 1 0 2 5 Staphylococcusepidermidis
3 1 1 1 0 1 0 3 7 Staphylococcusepidermidis
4 1 1 0 1 1 1 4 9 Sphingomonapaucimobilis
5 0 0 0 0 0 0 0 0 Ninguno
6 1 1 1 0 1 0 4 8 Bacilos ambientales
7 1 1 0 1 1 1 3 8 PantoeaAgglomerans
8 0 1 1 0 1 0 2 5 Staphylococcusepidermidis
9 1 1 1 0 1 0 1 5 Bacilos ambientales
10 0 0 0 0 0 0 0 0 Ninguno
116
CÓ
DIG
O D
E M
UE
ST
RA
S ESPONJERO
ENDODÓNTICO
ESTÉRIL / NO
ESTÉRIL
NIVEL DE
CONTAMINACIÓN
TO
TA
L
IDE
NT
IFIC
AC
IÓN
BA
CT
ER
IAN
A V
ITE
K
CO
MP
AC
T 2
GRUPO
A
PLÁSTICO COMÚN
CONTAMINADO
/ NO
CONTAMINADO
GRAM +
GRAM
-
AEROBIOS
TOTALES
ENTEROBACTERIAS
UFC
1 0 0 0 0 0 0 0 0 Ninguno
2 1 1 0 1 1 1 2 7 Enterobactercloacaedissolvens
3 0 0 0 0 0 0 0 0 Ninguno
4 1 1 1 0 1 0 3 7 Aerococcusviridans
5 1 1 1 0 1 0 2 6 Staphylococcusaureus
6 1 1 1 0 1 0 2 6 Bacilos ambientales
7 1 1 1 0 1 0 4 8 Bacilos ambientales
8 1 1 0 1 1 1 1 6 EscherichiaColi
9 0 1 0 1 1 1 4 8 Neisseriaspp.
10 0 0 0 0 0 0 0 0 Ninguno
117
CÓ
DIG
O D
E M
UE
ST
RA
S ESPONJERO
ENDODÓNTICO
ESTÉRIL / NO
ESTÉRIL
NIVEL DE
CONTAMINACIÓN
TO
TA
L
IDE
NT
IFIC
AC
IÓN
BA
CT
ER
IAN
A V
ITE
K
CO
MP
AC
T 2
GRUPO
B
PLÁSTICO
AUTOCLAVABLE
CONTAMINADO
/ NO
CONTAMINADO
GRAM +
GRAM
-
AEROBIOS
TOTALES
ENTEROBACTERIAS
UFC
1 0 0 0 0 0 0 0 0 Ninguno
2 0 0 0 0 0 0 0 0 Ninguno
3 1 1 1 0 1 0 2 6 Staphylococcus hominis
4 1 0 0 0 0 0 0 1 Ninguno
5 1 1 1 0 1 0 2 6 Staphylococcusepidermidis
6 0 0 0 0 0 0 0 0 Ninguno
7 1 0 0 0 0 0 0 1 Ninguno
8 0 0 0 0 0 0 0 0 Ninguno
9 1 0 0 0 0 0 0 1 Ninguno
10 1 1 1 0 1 0 1 5 Staphylococcusepidermidis