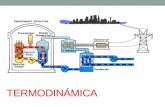
Termodinámica La termodinámica estudia las transferencias de ...
Química2 bach 6.3 primer principio de la termodinámica
description
Transcript of Química2 bach 6.3 primer principio de la termodinámica

6.3 PRIMER PRINCIPIO DE LA TERMODINÁMICA
Una relación para el trabajo, el calor y la energía interna
Química

La energía interna, U
Energía cinética de las moléculas o
átomos de todo el sistema
Energía potencial intermolecular e
intramolecular debida a la Energía de enlace
Si entra energía, en forma de calor la variación de la
U será positiva
Si sale energía en forma de calor, la variación de la U será negativa

A.7. Calcula el trabajo de expansión que tiene lugar en lacombustión completa de dos moles de octano en condicionesnormales.

Primer principio de la Termodinámica
La cantidad de calor comunicada a un sistema es igual al trabajo realizado por él más la variación de su energía interna
Δ𝑈 = 𝑞 +𝑊
Convenio de signos

Calor a volumen constante
Si no cambia el volumen, isócoro, la variación de
energía interna
Δ𝑈 = 𝑞 − 𝑝 · Δ𝑉 = 𝑞𝑣
La variación de energía interna coincide con el calor intercambiado qv
(función de estado)

Calor a presión constante. La entalpía
Reacciones en recipientes abiertos, presión constante
Δ𝑈 = 𝑞 +𝑊𝑒𝑥𝑡
Δ𝑈 = −𝑊𝑖𝑛𝑡 + 𝑞
Δ𝑈 = −𝑝Δ𝑉 + 𝑞𝑝
𝑞𝑃 = Δ𝑈 + 𝑝Δ𝑉
Primer principio
Trabajo de compresión
Despejamos qp
𝑞𝑝 = Δ 𝑈 + 𝑃𝑉
𝐻 = 𝑈 + 𝑝 · 𝑉
qp Puede expresarse como una
variación de una función de estado
Se define la entalpía como:
𝑞𝑝 = Δ 𝑈 + 𝑃𝑉 = Δ𝐻Y por tanto el calor qp

A.8. ¿En qué casos coincidirán H y V?
A.9. ¿Cuál es la relación de H con el número de moles?
A.10. ¿Cuál es la relación de qp y qV con el número de moles?

A.11. La vaporización de un mol de Mercurio a 350 y presiónconstante absorbe 270 J/g. El sistema realiza trabajo sobre elentorno, a causa de la variación de volumen que tiene lugarcuando el líquido pasa a vapor. Calcular:a) El trabajo realizado por un mol de líquido, a presión
constante, sabiendo que su volumen a 350 C es de 0,0187 L,si suponemos que el vapor se comporta como un gas ideal,realiza el cálculo por los dos procedimientos• A partir de la definición de trabajo W=P·V• A partir de la aproximación W=R·T·n
b) H y U para este procesoDatos: R=0,082 atm·L·mol-1·K-1=8,13 J·mol-1·K-1, 1 atm=101325 Pa
Sol: a1)W=5,1744 kJ; a2) W=5,1709 kJ; b) H=54,1 kJ; U=48,9 kJ;