Leishmania Sis
-
Upload
valeria-hernandez-sanchez -
Category
Documents
-
view
29 -
download
1
description
Transcript of Leishmania Sis
La leishmaniasis constituye un espectro de enfermedades causadas por especies del protozoo
flagelado Leishmania, intracelular obligado del humano y otros mamíferos, que produce lesiones a niveles cutáneo,
mucocutáneo y visceral.
Se transmite a los humanos por la picadura de flebótomos hembra infectados. En América, el vector es el
mosquito Lutzomyia, y en Europa, el género Phlebotomus
HISTORIALa leishmaniasis es una enfermedad de la que pueden
encontrarse antecedentes en épocas antiguas. Hay descripciones de leishmaniasis cutánea del
año 650 a. C. en la antigua Babilonia. La misma enfermedad conocida en Oriente como «úlcera
oriental» fue descrita por Avicena en el siglo X con el nombre de «úlcera de Balj», por la ciudad al norte del actual Afganistán. Posteriormente hay varios casos
descritos en el Oriente Medio, por ejemplo en Bagdad y Jericó, denominándola de diferentes formas.
En los siglos XV y XVI, durante la colonización española de América, se describe la enfermedad en las zonas del actual Ecuador y Perú llamándola «lepra blanca»; en
dichos lugares había evidencia de la presentación de la forma cutánea desde épocas preincaicas. Fernando de Oviedo en 1535, Pedro
Pizarro en 1571, Fernando de Santillán en 1572, fray Rodrigo de Loayza en 1586, Diego de Morales en 1602, Reginaldo Lizárraga en 1605, Bartolomé de la Vega y el
médico Cosme Bueno, describen la enfermedad que afecta a los indígenas de la ladera oriental de la cordillera de Los Andes, en los valles cálidos y húmedos donde
se produce coca, produciéndoles destrucción de nariz y cavidades nasales.
4
Enfermedades Tropicales desatendidas
Afecta 1/3 de la población mundial
Personas muy pobres
Débil prioridad política
Discapacidad, mutilantes, defunciones
y segregación
Baja rentabilidad para los productos farmacéuticos y otros
insumos
Leishmaniasis
Leishmaniasis
98 países con registro casos leishmaniasis
34 países con coinfección Leishmania-HIV
350.000 personas/riesgo500.000: LV1,5 Milhões LT
59.000 muertes/año
90% en Bangladesh, Brasil, Etiópia, India, Nepal y Sudan
2,35 millones de DALYs (Disability Adjusted Life Years),
Impacto general en el mundo
Fuente: OMS
Europa: La leishmaniasis cutánea, con una abundante variedad de lesiones, se asocia a: Leishmania major, Leishmania tropica yLeishmania
aethiopica. El complejo Leishmania donovani es causante de la enfermedad visceral.
América: La leishmaniasis cutánea localizada es causada por múltiples especies de los subgéneros Leishmania y Viannia: L. mexicana, L.
braziliensis, L. panamensis, L. guyanensis, y L. peruviana. La enfermedad mucocutánea (también conocida como espundia, uta), se asocia con
mayor frecuencia a L. braziliensis y L. panamensis, aunque otras especies pueden estar involucradas. L. infantum (sín. chagasi), da lugar a la
enfermedad visceral.La leishmaniasis cutánea difusa se presenta como consecuencia de
factores inmunes del hospedero, asociada a ciertas especies del parásito. Involucra, hasta ahora, a L. mexicana y L. amazonensis.
ETIOLOGÍA
• Familia Trypanosomatidae y género Leishmania
• La nueva clasificación (Rioux y col.) Leishmania y Viannia.
• Cada subgénero comprende varios complejos
Clasificación (1)
- Complejo: Leishmania donovani Leismania donovani Leishmania infantum Leishmania chagasi
- Complejo: Leishmania tropica
Leishmania tropica Leishmania killicki
- Complejo: Leishmania major
Clasificación (2)
- Complejo: Leishmania aethiopica Leishmania aethiopica
- Complejo: Leishmania mexicana
Leishmania mexicana Leishmania amazonensis
Leishmania garnhami Leishmanai pifanoi
Leishmania venezuelensis
Clasificación (3)
Subgénero: Viannia
- Complejo: Leishmania braziliensis Leishmania braziliensis Leishmania peruviana
Leishmania colombiensis
- Complejo: Leishmania guyanensis Leishmania guyanensis Leishmania panamensis
La difícil clasificación de las múltiples especies y subespecies
de Leishmania se realiza en función de su:
1) Biología: desarrollo en el flebótomo, crecimiento en medios de cultivo, desarrollo en los hospederos vertebrados.
2) Bioquímica: patrones isoenzimáticos, secuenciación de múltiples loci (multilocus enzyme typing) - actual "estándar de oro" (Schnian et al. 2011).
3) Inmunología: análisis parasitario con anticuerpos monoclonales.
4) Filogenia molecular, entre otros.
Los vectores de la Leishmaniasis son mosquitos del orden Diptera, familia Psychodidae, subfamilia Phlebotominae y
géneros Phlebotomus en el Viejo Mundo y Lutzomiya en América.
MORFOLOGÍA
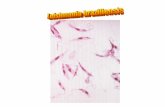
Leishmania es un protozoo intracelular obligado dimórfico; en los hospederos mamíferos se localiza en macrófagos y células dendríticas (células de Langerhans en la piel).
• Promastigote ( metacíclico), la forma infectante, elongado, extracelular, se desarrolla y multiplica en el tracto digestivo de los insectos transmisores, pertenecientes al género Lutzomyia en América y Phlebotomus en el Viejo Mundo. Mide 10 - 20 µm, sin contar la longitud de un único flagelo, cuyo tamaño oscila entre 15 - 25 µm; presenta un gran núcleo central, ribosomas, retículo endoplásmico, aparato de Golgi, vesículas y una mitocondria. El cinetoplasto aparece como una banda granular electrodensa dentro de la extensión de la mitocondria, localizado a 1 - 2 µm del extremo anterior del parásito, de donde emerge el flagelo. El axonema que se origina en el cuerpo basal está contenido dentro del bolsillo flagelar.
• Amastigote, la forma replicativa, redondo u oval, intracelular, reside y se multiplica en fagolisosomas dentro de fagocitos mononucleares de los hospederos, aunque se ha documentado la presencia de amastigotes en neutrófilos y fibroblastos en lesiones de piel. (Laskay T, et al. 2003). Mide 2 - 4 µm; con tinción Giemsa se aprecian un gran núcleo y un cinetoplasto pequeño, ambos de color púrpura, y un filamento delgado que une cinetoplasto y cuerpo basal, éste último apenas un punto visible.El cinetoplasto es una subestructura de la gran mitocondria, con DNA único y se encuentra asociado estrechamente al bolsillo flagelar y al cuerpo basal del flagelo. La presencia del cinetoplasto da el nombre al grupo de protozoos incluidos en el ordenKinetoplastida.
RESPUESTA INMUNE. PATOGENIA.
La respuesta inmune ante la infección por Leishmania inicia con la respuesta innata. Los receptores TLR2 (Toll-like receptor 2), presentes en macrófagos, células dendríticas (CD) y células asesinas naturales (NK) reconocen moléculas en la superficie del parásito, tales como el lipofosfoglicano (LPG) y una glicoproteína de 63kDa (gp36) e inducen la producción de citocinas proinflamatorias: TNF-a, IFN-g e IL-12, así como de moléculas coestimuladoras. (Ruiz JH, Becker I. 2007).
Existen múltiples receptores en los macrófagos que interactúan con Leishmania. De manera notable, Leishmania explota las opsoninas séricas del hospedero para facilitar la fagocitosis de las formas infectantes en las células del hospedero. Por ejemplo, la unión de la forma metacíclica a CR3, debido a la actividad de proteasa de GP63 resulta en la opsonización con ligandos para CR3 y/o CR1. (Ueno & Wilson. 2012), que favorecen la internalización de el parásito.
La glucoproteína 63 (GP63) o leishmanolisina. Es una metaloproteasa zinc-dependiente, que permite que el promastigote resista la lisis mediada por el complemento y favorece su ingreso al macrófago. Dentro de esta célula hospedera, GP63 es responsable de la activación de las tirosina-fosfatasas que dan lugar a la alteración de las vías de cinasa JAK, MAP, e IRAK-1. En el núcleo, está involucrada en la inactivación de factores de transcripción tales como AP-1 y NF-κB. (Isnard et al., 2012).
• La respuesta protectora contra la leishmaniosis es de tipo celular.
• El progreso de la infección, demostrado en el modelo Leishmania-ratón, depende de la dicotomía en el desarrollo de las células T CD4+ hacia las vías Th1 (protección) o Th2 (exacerbación).
• La IL-12 induce la expansión de clonas Th1, con la elaboración de diferentes perfiles de citocinas, como IFN-g y TNF-a, que inducen la producción de óxido nítrico (NO) en el macrófago.
• IL-4 e IL-10 determinan la diferenciación hacia clonas Th2 (y activación policlonal de células B), y la producción de IL-4, IL-5, IL-6, IL-9, IL-10, IL-13 y TGF-b.
El lipofosfoglucano (LPG) es uno de los principales glucoconjugados de superficie de los promastigotes. Protege a Leishmania al inhibir la maduración del fagosoma, mediante el secuestro de aniones superóxido y radicales hidroxilo y la inhibición de una actividad eficaz de la proteína cinasa-C, necesaria para el estallido respiratorio. Esto permite al parásito sobrevivir dentro de la vacuola hasta su diferenciación en amastigotes, que pueden subsistir y dividirse en compartimientos ácidos. Los LPGs también están involucrados en la sobrevivencia de los promastigotes en el vector. (Olivier et al., 2012).
Una clase abundante de glicosilinositol-fosfolípidos (GIPLs), moléculas de superficie en promastigotes y amastigotes, tienen un papel en la virulencia del parásito. Aún se encuentran bajo estudio. Se ha observado que inhiben la liberación de NO, entre otras acciones, en modelos animales. (De Assis RR et al. 2012; Olivier et al., 2012).
También se ha demostrado la capacidad de los amastigotes de L. mexicana de inhibir en cierta medida la apoptosis en células dendríticas en el modelo murino, lo que favorecería la invasión y la persistencia del parásito en las células infectadas. (Gutiérrez-Kobeh et al., 2013).
LEISHMANIOSIS VISCERAL (LV) O KALA-AZAR
• Más del 90% de los casos de leishmaniasis visceral a nivel mundial.
• Se presentan en seis países: India, Bangladesh, Sudán, Sudán del Sur, Etiopía y Brasil.
• Los agentes etiológicos pertenecen al complejo L. donovani.
• Se estiman unos 400 000 casos nuevos/año, y se considera que 1 de cada 10 pacientes fallece debido a la enfermedad. (Alvar et al., 2012).
• En México, los estados en los cuales se han detectado casos de LV son Chiapas, Puebla y Guerrero (la cuenca del Balsas). Los reportes de LV corresponden a L. chagasi, principalmente en Chiapas y Guerrero, y se identificó L. mexicana en un paciente inmuno- comprometido de Tabasco.
• La infección puede ser asintomática, aguda o crónica.
• En países en desarrollo, los niños con algún grado de desnutrición y los sujetos HIV positivos son la población en mayor riesgo de adquirir la enfermedad progresiva.
• El tiempo de incubación es de meses, a veces años.
• La aparición de signos y síntomas es habitualmente insidioso, y en ocasiones, en el sitio de la agresión se desarrolla un nódulo, permanente, como único signo inicial. Los cuadros agudos son menos frecuentes.
• Cuando se manifiesta la enfermedad, es grave, y la mortalidad sin tratamiento es del 100%.
• Existen reportes aislados de la enfermedad durante el embarazo. (Pagliano P, et al. 2005; Marius Mueller M, et al. 2006).
• Características generales de la enfermedad: fiebre irregular, pérdida de peso, hepatoesplenomegalia, anemia.
• Los signos y síntomas en niños son: fiebre, palidez, anorexia, pérdida de peso, deficiencia en el crecimiento, tos, vómito, diarrea y epistaxis; esplenomegalia masiva acompañada de hepatomegalia, linfadenopatías, a veces generalizadas, sangrado gingival, equimosis y petequias en extremidades. El bazo grande, firme, puede aparecer con consistencia blanda en casos agudos. En etapas posteriores del padecimiento se han descrito taquicardia, ictericia, distensión abdominal, ascitis o edema pedal, sangrados y equimosis más importantes, alteraciones en piel y anexos, como hiperpigmentación, lesiones verrucosas no ulceradas y alopecia.Los hallazgos de laboratorio indican trombocitopenia, anemia normocítica normocrómica, leucopenia, hipoalbuminemia, hipergammaglobulinemia (por la activación policlonal de células B). El factor reumatoide y complejos inmunes circulantes están presentes en la mayoría de los pacientes. Las transaminasas hepáticas séricas pueden estar elevadas.Un tratamiento incompleto puede ser causa de recurrencias.
• Complicaciones: Síndrome de desgaste, infecciones secundarias.
Es una enfermedad emergente, oportunista, asociada a SIDA.
En pacientes HIV+ se presenta diseminación parasitaria a piel en la LCD y en forma de síndromes viscerales. Se ha sugerido que casi cualquier órgano que contenga fagocitos puede ser infectado eventualmente. También se consideran en estos pacientes localizaciones atípicas, crónicas, recaídas, pobre respuesta a los fármacos habituales y ausencia de anticuerpos anti-leishmania.
La presentación más frecuente cursa con manifestaciones gastrointestinales.
En el 20 - 40% de los casos la esplenomegalia se encuentra ausente. Es necesario contemplar la presencia simultánea de otras infecciones, que pueden alterar aún más el cuadro.
Síndrome de desgaste
LEISHMANIOSIS CUTÁNEA LOCALIZADA (LCL
• La leishmaniosis cutánea es la forma de la infección con mayor distribución a nivel mundial. Un tercio de los casos ocurre en cada una de las siguientes regiones epidemiológicas: Las Américas, el Mediterráneo, y en Asia, desde el Medio Este hasta Asia Central. Los diez países que reportan la mayor cantidad de casos son: Afganistán, Algeria, Colombia, Brasil, Iran, Siria, Etiopía, Sudán del norte, Costa Rica and Perú, con un estimado del 70- 75% global. (Alvar et al., 2012).
• Los principales agentes causales en América son Leishmania mexicana, L. braziliensis, L. panamensis.
• Existen casos autóctonos en Texas, EUA, y se considera endémica en toda Latinoamérica, hasta el norte de de Argentina, con las excepciones de Chile y Uruguay.
• En México se le ha encontrado al menos en 20 Estados, con las principales zonas endémicas en: Chiapas, Oaxaca, Campeche, Quintana Roo, Tabasco,Yucatán y Veracruz. En Tabasco y Veracruz, LCL es causada por infección con miembros del complejo L. mexicana; en Nayarit y Campeche se han identificado los complejos L. mexicana y/o L. braziliensis. (Monroy-Ostria A., 2002).
• Se consideran dos cuadros clínicos cutáneos: leishmaniasis cutánea localizada (LCL), generalmente circunscrita al sitio de inoculación gracias a una respuesta inmune celular protectora, y leishmaniasis cutánea diseminada (LCD) caracterizada por una pobre respuesta inmune celular, que permite la diseminación no controlada en piel.
• La LCL es conocida en México como "úlcera de los chicleros" debido a que fue encontrada en trabajadores que extraían la goma del árbol del chicle, y con frecuencia se observaba afectando el pabellón auricular, de curso progresivo y mutilante.
• Se considera un problema de salud pública debido a su amplia distribución geográfica y porque puede llegar a producir lesiones destructivas e incluso discapacitantes.
• En México predominan las úlceras únicas en áreas corporales expuestas (cara, tronco, extremidades).
• El período de incubación varía de una a doce semanas, aunque puede ser más prolongado. La lesión inicial es una pápula que evoluciona a un nódulo eritematoso, pruriginoso e indoloro, acompañada hasta en un 30% de los casos de adenopatía regional, con un diámetro de 1 - 10 cm y que se ulcera en un lapso de 1 - 3 meses.
• La úlcera característica es redondeada, de borde elevado y bien definido, indurado, cubierta por una costra amarillenta; cuando ésta se desprende revela un fondo de tejido de granulación limpio. Es posible que aparezcan lesiones satélites. Con alguna frecuencia existe infección secundaria, con lesiones purulentas y dolorosas.En ocasiones no hay ulceración y se aprecian en su lugar lesiones vegetantes o verrucosas.
• El cuadro tiende a curar espontáneamente a corto o largo plazo, dejando como secuela una cicatriz visible como una placa atrófica y discrómica con telangiectasias.
• Es importante hacer notar que cuando afecta pabellones auriculares (forma cutáneo-condral) produce una úlcera crónica,progresiva, de fondo exudativo, generalmente indolora, mutilante.
LEISHMANIOSIS CUTÁNEA DIFUSA (LCD)
• Forma polar anérgica. Se ha reportado en Oaxaca, Campeche, Tabasco, Veracruz, Michoacán, Tamaulipas.
• Se caracteriza por lesiones nodulares con gran número de parásitos, diseminadas prácticamente en todo el tegumento, con excepción del cuero cabelludo, regiones inguinal y axilar, genitales externos, plantas y palmas, aunque se han reportado excepciones.
•La enfermedad es de curso crónico, se presentan resistencias a los tratamientos.
• Se asocia a recaídas, infecciones bacterianas secundarias.
• La respuesta inmune predominante, no protectora, es de tipo Th2.
• En la biopsia de la lesión, se identifican macrófagos vacuolados con abundantes amastigotes.
LEISHMANIOSIS MUCOCUTÁNEA (LMC)
• Este síndrome es conocido como espundia en Sudamérica. • Las manifestaciones clínicas se presentan muchos meses o años después de
haberse resuelto la enfermedad cutánea; se deben a metástasis de lesiones cutáneas, aunque en un porcentaje de los casos no es posible identificar la lesión primaria.
• Las lesiones se inician principalmente en mucosa nasal, simulando en el inicio una rinitis. Se aprecia inflamación de la mucosa e hipertrofia vascular, con ulceración posterior que llega a comprometer el tabique nasal cartilaginoso.
• El progreso de la enfermedad es crónico. Puede involucrar el labio superior, paladar, pilares, úvula, epiglotis, cuerdas vocales, hipofaringe, laringe y tráquea.
• Los cuadros severos se asocian a dificultad para respirar, deglutir; también se presenta disfonía, afonía e incluso asfixia.
• La infección secundaria es frecuente y complica el cuadro. Presenta resistencia a la quimioterapia específica. No es usual en niños, pero cuando ocurre la mortalidad es alta.
• Las lesiones presentan escasos parásitos. • La respuesta inmune predominante es de tipo Th1.
LEISHMANIOSIS DÉRMICA POST-KALA-AZAR (PKDL)
• Esta complicación, reconocida en India y Sudán, suele presentarse entre los 6 meses y 3 años posteriores al tratamiento en el 10% de los casos de leishmaniosis visceral.
• Las lesiones consisten en una erupción macular, maculopapular y nodular.
• Habitualmente inicia en cara y se disemina a tronco y extremidades, de acuerdo a su severidad
• . En ocasiones se autolimita, pero en una buena parte de los casos requiere tratamiento, ya que puede persistir por años.
• Su alta mortalidad se relaciona con el inmucompromiso e infecciones secundarias.
DIAGNÓSTICO.
• Para considerar un diagnóstico presuntivo se deben tener en cuenta el cuadro clínico y los antecedentes epidemiológicos (residencia o visita a zonas endémicas).
• En la LV, los amastigotes se encuentran en aspirados de médula ósea, biopsia de bazo e hígado, procedimientos invasivos, que requieren de hospitalización.
• En la LCL y LMC se realizan raspado, biopsia, improntas y extendidos de las lesiones y ganglios linfáticos.
• En ocasiones el número de amastigotes presentes es escaso, sobre todo en lesiones de larga evolución, con reacción granulomatosa.
• En cambio, en la LCD las lesiones son abundantes en parásitos.
• La visualización de amastigotes se realiza al microscopio después de tinción con la técnica Giemsa.
• En diferentes estudios se reportan resultados variables mediante cultivo.
• Entre las pruebas inmunológicas cabe considerar a la prueba de ELISA, IFAT (Indirect fluorescence antibody test), inmunofluorescencia directa y la prueba de aglutinación directa (DAT). (Cota et al., 2013).
• La prueba de ELISA es positiva en etapas tempranas de la enfermedad y permite evaluar niveles de anticuerpos.
• Los pacientes con hipergammaglobulinemia presentan títulos elevados de IgG e IgM. La utilización de IFAT se encuentra restringida a unos cuantos centros de estudio.
• En la leishmaniasis cutánea y mucocutánea los niveles de anticuerpos son bajos.
• La intradermorreación de Montenegro, prueba de hipersensibilidad celular a antígenos de Leishmania es un método indirecto, utilizado en estudios epidemiológicos.
• Es positiva en las formas LCL y LMC, después de unos 30 - 90 días de haber adquirido la infección y se mantiene indefinidamente.
• En los casos de LV es negativa durante la enfermedad activa, y solamente se positiviza con el tratamiento, por lo que es útil, en forma conjunta con los anticuerpos, en el monitoreo de la evolución durante el tratamiento.
• En la enfermedad cutánea difusa (LCD) también resulta negativa.
• Para la discriminación entre especies, se requiere una batería de métodos de identificación. Se han empleado el cultivo de promastigotes con anticuerpos monoclonales y perfiles isoenzimáticos.
• Se utiliza la técnica de PCR (reacción en cadena de la polimerasa) para el diagnóstico y distinción de género y especie, la cual se encuentra restringida a algunos centros de investigación y de referencia diagnóstica (Boelaert M, et al. 2007; Fagundes Aline, et al. 2010).
DIAGNÓSTICO DIFERENCIAL.
• En el caso de la leishmaniosis visceral, se deben descartar: paludismo, tuberculosis miliar, brucelosis, fiebre tifoidea, histoplasmosis, esplenomegalia tropical, desnutrición, linfoma, leucemia, entre otros.
• Por otra parte, impétigo, picaduras infectadas de mosquitos, lupus vulgar, lepra, sífilis, cáncer de piel, lesiones causadas por amibas de vida libre y otras patologías, pueden simular un cuadro de leishmaniosis cutánea.
EPIDEMIOLOGÍA.
La leishmaniosis se encuentra distribuída en unos 88 países, en trópicos, subtrópicos y regiones templadas. Se considera que 310 millones de personas en el mundo están en riesgo de infección.
La forma más frecuente en América es la cutánea. La enfermedad se asocia principalmente con la penetración o residencia cercana de grupos humanos en regiones selváticas; se han reportado casos en México, Centroamérica, Sudamérica, Texas, con la excepción de Chile, Uruguay e islas del Caribe.
En México, la leishmaniosis se ha identificado en 22 entidades federativas, aunque se considera la mayor endemicidad en Chiapas, Oaxaca, Tabasco, Veracruz, Campeche, Yucatan y Quintana Roo. (Monroy et al., 2002; Sanchez et al., 2010). Afecta a ambos sexos, aunque se reporta con mayor frecuencia en sujetos del sexo masculino, con aumento en la incidencia a partir de los 9 años de edad (Dirección de Epidemiología, 2006).
• Elevado número de casos• Expansión geográfica • Emergente: la urbanización y la co-
infección Leishmania-HIV
Magnitud
• LV- Muerte (90%), si no tratada• LTA- deformidades y mutilaciones –
graves• Poblaciones pobres
Transcendencia
• Baja- Difíciles de controlar con herramientas disponiblesVulnerabilidad
Por qué es importante para la salud pública?
Leishmaniasis
2011: OPS: Programa Regional de Leishmaniasis en las Américas:
Plan de Trabajo – en ejecución
Objetivo: Controlar la morbilidad e mortalidad de las leishmaniasis en las Américas
Acciones destacadas 2007 - 2011
Leishmaniasis
Enfermedad zoonótica
Sindromes clínicas: compromete la piel, las mucosas o las vísceras de los humanos
15 especies de parasitos patogénicas al hombre
≈ 54 especies vectores probables o sospechoso
Principales Reservorios:
Mamiferos: marsupiales, carnívoros,
roedores, endentados
Leishmaniasis en las Américas
Creditos: LC: Zerpa,O LM: Soto,J
Ciclos de transmisión
selvático
domestico rural
doméstico urbano
Principales determinantes
Migración
deforestación
cambio climático
Leishmaniasis en las Américas
Diversidades
Factores
Vectores
Hospedero
Reservorio
Parásitos
soci
ales
ambientales
hu
man
os
biológicos
Leishmaniasis en las Américas
Enfermedad zoonótica
≈4.000 casos/año
7 a 22% Letalidad
98%: Brasil, Paraguay, Colombia, Argentina, y Venezuela
Casos esporádicos: Guatemala, Honduras, El Salvador, Nicaragua
Leishmaniasis visceral en las Américas
Casos de leishmaniasis visceral, según país, Américas, 2006 -2010
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Leishmaniasis visceral en las Américas
Casos y percentual de leishmaniasis visceral en Brasil y Américas, 2006 -2010
1000
1500
2000
2500
3000
3500
4000
4500
2006 2007 2008 2009 2010
Ano
Nº
caso
s
50
55
60
65
70
75
80
85
90
95
100
105
110
%
Americas Brasil %
Leishmaniasis visceral en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Nº de casos de Leishmaniose visceral, según países prioritários, Américas, 2006 -2010
Leishmaniasis visceral en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Medidas de controlVigilancia
El diagnóstico precoz y el
tratamiento de casos humanos
Redución populación del vector
Eliminación de reservórios (perros)
Actividades educación en salud
Casos humanos
Entomológica
Reservorios:ciclo doméstico
Leishmaniasis visceral en las Américas
Reducir la morbidad y letalidad Reducir el risco de transmissión
Objetivos
≈60.000 casos/ano
79%: Brasil, Perú e Colombia
Promedio anual de casos de leishmaniasis cutánea y mucosa,
Américas, 2006 - 2010
Leishmaniasis cutánea y mucosa Américas
Casos de leishmaniasis cutánea, según Región, Américas, 2006 -2010
0
10000
20000
30000
40000
50000
60000
70000
2006 2007 2008 2009 2010
Ano
Nº
caso
s
Américas Andina Conosur Centro América
Leishmaniasis cutánea en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Casos de leishmaniasis cutánea, según países de mayor ocurencia, Américas, 2006 -2010
Leishmaniasis cutánea en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
1000
4000
7000
10000
13000
16000
19000
22000
2006 2007 2008 2009 2010
Brasil Colombia Peru Nicarágua Panamá
Bolivia Venezuela Costa Rica Equador Honduras
Casos de leishmaniasis cutánea, según país y Región Centro América, 2006 -2010
Leishmaniasis cutánea en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Casos de leishmaniasis cutánea, según país y Región Andina, Américas 2006 -2010
Leishmaniasis cutánea en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Casos de leishmaniasis cutánea em Brasil y CONOSUR, Américas 2006 -2010
Leishmaniasis cutánea en las Américas
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Casos leishmaniasis tegumentaria y proporción de mucosa en las Américas, 2006 -2010
10000
20000
30000
40000
50000
60000
70000
80000
2006 2007 2008 2009 2010
1
1.5
2
2.5
3
3.5
4
4.5
5
Nº casos L T % LM
Fuente: OPS/OMS – Datos disponibles por los programas control de leishmaniasis de los Países
Leishmaniasis cutánea y mucosa en las Américas
Medidas de controlVigilancia
El diagnóstico precoz y el tratamiento de casos humanos
Redución populación del vectorGestión ambientalControl químico si hay indicación
Actividades educación en salud
Casos humanos
Entomológica
Reducir la morbidad Reducir las formas graves : LM
Objetivos
Leishmaniasis cutánea y mucosa en las Américas
Apoyar los Programas Nacionales de la leishmaniasis en las Américas
Fortalecimiento de la gestión y el sistema de vigilancia de la leishmaniasis
Misiones y visitas técnicas
Establecimiento de Cooperaciónes Técnicas
Estandarización de normas y metodologías Regionales
Capacitación de recursos humanos
Estimular acciones interpaises en las áreas de fronteras
Apoyo y estimulo de proyectos y acciones para el control integrado de las
enfermedades vectoriales y desatendidas
Leishmaniasis en las Américas Acciones 2011-2015
Actualización de las informaciones sobre la leishmaniasis en las Américas y viabilizar un sistema de captura anual de los datos.
Levantamiento y actualización de las informaciones de leishmaniasis en los países endémicos:
Apoyar los países en las análisis de informaciones:
Estimulo las análisis espaciales y geográficas
validación de metodologías para estratificación de áreas de leishmaniasis según riesgo epidemiológico
Definición de áreas de riesgo y estandarización de las acciones de vigilancia y control:
Priorización de las áreas optimización de recursos humanos, material y otros insumos mayor efectividad Mejor impacto en los acciones
Leishmaniasis en las Américas Acciones 2011-2015
Apoyar los países en las análisis de informaciones:
Conocer y monitorear los indicadores de impacto y de proceso de interés para los programas de leishmaniasis
Elaborar y divulgar el Informe de leishmaniasis en las Américas
Fortalecer las acciones del diagnóstico clínico, de laboratorio y el tratamiento de la leishmaniasis en la región de las Américas.
Garantizar la disponibilidad del diagnóstico y medicamentos específicos para el tratamiento de pacientes con leishmaniasis,
Estimular los países para adquirir los medicamentos y otros insumos en el Fondo estratégico de la OPS : 2011 (preparación) 2012 (participación de los países)
Apoyar en las capacitaciones en diagnostico y tratamiento
Leishmaniasis en las Américas Acciones 2011-2015
) Estandarización de normas del control de las leishmaniasis en las Américas: "OMS Technical Report Series 949–Control of the Leishmaniasis" (2010)
Casos humanos: diagnostico, tratamiento, seguimiento y criterios de curación ( Em etapa final de elaboración)
Vector:
Vigilancia entomológica: metodologías para captura y monitoreo
Control vectores: indicaciones y metodologías para el uso de
control químico
Prevención: gestión ambiental
Reservorio doméstico:
Vigilancia canina: Indicación de monitoreo en perros
Control en perros: Indicación y estandarización de las acciones
Leishmaniasis en las Américas Acciones 2011-2015
Gestión de los Conocimientos:
Divulgación de informaciones y artículos de leishmaniasis de interés
Discusión y elaboración de cursos de formación a distancia:
clínica, diagnóstico y tratamiento de los casos
vigilancia y el control
Establecer colaboraciones técnicas con redes nacionales en
leishmaniasis para atender las necesidades en la Región.
Fomento para la promoción e inversión en investigación
Aclarar la dinámica de transmisión de Leishmania en humanos, reservorios y vectores
Conocer, estudiar el comportamiento y la estacionalidad del vector
Leishmaniasis en las Américas Acciones 2011-2015
Fomento para la promoción e inversión en investigación
Mejorar el diagnóstico de laboratorio de la leishmaniasis visceral
Evaluar el desempeño de las pruebas rápidas de diagnóstico de la LV
en los perros
Perfeccionar el diagnóstico laboratorial para las leishmaniasis
Validar o desempeño de pruebas rápidas para LV humana y en perros
Apoyar el desarrollo y evaluaciones de tecnologías para la vigilancia y
control de las leishmaniasis
Vacunas,
Pruebas diagnósticas más sensible y específica,
Collares impregnados,
Ensayos controlados para evalluar la eficácia y seguridad de los
tratamientos locales y combinaciones de medicamentos.
Obtener recursos para el mantenimento y la sostenibilidad de las acciones de vigilancia, prevención y control de las leishmaniasis en la Región.
Desarrollar sistema de información que responda las necesidades de vigilancia y control de las leishmaniasis en la Región y permita mantener actualizada las informaciones epidemiológicas en las Américas.
Apoyar los paises para el fortalecimento de las acciones de control de las leishmaniasis en las Américas:
Garantizar la disponibilidad de diagnostico y tratamiento gratuito a los pacientes con leishmaniasis en la Región.
Leishmaniasis en las Américas Desafíos
Estimular y apoyar los países para adquisición de los medicamentos y diagnósticos específicos de leishmaniasis
Garantizar la calidad de los medicamentos
Acceso a bajo costo.
Reducir la letalidad de leishmaniasis visceral
Reducir la proporción de leishmaniasis mucosa: Bolivia, Peru y Brasil
Leishmaniasis en las Américas Desafíos
Fondo estratégico OPS
Desarrollo y dispobilidad de nuevas ferramientas para prevención y control
Estimular proyectos y acciones integradas con las enfermedades desatendidas.
Fomentar integración entre las areas de investigación y Programa de control de las leishmaniasis en los países de la Región
Evalluación del costo efectividad de las acciones de control de las leishmaniasis en la Región.
Leishmaniasis en las Américas Desafíos
Muchas Gracias
“El trabajo integrado unifica y fortalece…”