Diapositivas PH
-
Upload
andrea-stevens -
Category
Documents
-
view
405 -
download
0
description
Transcript of Diapositivas PH
Reacciones Qumicas
Reacciones Qumicasa. cido base: tiene lugar una transferencia de protones.
b) Redox: tiene lugar una transferencia de electrones.
c) Precipitacin: se forma un compuesto insoluble que precipita en estado slido.
1cidos y BasesTienen un sabor caracterstico agrio, enrojecen el papel de tornasol, son capaz de disolver el mrmol y reaccionan fcilmente con las bases obtenindose la sal correspondiente. Por ejemplo: H2SO4 + 2 Na(OH) Na2SO4 + H2O
Reaccionan con los xidos de los metales, dando la sal correspondiente, por ejemplo: 2 HCl + K2O 2 KCl + H2OReaccionan con muchos metales, disolvindolos y desprendiendo hidrgeno: 2 HCl + Zn ZnCl2 + H2
Las bases o lcalis, tienen un sabor amargo, una sensacin jabonosa al tacto, colorean de azul el papel de tornasol y reaccionan con los cidos para formar las sales correspondientes.ACIDOS BASESARRHENIUSSustancia que en disolucin acuosa es capaz de dar protones iones hidronio (H+).
Sustancia que en disolucin acuosa es capaz de dar iones hidroxilos (OH-). EVOLUCIN DEL CONCEPTO ACIDO-BASE
La teora de Arrhenius permite dar una explicacin satisfactoria de la fuerza de un cido, por ejemplo en la reaccin: pero, el agua al ser el disolvente de una disolucin acuosa diluida, est en exceso, siendo su concentracin prcticamente constante, entonces se define una nueva constante de equilibrio llamada constante de acidez (Ka) como:
donde Ka es la constante de disociacin de un cido.
Un cido fuerte ser aquel que ceda muchos protones (H+), por lo tanto, a mayor Ka, el cido ser ms fuerte.Los cidos poliprticos poseen varias constantes de ionizacin, tantas como protones puedan ceder en disociaciones sucesivas, siendo cada vez ms pequeas. Por ejemplo:
De forma similar, la disociacin de una base ser: B(OH) B+ + OH- a mayor Kb, la base ser ms fuerte.
a mayor Kb, la base ser ms fuerte.Con frecuencia se utiliza, en lugar de Ka y Kb, las constantes pKa y pKb, que se definen en una escala logartmica decimal de la siguiente manera:pKa = log Ka y pKb = log Kby al ser pKa inversamente proporcional a Ka, tambin lo es la fuerza relativa del cido. Lo mismo ocurre con las bases.
Un procedimiento que nos permite, de forma aproximada, determinar la fuerza de un oxocido es la llamada Fuerza relativa de cido, o FRA. Consiste en restar al nmero de tomos de oxgeno el de los hidrgenos y establecer la siguiente relacin:
evidentemente, es una forma aproximada de comparar fuerzas relativas de unos cidos con otros, pero no me permite saber cul es ms fuerte si el clculo anterior es el mismo. Desde luego, la mejor forma de comparar la fuerza de los cidos (o de las bases) es a travs sus constantes de acidez (o de basicidad).
F.R.A.Fuerza del cidoEjemplos3cido muy fuerteHClO4,2cido fuerteHNO3 , H2SO41cido dbilH2CO3 , H3PO40cido muy dbilH3PO3 , H2CO2La teora de Brnsted Lowry plantea que cuando una sustancia pierde un protn, se est comportando como un cido.
Pero una vez se ha desprendido de l, como las reacciones son de equilibrio, podra volver a cogerlo por lo que se transforma en una base, la base conjugada del cido.
De manera similar, una base acepta protones, pero una vez lo ha captado, puede desprenderse de l, transformndose en un cido, su cido conjugado:cido1 + base2 base1 + cido2el cido1 y la base1 forman lo que se denomina un par cido base conjugado, (al igual que el cido2 y la base2).
La principal ventaja de esta teora es que permite ordenar de mayor a menor la fuerza de los cidos. HCl + NH3 Cl- + NH4+Segn esta definicin, en la reaccin el amoniaco es una base ya que tiende a aceptar los protones cedidos por el cido.
Estructuralmente una sustancia es un cido en potencia si posee tomos de hidrgeno.Y sera una base en potencia si posee algn tomo con un par o ms de electrones no enlazantes en los que el protn queda unido mediante un enlace covalente coordinado o dativo capaz de ceder protones a otra. Segn la citada teora, una sustancia actuar como cido frente a otra de menor acidez y como base frente a otra de mayor acidez, es decir, que hasta un cido puede actuar como base; por ejemplo:
HClO4 + HNO3 NO2ClO4 + H2Ocido base
el cido perclrico libera un protn por lo que se comporta como cido, mientras que el cido ntrico aqu acta como base ya que lo capta.
Por lo tanto, una sustancia actuar como base frente a cualquier otra sustancia que sea un cido ms fuerte que l, (en este caso, el cido perclrico es ms fuerte que el cido ntrico).
Se denominan sustancias anfteras o anfiprticas a aquellas que pueden actuar como cido o como base segn el medio en el que se encuentren. Este es el caso del agua o del ion bisulfato entre otros:- como cido HSO4- + OH- SO4-2 + H2O
- como base HSO4- + H3O+ H2SO4 + H2ODe forma anloga a la teora de Arrhenius, tambin se definen las constantes de acidez y basicidad como:
HA + H2O A- + H3O+
B + H2O BH+ + OH-
constantes de acidez y basicidad de los cidos ms comunesFuerzacidoBase conjugadaKapKacidosHClO4ClO4---fuertesHCl, HBr, HICl-, Br-, I---HNO3NO3---Ka > 55,55H2SO4HSO4---H3O+H2O5555- 174cidosHIO3IO3-19.10-1072semifuertesH2SO3HSO3-17.10-2177HSO4-SO4-212.10-219255,55 > Ka > 10-4HClO2ClO2-10.10-2200H3PO4H2PO4-75.10-3212HCOOHHCOO-18.10-4374cidosCH3COOHCH3COO-18.10-5474dbilesH2CO3HCO3-43.10-7637H2SHS-91.10-870410-4 > Ka > 10-10H2PO4-HPO4-262.10-8721NH4+NH356.10-10925HCNCN-49.10-10931cidosHCO3-CO3-260.10-111022muy dbilesHIOIO-10.10-111100HPO4-2PO4-348.10-131232Ka < 10-10HS-S-210.10-131300H2OOH-18.10-161574constantes de acidez y basicidad de las bases ms comunesFuerzaBasecido conjugadoKbpKbBasesLi(OH), K(OH)Li+ , K+--fuertesNa(OH)Na+--Ca(OH)2Ca+2--Ba(OH)2Ba+2--BasesCO3-2HCO3-17.10-4377dbilesCN-HCN20. 10-5469NH3NH4+18. 10-5475N2H4N2H5+90. 10-7605BasesNH2OHNH3OH+10. 10-9900muy dbilesC6H5NH2C6H5NH3+38. 10-10942EQUILIBRIO ACIDO-BASE EN SOLUCION ACUOSALas concentraciones en soluciones acuosa se expresan en moles/litros ( M ).Las reacciones qumicas en soluciones acuosa dependen de la [H+] de tal manera que pueden estudiarse la disociacin de cidos y bases dbiles de inters en los procesos biolgicos en donde muchas molculas presentan este comportamientoAutoionizacin del agua. Escala de pH.Segn BrnstedLowry hay sustancias que actan como bases y otras como cidos, y sto depende de con quin acten. Por ejemplo: H2O + H2O H3O+ + OH-cido1 base2cido2 base1esta autoionizacin del agua es pequea pero medible. Si escribimos la ley de equilibrio: ley de Roul
considerando la [H2O] como constante, resulta:Kw = K . [H2O] = [H3O+].[OH-]que es la constante de autoionizacin del agua, que a 25C toma el valor de:Kw = [H3O+].[OH-] =10-14
En una disolucin, se pueden dar las siguientes situaciones:- si [H3O+] > [OH-], es decir [H3O+] > 10-7 disolucin cida.- si [H3O+] = [OH-] = 10-7 disolucin neutra.- si [H3O+] < [OH-], es decir [H3O+] < 10-7 disolucin bsica.Sin embargo, para expresar la acidez o basicidad de una disolucin, es ms cmodo utilizar un parmetro llamado pH, que se define como:pH = log [H3O+]entonces:Para disoluciones neutras pH = 7Para disoluciones cidas pH < 7Para disoluciones bsicas pH > 7
Tambin se puede definir el pOH como:
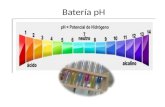
pOH = log [OH-]y, a 25 C, se debe cumplir la relacin:pH + pOH = 14ESCALA DE PHPHH+OH-POHAcido de batera010010-1414Acido estomacal110-110-1313Jugo de limn310-310-1111Agua de soda310-410-1010Caf negro510-510-99Agua pura710-710-77Bicarbonato de sodio910-910-55Jabn de tocador1010-1010-44Detergentes1110-1110-33Limpiadores caseros1310-1310-11Limpiadores de caera1410-141000Clculo del pH de disoluciones cidas y bsicas.cidos y bases fuertes.Los cidos y bases fuertes se disocian completamente, por lo tanto, al final de la disolucin no quedar nada del cido (o de la base) y de acuerdo con la estequiometra de la reaccin es fcil calcular la concentracin de iones H3O+ (o de OH) y a partir de ah su pH.cidos y bases dbiles.Si el cido o la base son dbiles, el problema se reduce a calcular la concentracin de iones H3O+ (o de OH) teniendo en cuenta que se trata de un equilibrio que viene determinado por su constante de acidez (Ka) o de basicidad (Kb).
Hidrlisis.La hidrlisis es una reaccin cidobase que se produce al disolver determinadas sales en agua. La reaccin tiene lugar entre uno de los iones de la sal y el agua y, hay que tener en cuenta que se trata de una reaccin de equilibrio. Slo pueden dar hidrlisis los siguientes iones:a) Los aniones, (carga negativa), procedentes de los cidos dbiles (Ka pequeas).b) Los cationes, (carga positiva), procedentes de las bases dbiles (Kb pequeas).Cabe distinguir cuatro casos:
Sales de cido fuerte y base fuerte.Estas sales no se hidrolizan. Todas las sales se disocian completamente en sus iones (ya que son compuestos inicos), pero en el caso de las sales de cido fuerte y base fuerte, estos iones no reaccionan con el agua. Por ejemplo:Na2SO4 2 Na+ + SO4-2 (reaccin totalmente desplazada)H2SO4 + 2 H2O SO4-2 + 2 H3O+al ser un cido fuerte, esta reaccin tambin estar muy desplazada, por lo tanto la reaccin inversa, es decir, la del anin con el agua para volver a dar el cido, no se podr dar (y sta sera la reaccin de hidrlisis).Para el otro ion de la sal (Na+), al proceder de una base fuerte, le ocurrir lo mismo:Na(OH) Na+ + OH-esta reaccin est totalmente desplazada a la derecha, por lo que la reaccin inversa, la del catin con el agua para volver a dar el hidrxido sdico, nunca se dar.
Sales de cido fuerte y base dbil.En este caso, el anin no se hidrolizar ya que proviene de un cido fuerte, pero si se hidrolizar el catin ya que proviene de una base dbil.
Darn lugar a soluciones acuosas cidas puesto que el catin reacciona con el agua para dar protones.Vamos a ver un ejemplo con la sal de cloruro amnico (NH4Cl):(reaccin totalmente desplazada)el anin no reaccionar con el agua al provenir de un cido fuerte:Cl- + H2O no reacciona el catin al provenir de una base dbil reacciona con el agua de la siguiente manera (y sta es la reaccin de hidrlisis):NH4+ + 2 H2O NH4OH + H3O+la constante de esta reaccin de hidrlisis ser: