Corea autoinmune en el adulto -...
Transcript of Corea autoinmune en el adulto -...
29Copyright © 2013 by AAN Enterprises Inc.
La enfermedad de Huntington es lo primero que considera un neurólogo cuando evalúa a un adulto con corea. A veces la etiología autoinmune es ignorada: paraneoplásica, parainfecciosa o idiopática. Los trastornos prototí-picos incluyen la corea paraneoplásica asociada a CRMP5 (proteína mediadora de la respuesta de colapsina tipo 5)-inmunoglobulina (Ig) G1 (generalmente relacionada al carcinoma de células pequeñas) y la corea idiopática asociada al anticuerpo antifosfolípido.2 La corea de Sydenham, un trastorno inmuno-mediado parainfeccioso, no posee un autoantígeno probado y es rara en los adultos mayores.3 Hay pocos datos publicados sobre las caracterís-ticas clínicas y serológicas para poder distinguir entre las coreas autoinmunes del adulto, que nos guíen en el tra-tamiento o nos informen sobre su evolución. Este informe describe nuestra experiencia con coreas autoinmunes del adulto a lo largo de 16 años y compara las formas autoinmunes paraneoplásica e idiopática.
MÉTODOS Pacientes. Este estudio utilizó el índice central informatizado de diagnósticos de la Mayo Clinic, y fue aprobado por el
Comité de Revisión Institucional (IRB 08-6647) de la Mayo Clinic. Se revisaron 2.634 registros médicos de pacientes vistos entre el 1
de enero de 1997 y el 1 de junio de 2012, con 1 o más diagnósticos de movimiento anormal hiperquinético (corea, distonía, disquine-
Corea autoinmune en el adulto
Orna O’Toole, MDVanda A. Lennon, MD, PhDJ. Eric Ahlskog, PhD,MDJoseph Y. Matsumoto, MDSean J. Pittock, MDJames Bower, MDRobert Fealey, MDDaniel H. Lachance, MDAndrew McKeon, MD
Dirección para correspondencia al
Dr. McKeon:
GLOSARIOAChR = receptor de la acetilcolina; ANNA-1 = anticuerpos nucleares antineuronales tipo 1; CASPR2 = proteína-símil 2 asociada a
la contactina; CRMP-5 = proteína mediadora de la respuesta de colapsina tipo 5; GABA = ácido -aminobutírico; GAD65 = isoforma
65-kDa de la ácido glutámico descarboxilasa; Ig = inmunoglobulina; LES = lupus eritematoso sistémico; LGI1 = proteína 1 inactivada
del glioma rico en leucina; VGCC = canal de calcio voltaje-dependiente; VGKC = canal de potasio voltaje-dependiente.
RESUMEN
Objetivo: Determinar las características de la corea autoinmune del adulto y comparar los subgrupos
paraneoplásico e idiopático.
Métodos: Mayo Clinic (Rochester, MN), des-
de 1997 a 2012. Se revisaron los registros médicos y datos de laboratorio, y se compararon los casos
no paraneoplásicos (n = 22) con los paraneoplásicos (n = 14).
Resultados: Veintiún pacientes fueron mujeres (58%). La mediana de la edad de inicio de los síntomas
-
-
-
po idiopático, 19 de los 22 pacientes tenían un trastorno autoinmune coexistente (los más frecuentes
-
co tenía un promedio de edad mayor (p = 0,001), eran en su mayoría hombres (p
mayor pérdida de peso (p = 0,02) y, frecuentemente, tenían neuropatía periférica (p = 0,008).
Conclusiones: La corea autoinmune es una enfermedad rara de inicio rápido. Ser hombre, de edad
mayor, con corea severa, neuropatía periférica coexistente y pérdida de peso, aumentan la posibi-
lidad de tener cáncer. Neurology® 2013;80:1133-1144
De los Departments of Neurology (O.O., V.A.L., J.E.A., J.Y.M., S.J.P., J.B., R.F., D.H.L., A.M.), Laboratory Medicine and Pathology (V.A.L., S.J.P.,
D.H.L., A.M.), and Immunology (V.A.L.), Mayo Clinic, College of Medicine, Rochester, MN.
Ir a Neurology.org para declaraciones de intereses completas. Aquellas relevantes para los autores, si existiesen, se encuentran al +nal del artículo.
Neurology Edición Argentina Julio/Agosto, 2013
RESULTADOS De los 36 pacientes, 21 fueron mujeres (58%), y la mediana de la edad de inicio fue 67 años (rango 18-87 años). Todos fueron evaluados por un neurólogo del equipo de la Mayo Clinic alrededor de un promedio de 5 meses luego del inicio de los sínto-mas (rango 0.25-120 meses). El inicio fue subagudo en 34 pacientes y no estaba documentado en 2. Tres pacientes eran del Condado Olmsted, MN, lo que da una incidencia estimada de 1,5 por millón de personas por año (usando una población promedio anual para el condado de 132.905 [1997–2011], y asumiendo que todos los pacientes con corea autoinmune habían sido vistos en la Mayo Clinic). Una revisión de los registros con+rmó que los mo-vimientos adventicios efectivamente eran coreiformes (semidirigidos, no estereotipados, yendo de un múscu-lo a otro; videos 1-4). La corea fue generalizada en 16 pacientes (44%) y focal en 20 (56%), pero se transfor-mó en generalizada en otros 12 pacientes. Las distribu-ciones focales incluyeron una hemicorea en 9 pacientes, de miembros en 8 pacientes (1 miembro, 6 pacientes; ambos brazos, 1 paciente; ambas piernas, 1 paciente) y facial y/o lingual en 3 pacientes. Los movimientos sacádicos anormales de los ojos fueron registrados en 4 pacientes (11%, todos en el grupo paraneoplásico). En 3 pacientes (16, 19 y 27) el inicio de la corea fue dentro de los 3 meses luego de iniciar un tratamiento hormo-nal (estrogénico, 2; progesterona sola, 1). La corea no paró luego de discontinuar la medicación. No hubo reportes de historia familiar de corea, pero 13 de 33 pacientes (40%) reportaron historia familiar de enfermedad autoinmune. Fueron conside-radas pero excluidas mediante pruebas sanguíneas las siguientes etiologías neurodegenerativas: enfermedad de Huntington, 10 pacientes; atro+a dentatorrubro-palidoluysiana, 3 pacientes; y neuroacantocitosis, 2 pacientes. Se registró historia de tabaquismo en 23 pa-cientes (64%; 86% de los casos paraneoplásicos). La RMN de encéfalo no aportó al diagnóstico en ningún caso. Se observó evidencia de infartos lacunares cró-nicos en los ganglios basales, en el contexto de otros cambios isquémicos generalizados, en 4 pacientes. Uno o más anticuerpos neurales fueron detectados en 15 pacientes (42%). La prueba de inmuno=uorescen-cia no reveló ninguna selectividad en la unión de IgG sérica a los ganglios basales. La información sobre el seguimiento (mediana 12 meses; rango 2-228 meses) estuvo disponible en 33 pacientes (96%).
Grupo paraneoplásico. La mediana de la edad de ini-cio de los síntomas fue 72 años (rango 59-87 años) y 10 de los 14 pacientes (71%) eran hombres (tabla e-1). Seis informaron un inicio focal de los síntomas; el resto tuvo un inicio generalizado. Según la clasi+-cación médica (reportada para 11 pacientes), la corea fue moderada o severa en 9 y leve en 2. Diez pacientes (71%) informaron una pérdida de peso reciente ma-yor a los 4 kg (mediana 11; rango 4-22 kg). La corea estuvo acompañada de síntomas/trastornos neurológi-cos adicionales en 12 pacientes. La neuropatía perifé-rica fue el más común (6, dolorosa en 3). En 7 pacien-tes se encontraron 1 o más enfermedades autoinmunes coexistentes: hipotiroidismo, 4; enfermedad celíaca, 3; diabetes mellitus, 1 y artritis reumatoidea, 1.
30
sia, hemibalismo, temblor mioclónico), para quienes las notas de
consultas médicas contenían términos de búsqueda tales como
anticuerpo; inmune; autoinmune; paraneoplásico; prednisona; este-
roide; inmunoglobulina endovenosa; IgEV; intercambio de plasma;
plasmaféresis; Sydenham y gravídica. De estos 460 registros médi-
cos, identi+camos 36 pacientes que habían tenido una presenta-
ción neurológica en la que predominaba la corea y la sospecha de
una etiología autoinmune. Estos 36 pacientes fueron separados
en 2 grupos: 1) el grupo paraneoplásico (n = 14), con inicio de
la corea en los primeros 2 años luego del diagnóstico de cáncer
activo o acompañada de un autoanticuerpo en suero o LCR con
un alto valor predictivo positivo para cáncer, tales como los anti-
cuerpos nucleares antineuronales tipo 1 (ANNA-1) o el CRMP-
5-IgG; o 2) el grupo idiopático (n = 22), con hallazgos clínicos,
serológicos o de LCR (aumento en ≥ 1 de los siguientes: protei-
norraquia [> 50 mg/dl], recuento de glóbulos blancos, índice de
IgG, tasa de síntesis de IgG o bandas oligoclonales) compatibles
con autoinmunidad, pero sin evidencia o factores de riesgo para
cáncer, y con mejoría neurológica luego de la prueba inmunote-
rapéutica o de forma espontánea. Hay videos disponibles docu-
mentando los movimientos coreiformes de 4 pacientes (videos
1–4 en el sitio web de Neurology® en www.neurology.org.).
No identi+camos ningún paciente con una etiología parain-
fecciosa de aparición en la edad adulta; 3 pacientes habían teni-
do un inicio de corea de Sydenham en la infancia y los síntomas
habían persistido luego de los 18 años. Se diagnosticó corea gra-
vídica en 3 pacientes, pero estos fueron excluidos del estudio: 2
no tenían una causa autoinmune identi+cada; 1 tenía una corea
de Sydenham de inicio en la infancia que empeoró durante el
embarazo.
Métodos de laboratorio. Todos los métodos de ensayo fueron
descriptos previamente.4-8 El suero y el LCR fueron analizados
mediante un ensayo de inmuno=uorescencia indirecta estanda-
rizado en un sustrato de cerebelo, mesencéfalo, ganglios basales,
tálamo, corteza cerebral, hipocampo, estómago y riñón de ratón,
para detectar autoanticuerpos IgG que se unieran selectivamente a
núcleos neuronales y gliales (ANNA-1 [anti-Hu], tipo 2 [anti-Ri]
y tipo 3; anticuerpo antiglial/neuronal, tipo 1 [anticuerpo AGNA
o SOX-1]), al citoplasma neuronal (anticuerpos contra célula de
Purkinje [tipos 1 {anti-Yo}, 2, y Tr], CRMP-5–IgG, y an++sina-
IgG), o a las sinapsis hipocámpicas y de ganglios basales.
Se buscaron las IgG especí+cas para receptores de neuro-
transmisores con inmuno=uorescencia indirecta en las sinapsis
hipocámpicas (NMDA [GluN1], AMPA [ácido propiónico
-amino-3-hidroxi-5-metil-4-isoxazol] [GluA1 y GluA2] y ácido
-aminobutírico [GABA]B), en células HEK293 transfectadas
con cADN apropiados (Euroimmun, Lübeck, Alemania).
Se detectaron con ensayo de radioinmunoprecipitación
aquellos anticuerpos reactivos a complejos de canales catiónicos
(canales de calcio voltaje dependientes neuronales [VGCC, tipo
P/Q y tipo N], complejos de canales de potasio voltaje depen-
dientes [VGKC], receptores nicotínicos de acetilcolina [AChR]
del tipo de músculo esquelético [subunidad 1 y del tipo de
ganglio neuronal [subunidad 3]) y a la isoforma 65-kDa de
la ácido glutámico descarboxilasa (GAD65). Los anticuerpos
contra músculo estriado esquelético fueron detectados mediante
ELISA. Adicionalmente, se buscaron CRMP-5–IgG y an++si-
na-IgG mediante ensayos recombinantes de Western blot. Los
sueros positivos para el complejo VGKC-IgG fueron testeados
para IgG reactiva a la proteína 1 inactivada del glioma rico en
leucina (LGI1) y a la proteína-símil 2 asociada a la contactina
(CASPR2) mediante un ensayo de inmuno=uorescencia basado
en células (Euroimmun).
Métodos estadísticos. Comparamos los datos relacionados a los
hallazgos demográ+cos y clínicos, de tratamiento y de evolución
(reportados por el médico), de los grupos paraneoplásico e idio-
pático, utilizando el test de Fisher y el Wilcoxon rank sum test
según correspondiera.
Neurology Edición Argentina Julio/Agosto, 2013 31
Al menos 1 cáncer fue diagnosticado en el período de los 2 años posteriores al inicio de la corea (13 de 14 pacientes); 6 pacientes tuvieron 1 o más anticuerpos paraneoplásicos altamente predictivos de cáncer (in-cluye 1 paciente en el cual el cáncer no fue encontra-do) (tabla 1). Se documentaron múltiples neoplasias en 5 pacientes; 3 tenían múltiples cánceres coexisten-tes; 2 tenían una historia remota adicional de cáncer. Los 19 cánceres identi+cados fueron (tabla 1): carci-noma pulmonar de células pequeñas, 4; carcinoma pulmonar de células no pequeñas, 3; hematológico, 3 (linfoma de Hodgkin, linfoma no-Hodgkin y leuce-mia mieloide crónica); adenocarcinoma colorrectal, 2; adenocarcinoma de próstata, 2; carcinoma de células escamosas de la amígdala, 1; carcinoma de vejiga, 1; adenocarcinoma de mama, 1; adenocarcinoma pan-creático, 1; adenocarcinoma gástrico, 1. El paciente 4 (un fumador) desarrolló la corea 178 meses después de habérsele diagnosticado un carcinoma de células escamosas de la amígdala; la detección de CRMP-5-IgG al momento de presentarse la corea fue predictivo de carcinoma de células pequeñas, pero ninguno fue encontrado. Los anticuerpos neurales con valor altamente predictivo de cáncer incluyeron el CRMP-5-IgG, 5 pacientes; ANNA-1, 3; ANNA-2, 1 y an++sina-IgG, 1. Los anticuerpos neurales con bajo valor predictivo de cáncer incluyeron el GAD65, 3 pacientes; VGCC (tipo P/Q), 2; estriatal, 2 y VGCC (tipo N), 1. Nin-gún paciente tuvo anticuerpos contra los receptores NMDA, AMPA o GABA
B detectables. Dos pacientes
tenían anticuerpos fosfolipídicos, pero ninguno tenía manifestaciones del síndrome antifosfolipídico (even-to trombótico o aborto). De 3 pacientes a los cuales se les estudió el ASTO, 1 tuvo un valor elevado; no se detectó evidencia de una infección activa por estrep-tococo al inicio de la corea y estudios secuenciales no revelaron un aumento en el valor. La corea mejoró en 3 de 7 pacientes que recibie-ron terapia oncológica y en 5 de 11 que recibieron inmunoterapia (tabla 1). La mejoría relacionada con la inmunoterapia estuvo asociada con el uso de cor-ticoides como monoterapia (2 de 6 pacientes), con plasmaféresis (1 de 3 pacientes), con la ciclofosfamida (2 de 3 pacientes) y con los corticoides combinados con IgEV (2 de 2 pacientes). La mejoría también fue variable con terapias sintomáticas (6 de 12 pacientes, tabla 1). Cuatro pacientes informaron efectos adver-sos por la terapia: empeoramiento de los movimientos hiperquinéticos, 1 (haloperidol) y de la disartria, 1 (al-prazolam). La mejoría espontánea se informó en 8 pacientes, no sostenida en 7 y remisión completa en 1 (tabla 1). En el último seguimiento, 2 pacientes habían muerto de carcinoma metastásico.
Grupo idiopático. La mediana de la edad de inicio de los síntomas fue 45 años (rango 18-87 años), y 17 de los 22 pacientes (77%) eran mujeres (tabla e-2). Catorce reportaron un inicio focal, segmen-tario o hemisíntomas (64%). Según la evaluación médica (informaron para 21 pacientes), la corea fue moderada o severa en 9 (42%) y leve en 12 (58%). Siete pacientes (32%) reportaron una pérdida de
peso reciente mayor a los 4 kg (mediana 11; rango 4-13 kg). La corea estuvo acompañada de síntomas/trastornos neurológicos adicionales en 14 pacientes (tabla e-2). Los síntomas cognitivos o de comporta-miento fueron los más comunes (9 pacientes) y eran leves excepto por el paciente 15, que desarrolló un cambio severo de la personalidad (desinhibición y juicio reducido).Un paciente tenía neuropatía peri-férica. En 19 pacientes (tabla 2) se encontraron una o más enfermedades autoinmunes coexistentes: lupus eritematoso sistémico (LES), 8; síndrome antifosfoli-pídico, 8 (6 tenían LES, 5 tenían 1 o más episodios de trombosis arterial o venosa, y 3 tenían historia de 1 o más abortos); síndrome de Sjögren, 4; artritis reu-matoidea, 3; púrpura trombocitopénica autoinmune, 3; enfermedad tiroidea autoinmune, 3 y diabetes me-llitus, 2. Los autoanticuerpos no neurales detectados incluyeron los siguientes: anticuerpo fosfolipídico o anticoagulante lúpico, 18; anticuerpo antinuclear (ANA, 14; especi+cidad de antígeno nuclear extraí-ble, 7; especi+cidad ADN doble cadena, 5); factor reumatoideo, 3 y anticuerpo antiperoxidasa, 1. Se detectaron uno o más autoanticuerpos neurales en 6 pacientes (tabla 2): GAD65, 3; VGCC tipo N, 1; AChR del músculo, 1; estriatal, 1; complejo VGKC, 1. Ningún paciente tuvo síndrome del hombre rígi-do, síndrome de Lambert-Eaton o miastenia gravis. Una evaluación posterior del paciente 15 reveló que el anticuerpo contra el complejo VGKC (0,20 nmol/l; normal ≤ 0,02 nmol/l) era especí+co para CASPR2-IgG; no se detectó LGI1-IgG. Cuatro de 6 pacientes a los cuales se les midió an-ticuerpo antiestreptolisina O, tuvieron un valor ele-vado, pero ninguno tuvo elevaciones posteriores en el estudio secuencial. No se detectó evidencia de una infección activa por estreptococo al inicio de la corea y ningún paciente tenía antecedentes de +ebre reumáti-ca o enfermedad cardíaca valvular. La mejoría de la corea relacionada con la inmu-noterapia estuvo asociada con el uso de corticoides como monoterapia en 14 pacientes, corticoides com-binados con IgEV en 1 y azatioprina sola en 1 (tabla 2). Siete tuvieron una remisión completa o casi com-pleta; 4 recayeron cuando la dosis de esteroides se redujo. Las drogas no esteroideas permitieron mante-ner la remisión: hidroxicloroquina, 6; azatioprina, 5; ciclofosfamida, 1 y micofenolato mofetil, 1. La me-joría o remisión espontánea fue reportada en 13 pa-cientes; para 5 de estos pacientes, la inmunoterapia no fue necesaria. Las terapias sintomáticas fueron be-ne+ciosas en 4 de 15 pacientes tratados (tabla 2). Los efectos colaterales reportados incluyeron sedación, 2; parkinsonismo, 1; bradifrenia, 1 y exacerbación de síntomas autonómicos, 1. En el último seguimiento, 3 pacientes habían muerto: 1 de insu+ciencia cardía-ca, 1 de trombosis venosa cerebral y 1 de causa des-conocida.
Comparación de los grupos paraneoplásico e idio-pático. En el grupo paraneoplásico los pacientes eran más viejos (p = 0,001) y tenían mayor cantidad de hombres (p = 0,006). También fue más frecuente en este grupo la pérdida de peso (p = 0,02) y la neuropatía periférica coexistente (0,008) (tabla 3).
32
Tab
la 1
Au
toan
ticu
erp
os s
éri
co
s, h
allazg
os o
nco
lóg
ico
s y
de L
CR
, y d
ato
s d
el tr
ata
mie
nto
y e
vo
lució
n d
el g
rup
o p
ara
neo
plá
sic
o
Mes
es d
esd
e el
inic
io d
e la
co
rea
al c
ánce
r (+
)
En
ferm
edad
M
ejo
ría/
Pac
ien
te
H
alla
zgo
s D
iag
nó
stic
o
o d
el c
ánce
r a
auto
inm
un
e
Te
rap
ia
Evo
luci
ón
Te
rap
ia
Evo
luci
ón
de
rem
isió
nn
ro.
An
ticu
erp
os
LC
R
de
cán
cer
la c
ore
a (-
) co
exis
ten
te
Inm
un
ote
rap
ia
Evo
luci
ón
de
la c
ore
a o
nco
lóg
ica
de
la c
ore
a si
nto
mát
ica
la c
ore
a es
po
ntá
nea
1
CR
MP
-5
NR
N
inguno
- -
- -
- -
Ris
peridona
Sin
N
D
mejo
ría
2 A
NA
P,
58
Adenoca
rcin
om
as
-4
8
Hip
otir
oid
ism
o,
-
- N
inguna
- Q
uetia
pin
a
Sin
S
(re
mis
ión
de m
am
a,
colo
n,
celia
quía
(m
etá
stasi
s)
mejo
ría
sost
enid
a)
páncr
eas
aF
L
+
24
3 T
PO
N
R
Pulm
ón,
+
3
Hip
otir
oid
ism
o
MP
EV
1 g
x 5
d,
luego
Mejo
ró d
e e
star
Desc
onoci
da
- D
esc
onoci
da
Desc
onoci
da
S
adenoca
rcin
om
a
sem
anal x
12 s
em
., lu
ego
post
rado e
n c
am
a a
PO
60 m
g,
reduci
da a
lo
movi
lizars
e c
on a
ndador;
la
rgo d
e 2
m
reca
ída 5
m d
esp
ués
de
su
spender
inm
unosu
pre
sión
4 C
RM
P-5
P,
62
Am
ígdala
s,
-178
Art
ritis
P
O 1
5 m
g d
iarios,
D
esc
ono
cida
Nin
guna
- A
lpra
zola
m
Em
peoró
con
S
carc
inom
a
re
um
ato
idea,
reduci
da a
5 m
g
halo
peridol,
esc
am
oso
celia
quía
dia
rios
para
AR
ci
ert
a
mejo
ría
co
n a
lpra
zola
m
S
tr
Halo
peridol
A
NA
E
NA
F
R
5 C
RM
P-5
N
R
Pulm
ón,
+
19
- P
LF
1 t
rata
mie
nto
S
in m
ejo
ría
Quim
iote
rapia
M
ejo
ría
Ris
peridona
a
Mejo
rías
N
VG
CC
P/Q
adenoca
rcin
om
a
sem
x 1
6
(1
cic
lo s
olo
) le
nta
en e
l
leve
s
mix
to,
carc
inom
a
tie
mpo
a (
sin
cé
lula
s pequeñas
pro
gre
sión
del c
ánce
r,
3.5
años)
6 C
RM
P-5
b
P, 6
8;
RG
B,
C
arc
inom
as
de p
ulm
ón +
9
- P
LF
S
in m
ejo
ría
Quim
iote
rapia
M
ejo
ría
Ris
peridona
Mejo
ría
S
26
de c
élu
las
gra
ndes
marc
ada
le
ve
y pequeñas
A
NN
A-1
T
S,
44
A
ST
O
Índic
e I
gG
,
1,6
7 A
NN
A-1
R
GB
6; T
S,
P
ulm
ón,
carc
inom
a
+0,5
H
ipotir
oid
ism
o
PLF
a x
1 t
rata
mie
nto
, M
ejo
ró d
e e
star
post
rado
Quim
iote
rapia
a
Mejo
ría
Clo
naze
pam
S
in
N
36
de c
élu
las
pequeñas
CF
F o
ral 5
0 m
g 3
vpd
en c
am
a a
movi
lizars
e
gra
dual e
n
m
ejo
ría
x 6
m;
MP
EV
g x
5 d
co
n a
ndador
el t
iem
po
luego d
e d
ete
rioro
agudo
A
NN
A-2
A
NN
A-1
Ris
peridona
1:5
12
C
RM
P-5
A
NN
A-2
1:1
28
Continúa
33
Ta
bla
1
Co
nti
nu
ac
ión
Mes
es d
esd
e el
inic
io d
e la
co
rea
al c
ánce
r (+
)
En
ferm
edad
M
ejo
ría/
Pac
ien
te
H
alla
zgo
s D
iag
nó
stic
o
o d
el c
ánce
r a
auto
inm
un
e
Te
rap
ia
Evo
luci
ón
Te
rap
ia
Evo
luci
ón
de
rem
isió
nn
ro.
An
ticu
erp
os
LC
R
de
cán
cer
la c
ore
a (-
) co
exis
ten
te
Inm
un
ote
rap
ia
Evo
luci
ón
de
la c
ore
a o
nco
lóg
ica
de
la c
ore
a si
nto
mát
ica
la c
ore
a es
po
ntá
nea
1:5
12
V
GC
C N
8 G
AD
65
c N
L P
róst
ata
,
+14
Celia
quía
M
PE
V 1
g x
5 d
S
in m
ejo
ría
Pro
state
ctom
ía
ND
A
lpra
zola
m
Mejo
ró c
on
N
adenoca
rcin
om
a
co
mbin
aci
ón
y
rese
rpin
a
Clo
naze
pam
Quetia
pin
a
Rese
rpin
a
Flu
fenazi
na
9 A
NN
A-1
N
L V
ejig
a,
+
0,5
-
PO
30 m
g d
x 4
m;
Sin
mejo
ría
Cirugía
In
icio
de
-
- S
ca
rcin
om
a
luego C
FF
ora
l
de v
ejig
a;
sínto
mas
3 m
de c
élu
las
50 m
g/
B
CG
desp
ués
de
tr
ansi
cionale
s
d x
6 m
; P
O
in
trave
sica
l co
menza
r
re
duci
da e
n 1
-2 m
el t
rata
mie
nto
G
AD
65
10
NL
NR
C
olo
n,
+
20
Hip
otir
oid
ism
o
- -
ND
N
D
Flu
fenazi
na
Mejo
ró
S
adenoca
rcin
om
a
Rese
rpin
a
11
NL
P, 5
6;
RG
B,
Lin
fom
a n
o
+24
- M
PE
V 1
g x
5 d
; S
in m
ejo
ría
Quim
iote
rapia
In
icio
de
Halo
peridol
Alg
una m
ejo
ría
S
26
Hodgki
n,
se
guid
o p
or
PLF
x 5
d
(incl
uyó
sí
nto
mas
7 m
con r
isperidona
lin
fom
a d
e
ritu
xim
ab)
desp
ués
de la
y lo
raze
pam
H
odgki
n
quim
iote
rapia
pero
much
a
se
daci
ón
+36
Q
uetia
pin
a
O
lanza
pin
a
Lora
zepam
Ris
peridona
12
aF
L (I
gM
) P,
114
Pulm
ón,
carc
inom
a
+2
DM
M
PE
V 1
g x
5 d
;
Mejo
ró lu
ego d
e C
FF
Q
uim
iote
rapia
E
mpeoró
C
lonaze
pam
S
in
S
de c
élu
las
pequeñas
luego
una v
ez
so
la;
de n
o c
am
inar
la
core
a
m
ejo
ría
x se
m x
6 s
em
.
a c
am
inar
con
CF
F E
V x
6 m
andador
TS
, 24
R
ese
rpin
a
BO
C,
5
13
GA
D65
P, 4
4
Leuce
mia
0
- P
O e
IgE
V;
Mejo
ró d
rást
icam
ente
;
Imatin
ib
Sin
cam
bio
s Te
trabenazi
na
Sin
N
m
ielo
cític
a
luego M
PE
V 1
g x
sem
re
caíd
a lu
ego d
e 2
sem
.
m
ejo
ría
tr
ata
mie
nto
Continúa
34
Ta
bla
1
Co
nti
nu
ac
ión
Mes
es d
esd
e el
inic
io d
e la
co
rea
al c
ánce
r (+
)
En
ferm
edad
M
ejo
ría/
Pac
ien
te
H
alla
zgo
s
o d
el c
ánce
r a
auto
inm
un
e
Te
rap
ia
Evo
luci
ón
Te
rap
ia
Evo
luci
ón
de
rem
isió
n
nro
. A
nti
cuer
po
s L
CR
D
iag
nó
stic
o
la c
ore
a (-
) co
exis
ten
te
Inm
un
ote
rap
ia
Evo
luci
ón
de
la c
ore
a o
nco
lóg
ica
de
la c
ore
a d
e cá
nce
r la
co
rea
esp
on
tán
ea
RG
B,1
0
14
Str
P,
78
Adenoca
rcin
om
a
-480
- M
PE
V 1
g x
3 d
, lu
ego
Mejo
ró d
rást
icam
ente
,
Nin
guna
- C
lonaze
pam
S
in
N
gást
rico
,
cada 2
sem
. ca
min
ando s
in c
aers
e
m
ejo
ría
adenoca
rcin
om
a
lu
ego d
el t
rata
mie
nto
pro
státic
o
(m
etá
stasi
s óse
a)
-24
Á
cido v
alp
roic
o
Leve
tirace
tam
Abre
viatu
ras:
aF
L =
antic
uerp
o a
ntif
osf
olip
ídic
o; A
NA
= a
ntic
uerp
o a
ntin
úcl
eo; A
ST
O =
antie
stre
pto
lisin
a O
; BO
C =
banda o
ligocl
onal;
BO
C e
xclu
siva
s de L
CR
< 4
; CF
F =
cic
lofo
sfam
ida; C
RM
P-5
= p
rote
ína c
ola
psi
na 5
media
dora
de
EV
; índic
e d
e Ig
G <
0,8
5; M
PE
V =
metil
pre
dnis
olo
na E
V; N
= n
o; N
D =
no d
isponib
le; N
L =
norm
al;
NR
= n
o r
ealiz
ado; P
LF
= p
lasm
afé
resi
s; P
O =
pre
dnis
ona o
ral;
pro
teín
as
(P)
35–
45 m
g/d
L; S
= s
í; S
tr =
est
riata
l; ta
sa d
e s
ínte
sis
(TS
) <
12 m
g/2
4 h
; TP
O =
antic
uerp
o a
ntit
iropero
xidasa
; V
alo
res
no
rmale
s de L
CR
: re
cuento
de g
lóbulo
s bla
nco
s (R
GB
) 0–
5/µ
L;
VG
CC
= c
anal d
e c
alc
io v
olta
je-d
ependie
nte
; vp
d =
3 v
ece
s por
día
. a M
ejo
ría d
e la
core
a p
ote
nci
alm
ente
atr
ibuib
le a
> 1
modalid
ad d
e t
rata
mie
nto
.b P
aci
ente
report
ado e
n o
tros
lugare
s co
mo p
aci
ente
5.1
c a G
AD
65.1
6
DISCUSIÓN Aunque rara, la corea autoinmune es la segunda causa de corea en adultos, detrás de la enfer-medad de Huntington. Aproximadamente 2 nuevos pacientes fueron identi+cados anualmente en nuestra institución. Calculamos que la incidencia en la pobla-ción local del Condado de Olmsted es de 1,5 por mi-llones de personas por año, que es la mitad de la inci-dencia reportada para la enfermedad de Huntington en la misma población.9 La mediana de la edad de inicio de la corea autoinmune fue similar a la reportada para la enfermedad de Huntington,9 que fue el primer diag-nóstico considerado en varios pacientes. Los factores clínicos que encontramos útiles para distinguir entre la corea autoinmune y una enfermedad neurodegenerati-va incluyen el inicio subagudo de los síntomas, el curso =uctuante con mejorías y remisiones espontáneas, la frecuente coexistencia con otros trastornos neuroló-gicos atípicos en la enfermedad de Huntington, y la ausencia en general de anormalidades en los movi-mientos oculares (los movimientos sacádicos oculares hipométricos son característicos de la enfermedad de Huntington10). En nuestra búsqueda dentro del regis-tro médico, la edad de inicio de la corea parainfecciosa (Sydenham) fue menor a los 18 años, pero los síntomas a veces persistían más allá de la infancia. La existencia de una base autoinmune en la corea también está apoyada por la evidencia clínica o sero-lógica de autoinmunidad o cáncer, LCR in=amatorio, y respuesta a la inmunoterapia. Hay que tomar en cuenta que no encontramos ningún autoanticuerpo restringido a los ganglios basales usando un ensayo inmunohistoquímico optimizado, contemporáneo y clínicamente validado para la detección de anti-cuerpos sinápticos. El GAD65-IgG fue detectado en 1 paciente usando esta metodología (+gura; el valor de radioinmunoprecipitación fue de 760 nmol/l); el GAD65-IgG fue detectado en el 14% del total de los pacientes mediante un ensayo de radioinmunopreci-pitación (todos los otros valores eran < 0,10 nmol/l; el rango normal es 0,00-0,02 nmol/l). La frecuencia del autoanticuerpo GAD65 en los ciudadanos sanos mayores de 50 años del Condado de Olmsted es del 8% (generalmente valores bajos).11La enzima GAD65 se distribuye en todo el cerebro, pero se encuentra en mayor cantidad en los ganglios basales12 y es de im-portancia crítica para la neurotransmisión inhibitoria GABAérgica en esta región. Signos patológicos tem-pranos de la enfermedad de Huntington son la pérdi-da degenerativa de neuronas GABAérgicas estriatales (y de GAD65).13 Los pacientes con manifestaciones neurológicas de autoinmunidad GAD65 (trastornos caracterizados por la pérdida de neurotransmisión in-hibitoria, incluyendo el síndrome del hombre rígido14 y la epilepsia autoinmune15) tiene típicamente valores de GAD65-IgG > 20 nmol/l. Nuestros hallazgos su-gieren que el espectro neurológico de la autoinmuni-dad GAD65 podría extenderse a la corea.16
La corea autoinmune del adulto se divide en 2 grupos: el paraneoplásico y el idiopático. Los cánceres más frecuentemente encontrados fueron el carcinoma de células pequeñas y varios adenocarcinomas. Otras asociaciones al cáncer reportadas incluyen el carcino-ma de células renales17,18 y la leucemia linfoblástica aguda.19 Nuestros hallazgos en pacientes con corea pa-
35
Ta
bla
2
Au
toa
nti
cu
erp
os
sé
ric
os
, h
all
azg
os
au
toin
mu
ne
s y
de
LC
R,
y d
ato
s d
el
tra
tam
ien
to y
ev
olu
ció
n d
el
gru
po
id
iop
áti
co
O
tras
Pac
ien
te
H
alla
zgo
s en
ferm
edad
es
Tera
pia
Mej
orí
as/r
emis
ion
esn
ro.
An
ticu
erp
os
L
CR
au
toin
mu
nes
In
mu
no
tera
pia
E
volu
ció
n d
e la
co
rea
sin
tom
átic
a E
volu
ció
n d
e la
co
rea
esp
on
tán
eas
15
Com
ple
jo
P, 8
0;
Hip
otir
oid
ism
o,
M
PE
V,
IgE
V
Mejo
ró m
odera
dam
ente
; pers
istie
ron
ND
N
D
N
VG
KC
R
GB
D
M
lo
s tr
ast
orn
os
de c
om
port
am
iento
(C
AS
PR
2)
18
G
AD
65, T
PO
T
g
16
AN
A
NL
PT
I P
O 6
0 m
g d
iarios,
R
em
itió
Alp
razo
lam
S
in m
ejo
ría
S
re
ducc
ión e
n 3
-4 s
em
.
aF
L (I
gG
)
VG
CC
-N
Clo
baza
m
17
aF
L (I
gM
e
NR
H
ipert
iroid
ism
o
Nin
guno
- D
iaze
pam
S
in m
ejo
ría
S,
mejo
ró,
con s
ínto
mas
18
AN
A
NL
SS
M
PE
V 1
g x
5 d
, se
guid
o d
e
Mejo
ró,
sínto
mas
leve
s R
isp
eridona
Mejo
ró
N
P
O 6
0 m
g d
iarios,
reduci
dos
en 1
-2 m
E
NA
aF
L (I
gM
)
19
AN
A
NL
AR
, S
S
AZ
P 5
0 m
g d
iarios,
reduci
dos
a
Mejo
ró
Halo
perid
ol
Sin
mejo
ría
S
25 m
g d
iarios
por
into
lera
nci
a
EN
A
aF
L (I
gG
)
20
AN
A
NR
LE
S,
SA
FL
PO
40 m
g d
iarios
x 4 s
em
M
ejo
ró
Ris
peridona
Sin
mejo
ría
N
EN
A
Lora
zepam
aF
L (I
gG
)
21
AN
A
NR
LE
S,
SA
FL, A
R,
P
O 1
0 m
g/d
e h
idro
xi-
Mejo
ró
Clo
naze
pam
S
in m
ejo
ría
ND
S
S
cloro
quin
a 2
00-4
00 m
g/d
A
DN
dc
Sodio
aF
L (I
gM
)
V
alp
roato
22
AN
A
RG
B,
7
LE
S,
SA
FL
PO
5 m
g/d
, aum
enta
do a
30 m
g/d
R
em
itió
Alp
razo
lam
S
in m
ejo
ría
N
si
sin
tom
átic
o.
La c
ore
a e
mpeoró
lu
ego d
e la
reducc
ión.
CF
F (
EV
lu
ego o
ral);
luego c
am
bio
a A
ZP
100 m
g d
iarios.
A
c A
DN
dc
P, 9
8
aF
L (I
gM
,
IgG
)
G
AD
65
A
L
23
AN
A
NR
D
M
MP
EV
1 g
x 3
d
Mejo
ró
Clo
naze
pam
S
in m
ejo
ría
S
Continúa
36
Ta
bla
2
Co
nti
nu
ac
ión
O
tras
Pac
ien
te
H
alla
zgo
s en
ferm
edad
es
Tera
pia
Mej
orí
as/r
emis
ion
esn
ro.
An
ticu
erp
os
LC
R
auto
inm
un
es
Inm
un
ote
rap
ia
Evo
luci
ón
de
la c
ore
a si
nto
mát
ica
Evo
luci
ón
de
la c
ore
a es
po
ntá
nea
s
E
NA
G
AD
65
24
AN
A
NR
N
inguna
Nin
guna
- N
D
ND
S
, re
mis
ión e
spontá
nea
aF
L (I
gM
)
A
L
A
ST
O
25
aF
L (I
gM
) N
R
SA
FL
Nin
guna
- N
D
ND
S
, tr
ast
orn
o d
el m
ovi
mie
nto
con e
stré
s
26
AN
A (
Sm
) N
L N
inguna
PO
60 m
g/d
x 1
mes,
reducc
ión
Rem
itió,
con le
ve c
ore
a d
el p
ie
Clo
naze
pam
, áci
do
Sin
mejo
ría
N
en 3
mese
s; A
ZP
150 m
g/d
. Luego
oca
sional.
Norm
aliz
ó la
marc
ha
valp
roic
o y
halo
peridol
sust
ituid
a p
or
hid
roxi
cloro
quin
a 2
00 m
g/d
A
DN
dc
E
NA
aF
L
A
L
27
aF
L N
L LE
S,
SA
FL
PO
40 m
g/d
. R
eca
ída d
e la
core
a c
uando s
e r
edujo
R
em
itió
Ris
peridona
Sin
mejo
ría
N
por
debajo
de 2
0 m
g/d
; co
menzó
AZ
P 1
00 m
g/d
A
L
28
AS
TO
N
R
Nin
guna
PO
30 m
g/d
; em
peoró
la c
ore
a c
on m
enos
Mejo
ró
Áci
do v
alp
roic
o
Mejo
ró
S
dosi
s
C
lonaze
pam
29
AN
A
NR
LE
S,
SA
FL
PO
más
hid
roxi
cloro
quin
a
Rem
itió c
asi
com
ple
tam
en
te
ND
N
D
S
200 m
g/d
A
DN
dc
aF
L
A
L
A
ST
O
30
- P,
68
Hip
ert
iroid
ism
o,
N
inguna
- N
D
ND
S
, m
ejo
ría e
spontá
nea
P
TI
31
AN
A
NL
LE
S
PO
10 m
d/d
; m
ofe
til m
icofe
nola
to 1
.500 m
g/d
;
Rem
itió,
con s
ínto
mas
ND
N
D
S
lu
ego c
am
bió
a h
idro
xicl
oro
quin
a
oca
sionale
s
250 m
g/d
le
ves
A
DN
dc
m
úsc
ulo
RA
ch
Continúa
37
Ta
bla
2
Co
nti
nu
ac
ión
O
tras
Pacie
nte
Hall
azg
os
en
ferm
ed
ad
es
Tera
pia
Mejo
rías/r
em
isio
nes
nro
. A
nti
cu
erp
os
LC
R
au
toin
mu
nes
Inm
un
ote
rap
ia
Evo
lució
n d
e l
a c
ore
a
sin
tom
áti
ca
Evo
lució
n d
e l
a c
ore
a
esp
on
tán
eas
32
A
NA
N
R
SS
P
O 5
-15 m
g/d
; hid
roxic
loro
quin
a
Solo
sín
tom
as o
casio
nale
s leves
Gabapentin,
S
in m
ejo
ría
S
400 m
g/d
clo
nazepam
y
lora
zepam
aF
L (
Igm
)
33
A
NA
N
L
LE
S
PO
30 m
g/d
; A
ZP
100 m
g/d
;
Mejo
ró
Ola
nzapin
a
Sin
mejo
ría
N
luego h
idro
xic
loro
quin
a
200 m
g/d
E
NA
aF
L (
IgG
)
B
2G
P
A
L
34
AN
A
NR
P
TI,
LE
S,
SA
FL
Nin
guna
- N
D
ND
S
, casi re
mis
ión e
spontá
nea
aF
L (
IgG
)
A
ST
O
35
FR
R
GB
, 153
AR
C
ore
a m
anifesta
da luego d
e la r
educció
n d
e
Perm
aneció
leve
Clo
nazepam
M
ejo
ró
S
S
tr
P,
109
A
L
BO
C,
7
36
FR
N
R
SA
FL
PO
50 m
g d
iarios x
1 m
, lu
ego
Mejo
ró,
en p
art
icula
r el habla
y la
Quetiapin
a
Mejo
ró inic
ialm
ente
pero
no
N
en m
iem
bro
s
park
insonis
mo s
ecundario
A
c a
FL
Clo
nazepam
(I
gM
e I
gG
)
A
L
Flu
fenazin
a
Reserp
ina
Abre
via
tura
s: A
ChR
= r
ecepto
r de la a
cetilc
olin
a; A
DN
dc =
AD
N d
oble
cadena;
aF
L =
anticuerp
o a
ntifo
sfo
lipíd
ico; A
L =
anticoagula
nte
lúpic
o; A
NA
= a
nticuerp
o a
ntinúcle
o; A
ST
O =
antiestr
epto
lisin
a O
; A
ZP
= a
zatioprina;
B2G
P
extr
aíb
les;
FR
= f
acto
r re
um
ato
ideo;
GA
D65 =
isofo
rma 6
5-k
Da d
e la á
cid
o g
lutá
mic
o d
escarb
oxila
sa;
IgE
V =
inm
unoglo
bulin
a E
V;
LE
S =
lupus e
rite
mato
so s
isté
mic
o;
MP
EV
= m
etilp
rednis
olo
na E
V;
N =
no;
ND
= n
o d
isponib
le;
NL =
norm
al; N
R =
no r
ealiz
ado;
PO
= p
rednis
ona o
ral; P
TI
= p
úrp
ura
tro
mbocitop
énic
a idio
pática;
S =
sí;
SA
FL =
sín
dro
me a
ntifo
sfo
lipíd
ico;
Sm
= a
nticuerp
o S
mith;
SS
= s
índro
me d
e S
jögre
n;
Str
= e
str
iata
l; T
g =
tiroglo
bulin
a;
TP
O =
anticuerp
o a
ntitiro
pero
xid
asa;
VG
CC
= c
anal de c
alc
io v
olta
je-d
ependie
nte
; V
GK
C =
canal de p
ota
sio
voltaje
-dependie
nte
. V
alo
res n
orm
ale
s d
e L
CR
: re
cuento
de g
lóbulo
s b
lancos (
RG
B)
0–
5/µ
L;
pro
teín
as (
P)
35–
45 m
g/
dL
Neurology Edición Argentina Julio/Agosto, 201338
Tabla 3 Comparación de los grupos paraneoplásico e idiopático
Grupo paraneoplásico Grupo idiopático (n = 14) (n = 22) Valor p
Edad, mediana 72 años 45 años 0,001
Sexo masculino 10/14 5/22 0,006
Corea moderada o severa 9/11 9/22 0,06
Inicio generalizado 8/14 8/22 0,307
10/14 7/22 0,02
Desorden neurológico coexistente 12/14 14/22 0,25
Neuropatía periférica coexistentea 6/14 1/22 0,008
Remisión/mejoría espontánea 8/14 12/22 1,00
a El inicio coincidió aproximadamente con la corea; no atribuible a otras causas, incluyendo la
diabetes o la quimioterapia por cáncer.
raneoplásica concuerdan con los hallazgos descriptos por un grupo europeo en 13 pacientes, con respecto a la predominancia del sexo masculino, a la edad más tardía de comienzo, al inicio subagudo, a la generaliza-ción temprana y la severidad, a la importante pérdida de peso y a la pobre respuesta al tratamiento.17 Deter-minamos además que varias de estas características le pertenecen más a los casos paraneoplásicos de corea que a los idiopáticos. Creemos que la mayor pérdida de peso en los casos paraneoplásicos re=eja el elevado gasto calórico por los severos movimientos hiperqui-néticos,20 a los efectos de las citoquinas relacionadas al cáncer21 o ambos. El factor más llamativo que diferen-ció ambos grupos fue la alta frecuencia de neuropatía periférica coexistente en el grupo paraneoplásico, que no pudo ser atribuida a la quimioterapia o la diabetes.
A pesar de haber obtenido varias pistas de este estudio retrospectivo para poder distinguir entre las formas paraneoplásica e idiopática de esta rara enfermedad, no se ha encontrado, además del cáncer y sus autoan-ticuerpos predictivos, ningún atributo restringido a un solo grupo. La sospecha de una causa autoinmune justi+ca la evaluación del suero y el LCR buscando anticuerpos paraneoplásicos y una búsqueda exhausti-va de cáncer. La detección de un autoanticuerpo con un valor predictivo alto para cáncer (por ej., CRMP-5–IgG), puede re+nar la búsqueda del cáncer a 1 o 2 tipos (por ej., carcinoma de células pequeñas, carcino-ma de células renales o timoma).1 Las anormalidades radiológicas distintivas de los ganglios basales fueron reportadas previamente por nuestro grupo en 5 de 15 pacientes con corea asociada a CRMP-5-IgG.1 Viglia-ni et al.17 publicaron hallazgos radiológicos similares en solo 1 de 13 pacientes con corea paraneoplásica. La ausencia de anormalidades radiológicas en los pacien-tes de esta publicación puede re=ejar el momento de la evaluación radiológica en el curso de la enfermedad. El hecho de que el anticuerpo contra el receptor NMDA no fue detectado en ningún paciente fue in-formativo. La disquinesia orolinguofacial es caracterís-tica de la encefalitis autoinmune por anticuerpos con-tra el receptor NMDA, que frecuentemente también es paraneoplásica.22 Los pacientes con este trastorno suelen presentar movimientos disquinéticos estereoti-pados y repetitivos, en contraste con los movimientos erráticos coreiformes. Además, las disquinesias en el contexto de esta encefalitis autoinmune coinciden con sintomatología psiquiátrica característica. Esto suele estar seguido por la aparición de una encefalopatía se-vera, convulsiones, hipoventilación y coma.23
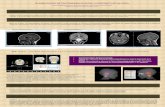
Figura GAD65-IgG detectada por inmunofluorescencia indirecta en el cerebelo del ratón
(A) Cerebelo, (B) otras regiones cerebrales (corte coronal). El patrón de tinción característico es más prominente en la capa granulo-
sa (GL) del cerebelo y el globo pálido (Gp). Las regiones teñidas menos intensamente incluyen la capa molecular del cerebelo (ML),
el tálamo (Th), el caudado y el putamen (C/P), el hipocampo (Hi) y la corteza cerebral (Cx). GAD65 = isoforma 65-kDa del ácido
glutámico descarboxilasa; Ig = inmunoglobulina.
Neurology Edición Argentina Julio/Agosto, 2013 39
El anticuerpo contra el complejo VGKC de es-peci+cidad CASPR2 fue detectado en el paciente 15, quien tenía corea idiopática respondedora a la inmu-noterapia y comportamiento desinhibido. Un reporte reciente describe a la corea respondedora a la inmuno-terapia a través de la presentación de 2 pacientes con autoanticuerpos contra el complejo VGKC de espe-ci+cidad LGI1. En contraste con nuestros pacientes, estos pacientes progresaron a una encefalitis límbica en semanas.24
La respuesta universal a los corticoides fue un criterio mayor que apoyó la existencia de una base autoinmune en los casos de corea idiopática en este estudio. El LES y el síndrome antifosfolipídico eran acompañantes comunes. El uso de anticonceptivos estrogénicos orales y el embarazo (corea gravídica) son factores de riesgo conocidos para el desarrollo de corea en pacientes con LES o síndrome antifosfolipí-dico.2,25 A veces se comienza con terapia anticoagu-lante porque se asume que la etiología es isquémica (secundaria al estado hipercoagulable).26 Sin embargo, ningún paciente en este estudio tuvo evidencia radio-lógica de isquemia subaguda de los ganglios basales. Por lo tanto, inferimos que la corea no resultó de un estado hipercoagulable y concluimos que la anticoa-gulación debe guardarse para tratar la trombosis, pero no la corea.27 La infrecuencia con la que se detectan anticuerpos neurales especí+cos en pacientes con corea autoinmune idiopática (5 de 21 pacientes), nos lleva a concluir que faltan ser descubiertos los autoanticuer-pos marcadores pertinentes.
La respuesta a la inmunoterapia fue un criterio de inclusión para la corea autoinmune idiopática. Solo un 60% de los pacientes con corea paraneoplá-sica mejoraron con inmunoterapia. Los tratamien-tos y las dosis variaron, pero podemos sacar algunas inferencias generales para la práctica clínica. Los pacientes con corea autoinmune idiopática cuyos síntomas sean lo su+cientemente invalidantes como para ameritar inmunoterapia, podrían ser tratados con prednisona oral de forma diaria, o semanalmen-te con metilprednisolona EV, con transición a un agente no esteroide como la azatioprina durante 3 a 6 meses. La coexistencia de otra enfermedad autoin-mune (como el LES) justi+caría aún más comenzar con la inmunoterapia. El tratamiento del cáncer es crucial para los pacientes con corea paraneoplá-sica. Los movimientos anormales paraneoplásicos pueden ocurrir raramente en el contexto del inicio de la quimioterapia.28 Este fenómeno puede haber ocurrido en el paciente 13, que estaba recibiendo imatinib para una leucemia linfocítica crónica cuan-do comenzó la corea. Podría haber sucedido que la apoptosis leucemoide inducida por el imatinib haya iniciado una respuesta inmune onco-neuronal antí-geno especí+ca. La inmunoterapia puede involucrar pruebas se-cuenciales con metilprednisolona (1.000 mg diarios por 3–5 días, seguido por 1.000 mg semanal por 5 se-manas), IgEV (0,4 g/kg día por 3 días, seguido de una vez por semana por 5 semanas) y plasmaféresis (5–7 intercambios administrados día por medio por 10–14 días). Ante un deterioro neurológico progresivo e im-placable, puede ser bene+ciosa la terapia con ciclofos-
famida en pulsos EV o dosis diaria oral y no parece aumentar el riesgo de enfermedad metastásica.29,30 Las terapias sintomáticas (=ufenazina, risperidona y ben-zodiazepinas) a veces son de ayuda. Un paciente en este estudio recibió tetrabenazina sin mejoría. Otro se bene+ció de un enfoque farmacológico similar, con una terapia combinada de una droga depletora de do-pamina, la reserpina, y un bloqueante D
2, la =ufenazi-
na. La autoinmunidad debería ser considerada una causa potencialmente tratable de corea. Las pruebas serológicas ayudan al diagnóstico y un per+l infor-mativo de los autoanticuerpos neurales puede guiar-nos a un tratamiento exitoso de un cáncer aún desco-
nocido.
CONTRIBUCIONES DE LOS AUTORESDr. O’Toole: adquisición de datos, análisis e interpretación de datos, borrador del manuscrito. Dr. Lennon: análisis e interpre-tación de datos, revisión del contenido del manuscrito, contri-bución de herramientas vitales. Dr. Ahlskog, Dr. Matsumoto, Dr. Pittock, Dr. Bower, Dr. Fealey, Dr. Lachance: adquisición de datos, revisión del contenido del manuscrito. Dr. McKeon: concepto y diseño del estudio, adquisición de datos, análisis e interpretación de datos, análisis estadístico, borrador y revisión del contenido del manuscrito, supervisión del estudio.
FONDOS PARA EL ESTUDIONo se reportan.
DECLARACIÓN DE INTERESESO. O’Toole no tiene nada que declarar. V. Lennon es el inventor de una patente relacionada con los anticuerpos AQP4 para el diagnóstico de NMO y recibe regalías por esta tecnología; es un inventor nombrado para pacientes que se relacionan con ensayos funcionales AQP4/NMO-IgG y AQP4-IgG como un marcador de cáncer; y recibe apoyo para investigación del NIH. J.E. Ahls-kog y J. Matsumoto no tienen nada que declarar. S. Pittock es inventor nombrado para pacientes que se relacionan con ensayos funcionales AQP4/NMO-IgG y AQP4-IgG como un marcador de cáncer, y recibe apoyo para la investigación de Alexion Phar-maceuticals, Inc., the Guthy-Jackson Charitable Foundation y el NIH. J. Bower, R. Fealey, y D. Lachance no tienen nada que declarar. A. McKeon recibe fondos para investigación de Guthy-Jackson Charitable Foundation. Ir a Neurology.org para decla-raciones completas.
Recibido el 1 de septiembre de 2012. Aceptado en su forma %nal el 11 de diciembre de 2012.
BIBLIOGRAFÍA
1. Vernino S, Tuite P, Adler CH, et al. Paraneoplastic chorea
associated with CRMP-5 neuronal antibody and lung car-
cinoma. Ann Neurol 2002;51:625–630.
2. Asherson RA, Harris NE, Gharavi AE, Hughes GR. Sys-
temic lupus erythematosus, antiphospholipid antibodies,
chorea, and oral contraceptives. Arthritis Rheum 1986;
29:1535–1536.
3. Guidelines for the diagnosis of rheumatic fever. Jones Cri-
teria, 1992 update. Special Writing Group of the Com-
mittee on Rheumatic Fever, Endocarditis, and Kawasaki
Disease of the Council on Cardiovascular Disease in the
Young of the American Heart Association. JAMA 1992;
268:2069–2073.
4. Lennon VA, Kryzer TJ, Griesmann GE, et al. Calcium-
channel antibodies in the Lambert-Eaton syndrome and
other paraneoplastic syndromes. N Engl J Med 1995;332:
1467–1474.
Neurology Edición Argentina Julio/Agosto, 201340
5. Thieben MJ, Lennon VA, Boeve BF, Aksamit AJ, Keegan M,
Vernino S. Potentially reversible autoimmune limbic enceph-
alitis with neuronal potassium channel antibody. Neurology
2004;62:1177–1182.
6. McKeon A, Lennon VA, Lachance DH, Fealey RD,
Pittock SJ. Ganglionic acetylcholine receptor autoanti-
body: oncological, neurological and serological accompa-
niments. Arch Neurol 2009;66:735–741.
7. Yu Z, Kryzer TJ, Griesmann GE, Kim K, Benarroch EE,
Lennon VA. CRMP-5 neuronal autoantibody: marker of
lung cancer and thymoma-related autoimmunity. Ann
Neurol 2001;49:146–154.
8. Pittock SJ, Lucchinetti CF, Parisi JE, et al. Amphiphysin
autoimmunity: paraneoplastic accompaniments. Ann
Neurol 2005;58:96–107.
9. Kokmen E, Ozekmekci FS, Beard CM, O’Brien PC,
Kurland LT. Incidence and prevalence of Huntington’s
disease in Olmsted County, Minnesota (1950 through
1989). Arch Neurol 1994;51:696–698.
10. Blekher T, Johnson SA, Marshall J, et al. Saccades in pre-
symptomatic and early stages of Huntington disease. Neu-
rology 2006;67:394–399.
11. Walikonis JE, Lennon VA. Radioimmunoassay for gluta-
mic acid decarboxylase (GAD65) autoantibodies as a diag-
nostic aid for stiff-man syndrome and a correlate of
susceptibility to type 1 diabetes mellitus. Mayo Clin Proc
1998;73:1161–1166.
12. Sheikh SN, Martin SB, Martin DL. Regional distribution
and relative amounts of glutamate decarboxylase isoforms
in rat and mouse brain. Neurochem Int 1999;35:73–80.
13. Kumar P, Kalonia H, Kumar A. Huntington’s disease: path-
ogenesis to animal models. Pharmacol Rep 2010;62:1–14.
14. Solimena M, Folli F, Aparisi R, Pozza G, De Camilli P.
Autoantibodies to GABA-ergic neurons and pancreatic
beta cells in stiff-man syndrome. N Engl J Med 1990;
322:1555–1560.
15. Quek AM, Britton JW, McKeon A, et al. Autoimmune
epilepsy: clinical characteristics and response to immuno-
therapy. Arch Neurol 2012;69:582–593.
16. Pittock SJ, Yoshikawa H, Ahlskog JE, et al. Glutamic acid
decarboxylase autoimmunity with brainstem, extrapyram-
idal, and spinal cord dysfunction. Mayo Clin Proc 2006;
81:1207–1214.
17. Vigliani MC, Honnorat J, Antoine JC, et al. Chorea and
related movement disorders of paraneoplastic origin: the PNS
EuroNetwork experience. J Neurol 2011;258:2058–2068.
18. Kujawa KA, Niemi VR, Tomasi MA, Mayer NW,
Cochran E, Goetz CG. Ballistic-choreic movements as the
presenting feature of renal cancer. Arch Neurol 2001;58:
1133–1135.
19. Schiff DE, Ortega JA. Chorea, eosinophilia, and lupus
anticoagulant associated with acute lymphoblastic leuke-
mia. Pediatr Neurol 1992;8:466–468.
20. Pratley RE, Salbe AD, Ravussin E, Caviness JN. Higher
sedentary energy expenditure in patients with Hunting-
ton’s disease. Ann Neurol 2000;47:64–70.
21. Tisdale MJ. Cachexia in cancer patients. Nat Rev Cancer
2002;2:862–871.
22. Dalmau J, Tuzun E, Wu HY, et al. Paraneoplastic anti-N-
methyl-D-aspartate receptor encephalitis associated with
ovarian teratoma. Ann Neurol 2007;61:25–36.
23. Dalmau J, Lancaster E, Martinez-Hernandez E,
Rosenfeld MR, Balice-Gordon R. Clinical experience
and laboratory investigations in patients with anti-
NMDAR encephalitis. Lancet Neurol 2011;10:63–74.
24. Tofaris GK, Irani SR, Cheeran BJ, Baker IW, Cader ZM,
Vincent A. Immunotherapy-responsive chorea as the pre-
senting feature of LGI1-antibody encephalitis. Neurology
2012;79:195–196.
25. Cervera R, Asherson RA, Font J, et al. Chorea in the
antiphospholipid syndrome: clinical, radiologic, and
immunologic characteristics of 50 patients from our clinics
and the recent literature. Medicine 1997;76:203–212.
26. Asherson RA, Derksen RH, Harris EN, et al. Chorea in
systemic lupus erythematosus and “lupus-like” disease:
association with antiphospholipid antibodies. Semin
Arthritis Rheum 1987;16:253–259.
27. Orzechowski NM, Wolanskyj AP, Ahlskog JE, Kumar N,
Moder KG. Antiphospholipid antibody-associated chorea.
J Rheumatol 2008;35:2165–2170.
28. Samii A, Dahlen DD, Spence AM, Maronian NC,
Kraus EE, Lennon VA. Paraneoplastic movement disorder
in a patient with non-Hodgkin’s lymphoma and CRMP-5
autoantibody. Mov Disord 2003;18:1556–1558.
29. Colleoni M, Rocca A, Sandri MT, et al. Low-dose oral
methotrexate and cyclophosphamide in metastatic breast
cancer: antitumor activity and correlation with vascular
endothelial growth factor levels. Ann Oncol 2002;13:
73–80.
30. Vernino S, O’Neill BP, Marks RS, O’Fallon JR,
Kimmel DW. Immunomodulatory treatment trial for parane-
oplastic neurological disorders. Neuro Oncol 2004;6:55–62.