COLOIDES Y SUSPENSIONES - WordPress.com
Transcript of COLOIDES Y SUSPENSIONES - WordPress.com

COLOIDES Y SUSPENSIONESOsmosis y diálisis
SEMANA 10 2021Licda. Isabel Fratti de Del Cid
Diapositivas con proporcionadas por la
Licda. Lilian Judith Guzmán Melgar

Son mezclas heterogéneas formadas por partículas másgrandes y pesadas que los solutos de la solución o quela fase dispersa de los coloides; por esto se asientan alreposar y pueden separarse sus componentes a través
de filtros y membranas semipermeables . Forman dos
fases se observa un sedimento y un sobrenadante.
SUSPENSIONES
Solución de NaCl Suspensión de almidón / H2O
Forman una sola fase, Forman dos fases, sedimentan al reposar
No se separan sus componentes y es posible separar sus componentes a
al reposar, ni por filtración, ni por través de filtración y membranas semiper
Membranas semipermeables permeables.
2

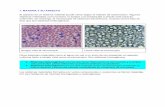
Características generales de las suspensiones
3
Sus partículas son mayores que las presentes
en las soluciones y los coloides, incluso pueden
verse a simple vista.
Se observan dos fases: un sedimento (parte
solida) y un sobrenadante (parte líquida)
Sus partículas se sedimentan si la suspensión se
deja en reposo.

Las partículas en suspensión:
• Son Mayores que las presentes en soluciones y coloides.
• Sedimentan si la suspensión se deja en reposo.
• Pueden separarse por centrifugación, decantación, filtración y membranas semipermeables.
• Debido a su tamaño quedan retenidas en los filtros o dentro de las membranas semipermeables
4

Ejemplos de suspensiones
5

COLOIDES : También llamadas dispersiones coloidales
Sistemas formados por una fase dispersante( esta enmayor cantidad) y una o más fases dispersas.
Las dispersiones coloidales, no pueden separarse porfiltración, ya que atraviesan los filtros, pero sipueden separarse a través de membranassemipermeables, pues las partículas dispersas, nopasan a través de éstas, debido a que son de grantamaño ( generalmente macromoléculas, como lashalladas dentro de la célula: polisacáridos, proteínas,ácidos nucleicos).
6

Componentes de una Dispersión Coloidal ( Coloides)
Son las partículas dispersas , se hallan en
menor cantidad, son comparables con el soluto
en la solución
Es la sustancia que se hallan en mayor cantidad, en la cual las partículas
dispersas están distribuidas. Es comparable
al solvente en las soluciones
FASE
DISPERSA
FASE
DISPERSANTE
7

Las dispersiones coloidales tiene una apariencia en algunos casos lechosa, gelatinosa o turbia, incluso las que parecen transparentes muestran la trayectoria de una haz de luz que atraviesa la dispersión (Efecto Tyndall).
Las partículas dispersas presentan un movimiento errático en zigzag, denominado Movimiento Browniano 8

Ejemplos de ColoidesSustancia
dispersada
Medio de
dispersiónEJEMPLO
Gaseosa LíquidaCrema Batida ; Crema para afeitar,
pompas de jabón
Gaseosa SólidaPiedra pómez, malvaviscos, espuma de
poli estireno
Líquida Gaseosa Niebla, nubes, fijadores para el cabello
Líquida Líquida Leche, mayonesa, crema de manos
Líquida Sólida Mantequilla, queso
Sólida GaseosaPolvo fino en smog, hollín en el aire,
humo.
Sólida LíquidaPlasma sanguíneo, pinturas ( látex) ,
jaleas, gelatina.
Sólida Sólida Vidrio, rubí, ópalo, perlas 9

Emulsiones líquidasSon coloides formados por dos líquidos inmiscibles, ejemplo
aceite y agua. Uno de ellos ( la fase dispersa) es dispersado en otro (fase dispersante).
Las emulsiones pueden ser aceite/agua ó agua/aceite. Ejemplo cremas para la cara y el cuerpo. Uno de los líquidos es no polar y el otro polar. La mezcla se logra a través de la
acción de sustancias conocidas como «emulsificante».
Sin emulsificante, se
separa aceite (no polar)
de agua (polar) aún
después de agitarlos
Con emulsificante se altera la
tensión superficial entre los líquidos
y se logra homogenizarlos, las gotas
de aceite, se dispersan en la fase
polar ( agua)10

Características generales de solución, suspensión y coloide.
PROPIEDADES GENERALES DE LAS SOLUCIONES, COLOIDES Y SUSPENSIONES
Propiedades Solución Coloide Suspensión
Tamaño de la Partícula
(1 nm = 10 -9 m )
0.1 – 1 nmÁtomos, iones
moléculas
pequeñas
1 – 1000 nmMoléculas
mayores ó
grupo de
moléculas
>1000 nmPartículas muy
grandes, incluso
visibles.
Tipo de mezcla Homogénea INCIERTO HETEROGENEA
Sedimentan al reposar NO NO SI
Separación por filtración NO NO SI
Presentan efecto Tyndall NO SINO
Se aplica
Pueden separarse a
través de membranas
semipermeables
NO SI SI11

Separación de los componentes de las soluciones, suspensiones, coloides .
12

DifusiónProceso espontáneo mediante el cual unasustancia se desplaza desde una región demayor concentración a una región de menorconcentración, hasta alcanzar la mismaconcentración en toda la mezcla. Laspartículas se desplazan a favor de ungradiente de concentración (de mayor amenor concentración)
13

TIPOS DE MEMBRANASIMPERMEABLES: No permiten el paso deninguna partícula (solutos , solventes,fase dispersa, fase dispersante).
SEMIPERMEABLES: Permiten el paso de ionesy moléculas pequeñas, pero NO el paso demoléculas grandes ( ejemplo fase dispersade coloides) Aquí encontramos a la mayoríade membranas biológicas.
PERMEABLES: Permiten el paso de solutos,fase dispersa, fase dispersante solvente yde moléculas grandes y pequeñas.
14

Tipos de Membrana
IMPERMEABLE SEMIPERMEABLE PERMEABLE
15

Osmosis
Es el paso de solventegeneralmente agua a través de unamembrana semipermeable .El movimiento de solvente se dadesde la mezcla menos concentrada( contiene más agua) hacia la masconcentrada( contiene menos agua ).El agua pasa de una solución dondehay más agua a donde hay menosagua.
16

17
Osmosis
17

Endosmosis: entrada de agua de el entorno hacia un sistema (ejemplo Célula) separado del entorno por una membrana semipermeable Exosmosis : salida de agua desde un sistema separado por una membrana semipermeable ( ejemplo célula) hacia el entorno
18

DiálisisPaso selectivo de iones y moléculaspequeñas (no moléculas grandes nipartículas coloidales), junto con el solventea través de una membrana semipermeable.El movimiento se da de una región demayor concentración de solutos a una demenor concentración de solutos.
19

Las siguientes parejas de soluciones, separadas a travésde una membrana semipermeable. Indique con flechashacia donde se desplazará el agua (ósmosis) y haciadonde se desplazaran las partículas disueltas (diálisis).Vea el ejemplo e indique con flechas hacia donde ocurre laosmosis y diálisis en los otros ejemplos.
Ejem:
Hacia donde se desplaza:
el agua (ósmosis) La glucosa
(diálisis)
A la izquierda A la derecha
Hacia donde se desplaza:
el agua
(ósmosis)
las partículas de
AgNO3 (diálisis)
Hacia donde se desplaza:
el agua
(ósmosis)
las partículas de NaCl
(diálisis)
20

Diálisis en el cuerpo humano.
Todas las células, órganos y sistemas de nuestrocuerpo, realizan procesos de diálisis, pero son losriñones , los especializados en éste proceso. Lasmembranas de los riñones eliminan en la orinamuchos productos de desecho como la urea,amonio, cuerpos cetónicos, creatinina. Cuandouna persona padece insuficiencia renal, losriñones no eliminan efectivamente productos dedesecho del metabolismo, los cuales se acumulanproduciendo toxicidad.
Las diálisis como tratamiento pueden ser dediferentes tipos.
21

22
https://www.youtube.com/watch?v=xUyEkXXcig8

Diálisis PeritonealDentro de la cavidad
peritoneal, se introduce una
solución hipotónica(fluido
dializador) de manera que las
sustancias que desean
eliminarse pasen a éste líquido
(fluido de desecho) y este es
drenado hacia afuera del
organismo. Puede realizarse en
casa, de forma ambulatoria.
23

Peritoneo : membrana semipermeable formada por dos capas, que envuelve la mayor parte de órganos dentro del abdomen formándose la cavidad peritoneal.
24

Hemodiálisis
Es realizada en clínicas especializadas .Consiste en extraer la sangre de pacientescon insuficiencia renal, pasarla por unosfiltros ( riñón artificial) que hacen la funcióndel riñón, eliminando desechos.Posteriormente la sangre vuelve aintroducirse al paciente.
25

Esquema de como se realiza una
Hemodiálisis y una diálisis peritoneal.
26

M: corresponde a la Molaridad de la solución.Si el soluto se disocia, deberá multiplicarse la Molaridad por el número de partículas disociadas.
Si es covalente y no electrolito no se disociará en unidades menores, por lo tanto la Osmolaridad y Molaridad tendrán el mismo valor
Osmolaridad
Osmolaridad = ( M ) ( # de partículas disociables por mol de soluto)
Valor numérico calculado a una mezcla para
predecir el efecto osmótico que tendrá en una
célula. Se calcula de la siguiente manera:
27

Ejemplo: Número de partículas formadas por mol de soluto
NaCl → Na+ + Cl-
1 + 1 = 2 partículas
Osmolaridad = 2M
Na2SO4 →2 Na+ + SO4-2
2 + 1 = 3 partículas
Osmolaridad = 3M
Al2(SO4)3 → 2 Al+3 + 3 SO4-2
2 + 3 = 5 partículas
Osmolaridad = 5M
28

Para solutos que no se disocian(compuestos no electrolitos), el valor
numérico de la osmolaridad = Molaridad
Urea, glucosa ( dextrosa), sacarosa,
# partículas = 1 Ya que éstas moléculas NO se disocian la Osmolaridad = Molaridad
Osmolaridad = M x 1
29

TONICIDAD: se refiere a la concentración osmolar de una mezcla respecto a la del interior de una célula. Ejemplo eritrocito ( glóbulo rojo, hematíe ).
ISOTONICA(0.28 - 0.32 osmolar)
HIPOTONICA(menor de 0.28 osmolar)
HIPERTONICA(mayor de 0.32 osmolar)
Entra agua al interior
del eritrocito
HEMOLISIS
Sale agua del
eritrocito
CRENACIÓN
Sale y entra agua al eritrocito
a la misma velocidad,
mantiene su morfología30

Tonicidad
Valor de
osmolaridad Concentración de solutos
de la mezcla, respecto a
la del interior de la
célula
EFECTO EN LA CÉLULA
( ejemplo eritrocito)
Hipotónica < 0.28 Menor concentración de
solutos en la mezcla.
Que las del interior de la
célula
Entra agua al eritrocito
( endosmosis) aumenta su
volumen, se hincha,
estalla hemolisis
Isotónica 0.28 – 0.32 La mezcla posee la
misma concentración de
solutos que el interior de
la célula.
El agua entra y sale a la
misma velocidad, conserva
su volumen y morfología,
no se observan cambios
Hipertónic
a
> 0.32 La mezcla posee mayor
concentración de
solutos, de las que hay
en el interior de la
célula
Sale agua del eritrocito;
(exosmosis)disminuye su
volumen crenación.
31

Soluciones Isotónicas mas utilizadas en los hospitales
1-NaCl 0.9% p/v (0.9 g de NaCl disueltos en 100mL de solución) : conocida como solución salina ó suero fisiológico.
M= g/pm = 0.9g / 58.45 g/mol = 0.015M
- Litros 0.1L
Osmolaridad = M x 2 * 0.015 x 2 = 0.30 osM
Por lo tanto es isotónica, no producirá cambios en las células ( ejemplo un eritrocito)
.* Se multiplica por dos pues el NaCl se disocia en 2 partículas : NaCl Na+ + Cl -
32

Cont. Soluciones isotónicas usadas en hospitales.
2-Glucosa 5% p/v ( 5g de glucosa (dextrosa) en 100mL de solución) conocido como « Suero dextrosado al 5 % p/v»
La fórmula de la glucosa es C6H12O6
M = g soluto / peso molecular = 5g / 180.15 g/mol
litros de solución 0.1 L
= 0.28 M
Osmolaridad = 0.28 M x 1* = 0.28 osmolar
Por lo tanto es isotonica
* Se multiplica por 1 , pues la glucosa No se disocia. 33

Mezcla No 2: Glucosa al 2.5 % p/v y NaCl 0.45 % p/v .Como tiene 2 componentes se calcula por separado la osmolaridadde c/ u y luego se suman
Para glucosa:
M= g/pm = 2.5g / 180.15 g/mol = 0.14 M
L 0.1L
Osmolaridad = 0.14 M x 1 = 0.14 osmolar
Para NaCl:
• M = g/pm = 0.45 g / 58.45 g/mol = 0.076M
• Litros 0.1 L
• Osmolaridad = 0.076 M x 2 = 0.15 osmolar
• Osmolaridad total = 0.14 + 0.15 = 0.29 osmolar, es isotónica.
34

1. ¿Cuál es la osmolaridad y tonicidadde una soluciónde Na2SO4 0.15M ; Que efecto causa en eleritrocito.?
35
Resolver

36
2. Calcule la osmolaridad y tonicidad de unasolución de AgNO3 al 2%. ¿Qué efecto causaal eritrocito?

3. En cuantas partículas se disocia un soluto, si suM es 0.12 y su osmolaridad es 0.48.?
Cuál de las siguientes sustancias podría ser.?Subraye :
a) Na2SO4 b) K3PO4 c) C6H12O6 d) CaCl2
37

38
4. ¿Cuál es la M de una solución de ZnCl20.90 osmolar.?

39
Calcule la osmolaridad, tonicidad y que le
sucede a un eritrocito en una solución
preparada con:
12g de urea CO(NH2)2 Disueltos en 350 mL de
solución:

40
Resuelva los siguientes ejercicios del
libro de texto 8.71 y 8.73 (Resp. Pág 339)

ESPACIO PARA RESOLVER
DUDAS DE PRÁCTICA
DE LABORATORIO