Sustancias puras mezclas y disoluciones
-
Upload
gonzalovizuete -
Category
Law
-
view
178 -
download
6
Transcript of Sustancias puras mezclas y disoluciones

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -1
4º CCNN - 1
1.- Sustancias puras y mezclas.
Los materiales que nos rodean pueden estar formados por varias sustancias mezcladas o por una sola, y en este segundo caso decimos que se trata de una sustancia pura.
Una sustancia pura es aquella que no puede separarse en otras más elementales por procedimientos físicos sencillos y que presenta una composición y propiedades características fijas en toda ella.
En realidad, en la naturaleza ninguna sustancia se encuentra totalmente pura. Una sustancia puede ser el principal componente de una muestra, pero otras sustancias, denominadas impurezas, están siempre presentes en mayor o menor grado.
En el mundo que nos rodea, las sustancias puras suelen encontrarse formando mezclas.
Una mezcla es materia que está formada por dos o más sustancias puras que denominamos componentes.
Como se verá más adelante, los componentes de una mezcla se pueden separar, sin que varíe su naturale za, por distintos procedimientos físicos (mecánicos y físicos).
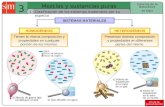
Mezcla heterogénea. Si es posible distinguir a simple vista los componentes de una mezcla. (El granito, la tierra que pisas, un guiso de lentejas...).
Cuando al mezclar dos o más sustancias aparece una mezcla heterogénea, decimos que esas sustancias son inmiscibles o insolubles.
Las mezclas heterogéneas se pueden separar por métodos mecánicos , que no exigen cambios de estado: Decantación, Filtración, Separación magnética, Disolución, Sedimentación….
Mezcla homogénea. Si los componentes no se distinguen a simple vista. (el aire, el agua de mar, la gasolina, el aceite). Las mezclas homogéneas también se denominan disoluciones .
Cuando al mezclar dos o más sustancias aparece una mezcla homogénea, decimos que las sustancias son miscibles o solubles .
Las mezclas homogéneas no se pueden separar por procedimientos mecánicos, pero si se pueden separar por métodos físicos , ligados a cambios de estado: Evaporación, Cristalización, Destilación, Cromatografía….
UNIDAD 3:
Sustancias puras, mezclas y disoluciones.
Métodos de separación de mezclas
Muchas veces no sólo es necesario conocer el grado de pureza de una sustancia, sino también la naturaleza de las impurezas presentes. En las etiquetas de las sustancias químicas utilizadas en el laboratorio aparece una relación de las impurezas que contienen, así como la cantidad en que éstas se encuentran presentes.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -2
4º CCNN - 2
EXPERIMENTAL TCM
Sustancias puras
Es aquel sistema material que tiene propiedades características fijas (punto de fusión, punto de ebullición, densidad, etc.), y que NO puede separarse en sustancias diferentes por ningún procedimiento de los que se usan para separar las mezclas Procedimientos mecánicos y físicos
Todas las partículas son
iguales
Sis
tem
as
hom
ogén
eos
M E Z C L A S
Disoluciones
Son aquellos sistemas materiales cuyas propiedades son iguales en toda la mezcla , (puntos de fusión, p. de ebullición, densidad, etc.) pero que cambian según la proporción de los componentes, y que pueden separarse por procedimientos físicos pero NO por mecánicos.
Al menos dos tipos de partículas diferentes dispersas entre si .
Mezclas heterogéneas
Son aquellos sistemas materiales cuyas propiedades son diferentes en cada punto de la mezcla y cambian según la proporción de los componentes , y que pueden separarse en sustancias diferentes por procedimientos mecánicos.
Al menos dos tipos de partículas diferentes,
agrupadas formando trozos visibles de cada sustancia
Sis
tem
as
hete
rogé
neas
2.- Métodos de separación de mezclas.
Una mezcla está formada por dos o más sustancias puras. En ocasiones es necesario separar los componentes de las mezclas, para lo que se aprovechan sus propiedades físicas.
Para separar en sus componentes una mezcla aprovechamos las propiedades características que los diferencian, ya que cada componente de la mezcla tiene las suyas propias y no las pierde por
Los métodos de separación son muy variados y de uso habitual en cualquier industria para purificar sus materias primas o sus productos.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -3
4º CCNN - 3
el hecho de mezclarse, sea la mezcla homogénea (disolución) o heterogénea.
Los métodos de separación de mezclas aprovechan las diferentes propiedades de cada uno de los componentes presentes en la mezcla.
Todos los métodos de separación son procesos físicos : al principio tendremos las sustancias mezcladas y al final tendremos las mismas sustancias, aunque separadas
Los métodos que se aplican dependen del tipo de mezcla que hay que separar: heterogénea (métodos mecánicos) u homogénea (métodos físicos).
2.1.- Separación de mezclas heterogéneas Se pueden separar por métodos mecánicos , que no exigen
cambios de estado. Estos métodos se basan en la diferencia de pro- piedades como tamaño de partículas, la densidad, solubilidad, pro- piedades magnéticas.....que presentan los diferentes componentes de la mezcla.
2.1.1.- Métodos aplicados cuando los componentes de la mezcla poseen distinta densidad:
- Sedimentación y decantación. Sirve para separar un sólido de un líquido , o un líquido de
otro inmiscible . Nos basamos para la separación en la diferencia de densidad entre las sustancias a separar de forma que el más denso cae al fondo, quedando el menos denso en la superficie.
Ejemplos:
� Una mezcla de agua y arena. La separación física se realiza, tras dejar reposar, abocando el componente menos denso (el agua)
� Una mezcla de aceite y agua. La separación física se realiza introduciendo la mezcla en un embudo de decantación para obtener la fase más densa (agua) al abrir la válvula del embudo.
- Centrifugación. Para acelerar el proceso de sedimentación se puede utilizar
una maquina llamada centrifugadora. Esta maquina hace girar a la mezcla a gran velocidad y aumenta el ritmo de sedimentación.
Las centrifugadoras poseen varios tubos alargados suspendidos de un aparato giratorio en los que se colocan la mezcla. El componente más denso cae al fondo de cada tubo al girar.
La obtención de plasma sanguíneo puede realizarse por centrifugación de las células de la sangre (el líquido sobrenadante constituye el plasma).
- Flotación Es una modalidad de la sedimentación. Se aplica generalmente
para la separación de sólidos . Se aprovecha la diferente flotabilidad de los sólidos en distintos líquidos. Por ejemplo, una mezcla de hierro y azufre se puede separar añadiendo agua a la mezcla, agitando y dejando que se separe, ya que el azufre, menos denso, flota, y el hierro cae al fondo.
Si tenemos una mezcla de hierro
y azufre, como el hierro tiene la propiedad de ser atraído por el imán, aprovecharemos esta propiedad para conseguir la separación.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -4
4º CCNN - 4
2.1.2.- Métodos aplicados cuando las partículas de los componentes de la mezcla tienen distinto tamaño.
- Filtración Es la separación de un sólido y un líquido en mezcla
heterogénea haciendo pasar el líquido por un filtro (papel con poros muy pequeños, porcelanas porosas…), por el que no pasa el componente que posee las partículas de mayor tamaño. Se puede filtrar, por ejemplo, una mezcla de agua y arena: el agua pasa por el filtro, mientras que la arena se queda en él.
En algunos casos, cuando el tamaño de las partículas en sus- pensión es tan pequeño que pasan a través de algunos filtros, se puede añadir a la mezcla un floculante . Un floculante es una sustancia que facilita la unión de las partículas, permitiendo la formación de partículas de mayor tamaño, que así pueden quedar atrapadas en el filtro. Uno de los floculantes más utilizados es la alúmina, que se utiliza en la depuración del agua.
- Separación manual y cribado. La técnica de separación manual se utiliza con
mezclas heterogéneas de sólidos en las que el tamaño de las partículas de los componentes es lo suficientemente grande. Por ejemplo, podemos separar por este método garbanzos y lentejas, arena y pepitas de oro, etc. Si el tamaño de grano entre los sólidos es muy diferente se puede utilizar un tamiz o criba; esta técnica recibe el nombre de cribado . Por ejemplo, cuando se separan los granos de trigo de la arena.
2.1.3.- Otros métodos.
- Separación magnética. Se basa en la propiedad que tienen los materiales férreos
de ser atraídos por los imanes . En el laboratorio el imán se ha de recubrir con un plástico transparente para facilitar su separación. Esta técnica se utiliza en el reciclado de residuos urbanos para separar los metales férreos.
- Disolución. Se utiliza para separar mezclas de sólidos
que presentan distinta solubilidad en un determinado disolvente . Consiste en la adición de un disolvente a la mezcla de sólidos en cuestión, para disolver la sustancia que se quiere obtener por separado, Una vez disuelta, se recoge la disolución formada por filtración.
Para separar una mezcla de sal con arena, basta con añadir agua sobre la mezcla colocada sobre un filtro, con lo cual la sal se disolverá, y se recogerá en la disolución formada. Posteriormente calentando se evapora el agua.
2.2.- Separación de disoluciones (mezclas homogéneas) . Una disolución NO se puede separar por los métodos
mecánicos empleados para separar una mezcla heterogénea. En el

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -5
4º CCNN - 5
caso de una disolución la tarea es más difícil. Se aplican métodos en los que se utilizan las distintas propiedades características (estado de agregación, volatilidad, temperatura de ebullición, etc.) que poseen las sustancias que las forman. Varios de ellos están relacionados con procesos físicos ligados a cambios de estado.
- Evaporación o Calentamiento a sequedad. Este método se utiliza para separar sustancias sólidas
disueltas en un líquido, aprovechando el cambio de estado del componente líquido a vapor y quedando como residuo el sólido.
Consiste en someter a calentamiento la disolución hasta alcanzar su ebullición y mantener dicha temperatura hasta la total vaporización del líquido (calentamiento a sequedad). De forma más lenta se puede hacer por evaporación sin necesidad de calentar (evaporación).
La obtención de sal en las salinas se basa en este método. El agua con gran cantidad de sal disuelta se deja reposar en grandes piscinas poco profundas. El agua, por la acción del Sol, se va evaporando lentamente y la sal se va depositando en el fondo de la piscina.
- Cristalización. Es similar a la evaporación, pero se utiliza con la intención de
liberar de impurezas una sustancia sólida.
Procedimiento. Preparamos una disolución saturada de nuestro sólido y colocamos una muestra de la disolución en un recipiente de gran superficie, llamado cristalizador; el líquido se va evaporando lentamente y aparece el sólido en forma de cristales de gran pureza, ya que las impurezas que acompañan al sólido continúan en la disolución.
- Destilación. Se utiliza para separar líquidos miscibles o bien un
líquido de un sólido miscible en él, basándonos en la diferencia entre sus temperaturas de ebullición .
� Destilación simple.
Se introduce la mezcla en el matraz de destilación y para que la ebullición no sea turbulenta se introducen unos trocitos de porcelana porosa. Se cierra el matraz con un tapón que lleva un termómetro, se conecta al refrigerante y se el inyecta agua. Por último, se inicia el calentamiento.
Los gases producidos pasan por un tubo alrededor del cual circula agua fría (refrigerante). Al enfriarse los gases vuelven al estado líquido y, por el extremo del tubo de salida, se recogen en otro recipiente que se llama colector. A este líquido recogido se le denomina destilado.
En el matraz de destilación quedarán las sustancias que no se hayan evaporado al calentar. A esto que queda se le denomina residuo.
La disolución comienza a hervir cuando se alcanza la temperatura de ebullición del líquido más volátil presente en la mezcla. Los vapores que se producen son mayoritariamente de esta sustancia, aunque también contendrá algo de las otras sustancias
Cristales de cromato de potasio
formados en el fondo de un cristalizador
Salinas a la orilla del mar.
Montaje para una destilación simple

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -6
4º CCNN - 6
líquidas que hay en el matraz de destilación pues no podemos evitar la evaporación.
� Destilación fraccionada.
Con la destilación simple no se separan perfectamente las sustancias. Si queremos que la separación sea mejor se añade un aparato especial llamado columna de fraccionamiento y se realiza un proceso similar a la destilación que se denomina destilación fraccionada.
Veamos como funciona con el ejemplo del alcohol y el agua: Al calentar la mezcla en el matraz, el vapor formado de la sustancia más volátil (el alcohol) arrastra algo de vapor de la otra sustancia (agua) y ascienden juntos por la columna. El vapor del alcohol asciende más y alcanza la parte superior de la columna, y el agua cae de nuevo al matraz como condensado al enfriarse dentro de la columna en las “trampas de condensación”. Cuando en lo alto de la columna se alcanza la temperatura de
ebullición del alcohol, sale el alcohol, que condensa al pasar por el refrigerante y se recoge como destilado.
En una disolución con varios solutos, la destilación fraccionada sirve para separarlos con solo modificar la temperatura de la columna, y así recoger distintas fracciones con cada uno de los solutos que se quieren separar.
Para separar los componentes del petróleo se realiza una destilación fraccionada, es decir, se destila por fracciones según su punto de ebullición. Primero se destilan el gasoil y las gasolinas, que son las fracciones más volátiles, y después los aceites lubricantes. Al final queda un residuo sólido: el asfalto.
La destilación también se utiliza en la fabricación de licores y perfumes.
- Cromatografía. Este método se basa en que las sustancias de la mezcla se
separan al ser arrastradas por un disolvente a lo largo de un papel de filtro, u otro material adsorbente, a distinta velocidad. Esta técnica es útil para separar las sustancias que forman una disolución, con el fin de reconocerlas.
Resulta útil, por ejemplo, para separar los componentes de una tinta. Se introduce en un recipiente una disolución acuosa de alcohol, se corta una tira de papel de filtro y se dibuja cerca de un extremo una mancha o una línea con la tinta que se va a analizar.
Se cuelga la tira de un soporte, de manera que su extremo inferior, en el que se encuentra la mancha de tinta, quede un poco sumergido en la disolución. El disolvente ascenderá por el papel de filtro y arrastrará las sustancias que componen la tinta. Cada sustancia quedará a diferente altura.
El método de cromatografía se utiliza en los laboratorios de investigación para separar e identificar sustancias de una mezcla que posean propiedades muy similares; así, por ejemplo, se emplea en análisis de alimentos, medicinas, sangre, etc.
Montaje para una destilación fraccionada
Columna para la destilación
fraccionada de petróleo.
Cromotograma de la tinta negra de un rotulador en
papel absorbente.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -7
4º CCNN - 7
2.3.- Diagramas de separación. Antes de proceder a la separación de una mezcla es
conveniente realizar un esquema o diagrama de separación. Por ejemplo, para una mezcla de arena, sal y perdigones de plomo, el esquema es como el que se muestra a continuación.
Otro ejemplo es los paneles de funcionamiento que nos
podemos encontrar en una estación depuradora de aguas residuales (EDAR).
AAA ccc ttt iii vvv iii ddd aaa ddd eee sss ... SSSUUUSSSTTTAAANNNCCCIIIAAASSS PPPUUURRRAAASSS YYY MMMEEEZZZCCCLLLAAASSS... MMMÉÉÉTTTOOODDDOOOSSS DDDEEE SSSEEEPPPAAARRRAAACCCIIIÓÓÓNNN...
1) Clasifica los siguientes sistemas como mezclas o sustancias puras:
Agua de soda; Madera; Tinta; Hierro; Amalgama de mercurio; Moneda de 1 €; sal; Diamante; Agua destilada; Sopa vegetal; Vino.
2) Conforme a tu experiencia indica que sustancias de las siguientes al mezclarlas con agua forman sistemas heterogéneos y cuales sistemas homogéneos. Anótalo en el cuadro adjunto.
aceite alcohol arena sal azúcar
Mezcla / disolución Miscibles / inmiscibles Solubles / insolubles
3) Escribe cinco ejemplos de mezclas que conozcas. ¿Qué tipo de sistema es una mezcla ordinaria?

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -8
4º CCNN - 8
4) ¿Qué diferencia existe entre una mezcla heterogénea y una disolución?
5) Explicar si son verdaderas o falsas las siguientes afirmaciones:
- Toda disolución es una mezcla, pero no todas las mezclas son disoluciones.
- Todas las disoluciones son sistemas homogéneos, pero no todos los sistemas homogéneos son disoluciones.
6) ¿Qué diferencias existen desde el punto de vista de las propiedades características entre una sustancia pura y una disolución?
7) Seguramente habrás observado alguna vez como al echar unos cristalitos de azúcar en el agua de un vaso desaparecen al cabo de cierto tiempo y, si agitas, desaparecen más rápidamente. Utilizando la TCM, haz un dibujo de cómo están las partículas de azúcar y las partículas de agua, antes y después de la disolución. ¿Cómo se explica el proceso de disolución según la teoría cinética?
8) ¿En que se diferencian, según la TCM, una sustancia pura, una disolución y una mezcla heterogénea?
9) Completa el siguiente cuadro sobre separación de mezclas:
Mezcla Método de separación
Propiedad en que se basa
Materiales de laboratorio Procedimiento
Barro seco con limaduras de hierro
Arena y azúcar
El grano de la paja
Alcohol y agua
Sal y agua
Petróleo y agua
10) Indica al menos cinco procesos de la vida cotidiana e industrial en los que se producen separaciones de mezclas.
11) ¿Cómo se pueden separar las sustancias puras que forman una disolución?
12) Explica el procedimiento de separación de una disolución por cristalización.
13) ¿En qué consiste la filtración? Pon un ejemplo de separación por medio de esta técnica de separación de mezclas.
14) Completa el esquema de separación de los componentes de la mezcla de sal, limaduras de hierro y arena. Indica en que propiedad característica se basa cada separación.
15) Dada una mezcla de agua, alcohol y aceite, elabora un esquema de separación como el de la actividad anterior.
16) ¿Cómo separarías una mezcla de serrín, arena y azúcar? Haz su esquema de separación.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -9
4º CCNN - 9
3.- Disoluciones.
Gran parte de los líquidos que conocemos o que manejamos habitualmente son disoluciones: El vinagre, el vino, el aceite, la gasolina, La mayoría de los productos de limpieza (lejía, amoniaco doméstico...), de los medicamentos (Jarabes, inyectables,...) y de los alimentos líquidos (refrescos, cerveza,....), el plasma sanguíneo, La orina. La saliva, el sudor, etc.
Disolución: mezcla homogénea estable de dos o más sustancias y que presentan las mismas propiedades en todos sus puntos.
A los componentes de una disolución se les denomina disolvente y solutos . Así, una disolución está formada por un disolvente y uno o más solutos.
El disolvente es la sustancia que actúa como medio dispersor del resto de sustancias de la disolución.
El soluto (solutos) es la sustancia (o sustancias) que se
dispersa (dispersan). Normalmente se considera que el disolvente es la sustancia
que tiene más propiedades en común con la disolució n, o que se encuentra en mayor proporción . Sin embargo, en las disoluciones formadas por dos componentes en los que uno de ellos es el agua, se suele llamar disolvente al agua, aunque no se encuentre en mayor cantidad. Las disoluciones que utilizan como disolvente el agua se llaman disoluciones acuosas .
3.1.- Proceso de disolución Si utilizamos el modelo de la TCM, podemos explicar el
fenómeno de la disolución. Cuando añadimos un sólido a un líquido, las primeras porciones de sólido que se disuelven son las más cercanas a su superficie, ya que se hallan en contacto con las partículas de disolvente, las cuales golpean y atraen a las partículas del soluto sólido, venciendo las fuerzas atractivas y separándolas de este para que queden dispersadas entre las del disolvente.
Existen formas de acelerar el proceso de disolución. Si se agita o se calienta la mezcla, o se pulveriza el soluto, si es sólido, el fenómeno de la disolución se produce con mayor rapidez. Esto se debe a que se esta facilitando la dispersión de las partículas
Siempre que un soluto se disuelve en un disolvente, la masa se conserva. La masa de la disolución es la resultante de la suma de las masas del soluto y el disolvente.
M D = M S + M d
Al realizar una disolución, el volumen final puede ser a veces mayor o menor que la suma de los volúmenes iniciales, dependiendo de la naturaleza de las sustancias disueltas.
V D ≠ V S + V d Debido al reajuste de espacios entre las distintas partículas del
soluto y del disolvente, el volumen final de una disolución no tiene por qué coincidir con la suma de los dos volúmenes.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -10
4º CCNN - 10
3.2.- Tipos de disoluciones. Atendiendo al estado de agregación del disolvente o el soluto o
solutos, existen los siguientes tipos de disoluciones:
� Un ejemplo de disolución gaseosa de gran importancia es
el aire. Contiene, principalmente, nitrógeno, oxigeno, dióxido de carbono y vapor de agua. Pero, además, contiene otros gases que arrojamos al aire y que se difunden por la atmósfera con gran facilidad, originando alteraciones que perjudican el desarrollo de la vida en nuestro planeta. Por ejemplo, el dióxido de carbono, procedente de las combustiones, no es un gas tóxico, pero su exceso da lugar al efecto invernadero
� En el caso de las disoluciones sólidas o aleaciones , los metales se calientan a altas temperaturas para que se fundan y se disuelvan, dispersándose las partículas de ambos metales. Existen aleaciones de gran importancia, como el acero, que es una disolución de hierro y carbono, o el acero inoxidable, que contiene además cromo.
� Dentro de las disoluciones líquidas , las acuosas son las de mayor interés en el desarrollo de la vida. Tanto las plantas como los animales asimilan los nutrientes que están disueltos en agua.
3.3.- Disolución saturada. Solubilidad Si en un vaso ponemos una cierta cantidad de agua a
temperatura ambiente, y le empezamos a echar azúcar, ésta se va disolviendo, pero si seguimos echando azúcar llegará un momento en que observaremos que el azúcar se queda en el fondo del vaso, la disolución no admite más azúcar. En ese momento decimos que la disolución está saturada .
Se dice que una disolución está saturada a cierta temperatura cuando en ella no se puede disolver más soluto.
A la proporción en que se encuentran soluto y disolvente en una disolución saturada se le llama solubilidad.
La solubilidad es una propiedad característica de las sustancias que mide la máxima cantidad de soluto que se puede disolver en una cantidad de disolvente señalada y a una temperatura determinada.
La solubilidad de una sustancia en otra se suele expresar en (gramos de soluto/100 gramos disolvente) o en (gramos de soluto/ 100 ml disolvente).
¡OJO!
No debe confundirse la solubilidad con la rapidez del proceso de disolución ya que existen sustancias muy solubles en agua pero que se disuelven muy lentamente. Por ejemplo, el carbonato de sodio tiene a 20 ºC una solubilidad de 75 g/100 c.c agua., pero puede tardar horas en disolverse totalmente.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -11
4º CCNN - 11
3.3.1.- Factores que influyen en la solubilidad. La solubilidad de una sustancia en otra depende de:
� La naturaleza de soluto y disolvente. Por ejemplo, la sal se disuelve fácilmente en agua, pero no lo hace en benceno. Luego la solubilidad es una propiedad característica.
� La temperatura a la que se realiza el proceso .
Por lo general al aumentar la temperatura aumenta la solubilidad de los sólidos.
La solubilidad de la mayoría de los gases y de los líquidos disminuye con la temperatura. (Ver Gráficas)
Al representar gráficamente la solubilidad de distintas sustancias frente a la temperatura, obtenemos una curva característica de cada sustancia, denominada curva de solubilidad.
� Los cambios de presión
No afectan la solubilidad de los sólidos y de los líquidos .
La solubilidad de los gases en todos los disolventes aumenta cuando lo hace la presión .
3.4. Concentración de las disoluciones Las propiedades de una disolución van a depender de la
proporción en que se encuentran sus componentes. Para conocer esta proporción se utiliza el concepto de concentración
3.4.1.- Clasificación cualitativa de las disolucion es según su concentración.
� Disolución diluida: Si la cantidad de soluto presente en la disolución es pequeña frente al valor de saturación.
� Disolución concentrada: Si la cantidad de soluto presente en la disolución está próxima al valor límite de saturación.
� Disolución saturada: Si la cantidad de soluto presente en la disolución alcanza su valor límite.
� A veces puede ocurrir que una disolución contenga más
soluto del que admite el disolvente, en ese caso la disolución recibe el nombre de sobresaturada . Este tipo de disolución no es estable y bastará cualquier ligera alteración de los factores externos (agitación, presencia de núcleos cristalinos, etc.) para que el exceso de soluto (si es sólido) aparezca en el fondo del recipiente.
Cuando se abre una botella de una bebida gaseosa, la presión sobre la superficie de la bebida se reduce a la atmosférica, y las burbujas de anhídrido carbónico empiezan a escapar. Si dejamos mucho tiempo abierta la botella, la gaseosa acaba «sin fuerza», ya que el gas que contenía se ha escapado.
La contaminación térmica de los ríos y lagos por las aguas residuales de las plantas industriales y nucleares hace aumentar ligeramente la temperatura, provocando una pequeñísima pero significativa disminución de la cantidad de oxígeno disuelto en el agua, que puede poner en peligro la vida acuática.
Equilibrio dinámico

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -12
4º CCNN - 12
AAA ccc ttt iii vvv iii ddd aaa ddd eee sss ... DDDIIISSSOOOLLLUUUCCCIIIOOONNNEEESSS YYY SSSOOOLLLUUUBBBIIILLLIIIDDDAAADDD...
17) Explica razonadamente cuál es el disolvente y cuál es el soluto en las siguientes disoluciones: i) agua de mar. ii) Aire contaminado con dióxido de azufre. iii) Agua clorada en una piscina.
18) Nombra 5 sustancias insolubles en agua.
19) ¿Puede ser diluida una disolución saturada? ¿Puede contener poco soluto una disolución concentrada?
20) La cantidad máxima de mármol que se puede disolver en 1 litro de agua es de 1mg. Si hacemos esta disolución, ¿será diluida, concentrada o saturada?.
21) Mira en las curvas de solubilidad cuál es el valor de la solubilidad de la sal común en agua a 20 ºC. Explica el significado de ese número y escríbelo en forma de razón. ¿Qué cantidad de sal podemos disolver en medio litro de agua a esa temperatura?
22) Con las curvas de solubilidad: i) Clasifica las sustancias según su solubilidad aumente, disminuya o no cambie con la temperatura. ii) A 20 ºC, ¿cual presenta mayor y menor solubilidad? indica sus valores. ¿Es característica para cada sustancia? iii) ¿Qué sustancia presenta la menor variación de solubilidad entre 40 ºC y 60 ºC? ¿Cuál la máxima? iv) ¿El nitrato potásico es más o menos soluble que el bromuro potásico?
23) i) Si añadimos 50 g de nitrato de potasio a 100 c.c. de agua a 20 ºC, ¿se disolverá completamente? ii) ¿Y si la temperatura fuese 60 ºC? iii) Si después de añadirlos a 60 ºC, dejamos enfriar hasta la temperatura ambiente (20 ºC), ¿sigue disuelto todo el nitrato que ya lo estaba?.
24) Al instalar una central eléctrica que utilizaba como refrigerante el agua de un río se observo que la temperatura media del agua del río aumento ligeramente y que los peces morían. Explica este hecho.
25) Al abrir una botella de refresco cuando esta muy fría. ¿Por qué salen burbujas? ¿De qué son las burbujas? ¿Por qué aumentan las burbujas al estar caliente?
3.4.2.- Medida cuantitativa de la concentración. Los términos diluida y concentrada no nos informan acerca de
la cantidad exacta de soluto que hay en una disolución. Luego, se hace necesario idear alguna magnitud que nos informe de la composición concreta de cada disolución: en que relación se encuentran el soluto y disolvente en la misma.
La CONCENTRACIÓN de una disolución es la relación en que se encuentran la cantidad de soluto y la cantidad de disolución. También, se puede definir como la relación entre la cantidad de soluto y la cantidad de disolvente en la disolución.
Matemáticamente se expresa mediante una RAZÓN entre la cantidad de soluto y la cantidad de disolución o disolvente.
Existen diversas formas de expresar la concentración de una
disolución, dependiendo de las magnitudes que se empleen (masa o
Antes de continuar conviene recordar qué se entiende por soluto, por disolvente y por disolución:
Soluto: es el componente que se disuelve y que marca el valor de la concentración. Es el que se encuentra en menor proporción.
Disolvente: es el componente que disuelve al soluto y se encuentra en mayor proporción.
Disolución: es la mezcla homogénea de soluto y disolvente; por tanto, su cantidad equivale a la suma de las cantidades existentes de soluto y disolvente.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -13
4º CCNN - 13
100(c.c.)V(c.c.)V
(%VOL)CD
S ⋅=
volumen) para dar la razón entre la cantidad de soluto y la de disolución o disolvente.
» Concentración en porcentaje en masa: C (% en masa) . Indica los gramos de soluto que hay por cada 100 g de disolución.
Para calcularla se utiliza la siguiente expresión:
Si, por ejemplo, la concentración de una disolución es del 45%
en masa, quiere decir que contiene 45 g de soluto por cada 100 gramos de disolución, y equivale a escribir la siguiente razón:
Ejemplo
» Concentración en porcentaje en volumen: C (% VOL). Indica los c.c. de soluto que hay por cada 100 c.c. de disolución.
Para calcularla se utiliza la siguiente expresión:
VS (c.c.) = Volumen de soluto en c.c. VD (c.c.) = Volumen de Disolución en c.c.
Si, por ejemplo, la concentración del alcohol de un vino es del 12% VOL (antes 12 º), quiere decir que contiene 12 c.c. de soluto (alcohol) por cada 100 c.c. de disolución (vino), y equivale a escribir la siguiente razón:
olución100c.c.Disto12c.c.solu
12%VOL =
Ejemplo En un recipiente se han colocado 6 ml de alcohol y se ha añadido
agua hasta completar 60 ml de disolución. ¿Cuál es s u concentración en % VOL? ¿Qué volumen de agua se ha añadido?
Como conocemos el Volumen de soluto y de disolución sin más que aplicar la
definición: 10%VOL100lución60c.c.Diso
o6c.c.solutC(%VOL) =⋅=
El volumen de agua añadido sólo se puede calcular de forma aproximada, si consideramos que los volúmenes son aditivos:
Vagua = VDisolución – Vsoluto = 60 c.c. de D - 6 c.c. de S = 54c.c. de Agua
» Concentración en gramos por litro: C (g/L). Indica los gramos de soluto que hay por cada litro de disolución.
Para calcularla se utiliza la siguiente expresión:

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -14
4º CCNN - 14
Si, por ejemplo, la concentración de una disolución es de 50 g/l,
quiere decir que contiene 50 g de soluto por cada litro de disolución, y equivale a escribir la siguiente razón:
Ejemplo La concentración de una disolución es 60 g/L. ¿Cuánt o soluto hay
contenido en 200 cm 3 de esta disolución?
Conocemos el Volumen de Disolución (que hay que pasarlo a litros) y la concentración en g/L sin más que despejar en la definición:
⇒⋅=⇒= (L)VC(g/L)(g)M(L)V(g)M
C(g/L) DSD
s
⇒⇒⇒⇒ MS = 60g/L · 0,2L de Disolución = 12 g de soluto
AAA ccc ttt iii vvv iii ddd aaa ddd eee sss ... MMMEEEDDDIIIDDDAAA CCCUUUAAANNNTTTIIITTTAAATTTIIIVVVAAA DDDEEE LLLAAA CCCOOONNNCCCEEENNNTTTRRRAAACCCIIIÓÓÓNNN...
26) Mezclamos 100 cm3 de agua con 50 cm3 de alcohol etílico. Conocidas las densidades de estas dos sustancias puras y suponiendo que los volúmenes son aditivos, calcular: i) Densidad de la disolución. ii) C (% masa). iii) C (% VOL). iv) C (g/L).
27) ¿Qué cantidad de sosa es necesaria para preparar 125 c.c. de disolución acuosa de sosa de concentración 80 g/L?
28) La concentración de una disolución de sal de mesa es 20%. i) ¿Cuántos gramos de sal se podrán recoger si evaporamos completamente el agua de 200 g de esa disolución? ii) Si la densidad de esa disolución es de 1,16 g/cm3, ¿cuál es su concentración en g/L?
29) Un suero salino tiene una concentración de 20 g/l. ¿Qué volumen del mismo habrá que inyectar a un paciente que necesita tomar 2 g de sal?
30) Se disuelven 20 g de azúcar en agua hasta completar 400 c.c. de Di- solución. Si la masa de la disolución anterior es de 420 g. Calcula la densidad de la disolución, la concentración en g/l y en % en masa. Explica el significado de los resultados obtenido.
31) La densidad puede expresarse en g/c.c. o también en g/l. Una de las unidades de la concentración también es g/l, es decir, densidad y concentración pueden expresarse en las mismas unidades, aunque sabemos que son magnitudes diferentes. ¿Qué diferencia existe entre lo que representa la densidad de una disolución y la concentración?
32) Para sazonar un caldo de pescado se añaden 16 g de sal a 2 litros de caldo. i) ¿Cuál es la concentración de la sal en el caldo? Expresada en g/l. ii) Explica el significado del resultado y escríbelo en forma de razón.
33) Si coges una cucharada del caldo anterior, ¿cuál será la concentración de sal en esa cucharada? ¿Cuántos gramos de sal habrá en esa cucharada de caldo? (el volumen de la cuchara es 30 c.c.).
34) En un vaso se han puesto 250 g de alcohol junto con 2 g de yodo, que se disuelven completamente. i) ¿Cuál es la masa de disolución obtenida? ¿Cuál es la concentración de la disolución en % en peso? Explica el significado del número que se obtiene y escríbelo en forma de razón. ii) Si tomamos 50 g de disolución y dejamos evaporar el alcohol, ¿cuántos g de yodo sólido quedan?
35) ¿Que harías para preparar 400 g de una disolución de sal común de concentración 8%?

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -15
4º CCNN - 15
36) Observa la etiqueta del bote con nitrato de potasio. Si dejas evaporar 250 cm3 de esa disolución, ¿cuánto soluto sólido podrías recoger?
37) Observa la etiqueta de la disolución de hidróxido de sodio. ¿Cuál es la masa de 1 L de esa disolución? Expresa su C (% masa)
38) Observa ahora la etiqueta de la disolución de nitrato sódico. ¿Qué volumen ocupan 100 g de esa disolución? ¿Cuál es su C (g/l)?
39) Preparas una disolución con 100 cm3 de agua y 40 g de un soluto. El volumen total resulta ser 112 cm3. ¿Cuál es la densidad de la disolución?
40) Se dispone de 400g de un lingote de oro y plata al 20% en masa de oro. ¿Cuántos g de oro se puede obtener al fundirlo. ¿y de plata?
41) Una disolución acuosa de ácido sulfúrico contiene 25 g de ácido y 100 g de agua. La densidad de esta disolución es 1,1 g/cm3. Calcular. i) Masa y volumen de disolución. ii) C (% masa). iii) C (g/L).
42) Si se deja evaporar 150 ml de una disolución salina de concentración 30 g/l. ¿Qué cantidad de sal obtenemos?
43) ¿Qué cantidad de yodo es necesaria para preparar 100 c.c. de disolución alcohólica de yodo de concentración 20 g/l?. ¿Qué volumen de esta disolución contiene 0,1 g de yodo?
44) Se disuelven 50 g de azúcar en 450 g de agua. ¿Cuál es la concentración en % en peso? ¿Qué masa de esta disolución contiene un gramo de azúcar?
45) ¿Que masa de una aleación de cobre y plomo, al 15 % en peso de cobre, es necesario para obtener por fusión 50 g de cobre puro?.
46) La amoxicilina es un antibiótico que puede venir preparado en forma de suspensión de concentración 50 mg/c.c.. La dosis máxima para un niño es de 50 mg/kg de peso cada 24 horas, repartidos en tomas cada 6 horas. Calcula cuántos cm3 de suspensión pueden administrarse al día, y cuantos en cada toma, a una niña de 25 kg de peso.
AAA ccc ttt iii vvv iii ddd aaa ddd eee sss ... CCoommpplleemmeennttaarr iiaass .. 47) En el lenguaje habitual se habla muchas veces de "sustancias puras":
"La Asturiana, pura leche de vaca"; "miel pura de abeja"..... ¿Son la leche y miel sustancias puras? Pega en el cuaderno las etiquetas de algunos de estos productos para justificar tu respuesta. ¿Qué es lo que quieren expresar con esos mensajes?
48) PRÁCTICA CASERA : calentar medio vaso de agua y añadir sal hasta que ya no se disuelva más y quede en el fondo. Filtrar la disolución (Utilizar un filtro de café). Continuar calentando la disolución obtenida hasta reducir su volumen a la mitad. Dejar enfriar en un plato y dejar en reposo durante unos días hasta que se evapore todo el agua. ¿Al filtrar que queda en retenido en el filtro? ¿Esta toda? ¿Qué es lo que queda en el plato al final?. ¿Forma pequeños cristales? ¿La filtración sirve para separar la sal disuelta e n el agua? Haz un dibujo comparativo entre los tamaños de: los poros del filtro, los granos de sal que quedaron retenidos en el filtro y las moléculas de sal y agua de la disolución
49) PRÁCTICA CASERA: Separar los diferentes componentes de la tinta negra de bolígrafo y rotulador por cromatografía sobre papel. Pega en el cuaderno los cromatogramas obtenidos. Tras la experiencia realizada: ¿Puedes garantizar que la tinta es una mezcla o por el contrario se trata de una sustancia pura? ¿Todas las tintas son iguales?
50) Glosario de términos del tema.

ESPA UNIDAD 3: SUSTANCIAS PURAS, MEZCLAS Y DISOLUC IONES -16
4º CCNN - 16