Glucosa en Orina
-
Upload
mario-corral -
Category
Documents
-
view
301 -
download
7
Transcript of Glucosa en Orina

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
MANUAL DE PRÁCTICAS DE LABORATORIO DE BIOLOGÍA, QUÍ MICA Y FÍSICA
CONTENIDO
Presentación .......................................................................................................................................... 1 Prácticas de Biología I ........................................................................................................................... 2 Práctica 1. Germinación de semillas ........................................................................................................ 2 Práctica 2. Identificación de carbohidratos, lípidos y proteínas................................................................. 4 Práctica 3. Observación de células eucarióticas....................................................................................... 7 Práctica 4. Observación de la pared celular ............................................................................................. 9 Práctica 5. Mitosis en raíz de cebolla ..................................................................................................... 10 Práctica 6. Observación de cloroplastos ................................................................................................ 12 Práctica 7. Hidrólisis de almidón con amilasa salival .............................................................................. 13 Práctica 8. Observación de protozoarios................................................................................................ 14 Práctica 9. Cultivo y observación de hongos .......................................................................................... 15 Práctica 10. Nutrición y transporte en plantas ........................................................................................ 17 Prácticas de Biología II ........................................................................................................................ 20 Práctica 1. Mitosis en raíz de cebolla ..................................................................................................... 20 Práctica 2. Observación de cromosomas en Drosophila ........................................................................ 22 Práctica 3. Elaboración de yogurt........................................................................................................... 25 Práctica 4. Determinación de glucosa en orina ...................................................................................... 27 Práctica 5. Hidrólisis de almidón en amilasa salival................................................................................ 28 Práctica 6. Observación de sangre humana.......................................................................................... 30 Práctica 7. Desarrollo embrionario del pollo ........................................................................................... 32 Práctica 8. Determinación del grupo sanguíneo y factor RH .................................................................. 34 Práctica 9. Fermentación ....................................................................................................................... 36 Práctica 10. Nutrición y transporte en plantas ........................................................................................ 38 Prácticas de Química I ......................................................................................................................... 40 Práctica 1. Elementos, compuestos y mezclas....................................................................................... 40 Práctica 2. Cambios físicos .................................................................................................................... 42 Práctica 3. Transferencia de calor.......................................................................................................... 44 Práctica 4. Cambios químicos ................................................................................................................ 46 Práctica 5. Tubo de rayos catódicos....................................................................................................... 47 Práctica 6. Espectros de emisión ........................................................................................................... 49 Práctica 7. Reacciones características de los grupos I, II y III ............................................................... 51 Práctica 8. Reacciones características de los grupos VIA y VIIA............................................................ 54 Práctica 9. Conductividad eléctrica de electrolitos y no electrolitos ........................................................ 56

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Prácticas de Química II ........................................................................................................................ 58 Práctica 1. Formación de óxidos ............................................................................................................ 58 Práctica 2. Formación de ácidos o anhídridos........................................................................................ 60 Práctica 3. Formación de hidróxidos o bases ......................................................................................... 62 Práctica 4. Formación de sales .............................................................................................................. 64 Práctica 5. Tipos de reacciones ............................................................................................................. 66 Práctica 6. Reacciones exotérmicas y endotérmicas.............................................................................. 68 Práctica 7. Factores que afectan la velocidad de las reacciones............................................................ 70 Práctica 8. Estequiometría ..................................................................................................................... 73 Práctica 9. Lluvia ácida .......................................................................................................................... 74 Práctica 10. Efecto invernadero ............................................................................................................. 76 Práctica 11. Métodos de separación de mezclas.................................................................................... 77 Práctica 12. Molaridad............................................................................................................................ 79 Prácticas de Física I ............................................................................................................................. 82 Práctica 1. Medición de cantidades físicas ............................................................................................. 82 Práctica 2. Determinación del error ........................................................................................................ 84 Práctica 3. Cinemática ........................................................................................................................... 86 Práctica 4. Caída libre............................................................................................................................ 88 Práctica 5. Tiro parabólico horizontal ..................................................................................................... 90 Práctica 6. Segunda Ley de Newton ...................................................................................................... 92 Práctica 7. Tercera Ley de Newton ........................................................................................................ 94 Práctica 8. Fricción................................................................................................................................. 96 Práctica 9. Plano inclinado ..................................................................................................................... 98 Práctica 10. Trabajo y potencia ............................................................................................................ 100 Prácticas de Física II .......................................................................................................................... 102 Práctica 1. Capilaridad ......................................................................................................................... 102 Práctica 2. Densidad y peso específico................................................................................................ 104 Práctica 3. Presión hidrostática ............................................................................................................ 106 Práctica 4. Principio de Arquímedes..................................................................................................... 108 Práctica 5. Presión atmosférica y manométrica.................................................................................... 110 Práctica 6. Gasto y ecuación de continuidad........................................................................................ 112 Práctica 7. Dilatación volumétrica ........................................................................................................ 114 Práctica 8. Uso del termómetro ............................................................................................................ 116 Práctica 9. Transferencia de calor por conducción y radiación ............................................................. 118 Práctica 10. Circuitos en serie y en paralelo......................................................................................... 121 Práctica 11. Intensidad de corriente ..................................................................................................... 123 Práctica 12. Medición de voltaje........................................................................................................... 126 Práctica 10. Medición de resistencia .................................................................................................... 128 Reglamento general para los laboratorios de Física, Química y Biología ..................................... 131

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 1 Características de los seres vivos. Relación de la Biología con la tecnologia y la ciencia
PRACTICA No. 1 GERMINACIÓN DE SEMILLAS
Objetivo General
Introducción
Cuando una semilla cae al suelo, si encuentra las condiciones adecuadas puede germinar y producir una nueva planta. Por lo general las semillas no germinan inmediatamente; en la mayoría de las especies las semillas se producen al final de la estación favorable siguiente que es cuando se dan las condiciones adecuadas. Las semillas para germinar necesitan unas condiciones externas favorables, las principales son: Un grado adecuado de humedad, indispensable para que la semilla se hinche y puedan rasgarse los tegumentos que la protegían, y para que el citoplasma de las células, que estaba desecado, recupere su estado físico normal. Temperatura comprendida en la mayoría de los casos, entre 15 y 20 oC. Presencia de oxígeno, puesto que la mayoría de las reacciones que movilizan las sustancias de reserva que proporcionan la energía necesaria para el crecimiento de la plántula son procesos de tipo respiratorio. La luz no es imprescindible para iniciar la germinación, pero es necesario en cuanto la plántula desarrolla sus primeras hojas y deja de alimentarse a expensas del contenido de los cotiledones. La germinación empieza siempre por el desarrollo de la radícula que atraviesa los tegumentos. En la zona en que ha terminado el crecimiento se desarrollan los pelos absorbentes, mientras el meristemo terminal continúa el crecimiento en longitud. Más tarde se desarrollaran las raíces laterales por encima de la zona pilífera. La segunda fase consiste en el desarrollo del brote, que varia según la planta considerada.
El alumno conocerá el proceso de la germinación e identificará los factores que intervienen en ella.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 1: Características de los seres vivos. Relación de la biologia con la tecnología y la ciencia
PRACTICA No. 1 GERMINACIÓN DE SEMILLAS
Materiales 4 Vasos de precipitados de 400 ml 100 gr. de algodón 1 foco de 40 Watts 32 semillas de frijol 4 Etiquetas Regla
Procedimiento: 1. Colocar el algodón en cada vaso hasta la mitad de su capacidad. 2. Agregar 100 ml de agua a dos de los vasos. 3. Colocar ocho semillas en cada vaso y cubrir con algodón. 4. Etiquetar cada uno de los vasos de la siguiente manera.
Medio Húmedo con luz Medio Seco con luz Medio Húmedo oscuro Medio Seco oscuro 5. Colocar dos vasos en una caja de cartón con un foco de 40 Watts que permanecera encendido todo
el experimento. 6. Colocar los otros dos vasos en una caja de cartón en la oscuridad. 7. Medir diariamente durante 15 días el crecimiento de la radícula y la plántula.
Tabla 1 Registro de crecimiento de raíz y tallo en la plántula de frijol Día Medio Húmedo con luz Medio seco con luz Medio Húmedo –
oscuro Medio seco-oscuro
Longitud de la
radícula (cm)
Longitud de la
plántula(cm)
Longitud de la
radícula (cm)
Longitud de la
plántula (cm)
Longitud de la
radícula (cm)
Longitud de la
plántula (cm)
Longitud de la
ridícula (cm)
Longitud de la plántula
(cm)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 1: Biomoléculas Orgánicas
PRÁCTICA No. 2 IDENTIFICACIÓN DE CARBOHIDRATOS, LÍPIDOS Y PROTEÍNAS
Objetivo General
Introducción
Materiales Sustancias Equipo
3 Vasos de precipitado de 100 ml Solución de glucosa al 5% 3 Pipetas de 5 y 10 ml Ácido Nítrico (HNO3) Parrilla eléctrica 1 Lupa Jugo de naranja 1 Huevo de gallina Solución de almidón al 1% 1 Papa fresca Reactivo de Benedict Tubos de ensayo Solución Hidróxido sodio al 50% Gradilla Solución de Sudan III (C22H16N4O) Goteros Éter Varillas de vidrio Hidróxido de amonio (NH4OH) Aceite de oliva Leche Tinta china roja Solución de Sulfato cúprico al 1%. Solución de Hidróxido sódico al 20%. Solución de Lugol
La mayor parte de los componentes químicos de los organismos son compuestos químicos del carbono. Los compuestos orgánicos en general determinan la estructura y función de las células que integran a los seres vivos. Así tenemos que los principales compuestos orgánicos son: carbohidratos, lípidos, proteínas, ácidos nucleicos y vitaminas. Los carbohidratos están formados por los elementos de carbono, hidrogeno y oxigeno, muchos de estos son utilizados como combustible por las células, porque al degradarse dejan libre una considerable cantidad de energía. Se pueden clasificar en monosacáridos, disacáridos y polisacáridos. Los monosácaridos son azucares que no se pueden desdoblar en otros mas sencillos. El representante más importante de todos ellos es la glucosa, que se encuentra en los frutos en cantidades muy variadas. Su mayor importancia biológica reside en el hecho de ser un combustible básico, necesario para el funcionamiento del organismo. Los lípidos son sustancias de composición muy variada, que tienen en común no ser solubles en agua y si en disolventes orgánicos (éter, cloroformo, etc.). Son sustancias que intervienen como soporte de las estructuras celulares, se pueden establecer dos grandes grupos, grasas y lipoides. Las grasas están formadas por glicerina y ácidos grasos. Por tanto se componen de carbono, oxigeno e hidrogeno. Las más importantes son la oleína, estearina y palmitina. Algunas plantas las almacenan en sus tejidos en gran cantidad, como es el caso de la aceituna. Lipoides. Su composición química es muy heterogénea; se parecen a las grasas en sus propiedades físicas, pero tienen una composición más compleja. Las proteínas están formadas por moléculas de gran tamaño, denominadas macromoléculas, que contienen básicamente carbono, hidrogeno, oxigeno y nitrógeno. Los huevos de ave contienen gran cantidad de proteínas, dos de estas proteínas son la vitelina y la albúmina.2
Determinar la presencia de carbohidratos, lípidos y proteínas en alimentos naturales de uso común. Mediante técnicas sencillas. Analizar la importancia de los compuestos orgánicos en alimentos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 1: Biomoléculas orgánicas
PRÁCTICA No. 2 IDENTIFICACIÓN DE CARBOHIDRATOS, LÍPIDOS Y PROTEÍNAS Procedimiento Identificación de carbohidratos Azúcares reductores
1. En un tubo de ensayo vierte 1ml de solución de glucosa al 5%, en un segundo tubo, solución de almidón al 1% y en un tercer tubo jugo de limón.
2. Adiciona a cada tubo 1ml del reactivo de Benedict y agita. 3. Caliéntalos a baño maría. 4. Anota tus observaciones.
Identificación de almidón
1. En un tubo de ensayo adicionar 1ml de solución de glucosa al 5%, en un segundo tubo 1ml de agua de papa (papa rayada en agua) y en un tercer tubo 1ml jugo de limón.
2. Agrega de dos a tres gotas de lugol. 3. Anota tus observaciones.
Identificación de lípidos
1. Poner en un tubo de ensaye 3 ml de Éter, en otro tubo adicionar 3 ml de agua y en un tercer tubo 3 ml de agua con un poco de detergente.
2. Añade en cada tubo 1 ml de aceite. 3. Agita los tubos y luego déjalos en reposo. Observa lo que ocurre y anótalo.
Tinción de lípidos
1. Poner en un tubo de ensayo 2 ml de aceite y 2 ml de agua. 2. Añade unas gotas de Sudán III y agita. deja el tubo en reposo y observa, anotando, lo que
ocurre. 3. En otro tubo, repetir lo mismo pero con Tinta roja.
Saponificación
1. A 5 ml de aceite de oliva colocados en un tubo de ensayo, se añade 1 ml de solución de NaOH (Sosa) al 50%. Calentamos a la llama del mechero mientras se agita suavemente.
2. Al cabo de un rato se observará que se forman tres capas: la inferior es de glicerina (por ser mayor su densidad), la segunda de jabón (densidad intermedia), con aspecto de espuma gruesa y la superior es el aceite no utilizado (menor densidad).La capa superior y la inferior pondrán de manifiesto que la hidrólisis ha tenido lugar, y la presencia de jabón indica que el aceite de oliva tiene lípidos saponificables.
3. Observar y anotar los resultados.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 1: Biomoléculas orgánicas
PRÁCTICA No. 2 IDENTIFICACIÓN DE CARBOHIDRATOS, LÍPIDOS Y PROTEÍNAS Identificación de proteínas Reacción Xantoproteica
1. A tres tubos de ensayo agrega aproximadamente 1ml de clara de huevo, de leche y de jugo de naranja, respectivamente.
2. Agrega a cada uno de los tubos, de cuatro a cinco gotas de ácido nítrico (HNO3) al 10%,
describe lo que observaste.
3. Calienta ligeramente los tubos y observa que ocurre.
4. Deja enfriar los tubos y agrega de dos a tres gotas de hidróxido de amonio (NH4OH), describe lo que observaste.
5. Repite el procedimiento con un trozo de queso fresco, anota tus observaciones.
Cuando pongas en baño maría tus soluciones usa unas pinzas para tomar los tubos, y cuando sea necesario poner a hervir las soluciones directamente en la flama del mechero. Reacción de Biuret
1. Poner en un tubo de ensayo 2 ml de clara de huevo diluida. 2. Añadir 2 ml de hidróxido sódico al 20% y a continuación unas gotas de solución de sulfato
cúprico al 1%, agitando para que se mezcle bien.
3. Observar lo que ocurre y anotarlo.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 2
PRÁCTICA No. 3 OBSERVACIÓN DE CÉLULAS EUCARIOTICAS
Objetivo General
Introducción
Materiales Sustancias Equipo Aguja enmangada Azul de metileno Microscopio Frasco lavador Verde de metilo Mechero de alcohol Palillos de dientes Portaobjetos Cubreobjetos Pipeta Pinzas Escalpelo Hoja de cebolla
Las células microbianas son de dos tipos diferentes. El tipo menos desarrollado es el de bacterias y algas verde-azules que se denominan procarioticas. El tipo celular mas desarrollado, eucariotica se halla en todas las demás formas biológicas; algas superiores, protozoarios, hongos, así como plantas y animales superiores. En la célula eucariotica la mayor parte del protoplasma esta llena de una red de membranas, el retículo endoplásmico que es el lugar de actividad de muchas enzimas. El retículo endoplásmico granuloso es activo para la síntesis de proteína. La respiración se efectúa en las mitocondrias. Estas están rodeadas por membranas dobles; la membrana interna es el origen de una serie de finas membranas internas en las cuales están situadas las enzimas que participan en el transporte ordenado de electrones desde substancias oxidables al oxigeno. Las paredes de las células eucarioticas, cuando existen, suelen estar compuestas de substancias inorgánicas, o bien orgánicas relativamente simples como polisacáridos, celulosa y polímeros de monosacáridos. La mayor parte de células animales no poseen una pared rígida. Las células flageladas poseen flagelos de dimensiones microscópicas, pero de estructura avanzada. Están compuestas de 20 fibrillas dispuestas de una manera distintiva; nueve pares de fibrillas están distribuidas más o menos uniformemente alrededor de dos fibrillas situadas cerca del centro. Cada fibrilla de una célula eucariotica tiene aproximadamente las dimensiones de un flagelo de un organismo procariota.1
Observar células eucarióticas y adquirir habilidad de trabajo manual en la preparación de muestras microscópicas.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 2
PRACTICA No. 3 OBSERVACIÓN DE CÉLULAS EUCARIOTICAS Procedimiento: Preparación de epidermis de cebolla (Allium cepa) 1. Tomar un trozo de hoja de cebolla de la parte interna , con la ayuda de una aguja enmangada
separar la epidermis del siguiente modo; realizar un corte transversal de 1cm de longitud con el escalpelo, con las pinzas arrancar un trozo de epidermis hasta que se desgarre.
2. Colocar la epidermis sobre el portaobjetos extendiéndola con la aguja y cubrir la muestra con verde
de metilo, dejar actuar durante cinco minutos. 3. Lavar la muestra con agua dejándola caer con cuidado con ayuda de un frasco lavador hasta
eliminar los restos de colorante. 4. Añadir una gotita de agua, colocar un cubreobjetos y presionar con cuidado. 5. Observar al microscopio, primero con los mínimos aumentos, luego pasar a aumentos mayores,
dibujar indicando los aumentos. Preparación de células de la mucosa bucal: 1. Tomar una muestra de la mucosa bucal con la ayuda de un palillo de dientes. Para ello basta pasar
el palillo por el interior del carrillo. Extender la muestra sobre el portaobjetos con el palillo, realizar un frotis.
2. Fijar la muestra pasándola sobre la llama del mechero, con cuidado de que no se queme, es una
fijación con calor. Cubrir la muestra con azul de metileno, dejar actuar durante dos minutos. 3. Lavar la muestra con agua dejándola caer con cuidado con ayuda de un frasco lavador hasta
eliminar los restos de colorante. Colocar un cubre objetos y presionar con cuidado. 4. Observar al microscopio primero con los mínimos aumentos, luego pasar a aumentos mayores,
dibujar indicando los aumentos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 2
PRÁCTICA No. 4 OBSERVACIÓN DE LA PARED CELULAR
Objetivo General
Introducción
Materiales Equipo Portaobjetos Microscopio
Cubreobjetos Cuchilla Pinzas Bulbos de cebolla
Procedimiento: 1. Mediante una cuchilla y unas pinzas, aislar una parte de la epidermis correspondiente a la zona
cóncava de la tercera o cuarta escama de la cebolla. 2. Colocarla extendida en un portaobjetos; a continuación se coloca el cubreobjetos y se observa al
microscopio óptico. 3. Con el objetivo de menor aumento, se examinará la preparación entera, observando que está
formada por células alargadas que encierran el núcleo.
El alumno podrá observar la pared celular en la epidermis de la cebolla
La estructura, aunque no se pueda observar en su totalidad con este método, es la típica de una célula vegetal. El límite más externo es la pared celular, que rodea el material vivo de la célula: el protoplasma. La parte que rodea todo el protoplasma y que está en contacto con la pared celular, es la membrana celular. Dicha membrana no es visible en estas células porque está aprisionada contra la pared celular. Próxima a esta pared hay una capa irregular, granular, que constituye el citoplasma. El núcleo aparece homogéneo. La pared celular esta compuesta de un polisacárido insoluble llamado celulosa. La pared celular le da rigidez al tejido vegetal; la unión de varias paredes celulares le dan una contextura dura y rígida a los vegetales.3

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO
PRÁCTICA No. 5 MITOSIS EN RAÍZ DE CEBOLLA
Objetivo general
Introducción
Materiales Sustancias Equipo Portaobjetos Solución de carnoy Microscopio Cubre objetos Acido clorhídrico al 10% Bisturí o cuchilla Acetocarmin Tijeras Esmalte Pinzas Raíz de cebolla Palillos de dientes
El estudiante identificará los principales cambios morfológicos que se pretenden durante la profase, metafase, anafase, telofase y citocinesis en células meristemáticas de raíces de cebolla
La mitosis es una serie de cambios por medio de los cuales el núcleo de una célula se convierte en dos. Esta simple definición muestra la mitosis como un proceso nuclear, relacionado principalmente con la duplicación y la distribución igual de cromosomas en las células hijas. En organismos multicelulares las células que sufren mitosis se encuentran generalmente en las regiones de crecimiento, como son la punta de la raíz en las plantas o un embrión en desarrollo. De las cinco fases principales de mitosis, la más larga es la interfase, que incluye el periodo entre una división celular y la siguiente. En una célula que se encuentra en interfase el núcleo y la membrana nuclear se pueden distinguir fácilmente. Sin embargo los cromosomas no se ven, por que el material cromosómico esta suspendido por el núcleo en la forma de un hilo delgado invisible. Los cromosomas se hacen visibles cuando los hilos se comienzan a condensar en forma de espirales compactos. Cuando ocurre esto, la célula entra en profase, la membrana nuclear desaparece, y con mayor aumento, los cromosomas se ven como si fueran dobles. La metafase se caracteriza por el alineamiento de los cromosomas a lo largo de la placa ecuatorial de la célula. Durante la telofase, la célula se constriñe por todos sus lados hasta que se forman dos células hijas. Durante la telofase tardía, se reforma una membrana nuclear y la célula generalmente vuelve al estado de interfase.8

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biologia I
BLOQUE DIDACTICO 1
PRACTICA No. 5 MITOSIS EN RAIZ DE CEBOLLA
Procedimiento: 1. Diez días antes de comenzar los experimentos, escoja un bulbo de cebolla fresca y elimine
mediante un raspado con una cuchilla, las raíces secas que se hallan en la base del bulbo. En un frasco boca ancha o un vaso desechable coloque la cebolla sujetándola con palillos, como se muestra en la figura 5.1.
Figura 5.1
2. Vierta agua en el frasco, hasta tocar la base de la cebolla. Mantenga la base de la cebolla húmeda y
cambie el agua diariamente. 3. Cuando las raíces nuevas alcancen 3cm. Aproximadamente de longitud, extraiga la cebolla del
recipiente y corte el ultimo centímetro de la punta. 4. Deposite estas raíces en la solución fijadora Carnoy (3 metanol: 1 acido acético) durante 20 minutos. 5. Traslade las raíces a un recipiente que contiene acido clorhídrico al 10% 10 minutos. Este tiempo
varia según el tipo de célula. 6. Coloque las raíces en un recipiente con agua y lávela por cinco minutos. 7. Traslade las raíz a un recipiente con acetocarmín. Este colorante las debe cubrir totalmente durante
20 minutos. 8. Saque la raíz del recipiente que contiene acetocarmín y póngala en un porta objeto. 9. Corte nuevamente la raíz, dejando el extremo inferior (ápice) y deseche el otro. 10. Coloque el ángulo recto el cubre objeto, bájelo lentamente hasta que se pose en el preparado, y
luego haga una leve presión con el dedo hasta conseguir una extensión del preparado. 11. Selle los bordes del cubre objeto con esmalte y deje secar. 12. Observe con el objetivo de menor aumento para localizar las figuras mitóticas, y posteriormente con
el objetivo de mayor aumento para discriminar detalles.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 2
PRÁCTICA No.6 OBSERVACIÓN DE CLOROPLASTOS
Objetivo general El alumno conocerá a través de esta practica la estructura de los cloroplastos en células vegetales vivas
Introducción
Materiales Equipo Portaobjetos Microscopio Cubreobjetos Mortero Tubo de ensayo Hojas de Elodea
Procedimiento 1. Coloque un portaobjetos las hojas de Elodea, y coloque un cubreobjetos presionando. 2. Coloque la preparación en la platina del microscopio óptico y enfoque comenzando con el menor
aumento, para observar los cloroplastos. 3. Dibuje un esquema de lo observado en el microscopio.
Los plastos son orgánulos característicos y exclusivos de las células vegetales autotrofos fotosintetizadores. Son los órganos encargados de realizar la fotosíntesis. Existen varios tipos de plastos, que se clasifican atendiendo a las sustancias que contienen. Los mas abundantes son los cloroplastos, de color verde, que contienen clorofila, los cloroplastos son generalmente esféricos u ovoideos, aunque pueden adoptar las formas mas variadas. En ocasiones los cloroplastos presentan corpúsculos esferoidales incoloros y mas refringentes que el resto, que son amilogenéticos y se llaman pirenoides. Los plastos están envueltos por una doble membrana que limita un espacio claro llamado estroma, en cuyo seno se distinguen unos grumos pigmentados o grana. Cada granum esta formado por una columna de membranas paralelas en forma de discos, que están empaquetados como una pila de monedas y conectados con los discos de otros grana por dobles membranas.2

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 2
PRÁCTICA No.7 HIDRÓLISIS DE ALMIDÓN CON AMILASA SALIVAL
Objetivo general
Introducción
Materiales Substancias Vaso de precipitados Agua destilada Tubos de ensayo Lugol Gradilla para tubos Solución de almidón al 5% Placa térmica Pinzas de madera
Procedimiento La amilasa de la boca transforma el almidón de los alimentos en azúcares sencillos. A continuación vamos a intentar reproducir este proceso: 1. Recoge en un tubo de ensayo limpio 10 ml de saliva. 2. Vierte unos 10 ml de la disolución de almidón en el tubo que contiene la saliva. 3. Mézclalo bien y rotúlalo como Tubo A. 4. Vierte otros 10 ml de la disolución de almidón en otro tubo. Rotúlalo como Tubo B. 5. Echa unas gotas de Lugol a cada unos de los tubos anteriores. 6. Pon los dos tubos de ensayo al baño maría y mantenlos unos 30 minutos a una temperatura entre 37 y 40º C. 6. Anota tus observaciones.
Esta práctica tiene como objetivo demostrar que efectivamente los polisacáridos como el almidón están compuestos de monosacáridos unidos por enlaces glicosídicos. El almidón está constituido de un solo monosacárido, la glucosa. Las propiedades del almidón son diferentes a las de la glucosa como se evidenciará mediante la hidrólisis del almidón para generar glucosa. Todos los polisacáridos son hidrolizados en sus constituyentes monosacáridos, por la acción de ácidos diluidos. Esta es una reacción gradual que puede observarse durante el tiempo de la sesión de laboratorio. Es por tanto recomendable que usted inicie el proceso de hidrólisis al comenzar la sesión de laboratorio y luego proceda con el resto de las pruebas. La hidrólisis del almidón se puede evidenciar con dos pruebas: a. Desaparición del color azul característico de la prueba del yodo. b. Aparición de glucosa, un azúcar reductor. La aparición de glucosa se evidenciará mediante la prueba de Benedict.
Comprobar la existencia de amilasa en la saliva y demostrar que el almidón es un polisacárido compuesto por muchas moléculas de azúcares sencillos (glucosa).

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 3
PRÁCTICA No.8 OBSERVACIÓN DE PROTOZOARIOS
Objetivo general
Introducción
Materiales Substancias Equipo Hoja de lechuga sucia Rojo neutro Microscopio Portaobjetos y cubreobjetos Gotero Vaso de precipitado
Procedimiento: 1. Tome la hoja de lechuga y enjuáguela con agua, y tomamos una muestra del agua con un cuenta
gotas y deposítela en el centro de un portaobjetos. Coloque un cubreobjetos. 2. Observe la preparación al microscopio. Mueva lentamente la preparación, e identifique las algas y
los protozoos. 3. Añada unas gotas de rojo neutro por el borde del cubreobjetos par que penetre en la preparación y
puedas ver los microorganismos.
El alumno conocerá a través de esta práctica la estructura, aspectos evolutivos e importancia ecológica de los protozoos.
De los animales, los protozoos son los mas pequeños. Su tamaño máximo es poco menos del diámetro de un eritrocito (7.5 µm). Los protozoos son parásitos y causan enfermedades que interesan al hombre; aparecen ampliamente en el agua y pueden alterar su color, gusto y olor; algunas especies producen colores verde o rojo; otras liberan aceites aromáticos que pueden causar olores desagradables o sabor amargo o picante en los alimentos. Los protozoos abundan en el suelo y constituyen a su fertilidad. Un gramo de suelo o de tierra de sembradío puede incluir 10 000 a 100 000 protozoos. Muchos protozoarios se alimentan de bacterias y otros microorganismos. La mayor parte de protozoarios de vida libre son aerobios y nadan en dirección de una fuente de oxigeno gaseoso. Se conocen unas 25 000 especies dentro del filo protozoa. Se agrupan en cuatro subfilos, principalmente según sus métodos de locomoción. Sarcodina; se mueven siguiendo protusiones de protoplasma llamados seudopodos. Mastigophora; son impulsados por uno o cuatro (a veces mas) flagelos largos, a modo de látigos. Ciliata; suelen estar cubiertos de miles de pequeños cilios, como pelos, cuyos movimientos rítmicos coordinados en uno y otro sentido aseguran la locomoción. Sporozoa adultos; suelen ser inmóviles; también difieren de otros protozoarios porque sufren esporulación en una etapa de su ciclo reproductor.1

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 3
PRÁCTICA No.9 CULTIVO Y OBSERVACIÓN DE HONGOS
Objetivo general
Introducción
Materiales Substancias Equipo Dos frascos de boca ancha con tapón de rosca o de presión
Solución de lactofenol Microscopio
Rebanada de pan blanco seco Alcohol 1 lupa Portaobjetos y cubreobjetos 22x22 mm
Aguja enmangada o lanceta
El alumno conocerá las condiciones necesarias para el desarrollo de hongos, y observara su morfología en el microscopio
Muchos hongos forman cuerpos fructíferos especializados, cargados de esporas, macroscópicos, que sobresalen varios centímetros del nivel del suelo, por lo que son fácilmente visibles. La mayoría de los hongos son organismos cenocíticos, esto es, que están formados por una masa multinucleada de citoplasma, la cual esta encerrada en un sistema de tubos rígidos y ramificados, de diámetro uniforme, que se denomina micelio. La pared de este sistema, a diferencia de las paredes celulares de los vegetales, esta formada de quitina, que es un polisacárido distinto a la celulosa. El micelio por lo general, se desarrolla a partir de una espora, que es una célula reproductiva aislada, la cual germina en un medio adecuado. Al germinar, la espora comienza por generar un filamento largo, llamado hifa, que después crece y se ramifica para dar lugar a otras hifas. El micelio es pues un conjunto de hifas. En el caso de los mohos que crecen en el pan, (Rhizopus) en las tortillas y materiales húmedos en general, el micelio y los esporangios son fácilmente perceptibles a simple vista. Dado su confinamiento dentro del sistema de tubos quitinosos, el protoplasma del hongo no puede alimentarse por ingestión de material particulado. Siempre se nutren exclusivamente de material disuelto, y como son incapaces de formar sustancias muy complejas a partir de nutrientes inorgánicos solo proliferan en donde encuentran material orgánico en descomposición; esto es saprobiontes característicos. La mayoría de los hongos lleva vida libre en el suelo o en el agua; algunos de ellos son parásitos de plantas o animales, en los cuales provocan diversas enfermedades.4

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 3
PRÁCTICA No.9 CULTIVO Y OBSERVACIÓN DE HONGOS Procedimiento: 1. Toma los dos frascos y cerciórate que están bien limpios y secos. Parte la rebanada de pan en dos
mitades y pon una de ellas en cada frasco. 2. Ahora agrega 10 gotas de agua al pan de uno de los frascos; al otro no le pongas nada. Cierra bien
los dos frascos, colócalos en un rincón sombreado de laboratorio y obsérvalos diariamente. 3. Colocar sobre un portaobjetos una gota de solución de lactofenol no demasiado grande para evitar
que el cubreobjetos flote y la preparación quede demasiado gruesa. Realizar la misma operación en otro portaobjetos que se usará para lavar la muestra.
4. Tomar el material a observar en una mínima cantidad con agujas finas o lancetas procurando
arrancarlo desde la base y disponerlo con cuidado sobre la gota de uno de los portaobjetos. Con esta especie de lavado se consigue desprender el exceso de conídios que casi siempre llenan estas preparaciones y que impiden ver lo que realmente interesa, los conidióforos.
5. Transportar el material con la lanceta a la gota del segundo portaobjetos que será ya el definitivo. Si
se trata de hongos con picnídios (estructuras globosas tapizadas en su interior por los conidióforos), se aplastarán éstos ligeramente sobre la gota o se seccionarán con un bisturí.
6. Con agujas muy finas se distribuye el material en la gota de manera que no quede amontonado.
Colocar el portaobjetos poco a poco y empezando por un lado para evitar que se formen burbujas entre los dos vidrios.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 3
PRÁCTICA No.10 NUTRICIÓN Y TRANSPORTE EN PLANTAS
Objetivo general
Introducción
Material Substancias Equipo 3 porta objetos Azul de metileno, gotas Microscopio 3 cubre objetos Colorante vegetal 1 bisturí 1 pinza de disección 1 placa de vidrio para realizar cortes 1 hoja de papel de seda para lentes 1 piseta con agua destilada 1 tallo de apio completo 1 hoja de limón o naranja 1 hoja de mango 1 navaja de afeitar de doble filo
Observar e identificar las estructuras de transporte que participan en la nutrición de las plantas
El tallo de una planta esta compuesto en su mayor parte de tejido vascular especializado el cual sirve para transportar entre las hojas y las raíces, el agua y los diversos materiales disueltos. En la punta tiene una yema que contiene tejido meristemático, que produce tanto crecimiento en longitud como nuevas hojas, reserva ciertas sustancias que son utilizadas en el crecimiento normal y sostenimiento de las células del mismo tallo, contiene en muchos puntos una yema que produce flores. La raíz realiza tres funciones principales para el organismo vegetal, fija la plata firmemente al suelo, absorbe del suelo agua y varios minerales y como órgano de almacenamiento de los carbohidratos y otras sustancias elaboradas por la planta. El movimiento ascendente a lo largo del xilema es el resultado del funcionamiento conjunto de tres órganos principales de las plantas; la raíz, el tallo y las hojas. La raíz se encarga de empujar por medio de la presión osmótica, la entrada de agua desde el suelo por los pelos radicales. Las hojas se encargan de jalar mediante el efecto de traspiración. El tallo por medio de las propiedades de cohesión y de adhesión del agua y del pequeño diámetro de los túbulos del xilema, ayuda a mantener la columna de agua mientras que esta se eleva a grandes alturas. La cohesión es la tendencia de la molécula de una sustancia única a permanecer juntas y la adhesión es la tendencia de las moléculas de diferentes sustancias a adherirse unas a otras.3

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología I
BLOQUE DIDÁCTICO 3
PRÁCTICA No.10 NUTRICIÓN Y TRANSPORTE EN PLANTAS
Procedimiento: Comparar diferentes hojas de plantas: mango y limón o naranja. 1. Ordena las hojas, de mayor a menor, según sea la cantidad de nervaduras que presentan y registra
los datos en el cuadro de resultados. 2. Ordena las hojas de mayor a menor según el grosor de las nervaduras y registra los resultados en el
cuadro1. 3. Sobre la placa de vidrio realizar cortes longitudinales muy delgados de las dos hojas; de tal forma
que la luz pase a través de ellos, colocarlos sobre el portaobjetos con ayuda de las pinzas. Agregar una gota de colorante azul de metileno. Con un trozo de papel absorbente retirar el exceso de colorante, colocar el cubreobjetos y observar al microscopio con objetivo de 10x.
Cuadro 1 Registro de resultados
Nombre de la hoja Orden Nervaduras Grosor
1 2
Nombre de la hoja Orden
Nervaduras Grosor 1 2
Escribe el nombre de la hoja en cada espacio según corresponda: 1 mayor, 2 medio.
4. Busca señales del movimiento del agua dentro del tallo de apio. Observa cuidadosamente las hojas
para saber si el agua coloreada llego a las venas de las hojas. 5. Con la navaja haz un corte transversal en el tallo de apio, a 4cm de la parte de abajo. 6. Examina la superficie del corte transversal, busca áreas que contengan el agua coloreada. En un
papel haz un dibujo del corte transversal del tallo. Muestra la localización del tejido conductor de agua.
7. Corta un trozo de 3cm del tallo de apio. Corta esta sección a lo largo y quita del tallo uno de los tubos con color. Con la navaja haz un corte fino transversal del tubo. Con ayuda de las pinzas de disección coloca el corte de tejido sobre un porta objetos. Observa al microscopio con el lente objetivo de menor aumento. Trata de localizar en el tejido las áreas mas finas que tengan de una o varias células de espesor. Cambia a mayor aumento. Observa las células y dibuja varias de ellas.
8. Quita otro tubo de color. Pártelo a lo largo y corta una sección en forma de cuña. Haz una preparación húmeda de este trozo de tejido, obsérvalo con menor y mayor aumento. Dibuja varias células.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 1 Reproducción celular y en organismos: Mitosis
PRÁCTICA No. 1 MITOSIS EN RAÍZ DE CEBOLLA
Objetivo general
Introducción
El estudiante identificará los principales cambios morfológicos que se pretenden durante la profase, metafase, anafase, telofase y citocinesis en células meristemáticas de raíces de cebolla.
El término mitosis en sentido estricto se refiere a la división del núcleo en dos núcleos hijos, y se aplica el termino citocinesis a la división del citoplasma para formar dos células hijas, cada una de las cuales contiene uno de los núcleos. Toda división mitótica es un proceso en el que cada fase va seguida imperceptiblemente de la siguiente. Para fines descriptivos la mitosis se divide en cuatro fases: profase, metafase, anafase y telofase. Entre las divisiones mitóticas se considera que el núcleo esta en reposo o interfase.1
Profase. Se caracteriza porque la cromatina del núcleo va modificando su configuración hasta formar las unidades llamadas cromosomas, que se van individualizando y haciendo mas patentes a medida que avanza la profase, llegándose a distinguir en cada uno de ellos dos filamentos, llamados cromatidas, unidos por un punto, denominado centrómero. Se inicia la desintegración de la membrana nuclear, y cada uno de los centreolos hijos, emigra hacia polos opuestos de la célula, formándose entre ambos unos filamentos proteicos que son las fibras del llamado huso mitótico. Metafase. Se inicia cuando los cromosomas se han individualizado completamente, acortándose y apareciendo mas gruesos. Se disponen además ordenados en un plano ecuatorial de la célula, conectándose por sus centrómeros a las fibras del huso. Anafase. Los cromosomas se dividen a nivel de sus centrómeros, y las cromatidas hermanas, que estaban unidas por dichos centrómeros, se separan y se desplazan hacia los polos de la célula, como si las fibras del huso tiraran de ellas. Telofase. Se inicia con la llegada de los cromosomas a los polos respectivos, que suele acompañarse del proceso de división del citoplasma, el cual empieza con la formación de un surco cerca del plano ecuatorial, o por la producción de un tabique central, hasta que la célula queda dividida por una membrana completa, dando lugar a las dos células hijas. Observando en el microscopio un tejido que este en fase de crecimiento, como ocurre por ejemplo con la punta de una raíz de cebolla, puede observarse que gran cantidad de células aparecen con sus núcleos bien delimitados con cromatina y, por tanto, sin visualizarse en su interior los hilos denominados cromosomas, indicativos de que se esta produciendo la mitosis. Estas células con núcleos bien visibles están en fase de reposo divisional, solo unas pocas células muestran los núcleos menos delimitados y tienen cromosomas más o menos claros.2

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 1 Reproducción celular y en organismos: Mitosis
PRÁCTICA No. 1 MITOSIS EN RAIZ DE CEBOLLA
Materiales Sustancias Equipo
Portaobjetos Solución de Carnoy Microscopio Cubre objetos Acido clorhídrico al 10% Bisturí o cuchilla Acetocarmin Tijeras Esmalte Pinzas Raíz de cebolla Vaso desechable Vaso de precipitado
Procedimiento 13. Cinco o seis días antes de comenzar los experimentos, escoja un bulbo de cebolla fresca y elimine
mediante un raspado con una cuchilla, las raíces secas que se hallan en la base del bulbo. En un frasco boca ancha o un vaso desechable coloque la cebolla sujetándola con palillos de dientes.
14. Vierta agua en el frasco, hasta tocar la base de la cebolla. Mantenga la base de la cebolla húmeda y cambie el agua diariamente.
15. Cuando las raíces nuevas alcancen 3cm. Aproximadamente de longitud, extraiga la cebolla del recipiente y corte el último centímetro de la punta.
16. Deposite estas raíces en la solución fijadora Carnoy (3 metanol: 1 acido acético) durante 20 minutos.
17. Traslade las raíces a un recipiente que contiene acido clorhídrico al 10% 10 minutos. Este tiempo varía según el tipo de célula.
18. Coloque las raíces en un recipiente con agua y lávela por cinco minutos.
19. Traslade las raíces a un recipiente con acetocarmin. Este colorante las debe cubrir totalmente durante 20 minutos.
20. Saque la raíz del recipiente que contiene acetocarmin y póngala en un porta objeto.
21. Corte nuevamente la raíz, dejando el extremo inferior (ápice) y deseche el otro.
22. Coloque el ángulo recto el cubre objeto, bájelo lentamente hasta que se pose en el preparado, y luego haga una leve presión con el dedo hasta conseguir una extensión del preparado.
23. Selle los bordes del cubre objeto con esmalte y deje secar.
24. Observe con el objetivo de menor aumento para localizar las figuras mitóticas, y posteriormente con el objetivo de mayor aumento para discriminar detalles.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÀCTICO 1
PRACTICA No. 2 Observación de cromosomas en Drosophila
Objetivo general
Identificar los cromosomas en una larva de Drosophila Melanogaster
Introducción
Materiales Sustancias Equipo
Frasco de vidrio Acetocarmin Microscopio Fruta en estado de descomposición
Pinzas 2 agujas de disección Portaobjetos Cubreobjetos Toallas de papel
Thomas H. Morgan, trabajando con la mosca del vinagre (Drosophila melanogaster), demostró en 1910 que los genes se encuentran en los cromosomas. Los experimentos de Morgan demostraron: que los genes se encuentran en los cromosomas, que varios genes están en el mismo cromosoma, por lo que tienden a transmitirse juntos, y que sin embargo los cromosomas homólogos pueden intercambiar fragmentos, lo que da como resultado un complejo barajamiento de genes.2 Drosophila melanogaster, es una especie con ciclo de vida corto (10 a 14 días a 24ºC), el huevo de Drosophila mide alrededor de 0,5 mm de longitud. La duración de los distintos estados del ciclo varía con la temperatura, por ejemplo a 25ºC el período huevo larva es de 5 días y el de pupa 4 días. La exposición continua a una temperatura superior a los 30ºC puede producir la esterilidad o muerte de las moscas y a temperaturas, más baja, se prolonga el ciclo de vida, perjudicándose la viabilidad.Todo el desarrollo del huevo se completa dentro de 24 horas.
El período larval consta de tres estados. En el tercer período, la larva puede alcanzar hasta 4,5 mm de longitud. Las larvas poseen gran actividad y son muy voraces observándose en el medio de cultivo un gran número de canales y túneles.3

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 1
PRÁCTICA No. 2 Observación de cromosomas en Drosophila
Procedimiento 1. Realizar un cultivo de larvas D. melanogaster, esto se hace introduciendo alguna fruta en estado de
descomposición en un frasco de vidrio, y dejarlo al aire libre durante 5 días para que la mosca de fruta deposite sus huevos y se desarrollen en larvas.
2. De este cultivo seleccione una larva bien desarrollada de la pared del frasco. Utilice una aguja de disección. Coloque la larva en el centro de un portaobjetos y agregue una gota de acetocarmín a la larva.
Disección de la larva 1. Utilice dos agujas de disección, una en cada mano. 2. Identifique el extremo anterior (cabeza) de su larva localizando los ganchos bucales de color negro. 3. Coloque la aguja de disección en su mano izquierda aproximadamente a una tercera parte del
extremo posterior de la larva y sosténgala suave pero firmemente. 4. Coloque la aguja de disección de su mano derecha justamente atrás de los ganchos bucales de
color negro. 5. Mueva la aguja de disección que se encuentra atrás de los ganchos bucales lentamente en dirección
opuesta a la otra aguja a manera de estirar la larva. 6. Cuando la cutícula se empieza a romper justo atrás de los ganchos bucales, pare el movimiento
hacia adelante, mantenga la aguja firmemente en su lugar, y mueva la otra aguja lentamente en dirección opuesta. Las estructuras internas de la larva serán sacadas afuera del cuerpo.
Identificación de las glándulas salivales 1. Las glándulas salivales son órganos pares localizados cerca del extremo anterior de la larva. Si se
ha realizado bien la disección, deben poderse ver las glándulas a cada lado del intestino, generalmente tienen un cuerpo graso largo, delgado, unido a ellas.
2. Las glándulas salivales deben ahora ser separadas del resto de la larva. Utilizando sus agujas de disección, sostengan el cuerpo y corte la glándula.
Aplastado de las glándulas salivales 1. Doble a lo largo dos toallas de papel juntas. 2. Coloque el montaje con las glándula aproximadamente a 1cm de un extremo de las toallas. 3. Doble las toallas de nuevo de manera que el extremo opuesto al montaje lo cubra. 4. Coloque suavemente su dedo pulgar sobre la toalla que cubre el cubreobjetos y presione lo mas
fuertemente posible.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 1
PRÁCTICA No. 2 OBSERVACIÓN DE CROMOSOMAS EN DROSOPHILA
Procedimiento Observación de los cromosomas 1. Observe su montaje contra luz y localice las glándulas salivales aplastadas. 2. Coloque el montaje en el microscopio con la glándula aplastada bajo el objetivo 10x. Localice el
condensador de su microscopio y la palanca que controla el diafragma. Abra el diafragma hasta 2/3 partes de la abertura total.
3. Observe en el microscopio y mueva el condensador hacia arriba y abajo hasta obtener una iluminación brillante y homogénea en todo el campo.
4. Busque lentamente hasta encontrar un núcleo. Los cromosomas deben de poderse observar claramente aun a bajo poder.
5. Ahora cambie a alto poder colocando en posición el objetivo 40X.Reenfoque moviendo el tornillo micrómetro.
Análisis de los cromosomas. Localización del cromocentro Siga todos los cromosomas hasta el punto donde están unidos. Esta región fuertemente coloreada es el cromocentro y representa una fusión de todos los centrómeros y el cromosoma Y si la larva era macho. Numero de brazos cromosómicos ¿Cuantos brazos cromosómicos tiene D. melanogaster? Haga un dibujo y cuente los extremos libres

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 1
PRÁCTICA No. 3 ELABORACIÓN DE YOGURT
Objetivo general
Introducción
Material Sustancias Equipo 1 recipiente de plástico de 1L 1 Litro de leche fresca o
envasada Balanza analítica
1 recipiente de plástico con tapa de 2L
1 vaso de yogurt natural de 140 ml
Medidor de pH
1 Baño María 1 sobre de leche en polvo 250 gr
1 cuchara NaOH 0.1 N 1 bureta Fenolftaleína 1 soporte universal 1 pinza para bureta 1 matraz Erlenmeyer 1 vaso precipitado de 250 ml 1 pipeta graduada de 10 ml
El yogurt es el producto obtenido mediante la coagulación por fermentación de la leche entera, total o parcialmente descremada, provocada por Streptococcus thermophilus y Lactobacillus bulgaricum. Las cualidades nutritivas del yogurt provienen no solo de la presencia de los compuestos de la leche, sino también de la transformación de estos como resultado de la fermentación ácido láctica causada por los microorganismos. Para la fermentación debe usarse un sitio adecuado con suficiente calor para que el cultivo del yogurt se desarrolle, ( cerca de la estufa ) o si prefiere, colocar en un horno un recipiente con agua a una temperatura mantenidas entre 45° y 47° C durante 2 a 4 hrs. Esto es en estricto sentido, pues si la temperatura asciende a 49° C el cultivo madre mu ere, y si desciende a 35°C la acción de los microorganismo se detiene.4
Observar como actúa la proteína de la leche “caseína” ante el cambio de pH y acidez que se produce por la fermentación de la leche al adicionar cultivo láctico y elevar su temperatura a unos 45ºC - 47ºC durante 4 horas.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 1
PRÁCTICA No. 3 ELABORACIÓN DE YOGURT
Procedimiento 1. Se mezcla 1 litro de leche con 40gr. de leche en polvo en un recipiente de plástico con capacidad
para 2L. 2. Se el adiciona 70gr. de azúcar a la mezcla de leche en polvo con la leche líquida. 3. Se agrega a la mezcla antes realizada ¼ de yogurt natural y se mezcla homogéneamente de
manera lenta y tratando de incorporar todo los ingredientes antes mencionados, dejar reposar la mezcla unos minutos.
4. Se toman 100 ml de toda la mezcla en un recipiente de plástico con capacidad para 1L. 5. Se procede a introducir los dos recipientes de plástico en un baño maría a una temperatura de entre
45°C a 47°C, aproximadamente 4 horas controlando s u temperatura. 6. De la muestra colocada en el recipiente de plástico de 1L. se toman 10 ml y se monitorea el pH y la
acidez cada hora y se anotan los resultados en una tabla para su posterior análisis y discusión. Para medir acidez se hacen titulaciones utilizando una solución de NaOH 0.1N y fenolftaleína como indicador:

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
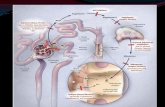
PRÁCTICA No. 4 DETERMINACIÓN DE GLUCOSA EN ORINA
Objetivo general
Introducción
Materiales Sustancias Equipo Pipeta de 10ml Reactivo de Benedict Parrilla eléctrica Vaso de precipitado Orina Tubo de ensaye
Procedimiento:
1. Con una pipeta depositar 5 ml de solución de Benedict en un tubo de ensayo. 2. Agregar 8 gotas de orina y mezclar completamente. 3. Hervir durante 2 minutos. 4. Dejar enfriar la muestra a temperatura ambiente. 5. Examinar la muestra y ver si existe algún cambio de color o precipitado.
Color Resultado Azul Negativo Verde Huellas Verde con precipitado amarillo + Desde verde hasta verde oscuro ++ Castaño +++ Desde anaranjado hasta rojo ladrillo ++++
El alumno aprenderá a identificar anormalidades en una muestra de orina realizar un análisis para determinación de glucosa
La orina esta formada por un 95% de agua, que lleva en disolución sales minerales (cloruros, fosfatos, bicarbonatos, sulfatos, sodio, potasio, amoniaco), desechos del metabolismo proteico (urea, acido úrico y creatinina), pigmentos, toxinas, hormonas sexuales, componentes anormales como albúmina y glucosa, la presencia de glucosa indica que existe una alteración en el metabolismo hepático, como en la diabetes.2 El análisis de orina húmedo o rutinario, proporciona, a costos razonables, un tamizaje adecuado para la detección de anormalidades químicas y morfológicas presentes en la orina. Este procedimiento se compone de dos partes: Un análisis macroscópico, en el cual se determinan las características fisicoquímicas (apariencia, gravedad específica y la medición de los constituyentes químicos por medio de la tira), y un examen microscópico del sedimento, en campo claro o contraste de fases. Por medio de este simple examen de orina, se puede detectar y monitorear muchas entidades que afectan al riñón y al tracto urinario inferior.
La Glucosa es una sustancia reductora, la cual reduce al sulfato cúprico (color azul), de la solución de Benedict , a óxido cúprico (color rojo) que es insoluble.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRÁCTICA No. 5 HIDRÓLISIS DE ALMIDÓN CON AMILASA SALIVAL
Objetivo general
.
Introducción
Materiales Reactivos Equipo 1 Gradilla con 4 tubos de ensayo grandes (10ml)
HCl concentrado Cronómetro
Baño María en ebullición Solución de almidón 1 %: Pipetas de varios volúmenes Solución de yodo Reactivo de Benedict NaOH 0.4 mol/l
Esta práctica tiene como objetivo demostrar que los polisacáridos como el almidón están compuestos de monosacáridos unidos por enlaces glicosídicos.
El almidón está constituido de un solo monosacárido, la glucosa. Las propiedades del almidón son diferentes a las de la glucosa como se evidenciará mediante la hidrólisis del almidón para generar glucosa. Todos los polisacáridos son hidrolizados en sus constituyentes monosacáridos, por la acción de ácidos diluidos. Esta es una reacción gradual que puede observarse durante el tiempo de la sesión de laboratorio. Es por tanto recomendable que usted inicie el proceso de hidrólisis al comenzar la sesión de laboratorio y luego proceda con el resto de las pruebas. La hidrólisis del almidón se puede evidenciar con dos pruebas: a. Desaparición del color azul característico de la prueba del yodo. b. Aparición de glucosa, un azúcar reductor. La aparición de glucosa se evidenciará mediante la prueba de Benedict.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRÁCTICA No. 5 HIDRÓLISIS DE ALMIDÓN CON AMILASA SALIVAL Preparación de las soluciones Solución de hidróxido de sodio. Pesar 16.0 g de NaOH y llevar a 1000 ml con agua destilada. Solución de almidón al 1%. Pesar 1 g de almidón y llevar a 100 ml con agua destilada caliente.
Preparar fresco. Solución de yodo: Disolver un gramo de yodo en una solución de Kl 2%. Procedimiento 1. Coloque 10 ml de una solución de almidón al 1% en un tubo de ensayo grande. Pida a su instructor
que le añada 1 ml de HCI concentrado al tubo. Agite bien y luego coloque el tubo en un baño de agua hirviendo con cuidado de no quemarse.
2. Mientras el almidón se está hidrolizando (tarda de 1:30 h a 2 h aproximadamente), efectúe la prueba
de coloración del yodo. Para ello, añada en otro tubo 5 ml de agua, una gota de la solución de yodo y 0.5 ml de la solución de almidón que tiene hidrolizando en el baño maría a ebullición. Anote el resultado de la prueba del yodo.
3. Después de que la hidrólisis del almidón se haya llevado a cabo por 15 minutos, saque 0.5 ml del
almidón que se está hidrolizando en el baño maría y repita la prueba del yodo. Continúe la hidrólisis hasta obtener una prueba de yodo negativa.
4. Posteriormente y para confirmar la presencia de glucosa, efectúe la prueba de Benedict. Para ello,
añada en un tubo 0.5 ml del almidón hidrolizado, 1 ml de NaOH 0.4 mol/l (para neutralizar el ácido) y 2.5 ml de reactivo de Benedict. Incubar por 8 minutos en agua hirviendo. Anote y analice los resultados. Utilice sus resultados de la Prueba de Benedict y de la Prueba de yodo para almidón para interpretar sus resultados.
5. Haga un cuadro con los resultados de la prueba del yodo a diferentes tiempos y anote el tiempo que
tardó la prueba de Benedict en dar positiva para la presencia de glucosa.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO
PRÁCTICA No. 6 OBSERVACIÓN DE SANGRE HUMANA
Objetivo general
Introducción
Observar e identificar células de sangre humana en el microscopio y adquirir habilidad de trabajo manual en la preparación de muestras microscópicas
La sangre es un líquido viscoso de color rojo, sabor salado y olor característico. Su densidad es de 1,055, su reacción es alcalina, y se encuentra a una temperatura aproximadamente de 38oC. para su mejor estudio se acostumbra a dividirla en elementos formes (o figurados) y plasma. Los elementos formes se conocen con el nombre general de glóbulos, y se pueden agrupar en tres categorías: glóbulos rojos, glóbulos blancos y plaquetas. Los glóbulos rojos también llamados eritrocitos, son corpúsculos discoidales, deprimidos en el centro. A ellos se debe el color rojo de la sangre. Existen un número aproximado de 4.5 a 5 millones por milímetro cúbico. La carencia de un núcleo en los glóbulos rojos es característica de los mamíferos a excepción de los camélidos. En los demás vertebrados existe núcleo, que generalmente es elíptico. Los glóbulos blancos o leucocitos, bajo esa denominación se reúnen células incoloras perfectamente dotadas de núcleo y estructura citoplásmica. Se encuentran entre 5 000 y 9 000 por milímetro cúbico. Su tamaño y morfología están en relación con sus distintas funciones: Serie agrunolítica: las células carecen de granulaciones en el protoplasma, pertenecen a dos tipos, linfocitos y monocitos. Los linfocitos tienen un núcleo grande y esférico y protoplasma poco abundante, de naturaleza basófila. Participan en los procesos inmunitarios al producir anticuerpos esféricos frente a determinados antígenos. Serie granulocítica. Los leucocitos de este grupo poseen granulaciones en el protoplasma. Según las afinidades tintoriales se distinguen: Neutrófilos; se tiñen con colorantes neutros, son los encargados de eliminar microorganismos, partículas extrañas, etc. Eosinófilos; se tiñen con colorantes ácidos. Forman aprox. el 30% del total, y Basófilos; se tiñen con colorantes básicos. Son los menos abundantes. Las plaquetas o trombocitos son pequeños trozos de células producidos por la fragmentación de unas células de gran tamaño existentes en la medula ósea roja, llamadas megacariocitos. Hay unas 250 000 por milímetro cúbico, y su función consiste en iniciar el proceso de la coagulación de la sangre. El pasma sanguíneo: es la fracción liquida de la sangre, puede considerarse que contiene aprox. 90% de agua y 10% de solutos, de los cuales los más importantes son la glucosa, proteínas y sales minerales.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO
PRÁCTICA No. 6 OBSERVACIÓN DE SANGRE HUMANA
Materiales Sustancias Equipo
Pinzas Alcohol Éter Microscopio Aguja esterilizada Metanol Dos portaobjetos Cubreobjetos Frasco lavador Giemsa Pipeta
Procedimiento: Preparación de la muestra de sangre. 1. Limpiar la yema del dedo con un poco de alcohol. Realizar un pinchazo con una aguja o lanceta
esterilizada. Presionar el dedo hacia la punta hasta obtener una gota de sangre que se coloca sobre el portaobjetos.
2. Realizar un frotis. Para ello proceder del siguiente modo: apoyar un porta sobre el que tiene la muestra formando un ángulo de 45o y de manera que la sangre este en contacto entre los dos cristales. Arrastrar el primero sobre el otro de manera que l sangre quede muy bien extendida.
3. Dejar secar al aire. 4. Fijar la muestra con metanol. Para ello añadir metanol y dejar secar durante tres minutos. 5. Retirar el sobrante de metanol. 6. Teñir con Giemsa durante 15 minutos. 7. Lavar la muestra con agua dejándola caer con cuidado con ayuda de un frasco lavador hasta
eliminar los restos de colorante. 8. No es necesario colocar un cubreobjetos. Observar al microscopio, primero con los mínimos
aumentos, luego pasar a aumentos mayores. Para observar con el objetivo de inmersiones necesario poner una gota de aceite de inmersión sobre la muestra.
Precaución: Limpiar el objetivo de inmersión con alcohol éter después de su uso. 9. Dibuja tus observaciones indicando los aumentos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRÁCTICA No. 7 DESARROLLO EMBRIONARIO DEL POLLO
Objetivo general
Introducción
El alumno conocerá e identificara las diferentes etapas que se dan en el desarrollo embrionario así como las condiciones necesarias para que se lleve a cabo
El huevo o cigoto se origina por la fusión total del espermatozoide y del ovulo, fenómeno que constituye la fecundación. El periodo que media entre la fecundación y el nacimiento se llama desarrollo embrionario, el cual en animales como lo mamíferos, comienzan inmediatamente después de la fecundación, mientras que, en otros, tienen que concurrir una serie de circunstancias externas para que se inicie la división del huevo. La célula huevo contiene una sustancia viva, llamada vitelo o plasma germinativo, y una sustancia de reserva, el vitelo o plasma nutritivo. El desarrollo embrionario es un proceso continuo, en el cual sus estadios se desarrollan sin ninguna interrupción; se consideran tres periodos distintos: segmentación, formación de las hojas blastodérmicas y organogénesis. Segmentación del huevo: Después de la fecundación, el huevo se divide, por mitosis sucesivas, numerosas veces. Las células a que da lugar permanecen unidas y se llaman blastómeros. Formación de las hojas embrionarias o morfogénesis: En la blástula llega un momento en que los blastómeros se invaginan, para dar lugar a la forma embrionaria denominada grastula. En la grastula aparece una nueva cavidad interna, limitada por la pared, que esta constituida por dos hojas embrionarias, llamadas ectodermo, la externa, y endodermo, la interna, con lo cual el blastocele desaparece prácticamente. La nueva cavidad formada se llama arquenteron o intestino primitivo, y comunica con el exterior mediante una abertura, el blastoporo. Organogénesis o diferenciación: De cada una de las tres hojas embrionarias, ectodermo, mesodermo y endodermo, se diferencian los distintos tejidos, a partir de los cuales y de su ordenación se formaran los órganos, los aparatos y los sistemas. El proceso, muy complejo es como sigue: Ectodermo. En el se diferencian el ectodermo epidérmico y el ectodermo neural. Del primero se origina el tejido epitelial, que forma la piel y todos sus órganos, tales como uñas, pelos, glándulas y todas las mucosas exteriores. Del ectodermo neural se forma el sistema nervioso central, que en los invertebrados tienen un desarrollo ventral, mientras que en los vertebrados es dorsal. Mesodermo. De esta forma el tejido conjuntivo en su totalidad y también el tejido muscular y todo el esqueleto, junto con los aparatos circulatorio, excretor y reproductor. Endodermo. A partir de el se forman el tubo digestivo así como el revestimiento interior del aparato respiratorio y la vejiga de la orina.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRÁCTICA No. 7 DESARROLLO EMBRIONARIO DEL POLLO
Materiales Equipo 10 Huevos fecundados Termómetro Una incubadora (caja de unicel) Dos recipientes de plástico Agua Pinzas y tijeras Foco
Procedimiento La práctica consiste en incubar 10 huevos fecundados, durante 21 días, y cada tercer día se cáscara uno de ellos para observar el desarrollo del embrión. Se registraran las observaciones. 1. El día anterior al comienzo de la experiencia debemos montar la incubadora, para que adquiera la
temperatura adecuada (37.6 °C) y la humedad relativ a requerida (80 %). Estas condiciones pueden generarse en el interior de una caja de cartón cerrada, con un foco de 60 Watts y dos vasijas de agua en su interior.
2. Al día siguiente, introducimos los huevos en la incubadora y realizamos una señal en la cáscara con un lápiz en la parte del huevo que queda hacia arriba (no usar nunca rotuladores, ya que los componentes de la tinta pueden resultar tóxicos para los embriones). Esta marca nos señalará la parte más elevada del huevo, que es donde se suele alojar el embrión, facilitándonos de esta forma su búsqueda cuando abramos el huevo.
3. Es importante no cubrir la superficie de los huevos total o parcialmente con elementos impermeables, ya que el embrión no recibiría el oxígeno necesario.
4. Después de 3 días de incubación, romper con pinzas el cascaron comenzando en la marca, anota
las observaciones, (cambios de coloración, formación de tejidos, formación de órganos) 5. En el sexto día el primer paso será practicar un pequeño orificio en uno de los huevos, por la marca
de lápiz que se hizo, ayudándonos con las pinzas, con pequeños golpes, hasta que seamos capaces de introducir las pinzas para poder ir haciendo una ventana cada vez mayor en la cáscara. Este proceso finaliza en el momento que somos capaces de observar al embrión en desarrollo y la ventana es lo suficientemente grande para poder maniobrar con las pinzas y las tijeras.
6. En este momento, procedemos a cortar con las tijeras las membranas que mantienen unido al embrión al resto de las estructuras del huevo, y ayudándonos de una espátula pequeña, recogemos al embrión y lo trasladamos a un recipiente.
7. Una vez que tenemos al embrión en el pocillo, se eliminan las membranas que lo envuelven (membrana amniótica), siempre bajo la lupa, ya que estas estructuras son demasiado pequeñas para hacerlo sin la ayuda óptica. En este momento ya se pueden visualizar todas las estructuras superficiales embrionarias.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRÁCTICA No. 8 DETERMINACIÓN DEL GRUPO SANGUÍNEO Y FACTOR Rh
Objetivo general
Introducción
Los grupos sanguíneo son una forma de clasificar la sangre, dependiendo de ciertas características que pose, estas dependen de los antígenos que los glóbulos rojos presentan en su superficie y en el suero de la sangre. Las dos clasificaciones más importantes para describir grupos sanguíneos en humanos son los antígenos y el factor RH. Las transfusiones de sangre entre grupos incompatibles pueden provocar una reacción inmunológica que puede desembocar en hemólisis, anemia, fallo renal, shock, o muerte. Los glóbulos rojos o hematíes son células sanguíneas, por lo tanto todos los tenemos. Sin embargo, en la membrana de los glóbulos rojos pueden existir unas proteínas especiales: son las glucoproteínas A y B. Así, un glóbulo rojo puede tener proteína A, proteína B, tener ambas o no tener ninguna. De manera que un individuo tendrá grupo sanguíneo A si sus glóbulos rojos tienen la glucoproteína A en su membrana, siguiendo el mismo criterio para el resto de los grupos (si no existe proteína, entonces será de grupo sanguíneo O). Estas proteínas corresponderían a lo que denominan antígenos. Ahora bien, en el plasma sanguíneo tenemos anticuerpos. Evidentemente, un individuo del grupo A no podrá tener anticuerpos anti-A, pues ésto no sería viable (la sangre coagularía). Así los individuos A tendrán anticuerpos anti-B, los individuos B tendrán anticuerpos anti-A, los individuos AB no tendrán anticuerpos de este tipo, los individuos O tienen los dos tipos de anticuerpos. De la misma manera, el factor Rh es otra proteína que existe en los glóbulos rojos de algunas personas. El factor Rh positivo es un factor hereditario dominante. Este asunto tiene especial importancia en donaciones de sangre. Como hemos visto, un individuo A tiene en su plasma anticuerpos anti-B, así que no podrá recibir sangre de un individuo B, pues estos anticuerpos provocarían la coagulación de la sangre del donante en los vasos sanguíneos de la persona receptora.6
En esta práctica cada alumno del grupo conocerá su grupo sanguíneo y el factor RH y conocerá la técnica para determinar el grupo sanguíneo

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRÁCTICA No. 8 DETERMINACIÓN DEL GRUPO SANGUÍNEO Y FACTOR Rh
Materiales Sustancias 4 portaobjetos Solución anti-A Material punzante estéril Solución anti-B Algodón Solución anti-D (anti Rh) Agua oxigenada Una gota de sangre
Procedimiento 1. Colocar una gota de suero anti-A, una de anti-B y una de anti-D, cada una en un portaobjetos
diferente. 2. Pinchar la yema del dedo, previa desinfección con alcohol o agua oxigenada. Depositar una gotita
de sangre en cada portaobjetos y mezclar con los sueros, utilizando palillos de madera. 3. Observar los resultados y determinar el grupo sanguíneo y el factor Rh, de acuerdo al cuadro
siguiente:
PORTAOBJETOS
A PORTAOBJETOS
B PORTAOBJETOS
D GRUPO SANGUINEO
+ - + A Rh+ - + + B Rh+ + + - AB Rh- - - - O Rh-
Nota: El signo (+) indica coagulación. El signo (–) indica que no hubo coagulación.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Biología II
BLOQUE DIDÁCTICO 4
PRACTICA No. 9 FERMENTACIÓN
Objetivo general
Introducción
C6H12O6 2C2H5OH + CO2
El estudiante conocerá el proceso de fermentación alcohólica y comprobara la producción de CO2 durante ésta.
La primera reacción biológica catalizada, conocida desde hace unos diez mil años. En ella, ciertos microorganismos (llamados levaduras o fermentos) transforman los azucares de las frutas en alcohol, el principio de la fermentación no son las células vivas, sino sustancias químicas producidas por ellas, es decir, enzimas. La fermentación consiste en una serie de reacciones enzimáticas de oxido-reducción. Hay varios tipos de fermentaciones; la alcohólica es producida por levaduras-hongos microscópicos unicelulares-que se denominan genéricamente fermentos. En la fermentación alcohólica se convierte un carbohidrato, como glucosa, en etanol y dióxido de carbono. Enzimas de levadura
La alcohólica es una fermentación anaeróbica, es decir, no necesita oxigeno para llevarse a cabo. En unos casos se aprovecha el CO2 (para que esponje el pan durante su fabricación por ejemplo) y en otros el etanol (producción de vino, cerveza y otras bebidas fermentadas). Hay otros tipos de fermentaciones. Las que a continuación comentaremos son producidas por bacterias. Fermentación acética. Responsable de la conversión del etanol en acido acético; se presenta en un vino que se agria. Fermentación láctica. La produce el Lactobacillus, que convierte la lactosa en acido láctico, como en la obtención del yogurt. Fermentación pútrida. Consiste en la desintegración de las proteínas de plantas y animales muertos a. En esta practica se llevara a cabo la fermentación alcohólica se convertirá la glucosa del jugo de manzana en alcohol, liberando CO2.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Materiales Sustancias Equipo
4 matraces Erlenmeyer de 100 ml Solución de azúcar al 5% Balanza analítica Levadura de pan 3 gr Frutas dulces (manzana,
naranja, piña, uva)
4 mangueras de hule de 30 cm Agua 4 tapones de corcho o hule Lienzo de manta de cielo 4 vasos de precipitados
Procedimiento
1. Obtener 100 ml de jugos de diferentes frutas dulces como manzana, naranja, uva o piña. Filtrar con manta de cielo para eliminar partículas de fruta.
2. Preparar 100 ml de una solución de sacarosa (azúcar de mesa) al 5%.
3. Colocar el jugo y la solución de azúcar en diferentes matraces Erlenmeyer de 100 ml.
4. Adicionar 0.5gr de levadura a cada matraz.
5. Tapar los matraces con un tapón de corcho o hule (algodón bien apretado también sirve) e
insertar a través del tapón la manguera de hule, cuyo extremo se colocará en un vaso de agua. 6. Observar durante tres días.
7. Registrar la emisión de gases a través del vaso de agua en cada una de las botellas con jugo y
la botella con solución azucarada. Detectar el olor del producto fermentado.
¿Que substancias se producen mediante la fermentación al cabo de ese tiempo?8

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la Química. 1.3 La materia
PRÁCTICA No 1. Elementos, Compuestos y Mezclas
Objetivo
Introducción
El alumno diferenciará los elementos de los compuestos y mezclas.
Las sustancias elementales son aquellas que no pueden ser descompuestas en otras más sencillas, por
el tipo ordinario de cambio químico. El nombre de elemento se les da a las sustancias elementales, ya
sea cuando se encuentran aisladas o combinadas con otras para formar compuestos.
Los compuestos son sustancias que pueden ser descompuestas en dos o más de carácter más simple.
Los compuestos son químicamente homogéneos, la proporción de sus componentes es fija, al formarse
hay siempre manifestación de energía, los elementos que los forman pierden sus propiedades
originales. Existen compuestos binarios (HCl, NaBr, CaI, H2O), ternarios (HNO3, BaSO4, CCl4) y
cuaternarios (NH4HCO3, Na2HPO4).
Cuando dos o mas sustancias se unen en forma aparente para dar una tercera, se obtienen las mezclas,
las cuales pueden definirse como la unión de dos o mas sustancias, en las que cada una conserva
separadamente todas sus propiedades originales, el conjunto presenta el promedio de las propiedades
de aquellas que lo forman. Las mezclas son químicamente heterogéneas, la proporción de sus
componentes es variable, al formarse no se manifiesta absorción o desprendimiento de energía. Sus
constituyentes conservan por separado íntegras sus propiedades originales. Las sustancias que las
forman se pueden separar por métodos físicos y mecánicos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la Química. 1.3 La materia
Materiales Substancias Equipo 1 vidrio de reloj Limadura de hierro (Fe) Parrilla eléctrica Arena Clavo oxidado Mechero de alcohol Pinzas de crisol Cinta de magnesio (Mg) Imán Azúcar 1 vaso de precipitado
Procedimiento
Elementos
1. Mostrar los elementos Hierro (clavo de fierro) y Magnesio (cinta de magnesio).
Compuestos
2. Limar el clavo oxidado y eliminar todo el óxido (óxido de hierro Fe2O3)
3. Tomar la cinta de magnesio con las pinzas y llevar a la flama, cuidando de no ver directamente
la llama que se produce, depositar las cenizas en el vidrio de reloj.
4. Registrar tus observaciones e indicar las reacciones.
Mezclas
5. En un vaso de precipitado preparar una solución al 10% de azúcar, determinar si se trata de un
compuesto o una mezcla.
6. Tapar el vaso de precipitado con el vidrio de reloj de manera que quede un poco abierto y en
diagonal y calentar en la parrilla eléctrica. Cuando comience a condensarse el agua sobre el
vidrio de reloj colocar un vaso de precipitado para colectarla. Calentar hasta que se formen
cristales en el vaso que contiene la solución de azúcar.
7. Mezclar arena con limadura de hierro y separar la limadura de hierro utilizando un imán.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la química; 1.5 Cambios de la materia
PRÁCTICA No 2. Cambios físicos
Objetivo
Introducción
Materiales Substancias Equipos 2 vasos de precipitado 250ml Agua Congelador 1 termómetro Hielo Parrilla eléctrica 2 Matraces Erlenmeyer 250ml Cristales de yodo Tapón de hule bihoradado Tubo de vidrio Condensador Vidrio de reloj
El alumno identificará los fenómenos o cambios físicos que sufre la materia
Toda materia se transforma continuamente. El cambio es una constante manifestación de la naturaleza.
Los cambios físicos son alteraciones que no implican transformación de la composición química de la
sustancia, es decir no hay formación de nuevas sustancias. Entre este tipo de cambio se encuentran los
del estado físico (evaporación, sublimación, fusión, congelación, etc.) y los cambios de estructura cristalina
de un solido.
Las propiedades físicas son las características propias de una sustancia que se observan en ausencia de
cualquier cambio de composición. El color, olor, sabor, estado físico (solido, líquido o gaseoso), densidad,
punto de ebullición, punto de fusión, la conductividad térmica o eléctrica, son propiedades físicas. Estas
propiedades también pueden ser extensivas las cuales dependen de la cantidad de sustancia presente:
temperatura, densidad, color, etc.
La incremento de energía de un sistema puede originar modificaciones en las propiedades físicas del
sistema. Si se calienta un sólido, éste se puede fundir. Los sólidos se dilatan con la elevación de la
temperatura, si se calienta un líquido, este se evapora la destilación es una aplicación de esta propiedad.
Otra aplicación es el secado de materiales. La generación de vapor de una caldera, es un ejemplo de la
utilizacion de la energía térmica para generar fuerza motriz.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la química; 1.5 Cambios de la materia
PRÁCTICA No 2. Cambios físicos Procedimiento Congelación
1. Agregar agua en un vaso de precipitado, en otro vaso agregar una solución de sal al 20% y medir su temperatura inicial.
2. Llevar ambos vasos de precipitado al congelador de un refrigerador, hacer mediciones de la
temperatura cada 10 minutos, hasta la congelación del agua y la solución de sal.
3. Construir una tabla con los resultados que obtuviste. Evaporación y Condensación
1. Colocar en dos matraces Erlenmeyer de 250 ml aproximadamente 50 ml de agua y 50 ml de salmuera al 20%
2. Colocar un tapón de hule e introducir el termómetro en cada uno de los matraces. Adaptar el
condensador y colocar el vaso de precipitado a la salida de éste.
3. Calentar los dos matraces hasta ebullición, manteniendo el calentamiento por 3 o 4 minutos más (Evaporación). Registra las temperaturas de ebullición de ambas sustancias.
4. Cesar el calentamiento después de colectar aproximadamente 20 ml de líquido en el vaso de
precipitados (Condensación). Anota tus observaciones. Sublimación del yodo
1. Colocar en un vaso de precipitado de 250 ml limpio y seco unos cristales de yodo.
2. Tapar el vaso de precipitado con un vidrio de reloj que contenga hielo
3. Calentar el vaso de precipitado por aproximadamente 2 o 3 minutos (Sublimación).
4. Observar la parte inferior de la cápsula de porcelana (Cristalización).

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la química; 1.5 Cambios de la materia
PRÁCTICA No 3. Transferencia de calor
Objetivo
Introducción
Calcular la cantidad de calor que se transfiere durante un cambio físico
Se define una cantidad de calor como la energía térmica necesaria para producir algún cambio físico o
químico. Las unidades son Joule, caloría, kilocaloría y Btu. La cantidad de energía térmica necesaria para
elevar la temperatura de una sustancia varía para diferentes materiales. Debe haber alguna propiedad del
material que se relaciona con la cantidad de calor absorbido o liberado durante un cambio de temperatura.
Para establecer esta propiedad, se define el concepto de capacidad calorífica.
La capacidad calorífica de un cuerpo es la razón de la cantidad de calor suministrado con el
correspondiente incremento de temperatura del cuerpo.
Capacidad calorífica = Q / ∆t, (cal/°C, Caloría sobre grado Celsius).
La masa no se considera porque es una propiedad del objeto. Para lograr que sea una propiedad del
material se define la capacidad calorífica por unidad de masa, a esta propiedad se le da el nombre de
capacidad calorífica específica, o calor específico.
La capacidad calorífica específica es la cantidad de calor necesario para elevar un grado la temperatura de
una unidad de masa
C = Q / m∆T, (J / Kg °C, Joule/ Kilogramo por grado Celsius)
El calor específico del agua es igual a 1 cal/g°C. Una vez establecidos los calores específicos de gran
numero de materiales, en muchos experimentos pueden determinarse la energía térmica liberada o
absorbida. Por ejemplo la cantidad de calor Q requerida para elevar la temperatura de una masa m en el
intervalo de temperatura ∆T,
Q = mc∆T (cal, Kcal o Btu)
Existen ciertos fenómenos curiosos cuando un sólido se funde o un líquido hierve. En estos casos la
temperatura permanece constante.
En el cambio de fase de sólido a líquido, el calor latente de fusión es la cantidad de calor por unidad de
masa requerida para cambiar la sustancia de la fase sólida a la fase líquida a la temperatura de fusión.
Lf = Q / m
El calor latente de fusión del agua es de 80 cal/g o 144 Btu/lb.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la química; 1.5 Cambios de la materia
PRACTICA No 3. Transferencia de calor
Materiales Substancias Equipo
2 Vasos de precipitado de 250 ml Agua Balanza analítica Trozo de cobre Parrilla eléctrica Termómetro
Procedimiento Medición del calor
1. Colocar en un vaso de precipitado 100 ml de agua y medir su temperatura inicial.
2. Calentar un trozo de cobre durante 5 minutos en la parrilla eléctrica, medir y registrar la temperatura.
3. Colocar el trozo de cobre en 100 ml de agua, medir y registrar la temperatura final.
4. Calcular la cantidad de calor absorbida por el cobre, considerando que el calor cedido por el metal
es igual al calor ganado por el agua.
Medición de calor en cambio de fase
1. Pesar un vaso de precipitado de 250 ml, colocar en el vaso 200 ml de agua, medir y registrar la
temperatura inicial del agua.
2. Pesar nuevamente el vaso de precipitado con agua.
3. Calentar hasta que comience a ebullir, medir y registrar la temperatura.
4. Pesar el contenido del vaso después de haberse consumido cierta cantidad de agua. (aprox. 50 ml)
5. Calcular la cantidad de calor necesario para elevar la temperatura del agua a la temperatura de
ebullición
6. Calcular la cantidad de calor que se requiere para evaporar el agua.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química 1
BLOQUE DIDÁCTICO 1: Objeto de estudio de la química; 1.5 Cambios de la materia
PRÁCTICA No 4. Cambios químicos
Objetivo
Introducción
Materiales Substancias Equipo Vasos de precipitado de diferentes tamaños 2 Velas de parafina Mechero de alcohol Tubos de ensayo Nitrato de sodio (NaNO3) Espátula Mercurio (Hg) Palillo Frasco de 500 gr y un frasco de 5 Kg Cerillo
Procedimiento 1. Encender 2 velas cortas y simultáneamente cubrirlas con frascos de tamaños muy diferentes. (un
frasco de 500 gr y un frasco de 5 Kg). Describe lo que sucede en ambos casos. Elabora una explicación referida al comportamiento de las velas.
2. En un tubo de ensayo colocar un volumen de 1cm3 de nitrato de sodio y calentarlo en la llama de un mechero, sujetándolo con una pinza (la boca del tubo debe inclinarse en sentido contrario al de tu cara). Encender la punta del palillo, apagar e introducir en el tubo de ensayo. Anota tus observaciones.
3. Calentar mercurio en un tubo de ensaye utilizando pinzas, registra tus observaciones e indica la reacción, después deja enfriar, y registra tus observaciones e indica la reacción.
El alumno identificará que es un cambio químico por medio de la reacción de combustión
Las propiedades químicas son las que exhibe la materia cuando experimenta cambios en su composición,
ya sea transformándose en una sustancia nueva por descomposición o por reacción con otras especies.
Por ejemplo: descomposición por efecto del calor, reacción de un ácido, combustión, etc.
Los cambios químicos son las alteraciones que sufren las sustancias para producir nuevas sustancias
químicas.
La cesión de energía a un sistema puede originar modificaciones en las propiedades químicas del sistema,
cuando se modifican las propiedades químicas de un sistema, significa que ha habido una reacción
química.
La reacción química en cuestión puede ocurrir entre distintos componentes del sistema, o en el caso de un
solo reactivo, éste puede reaccionar consigo mismo, por efecto de la influencia de la energía cedida al
sistema constituido por este reactivo.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 2: Estructura atómica de la materia. 2.2 Partículas subatómicas
PRÁCTICA No 5. Tubo de rayos catódicos
Objetivo
Introducción
El alumno será capaz de describir el comportamiento de los rayos catódicos en campos eléctricos y magnéticos.
Desde el año de 1705, se conocía que es posible producir un fulgor de luz cuando un objeto
eléctricamente cargado se coloca en un recipiente de vidrio del cual se ha extraído parte del aire; es decir
en el cual se ha hecho un vacio parcial. El fenómeno ocurre solamente con bajas presiones de aire.
El tubo de rayos catódicos consiste en un tubo de vacío, compuesto en su interior por dos alambres y dos
placas (ver figura1) en la cuales se colocan cargas eléctricas, que se denominan electrodos. El electrodo
con carga positiva es el ánodo y el de carga negativa es el cátodo. Si los electrodos se cargan con cargas
opuestas y el tubo se evacua lentamente, se produce un fulgor alrededor del cátodo. Al continuar la
evacuación ocurre una descarga entre los dos electrodos y en el tubo empieza a notarse un fulgor. Si se
coloca un objeto entre los dos electrodos se produce una sombra, lo que sugiere que hay una radiación
que emana del cátodo hacia el ánodo.
William Crookes estudió esta radiación y concluyó que la radiación frecuentemente llamada rayos
catódicos, consiste de partículas negativamente cargadas que emanan del cátodo a altas velocidades.
J.J. Thompson demostró entonces que este rayo puede ser desviado por un campo electrostático y
también por uno magnético. Aunque estos rayos viajan en línea recta, su trayectoria puede ser desviada
en campos magnéticos o eléctricos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 2: Estructura atómica de la materia. 2.2 Partículas subatómicas
PRÁCTICA No 5. Tubo de rayos catódicos
Materiales Equipo 1 condensador 1 Tubo de Crookes con pantalla de sulfuro de zinc (ZnS) 1 pila 2 pinzas de caimán con conductores 1 imán
Procedimiento 1. Conectar la fuente de alto voltaje a los electrodos del tubo de Crookes, por medio de las pinzas de
caimán. 2. Aplicar el voltaje requerido, y observar que se produce un haz luminoso de color verde fluorescente. 3. Colocar un campo magnético (imán) en la trayectoria de la radiación y observar la deflexión
producida. 4. Realizar el mismo procedimiento con un campo eléctrico. Nota: El ánodo esta conectado a un objeto metálico la cual se interpone en la trayectoria de los rayos que emanan del cátodo, produciendo una sombra en la pantalla. El polo positivo atrae los rayos y el polo negativo los repele. Esto prueba que los rayos catódicos poseen carga negativa.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 2: Estructura atómica de la materia 2.2 Partículas subatómicas
PRÁCTICA No 6. Espectros de emisión
Objetivo
Introducción
Que el alumno observe la radiación emitida por diferentes sustancias de prueba
El espectro de emisión atómica de un elemento es un conjunto de frecuencias de las ondas emitidas por átomos de ese elemento. Cada espectro de emisión atómico de un átomo es único y puede ser usado para determinar si ese elemento es parte de un compuesto desconocido. Las características del espectro de emisión de algunos elementos son claramente visibles a ojo descubierto cuando estos elementos son calentados. Por ejemplo, cuando un alambre de platino es bañado en una solución de nitrato de estroncio y después es introducido en una llama, los átomos de estroncio emiten color rojo. De manera similar, cuando el cobre es introducido en una llama, ésta se convierte en luz azul. Estas caracterizaciones determinadas permiten identificar los elementos mediante su espectro de emisión atómica. El hecho de que sólo algunos colores aparezcan en las emisiones atómicas de los elementos significa que sólo determinadas frecuencias de luz son emitidas. Cada una de estas frecuencias están relacionadas con la energía con la fórmula:
Efoton = hv
Donde E es la energía, h es la constante de Planck y v es la frecuencia. La frecuencia v es igual a: v=c/λ. Donde c es la velocidad de la luz en el vacío y λ es la longitud de onda. Con esto se concluye que sólo algunos fotones con ciertas energías son emitidos por el átomo. El principio del espectro de emisión atómica explica la variedad de colores en signos de neón, así como los resultados de las pruebas de las llamas químicas mencionadas anteriormente. Las frecuencias de luz que un átomo puede emitir depende de los estados en que los electrones pueden estar. Cuando están excitados, los electrones se mueven hacia una capa de energía superior. Y cuando caen hacia su capa normal emiten la luz. La tabla 1 da las amplitudes aproximadas de longitudes de onda para los colores del espectro visible.
Tabla 1 Longitudes de onda del espectro visible en Angstroms
Color Longitud de onda Angstroms (Å) Rojo 6200-7500 Naranja 5900-6200 Amarillo 5700-5900 Verde 5000-5700 Azul 4500-5000 Violeta 4000-4500

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 2: Estructura atómica de la materia 2.2 Partículas subatómicas
PRÁCTICA No 6. Espectros de emisión
Material Reactivos Equipo
Cloruro de sodio NaCl Mechero de alcohol 1 asa de platino o lápiz Cloruro de litio 1 vidrio de reloj Cloruro de estroncio 1 vaso de precipitados de 50ml Cloruro de potasio KCl Cloruro de bario BaCl Acido clorhídrico concentrado
HCl
Procedimiento 1. Colocar en el vaso de precipitado aproximadamente 25 ml de ácido clorhídrico y tapar con el vidrio
de reloj. 2. Sumergir la punta del asa de platino en el ácido clorhídrico y quemar en la flama durante un minuto. 3. Tomar una pequeña porción de cada una de las sales con el asa de platino y llevarlas a la flama
directa, hasta que se consuma por completo. (Cada vez que se trabaje con una nueva sal se debe sumergir el asa de platino en el ácido.)
4. Observar y registrar la coloración que produjo la flama. 5. Determinar la longitud de onda, la frecuencia y la energía de la radiación emitida, basándose en su
color.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 3: La tabla periódica de los elementos. 3.2 Propiedades de los elementos derivados en su posición de la tabla periódica
PRÁCTICA No 7. Reacciones características de los grupos I, II y III.
Objetivo
Introducción
Relacionar las propiedades de los elementos con su ubicación en la tabla periódica
Los metales alcalinos, Litio (Li), Sodio (Na), Potasio (K), Rubidio (Rb), y Cesio (Cs), son metales blandos
de color gris plateado que se pueden cortar con un cuchillo presentan densidades muy bajas y son
buenos conductores de calor y la electricidad; reaccionan de inmediato con el agua, oxígeno y otras
substancias químicas, y nunca se les encuentra como elementos libres (no combinados) en la naturaleza.
Los compuestos típicos de los metales alcalinos son solubles en agua y están presentes en el agua de
mar y en depósitos salinos. Como estos metales reaccionan rápidamente con el oxígeno, se venden en
recipientes al vacío, pero por lo general se almacenan bajo aceite mineral queroseno. En este grupo los
más comunes son el sodio y el potasio.
Entre los elementos del grupo II A. Se encuentran el Berilio (Be), Magnesio (Mg), Calcio (Ca), Estroncio
(Sr), Bario (Ba) y el Radio (Ra). Estos metales presentan puntos de fusión mas elevados que los del
grupo anterior, sus densidades son todavía mas bajas, pero son algo mas elevadas que la de los metales
alcalinos comparables. Son menos reactivos que los metales alcalinos. Todos los metales alcalinotérreos
poseen dos electrones de valencia y forman iones con doble carga positiva (2 +).
El primer elemento del grupo III A es el Boro (B), un metaloide con un punto de fusión muy elevado y en
el que predominan las propiedades no metálicas. los otros elementos que comprenden este grupo son:
Aluminio (Al), Galio (Ga), Indio (In), y Talio (Tl), que forman iones con una carga triple positiva ( 3 + ). La
densidad y las características metálicas aumentan conforme se incrementa él número atómico de este
grupo.
Los elementos del grupo VI A, conocidos como la familia del grupo del oxígeno, comprenden al Oxígeno
(O), Azufre (S), Selenio (Se), Telurio (Te) y Polonio (Po). Aunque todos ellos tienen seis electrones de
valencia, sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta el
número atómico.
El grupo VII A Comprenden el Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), y Astatino (At). El nombre de la
familia halógeno proviene de las palabras griegas que significan " formadores de sales". Cada átomo de
halógeno tiene siete electrones de valencia. Como elementos, los halógenos son todos diatómicos, tienen
dos átomos por molécula y son demasiado reactivos como para encontrarse libres en la naturaleza.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 3 La tabla periódica de los elementos. 3.2 Propiedades de los elementos derivados en su posición de la tabla periódica
PRACTICA No 7. Reacciones características de los grupos IA, IIA y IIIA.
GRUPO IA METALES ALCALINOS Materiales Reactivos Equipo
1 vaso de precipitado 200 ml Sodio metálico Mechero de alcohol 1 vidrio de reloj Potasio metálico Papel filtro Solución de fenolftaleína Agua destilada
Procedimiento 1. Cortar un pequeño trozo de sodio, secar por presión entre dos papeles. Depositar el sodio en un
vaso de precipitados que contenga aproximadamente 100 ml de agua destilada con unas gotas de fenolftaleína, cubrir inmediatamente el vaso con un vidrio de reloj.
2. Cuando la reacción ha terminado se destapa el vaso y se comprueba, aproximando una llama, la
flamabilidad del gas producido.
GRUPO IIA METALES ALCALINOTERREOS
Materiales Reactivos Equipo 10 tubos de ensaye Cinta de magnesio Mg Mechero de alcohol 1pinza para tubo de ensaye Acido clorhídrico concentrado HCl 2 vasos de precipitado de 100 ml Hidróxido de sodio NaOH al 10% Cerillo Solución de MgCl2 Calcio metálico
Procedimiento 1. Poner en dos tubos de ensayo, cinta de magnesio (de 1 a 2 cm de longitud) y agua destilada. Es
importante que la superficie del magnesio este brillante (la superficie del Mg deberá limpiarse previamente con papel esmeril hasta brillo plateado). Enseguida aparecerán burbujas. Calentar uno de los tubos; al otro agregar HCl diluido y calentar. Comparar las reacciones.
2. Colocar en un tubo de ensayo agua fría y trozos de calcio. Comprobar la flamabilidad de los gases producidos, acercando inmediatamente un cerillo encendido a la boca del tubo.
3. Preparar Mg (OH)2, (añadiendo NaOH al 10% a una disolución de MgCl2). Agregar acido clorhídrico diluido al precipitado.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 3 La tabla periódica de los elementos. 3.2 Propiedades de los elementos
derivados en su posición de la tabla periódica
PRÁCTICA No 7. Reacciones características de los grupos IA, IIA y IIIA. GRUPO IIIA DEL ALUMINIO
Material Reactivos 10 tubos de ensayo Lámina de aluminio (lata de refresco) 2 pipetas graduadas de 5 ml Acido clorhídrico diluido 2 pipetas graduadas de 2 ml Solución de cloruro mercúrico HgCl2 Algodón
Procedimiento 1. Poner trozos pequeños de aluminio en dos tubos de ensaye que contengan: Tubo1. Agua destilada. Tubo2. Acido clorhídrico diluido. 2. Posteriormente agregar solución de hidróxido de amonio al tubo que contiene acido clorhídrico. 3. Frotar un trozo de aluminio con un algodón empapado en disolución de cloruro mercúrico después
de introducir en agua destilada. 4. Anotar las observaciones.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 3: La tabla periódica de los elementos. 3.2 Propiedades de los elementos derivados en su posición de la tabla periódica
PRÁCTICA No 8. Reacciones características de los grupos VIA y VIIA
Objetivo
Introducción
Relacionar las propiedades de los elementos con su ubicación en la tabla periódica
Los elementos del grupo VI A, conocidos como la familia del grupo del oxígeno, comprenden al Oxígeno (O), Azufre (S), Selenio (Se), Telurio (Te) y Polonio (Po). Aunque todos ellos tienen seis electrones de valencia, sus propiedades varían de no metálicas a metálicas en cierto grado, conforme aumenta el número atómico. Los tres primeros miembros (O, S y Se) son no metales y los dos últimos (Te y Po) son metaloides. El oxígeno es un gas diatómico, el azufre y el selenio tienen las formulas moleculares S8 y Se8, el Telurio y el Polonio poseen estructuras tridimensionales más extensas. Los elementos de este grupo forman una gran cantidad de compuestos moleculares con los no metales. El Oxígeno, el Azufre, el Selenio y el Telurio forman aniones dinegativos. El grupo VIIA comprenden el Flúor (F), Cloro (Cl), Bromo (Br), Yodo (I), y Astato (At). El nombre de la familia halógeno proviene de las palabras griegas que significan " formadores de sales". Cada átomo de halógeno tiene siete electrones de valencia. Como elementos, los halógenos son todos diatómicos, tienen dos átomos por molécula y son demasiado reactivos como para encontrarse libres en la naturaleza. Los halógenos tienen altas energías de ionización y gran afinidad electrónica. Los aniones mononegativos derivados de los halógenos se denominan halogenuros (Bromuro, Cloruro y Yoduro). La gran mayoría de los halogenuros de los metales alcalinos y alcalinotérreos son compuestos iónicos. Los halógenos también forman muchos compuestos moleculares, entre ellos mismos y con elementos no metálicos de otros grupos. Los halogenuros de hidrógeno se disuelven en agua para formar los ácidos halhídricos (por ejemplo, clorhídrico)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 3: La tabla periódica de los elementos. 3.2 Propiedades de los elementos derivados en su posición de la tabla periódica
PRÁCTICA No 8. Reacciones características de los grupos VIA y VIIA.
GRUPO VIA
Materiales Reactivos Equipo Matraz Erlenmeyer 250 ml Azufre elemental Medidor de pH Vaso de precipitado 250 ml Agua destilada Balanza digital Tubo de vidrio Mechero de alcohol Manguera de hule Tapón monohoradado
Procedimiento
1. Colocar aproximadamente 2gr de Azufre en el matraz Erlenmeyer 2. Colocar 100 ml de agua en el vao de precipitado. Medir el pH. 3. Tapar el matraz. Colocar el tubo de vidrio y la manguera en la horadación y el otro extremo de la manguera en el interior del vaso con agua. 4. Calentar suavemente el matraz Erlenmeyer hasta observar el burbujeo en el agua del vaso de precipitado. 5. Después de dos minutos de burbujeo retirar el fuego. Medir el pH del líquido en el vaso. 6. Anotar tus observaciones y las reacciones químicas que ocurren en el matraz y en el vaso de precipitados.
GRUPO VIIA HALÓGENOS
Materiales Reactivos Equipo 2 Matraces Erlenmeyer de 500ml Polvo de antimonio Mechero de alcohol 4 Pipetas de 10ml Mercurio Hg 2 Tubos de ensayo Cristales de yodo 1 tubo de vidrio y manguera Permanganato de potasio KMnO4 1 Matraz de bola Oxido de manganeso MnO2 Tapón de corcho Acido clorhídrico concentrado HCl
Procedimiento: 1. Introducir polvo de antimonio en un tubo de ensayo y hacer reaccionar con cloro gaseoso. Nota: para producir el cloro gaseoso añadir al matraz bola Aprox. 3.0 gr de KMnO4 y 1.0 gr. de MnO2; posteriormente agregar HCl concentrado hasta el desprendimiento de vapores. Anota tus observaciones para esta reacción. 2. Colocar unas gotas de mercurio en un tubo de ensayo y agregar sobre este unos cristales de yodo
(si no se observa reacción calentar suavemente). Registra tus observaciones para esta reacción.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 4: Enlace químico. 4.1 Tipos de enlaces químicos
PRÁCTICA No 9. Conductividad eléctrica de electrolitos y no electrolitos
Objetivo
Introducción
El alumno será capaz de distinguir entre una solución electrolítica y una no electrolítica
Al comparar las soluciones acuosas de azúcar, sal común y acido clorhídrico, el azúcar forma un sólido molecular y, al disolverse en agua, las moléculas de azúcar permanecen intactas. Estas moléculas se separan del cristal y pasan a formar parte del líquido. Pero el cloruro de sodio se comporta de manera completamente diferente. Al disolverse la sal común, pasan a la solución iones de sodio cargados positivamente e iones cloruro cargado negativamente y ambos iones se comportan de manera independiente:
NaCl(s) Na+ (aq) + Cl- (aq)
Con el acido clorhídrico, ocurre algo semejante. Esta sustancia es un gas en condiciones normales que, a muy bajas temperaturas, se condensa en forma de solido molecular. Cuando el acido clorhídrico se disuelve en agua, en la solución se encuentran iones hidrogeno cargados positivamente y iones cloruro cargados negativamente. Como ocurrió con el cloruro de sodio, se forma una solución conductora que contiene iones:
HCl (g) H+
(aq) + Cl - (aq)
Las sustancias semejantes al NaCl(s) y al HCl(g) que se disuelven en agua formando soluciones conductoras, se denomina electrolitos. La conducción de la electricidad se basa en el movimiento de los iones a través de la solución, moviéndose los iones positivos y negativos con independencia.
Los iones presentes en una solución electrolítica se originan de dos maneras:
Pueden estar presentes en el complejo puro, como ocurre en los sólidos iónicos; cuando uno de estos iones se disuelve en agua, los iones se separan y se mueven a través de la solución. Sin embargo, existen compuestos que aunque forman iones al disolverse en agua, no los contienen en estado anterior puro, no importa que sean sólidos, líquidos o gaseosos.
Una sustancia que se disuelve y produce exclusivamente iones se llama electrolito fuerte.
No todas las sustancias que forman electrolitos se disocian tan completamente. Por ejemplo, el vinagre es una solución acuosa de acido acético. Esta solución produce la corriente eléctrica, lo cual indica la presencia de iones:
CH3COOH H+ (aq) + CH3COO- (aq)
Pero solamente una pequeña fracción del acido acético disuelto forma iones. Tales, sustancias que se disuelven y se asocian parcialmente en iones, de llaman electrolitos débiles.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química I
BLOQUE DIDÁCTICO 4: Enlace químico 4.1 Tipos de enlaces químicos
PRÁCTICA No 9. Conductividad eléctrica de electrolitos y no electrolitos
Materiales Sustancias Conductímetro cualitativo Solución de ácido clorhídrico HCl 1:10 Clavija Solución de hidróxido de potasio KOH 10% Contacto Solución de CuSO4 al 10% Pizeta Solución de azúcar C6H12O6 al 10% Foco Solución de ácido acético CH3COOH al 10% Clavija Solución de Urea Agua destilada
Procedimiento: 1. Tome el conductímetro cualitativo para soluciones y con la pizeta lave los electrodos e introdúzcalos
en la solución de estudio. 2. Conecte la clavija al contacto y cierre el circuito por medio del apagador, observe si enciende o no
enciende el foco, en el caso de que encienda observe con que intensidad lo hace. (Alta, media o baja).
Figura 2 Conductímetro cualitativo
3. Apagar el foco accionando el apagador y desconectar la clavija del contacto. 4. Construir un cuadro con los nombres de cada compuesto, su fórmula, el tipo de enlace que poseen
sus moléculas y la intensidad luminosa observada en el conductímetro.
Electrodos

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
BLOQUE DIDÁCTICO 1. Nomenclatura de compuestos ino rgánicos. 1.2 Los compuestos que forma el oxígeno
PRÁCTICA No 1. Formación de óxidos
Objetivo
Introducción
El alumno conocerá las reacciones por las cuales se forman óxidos y anhídridos
Los óxidos son un extenso grupo de compuestos binarios que resultan de la unión de un metal o no metal con el oxígeno. Se clasifican en óxidos básicos u óxidos metálicos y óxidos ácidos o no metálicos.
Los óxidos metálicos son compuestos con elevado punto de fusión que se forman como consecuencia de la reacción de un metal con el oxígeno. Esta reacción es la que produce la corrosión de los metales al estar expuesto al oxígeno del aire.
Un ejemplo de formación de un óxido metálico es la reacción del magnesio con el oxígeno, la cual ocurre con mayor rapidez cuando se quema una cinta de magnesio. La cinta de magnesio de color grisáceo se torna en un polvo blanco que es el óxido de magnesio. Ecuación:
Por ejemplo 2Mg + O2 2MgO
Los óxidos metálicos se denominan también óxidos básicos por que tiene la propiedad de reaccionar con el agua y formar bases o hidróxidos.
Por ejemplo MgO + H2O Mg (OH)2
Las bases se pueden reconocer fácilmente a través de un cambio de color en un indicador acido-básico como el papel tornasol. Las disoluciones básicas tornan el papel tornasol rosado a un color azul al entrar en contacto con ella.
Los óxidos no metálicos o ácidos son compuestos de bajos puntos de fusión que se forman al reaccionar un no metal con el oxígeno. Se denominan también anhídridos y muchos de ellos son gaseosos.
Por ejemplo C + O2 CO2
Cuando los óxidos metálicos reaccionan con el agua forman ácidos, por lo que se le llaman también óxidos ácidos.
Por ejemplo CO2 + H2O H2CO3
Los ácidos se pueden también reconocer por el cambio de color de un indicador ácido-base como el papel tornasol. Las disoluciones ácidas tornan el papel tornasol azul a un color rosado al entrar en contacto con ella.Los ácidos producidos por la reacción de los óxidos no metálicos con el agua se denominan Oxiácidos debido a que contienen oxígeno.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de compuestos ino rgánicos. 1.2 Los compuestos que forma el oxígeno
PRÁCTICA No 1. Formación de óxidos
Materiales Reactivos Equipo Pinzas de crisol Cinta de magnesio Medidor de pH Mechero de alcohol Agua 2 tubos de ensaye Pastilla de Alka-Seltzer Papel tornasol rosa y azul Jugo de limón Globo Fenolftaleína
Procedimiento
Formación de un óxido
1. Tomar una cinta de magnesio de 3 cm aproximadamente y sujetar con las pinzas para crisol. Calentar una esquina del extremo libre hasta que alcance la ignición. No mirar la luz producida directamente ya que es muy intensa. (indica la reacción)
2. Depositar las cenizas formadas en el experimento anterior en un tubo de ensaye y agrega 5ml de agua, con el agitador tratar de disolver toda la muestra. Calentar ligeramente sin hervir y deja reposar unos segundos, escribe las reacciones obtenidas en los pasos 1 y 2.
3. Humedecer con la solución formada el extremo de una tira de papel tornasol color rosa, observa lo que sucede con la coloración del papel y regístralo.
4. Agregar al tubo de ensaye tres gotas de fenolftaleína, observa el cambio de coloración y regístralo. Medir el pH del líquido.
Formación de un anhídrido 1. En un tubo de ensayo agregar jugo de limón (o 2 ml de vinagre). 2. Vertir un trozo de pastilla Alka-Seltzer y rápidamente ajusta el globo al tubo de ensayo. Observar el
fenómeno que ocurre y argumenta la naturaleza de los productos formados. Anota tus observaciones e indica la reacción.
3. Una vez terminada la reacción anterior, con cuidado retira el globo del tubo de ensayo y de inmediato ajústalo a otro tubo que contenga agua ligeramente caliente. Mezcla lo mas que puedas el agua con el gas contenido en el globo y comprueba si al humedecer un trozo de papel tornasol azul se observa algún cambio.
4. Medir el pH, anota tus observaciones y escribe la reacción que tiene lugar.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de los compuestos inorgánicos. 1.2.2 Óxidos no metálicos o ácidos (anhídridos)
PRÁCTICA No 2. Formación de ácidos o anhídridos
Objetivo
Introducción
Materiales Reactivos Cuchara de combustión Azufre elemental Cartulina Agua 2 Vasos de precipitado 250ml Rojo de metilo Tubo de vidrio Fenolftaleína
El alumno conocerá las reacciones que intervienen en la formación de ácidos
Hidrógeno significa productor de agua, se forma en el interior de la tierra debido a la reacción química
que se establece entre el agua y los metales. Durante las erupciones volcánicas sale a la atmosfera.
El hidrógeno libre se encuentra en la atmosfera en una cantidad mínima (0.01%).
El hidrógeno se combina con todos los elementos no metálicos, dando compuestos gaseosos, tiene
una gran tendencia a combinarse con el oxígeno, uniéndose a el para formar agua, puede arder en el
seno del oxígeno y así produce una llama poco brillante que es sumamente caliente (2800ºC) cuando
el O2 es puro.
El hidrógeno se combina con metales dando compuestos que reciben el nombre de hidruros. Es un
elemento que se encuentra presente en todos los ácidos.
Los ácidos son sustancias que tienen sabor agrio y poseen un valor de pH menor de 7 y no viran la
fenolftaleína. Todos los ácidos tienen un elemento no metálico e hidrógeno, pero unos contienen
oxígeno y otros no. Según esto pueden clasificarse en dos grupos:
Hidrácidos: si no contienen oxígeno
Oxácidos: si contienen oxígeno
Los hidrácidos tienen una nomenclatura muy simple: primero se indica la palabra genérica ácido y
después la especifica del elemento no-metálico terminada en hídrico.
Los oxácidos son sustancias que presentan carácter ácido y resultan de la combinación entre un
óxido no metálico y el agua.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de los compuestos inorgánicos. 1.2.2 Óxidos no metálicos o ácidos (anhídridos)
PRÁCTICA No 2. Formación de ácidos o anhídridos
Procedimiento Formación de oxiácidos a partir de un óxido metálico
1. En un vaso de precipitado introduce una cucharilla de combustión con azufre en ignición.
2. Cuando se apague el azufre cubre la boca del vaso con una cartulina. Vierte un poco de agua en el
interior del vaso de precipitado y agita. Agrega unas gotas de fenolftaleína y anota tus
observaciones. Recuerda que los ácidos se mantienen incoloros en presencia de fenolftaleína.
3. Mide el pH de la solución y escribe las reacciones que ocurren en los pasos 1 y 2.
Formación de ácido carbónico
1. En un vaso de precipitado que contenga 100ml de agua, agregar el indicador rojo de metilo.
2. Burbujear CO2, esto se hace introduciendo un tubo de vidrio en el vaso con agua y soplando con la
boca. Registra tus observaciones.
3. Mide el pH del líquido y anota tus observaciones. Escribe la reacción que tiene lugar.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de compuestos inor gánicos. 1.3 Hidróxidos o bases
PRÁCTICA No 3. Formación de hidróxidos o bases
Objetivo
Introducción
Materiales Reactivos 2 Tubos de ensayo Agua destilada Cerillo Sodio metálico Na Papel tornasol rosa Òxido de calcio CaO Fenolftaleína
El alumno comprobara las reacciones de formación de hidróxidos
Los hidróxidos son sustancias que tienen un sabor amargo, que presentan un pH mayor que 7 y que enrojecen la solución alcohólica de fenolftaleína. El análisis químico revela que los hidróxidos están formados por un metal, por oxígeno y por hidrógeno. Su nomenclatura es muy simple y se designan con la palabra genérica hidróxido seguida del nombre del metal. Los hidróxidos se pueden considerar como derivados de la reacción entre un oxido metálico y el agua. Su reacción de formación se escribe así
Óxido metálico + agua hidróxido Ningún metal genera más de dos hidróxidos. Los hidróxidos deben sus características químicas al grupo OH, que recibe la denominación hidroxilo u oxhidrilo. El grupo OH de las moléculas de los hidróxidos, se ioniza cuando el hidróxido se pone en contacto con el agua, impartiendo a las soluciones propiedades contrarias a las que presentan los ácidos. Cuando los óxidos metálicos y los hidróxidos se disuelven en agua adquieren otra propiedad llamada alcalinidad que puede comprobarse con el uso de indicadores como fenolftaleína o papel tornasol. Otro método para obtener hidróxidos, debido especialmente a la reactividad de los elementos, se puede observar en aquellos metales que pertenecen a la familia IA Y IIA de la tabla periódica, cuando se hacen reaccionar con agua como se muestra en la siguiente expresión:
M + H2O MOH + H2(g)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de compuestos inor gánicos. 1.3 Hidróxidos o bases
PRÁCTICA No 3. Formación de hidróxidos o bases
Procedimiento Formación de hidróxidos a partir de un metal activo 1. Tomar un tubo de ensayo y agregar 4 ml de agua destilada y adiciona un trozo pequeño muy
pequeño de sodio, tapa inmediatamente con el dedo y cuando la presión sea suficiente acerca a la boca del tubo un cerillo encendido, si arde será indicativo de la presencia de un combustible. Indica la reacción.
2. Comprobar el carácter químico de la solución formada empleando tanto papel tornasol rosa como
fenolftaleína. Mide el pH y anota tus observaciones. Formación de hidróxidos a partir de un óxido metáli co 1. En un tubo de ensaye que contenga 2 gr de oxido de calcio (CaO), vierte un poco de agua y agita.
Agrega unas gotas de fenolftaleína y va el color que se forma. mide el pH y anota las observaciones.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de los compuestos inorgánicos. 1.5 Sales
PRÁCTICA No 4. Formación de sales
Objetivo
Introducción
Materiales Reactivos Equipo Cápsula de porcelana Lentejas de hidróxido de sodio Mechero de alcohol
Varilla de vidrio Agua Gotero de vidrio Acido clorhídrico HCl Parrilla eléctrica Solución de hidróxido de calcio Ca(OH)2 Tubo de ensayo Fenolftaleína Soporte universal Bebida gaseosa incolora Tubo de vidrio Tapón de corcho monohoradado
El alumno conocerá las reacciones que intervienen en la formación de sales
Las sales son substancias que se obtienen al sustituir los hidrógenos de los ácidos por metales. Esto puede hacerse por reacción directa entre un metal y un ácido:
Zn + H2SO4 ZnSO4 + H2 O por reacción de neutralización entre un ácido y un hidróxido
2NaOH + H2SO4 Na2SO4 + H2O Pueden existir tres tipos de sales; 1) Sales neutras. Provienen de un proceso de neutralización que es la combinación de todos los
cationes H+ de un ácido con todos los aniones OH- de un hidróxido, de la que se obtiene agua y una sal neutra.
2) Hidrógeno sales: Resultan del reemplazo parcial de los hidrógenos de un ciclo por átomos metálicos. Se forman con ácidos que presentan dos o más hidrógenos en su molécula.
A través de la siguiente experimentación podrás determinar que al reaccionar un hidróxido se obtiene una sal y agua.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 1. Nomenclatura de los compuestos inorgánicos. 1.5 Sales
PRÁCTICA No 4. Formación de sales
Procedimiento
1. En una cápsula de porcelana coloca unas lentejas de hidróxido de sodio.
2. Agregar un poco de agua y agita con una varilla de vidrio hasta que todo el hidróxido de sodio entre
en solución.
3. Añadir unas gotas de solución alcohólica de fenolftaleína y empleando un gotero, deja caer sobre la
solución unas gotas de acido clorhídrico HCl hasta que desaparezca el color rojo de la solución y
esta quede incolora.
4. Ahora con cuidado, porque puede haber proyecciones, coloca la capsula con el producto de la
reacción a la llama hasta que el liquido se evapore. Retira la cápsula del fuego y deja enfriar.
Observa el residuo y pruébalo. Escribe la reacción ocurrida y anota tus observaciones.
Formación de una oxisal
Puedes obtener un anhídrido a partir de una bebida gaseosa incolora
1. Medir con una probeta 10 ml de bebida gaseosa y colócalo en un tubo generador como se muestra
en la figura. Calienta ligeramente y permite que el gas contenido burbujee en una solución de
hidróxido de calcio.
Figura 1 Montaje para la obtención de una oxisal
Registra todas tus observaciones.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 2. Reacciones químicas inorgánica s. 2.2.2 Tipos de reacciones
PRACTICA No 5. Tipos de reacciones
Objetivo
Introducción
El alumno será capaz de diferenciar las diferentes clases de reacciones y enlaces que se forman en los diferentes compuestos, utilizando el equipo, material y reactivos adecuados.
Las reacciones químicas siempre transforman una o mas sustancias diferentes; esto es, los átomos se
reagrupan para formar otras sustancias. Como se conocen millones de reacciones, es conveniente
clasificarlas en grupos o tipos: 1) Reacciones de combinación, 2) Reacciones de desplazamiento, 3)
Reacciones de descomposición, 4) Reacciones reversibles e irreversibles, y 5)Reacciones de oxido–
reducción. Las ecuaciones químicas se emplean para describir las reacciones químicas e indican: 1. Las
sustancias que reaccionan o reactivos. 2. Las sustancias que se forman o productos y 3. Las cantidades
de las sustancias que participan en la reacción.
Las reacciones de síntesis son en las que se unen químicamente dos o más elementos o compuestos
para formar cuerpos mas complicados.
A + B A B
Las reacciones de adición son aquellas en las que las sustancias reaccionantes son dos compuestos, o un
compuesto y un elemento, y la sustancia producida es un compuesto.
A + B A B
Las reacciones de análisis son aquellas en las que la sustancia reaccionante es un compuesto que por
acción del calor, de la electricidad o de algún otro medio (por ejemplo enzimas en procesos de
fermentación), se descompone en dos o mas elementos o compuestos.
A B A + B
En las reacciones de sustitución simple las sustancias reaccionantes son un compuesto y un elemento, y
las sustancias producidas, un elemento y un compuesto diferente de los anteriores.
A + BC AC + B
En las reacciones de doble sustitución las sustancias reaccionantes son dos compuestos, y las sustancias
producidas son otros dos compuestos diferentes de los anteriores; de tal manera que hay un intercambio
de iones entre las sustancias participantes.
AB + CD AC + BD

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 2. Reacciones químicas inorgánica s. 2.2.2 Tipos de reacciones
PRACTICA No 5. Tipos de reacciones
Materiales Reactivos Equipo Alambre de cobre Òxido rojo de mercurio (HgO) Mechero de alcohol Solución de Cloruro de bario BaCl2 Solución de acido clorhídrico HCl 1:1 Granalla de zinc (Zn) Solución de Sulfato de sodio Na2SO4
Procedimiento: 1. Poner un alambre de cobre en el mechero, hasta que tome un color negro, luego disuelva lo negro
en un vaso de precipitado que contenga HCl; luego vierta NH4OH concentrado. Indique la reacción. 2. Calentar en el mechero un tubo de ensaye que contenga 0.5g de HgO y con un punto de ignición,
identificar el gas desprendido. Indique la reacción. 3. Añadir 1.0 ml, de una solución de acido clorhídrico a un tubo de ensaye que contenga granilla de
zinc. Observar el fenómeno e indique la ecuación. 4. Agregar 1.0 ml de una solución de Na2SO4 a un tubo de ensaye que contenga solución de BaCl2.
Indique la reacción.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 2. Reacciones químicas inorgánicas . 2.2.2 Tipos de reacciones
PRÁCTICA No 6. Reacciones exotérmicas y endotérmicas
Objetivo
Introducción
Materiales Reactivos 2 Vasos de precipitado 250ml Sodio metálico Na 1 Tubo de ensayo Agua Papel filtro Óxido de calcio o cal viva CaO Termómetro Nitrato de potasio KNO3
Óxido rojo de mercurio HgO
El alumno sabrá identificar las reacciones exotérmicas y endotérmicas y calculara el cambio de entalpía en estas reacciones
La termoquímica es la parte de la química trata de las leyes y fenómenos térmicos en las combinaciones
químicas.
Cuando un sistema absorbe calor, parte de la energía absorbida que puede utilizarse para realizar un
trabajo, tal como elevar un peso, expandirse contra la atmosfera o accionar una batería; y otra parte se
almacena dentro del propio sistema como energía de los movimientos internos de los átomos y moléculas y
como energía de interacción entre los átomos y moléculas. Esta parte se denomina energía interna.
La entalpía, H, es una magnitud muy estrechamente relacionada con la energía interna y definida de forma
que el incremento de entalpía de cualquier sistema que sufre un cambio a presión y temperatura constante
es exactamente igual al calor absorbido en el proceso si el único trabajo realizado es la expansión contra la
atmosfera. Aunque estas restricciones de la definición puedan parecer severas, son aproximadamente las
condiciones en que se verifican la mayor parte de los procesos químicos en recipientes abiertos. Como
consecuencia de la ley de la conservación de la energía, la entalpía contenida en un sistema es una
propiedad fija de dicho sistema y las variaciones de entalpía de dos procesos opuestos entre sí son iguales
en valor absoluto y de signo contrario.
Un proceso es endotérmico cuando ∆H es positivo esto es, cuando el calor es absorbido. Un proceso es
exotérmico cuando ∆H es negativo, esto es cuando se libera calor.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 2. Reacciones químicas inorgánicas . 2.2.2 Tipos de reacciones
PRACTICA No 6. Reacciones exotérmicas y endotérmicas
Procedimiento
1. Tomar un trozo de sodio metálico (del tamaño de una lenteja) y secarlo con el papel filtro.
2. En un vaso de precipitado que contenga aproximadamente 100ml de agua adicionar el sodio
metálico.
3. Medir la temperatura a la que ocurre la reacción, y tocar el vaso de precipitado por la parte externa,
registra tus observaciones y escribe la reacción ocurrida.
4. En un vaso de precipitado adicionar 100ml de agua y después 10gr de oxido de calcio, anota tus
observaciones. Anota tus observaciones y escribe la reacción que tuvo lugar.
5. En un tubo de ensayo agregar 2 gr de óxido rojo de mercurio y calentarlo suavemente con la flama
del mechero. Indica la reacción, anota tus observaciones y escribe la reacción.
6. Agregar 2 gr de nitrato de potasio en un vaso de precipitado que contenga 50 ml de agua. Indica la
reacción y anota tus observaciones.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 3. Cambios energéticos en las reac ciones químicas. 3.2.1 Factores que afectan la velocidad de las reac ciones
PRÁCTICA No 7. Factores que afectan la velocidad de las reacciones
Objetivo
Introducción
Conoce los efectos que tienen los factores de temperatura, naturaleza de los reactivos, concentración y
efecto de catalizador en las reacciones.
Hay cuatro factores que tienen gran influencia sobre la velocidad de las reacciones químicas:
La naturaleza de los reactivos. No todas las reacciones de combustión suceden a la misma velocidad, ni
todos los procesos ácido-base, ni todas las reacciones de sustitución. Cada reacción tiene una velocidad
determinada por la facilidad con la que sus reactivos pueden llevar a cabo el proceso químico en cuestión.
La concentración de los reactivos. Para que ocurra una reacción química los reactivos deben entrar en
contacto íntimo, o sea, sus moléculas deben tocarse. Si la reacción es con un sólido, se efectúa mas rápido
si el sólido esta finamente dividido.
La temperatura. Por lo general la velocidad de una reacción aumenta cuando se eleva la temperatura.
La presencia de los catalizadores. Muchos procesos químicos y bioquímicos se llevan a cabo a diferente
velocidad, dependiendo de su interacción con agentes externos a la reacción llamados catalizadores. Un
catalizador es una sustancia que se encuentra presente en el medio en el que se lleva a cabo una reacción,
y que produce un efecto en la aceleración o desaceleración, sin que se aprecie cambio químico en su
estructura al inicio y al final del proceso.
Se acostumbra dividir los catalizadores en homogéneos y heterogéneos. La catálisis homogénea tiene lugar
en un mismo estado de agregación. La catálisis heterogénea ocurre en diferentes fases, es decir el
catalizador puede ser un sólido suspendido en la mezcla de los reactivos, o bien se deposita en una
superficie donde chocan los reactivos gaseosos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 3. Cambios energéticos en las reac ciones químicas. 3.2.1 Factores que afectan la velocidad de las reac ciones
PRÁCTICA No 7. Factores que afectan la velocidad de las reacciones
Materiales Reactivos Equipo 6 tubos de ensaye 5 ml Permanganato de potasio
(KMnO4) 0.01 M Cronómetro
Pinzas para tubos de ensayo
10 gotas Acido sulfúrico H2SO4 2M
Agitador 5ml Na2C2O4 Termómetro 1ml H2O2 3% 5 ml HCl 6 M 5 ml HCl 3 M 7 ml HCl 2 M 9 cm de cinta de magnesio 9 ml de NaS2O3 0.1 M Catalizador (MnCl2 y MnSO4)
Procedimiento:
Experimento 1 Naturaleza de los reactantes.
1. A un tubo de ensayo con 1ml de permanganato de potasio 0.01M, agregar 10 gotas de acido
sulfúrico 2M, después adicionar 1ml de Na2C2O4 y anotar el tiempo de reacción. Escribir la reacción.
2. Al segundo tubo de ensayo (que contiene 1ml KMnO4 00.01 M) hacer reaccionar con 10 gotas de
acido sulfúrico, y posteriormente adicionar 1ml de H2O2 y anotar el tiempo de reacción. Escribir la
reacción.
Experimento 2 Efecto de la concentración
3. Agregar a 3 tubos de ensayo HCl 6M, 3M y 2M, respectivamente. Agregar a cada tubo 3 cm de cinta
de magnesio, medir el tiempo de reacción. Escribir la reacción.
Experimento 3 Efecto de la temperatura
4. A 3 tubos de ensayo agregar 3 ml de Na2S2O3 0.1M.
5. Para el tubo uno medir la temperatura inicial y después adicionar 2 ml de HCl, medir el tiempo que
transcurre desde el momento en que se mezclan los dos reactantes hasta que aparece una turbidez
(formación de un precipitado).
6. Para el tubo 2, calentar el tubo a 10 oC por encima de la temperatura del tubo 1, adicionar 2 ml de
HCl 2 M, anotar el tiempo de reacción.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 3. Cambios energéticos en las reac ciones químicas. 3.2.1 Factores que afectan la velocidad de las reac ciones
PRÁCTICA No 7. Factores que afectan la velocidad de las reacciones
7. Calentar el tubo 20oC por encima de la temperatura del tubo 1, agregar 2 ml de ácido clorhídrico 2
M, y anotar el tiempo de reacción.
Experimento 4 Efecto de un catalizador
8. Agregar a 3 tubos de ensayo Na2C2O4 y H2SO4.
9. Al tubo 1 agregar KMnO4 (anotar el tiempo de reacción)
10. Al tubo dos agregar MnCl2 y KMnO4 (anotar tiempo de reacción)
11. Al tubo tres agregar MnSO4 y KMnO4 (anotar tiempo de reacción)
12. Escribir las reacciones ocurridas.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 4. Estequiometría. 4.1 Estequiometría
PRÁCTICA No 8. Estequiometria
Objetivo
Introducción
Material Reactivos Parrilla eléctrica Dióxido de manganeso 2 tubos de ensaye Clorato de potasio KClO3 1 pinza para bureta 1 balanza analítica
Procedimiento:
1. Añadir en un tubo de ensaye limpio y seco una pequeña cantidad de MnO2, aproximadamente 0.01 gr.
2. Adicionar aproximadamente 1 gr de clorato de potasio (KClO3) bien seco y comprobar nuevamente el peso.
3. Tapar ligeramente el tubo y adáptalo al soporte, calentar lenta y suavemente hasta que el sólido se funda.
4. Intensificar el calentamiento cuando sea posible durante varios minutos, hasta el desprendimiento total del oxígeno, lo que se conocerá si al introducir en el tubo una astilla de ignición, no aumenta su combustión, dejar enfriar el tubo y pesar con mucho cuidado tan exactamente como sea posible.
Estudiar las combinaciones ponderales entre los elementos, compuestos y cuerpos en general
La estequiometría es la rama de la química que se encarga del estudio cuantitativo de los moles, las
masas y los volúmenes de los reactivos y los productos que participan en una reacción.
En esta práctica se investigará la relación del peso del cloruro de potasio y del oxígeno en el clorato de
potasio, así como la utilidad y la aplicación de los resultados, al analizar una mezcla de clorato de potasio.
Cuando el clorato de potasio se calienta por algún tiempo se descompone en oxígeno el cual puede ser
desechado o recogerse en un recipiente para su posterior reconocimiento, potasio y cloro que permanecen
en forma de cloruro de potasio. El peso baja debido al desprendimiento del oxígeno del clorato de potasio,
el cual permite calcular la cantidad de KCl que existe en la mezcla original.
Para aumentar la velocidad de la reacción, puede utilizarse dióxido de manganeso (MnO2) como
catalizador cuyo peso deberá considerarse, ya que permanece constante.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 5. Contaminación. 5.1.2 Lluvia ácida
PRÁCTICA No 9. Lluvia ácida
Objetivo
Introducción
Materiales Reactivos 2 Matraces Erlenmeyer Sulfito de sodio Na2SO3 1 Vaso de precipitado Agua Un embudo de decantación Acido clorhídrico HCl Un tubo de vidrio Una varilla de vidrio Papel indicador universal de Ph Una hoja de árbol Un trozo de mármol Una hoja de papel Pipeta y extractor
La lluvia es ligeramente ácida, tiene un pH aproximadamente de 5.6 debido a que contiene disuelto dióxido
de carbono (CO2) de la atmósfera. La acidez del agua de lluvia empieza a ser preocupante cuando su pH
es inferior a 5.6, entonces se habla de lluvia ácida, y está asociada al uso de combustibles fósiles, se debe
a la emisión de dióxido de azufre y óxidos de nitrógeno por las centrales térmicas generadoras de energía
eléctrica, plantas de fundición de minerales, calderas industriales y los escapes de vehículos de motor.
La lluvia ácida se forma cuando la humedad en el aire se combina con los óxidos de nitrógeno y el dióxido
de azufre emitidos por fábricas, centrales eléctricas y vehículos que queman carbón o productos derivados
del petróleo. En interacción con el vapor de agua, estos gases forman ácido sulfúrico y ácido nítrico.
Finalmente, estas sustancias químicas caen a la tierra acompañando a las precipitaciones, constituyendo
la lluvia ácida.
Los contaminantes atmosféricos primarios que dan origen a la lluvia ácida pueden recorrer grandes
distancias, trasladándolos los vientos a cientos o miles de kilómetros antes de precipitar en forma de rocío,
lluvia, llovizna, granizo, nieve, niebla o neblina. Cuando la precipitación se produce, puede provocar
importantes deterioros en el ambiente.
El alumno comprobara el efecto que tiene el dióxido de azufre (SO2) sobre distintos materiales que se concentran en la naturaleza.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 5. Contaminación. 5.1.2 Lluvia ácida
PRACTICA No 9. Lluvia ácida
Medidas de seguridad:
Sulfito de sodio: la inhalación de la sustancia puede provocar reacciones asmáticas, esta sustancia es
peligrosa para el medio ambiente. Acido clorhídrico. Corrosivo.
Procedimiento
1.- Se introduce 1gr de sulfito de sodio en un matraz Erlenmeyer(A)
2.- En el otro Erlenmeyer (B) se añaden 150 ml de agua. Se mide el pH de esta agua.
3.- En el embudo de decantación se introducen por su parte superior, 50 ml de acido clorhídrico ya
diluido (una parte de HCl concentrado por dos de agua).
4.- Se monta un dispositivo que comunica los dos matraces mediante una manguera de hule. Un
extremo de la manguera está sumergido en el agua del matraz B. El embudo de decantación también se
halla colocado en el matraz A a través de un tapón.
5.- Se abre lentamente la llave del embudo y se deja caer el ácido sobre el sulfito de sodio.
6.- No se observa una reacción rápida. Vamos a ayudar a que se produzca la reacción calentando el
matraz A. Se observará un rápido desprendimiento gaseoso de SO2 en forma de burbujeo en el agua
del Erlenmeyer B.
7.- Medir el pH del matraz B cuando han pasado 5 minutos desde el comienzo de la reacción.
8.- Separar 20 ml de disolución del matraz Erlenmeyer B y se coloca en un vaso de precipitado.
9.- Con una pipeta se extrae cierta cantidad de líquido de esta disolución y se depositan algunas gotas
sobre la hoja de árbol, el trozo de mármol y la hoja de papel. Se observa el efecto producido al cabo de
24 horas.
10.- Escribir las reacciones que ocurren en los dos matraces.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 5. Contaminación. 5.1.3 Efecto invernadero
PRÁCTICA No 10. Efecto invernadero
Objetivo
Introducción
Materiales 1 Bolsa de plástico transparente 1 Botella de vidrio 3 Termómetros
Procedimiento
1. Colocar un termómetro en la bolsa de plástico.
2. Cerrar la bolsa con un nudo y colocarla en un lugar soleado.
3. Colocar junto a la bolsa, la botella de refresco con el segundo termómetro en su interior.
4. Situar el tercer termómetro junto a los objetos anteriores.
5. Transcurridos 10 minutos, observar la temperatura que marcan los 3 termómetros.
6. Explicar a que se debe la diferencia de temperaturas en los termómetros
El alumno analizará el fenómeno de efecto invernadero
Se denomina efecto invernadero al fenómeno por el cual determinados gases, que son componentes de
la atmósfera, retienen la energía que el suelo terrestre emite y una parte de la misma la remiten a la
superficie de la Tierra. Este fenómeno evita que gran parte de la energía emitida por la Tierra se trasmita
directamente al espacio, lo que provocaría un continuo enfriamiento de la superficie terrestre e impediría
la vida.
El efecto invernadero se está viendo acentuado por la emisión de ciertos gases debidos a la actividad
humana, como el dióxido de carbono y el metano, que está produciendo un calentamiento en la Tierra.
Hay un consenso prácticamente unánime en la comunidad científica sobre que este calentamiento se
está produciendo por esta causa.
Este efecto tiene cierta similitud al calentamiento que se produce en un invernadero, aunque el proceso
es diferente.
El efecto invernadero afecta a todos los cuerpos planetarios dotados de atmósfera.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 6. Sistemas dispersos. 6.1.3 Mezclas homogéneas y heterogéneas
PRÁCTICA No 11. Métodos de separación de mezclas
Objetivo
Introducción
Mostrar algunas técnicas de separación de los componentes de una mezcla y adquirir los criterios necesarios para seleccionar una técnica específica con base en las propiedades físicas que exhiban los componentes de la mezcla.
Las sustancias que forman una mezcla se pueden separar empleando diversos métodos. Estos métodos son numerosos y entre los más generales podemos mencionar los siguientes: Métodos mecánicos. Sin cambio en el estado físico: tamizado, levigación, decantación, centrifugación y filtración. Métodos físicos. Existe un cambio en el estado físico de uno de los componentes: extracción con disolventes, cristalización, destilación, sublimación. Tamizado. Este método se utiliza cuando una mezcla sólida esta formada por componentes pulverizados, pero cuyas partículas se diferencian por su tamaño, se les pasa a través de cribas, tamices, zarandas, cernedores o cedazos, que son redes de mayas más o menos finas, formados por hilos metálicos o de crin o de seda. En los molinos se utiliza este método para separar la harina del salvado. Levigación. Cuando un mineral del cual se puede extraer un metal que se encuentra en la naturaleza mezclado con tierras y rocas de escaso valor industrial. Decantación. Se utiliza para separar dos sustancias líquidas, siempre que éstas no sean miscibles y tengan distinta densidad; también sirve para separar una sustancia líquida de otra sólida, siempre que ésta sea insoluble en el seno del líquido y se encuentre sedimentada. Así podemos separar, por ejemplo, la arena del agua. Por filtración se separa un sólido de un líquido en el que el primero se halla en suspensión, sirviéndose de medios porosos, los cuales permiten el paso del líquido y detienen la materia sólida no soluble. Los filtros mas empleados en el laboratorio son hojas o discos de celulosa sin encolar, que se usan en pliegue de abanico. La destilación consta de dos procesos fundamentales: evaporación y condensación. La primera es la conversión de un líquido a vapor; la condensación es la conversión de un vapor o gas a líquido. En la evaporación de una solución queda como residuo el sólido disuelto (soluto) y la sustancia líquida (disolvente) se pierde; en la destilación se retira también el disolvente, pero éste se recupera. En el laboratorio se emplean como evaporadores matraces especiales y matraces comunes de vidrio resistente, conectados con refrigerantes (condensadores de distintas formas de acuerdo a las necesidades de la operación).

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 6. Sistemas dispersos. 5.1.3 Mezclas homogéneas y heterogéneas
PRACTICA No 11. Métodos de separación de mezclas
Materiales Reactivos equipo Vasos de precipitados de 400 y 250 ml Mezcla sólida (CaCO3, NaCl,
SiO2) Mechero de alcohol
Vidrio de reloj HCl 4 M Equipo de filtración al vacio
Soporte Malla de asbesto Espátula Agitador Probeta de 25 ml Embudo Papel filtro Cápsula de porcelana
Procedimiento
1. Pesar 2.00 g de mezcla y llevarla a un vaso de precipitados de 400 ml. Adicionar lentamente 10 mL
de agua agitando continuamente. Filtrar por gravedad a través de un papel filtro previamente pesado y
recoger el filtrado en una probeta graduada.
2. Pesar una cápsula de porcelana limpia y seca, añadir 5.00 mL del filtrado y someter el conjunto a
evaporación. La cápsula debe taparse con un vidrio de reloj previamente pesado.
3. Cuando el solvente en la cápsula se haya evaporado y el componente 1 esté seco, se deja enfriar el
conjunto a temperatura ambiente y se pesa. Luego se vuelve a calentar por 5 min, se deja enfriar y se
pesa de nuevo. El procedimiento se repite hasta obtener un peso constante.
4. Añadir más agua destilada al vaso de precipitados con el fin de lograr la transferencia de todo el resto
de la mezcla sólida al papel filtro. Adicionar lentamente, con una pipeta, HCl 4.0 M al sólido en el papel
filtro previamente pesado. Lavar repetidas veces el componente 2 en el papel filtro con el filtrado ácido y
finalmente con agua destilada utilizando la pizeta. Transferir el papel a la estufa a una temperatura de
110 ºC hasta sequedad. Retirar el conjunto de la estufa y pesar. Repetir el calentamiento otros 5 min.
Pesar nuevamente y repetir el procedimiento hasta peso constante.
5. Explicar el destino final de cada componente de la mezcla y la propiedad física que se utilizó para su
separación.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 6. Sistemas dispersos. 6.4 Concentración de las disoluciones
PRACTICA No 12. Molaridad
Objetivo
Introducción
Los alumnos aprenderán a prepararán soluciones con una concentración conocida
Una solución es un sistema de composición variable y cuyos componentes no son fácilmente
interconvertibles. El componente que se encuentra en mayor proporción se llama solvente y los demás
se llaman solutos.
Las maneras de expresar la concentración de las soluciones son en unidades físicas y en unidades
químicas, dentro de las unidades físicas están: gramos de soluto por gramos de solvente y gramos de
soluto que hay en 100 gramos de solución o % en peso. La concentración se puede expresar en
unidades químicas las cuales son; Formalidad (F), Molaridad (M), Molalidad (m), fracción molar (nx) y
normalidad (N).
Formalidad. Como en los compuestos iónicos no existen moléculas sino solamente iones sería impropio
hablar de moles o moléculas-gramo, refiriéndose a una sustancia iónica y por eso se emplea el término
fórmula-gramo, para describir el peso del compuesto en gramos.
La formalidad de una solución es entonces el numero de fórmulas-gramo de soluto por litro de solución.
Formalidad = (No. Formulas – gramo de soluto) / litro de solución
Molaridad. La molaridad de una solución es el número de moles de soluto por litro de solución.
M = No. moles de soluto / litro de solución
Molalidad. Es el numero de moles de soluto disueltos en 1000 gr de solvente; es decir el número de
moles de soluto disueltos en un kilogramo de solvente.
m = g. de soluto por 100 gr de solvente / peso molecular del soluto
Normalidad. Es el número de equivalentes de soluto presentes en un litro de solución. El equivalente
también se conoce como peso equivalente o equivalente-gramo.
N = No. de equivalentes de soluto / litro de solución.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Química II
BLOQUE DIDÁCTICO 6. Sistemas dispersos. 6.4 Concentración de las disoluciones
PRACTICA No 12. Molaridad
Materiales Reactivos 1 Balanza Sacarosa (C12H22O11) 1 matraz volumétrico de 100 mL Agua destilada 2 frascos con tapa de 250 mL Etiquetas 1 pizeta Sal común (NaCl) 1 gotero
Procedimiento
1. Pesar en la balanza 5.8 gramos de NaCl e introducir en el matraz volumétrico de 100ml.
2. Usar una pizeta para llenar poco a poco el matraz volumétrico con agua destilada. Cuando el
nivel de la solución esté cerca de la línea de aforo, vierte el agua en pequeñas cantidades para
evitar que rebase dicha línea; si lo consideras necesario, utiliza el gotero.
3. Tapar el matraz y agita hasta que se disuelva completamente el soluto y vacía la solución en un
frasco limpio y seco.
4. Tapar el frasco y agítalo para homogeneizar la solución. Calcula la molaridad de la solución que
preparaste. Anota en la etiqueta la fórmula del soluto y la concentración molar; pégala en el
frasco.
5. Pesar 3.4 g de sacarosa y deposítala en el matraz volumétrico. Agrega agua hasta la línea de
aforo del matraz, con cuidado de no rebasarla.
6. Tapar el matraz y agítalo hasta que se disuelvan todos los cristales de sacarosa. Vierte la
solución que preparaste en un frasco limpio y seco.
7. Tapar el frasco y agítalo para homogeneizar la solución. Calcula la molaridad de la solución que
preparaste. Anota en la etiqueta la fórmula del soluto y la concentración molar; pégala en el
frasco.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 2 Magnitudes físicas y su medición. 2.1 Magnitudes fundamentales y derivadas.
Práctica No.1 Medición de cantidades físicas.
Objetivo
Introducción
El alumno conocerá las unidades fundamentales y las derivadas del Sistema Internacional de Unidades.
Una cantidad física se mide por comparación contra algún estándar conocido. La magnitud de una cantidad física queda completamente especificada por un número y una unidad de medida. En vista de que hay muchas medidas diferentes para una misma cantidad, necesitamos de alguna manera guardar registro del tamaño exacto de las unidades particulares. Para esto es necesario establecer medidas estándar para cantidades específicas. Un estándar es un registro físico permanente o fácilmente determinado del tamaño de una cantidad de medición. El Comité Internacional de Pesos y Medidas ha establecido siete cantidades fundamentales y les ha asignado unidades básicas oficiales a cada cantidad. Un resumen de estas cantidades se da en la siguiente tabla:
Tabla 1.1 Unidades básicas del Sistema Internaciona l para siete cantidades y dos cantidades complementarias
Cantidad Unidad Símbolo Unidades básicas
Longitud Metro m Masa Kilogramo Kg
Tiempo Segundo s Energía eléctrica Ampere A
Temperatura Grado Kelvin ºK Intensidad luminosa Candela Cd
Cantidad de sustancia Mol Mol Unidades complementarias
Ángulo plano Radián Rad Ángulo sólido Estereorradián Sr
Podemos medir muchas cantidades, como volumen, presión, velocidad y fuerza, que son combinaciones de dos o más cantidades fundamentales. A las combinaciones de estas cantidades se les llama cantidades derivadas. Algunas de éstas se dan en la siguiente tabla:
Tabla 1.2 Unidades derivadas para cantidades física s comunes Cantidad Unidad derivada Símbolo
Área Metro cuadrado m2 Volumen Metro cúbico m3 Velocidad Metro por segundo m/s Fuerza Newton N Cantidad de electricidad Coulomb C Trabajo Joule J Potencia Watt W Frecuencia Hertz Hz Densidad de masa Kilogramo por metro cúbico Kg/m3

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
BLOQUE DIDÁCTICO 2 Magnitudes físicas y su medición.
2.1 Magnitudes fundamentales y derivadas.
Práctica No.1 Medición de cantidades físicas.
Materiales Sustancias Equipo 1 regla de 30 cm 10 g de plastilina Multímetro eléctrico 1 probeta graduada de 100 ml 190 ml de agua Balanza digital 1 vaso de precipitados de 100 ml Cronómetro 1 termómetro Dinamómetro Pesa de 250 gr Pila de 1.5 Volts
Procedimiento 1. Medir el ancho y el largo de tu libro de física, calcular el área de la portada, registrar este dato en la
tabla 1.3. 2. Determinar la masa de la plastilina. Anotar el valor obtenido. 3. Sostener la plastilina a una altura de 20 cm, soltarla y registrar el tiempo que tarde en llegar al piso. 4. Medir 90 ml de agua con la probeta graduada. 5. Vertir el agua en el vaso de precipitados, medir y registrar su temperatura. 6. Medir la masa del vaso de precipitados vacío. Agregar 100 ml de agua y nuevamente medir la masa
del vaso de precipitados. Obtener por diferencia la masa del agua. Registrar los datos obtenidos. 7. Medir la fuerza que ejerce una pesa de 250 gr utilizando el dinamómetro, registrar este dato en la
tabla 1.3. 8. Medir el voltaje de una pila, utilizando el multímetro eléctrico, registrar este dato en la tabla 1.3.
Tabla 1.3 Registro de las mediciones
Magnitudes determinadas Medidas (número) Unidades ( símbolo) Área de la portada del libro Masa de la plastilina Volumen del agua Tiempo que tarde en caer la plastilina Temperatura del agua Masa del vaso de precipitados vacío Masa de 100 ml de agua Velocidad de la canica al caer Fuerza Voltaje

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 2 Magnitudes físicas y su medición. 2.7 Precisión de instrumentos y errores.
Práctica No.2 Determinación del error.
Objetivo
Introducción
El alumno determinará el error promedio, absoluto, relativo y porcentual al realizar la medición de una magnitud.
En toda medición es posible incurrir en un cierto grado de error; al realizar mediciones es de suma importancia determinar ese grado de error que se podrá permitir. La aproximación en la exactitud de los resultados es parte fundamental de la comprensión del mismo fenómeno que se observa, tanto como la aceptación de una hipótesis planteada. Existen diferentes formas de medir un mismo fenómeno, esto implica que el error forma parte del resultado. Como cada observador tiene un ángulo de visión diferente, hacer un promedio de observaciones es importante para obtener un resultado fiable. Errores sistemáticos. Este tipo de errores son los que se presentan constantemente; ocurren cuando: a) Existe un defecto en el instrumento de medida; por ejemplo, cuando se utiliza una balanza y el plato
está deformado imperceptiblemente. El efecto se evidencia cuando un objeto es pesado en otra balanza.
b) Error de calibración o de ajuste, se presenta cuando el instrumento no está en condiciones óptimas para su funcionamiento.
c) El error de paralaje se da cuando la persona que hace una medida tiene diferente ángulo de visión respecto a otra, por lo que los resultados difieren.
d) El error en las escalas del instrumento ocurre cuando las marcas en el instrumento son defectuosas; esto es muy común en las escalas fabricadas con plásticos y tintas de mala calidad.
Errores por circunstancia. Este tipo de errores es el que se presenta por causas naturales o ambientales. Un experimento al nivel del mar no tiene el mismo comportamiento que a 2000 m de altura. De la misma manera cuando las condiciones de humedad se alteran, los instrumentos pueden sufrir cambios en su funcionamiento. Así pues los errores por circunstancia se deben a condiciones de altitud, humedad, temperatura, etc.
Tipos de error al medir Cuando se realizan varias mediciones de una misma magnitud, es necesario considerar los tipos de errores que se presentan: El error absoluto (EA). Se obtiene restando el valor promedio obtenido a la medición real. El error relativo (ER). Se obtiene dividiendo el error absoluto entre el valor promedio. El error porcentual (EP). Se obtiene multiplicando ER por 100. _ El valor promedio (X) de una serie de medidas es la sumatoria de todas las mediciones dividida entre el número de mediciones efectuadas. La desviación media (Dm) de una serie de mediciones es la representación del margen de error que hay en el valor promedio.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 2 Magnitudes físicas y su medición. 2.7 Precisión de instrumentos y errores
Práctica No.2 Determinación del error.
Materiales Sustancias 2 termómetros Agua 1 vaso de precipitados de 250 ml Parrilla eléctrica
Procedimiento
1. En el vaso de precipitado agregar 200 ml de agua y someter a calentamiento hasta que comience la ebullición.
2. 5 personas diferentes tomarán registro de la temperatura de ebullición del agua, con cada uno de los dos termómetros. (X1 y X2)
3. Calcular el valor promedio de las mediciones. _ X = (∑ X) / número de mediciones Donde X = temperatura 4. Calcular el error absoluto (EA) por cada medición
EA = |medida – valor promedio|
5. Calcular la desviación media y el margen de error en las medidas, sumando el resultado de cada error absoluto sin considerar el signo (o sea su valor absoluto) y se obtiene el promedio de ellos:
Desviación media (Dm) = (∑ de errores absolutos) / número de valores
6. Calcular el error relativo (ER) de cada una de las mediciones, dividiendo el error absoluto entre el
valor promedio _ ER = EA / X
7. Calcular el error porcentual (EP) multiplicando el error relativo por 100.
8. Calcular la media de la temperatura de ebullición del agua y de los errores
Tabla 2.1 Registro de resultados para 5 mediciones de la temperatura de ebullición del agua.
Mediciones X 1 (ºC) X2 (ºC) EA1 EA2 ER1 ER2 EP1 EP2 1 2 3 4 5

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 4 Movimiento en una dimensión. 4.1 Concepto de distancia, desplazamiento, velocidad y aceleración.
Práctica No.3 Cinemática.
Objetivo
Introducción
El alumno determinará la distancia, desplazamiento, velocidad y aceleración durante el movimiento de un cuerpo.
La cinemática es la parte de la mecánica que estudia las diversas clases de movimiento de los cuerpos, sin atender a las causas que lo producen. A medida que se mueve un cuerpo, cambia su posición al paso de cierto tiempo; para determinar ese movimiento debe considerarse un punto de referencia que indique de donde a donde se está moviendo el cuerpo. La distancia es una magnitud escalar, pues es únicamente la separación que existe entre dos puntos. Sus valores se expresan con algún número seguido por la unidad. Lo que se entiende por posición en una dimensión corresponde a la distancia a la cual está una partícula respecto de un punto dado. A este punto, el cual se elige arbitrariamente y debe estar fijo, se le llama origen. La posición en una dimensión es una magnitud escalar y determina la posición de la partícula respecto del origen. El desplazamiento es la posición que va adquiriendo una partícula (es decir un movil) respecto al tiempo transcurrido, es una cantidad vectorial que tiene signo.
d = (v) (t) La velocidad se puede definir como el desplazamiento que efectúa una partícula dividido entre el tiempo que tarda en realizarlo, por lo tanto es una cantidad vectorial. La rapidez es la distancia recorrida en determinado tiempo, por lo cual es una cantidad escalar. Frecuentemente los conceptos velocidad y rapidez son usados como sinónimos, por ello es importante señalar la diferencia entre ambas. No es común encontrar un movimiento con velocidad constante. Lo que es común es que la velocidad cambie a lo largo de la trayectoria. En el caso de un auto los cruces de la calle, los semáforos, los baches en la ruta, etc. impiden mantener una velocidad uniforme. Si decimos que llevaremos una velocidad continua de 80 km/h, es precisamente la velocidad media que intuimos durante todo el trayecto. Con esta velocidad, se compensan exactamente las detenciones y los tramos de la carretera en la cual viajamos más rápido.
Cuando se utilizan solo dos velocidades, (velocidad inicial y final), la fórmula de la velocidad media es:
vmedia = (vi + vf) / 2 Al considerar los cambios de velocidad en intervalos de tiempo se da paso al concepto de aceleración. La aceleración se define como la razón entre el cambio de velocidad y el intervalo de tiempo en el cual ocurre. Es una magnitud vectorial, es decir tiene magnitud y dirección.
a = ∆v / ∆t = (vf – vi) / (tf – ti)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 4 Movimiento en una dimensión. 4.1 Concepto de distancia, desplazamiento, velocidad y aceleración.
Práctica No.3 Cinemática.
Materiales
Flexómetro Brújula Cronómetro
Procedimiento 1. Medir 50 m en dirección Norte-Sur, y 10 alumnos recorrerán esta distancia corriendo.
Inmediatamente, después lo harán en sentido Sur-Norte. 2. Registrar los tiempos que tardan en desplazarse, en cada uno de los sentidos en la tabla 3.1 3. Calcular las velocidades y la aceleración, registra tus resultados en la tabla 3.1.
Tabla 3.1 Registro de resultados durante el movimiento de 10 personas en dos sentidos.
Persona Tiempo N-S (s) Tiempo S-N (s) v1 (m/s) v2 (m/s) a (m/s²) 1 2 3 4 5 6 7 8 9
10

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 4 Movimiento en una dimensión. 4.5 Caída libre y tiro vertical.
Práctica No. 4 Caída libre.
Objetivo
Introducción
Materiales Equipo 1 pelota de hule Flexómetro 1 piedra Cronómetro 1 esfera de unicel 1 canica 1 pluma de gallina
El alumno calculará la velocidad de un objeto en caída libre.
Los cuerpos en caída libre no son más que un caso particular del movimiento rectilíneo uniformemente acelerado, con la característica de que la aceleración se debe a la acción de la gravedad. Un cuerpo tiene caída libre si desciende de manera perpendicular a la superficie de la tierra y no sufre ninguna resistencia originada por el aire. Sin embargo, cuando la resistencia del aire sobre los cuerpos es tan pequeña que se puede despreciar es posible interpretar su movimiento como una caída libre. Es común para cualquiera de nosotros observar la caída de los cuerpos sobre la superficie de la tierra pero te has preguntado ¿Qué tiempo tardan en caer dos cuerpos de diferente tamaño desde una misma altura y simultáneamente? Cuando en un tubo al vacío se dejan caer a la vez una pluma de ave, una piedra y una moneda, su caída será vertical y en el mismo tiempo, independientemente de su tamaño y peso, por lo que su movimiento es en caída libre. La aceleración gravitacional impone a los cuerpos un movimiento uniformemente variado, por lo que su velocidad aumenta en forma uniforme mientras que la aceleración permanece constante. La aceleración de la gravedad siempre está dirigida hacia abajo y se representa con la letra g, a nivel del mar y a 45º latitud, vale 9.806 m/s². Para la caída libre de los cuerpos se considera que la velocidad inicial tiene un valor de cero, pues parte del reposo.
Tabla 5.1 Ecuaciones para caída libre
Ecuaciones generales Ecuaciones especiales vf = vi + gt vi = 0
H = ½ (vi + vf) t vf = g t Vf ² = vi² + 2gh h = ½ vf t H = vit + ½ gt² vf² = 2gh
h = ½ gt²

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 4 Movimiento en una dimensión. 4.5 Caída libre y tiro vertical.
Práctica No.4 Caída libre.
Procedimiento 1. Dejar caer cada uno de los objetos desde una altura previamente medida (5 a 10 m). 2. Medir el tiempo de caída varias veces y calcular un promedio de los tiempos. 3. Calcular la velocidad de caída de los objetos.
Tabla 4. 2 Registro de resultados y cálculo de velocidad de un cuerpo en caída libre
Objeto Altura, h(m) Tiempo de caída, t (s) Velocidad, v (m/s)
t1 t2 t3 v 1 v 2 v3 Pelota Piedra Esfera de unicel Canica Cuestionario ¿Es igual la velocidad? ¿Por qué?

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 5 Movimiento en dos dimensiones 5.1 Tiro parabólico Práctica No. 5 Tiro parabólico horizontal
Objetivo
Introducción
El alumno hallará la relación entre la posición en el eje X y la posición en el eje Y para el movimiento de un proyectil.
Hemos visto que los objetos que se lanzan hacia arriba o hacia abajo o que se dejan caer a partir del reposo sufren una aceleración uniforme en el campo gravitacional terrestre. Un objeto que es lanzado al espacio sin fuerza de propulsión propia recibe el nombre de proyectil. Si despreciamos la resistencia ejercida por el aire, la única fuerza que actúa sobre un proyectil es su peso, W, que hace que la trayectoria se desvíe de la línea recta. Recibe una aceleración constante hacia abajo por efecto de la gravedad. Generalmente, la dirección de esta gravedad no coincide con la dirección de su velocidad inicial. Un proyectil tiene una velocidad horizontal constante y su velocidad vertical varía constantemente bajo la influencia de la gravedad. Si un objeto es lanzado horizontalmente, se puede describir más fácilmente su movimiento si se consideran su movimiento horizontal y su movimiento vertical en forma separada. Por ejemplo si un proyectil se deja caer al mismo tiempo que otro se lanza horizontalmente, la velocidad horizontal del segundo permanece constante a lo largo de toda la trayectoria. Por otro lado, la velocidad vertical es inicialmente cero y aumenta uniformemente. Los proyectiles caerán en el mismo instante, aún cuando uno de ellos también se esté desplazando horizontalmente.
Tabla 6.1 Ecuaciones para el movimiento de proyecti les
Movimiento de proyectiles X = vox t y = (voy + vy ) t /2 Vy = voy + gt
Y = voy t + ½ gt2 2gy = vy2 – voy2
Donde y = posición vertical voy = velocidad inicial vertical g = aceleración gravitacional Para los problemas en los que la velocidad inicial es puramente horizontal, la posición final resultará por debajo del origen y la velocidad final habrá de estar dirigida hacia abajo. Dado que la aceleración gravitacional también tiene una dirección que apunta hacia abajo, resulta más conveniente elegir la dirección hacia abajo como positiva. Nótese asimismo que para el lanzamiento horizontal
vox = vx voy = 0
Dado que la velocidad horizontal es constante y que la velocidad inicial vertical es igual a cero. Por lo tanto, las posiciones vertical y horizontal de la velocidad en cualquier instante están dadas por
x = vox t Posición horizontal y = ½ gt² Posición vertical (1)
De manera similar, los componentes vertical y horizontal de la velocidad en cualquier instante están dadas por.
vx = vox velocidad horizontal vy = gt velocidad vertical (2)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 5 Movimiento en dos dimensiones 5.1 Tiro parabólico BLOQUE DIDÁCTICO 5 Movimiento en dos dimensiones.
5.1 Tiro parabólico.
Práctica No. 5 Tiro parabólico horizontal.
Materiales Pelota Cronómetro Flexómetro
Procedimiento 1. Dejar deslizar la pelota sobre la superficie de la mesa de trabajo, registrar el tiempo que tarda en
caer la pelota al suelo
2. Medir la distancia que recorrió la pelota a partir del punto en que salió del borde de la mesa.
3. Calcular la velocidad inicial horizontal.
4. Calcular la componente vertical de la velocidad.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton. 6.3 Segunda Ley de Newton.
Práctica No. 6 Segunda Ley de Newton.
Objetivo
Introducción
El alumno analizará de manera práctica problemas en donde se aplique la segunda Ley de Newton, a partir del análisis y descripción de esta ley.
La segunda Ley de Newton es un enunciado de como varía la aceleración de un cuerpo con la fuerza aplicada y la masa del cuerpo. Por lo tanto podemos pensar de la masa de un cuerpo como la cantidad de materia de que está formado el propio cuerpo. “Siempre que una fuerza equilibrada actúe sobre un cuerpo, se produce una aceleración en la dirección de la fuerza que es directamente proporcional a la fuerza e inversamente proporcional a la masa del cuerpo.” De acuerdo con lo anterior, podemos escribir la proporcionalidad
a ∝ F / m Siempre que la masa permanezca constante, un aumento en la fuerza aplicada resultará en un aumento similar de la aceleración producida. Por otro lado, si la fuerza permanece sin cambio, un aumento en la masa del cuerpo resultará en una disminución proporcional de la aceleración. Si se escogen las unidades adecuadas, se puede escribir esta proporción como una ecuación:
fuerza resultante = masa x aceleración F = ma (6.1)
Antes de considerar algunos ejemplos que utilicen la segunda Ley de Newton, debemos lograr un claro entendimiento de la diferencia entre el peso de un cuerpo y su masa. El peso de cualquier cuerpo es la fuerza con la que tal cuerpo es atraído verticalmente hacia abajo por la gravedad. Cuando un cuerpo cae libremente hacia la tierra, la única fuerza que actúa sobre él es su peso W. Esta fuerza neta produce una aceleración g, que es la misma para todos los cuerpos que caen. Así, de la segunda ley de Newton podemos encontrar la relación entre masa y peso de un cuerpo:
W = mg o m = W / g (6.2)
En cualquier sistema de unidades, 1) la masa de una partícula es igual a su peso dividido por la aceleración de la gravedad, 2) el peso tiene las mismas unidades que la unidad de fuerza; y 3) la aceleración de la gravedad tiene las mismas unidades que la aceleración.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton. 6.3 Segunda Ley de Newton.
Práctica No. 6 Segunda Ley de Newton.
Materiales Cable de metal Riel de deslizamiento de aluminio 1m Pesa de 50 gr,100 gr y 200 gr Bloque de metal 30 gr, 50 gr, 70 gr Polea Cronómetro Balanza Flexómetro Cinta adhesiva
Procedimiento 1. Registrar el peso del bloque de metal. 2. Colocar el riel de deslizamiento sujetándolo sobre la mesa usando cinta adhesiva. 3. Sobre una superficie lisa (mesa), montar un dispositivo como el que se muestra en la figura 1
utilizando un alambre de metal, la pesa, la polea y el bloque.
Figura 6.1
4. Sujetar el bloque A al alambre que está sujeto a la polea, colocar la pesa B en el alambre al otro
extremo de la polea, dejar que se desplace el bloque sobre la mesa, registrar el tiempo que tardó el bloque en recorrer el riel de deslizamiento.
5. Registrar distancias y tiempos de recorrido por triplicado para cada posición de bloque y peso.
Bloque Peso Distancia Tiempo 30 50 50 100
Dispositivo
70 200 50 50 30 100 70 100
Combinaciones
50 200
āāāā = (Vf - Vi) / (t f - t i)
Bloque A
Pesa B
Polea
Riel de deslizamiento

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton. 6.4 Tercera Ley de Newton.
Práctica No. 7 Tercera Ley de Newton.
Objetivo
Introducción
El alumno resolverá de manera práctica problemas en donde se aplique la tercera Ley de Newton, a partir del análisis y descripción de esta Ley.
Las fuerzas pueden actuar de tal manera que causen movimiento o lo impidan. Los grandes puentes deben diseñarse de tal manera que el efecto global de las fuerzas sea impedir el movimiento. Toda armadura, viga, trabe y cable debe estar en equilibrio. En otras palabras, las fuerzas resultantes que actúan en cualquier punto de la estructura deben estar equilibradas. Las plataformas, los montacargas, ganchos, cables elevadores y aún los grandes edificios deben ser construidos de tal manera que los efectos de las fuerzas sean controlados y soportados.
Debe existir una interacción mutua entre una fuerza que actúa y otra fuerza que reacciona. Cuando dos cuerpos interaccionan la fuerza ejercida por el primer cuerpo sobre el segundo es igual en magnitud pero opuesta en dirección a la fuerza que ejerce el segundo cuerpo sobre el primero. Este principio se anuncia en la tercera ley de Newton:
“A toda acción corresponde una reacción igual en magnitud y dirección pero de sentido opuesto.”
Nótese que las fuerzas que actúan y las que reaccionan, aunque son iguales en magnitud y opuestas en dirección, nunca se neutralizan porque siempre actúan sobre cuerpos diferentes. Para que dos fuerzas se cancelen, deberán actuar sobre el mismo cuerpo. Considerando la colisión de frente de las masas m1 y m2 , u1 y u2 son las velocidades antes del impacto, v1 y v2 las velocidades después del impacto. El impulso de la fuerza F1 que actúa sobre la masa de la derecha es
F1 ∆t = m1v1 – m1u1
m
(a) Antes del impacto (b)Durante el impacto (c) Despues del impacto
m1+ m2 u2 F1∆t = - F2 ∆t m2 v1 + m2v2
De manera similar el impulso de la fuerza F2 sobre la masa de la izquierda es
F2 ∆t = m2 v2 – m2 u2
Durante el lapso ∆t, F1 = - F2, de tal manera que F1 ∆t = - F2 ∆t
o sea
m1u1 + m2u2 = m1v1 + m2 v2
Cuando dos cuerpos chocan, la cantidad total del momento antes del impacto es igual a la cantidad total del momento después del impacto.
m1 m2 m1 m2 m1 m2
u1 u2 F1 F2
V1 V2

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
BLOQUE DIDÁCTICO 6 Leyes de Newton. 6.4 Tercera Ley de Newton.
Práctica No. 7 Tercera Ley de Newton.
Materiales Riel de deslizamiento 2 resortes 2 placas metalicas (6 x 6 cm) 2 Carritos de juguete de 300 gr , 350 gr Cronómetro Cinta adhesiva
Procedimiento: 1. Sujetar el riel de deslizamiento en la mesa de trabajo, utilizando la cinta adhesiva. 2. Colocar los resortes en cada placa metálica, impulsar ambos carritos sobre el riel de deslizamiento
utilizando el resorte, medir la distancia de desplazamiento y registrar el tiempo, calcular la velocidad antes del impacto.
3. Calcular las fuerzas que se aplicaron a cada carrito.
Figura 7.1 Colisión de frente entre dos masas
Choque
u2 u1
m1 m2
u0 u0
m1 m2
D1 D2
v2 v1

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton. 6.7 Fuerzas de fricción, estática y dinámica.
Práctica No. 8 Fricción.
Objetivo
Introducción
El alumno calculará los coeficientes de fricción estático y cinético y relacionará la fricción con la oposición que ofrece un cuerpo al movimiento cambiando la rugosidad.
La fricción es una fuerza que aparece en la zona de contacto entre dos cuerpos, cuando por lo menos uno de ellos quiere ponerse en movimiento. Si observamos la superficie de un cuerpo, por mas liso que pareciera, veríamos (con una lupa o microscopio) que no es tan liso, de hecho se verían una serie de "montañas" y "valles" que se traban con las correspondientes del otro cuerpo que está en contacto con él. Existen dos tipos de fricción, la fricción estática y la fricción dinámica. El primero es una resistencia, la cual se debe superar para poner en movimiento un cuerpo con respecto a otro que se encuentra en contacto. El segundo, es una fuerza de magnitud considerada constante que se opone al movimiento una vez que éste ya comenzó. En resumen, lo que diferencia a un roce con el otro, es que el estático actúa cuando los cuerpos están en reposo relativo en tanto que el dinámico cuando están en movimiento. Siempre que una superficie se desliza sobre otra, la fuerza de fricción ejercida por cada cuerpo sobre el otro es paralela o tangente a las dos superficies y actúa de tal manera que se opone al movimiento relativo de las superficies. Es importante notar que estas fuerzas no sólo existen cuando ocurre un movimiento relativo, sino que también están presentes en cuanto uno de los cuerpos tiende a deslizarse sobre el otro. Supóngase que una fuerza se ejerce sobre un bloque que descansa en reposo sobre una superficie horizontal. Al principio el bloque no se moverá debido a la acción de una fuerza llamada fuerza de fricción estática, Fs. Pero a medida que la fuerza aplicada se aumenta, llega un momento en que se provoca el movimiento del bloque, y la fuerza de fricción ejercida por la superficie horizontal mientras el bloque se encuentra en movimiento se denomina fuerza de fricción cinética y se representa Fk. La fuerza de fricción estática es directamente proporcional a la fuerza normal entre las dos superficies. Esta proporcionalidad puede escribirse como
Fs ∝ N Donde N es igual al peso del bloque Que puede escribirse como ecuación
Fs = µs N (8.1) En la que µs es una constante de proporcionalidad denominada coeficiente de fricción estático. Dado que µs es una relación constante entre dos fuerzas, es una cantidad sin dimensiones. Una vez que la fuerza aplicada ha superado en magnitud a Fs el bloque inicia el movimiento. Una fuerza menor que la inicial basta para mantener al bloque moviéndose con velocidad constante. Por tanto, la fuerza de rozamiento cinética Fk es menor que Fs para las mismas superficies.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton. 6.7 Fuerzas de fricción, estática y dinámica.
Práctica No. 8 Fricción.
Materiales Base de rozamiento de madera Polea Base de rozamiento de aluminio Riel de deslizamiento de aluminio Bloque de madera Riel de deslizamiento de madera Transportador Pesa Cinta adhesiva Alambre de cobre
Procedimiento:
1. Colocar el bloque en la base de rozamiento cuando ésta se encuentra en forma horizontal. 2. Levantar lentamente el plano por el extremo donde se encuentre el bloque y medir el ángulo en
el cual el bloque de madera inicia el movimiento. Anota tus resultados en la siguiente tabla: 3. Comparar los resultados con los reportados en teoría y calcular el % de error, registra las
operaciones en este espacio y completa la siguiente tabla
Superficie Ángulo θ Coeficiente teórico µk Coeficiente práctico µk
Madera-madera Madera-aluminio
4. Montar un dispositivo como el que se muestra en la figura 8.1, lubricar con agua el riel de
deslizamiento. Dejar que se deslice el bloque y registrar el tiempo que tardó el bloque en recorrer el riel de deslizamiento. Realizar el mismo procedimiento, utilizando aceite como lubricante.
Tabla 8.1 Registro de resultados Riel sin lubricante Riel lubricante con
agua Riel lubricado con aceite
Tiempo de recorrido (s)
Distancia (cm) ¿Existe alguna diferencia con respecto al tiempo de desplazamiento del bloque al utilizar un lubricante?
Bloque A
Polea
Riel de deslizamiento
Figura 8.1
Pesa
B

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton 6.7 Fuerzas de fricción, estática y dinámica.
Práctica No.9 Plano inclinado
Objetivo
Introducción
El alumno identificará las características del movimiento uniformemente acelerado en un plano inclinado.
El plano inclinado es una máquina simple que facilita el trabajo y permite subir o bajar objetos de gran peso con menor esfuerzo, deslizándolos sobre la superficie del plano. Las rampas que se utilizan en la industria de la construcción para cargar y descargar materiales muy pesados son ejemplos de planos inclinados. Cuando se tiene un plano inclinado y se rueda un objeto sobre el, la velocidad se incrementará a medida que el plano se encuentre más inclinado, es decir, se recorre una mayor distancia en un tiempo menor. Cuando se sube por un plano inclinado, la velocidad disminuye y se recorre menor distancia en mayor tiempo. Se dice que el movimiento de un movil en plano inclinado es uniformemente acelerado cuando la velocidad experimenta aumentos o disminuciones iguales en tiempos iguales. A la relación entre el cambio de rapidez y el tiempo se llama aceleración, la cual emplea como unidad de medida m/s² y se calcula mediante la siguiente ecuación:
a = rapidez / tiempo Considerando el movimiento de un peso W hacia arriba del plano inclinado de la siguiente figura: Fo Fo = W s Fi h W θ W (b) (a) Figura 10.1 Una caja debe ser levantada a una plataforma de carga de 6ft de altura. Se utiliza una rampa de 12 pies de largo para deslizar la caja desde el piso hasta la plataforma a) ¿Cual es la ventaja mecánica ideal de la rampa? b) ¿Cuál es su ventaja mecánica real? El ángulo de pendiente θ es tal que el peso debe moverse una distancia s hasta alcanzar la altura h en lo alto del plano inclinado. Si despreciamos la fricción, el trabajo requerido para empujar el peso hacia arriba es el mismo trabajo que se requiere para levantarlo verticalmente. Trabajo de entrada = trabajo de salida.
Fis = W h

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 6 Leyes de Newton 6.7 Fuerzas de friccion estatica y dinamica
Práctica No.9 Plano inclinado
Materiales
Carril de deslizamiento 1 regla 1 automóvil de juguete de libre tracción 1 cronómetro 5 pesas de 50 g
Procedimiento 1. Coloca el plano inclinado sobre la mesa, formando un ángulo de inclinación; procura que no
sobrepasen 20 cm de altura, medir la altura del plano. 2. Trazar 6 marcas sobre el plano; entre cada marca deben mediar intervalos de 20 cm. 3. Soltar el móvil, sin empujarlo, desde la parte superior y registra el tiempo que tarda en llegar al final.
Calcula la rapidez. 4. Suelta el móvil nuevamente, sin empujarlo, desde la parte superior del plano inclinado y mide el
tiempo que tarda en recorrer cada tramo de 20 cm del plano. Registra tus mediciones. 5. Acomodar las pesas en el automóvil y repite los pasos 3 y 4.
Tabla 5.1 Registro de datos obtenidos en el movimie nto de un objeto en plano inclinado
Tramo 1 2 3 4 5 6 Tiempo(s) Automóvil
sin pesas Rapidez (m/s)
Tiempo(s)
Plano 1
Automóvil con pesas Rapidez
(m/s)
Tiempo(s) Automóvil son pesas Rapidez
(m/s)
Tiempo(s)
Plano 2
Automóvil con pesas Rapidez
(m/s)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 7 Trabajo, potencia y energía mecánica. 7.1 Trabajo mecánico.
Práctica No. 10 Trabajo y potencia
Objetivo
Introducción
El alumno comprenderá las unidades básicas de potencia y trabajo a través de un dispositivo.
La razón principal para la aplicación de una fuerza es causar un desplazamiento. Por ejemplo, una grúa enorme levanta una viga de acero hasta la parte superior de un edificio; el compresor en un acondicionador de aire fuerza el paso de un líquido a través de su ciclo de enfriamiento, y fuerzas electromagnéticas mueven los electrones a través de una pantalla de televisión. Siempre que una fuerza actúa a través de una distancia se descubrirá que se realiza trabajo, de tal manera que puede ser medido o predicho. La capacidad para medir trabajo será definida como energía y el ritmo al cual se lleva a cabo será definido como potencia. En la actualidad el empleo y control de la energía es probablemente la mayor preocupación en la industria. Cuando tratamos de arrastrar un bloque por medio de una cuerda y no pasa nada, estamos ejerciendo una fuerza, pero el bloque no se ha movido. Por otra parte, si continuamos incrementando nuestra fuerza, el bloque se moverá al fin. En este caso hemos logrado algo real a cambio de nuestro esfuerzo. Este logro se define como trabajo. Este trabajo tiene una definición explícita, cuantitativa y operacional. Para que se realice trabajo son necesarias tres cosas: 1. Debe haber una fuerza aplicada. 2. La fuerza debe actuar a lo largo de cierta distancia, llamada desplazamiento. 3. La fuerza debe tener una componente a lo largo del desplazamiento. Si se dan las tres condiciones, estamos preparados para dar una definición de trabajo: El trabajo es una cantidad escalar igual al producto de las magnitudes del desplazamiento y de la componente de la fuerza en la dirección del desplazamiento.
Trabajo = Componente de la fuerza x desplazamiento
Trabajo = F x s Fx es la componente de F a lo largo del desplazamiento s. su magnitud puede encontrarse por trigonometría, y el trabajo puede expresarse en términos del ángulo θ entre F y s.
Trabajo = (F cos θ) s Con frecuencia, la fuerza que origina el trabajo esta dirigida enteramente a lo largo del desplazamiento. Esto pasa cuando se levanta un peso verticalmente o cuando una fuerza horizontal arrastra un objeto a lo largo del suelo. En estos casos simples Fx = F, y el trabajo es el producto simple de la fuerza y el desplazamiento:
Trabajo = Fs

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física I
BLOQUE DIDÁCTICO 7 Trabajo, potencia y energía mecánica. 7.1 Trabajo mecánico.
Práctica No. 10 Trabajo y potencia
Materiales
Polea Pesa 150 gr Riel de deslizamiento de aluminio Alambre de cobre Bloque de metal de 50 gr Cronómetro
Procedimiento
1. Registrar el peso del bloque de metal. 2. Colocar el riel de deslizamiento sujetándolo sobre la mesa usando cinta adhesiva. 3. Sobre una superficie lisa (mesa), montar un equipo como el que se muestra en la figura 10.1
utilizando un alambre de metal, la pesa, la polea y el bloque.
Figura 10.1
4. Sujetar el bloque de 50 gr al alambre que esta sujeto a la polea, colocar la pesa de 80 gr en el alambre al otro extremo de la polea, dejar que se desplace el bloque de sobre la mesa, registrar el tiempo que tardo el bloque en recorrer el riel de deslizamiento.
5. Registrar los datos en la siguiente tabla
Masa 1 2 Peso
Tiempo Fuerza
6. Calcular el trabajo y la potencia.
Bloque
m
Pesa m2
Polea
Riel de deslizamiento

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática 1.2 Características de los líquidos
Práctica No.1 Capilaridad
Objetivo
El alumno identificará la propiedad de capilaridad al poner en contacto tubos capilares con un líquido colorante.
Introducción
La capilaridad es una propiedad de los líquidos que depende de su tensión superficial (la cual a su vez, depende de la cohesión o fuerza intermolecular del líquido), que le confiere la capacidad de subir o bajar por un tubo capilar.
Cuando un líquido sube por un tubo capilar, es debido a que la fuerza intermolecular (o cohesión intermolecular) entre sus moléculas es menor a la adhesión del líquido con el material del tubo. El líquido sigue subiendo hasta que la tensión superficial es equilibrada por el peso del líquido que llena el tubo. Éste es el caso del agua, y esta propiedad es la que regula parcialmente su ascenso dentro de las plantas, sin utilizar energía para vencer la gravedad. Sin embargo, cuando la cohesión entre las moléculas de un líquido es más potente que la adhesión al capilar (como el caso del mercurio), la tensión superficial hace que el líquido descienda a un nivel inferior, y su superficie es convexa.
Un aparato comúnmente empleado para demostrar la capilaridad es el tubo capilar; cuando la parte inferior de un tubo de vidrio se coloca verticalmente, en contacto con un líquido como el agua, se forma un menisco cóncavo; la tensión superficial succiona la columna líquida hacia arriba hasta que el peso del líquido sea suficiente para que la fuerza de la gravedad se equilibre con las fuerzas intermoleculares.
El peso de la columna líquida es proporcional al cuadrado del diámetro del tubo, por lo que un tubo angosto succionará el líquido en una longitud mayor que un tubo ancho. Así, un tubo de vidrio de 0.1 mm de diámetro levantará una columna de agua de 30 cm. Cuanto más pequeño es el diámetro del tubo capilar mayor será la presión capilar y la altura alcanzada. En capilares de 1 µm (micrómetro) de radio, con una presión de succión 1.5 × 10³ hPa (hectopascal = hPa = 1.5 atm), corresponde a una altura de columna de agua de 14 a 15 m. Las plantas succionan agua del terreno por capilaridad, aunque las plantas más grandes requieren de la transpiración para desplazar la cantidad necesaria.
Fig.1.1 . Cuando se introduce un capilar en un recipiente con agua, ésta asciende por el capilar como si trepase agarrándose por las paredes, hasta alcanzar un nivel

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática 1.2 Características de los líquidos
Práctica No.1 Capilaridad
Materiales Sustancias Equipo 4 vasos de precipitado Agua Cronómetro 3 alcatraces o cartuchos Anilina 5 Tubos capilares 1 mm de diámetro Detergente 5 Tubos capilares de 2 mm de diámetro Aceite comestible 5 Tubos capilares de 3 mm de diámetro Azúcar 5 Tubos capilares de 4 mm de diámetro Sal Regla
Procedimiento 1. Agregar anilina en cada uno de los vasos de precipitado. 2. Introducir una flor en cada vaso de precipitado. 3. Medir el tiempo que tarda en llegar el colorante a la flor. Registra los datos en la tabla 1.1.
Tabla 1.1Registro de los tiempos en que tarda el co lorante en colorar a la flor Cartucho 1 Cartucho 2 Cartucho 3 Tiempo (min)
4. Preparar soluciones de azúcar, sal y solución jabonosa. 5. Colocar las soluciones en diferentes vasos de precipitado. 6. Colocar en cada solución un tubo capilar de diferente diámetro. En cada solución quedarán capilares
de 1, 2, 3 y 4 mm de diámetro. 7. En un tiempo determinado por ejemplo cada media hora, medir la altura que alcanzó el líquido en
cada uno de los tubos capilares. 8. Registra tus datos en la siguiente tabla 1.2. Tabla 1.2 Registro de resultados
Altura (cm) Capilar 1 mm Capilar 2 mm Capilar 3 mm Capilar 4 mm
Solución de azúcar Solución de sal Solución jabonosa Agua Aceite

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática. 1.3 Densidad y peso específico.
Práctica No.2 Densidad y peso específico.
Objetivo
El alumno determinará la densidad y peso específico de varias sustancias.
Introducción Es importante entender la relación del peso de un cuerpo con su volumen correspondiente. Por ejemplo, si se consideran plomo o hierro, se dice que ellos son pesados, en tanto que la madera o el corcho se consideran ligeros, lo que realmente significa es que un cubo de madera es más ligero que un cubo de plomo de tamaño similar. Es posible que un cubo de plomo pese lo mismo que un cubo de madera, aunque sus tamaños relativos difieran considerablemente. Por otro lado, 1 cm³ de plomo pesa 16 veces más que 1 cm³ de madera. La cantidad que relaciona el peso de un cuerpo con su volumen se conoce como peso específico.
El peso específico de un cuerpo se define como la razón de su peso W a su volumen V. Las unidades son el Newton por metro cúbico (N/m³)
D = W / V W = DV (2.1)
Por lo tanto, si un objeto de 20 kg ocupa un volumen de 0.5 m³, su densidad de peso será 40 kg/m³.
El peso de un cuerpo no es constante sino que varía de acuerdo con su ubicación. Una relación más útil para la densidad toma en cuenta que la masa es una constante universal, independiente de la gravedad. La densidad de masa (ρ) de un cuerpo se define como la razón de su masa (m), a su voumen (V).
ρ = m / V m = ρV (2.2)
Las unidades de la densidad son la razón de una unidad de masa a una unidad de volumen, es decir, gramos por centímetro cúbico, kilogramos por metro cúbico o slugs por pie cúbico. La relación entre el peso específico y la densidad se encuentra al recordar que W = mg. O sea
D = mg / V = ρ V (2.3)
Tabla 2.1 Densidad y peso específico de algunas sus tancias
Sustancia D, lb/ft³ ρρρρ, kg/m³ Aluminio 169 2700 Oro 1204 19300 Hielo 57 920 Alcohol 49 790 Gasolina 42 680 Mercurio 850 13600 Agua 62.4 1000 Aire (ºC) 0.0807 1.29

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática. 1.3 Densidad y peso específico.
Práctica No.2 Densidad y peso específico.
Materiales Sustancias Equipo Matraz aforado de 100 ml 100 ml de agua Balanza 100 ml de miel 100 ml de alcohol 100 ml de aceite comestible
Procedimiento 1. Pesar el matraz, llenarlo de agua hasta donde indica la marca y volver a pesarlo, registra los datos
en la tabla 2.1 2. Lavar el matraz y llenarlo hasta la marca con miel, registrar el peso del matraz. 3. Registrar el peso del matraz con las otras sustancias al igual que se realizó con el agua y la miel.
Anota tus datos en la tabla 2.1. 4. Calcular la densidad y peso específico para cada una de las sustancias, anota tus resultados en la
tabla 2.1.
Tabla 2.1 Registro de datos para el calculo de la densidad y peso específico de diferentes sustancias Sustancia Peso del matraz Peso del matraz con la sustancia D ensidad Peso específico Agua Miel Alcohol Aceite

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
BLOQUE DIDÁCTICO 1 Hidrostática. 1.4 Presión.
Práctica No.3 Presión hidrostática.
Objetivo
El alumno identificará como actúa la presión hidrostática sobre un cuerpo y realizará el calculo de ésta.
Introducción
Un fluido pesa y ejerce presión sobre las paredes, sobre el fondo del recipiente que lo contiene y sobre la superficie de cualquier objeto sumergido en él. Esta presión, llamada presión hidrostática provoca, en fluidos en reposo, una fuerza perpendicular a las paredes del recipiente o a la superficie del objeto sumergido sin importar la orientación que adopten las caras. Si el líquido fluyera, las fuerzas ya no serían perpendiculares a las superficies.
La presión hidrostática en un punto del interior de un fluido en reposo es directamente proporcional a la densidad del fluido, d, y a la profundidad, h.
P = ρ g h
Debido a la presión hidrostática, (p), siempre actuará una fuerza de valor (p•s) sobre cualquier superficie (s) situada en el seno de un fluido. La dirección de esta fuerza es perpendicular a dicha superficie, independientemente de la orientación que tenga. El punto de aplicación de la fuerza se sitúa sobre la superficie.
La presión hidrostática sólo depende de la densidad del fluido y de la profundidad (g es constante e igual a 9.8 m/s²). Como la densidad de los gases es muy pequeña, la presión hidrostática es inapreciable para pequeñas alturas de gas, pero es importante en los líquidos, tanto más cuanto mayor sea su densidad. La densidad del mercurio es casi 14 veces mayor que la del agua, por eso, si llenamos dos recipientes iguales con agua y con mercurio, respectivamente, la presión en el fondo será casi 14 veces mayor en el recipiente que contiene mercurio. Debido a que la presión hidrostática aumenta hacia abajo en el líquido, la presión sobre las paredes también aumenta hacia abajo. Si perforamos distintos agujeros en la pared del recipiente, la velocidad de salida se hace mayor al aumentar la profundidad.
Figura 3.1 La presión ejercida sobre el fondo de los recipientes de igual sección es la misma con independencia de su forma, si las alturas (h) son iguales. Presión: p1 = p2 = p3; s1 = s2 = s3; sección

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática. 1.4 Presión.
Práctica No.3 Presión hidrostática.
Materiales Sustancias
Pelota de hule de 5 cm de diámetro Agua Regla de 30 cm
Procedimiento 1. Sumergir la pelota de hule en una cubeta con agua, realizar esto a diferentes profundidades (10, 20
y 30 cm). Anotar los datos en la tabla 3.1. 2. Medir la altura que alcanza la pelota al soltarla. Registrar los datos en la tabla 3.1. 3. Calcular la presión hidrostática. Anota tus resultados en la tabla 3.1. Tabla 3.1 Registro de resultados para el calculo de la presión hidrostática
Profundidad (cm) Altura (cm) Presión hidrostática 5 10 15 20

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática. 1.6 Principio de Arquímedes.
Práctica No.4 Principio de Arquímedes.
Objetivo
El alumno calculará la densidad de un objeto de manera práctica aplicando el principio de Arquímedes.
Introducción El hecho de que algunos objetos puedan flotar o que parezcan ser más ligeros cuando se sumergen en un líquido, se debe a una fuerza ascendente que ejercen los fluidos sobre los cuerpos total o parcialmente sumergidos en ellos. Fue el sabio griego Arquímedes (287-212 a.C.) quien primero estudió este fenómeno, el cual se conoce como principio de Arquímedes.
Este principio establece que:
Todo cuerpo sumergido en un fluido sufre un empuje hacia arriba con una fuerza igual al peso del fluido que desplaza.
Para explicar el fenómeno imaginemos un cuerpo, de cualquier forma sumergido en un líquido; éste ejerce una fuerza en torno al cuerpo debido a la presión hidrostática; la presión es más fuerte en los puntos que se encuentran a mayor profundidad. Por lo tanto, existe una fuerza de flotación resultante hacia arriba llamada empuje hidrostático. El hecho de que un cuerpo flote o se hunda depende de su peso y de la magnitud de empuje hidrostático; si el peso del cuerpo es mayor que el peso del líquido que desplaza, el cuerpo se hunde. Si el peso del cuerpo es menor que el peso del líquido que desplaza, entonces el cuerpo flota. Si el peso del cuerpo y el peso del líquido que desplaza son iguales, entonces el cuerpo se mantiene en equilibrio dentro del líquido.
Para calcular el valor del empuje hidrostático es necesario considerar el volumen del cuerpo sumergido (que será el volumen del líquido desplazado) y el peso específico del líquido. A mayor volumen de líquido desplazado el empuje es mayor; a mayor peso específico, mayor empuje también.
Empuje hidrostático = peso específico x volumen
E = Pe x V o E = Pe V (4.1) Para encontrar el volumen sumergido de un sólido flotante, se utiliza la siguiente fórmula:
ps Vs = pLVL (4.2)
Para encontrar la altura que un sólido flotante tiene sumergida, se utiliza la siguiente fórmula:
ps hs = pL hL (4.3)
ps = densidad del sólido, pL = densidad del líquido Vs = volumen del sólido, VL = volumen del líquido hs = altura del sólido, hL = altura del líquido

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática 1.6 Principio de Arquímedes
Práctica No.4 Principio de Arquímedes
Materiales Sustancias Equipo Probeta de 500 ml Agua Balanza digital Cubo de poliuretano Cubo de metal Cubo de madera
Procedimiento 1. Agregar un volumen de agua a la probeta, aproximadamente 250 ml, e introducir el cubo de
poliuretano, Observa si en la escala de la probeta hubo un aumento en el volumen de agua. Registra la medición. Anota tus mediciones en la tabla 4.1.
2. Retirar el cubo de poliuretano, y ahora debes sumergir el cubo de metal y registrar el nuevo volumen que observes en la probeta. Anota tus mediciones en la tabla 4.1.
3. Calcular el peso a partir del volumen de agua desplazado, registra tus resultados en la tabla 4.1. Tabla 4.1 Registro de resultados Objeto Volumen inicial
(cm³) Volumen final (cm³)
Volumen desplazado (cm³)
Peso del objeto (gr)
Cubo de poliuretano
Cubo de metal Cubo de madera

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática. 1.4 Presión.
Práctica No.5 Presión atmosférica y manométrica.
Objetivo
El alumno aprenderá a diferenciar la presión atmosférica de la presión manométrica y calculará cada una de estas.
Introducción
La fuerza que ejerce la presión atmosférica es enorme, no obstante nuestro cuerpo no lo aprecia en las condiciones ordinarias, solamente cuando subimos, con rapidez, a una montaña, sentimos una molestia en los oídos. Una explicación elemental es que la presión al actuar en todas las direcciones provoca que la suma de las fuerzas sea nula, sin embargo, si logramos destruir ese equilibrio, haciendo que la presión actúe de modo que dé lugar a una fuerza en una dirección determinada, entonces se pone de manifiesto el alto valor que esta tiene. Una manera de medir la presión atmosférica es con un barómetro de mercurio, su valor se expresa en términos de la altura de la columna de mercurio de sección transversal unitaria y 760 mm de alto. Con base en esto decimos que una atmósfera estándar es igual a 760 mm Hg (milímetros de mercurio).
Se llama presión manométrica a la diferencia entre la presión absoluta o real y la presión atmosférica. Se aplica tan solo en aquellos casos en los que la presión es superior a la presión atmosférica. Muchos de los aparatos empleados para la medida de presiones utilizan la presión atmosférica como nivel de referencia y miden la diferencia entre la presión real o absoluta y la presión atmosférica, llamándose a este valor presión manométrica.
Los aparatos que miden la presión manométrica reciben el nombre de manómetros y funcionan según los mismos principios en que se fundamentan los barómetros de mercurio y los aneroides. La presión manométrica se expresa bien sea por encima o por debajo de la presión atmosférica. Los manómetros que sirven para medir presiones inferiores a la atmosférica se llaman manómetros de vacío o vacuómetros. Cuando la presión se mide en relación a un vacío perfecto, se llama presión absoluta; cuando se la mide con respecto a la presión atmosférica, se llama presión manométrica.
El concepto de presión manométrica fue desarrollado porque casi todos los manómetros marcan cero cuando están abiertos a la atmósfera. Cuando se les conecta al recipiente cuya presión se desea medir, miden el exceso de presión respecto a la presión atmosférica. Si la presión en dicho recipiente es inferior a la atmosférica, señalan cero.
Un vacío perfecto correspondería a la presión absoluta cero. Todos los valores de la presión absoluta son positivos, porque un valor negativo indicaría una tensión de tracción, fenómeno que se considera imposible en cualquier fluido. Las presiones por debajo de la atmosférica reciben el nombre de presiones de vacío y se miden con medidores de vacío que indican la diferencia entre la presión atmosférica y la presión absoluta. Las presiones absoluta, manométrica y de vacío son cantidades positivas y se relacionan entre si por medio de:
Pman = Pabs – Patm (para presiones superiores a la Patm) Pvac = Patm – Pabs (para presiones inferiores a la Patm)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 1 Hidrostática. 1.4 Presión.
Práctica No.5 Presión atmosférica y manométrica.
Materiales Sustancias Equipo
Olla Agua Olla de presión con medidor de temperatura y presión
Termómetro
Procedimiento 1. Calentar agua en una olla de presión equipada con manómetro y termómetro. 2. Medir temperatura y presión a lo largo de 15 minutos. 3. Calentar agua en una olla normal y registrar la temperatura durante 15 minutos, comparar los
resultados con los del experimento anterior. 4. Calcular la presión total en la olla de presión. Tabla 5.1 Registro de resultados para el calculo de la presión total o absoluta.
Temperatura (ºC) Presión atmosférica
Presion manométrica (Kg / m²)
Presion absoluta (Kg / m²)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 2 Hidrodinámica. 2.2 Gasto y ecuación de continuidad.
Práctica No.6 Gasto y ecuación de continuidad.
Objetivo
El alumno analizará el concepto de gasto y lo aplicará en la ecuación de continuidad.
Introducción El gasto se define como el volumen de fluido que pasa a través de cierta sección transversal en la unidad de tiempo. A fin de expresar cuantitativamente esta rapidez, considérese el flujo de un fluido líquido a través del tubo de la figura 5.1 con una velocidad media (v). Durante un intervalo de tiempo t, cada partícula en la corriente se mueve una distancia (vt). El volumen V que fluye a traves de la sección transversal A se obtiene mediante la siguiente expresión:
V = A vt De este modo el gasto puede calcularse como:
R = Avt / t = vA (5.1)
Gasto = velocidad x sección transversal
Figura 5.1. Calculo de la velocidad de un fluido por un tubo.
Las unidades de R expresan la razón de una unidad de volumen respecto a una unidad de tiempo. Ejemplos comunes son pies³/s, m³/s, l/s y gal/min. Si el fluido es incompresible y se ignoran los efectos del rozamiento interno, el gasto R permanecerá constante. Esto significa que la variación en la sección transversal del tubo, como se muestra en la figura 5.2, dará como resultado un cambio en la velocidad del líquido, de modo que el producto vA permanecerá constante.
Esto puede escribirse como R = v1A1 = v2A2 (5.2)
Un líquido fluirá con más rapidez a través de una sección estrecha del tubo y más lentamente a través de secciones más amplias. Este es el principio que hace que el agua fluya más rapidamente cuando las márgenes de una corriente se juntan.
vt
V = A x vt A
Figura 5.2. En el flujo laminar, el producto de la velocidad del fluido por el área de la sección transversal del tubo es constante en cualquier punto.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 2 Hidrodinámica. 2.2 Gasto y ecuación de continuidad.
Práctica No.6 Gasto y ecuación de continuidad.
Materiales Sustancias 1 manguera de hule de 2 cm de diámetro Agua 1 manguera de hule de 1 cm de diámetro 1 reducción de manguera Cronómetro Vaso de precipitado de 250 ml Probeta de 100 ml
Procedimiento 1. Calcular la velocidad inicial en el lavamanos del laboratorio, para esto une la manguera de 2 cm de
diámetro a la llave del agua, abre la llave y toma el tiempo (t1) que tarda en descargarse el agua en el otro extremo. Sabiendo el largo de la manguera, calcula la velocidad (m/s).
2. Unir las dos mangueras mediante la reducción, conectar la manguera de hule de mayor diámetro a la boca de la llave del lavamanos.
3. Abrir la llave del agua dejando pasar un tiempo (t2) determinado para obtener un volumen de agua en el vaso de precipitado. Con la probeta mide el volumen de agua obtenido.
4. Calcular la velocidad a la que sale el agua después de la reducción de la manguera. 5. Comprueba la ecuación de continuidad.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 3 Termología. 3.4 Dilatación de los cuerpos.
Práctica No.7 Dilatación volumétrica
Objetivo
El alumno analizará como afecta un aumento de temperatura en un sólido y calculará el coeficiente de dilatación volumétrica.
Introducción
Se denomina dilatación al cambio de longitud, volumen o alguna otra dimensión métrica que sufre un cuerpo físico debido al cambio de temperatura que se provoca en ella por cualquier medio.
La dilatación de cualquier objeto que se calienta es isotrópica, es decir, que es la misma en todas las direcciones. Por tanto, el volumen de un líquido, gas o sólido sufrirá un incremento predecible en volumen al aumentar la temperatura. Las siguientes ecuaciones son las relaciones para la dilatación volumétrica o tridimensional:
∆V = βV0 ∆t (7.1) V = V0 + βV0 ∆t (7.2)
β es el cambio en volumen por unidad de volumen por grado de elevación de la temperatura. Este es el coeficiente de dilatación volumétrica y es aproximadamente tres veces más grande que el coeficiente de dilatación lineal.
β = 3α (7.3)
Cuando se trabaja con sólidos, β puede calcularse con la tabla de coeficientes lineales.
Tabla 7.1 coeficiente de dilatación lineal αααα Sustancia
10 ‾⁵ / °C 10 ‾⁵/ °F Aluminio 2.4 1.3 Latón 1.8 1.0 Concreto 0.7-1.2 0.4-0.7 Cobre 1.7 0.94 Vidrio Pyrex 0.3 0.17 Hierro 1.2 0.66 Plata 2.0 1.1
El coeficiente de dilatación volumétrico, designado por β, se mide experimentalmente comparando el valor del volumen total de un cuerpo antes y después de cierto cambio de temperatura y se encuentra que en primera aproximación viene dado por:
β ≈ 1 ∆V(T) = d lnV(T) V(T) ∆T dT
(7.4) Causa de la dilatación: En un sólido las moléculas tienen una posición razonablemente fija dentro de él, y tienen un movimiento vibracional. Al absorber calor la energía cinética promedio de las moléculas aumenta y con ella la amplitud media del movimiento vibracional. El efecto combinado de este incremento es lo que da el aumento de volumen del cuerpo.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 3 Termología 3.4 Dilatación de los cuerpos
Práctica No.7 Dilatación volumétrica
Materiales Sustancias Equipo Matraz aforado de 500 ml Agua Parrilla eléctrica Flexómetro Tapón de corcho Procedimiento 1. Colocar en un matraz aforado un tapón no hermético en la parte inferior del cuello. 2. Calentar suavemente el matraz, el tapón se desplazará hacia arriba, medir el tiempo, distancia lineal
de desplazamiento y el volumen aumentado por la temperatura. 3. Llenar el matraz con agua hasta la marca de aforo, colocar el tapón en el cuello del matraz y
calentar suavemente, realizar nuevamente mediciones de tiempo, distancia lineal de desplazamiento y volumen aumentado por la temperatura.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 3. Termología 3.1 Concepto de temperatura y su medición
PRÁCTICA NO. 8 Uso del termómetro
Objetivo
Introducción
El alumno determinará los cambios de temperatura que sufre un líquido al ser calentado, utilizando el termómetro.
El termómetro es un instrumento de medición de temperatura. Desde su invención ha evolucionado mucho,
principalmente a partir del desarrollo de los termómetros electrónicos digitales.
Para poder determinar la temperatura que medimos, el termómetro cuenta con una escala graduada
cuidadosamente que está estrictamente relacionada con el volumen que ocupa el mercurio en el tubo. Existen
infinidad de gamas de termómetros, hoy en día podemos encontrar una presentación un poco más moderna de
tipo digital, aunque el mecanismo interno no varía.
Este artefacto se utiliza habitualmente para medir o tomar la temperatura de un individuo; de la misma manera,
el termómetro se utiliza para medir la temperatura en ambientes y en animales, como también en ciertos
artefactos electrodomésticos. Con respecto a la temperatura que éste mide, la escala que más se utiliza en el
mundo entero es la Celsius, la misma mide la temperatura en grados centígrados y se le dio este nombre por
su creador Andrés Celsius.
Existen de todas formas otras escalas utilizadas pero en menor medida: Fahrenheit, Réaumur (actualmente en
desuso) y Kelvin o también conocida como temperatura absoluta, este tipo de escala se utiliza específicamente
en laboratorios, los termómetros de laboratorio suelen fabricarse con dos o más escalas. Además de los
termómetros digitales o de vidrio, existen otros que se utilizan en la actualidad; el termómetro de resistencia es
uno de ellos. El mismo está formado por un alambre de platino y cuya resistencia eléctrica va variando a
medida que la temperatura lo hace. Podemos mencionar también el pirómetro, que es un termómetro que se
utiliza exclusivamente para medir las altas temperaturas. Luego debemos nombrar al termopar, un artefacto
empleado para medir temperaturas con un sistema basado en la fuerza electromotriz, la cual se genera cuando
se calienta la soldadura de dos metales distintos. Por último, dentro de la gama más conocida y utilizada de
termómetros, tenemos el termómetro de lámina bimetálica, el mismo está constituido por dos láminas de
metales cuyos coeficientes de dilatación son muy distintos, se emplea principalmente como sensor de
temperatura en el termohigrógrafo.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 3. Termología
3.1 Concepto de temperatura y su medición
PRÁCTICA NO. 8 Uso del termómetro
Materiales Equipo Agua Cronómetro Cloruro de Sodio (NaCl) Parrilla eléctrica 2 hojas blancas Regla
Procedimiento
1. Hervir agua pura utlizando la parrila eléctrica, con la ayuda del termómetro medir la temperatura
cada tres minutos.
2. Preparar una solución salina al 20 % , llevarla a ebullición y medir su temperatura cada tres
minutos.
3. Construir una gráfica de temperatura contra tiempo con los datos obtenidos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 3. Termología
3.3 Mecanismos de transferencia de calor
PRÁCTICA No. 9 Transferencia de calor por conducción y radiación
Objetivo
Introducción
El alumno analizará la transferencia de calor por conducción y radiación a través de un experimento.
En los sólidos, la única forma de transferencia de calor es la conducción. Si se calienta un extremo de una
varilla metálica, de forma que aumente su temperatura, el calor se transmite hasta el extremo más frío por
conducción. No se comprende en su totalidad el mecanismo exacto de la conducción de calor en los sólidos,
pero se cree que se debe, en parte, al movimiento de los electrones libres que transportan energía cuando
existe una diferencia de temperatura. Esta teoría explica porqué los buenos conductores eléctricos también
tienden a ser buenos conductores del calor. En 1822, el matemático francés Joseph Fourier dio una
expresión matemática precisa que hoy se conoce como ley de Fourier de la conducción del calor. Esta ley
afirma que la velocidad de conducción de calor a través de un cuerpo por unidad de sección transversal es
proporcional al gradiente de temperatura que existe en el cuerpo.
La radiación presenta una diferencia fundamental respecto a la conducción y la convección: las sustancias
que intercambian calor no tienen que estar en contacto, sino que pueden estar separadas por un vacío. La
radiación es un término que se aplica genéricamente a toda clase de fenómenos relacionados con ondas
electromagnéticas. Algunos fenómenos de la radiación pueden describirse mediante la teoría de ondas, pero
la única explicación general satisfactoria de la radiación electromagnética es la teoría cuántica.
Todos los cuerpos calientes emiten radiaciones térmicas que cuando son absorbidas por algún otro cuerpo,
provocan en él un aumento de temperatura. En este caso, la transmisión no se efectúa por conducción ni por
convección, pues en estos procesos sólo puede ocurrir cuando hay un medio material a través del cual se
puede transferir el calor.
La expresión matemática de esta ley, llamada distribución de Planck, relaciona la intensidad de la energía
radiante que emite un cuerpo en una longitud de onda determinada con la temperatura del cuerpo. Para cada
temperatura y cada longitud de onda existe un máximo de energía radiante. Sólo un cuerpo ideal (cuerpo
negro) emite radiación ajustándose exactamente a la ley de Planck. Los cuerpos reales emiten con una
intensidad algo menor.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
L a d r i l l o
Laboratorio de Física II
BLOQUE DIDÁCTICO 3. Termología
1.3 Mecanismos de transferencia de calor
PRÁCTICA No. 9 Transferencia de calor por conducción y radiación
Materiales
Bloque de cobre 10 x 10 cm. Bloque ladrillo 10 x 10 cm. Bloque de vidrio 10 x 10 cm. Cronómetro Parilla eléctrica Termómetro
Procedimiento
Conducción
1. Colocar cada uno de los bloques en la parrilla eléctrica (Figura 9.1)
2. Calentar los bloques de cada material.
3. Medir la temperatura superficial durante 30 minutos.
Tabla 9.1 Temperatura de diversos materiales calent ados por conducción
Materiales Tiempo (minutos). 0 5 10 15 20 25 30
Cobre Ladrillo Fierro Vidrio
Madera
C o b r e
f i e r r o
V i d r i o
M a d e r a
Parrilla eléctrica Figura 9.1

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 3. Termología
1.4 Mecanismos de transferencia de calor
PRÁCTICA No. 9 Transferencia de calor por conducción y radiación
Radiación
1. Prender la parrilla de calentamiento y colocar los bloques a 10 cm de la parrilla y medir la
temperatura en 1, 3, 5, 10, 15 y 20 minutos.
2. Registrar la temperatura en la parte opuesta de la parrilla durante 30 minutos
Tabla 9.1 Temperatura de diversos materiales calent ados por radiación
Materiales Tiempo (minutos). 0 5 10 15 20 25 30
Cobre Ladrillo Fierro Vidrio
Madera
3. Calcular la cantidad de calor para cada uno de los materiales.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.6 Concepto de pila, resistencia, Ley de Ohm.
Práctica No. 10 Circuitos en serie y en paralelo
Objetivo
El alumno aprenderá a construir circuitos en serie y en paralelo.
Introducción
Sabemos que la corriente eléctrica consiste en un flujo de electrones a través de un conductor debido a una diferencia de potencial. Si no hay diferencia de potencial o voltaje, no hay corriente eléctrica. Una pila eléctrica o batería es una fuente constante de voltaje que permite mantener una corriente continua de electrones a través de un conductor. La primera fuente constante de voltaje fue construida en 1779 por el profesor italiano Alessandro Volta. El descubrió que al sumergir una placa de cobre y una de zinc en ácido podía generarse electricidad al unir las placas mediante un circuito. Un circuito eléctrico simple es un arreglo de partes que proporcionan un camino a los electrones para obtener trabajo. En el circuito eléctrico, la corriente necesita un camino y una fuente de voltaje. La corriente eléctrica puede efectuar trabajo al encender una lámpara instalada en el circuito.
Circuito en serie: en estos circuitos, la corriente eléctrica sólo puede seguir por una trayectoria a través de las resistencias en serie. La corriente tiene el mismo valor en todas las partes del circuito; el voltaje es igual a la suma de los voltajes a través de las resistencias y la resistencia total es igual a la suma de todas las resistencias conectadas. (ver Fig 10.1)
Figura 10.1 Circuito en serie compuesto por una pila, y dos focos conectados en serie.
Circuito en paralelo: en un circuito con resistencia conectadas en paralelo, cada resistencia está conectada directamente a la fuente de voltaje. Cuando se desconecta una resistencia, no se interrumpe el paso de la corriente por las demás. El total de corriente, mantenido por la fuente de voltaje, es igual a la suma de las corrientes en las ramas individuales.
I = V/R
I: Intensidad de corriente (Amperios, A)
V: Diferencia de potencial o voltaje
(voltaje, V)
R: Resistencia (Ohms, Ω)
R = R + R
R1 R2
V
R2
R1
V
Rtotal = 1 / [(1/R1) + (1/R2)]

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.6 Concepto de pila, resistencia, Ley de Ohm.
Práctica No. 10 Circuitos en serie y en paralelo
Materiales Pinzas de electricista 1.4 m de alambre de cobre 1 desarmador 2 portalámparas 1 interruptor 2 pilas de 9 volts Cinta de aislar 2 focos de 15 watts
Procedimiento: Construccion de un circuito en serie: 1. Cortar con las pinzas el cable en cinco partes iguales, que se llamarán, 1,2, 3, 4; retirar de cada
extremo dos centímetros de aislante. 2. Poner con el desarmador un extremo del alambre número 1 en un tornillo del portalámparas y en el
otro tornillo uno de los extremos del alambre número 2. 3. Colocar el otro extremo del alambre número dos en la entrada del interruptor, y en la salida, un
extremo del alambre número 3. 4. Conectar el otro extremo del alambre número 3 en la parte superior de la pila y fijarlo con cinta de
aislar. 5. Poner en la parte inferior de la pila el otro extremo del alambre número 1. 6. Enroscar el foco en el portalámparas y accionar el interruptor para abrir o cerrar el circuito. Observar
lo que le sucede al foco. 7. Abrir el circuito y con el alambre número 4 conectar el otro portalámparas entre el primero y el
interruptor. Enroscar el otro foco y observar lo que sucede en ambos focos. 8. Retirar de la parte superior de la pila el alambre, coloca otra pila encima de ésta y vuelve a colocar
el alambre en la forma anterior. Observa la intensidad luminosa de los focos. Construccion de un circuito en paralelo: 1. Con el circuito construido anteriormente, desconectar el portalámparas 2, cortando por la mitad el
cable 2 y el cable 4. 2. Cortar el cable 1 por la mitad, e interconectar las lámparas nuevamente, uniendo el cable 2 del
segundo portalámparas con el cable 1, unir el cable 4 con el cable 2 que sale del primer portalámparas, y los extremos 2 y 4 que quedaron unidos se conectarán al interruptor, que estará conectado a una pila de 9 volts.
3. Dibuja los diagramas correspondientes para cada circuito que construiste.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.5 Diferencia de potencial o voltaje.
Práctica No.11 Intensidad de corriente
Objetivo
El alumno aprenderá a realizar mediciones de la intensidad de corriente en un circuito eléctrico conectado en serie.
Introducción
La intensidad de corriente puede medirse contando la cantidad de electrones que pasan por un punto dado en un tiempo determinado. La intensidad de corriente es la carga eléctrica que pasa por una sección del conductor en un segundo. Puede expresarse de la siguiente forma:
I = q / t q = carga eléctrica en coulombs (C) t = tiempo en segundos (s) I = intensidad de corriente en coulombs/segundo
La unidad de intensidad de corriente eléctrica (coulombs/segundo) se llama amperio (A) en honor del científico francés Andre Marie Ampere. La cantidad de corriente que fluye en un alambre está determinada por el número de electrones que
pasan por un punto dado, en un segundo. 1 Coulomb es 6.28x10¹⁸ electrones. Si un Coulomb pasa en un punto en un segundo, se tendrá una corriente de 1 ampere.
En esta práctica utilizaremos el multímetro para la medición de corriente, un medidor de corriente siempre debe conectarse en serie con la fuente de potencia y la carga. Si se conecta en paralelo con cualquiera de las componentes, puede tenerse un flujo de corriente demasiado elevado en el medidor y dañar su mecanismo. Cuando se usa un medidor para medir corriente continua debe considerarse la polaridad: debe conectarse de manera que el flujo de corriente a través del medidor sea desde la terminal negativa del medidor hasta la positiva. No es necesario considerarse la polaridad cuando se usa un medidor cuya posición cero se encuentra en el centro de la escala. Como la polaridad de la corriente alterna cambia continuamente, no es necesario observar la polaridad cuando se mide. Nunca debe conectarse un medidor en un circuito, a menos que se conozca aproximadamente la corriente que fluye dentro de éste y que el medidor pueda manejar ese rango.
El dispositivo que se utiliza para medir la intensidad de la corriente que pasa por un conductor, se llama amperímetro. El amperímetro debe conectarse de forma que pueda “contar” todos los electrones que pasen por el hilo y la única manera de conseguirlo es “abrir la línea” e intercalar en ella el amperímetro, esto es, una
conexión en serie.
Figura 11. Circuito en serie

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.5 Diferencia de potencial o voltaje.
Práctica No.11 Intensidad de corriente
Introducción
En esta práctica se hará uso del multímetro que quiere decir múltiples mediciones, con este aparato puedes obtener medidas de corrientes, voltajes, resistencias, transistores, diodos y continuidad, tanto en corriente alterna (CA) como en corriente directa (CD).
Sus partes principales son: pantalla, selector, carátula de funciones y escalas, entradas y puntas. Se les llama entradas a los orificios en donde se insertan los conectores machos (jacks) de los cables rojo y negro, y se llaman puntas a las partes que hacen contacto con los elementos a medir.
Instrucciones de seguridad
1. Nunca aplique al medidor, voltaje o corriente que exceda las especificaciones máximas de medición. 3. No mida voltajes si el voltaje en el contacto “COM” de entrada tipo Jack excede 600 V respecto a tierra. 4. Nunca conecte los cables de prueba del medidor a una fuente de voltaje, cuando el selector de funciones está en la escala de; corriente, resistencia o prueba de diodo. Hacerlo puede dañar el medidor y pierde su garantía. 6. Siempre Coloque el selector de funciones en la posición de “OFF”, y apague la energía y desconecte los cables de prueba antes de quitar la tapa para reemplazar la batería ó fusible. 7. Nunca opere el medidor a menos que la tapa posterior y la tapa de la batería y de fusibles estén colocadas y aseguradas. 8. Siempre, gire el selector de funciones a la posición de “OFF” (apagado) cuando el medidor no está en uso. 9. Si en la pantalla aparece "OL" durante una medida, es que el valor excede el rango seleccionado, cambie a un rango más alto.
NOTA: En algunos rangos bajos de voltaje en “CA” y ”CD”, sin estar los cables de prueba conectados a
un dispositivo, la pantalla puede mostrar una lectura aleatoria cambiante. Esta respuesta es normal y es causado por la alta sensibilidad en la entrada para medir la lectura se estabilizará e indicará un valor apropiado al estar conectada a un circuito.
Controladores 1. Termómetro IR *5 y apuntador láser 2. Pantalla “LCD” *6 de 4000 conteos 3. Botón retención y luz de Fondo. 4. Botón SELECTOR 5. Selector de Funciones 6. Conectores de entrada mA, µA y A 7. Conector de entrada común (COM) 8. Conector de entrada positivo (Temp-
V) 9. Botón de retención de Rango 10. Botón para medición Relativa 11. Botón para apuntador láser
Multímetro Extech 470, (# de Parte EX470) Este multímetro es autorrango, con lecturas en valor de RMS *1 (Valor eficaz)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.5 Diferencia de potencial o voltaje.
Práctica No.11 Intensidad de corriente
Materiales Equipo
Batería de 9 volts Multímetro 1 foco de 2 volts 1 pinza de electricista 1.4 m de cable o alambre de cobre 1 desarmador 1 portalámparas Cinta de aislar
Procedimiento: 1. Construir un circuito que estará formado por la batería y el foco, conectados en serie.
2. Antes de conectar el multímetro al circuito; insertar el conector tipo banana del cable negro de prueba en el conector tipo jack marcado como COM. Seleccionar la escala de µA e insertar el conector tipo banana del cable rojo de prueba en el conector tipo jack marcado como µA/A. presionar el botón SELECT para indicar DC (corriente directa) en la pantalla.
3. Cortar la tensión (energía) del circuito bajo prueba, enseguida abra el circuito en el punto donde se desea medir la corriente.
4. Colocar el multímetro en cualquier parte del circuito, puesto que el circuito está conectado en serie, la corriente es la misma en todos los puntos. (ver figura 11)
5. Colocar la punta roja en el terminal positivo del instrumento y la punta negra en el terminal negativo y aplique energía al circuito.
El circuito fue abierto a fin de conectar las puntas de prueba del amperímetro, de manera que el instrumento quede en serie con el circuito.
6. Registre la lectura que aparece en la pantalla.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 6 Electricidad. 4.5 Diferencia de potencial o voltaje.
Práctica No.12 Medición de voltaje
Objetivo
El alumno aprenderá a realizar mediciones de voltaje en corriente alterna y en corriente directa.
Introducción
Los cuerpos cargados electricamente ejercen una fuerza sobre los objetos que lo rodean y la característica de ésta fuerza es la de repeler a los cuerpos de cargas iguales y atraer a los cuerpos con carga diferente. Esta fuerza es llamada fuerza electromotriz e indica que las cargas eléctricas de los cuerpos tienden a mover a los electrones de los cuerpos próximos a ellos.
Si pudieramos cargar dos esferas transportando electrones de la esfera de la izquierda a la esfera de la derecha (Figura 12) tendriamos que realizar trabajo y las cargas originarían una fuerza electromotriz tendiente a mover los electrones de la esfera negativa a la positiva.
La magnitud de la fuerza electromotriz que actúa entre los cuerpos cargados depende de la magnitud de las cargas y la distancia que las separa (de acuerdo con la Ley de Coulomb), pero la energía utilizada debido al trabajo realizado para trasladar electrones a la esfera de la derecha queda almacenada como energía potencial electrica. Estos electrones pueden realizar trabajo si regresan a la esfera positiva.
La energía potencial eléctrica o potencial eléctrico se define de la siguiente manera:
Potencial eléctrico = energia potencial / carga eléctrica, V = E / q
En donde las unidades de energía se expresan en Joules (J) y las unidades de carga eléctrica se expresan en coulombs (C)
A esta unidad (Joules/ Coulomb) se le da el nombre de volt (V).
La mayoría de las instalaciones eléctricas residenciales son de 127 Volts en corriente alterna, pero hay casos en donde se tienen 220 Volts para alimentar equipos de aire acondicionado, motobombas y algunos otros aparatos.
La parte que mide voltaje en corriente alterna de la carátula del multímetro tiene dos medidas: 200 y 750 Volts. Cualquiera de las dos puede utilizarse para medir 127 Volts en corriente alterna. La mayoría de las mediciones en corriente directa son para pilas (baterías alcalinas, o de niquel cadmio o de otros materiales). Generalmente estos valores son de 1.5, 6, 9 y 12 Volts. Por todo lo anterior, la parte que mide corriente directa o continua de un multímetro solo se utiliza para medir voltajes en baterías, pilas o acumuladores, o en algunos casos para hacer mediciones en electrónica.
+ - Figura.12 Dirección de la fuerza eléctrica actuando en los electrones.
Esferas cargadas

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.5 Diferencia de potencial o voltaje.
Práctica No.12 Medición de voltaje
Materiales Equipo
Pila de 1.5 Volt gastada Multímetro Medición de voltaje en corriente alterna. Procedimiento: 1. Medir el voltaje en una toma de corriente o contacto, para esto insertar los jacks machos en las entradas (hembra) del multímetro. El cable negro siempre se inserta en la entrada identificada en la carátula como COM. El cable rojo va en una de las otras dos entradas, en este caso elige la que tiene: VΩmA. 2. Mover el selector a la posición ACV en 200 Volts. Si tienes duda acerca del voltaje a medir entonces debes seleccionar la mayor escala del multímetro. 3. Insertar las puntas en los orificios o ranuras del contacto y registrar el voltaje que aparece en la pantalla. Nota: Si intercambiaste las puntas (cables rojo y negro) a la hora de insertarlas en la toma de corriente no hay problema. Pero si conectaste una de ellas (jack macho) en la otra entrada del multímetro (para medir Amperes) o bien elegiste otra escala con el selector, probablemente el multímetro se dañará. Medición de voltaje en corriente directa. Procedimiento: 1. Medir el voltaje en una batería común doble A, para esto insertar los jacks machos en las entradas hembra) del multímetro. El cable negro siempre se introduce en la entrada identificada en la carátula como: COM. El cable rojo va en una de las otras dos entradas, en este caso elige la que diga VΩmA. 2. Mover el selector a la posición DCV en 20 Volts. 3. Colocar la punta roja en la cabeza de la batería (siempre es la terminal positiva) y la punta negra en la parte plana de la batería (siempre es la Terminal negativa). En la pantalla aparecerá un voltaje aproximado a 1.5 Volts, difícilmente será esta cantidad ya que varía dependiendo de lo descargada que esté la batería. Si intercambiaste las puntas (cables rojo y negro) a la hora de colocarlas en la batería no hay problema.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad. 4.6 Concepto de pila, resistencia, Ley de Ohm.
Práctica No.13 Resistencia eléctrica.
Objetivo
El alumno aprenderá a realizar mediciones de la resistencia eléctrica.
Introducción
La oposición o resistencia que presenta un conductor al paso de la corriente eléctrica depende de los siguientes factores:
La naturaleza del material. Muchos materiales presentan gran resistencia al paso de la corriente eléctrica debido a su estructura molecular. La porcelana y el vidrio, por ejemplo, son malos conductores; en cambio, el cobre y la plata son buenos conductores. La longitud del conductor. La resistencia de un conductor aumenta con su longitud. A mayor lontigud de un alambre de metal habrá más choques entre los iones y los electrones, con lo que aumenta su resistencia. El área de sección transversal. Un alambre más grueso presenta menor resistencia al paso de la corriente eléctrica que uno delgado. La temperatura. A medida que aumenta la temperatura en un conductor sólido, los iones fijos en la red cristalina vibran más. Esto provoca un mayor número de choques entre los electrones libres que fluyen y los iones y en algunos semiconductores la resistencia disminuye al aumentar la temperatura.
Los efectos que produce la resistencia de un conductor en la intensidad de la corriente eléctrica y el potencial eléctrico o voltaje fueron estudiados por el físico George Simon Ohm, quien descubrió que la intensidad de la corriente que pasa por un conductor es directamente proporcional a la diferencia de potencial (voltaje), e inversamente proporcional a la resistencia del conductor. Esta proporcionalidad se conoce como la Ley de Ohm y se expresa matemáticamente de la siguiente forma
I = V / R I = Intensidad de corriente (amperios), A V = diferencia de potencial (Volts), V R = resistencia (ohms) Ω En un circuito eléctrico, la corriente eléctrica solo puede seguir por una trayectoria a través de las resistencias en serie. La corriente tiene el mismo valor en todas las partes del circuito; el voltaje es igual a la suma de los voltajes a través de las resistencias y la resistencia total es igual a la suma de todas las resistencias conectadas. Un ohmímetro es un dispositivo que mide la resistencia de un circuito o de una componente. También sirve para localizar circuitos abiertos o corto circuitos. Básicamente, un ohmímetro consta de un medidor de corriente continua, una fuente de baja tensión y baja potencia de c-c y resistores limitadores de corriente, todos ellos conectados en serie. El medidor de bobina movil es el único aparato de medición de corriente que se usa en los ohmímetros. Como fuente de energía se usa una batería de baja tensión.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.6 Concepto de pila, resistencia, Ley de Ohm.
Práctica No.13 Resistencia eléctrica
Materiales Equipo 1 hoja de papel cuadriculado Multímetro 1 lápiz del número 2 2 clips 1 placa de cobre (6 x 2 cm) 1 placa de acero (6 x 2 cm) 1 placa de fierro (6 x 2 cm) 30 cm de alambre de cobre calibre 12 10 cm de alambre de cobre calibre 8 40 cm de alambre de cobre calibre 10 Pinzas Resistencia contra longitud de un conductor.
Procedimiento 1. Construir un conductor por medio de una tira de papel con grafito; para ello, en un papel
cuadriculado colorear con un lápiz del número 2, un sector formado por un cuadro de alto y 20 cuadros de longitud (sugerido). El grafito depositado será el material de la resistencia.
2. Para realizar la medición de la resistencia eléctrica; se debe ajustar el multímetro a cero antes de
medir resistencias. Para esto debes seleccionar el rango deseado en el botón para selección de escalas de medición. Conecta el cable negro en la entrada marcada COM y el rojo en la entrada marcada +. Une las puntas de prueba de los cables negro y rojo para poner en corto al aparato. Gira el control cero ohms hasta que en la pantalla marque cero ohms. Si esto no se logra se deben reemplazar las baterías del multímetro. Desconecta las puntas de prueba de los cable rojo y negro y conectalos al componente que se quiere medir.
3. Conectar el multímetro a la tira de papel con grafito , utilizando clips metálicos para fijar la puntas del multímetro. (ver figura 13) y realizar la medición.
4. Coloca el botón de encendido en cualquiera de las porciones de corriente alterna o corriente directa y registra la medición que aparace en la pantalla del multímetro.
Figura 13

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Laboratorio de Física II
BLOQUE DIDÁCTICO 4 Electricidad 4.6 Concepto de pila, resistencia, Ley de Ohm.
Práctica No.13 Resistencia eléctrica
Resistencia debida a la naturaleza del material
5. Medir la resistencia eléctrica en las placas de fierro, cobre y acero, utilizando el multímetro como se describió en el paso número 2.
Resistencia contra longitud de un conductor
6. Cortar el cable de calibre 12 en 3 partes de diferente medida, medir la resistencia para cada cable como se describió en el paso 2. Registrar los datos en la tabla 13.1, graficar resistencia contra longitud del alambre y obtener una ecuación que se ajuste a los datos obtenidos.
Tabla 13.1 Efecto de la longitud sobre la resistenc ia en un conductor.
Longitud del alambre (cm) Resistencia ( ΩΩΩΩ)
Resistencia contra el área de sección transversal.
7. Medir la resistencia para 10 cm de alambre de cobre de diferente calibre (8, 10 y 12). Anotar los resultados en la tabla 13.2:
Tabla 13.2 Efecto del área de sección transversal s obre la resistencia en un conductor.
Área de sección transversal (cm) Resistencia ( ΩΩΩΩ)
8. Graficar resistencia contra área de sección transversal, obtener una ecuación que se ajuste con los datos obtenidos.
Resistencia contra temperatura
9. Cortar 3 tramos iguales de alambre de cobre calibre 10, realizar la medida de la resistencia para uno de los alambres cuando se encuentra a temperatura ambiente.
10. Calentar los otros dos alambres,hasta alcanzar una temperatura de 30 °C aproximadamente y realizar la medida de la resistencia, seguir incrementando la temperatura del otro alambre hasta que alcance 40 °C aproximadamente y medir la resistencia, registrar los datos en la tabla13.3 y graficar resistencia contra temperatura:
Tabla 13.3 Efecto de la temperatura sobre la resist encia en un conductor.
Temperatura ( °°°°C) Resistencia ( ΩΩΩΩ)

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
REGLAMENTO GENERAL PARA LOS LABORATORIOS DE F ÍSICA, QUÍMICA Y BIOLOGÍA
Objetivo Establecer lineamientos sobre disciplina, seguridad, evaluación y preservación del medio ambiente, al que quedarán sujetos profesores y alumnos en el desarrollo de las prácticas de las asignaturas de Física, Química y Biología. 1.- Observancia .- El presente reglamento se aplicará a las prácticas de laboratorio de las siguientes asignaturas: Biología I, Biología II, Química I, Química II, Física I y Física II. A) De los alumnos 2.- Disciplina 2.1 Los alumnos deberán asistir puntualmente en la fecha y horario establecido para la realización de la
práctica. 2.2 Cuando un alumno o grupo de alumnos no se presenten a la práctica asignada sin justificación se
registrará como inasistencia. 2.3 Ningún alumno deberá ausentarse durante el desarrollo de su práctica sin autorización del profesor
responsable. 2.4 Los alumnos solo podrán hacer uso del laboratorio siempre que esté presente un profesor que lo
autorice expresamente. 2.5 Todo alumno que cometa faltas al buen orden y a la disciplina en general, será sancionado
en base al reglamento general de la institución. 2.6 Los materiales y equipo de laboratorio se prestarán a los alumnos mediante un vale,
comprometiéndose a regresarlos en buen estado al término de su uso. En caso de daños o pérdida del equipo o materiales, ocasionados por descuido o negligencia, éstos deberán ser reintegrados en su totalidad antes de concluir el periodo cursado.
2.7 Una vez terminada la práctica, el alumno deberá dejar equipo, materiales y área de trabajo en
perfectas condiciones de limpieza y funcionalidad. 3.- Seguridad 3.1 Todos los alumnos que realicen directamente la práctica, deberán usar adecuadamente el equipo de seguridad personal necesario (bata de algodón de manga larga, guantes, cubreboca, mascarilla, anteojos, según el tipo de práctica). 3.2 Queda estrictamente prohibido fumar y consumir alimentos o bebidas en la sala donde se realizan las prácticas de laboratorio. 3.3 Queda estrictamente prohibido cometer actos que puedan propiciar accidentes.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
3.4 Los alumnos deberán conocer las normas de seguridad del laboratorio en materia de: casos de incendio, derrames de reactivos y accidentes de contacto con materiales tóxicos o corrosivos. 3.5 Asegúrese que la llave de agua y gas estén cerradas, así como también los aparatos eléctricos se encuentren desconectados al término de la práctica. 4.- Evaluación 4.1 La calificación mínima aprobatoria será de 80%, la evaluación del laboratorio deberá incluir aspectos de asistencia, desarrollo de la práctica y reporte escrito. 4.2 El alumno deberá asistir al 100% de las prácticas que se lleven a cabo. 5.- Preservación del medio ambiente 5.1 Los usuarios de los laboratorios deberán seguir las indicaciones que sobre la disposición de residuos (almacenamiento, uso, estabilización y disposición final) contienen los instructivos de prácticas y observar la normatividad sobre el manejo de residuos peligrosos. B) De los Asesores - El asesor será responsable de la planeación de las prácticas de laboratorio de la asignatura correspondiente. - El profesor deberá asistir y coordinar las prácticas de su asignatura. - El profesor será responsable de la evaluación de las prácticas de laboratorio de las asignaturas
correspondientes.
GENERALIDADES
1. Los alumnos deberán asistir al laboratorio bajo horarios establecidos para el desarrollo de sus
prácticas. 2. Los alumnos que participan directamente en la realización de la práctica, deberán utilizar una
bata de laboratorio de algodón de manga larga.
3. Las prácticas serán impartidas por el asesor de la materia.
4. Los alumnos podrán hacer uso del laboratorio siempre que esté presente un profesor; de lo contrario, ningún alumno podrá tener acceso al laboratorio.
5. Una vez terminada la práctica, los alumnos deberán dejar el equipo y el área de trabajo en
perfectas condiciones de limpieza y funcionalidad, reportando los datos obtenidos.

INSTITUTO DE ESTUDIOS DE BACHILLERATO DEL ESTADO DE OAXACA
Asistencia y Disciplina
1. El alumno deberá asistir al total de las prácticas programadas. 2. Después de los diez minutos de la hora señalada para el inicio de la práctica no se permitirá la
entrada de ningún alumno. 3. Las inasistencias deberán justificarse tres días antes o después de la realización de la práctica. 4. Los alumnos tienen la necesidad de permanecer en el área de trabajo correspondiente donde se
está efectuando la práctica durante el tiempo asignado para el desarrollo de la misma y solamente podrán salir con la autorización del catedrático o auxiliar.
5. Todo alumno que cometa faltas al buen orden y a la disciplina en general, será sancionado en
base al reglamento de la institución.