Fisiopatología Digestiva Falla Hepática
Click here to load reader
description
Transcript of Fisiopatología Digestiva Falla Hepática

Falla Hepática Fisiopatología Sistema Digestivo
Dr. Gabriel Astete
Estructuralmente el hígado está constituido por una masa de células irrigada principalmente por las venas mesentéricas superior e inferior, a través de la vena porta, recibiendo la sangre de todo el territorio esplácnico. Alrededor de un 77% del hígado está compuesto por los hepatocitos, sus células funcionales; aproximadamente un 23% son células del estroma.
Las células del hígado se distribuyen tridimensionalmente para captar el flujo portal y metabolizar la sangre procedente del territorio esplácnico. Tradicionalmente los lobulillos hepáticos tienen forma hexagonal, en cuyos vértices se encuentran ramas de la vena porta, drenaje biliar y ramas de la arteria hepática (triada hepática), mientras que en su centro se encuentra el drenaje venoso (vena central) hacia la vena cava, a través de la vena hepática. Los lobulillos son considerados como “masa de hepatocitos funcionales”.
Rappaport describió una división funcional de los hepatocitos (Acino de Rappaport), los que se distribuyen en cadena a partir de la triada hepática hacia la vena central, siguiendo la sangre este mismo recorrido.
Función hepática
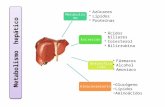
1. Función Metabólica: � Metabolismo de los Carbohidratos:
- Acumula glucógeno o libera energía (gluconeogénesis). � Metabolismo de los Lípidos:
- Sintetiza lípidos a partidos del exceso de carbohidratos o aa. - Sintetiza cuerpos cetónicos a partir de acetil-CoA, proveniente de
lípidos movilizados en ayuno. � Metabolismo de los Aminoácidos y Proteínas:
- Garantiza niveles plasmáticos de aa, independiente de la dieta (interconversión).
- Obtiene glucosa a partir de aa gluconeogénicos.

2. Función Biliar: � Ácidos Biliares y Fosfolípidos. � Emulsión, procesamiento y absorción de las grasas.
3. Metabolismo de Xenobióticos: � En gran medida se produce a través de la bilis; también modifica los
compuestos para eliminación renal. Metabolismo de la Glucosa:
El hígado no extrae glucosa de la dieta (5-10%). La mayor cantidad de glucosa metabolizada por el hígado proviene de sus depósitos internos, ésta es transformada para ser depositada en el tejido graso. El hígado es esencial para liberar glucosa al torrente sanguíneo.
La metabolización de la glucosa se realiza principalmente por dos vías: � Glucogenogénesis. � Glucólisis (principal): sus productos pueden realizar ciclo de Krebs, síntesis de
ácidos grasos y síntesis de aa no esenciales. Por lo tanto, el hígado es un productor de energía. Esto es mediado por insulina y
glucagón, siendo insulina un proactivo para la reserva de energía y el glucagón es un proactivo para liberar energía a partir de los elementos almacenados.
Efectos de las variaciones insulina-glucagón Insulina Glucagón
Favorece captación hepática de glucosa Inhibe glucólisis Disminuye captación hepática de lactato, piruvato y alanina
Inhibe glucogenogénesis
Promueve captación de aa por el músculo Estimula gluconeogénesis Disminuye lipólisis Estimula la oxidación de ácidos grasos y
cetogénesis Aumenta litogénesis Disminuye síntesis de enzimas gluconeogénicas
Aumenta síntesis de enzimas glicolíticas
Resumen metabolismo de la glucosa Síntesis de glucógeno Glucólisis
- Forma de depósito de la glucosa. - La capacidad de depósito de glucógeno es limitada (no se puede más allá de 7% del peso del hígado). - Altas concentraciones de glucógeno inhiben su síntesis (esto obliga su almacén en otros tejidos, como músculo y células adiposas de los mesenterios).
- Oxida la glucosa a partir de G6P, generando piruvato. - Ocurre en períodos de ingesta alimentaria de hidratos de carbono. Ocurre cuando los niveles de glucosa saturan la síntesis de glucógeno. - Su rol fundamental es continuar el depósito de nutrientes. No es importante en la generación de energía, ya que esta se obtiene de la oxidación de los ácidos grasos.

Metabolismo de Ácidos Grasos: Todos los ácidos grasos son captados por el hígado e ingresan a dos vías:
esterificación y oxidación, obteniéndose cuerpos cetónicos, lipoproteínas, etc. Las lipoproteínas están relacionadas con el metabolismo del colesterol. Particularmente, el hígado forma las VLDL y participa en la síntesis de HDL. El colesterol dietario es captado por los quilomicrones, el cual participa en la síntesis de ácidos biliares (bilis).
Metabolismo Proteico:
El hígado sintetiza dos tipos de proteínas: 1. Proteínas estructurales, de las paredes, membranas, organelos. Requieren de una
producción constante por su gran tasa de recambio. Las proteínas de membrana tienen una vida media de 3-6 días y los receptores de 10-20 horas.
2. Proteínas de secreción, como las proteínas plasmáticas (valoradas clínicamente), que son producidas por el hígado y pasan al torrente sanguíneo. La proteína plasmática más representativa es la albúmina, la cual se encarga de mantener la presión oncótica del plasma, transportar compuestos endógenos (bilirrubina, ácidos grasos, metales, hormonas) y exógenos (fármacos). También participa en la cicatrización, sin ella no hay capacidad de regeneración.
Se producen alrededor de 15 gramos al día de albúmina en condiciones basales. Su
síntesis puede ser afectada por los siguientes factores: � Hormonales (hormona del crecimiento, tiroideas, glucocorticoides). � Nutrición: este factor afecta enormemente su síntesis. Se requiere de cierta cantidad
de aa esenciales para producirla, durante el ayuno de 24 horas los niveles de síntesis de albúmina disminuyen un 30%.
� Las enfermedades que afectan la presión oncótica también alteran la producción de albúmina. Si la presión oncótica plasmática aumenta por razones distintas al aumento de albúmina, el hígado disminuirá la producción de ésta, resultando una desnutrición proteica.
� El trauma espontáneo o quirúrgico altera la secreción de hormonas glucocorticoideas y por lo tanto la producción de albúmina.
El nitrógeno es el resultado del metabolismo de las proteínas. Éste es tóxico para las
células, por lo que es eliminado a través de dos vías: � Síntesis de glutamina. � Síntesis de urea (elimina cerca del 90% del nitrógeno sobrante), ésta se desarrolla
mayoritariamente en el hígado, por lo que cualquier afección hepática generará el aumento de la urea o de los componentes nitrogenados no metabolizados (ej. amonio).
Vitaminas:
Pueden ser producidas en el hígado o su metabolismo puede ser completado en éste. Las más importantes son:
� Vitamina A: Completa su metabolización en el hígado y se almacena en él. El exceso de vitamina A almacenada provoca daño hepático.

� Vitamina B: También llamado Complejo B. Las que se metabolizan y almacenan en el hígado son: tiamina, riboflavina, piridoxina, ácido fólico y vitamina B12. Éstas participan en múltiples procesos de conducción nerviosa, absorción de hierro, etc. No se conoce toxicidad por su aumento, de hecho, sus dosis deben ser elevadas.
� Vitamina D: Requiere ser activada. Es hidroxilada en el hígado, formando 25-hidroxivitamina D, la cual es transportada al riñón por la albúmina, donde es transformada en calcitriol (metabolismo del calcio).
� Vitamina K: Requiere absorción intestinal y metabolización en el hígado para poder ser usada en la síntesis de factores de coagulación vitamina K dependientes: protrombina, factores VII, IX, X, proteína C y proteína S. La mala metabolización de la vitamina K alterará la cascada de la coagulación.
Metabolismo y condiciones patológicas
La insuficiencia hepática aguda afecta globalmente todas las funciones hepáticas, es decir, sus funciones metabólicas.
El daño hepático crónico es un proceso progresivo, que admite tolerancia, adaptación a los cambios, hasta que se cae en una insuficiencia. Se presentará alteración del metabolismo pero de manera escalonada.
a. Insuficiencia hepática:
Complicaciones de la insuficiencia hepática grave 1. Edema cerebral con o sin hipertensión endrocraneal. El edema se produce por la
falta de albúmina, lo que genera un aumento de la presión hidrostática y un aumento del volumen circulante. También se presenta edema en pulmón, extremidades inferiores, etc.
2. Insuficiencia renal (funcional o necrosis tubular). El cambio de la presión oncótica altera la perfusión y filtración del glomérulo, lo que genera alteraciones tubulares.
3. Infecciones bacterianas (urinarias, bacteriemias, neumonías) y fúngicas. La alteración de la síntesis de proteínas afecta la producción de anticuerpos.
4. Diátesis hemorrágica (hemorragia digestiva e intracraneal). Hay hemorragias por alteración de la cascada de coagulación.
5. Transtornos respiratorios (hiperventilación central, distrés). Son secundarios al edema cerebral o acumulación de agua en el pulmón (distrés).
6. Hipoglicemia. Por mal funcionamiento del hígado, cuya función principal es mantener la glicemia.
7. Hipertensión portal (ascitis y manifestaciones relacionadas). No se captarán los elementos de la sangre portal, por lo que la vena porta se congestionará.
8. Trastornos hemodinámicas (circulación hiperdinámica). Todos estos cambios aumentan el volumen sanguíneo circulante, alterando el funcionamiento del corazón.
9. Trastornos hidroelectrolíticos y del equilibrio ácido-base (hiponatremia, alcalosis metabólica, acidosis láctica, hipofosfatemia). Por menor irrigación de los tejidos.

10. Otros (pancreatitis, anemia aplástica). Cada una de las complicaciones tiene una sintomatología especial. La insuficiencia hepática conlleva al edema cerebral y una encefalopatía hepática, que son alteraciones del SNC derivadas de una falla hepática. Esto ocurre porque el tejido encefálico es el más sensible al aumento del amonio, el que traspasa rápidamente la barrera hematoencefálica. Grado Descripción
0 Detectable sólo mediante test neurológicos. 1 Escasos signos: euforia, ansiedad, problemas de atención en ejercicios de suma o
resta. 2 Letargia y mínima desorientación temporal, cambios en la personalidad y
comportamiento inadecuado. 3 Somnolencia, poca respuesta al estímulo verbal, confusión, desorientación
marcada, comportamiento francamente extraño. 4 Estado de coma.
Existe tratamiento para cada una de las complicaciones de la insuficiencia hepática. En el peor de los casos se realiza un transplante hepático, ya que la insuficiencia hepática severa es incompatible con la vida. Son indicaciones de transplante:
� Encefalopatía hepática III o IV, independiente del curso. � Falta de respuesta al tratamiento conservador (tratamiento farmacológico, dietario y
cambios de hábitos). Contraindicaciones de transplante:
� Edad avanzada (no hay límite preciso, va a depender de la condición general del paciente).
� Infección por VIH. � Enfermedades extrahepáticas graves, concomitantes. � Trombosis portal.
b. Cirrosis hepática:
Es el mayor representante del daño hepático crónico. Hay procesos inflamatorios nodulares en todo el parénquima hepático. El hígado cirrótico se caracteriza por una fibrogénesis, acumulación de tejido conectivo no funcional, la fibrogénesis hepática está asociada a necrosis e inflación. El etanol es uno de los principales compuestos que produce cirrosis, puede inducir la fibrogénesis aún en ausencia de inflamación hepatocelular. Primero se produce la hepatopatía alcohólica. El etanol se metaboliza principalmente en el hígado a través de tres sistemas enzimáticos: catalasa peroxisómica, citocromo P450 y alcohol deshidrogenasa, siendo ésta última la principal. La producción de esta enzima es limitada, por lo que el abuso del alcohol disminuye su síntesis, lo que determina:

� Aumento de acetaldehído. � Inactivación de otras enzimas. � Hiperuricemia. � Acidosis láctica. � Aumento síntesis de TAG. � Hígado graso alcohólico. � Depósito de colágeno (dentro o alrededor del hepatocito) � CIRROSIS.
El tiempo que demore este proceso depende la dosis de etanol, de la carga genética para producir las enzimas metabolizantes, de la masa hepática, etc. El principal aporte sanguíneo del hígado es la vena porta, cualquier alteración de la arquitectura como la que produce la cirrosis, afectará el flujo de la porta, generando hipertensión portal. Esto generará un flujo retrógrado, ya que las venas mesentéricas no poseen válvulas y la dirección del flujo dependerá de los gradientes de presión. Se producirá congestión venosa en el los plexos venosos del territorio esófago gástrico (proveniente de la vena gástrica izquierda), generando várices esofágicos (fenómeno más común de la hipertensión portal). También puede crecer el bazo por congestión de la vena esplénica. Se abren comunicaciones entre la vena esplénica y renal, alterando el flujo renal. Se recanaliza la vena umbilical para drenar sangre hacia el territorio subcutáneo. Y hay congestión de los plexos hemorroidales.

Cuando aumenta la presión hidrostática del capilar, sale agua, lo que genera acumulación de líquido en los tejidos. Se genera edema en el peritoneo. El peritoneo es un órgano que produce y absorbe líquido, al aumentar la presión en sus venas se exudará líquido a la cavidad abdominal, generando su acumulación o ascitis (edema) y crecimiento esplénico. Existen numerosas causas de hipertensión portal (síndrome de hipertensión portal):
� Pre-hepáticas: - Trombosis esplénica; portal. - Cavernomatosis portal.
� Intra-hepáticas: - Cirrosis Hepática. - Hipervitaminosis A. - Intoxicación por metales. - Hepatitis fulminante. - Carcinoma. - Hepatitis crónica viral, activa, etc. - Otras.
� Post-hepáticas: - Malformaciones y trombosis de vena cava inferior. - Valvulopatía Mitral.
� Hiperaflujo: - Fístulas arteriovenosas esplénicas, aorto-mesentéricas, aortoportales, hepato-porta.
La hipertensión portal es la complicación más frecuente de los pacientes cirróticos, sobre el 80% la presente. De los pacientes que logran vivir más de 10 años, 90% de ellos presentan várices esofágicas. El 15% de estos pacientes sangran y más de un tercio de ellos muere por esa hemorragia. La hipertensión portal no solo mata por desnutrición, sino que también por hemorragias digestivas. Si se considera a todos los pacientes cirróticos, un tercio de ellos fallecen por hemorragia secundaria a la hipertensión portal. Sistema de Child-Pugh Es una forma de clasificar la gravedad del paciente cirrótico. Se consideraron los siguientes parámetros para clasificar a un paciente con daño hepático crónico o cirrosis: Parámetros / Puntos 1 2 3 Ascitis No Pequeña, controlada con diuréticos Tensa Encefalopatía No Estados 1-2 Estados 3-4 Albúmina (g/L) >3,5 2,8 - 3,5 <2,8 Bilirrubina (mg/dL) <2 2 – 3 > 3 PT (seg. > normal) < 4 seg. 4 – 6 seg. > 6 seg. INR* <1,7 1,7 – 2,3 >2,3 *INR es una medida derivad del PT. Es reciente. El paciente con menor puntaje tiene 6 puntos y el peor tiene 18 puntos. Obteniéndose 3 posibilidades (sin contarte los puntos del INR):
� Clase A: 5 - 6 puntos.

� Clase B: 7- 9 puntos. � Clase C: 10 - 15 puntos.
Mortalidad asociada
Tipo de Child Cirrosis (a un año) Resecciones hepáticas Cirugía abdominal A 0% 3,7% 10% B 20% 16,7% 30% C 55% 16,7% 82%
Trascrito por:
Loreto Hernández
2009