Expo Fisico Quimica
-
Upload
rachele-piovanelli -
Category
Documents
-
view
224 -
download
0
description
Transcript of Expo Fisico Quimica

LA PRESION DE VAPOR DE LOS LIQUIDOS
Un líquido colocado en una vasija se evaporará
parcialmente para establecer una presión
de vapor, que en el equilibrio es constante a cualquier temperatura.
Esta presión se conoce como presión suturada de vapor. Mientras esta se mantenga estable el
líquido no tendera a evaporarse, pero a una presión menor hay una nueva transformación hacia la fase de gas, y a otra más elevada se
verifica una condensación, hasta restablecer la presión
de equilibrio.
Para un líquido cualquiera la
vaporización va acompañada (le
absorción de calor y la cantidad de calor absorbido a una
temperatura y presión dada : requerida para calentar cierto peso dr
líquido se conoce con el nombre de calor de
vaporización.

El calor de vaporización es la diferencia de entalpia de vapor y liquido
calor de vaporización y entalpias de vapor y de liquidoEn una evaporización es positiva, mientras que en una condensación es negativa y numéricamente igual al calor absorbido en la vaporización. también es la diferencia de energía interna del vapor y del líquido y el trabajo de expansión en el cambio de fase es :
Donde P es la presión de vapor y

Hay varios procedimientos para medir la presión de vapor de un líquido:
Estáticos
Se deja que el líquido establezca su presión de vapor sin que
haya ningún disturbio.
Dinámicos
El líquido hierve o se hace pasar una corriente inerte de gas a
través del mismo.
• La línea de separación entre esos métodos no es muy claro, y un procedimiento particular es una combinación de los dos.
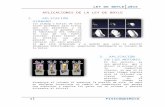
• El método isoteniscópico de Menzies y Smith es preciso, flexible y conveniente para la medición de las presiones de vapor una sustancia en un intervalo amplio de temperaturas.

B se llena aproximadamente en su mitad o tres cuartas partes con el líquido problema
En la porción en forma de U del tubo C, se colocan 2 ó 3 cm de altura
El isoteniscopio se conecta al resto del aparato y se sumerge a baño María A, cuya temperatura se mide con un termómetro D.
El aparato va provisto de un tubo barométrico para medir la presión.
G es un frasco grande que atenúa las fluctuaciones de presión del sistema. (se conecta a una bomba de succión o de aire)
El líquido debe hervir a fin de expulsar todo el aire de BC.
Se ajusta A a la temperatura deseada y se admite aire lentamente al sistema hasta que los niveles de líquido en el tubo C en forma de U son iguales.
• Las presiones en ambos lados del tubo en U deben su iguales.
• La presión de vapor en B es igual al resto del aparato y puede obtenerse de la lectura del barómetro y de la columna de mercurio en E.
• La diferencia entre la presión barométrica y la de E, es la presión de vapor del líquido B a la temperatura de A.

Un método dinámico simple:
El líquido B se hierve después de eliminar el aire que contiene bajo una presión externa medida y se lee la temperatura de condensación del vapor con un termómetro T.
La presión barométrica menos la presión P es aquella en la que el líquido hierve, y es la de vapor del líquido a temperatura T.
Si cambiamos de presión P, el líquido hierve a distintas temperaturas y se obtiene la presión de vapor correspondiente.
La función del matraz C es la de condensar cualquier escape de vapor y evitar la destilación del liquido en el manómetro de mercurio.

Walker propuso un método dinámico más elaborado que consiste en la saturación de algún gas inerte como el nitrógeno con vapor al burbujear una cantidad medida de gas por el liquido a temperatura constante y condensándolo o absorbiéndolo después para pesar de esta manera el vapor del líquido.
Si Pt es la presión en el aparato en condiciones de saturación,los moles de gas que pasan por él, y el número de moles de vapor colectado, entonces la presión parcial del vapor P es igual a la de vapor del líquido en la condición de saturación es:

VARIACIÓN DE LA PRESIÓN DE VAPOR CON LA TEMPERATURA
La presión de vapor de un líquido, es constante a una temperatura dada
AI aumentar la temperatura es mayor la porciónde moléculas que adquieren la energía suficiente para escapar de la fase líquida
Por encima de la temperatura crítica, no existe ya líquido.
Por encima de la temperatura crítica la tendencia de escape de las moléculas es tan elevada que ninguna presión aplicada es suficiente para mantenerlas unidas en el estado líquido, y toda la masa persiste como gas.

Hay un ascenso lento a bajas temperaturas, y luego uno muy rápido como puede observarse por aumento de las pendientes de las curvas.
Esta variación de la presión de vapor con la temperatura se expresa matemáticamente con la ecuación de Clausius-Clapeyron.

Además si suponemos que el vapor se comporta esencialmente como un gas ideal, entonces Vg por mol viene dado por Vg= RT / P
Si de ésta ecuación se integra y que el calor de vaporización molar es constante, entonces:

La comparación de la ecuación con la de unalínea recta, y = mx + b, sugiere que si para un líquido, segrafica contra 1/T, la gráfica debe ser una línea recta con una pendiente m,e (y - intersección b) = C
Si se grafica contra 1/T , de las pendientes de las líneas Se deducen los calores de vaporización de diversos líquidos así:

Por integración de la ecuación anterior, entre los límitesP1 y P2 que corresponden alas temperaturas TI y T2, se tiene:
Esta ecuación permite calcular de los valores de la presión devapor a dos temperaturas, o, cuando se conoce sepuede calcular Pa cierta temperatura deseada a partir de una simple presión de vapor disponiblea cierta temperatura dada.
El calor de vaporización de un líquido, disminuye en generalcon el aumento de temperatura y se hace cero en la temperaturacrítica.

Presión de Sublimación de solidos
Muchos sólidos presentan una presión de vapor discernible y medible. La presión de vapor de equilibrio de un solido (presión de
sublimación), es totalmente análoga a la de vapor saturado de un líquido.
Para cualquier sólido dado la presión de vapor es constante a cierta temperatura establecida, y el proceso va acompañado de una absorción de calor llamada de sublimación , y por un cambio de volumen .
Donde: , es el volumen molar del sólido, que si lo suponemos despreciable en relación con y consideramos que el vapor se comporta como un gas ideal, entonces la variación de la presión de sublimación de un sólido con la temperatura está dada por la ecuación de ClausiusClapeyron.

Ahora T es la temperatura de sublimación y es el cambio térmico. En las sublimaciones se maneja la misma ecuación que en las
vaporizaciones. A una temperatura dada, la sublimación de un sólido es equivalente a
la fusión del sólido y la vaporización del líquido que resulta. Como en un proceso es independiente del camino, encontraremos que
a una temperatura: Cuando cualquiera de estas dos cantidades se Conocen, es posible
calcular la tercera.