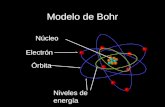
Bohr Sommerfeld..
-
Upload
sergioabelramirezzap -
Category
Documents
-
view
257 -
download
0
description
Transcript of Bohr Sommerfeld..
Modelo atmico de Bohr-Sommerfeld
IES La Magdalena.Avils. Asturias
En 1897 los experimentos realizados sobre la conduccin de laelectricidad por los gases dieron como resultado el descubri-miento de una nueva partcula con carga negativa: el electrn.J.J Thomson propone entonces el primer modelo de tomo:Los electrones (pequeas partculas con carga negativa)se encuentran incrustados en una nube de carga positi-va. La carga positiva de la nube compensa exactamentela negativa de los electrones siendo el tomo elctrica-mente neutro.
J. J. Thomson (1856-1940)
Primer modelo de tomo compuesto (Thomson, 1897)Los electrones, diminutas partculas con carga elctrica negativa,estn incrustadas en una nube de carga positiva de forma similara las pasas en un pastel (modelo de "pastel de pasas")
Modelo de tomo planetario (Rutherford, 1911)E. Rutherford realiza en 1911 un experimento crucial con el que tratabade comprobar la validez del modelo atmico de Thomson.Partculas alfa ( procedentes de un material radiactivo, se aceleran y sehacen incidir sobre una lmina de oro muy delgada, visualizndose la di-reccin en la que emergen tras atravesar los tomos de la lmina.El anlisis de los resultados obtenidos lleva a Rutherford a proponerla existencia de un ncleo (muy pequeo en relacin con el volumentotal del tomo) en el que se concentra la prctica totalidad de la ma-sa del tomo, y cuya carga positiva compensar la negativa de loselectrones corticales que girar alrededor del ncleo de forma anlogaa como los planetas orbitan alrededor del Sol (modelo planetario).
En 1918 el propio Rutherford consider que los ncleos de hidr-geno (que haban sido identificados en reacciones nucleares)deberan de ser una partcula fundamental que se encontraraalojada en los ncleos de los tomos, proponiendo el nombre deprotn para dicha partcula.El neutrn fue propuesto tambin por Rutherford en 1920, sien-do identificado por J. Chadwick en 1932 como producto de lareaccin nuclear producida al bombardear ncleos de berilio conpartculas alfa.
-10
m (0,1 nm),
mientras que el ncleo atmico es 10 000 veces ms pequeo-14-15 -18
E. Rutherford (de frente) y J. Chand-wick (de lado) en el laboratorio.
1
El dimetro de un tomo tpico es del orden de 10(10m). Los protones y neutrones tienen un dimetro del ordende 10m, y el dimetro del electrn es del orden de 10m.
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
La crisis del modelo de Rutherford
J. C. Maxwell, apoyndose en trabajos anteriores de Oersted, Faraday yAmpere, que relacionaban electricidad y magnetismo, dio forma matemti-ca a la teora electromagntica durante la dcada de 1860. Dicha teorapredeca la existencia de ondas electromagnticas.El hecho de que las ondas electromagnticas se propagaran con idnticavelocidad que la luz llev a la consideracin de que la luz misma no esms que una onda electromagntica. La teora de Maxwell unificaba asptica y electromagnetismo.Existen una gran variedad de ondas electromagnticas que van desde losrayos gamma, muy energticos y fuertemente ionizantes (son capaces dearrancar electrones de los tomos produciendo iones), hasta las ondas deradio en el extremo opuesto del espectro.
J.C. Maxwell (1831 -1879)
Hertz confirm en 1888 la prediccin de Maxwell al generar y recibir ondaselectromagnticas en el laboratorio.
El modelo de tomo planetario propuesto por Rutherford mostr pronto algunos inconvenientes tericos que lohacan inviable:
Contradeca la teora electromagntica de Maxwell. Segn esta teora una carga elctrica aceleradadebera de emitir ondas electromagnticas.Un electrn al girar en crculos alrededor del ncleo debera emitir, por tanto, ondas electromagnticas.Dicha emisin provocara una prdida de energa que hara que el electrn describiera rbitas deradio decreciente hasta caer sobre el ncleo. El modelo atmico de Rutherford era, por tanto, inviabledesde el punto de vista de la fsica clsica.
No daba una explicacin satisfactoria a los espectros atmicos. Si encerramos en un tubo hidrgeno ohelio y sometemos el gas a voltajes elevados, el gas emite luz. Si hacemos pasar esa luz a travs de unprisma, los colores que la constituyen se separan dndonos el espectro de la luz analizada.Pronto se concluy que la emisin de luz podra deberse a que los electrones absorban energa de la co-rriente elctrica y saltaban a rbitas superiores para, a continuacin, volver a caer a las rbitas ms prxi-mas al ncleo emitiendo el exceso de energa en forma de energa luminosa.Esta interpretacin conduca, sin embargo, a afirmar que los espectros deberan de ser continuos, ya que alexistir rbitas de cualquier radio (y energa) todos los saltos son posibles. La experiencia, por el contrario,mostraba que los espectros de los tomos son discontinuos. Constan de rayas de diversos colores sobreun fondo negro (ver imagen).
Espectro continuo. Se observan todos los coloresque el ojo puede percibir.
Espectros de emisin de H (arriba) y del He(abajo). No son continuos. Constan de rayas dediversos colores separadas por amplias zonasnegras en las que no se observa luz.
2
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
El inicio de la Fsica Cuntica. Modelo atmico de Bohr(1913)Con el fin de resolver los problemas acumulados sobre el modelo de tomoplanetario, y para explicar el espectro del tomo de hidrgeno, Niels Bohr pro-pone en 1913 un nuevo modelo atmico sustentado en tres postulados:1. Cualquiera que sea la rbita descrita por un electrn, ste no emiteenerga. Las rbitas son consideradas como estados estacionarios deenerga. A cada una de ellas le corresponde una energa, tanto mayor,cuanto ms alejada se encuentre del ncleo.
2.
No todas las rbitas son posibles. nicamente pueden existir aquellasrbitas para las cuales el momento angular del electrn sea un mltiploentero de h / 2 (lase "hache cruzada").
mvr n
h2
NOTAEl momento angular (L) de una partcula incluye lasmagnitudes que caracterizan a una partcula quegira: su masa, su velocidad y la distancia al centro degiro. Para una partcula de masa m que gire con ve-locidad v describiendo una circunferencia de radio r,
Niels Bohr (1885-1962)
el momento angular viene dado por: L = m v r.El nmero, n, que determina las rbitas posibles, se denomina nmero cuntico principal.Las rbitas que se correspondan con valores no enteros del nmero cuntico principal, no existen.3. La energa liberada al caer un electrn desde una rbita superior, de energa E2, a otra inferior, deenerga E1, se emite en forma un cuanto de luz (fotn). La frecuencia ( f ) del cuanto viene dada porla expresin:
E2 E1 h f
h (constante de Planck) = 6,62. 10
34
J.s
Los clculos basados en los postulados de Bohr daban exce-lentes resultados a la hora de interpretar el espectro deltomo de hidrgeno, pero hay que tener en cuenta que con-tradecan algunas de las leyes ms asentadas de la Fsica: El primer postulado iba en contra de la teora elec-tromagntica de Maxwell, ya que segn esta teoracualquier carga elctrica acelerada debera de emitirenerga en forma de radiacin electromagntica. El segundo postulado era an ms sorprendente. Enla fsica clsica era inaceptable suponer que el elec-trn no pudiera orbitar a determinadas distancias delncleo, o que no pudiera tener determinados valoresde energa. La afirmacin era equivalente a suponer queun objeto que describe circunferencias atado a una cuer-da, no puede describir aquellas cuyo radio no sea mltiplode dos (por ejemplo).
Modelo atmico de Bohr(1913)Fuente: Wikimedia Commons
El tercer postulado afirmaba que la luz se emita enforma de pequeos paquetes o cuantos, lo cual a pe-sar de que ya haba sido propuesto por Planck en 1900,no dejaba de sorprender en una poca en la que la idea
de que la luz era una onda estaba firmemente arraigada.
El tomo de Bohr era, simplemente, un sntoma de que la fsica clsica, que tanto xito haba tenido enla explicacin del mundo macroscpico, no serva para describir el mundo de lo muy pequeo, el domi-nio de los tomos.Posteriormente, en la dcada de 1920, una nueva generacin de fsicos (Schrdinger, Heisenberg, Dirac)elaborarn una nueva fsica, la Fsica Cuntica, destinada a la descripcin de los tomos, que supuso una rup-tura con la fsica existente hasta entonces.3
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
Estudiando la distribucin de lneas del espectro visible del hidrgeno Balmer en 1885 haba deducido, de for-ma emprica, que la posicin de las lneas responda a la siguiente frmula matemtica:
151 2 n
La ley de Coulomb nos permite calcular la fuerza con la que un electrn (de carga e) es atrado por el ncleo decarga Ze (el nmero de protones, o cargas positivas del ncleo, viene dado por el nmero atmico, Z):
F k
(Ze) e Ze22
(Z 1 para el tomo de H)
Imponiendo la condicin para que el electrn describa una circunferencia obtenemos:FN m aN
k
2r 2 r
m
k Ze
2 2
Teniendo en cuenta el segundo postulado de Bohr, tenemos:
2 2
h2 2 h22 2
k Z e2 n2
2 2 2
2
; r n ; n 1,2,3...
Esta expresin permite calcular el radio de las rbitas permitidas. Como se puede observar existe una con-dicin de cuantizacin, impuesta por los valores permitidos de n (nmero cuntico). De esta manera son po-sibles las rbitas para las cuales n tenga valores enteros, mientras que no existen aquellas rbitas para lascuales n no sea entero.La frecuencia de las lneas que aparecen en el espectro puede ser calculada ahora si tenemos en cuenta lacuantizacin de las rbitas:La energa de un electrn que orbita alrededor de un ncleo, con carga Ze, viene dada por:
E Ec Ep
1 Z e2k2 r
Introduciendo el valor del radio obtenido para las rbitas posibles obtenemos:
E Ec Ep
2 2 2
2 n
Sustituyendo el valor obtenido para la energa en la expresin que da la frecuencia de la luz emitida
(tercer postulado) tenemos:
2 22
2 2f 3 2 2 h n1 n2
Considerando que n1 = 2 para el espectro visible del tomo de hidrgeno (lo que equivale a decir que laluz visible del espectro del hidrgeno se emite cuando los electrones caen desde rbitas superiores a lasegunda orbita), tenemos que las frecuencias observadas deberan responder a la expresin:La expresin obtenida concuerda con la obtenida experi-
f 2 2
2 2 2 4 h3 2 n
mentalmente por Balmer (ver ms arriba) haciendo:2 2R 3h
4
1 1f R 2 2 ; R 3,29.10 s ; n 3,4... kr r 2Ze v 2 mv rm v r 2 n2; m v r n24 4 m rh h2 24 m r 4 mk Z e1 Z e 1 Z e2 22mk Z e4 1k k 2 2 h22 r 2 nh42mkZe2 22mk Z e4 1 1h f E2 E1 2h n 2 n1 2 22mk Z e4 1 1 2 mk Z e 1 122mk Z e4
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
Extensin de Sommerfeld. rbitas elpticas
Sommerfeld (en 1916) perfeccion el tomo de Bohr considerando que si el electrn est sometido a una fuer-za inversamente proporcional al cuadrado de la distancia (ley de Coulomb), debera de describir una elipse,no una circunferencia.Segn la teora desarrollada por Bohr un electrn no puede poseer valores arbitrarios de energa cuando orbitaalrededor del ncleo, hay valores permitidos y valores prohibidos, ya que existen rbitas permitidas y otras queestn prohibidas.. La energa est "cuantizada".Para fijar una elipse necesitamos determinar fijar dos parmetros: el valor del semieje mayor y el del semiejemenor.
Los parmetros ms importantesde la elipse son:El semieje mayor, a.El semieje menor, b.La distancia focal, c.El eje mayor tendr por tanto unalongitud igual a 2a, el menor a 2by la distancia entre focos serigual a 2c
Por tanto, para determinar las posibles rbitas elpticas necesitamos dos nmeros cunticos:n : Nmero cuntico principal. Cuantiza (fija) el semieje mayor.l : Nmero cuntico secundario. Cuantiza (fija) el semieje menor.
Con el mismo valor del radio (semieje mayor de la elipse), exis-ten muchas elipses que se diferencian en su excentricidad (dis-tinto valor del semieje menor).El nmero cuntico principal, n, fija el valor del semieje mayor.El nmero cuntico secundario, l, fija el valor del semieje menor.
El nmero cuntico secundario solamente puede tomar losvalores enteros comprendidos entre cero y n-1:l = 0, 1, 2, 3 ... (n-1)
Si consideramos un espacio tridimensional,vemos que las elipses (rbitas electrnicas)pueden adquirir diversas orientaciones.Otro nmero cuntico,ml, nmero cunticomagntico, fija (cuantiza) las orientacionespermitidas.
El nmero cuntico magntico adquie-re valores enteros comprendidos entre- l y +l (incluyendo el valor cero).ml = -l ... 0 ... +l
Una misma elipse (rbita) puedetener muchas orientaciones en elespacio.El nmero cuntico magntico fijalas orientaciones permitidas
5
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
Las rbitas posibles, en consecuencia, quedan fijadas por tres nmeros cunticos:n : Nmero cuntico principal. Cuantiza (fija) el semieje mayor de la rbita (elipse). Valores: n =1, 2, 3 ...
l :
ml:
Nmero cuntico secundario. Cuantiza (fija) el radio menor de la rbita (elipse). Valores: l =0, 1, 2, 3 ... (n-1)..Nmero cuntico magntico. Cuantiza (fija) la orientacin de la rbita en el espacio. Valores: ml = - l ... 0 ... +l
A cada rbita, determinada por los tres nmeros cunticos, le corresponde un valor de energa.
Ejemplo 1 (Oviedo. 2010-2011)De los siguientes conjuntos de nmeros cunticos, indique los que son posibles y los que no sonposibles. Justifique la respuesta.a) n = 3; l = 3; ml = 0. b) n = 2; l = 1; ml = 0. c) n = 6; l = 5; ml = -1 d). n = 4; l = 3; ml = -4
Solucin:a) Para n = 3 los valores posibles de l son: 0, 1, 2. En el enunciado aparece el valor l = 3 que no estpermitido. Incorrecto.
b) Valores permitidos para los tres nmeros cunticos
Correcto
c) Para n = 6 ; l = 0, 1, 2, 3, 4, 5. En el enunciado aparece el valor l = 5 que est permitido. Como mladquiere los valores enteros entre -5 y + 5, incluyendo el cero, los valores son correctos.d) Para n = 4; l = 0, 1, 2, 3. En el enunciado aparece el valor l = 3 que est permitido, pero como ml ad-quiere los valores enteros entre -3 y + 3 incluyendo el cero, los valores son incorrectos, ya que ml nopuede valer -4.
Si ahora consideramos al electrn como una partcula situada en determinada rbita, a la energa de la rbitahemos de sumar una energa propia del electrn (podemos imaginar el electrn como una partcula que girasobre su propio eje). Esta energa est tambin cuantizada (es decir, no puede tomar cualquier valor) y es fun-cin de un cuarto nmero cuntico, ms, llamado "nmero cuntico de spin".
En resumen, la energa de un electrn situado en una rbita es funcin de cuatro nmeroscunticos: tres que fijan el valor de la energa de la rbita considerada: n, l y ml , y el nme-ro cuntico de spin, ms, que cuantiza la energa propia del electrn:
E Electrn = f (n, l, ml, ms)
6
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
Una vez que conocemos los distintos niveles de energa en los que pueden situarse los electrones el siguientepaso ser calcular su energa y ordenarlos segn un orden creciente. Cuando se trata de hacer eso se com-prueba que en condiciones normales (ausencia de campos magnticos) los valores de energa depen-den nicamente de los valores de los nmeros cunticos n y l. Es decir, aquellos estados de energaque difieren en el valor de ml tienen la misma energa (se dice que son degenerados).Por razones histricas los niveles con l =0 se nombran como "s"; "p" cuando l=1; "d" si l=2, y "f" para l=3.
Estados degenerados(iguales valores de n y l)
Para recordar el orden de energa (de menor a mayor) se recurre al llamado diagrama de Meller:
1s
2s 2p
Se puede observar que a partir de la tercera capa esta-
3s 3p 3d4s 4p 4d
4f
dos con un valor de n superior (por ejemplo el 4s) pue-den tener menos energa que otros con un valor de ninferior (por ejemplo el 3d).
5s 5p 5d 5f
En general, cuanto mayor es n+l, mayor es la energa.
6s 6p 6d 6f7s 7p
A la hora de ir llenando con electrones los distintos estados de energa disponibles hay que tener en cuenta elllamado Principio de Exclusin de Pauli:
No pueden existir dos electrones con los cuatro nmeros cunticos iguales
Podemos determinar el nmero mximo de electrones que pueden situarse en un nivel energtico dado apli-cando el principio de Exclusin de Pauli:
Para n = 1 (primera rbita), l slo puede tomar un valor: l = 1 - 1 = 0. En consecuencia ml = 0 y s = +1/2y -1/2. Luego para la primera rbita existen dos posibles valores de energa para el electrn:
Para n =2 (segunda rbita), l puede tomar valores desde cero hasta l = 2-1 =1. Por tanto: l =0, 1.
Para l =0, y segn lo visto ms arriba, existen dos posibles valores de energa:
7
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
Para l =1, ml puede tomar tres valores: -1, 0, 1, y teniendo en cuenta los dos valores posibles
para el nmero cuntico de spin, tendremos un total de seis estados de energa distintos:
Para n =3 (tercera rbita), l puede tomar valores desde cero hasta l = 3-1= 2. Por tanto, tres valores: l =0, 1 y 2
Para l =0 y l = 1 ya se ha visto que son posibles dos y seis estados de energa. Para l = 2, m l
puede tomar cinco valores: -2, - 1, 0, +1, +2, y teniendo en cuenta los dos valores posibles parael nmero cuntico de spin, tendremos un total de diez estados de energa distintos.Para n =4 (cuarta rbita), l puede tomar valores desde cero hasta l = 4-1= 3. Cuatro valores: l = 0, 1, 2 y 3
Para l = 3 ml puede tomar siete valores: -3, -2, - 1, 0, +1, +2, +3, y teniendo en cuenta los dos
valores posibles para el nmero cuntico de spin, tendremos un total de catorce estados deenerga distintos.
Se concluye que en un estado s puede haber como mximo dos electrones, seis en unop, diez en un d y catorce en un f
Ejemplo 2 (Oviedo. 2011-2012)Deduzca el nmero mximo de electrones en un tomo que pueden tener los siguientes nmeros cun-ticos: a). n = 2; ml = 0 ; b) l = 2; ms = - 1/2
Solucin:a) Para n = 2 ; l = 0,1, y teniendo en cuenta los valores posibles de ml (0 para l=0 y -1,0,+1 para l=1),existen dos rbitas o niveles de energa con n=2 y ml =0:
(2,0,0) y (2,1,0). Como cada nivel puede ser ocupado por dos electrones con spin contrario tendremosun total de cuatro electrones.
b) Para l = 2 ; n = 3, 4, 5, 6, 7 y ml = -2, -1, 0, +1, +2 que hacen un total de 25 rbitas o niveles energ-ticos. Como est fijado el valor de ms podrn existir 25 electrones
8
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
Configuracin electrnica de los tomos
Con todos estos datos la configuracin electrnica de un tomo (esto es, la distribucin de sus electrones entrelos estados de energa posibles) se obtiene siguiendo las siguientes normas:
Para obtener la configuracin electrnica de un tomo:1. Considerar el nmero de electrones que se deben distribuir. Recordar que el nmero de electro-nes en un tomo neutro viene dado por el nmero atmico Z.2. Los electrones se van distribuyendo entre los estados de energa posibles llenando primero losde menor energa. Cuando un nivel se complete, pasar al siguiente (recordar el principio de exclusiny para establecer el orden de llenado usar el diagrama de Meller).3. La configuracin final debe darse ordenada por capas.
Si queremos afinar un poco ms en la configuracin electrnica deberemos usar el Principio de Mxima Mul-tiplicidad o Regla de Hund que establece que a la hora de ocupar estados de energa degenerados (porejemplo los tres estados"p") los electrones tienden a situarse en ellos con idntico spin.Apliquemos esto para el tomo de nitrgeno (Z=7). Representaremos los estados posibles por cuadrados y elvalor del spn por una flecha que apunta hacia arriba cuando el spin valga +1/2 y hacia abajo cuando valga -1/2
2p
2s
1s
2p
2s
1s
2p
2s
1s
Los dos primeros electrones se sitan en el estado de energams bajo. Como han de respetar el principio de exclusin se co-locan con "espines contrarios".Los valores de los nmeros cunticos sern (n, l, ml, ms):(1, 0, 0,+1/2)(1, 0, 0,-1/2)
Los dos siguientes electrones se sitan en el siguiente estadode energa. Para respetar el Principio de Exclusin se colocancon "espines contrarios".Los valores de los nmeros cunticos sern (n, l, ml, ms):(2, 0, 0,+1/2)(2, 0, 0, -1/2)
El quinto electrn puede situarse en cualquiera de los tres niveles2p, ya que son degenerados. Supongamos que se sita en elprimero (2,1, 0, +1/2). El prximo electrn tiene ahora dos posibi-lidades: situarse en ese mismo estado, para lo cual debera de"invertir" su spin para no tener los cuatro nmeros cunticos igua-les, o situarse en otro nivel 2p con el mismo spin. Esta ltima esla opcin energticamente ms favorable (regla de Hund).Los valores de los nmeros cunticos para los electrones quinto ysexto sern entonces (n, l, ml, ms):(2, 1, -1,+1/2)(2, 1, 0, +1/2)
9
Qumica 2 Bachillerato. IES La Magdalena. Avils. Asturias
Modelo Bohr-Sommerfeld
2p
2s
1s
El sptimo electrn repetir lo dicho para el sexto. Esto es, se colocaen el tercer nivel 2 p (de igual energa) con el mismo spin que losprecedentes.Los valores de los nmeros cunticos para los tres ltimos electronessern entonces (n, l,ml, ms):(2, 1, -1,+1/2)
(2, 1, 0,+1/2)(2, 1, 1,+1/2)
2 6
Aunque la estabilidad es considerablemente menor que la correspondiente a la estructura de gas noble,tambin presentan una estabilidad considerable las estructuras que se corresponden con los niveles po d llenos o semillenos. Para alcanzarlas algunos elementos pueden promocionar electrones desde nivelesde energa inferior a niveles superiores. Este efecto se observa, sobre todo, entre los metales de transi-cin, en los cuales los niveles (n-1) d y ns estn muy prximos energticamente.Ejemplos:
Cr = 1s2 2s2 p6 3s2 p6 d4 4s2Cu = 1s2 2s2 p6 3s2 p6 d9 4s2
1s2 2s2 p6 3s2 p6 d54s11s2 2s2 p6 3s2 p6 d104s1
Este efecto es muy importante en la qumica del carbono el cual, a pesar de tener como estructura te-2 2 2 2 1 3pleada en promocionar un electrn de un nivel 2s al 2p se compensa con creces al formar cuatro enlaces cova-lentes en vez de dos.
Ejemplo 3 (Oviedo. 2011-2012)A continuacin se enumeran cuatro combinaciones de nmeros cunticos escritos siguiendo el orden{n, l, ml, ms}. Indique las combinaciones que estn permitidas y las que no lo estn, justificando su res-puesta: a) {1, 1, 1, 1/2}; b) {2, 1, 0, 1/2}; c) {3, 2, 1, 0}; d) {2, 1, -2, 1/2}
Solucin:a) Para n=1; l =0. Luego esta combinacin no es posible. Incorrecto.b) Para n=2 ; l= 0,1. Los valores de ml (-1, 0, +1) y ms (-1/2, + 1/2) tambin son posibles. Correcto.c) Para n=3 ; l= 0,1, 2. El valores de ml es correcto, pero ms no puede tomar el valor 0.Incorrecto.d) Para n=2 ; l= 0,1. El valores de ml es incorrecto, ya que slo puede tomar los valores -1, 0, +1. Inco-rrecto.
Ejemplo 4 (Oviedo. 2011-2012)Indique un valor aceptable para el nmero cuntico cuyo valor falta en el conjunto: n = 3, l = ?, ml = 2.Justifique la respuesta. A partir de los valores de los nmeros cunticos n y l del conjunto anterior, indi-que el tipo de orbital que representan.
Solucin:Para n = 3 ; l = 0, 1, 2Si ml = 2, l = 2, ya que entonces ml = - 2, -1, 0, +1, +2Luego l = 2
10
Sabemos que la configuracin ns p (configuracin de gas noble) en la ltima capa es especialmente estable.rica 1s 2s p , presenta la configuracin 1s 2s p en la mayora de sus combinaciones. La energa em-