4 Modelo Atomico Bohr
-
Upload
javier-lara-lema -
Category
Documents
-
view
55 -
download
0
description
Transcript of 4 Modelo Atomico Bohr
-
U N A MFacultad de Ingeniera
AVM
MODELO ATMICODE NIELS BOHRMODELO ATMICODE NIELS BOHR
M. C. Q. Alfredo Velsquez Mrquez
-
U N A MFacultad de Ingeniera
AVM
En 1814 el ptico alemn y constructor de instrumentos Joseph von Fraunhofer, uni un telescopio a un prisma y examin los colores espectrales de la luz solar con mayor cuidado que cualquier otro predecesor y observ que la perfecta continuidad cromtica que haba visto Newton, donde un color se fusionaba imperceptiblemente con el otro, estaba en realidad quebrada por lneas oscuras. As como Galileo haba visto manchas oscuras en la brillante superficie del Sol, Fraunhofer descubri manchas oscuras en el glorioso fenmeno del espectro.
FRAUNHOFER
-
U N A MFacultad de Ingeniera
AVM
En 1859, dos profesores alemanes, Gustav Robert Kirchhoff y Robert Wilhelm Bunsen, sumando los logros alcanzados por Fraunhofer, desarrollaron el espectroscopio, un aparato que permite observar los espectros de absorcin y de emisin de los diversos elementos, y sentaron las bases de la espectroscopia moderna, determinaron que cada elemento tiene un espectro de absorcin nico, en el cual se observan franjas oscuras en idntica posicin que las observadas en su respectivo espectro de emisin.
KIRCHHOFF / BUNSEN
-
U N A MFacultad de Ingeniera
AVM
La pregunta que quedaba por responder era:POR QU LOS TOMOS DE LOS DIFERENTES ELEMENTOS SOLO ABSORBEN O EMITEN ONDAS ELECTROMAGNTICAS DE DETERMINADAS LONGITUDES DE ONDA?
-
U N A MFacultad de Ingeniera
AVM
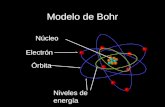
En 1913, el fsico dans Niels Bohr, propuso una nueva teora atmica basada en la teora cuntica de Planck, el efecto fotoelctrico, los espectros electromagnticos y sus propios resultados experimentales. Dicha teora fue enunciada en forma de postulados que permiten visualizar al tomo como un sistema planetario en el cual los electrones giran alrededor del ncleo atmico en rbitas o estados estacionarios, tal como los planetas lo hacen alrededor del sol.
Niels Henrik David Bohr
-
U N A MFacultad de Ingeniera
AVM
1.- Los electrones se mueven alrededor del ncleo en rbitas circulares estables.
Postulados del Modelo de Bohr
De acuerdo a la fsica clsica, si los electrones se movieran en rbitas circulares, se aceleraran irradiando constantemente energa (perderan energa), describiendo una espiral hasta colapsar finalmente con el ncleo.
-
U N A MFacultad de Ingeniera
AVM
2.- Slo son permitidas aquellas rbitas en las cuales el momento angular del electrn est cuantizado, siendo un mltiplo entero de
Postulados del Modelo de Bohr
Momentoangular
E1
Esto implica que un electrn en una rbita o estado estacionario n, posee un momento angular constante; y por lo tanto, su energa en dicha rbita se mantiene constante.
E2E1 < E2
h2
h2mvr = n
-
U N A MFacultad de Ingeniera
AVM
3.- Cuando un electrn pasa de una rbita a otra, dicha transicin va acompaada de la absorcin o emisin de una cantidad definida de energa.
Postulados del Modelo de Bohr
E1
E2
-
U N A MFacultad de Ingeniera
AVM
3.- Cuando un electrn pasa de una rbita a otra, dicha transicin va acompaada de la absorcin o emisin de una cantidad definida de energa.
Postulados del Modelo de Bohr
E1
E2
-
U N A MFacultad de Ingeniera
AVM
3.- Cuando un electrn pasa de una rbita a otra, dicha transicin va acompaada de la absorcin o emisin de una cantidad definida de energa.
Postulados del Modelo de Bohr
E1
E2
El fotn absorbido y el fotn emitido tienen la misma longitud de onda y por lo tanto la misma energa.
Ef = hc
-
U N A MFacultad de Ingeniera
AVM
3.- Cuando un electrn pasa de una rbita a otra, dicha transicin va acompaada de la absorcin o emisin de una cantidad definida de energa.
Postulados del Modelo de Bohr
E1
E2
La energa del fotn emitido o absorbido es igual a la diferencia de energa entre las dos rbitas.
Ef = hc
Ef = E1,2
Ef = hc
-
U N A MFacultad de Ingeniera
AVM
Desarrollo Matemtico de Bohr
Cuando un electrn gira alrededor del ncleo describiendo una rbita, se ejerce sobre l una fuerza elctrica (Fe), que por convencin se considera negativa y que de acuerdo a la ley de Coulomb se obtendra con la expresin siguiente:
Fe = Q1Q2k
d2
Si se consideran negativas las fuerzas que jalan al electrn haca el ncleo, Q1 sera la carga del electrn (e), Q2 la carga del ncleo (Ze), k la constante de Coulomb y d la distancia entre las cargas (r); por lo tanto, se obtendra la ecuacin 1 siguiente:
Fe = Ze2k
r2_1
Dado que el electrn describe un movimiento circular, se ejerce sobre l una fuerza centrpeta, la cual sera negativa y cuya ecuacin 2 sera la siguiente:Fc =
mv2r
_2
En este caso, como las fuerzas elctrica y centrpeta tratan de jalar al electrn hacia el ncleo, se puede decir que se trata de la misma fuerza; por lo tanto, las expresiones 1 y 2 se pueden igualar para obtener la ecuacin 3:
Ze2kr
= mv23
Por otro lado, la energa total (ET) que posee un electrn en una rbita, es la suma de las energas potencial (EP) y cintica (EC), como se muestra en la ecuacin 4 siguiente:
4 ET = EP + EC
En este caso, la energa potencial (EP), corresponde al trabajo necesario para llevar al electrn desde la rbita hasta el ncleo.EP = W = FdEl trabajo se define como el producto de la fuerza por la distancia, pero en este caso la fuerza es la fuerza elctrica (Fe) y la distancia es el radio de la rbita (r); de tal forma que, se obtendra la ecuacin 5 siguiente:
EP = Ze2k
r5
Por otro lado, la energa cintica ( EC) que posee el electrn, se obtendra con la ecuacin 6 siguiente:EC = 6
Ze2k2r
Si se sustituyen las expresiones de la energa potencial (5) y de la energa cintica (6) en la expresin de la energa total (4), se obtiene la expresin (7) siguiente:
ET = Ze2k
2r7
De acuerdo al segundo postulado, el momento angular del electrn esta cuantizado como se muestra en la expresin (8) siguiente:
8nh2
mvr =
De la expresin anterior se puede despejar la velocidad (v) y sustituir en la expresin (3). Posteriormente se simplifica y se despeja el radio (r) para obtener la expresin (9) siguiente:
9n2h2
r = 42mZe2k
En la expresin anterior se tienen muchas constantes las cuales se pueden agrupar en un solo termino, obtenindose la expresin (10) siguiente:
10 r = RBn2Z-1
Donde RB es una constante llamada radio de Bohr cuyo valor es 5.2917x10-11 [m] y equivale a:
h2RB = 42me2k
Si se sustituye la ecuacin (9) en la ecuacin (7), se obtendra la expresin (11) siguiente:ET =
22mZ2e4k2
n2h211
En un salto cuntico estn involucradas dos rbitas, una de alta energa y una de baja energa; de tal forma que, las expresiones para determinar dichas energas son las siguientes:
EA =22mZ2e4k2
n h22A
EB =22mZ2e4k2
n h22B
De acuerdo al tercer postulado, la energa del fotn absorbido o emitido es igual a la diferencia de energa entre las dos rbitas.EF = EA,B = EA EB
Sustituyendo las expresiones de EH y EL en sta ultima expresin se obtendra:
22mZ2e4k2
h2 n2B n2A
1 1EF =
De acuerdo a Planck, la energa de un fotn se puede calcular conociendo la longitud de la onda electromagntica.
hc
EF =
Sustituyendo esta ltima expresin en la anterior, se tendra:22mZ2e4k2
h2 n2B n2A
1 1hc =
22mZ2e4k2
h3c n2B n2A
1 11 =
22me4k2
h3cRH=
RHZ2 n2B n2A
1 11 =
12
-
U N A MFacultad de Ingeniera
AVM
Formulario de Bohr
Fe = Q1Q2k
d2
Fe = Ze2k
r2_1
Fc = mv2
r_2
Ze2kr
= mv23
4 ET = EP + EC
EP = W
EP = Ze2k
r5
ET = Ze2k
2r7
8nh2
mvr =
9n2h2
r = 42mZe2k
10 r = RBn2Z-1
h2RB = 42me2k
ET =22mZ2e4k2
n2h211
EA =22mZ2e4k2
n h22A
EB =22mZ2e4k2
n h22B
EF = EA,B = EA EB
22mZ2e4k2
h2 n2B n2A
1 1EF =
hc
EF =
22mZ2e4k2
h2 n2B n2A
1 1hc =
22mZ2e4k2
h3c n2B n2A
1 11 =
22me4k2
h3cRH=
RHZ2 n2B n2A
1 11 =
12
EC = 6Ze2k2r
Slide 1Slide 2Slide 3Slide 4Slide 5Slide 6Slide 7Slide 8Slide 9Slide 10Slide 11Slide 12Slide 13