10. coloides y suspensiones 2013
Transcript of 10. coloides y suspensiones 2013

COLOIDES Y COLOIDES Y SUSPENSIONESSUSPENSIONES
SEMANA 10Licda. Lilian Judith Guzmán Melgar
1

SUSPENSIONES
Las suspensiones son mezclas heterogéneas formadas por un sólido en polvo o pequeñas partículas no solubles.
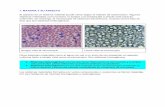
Solución de NaCl Suspensión de Solución de NaCl Suspensión de almidón en aguaalmidón en agua
2

Las suspensiones presentan las siguientes características:
• Sus partículas son mayores que las soluciones y los coloides, lo que permite observarlas a simple vista
• Sus partículas se sedimentan si la suspensión se deja en reposo.
• Los componentes de la suspensión pueden separarse por medio de centrifugación, decantación, filtración y evaporación.
3

Ejemplos de suspensiones
4

COLOIDESCOLOIDES
Sistemas heterogéneos formados Sistemas heterogéneos formados por una por una fase fase dispersantedispersante y una o más y una o más fases dispersas, fases dispersas, también llamada: también llamada: Dispersión Coloidal.Dispersión Coloidal.
Las dispersiones coloidales no se Las dispersiones coloidales no se definen en función de materia que definen en función de materia que contienen, sino del tamaño de las contienen, sino del tamaño de las partículas que la forman.partículas que la forman.
5

Partes de una Dispersión Partes de una Dispersión ColoidalColoidal
Son las partículas dispersas comparables
con el soluto en la solución
Es la sustancia en la cual las partículas dispersas están
distribuidas (medio). Comparable con el
solvente de la solución.
FASE FASE DISPERSADISPERSA
FASE FASE DISPERSANTEDISPERSANTE
6

Las dispersiones Las dispersiones coloidales tiene una coloidales tiene una apariencia lechosa o apariencia lechosa o turbia, incluso las que turbia, incluso las que parecen transparente parecen transparente muestran la trayectoria de muestran la trayectoria de una haz de luz que una haz de luz que atraviesa la dispersión atraviesa la dispersión ((Efecto de TyndallEfecto de Tyndall).).Las partículas dispersas Las partículas dispersas presentan un movimiento presentan un movimiento errático en zigzag, este errático en zigzag, este efecto es denominado efecto es denominado Movimiento BrownianoMovimiento Browniano
7

Tipos de Dispersiones ColoidalesTipos de Dispersiones Coloidales
TIPOSFASE DE LA PARTICULA
FASE DEL MEDIO
EJEMPLO
Espuma Gaseosa Líquida Crema Batida
Espuma Sólida Gaseosa Sólida Piedra pómez, malvaviscos
Aerosol Líquida GaseosaNiebla, nubes, fijadores para el cabello
Emulsión Líquida Líquida Líquida Leche, mayonesa, crema
Emulsión Sólida Líquida Sólida Mantequilla, queso
Humo Sólida GaseosaPolvo fino en smog, hollín en el aire
Sol* Sólida LíquidaSoluciones de almidón y jaleas.
Sol sólido Sólida Sólida Vidrio, rubí, opalo, perlas
8

EmulsionesEmulsiones
Una emulsión es una mezcla de dos líquidos inmiscibles, uno de ellos (fase dispersa) es dispersado en otro (fase dispersarte).
Las emulsiones pueden ser aceite/agua ó agua /aceite.
9

Agentes EmulsificantesAgentes Emulsificantes
Los agentes Los agentes emulsificantesemulsificantes mantienen mantienen dispersas las partículas, estabilizan las dispersas las partículas, estabilizan las emulsiones. emulsiones.
Ejemplo:Ejemplo:
caseína en la leche, las sales biliares.caseína en la leche, las sales biliares.
10

ComparaciónComparación
PROPIEDADES DE LAS SOLUCIONES, COLOIDES Y SUSPENSIONES
Propiedades Solución Coloide Suspensión
Tamaño de la Partícula 0.1 – 1 nm 1 – 1000 nm > 1000 nm
Mezcla Homogénea SI NO NO
Estabilidad a la gravedad Muy establesMenos
establesinestables
Separación por filtración NO NO SI
Presentan efecto de Tyndall
NO SINO
(ESTAS NO SON TRANSPATENTES
)
Presentan movimiento Browniano
NO SI NO
11

PROPIEDADES DE LOS DISTINTOS TIPOS DE PROPIEDADES DE LOS DISTINTOS TIPOS DE MEZCLASMEZCLAS
Las suspensiones se sedimentan Las suspensiones se separan mediante papel
filtro Las partículas de una solución atraviesan las
membranas semipermeables, pero los coloides y las suspensiones no.
12

DifusiónDifusión
Es el proceso espontáneo mediante el cual una sustancia se desplaza desde una región de concentración elevada a una región de menor concentración, y elimina la diferencia de concentración entre las dos regiones.
13

TIPOS DE MEMBRANASTIPOS DE MEMBRANAS
• IMPERMEABLES: No son atravesadas ni por solutos ni por el disolvente
• SEMIPERMEABLESSEMIPERMEABLES: Permiten el paso de iones y moléculas pequeñas, pero NO el paso de moléculas grandes y coloides.
• PERMEABLESPERMEABLES: Permiten el paso del disolvente y de moléculas grandes y coloides.
14

Tipos de Membrana
IMPERMEABLEIMPERMEABLE SEMIPERMEABLESEMIPERMEABLE PERMEABLEPERMEABLE
15

OsmosisOsmosis
Es el paso de disolvente a través de una membrana semipermeable .El movimiento de solvente desde la solución menos concentrada hacia la mas concentrada.
Diminutas moléculas de agua agua pasan a través de la membrana
16

OsmosisOsmosis
17

DiálisisDiálisis
Es el paso de selectivo de iones y iones y moléculas pequeñasmoléculas pequeñas, no moléculas grandes ni las partículas coloidales, junto con el disolvente a través de una membrana semipermeable.
18

Diálisis Peritoneal y HemodiálisisDiálisis Peritoneal y Hemodiálisis
19

PROPIEDADES COLIGATIVASPROPIEDADES COLIGATIVAS
Las propiedades coligativas están relacionadas con la concentración de las concentración de las partículaspartículas de soluto disueltas, sin que importe su identidad, algunas propiedades coligativas son:
• Disminución en la temperatura de congelación, • Aumento en la temperatura de ebullición.
Para los sistemas vivos la propiedad coligativa más importante es la presión osmótica.presión osmótica.
20

Presión Osmótica (Presión Osmótica ())
Es una medida de concentración y es la presión contraria que se necesita para evitar la osmosis.
Esta presión detiene el flujo entre una solución diluida hacia una mas concentrada separadas por una membrana semipermeable.
21

La concentración osmótica de una solución, o el número de partículas de soluto (iones, moléculas o macromoléculas) disueltas en el solvente, se denomina, osmolaridad.osmolaridad.
22

OsmolaridadOsmolaridad
La intensidad de la presión La intensidad de la presión producida por un soluto es proporcional a producida por un soluto es proporcional a su concentración en número de iones o su concentración en número de iones o moléculas.moléculas.
Osmolaridad = ( M ) ( # de partículas por mol de soluto)
23

Partículas por mol de solutoPartículas por mol de solutoNaCl:
NaCl → Na+ + Cl-
1 + 1 = 2 partículas
Na2SO4
Na2SO4 → 2 Na+ + SO4-2
2 + 1 = 3 partículas
Al(OH)3
Al(OH)3 → Al+3 + 3 OH-
1 + 3 = 4 partículas
24

Para partículas de soluto que no se disocian
(compuestos covalentes):
Urea, glucosa, sacarosa, dextrosa
# partículas = 1 25

TonicidadTonicidadSolución IsotónicaSolución Isotónica:: ( 0.28 – 0.32 osmolar)
Es aquella que presenta la misma presión osmótica que el líquido del interior de una célula viva.
Solución HipotónicaSolución Hipotónica : ( < 0.28 osmolar)
Es aquella solución que presenta una concentración menor que la del líquido del interior de la célula. Causa al eritrocito HHemólisisemólisis
Solución HipertónicaSolución Hipertónica : ( > 0.32 osmolar)
Solución que tiene una concentración mayor que la del líquido del interior de la célula. Causa al eritrocito CrenaciónCrenación
26

TonicidadTonicidad
ISOTONICAISOTONICA(0.28 - 0.32)
HIPOTONICAHIPOTONICA(menor de 0.28)
HIPERTONICAHIPERTONICA(mayor de 0.32)
HEMOLISISHEMOLISIS CRENACIÓNCRENACIÓN27

Soluciones Isotonicas mas utilizadas en los hospitales
- NaCl 0.9% p/v- Glucosa 5% p/v
28

EJERCICIOSEJERCICIOS
1) ¿Cuál es la osmolaridad de una solución de ZnCl2 0.1M?
¿Qué efecto causa al eritrocito?
2) ¿Cuál es la osmolaridad de una solución de AgNO3 al 1% P/V que se aplicara en los ojos de un recién nacido? ¿Qué efecto causa al eritrocito? Pm AgNO3 = 169.88 g
29

3) ¿Cuál es la osmolaridad de un colirio que contiene 2.5mg/ml de ZnSO4?
¿Qué efecto causa en el eritrocito? (Pm ZnSO4 =161.43 g)
4) ¿Cuál es la osmolaridad de un suero dextrosado (C6H12O6) al 5% p/v?
¿Qué efecto causa al eritrocito?
(Pm C6H12O6= 180 g)
30

5) ¿Cuál es la osmolaridad de una solución de MgSO4 al 5% P/P cuya densidad es 2.66 g/ml? ¿Qué efecto causa en el eritrocito
(Pm MgSO4= 120g)
6) Calcule la concentración en p/v de una solución de NaCl 0.3 osmolar.
(pm NaCl = 58.44g)
31

Fin32