validación del método analítico para la cuantificación de bacitracina ...
Transcript of validación del método analítico para la cuantificación de bacitracina ...

i
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DE
BACITRACINA EN EL LABORATORIO DE CONTROL DE CALIDAD DE UNA
INDUSTRIA FARMACÉUTICA VETERINARIA
JOHANNA CAROLINA VELANDIA CASTELLANOS
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS BASICAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL
BOGOTÁ D.C. COLOMBIA
2008

ii
Articulo 23 de la R resolución No 13 de Julio de 1946
¨ La universidad no se hace responsable por los conceptos emitidos por sus alumnos
en sus trabajos de tesis. Solo vela por que no se publique nada contrario al dogma y a la
moral católica y por que las tesis no contengan ataques contra persona alguna, antes
bien se vea en ellas el anhelo de buscar la verdad y la justicia ¨.

iii
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DE
BACITRACINA EN EL LABORATORIO DE CONTROL DE CALIDAD DE UNA
INDUSTRIA FARMACÉUTICA VETERINARIA
JOHANNA CAROLINA VELANDIA CASTELLANOS
TRABAJO DE GRADO
Presentado como requisito parcial
Para adoptar al titulo de
Microbióloga Industrial
DIRECTORA
VIVIANA PEÑA PÁEZ
Microbióloga Industrial
CO-DIRECTORA
JANETH ARIAS PALACIOS
Bacterióloga M.Sc- M.Ed
PONTIFICIA UNIVERSIDAD JAVERIANA
FACULTAD DE CIENCIAS BASICAS
CARRERA DE MICROBIOLOGÍA INDUSTRIAL
BOGOTÁ D.C. COLOMBIA
2008

iv
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DE
BACITRACINA EN EL LABORATORIO DE CONTROL DE CALIDAD DE UNA
INDUSTRIA FARMACÉUTICA VETERINARIA
AUTOR
JOHANNA CAROLINA VELANDIA CASTELLANOS
APROBADO
Viviana Peña Páez
Microbióloga Industrial DIRECTORA
Cindy Fernández López Microbióloga Industrial
JURADO
Janeth Arias Palácios Bacterióloga M.Sc- M.Ed
CO-DIRECTORA
Jazmín Andréa Castellanos
Química JURADO

v
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA CUANTIFICACIÓN DE
BACITRACINA EN EL LABORATORIO DE CONTROL DE CALIDAD DE UNA
INDUSTRIA FARMACÉUTICA VETERINARIA
AUTOR
JOHANNA CAROLINA VELANDIA CASTELLANOS
APROBADO
Ingrid Schuler Ph.D
Bióloga Decana Académica
Janeth Arias Palacios
Bacterióloga M.Sc - M.Ed Directora de Carrera

vi
AGRADECIMIENTOS
A mis padres y hermana, gracias por su constante, incondicional e invaluable apoyo
emocional, intelectual y económico, que me permitió llevar a cabo este proyecto.
Buscando en todos y cada uno de los segundos de mi vida nunca defraudar su
confianza. Gracias por que me han dado todo, desde la vida, educación, formación
intelectual, personalidad creativa y competente.
A la Microbiologa Industrial Viviana Peña Páez, por ser una gran directora de tesis.
No me habría sido posible llevar a cabo esta investigación sin su ayuda, sus
conocimientos, su orientación, guía, perspicacia, su apoyo, dedicación y por su gran
amistad.
A la Doctora Janeth Arias Palacios, por sus conocimientos, orientación, apoyo y
respaldo durante el tiempo de realización de este trabajo y por creer en este proyecto.
A los Doctores Sergio Enrique Castro Ureña y Sergio Castro Brandon, de la
empresa VICAR FARMACEUTICA S.A., por su incondicional respaldo, apoyo
económico, por permitirme hacer uso del laboratorio y los implementos en el,
hospitalidad y amabilidad.
A la Química Farmacéutica Johanna Garcia, por su oportuna e invaluable
colaboración en textos guía y sus conocimientos, por ser ficha clave y esencial en la
realización y conclusión de esta investigación y por su gran amistad.
A la Química Sofía Mariana Riaño Torres, por su incondicional apoyo, orientación y
ayuda. Por su oportuna e invaluable colaboración, sus conocimientos, siendo ficha clave
y esencial en la realización de esta investigación y por su gran amistad.

vii
TABLA DE CONTENIDO
Pagina
1. RESUMEN 1
ABSTRACT 2
2. INTRODUCCIÓN 3
3. REVISIÓN DE LITERATURA 6
3.1 ANTIBIÓTICOS 6
3.1.1 Definición 6
3.1.2 Clasificación de los antibióticos 7
3.1.2.1 Espectro de acción 7
3.1.2.2 Mecanismo de acción 7
3.1.2.2.1 Antibióticos que interfieren con la biosíntesis de la pared celular 7
3.1.2.2.2 Antibióticos que actúan sobre la membrana celular 8
3.1.2.2.3 Antibióticos que inhiben la síntesis de proteínas 9
3.1.2.2.4 Antibióticos que actúan sobre la síntesis de ácidos nucleicos. 9
3.1.2.3 Estructura química 10
3.1.2.3.1 Aminoglucosidos 10
3.1.2.3.2 Anfenicoles 10
3.1.2.3.3 Antimicobacterianos 10
3.1.2.3.4 Cefalosporinas y otros B-lactamicos 11
3.1.2.3.5 Glucopeptidos 11
3.1.2.3.6 Lincosaminas 11
3.1.2.3.7 Macrólidos 11
3.1.2.3.8 Penicilinas 11
3.1.2.3.9 Quinolonas 12
3.1.2.3.10 Sulfamidas y diaminopirimidinas 12
3.1.2.3.11 Tetraciclinas 12

viii
3.1.2.3.12 Polipeptidicos 13
3.2 BACITRACINA 13
3.2.1 Descubrimiento 13
3.2.2 Sinónimos 13
3.2.3 Formula empírica 14
3.2.4 Formula estructural 14
3.2.5 Peso molecular 14
3.2.6 Descripción, Solubilidad, Conservación, Estabilidad 14
3.2.7 Espectro antimicrobiano de acción 15
3.2.8 Tipo y mecanismo de acción 16
3.2.9 Farmacocinética 16
3.2.10 Indicaciones y administración 17
3.2.11 Interacciones 17
3.2.12 Efectos adversos 17
3.3 BACITRACINA ZINC 18
3.3.1 Descripción, solubilidad, conservación 18
3.3.2 Estabilidad 18
3.3.3 Incompatibilidades 18
3.3.4 Acción farmacológica 18
3.3.5 Indicaciones de uso, dosis recomendadas, vías de aplicación 19
3.3.6 Condiciones de almacenamiento 19
3.4 BACITRACINA METILEN DISALICILATO 19
3.4.1 Descripción, solubilidad, conservación 19
3.4.2 Indicaciones de uso 19
3.5 Micrococcus luteus 20
3.5.1. Clasificación científica 20
3.5.2 Características 20

ix
3.5.3 Bioquímica 21
3.5.4 Patogénesis 21
3.5.5 Usos industriales 21
3.6 VALIDACION DE METODOS ANALITICOS 22
3.6.1 Definición 22
3.6.1.1 Definición General 22
3.6.1.2 Definición Analítica 22
3.6.2 Métodos Susceptibles a ser Validados 22
3.6.3 Entorno Legal 23
.6.3.1 Norma de Correcta Fabricación de Medicamentos 23
3.6.3.2 Farmacopeas 23
3.6.4 Fases en el desarrollo de un método analítico y criterios de validación 23
3.6.4.1 Definición de las características de practicabilidad 23
3.6.4.2 Estudios de estabilidad de la muestra preparada para análisis 24
3.6.4.3 Puesta a punto. Características de idoneidad 24
3.6.4.4 Características de fiabilidad 25
3.7 CARACTERÍSTICAS DEL DESEMPEÑO ANALÍTICO 26
3.7.1 SELECTIVIDAD 27
3.7.1.1 Definición 27
3.7.1.2 Ámbito de aplicación 28
3.7.1.2.1 Según el objetivo de ensayo 28
3.7.1.2.2 Según la técnica analítica aplicada 28
3.7.2 LINEALIDAD 29
3.7.2.1 Definición 29
3.7.2.2 Ámbito de aplicación 30
3.7.3 PRECISION 30
3.7.3.1 Definiciones 30

x
3.7.3.2 Diferentes tipos de estudio en la precisión 31
3.7.3.2.1 Repètibilidad 31
3.7.3.2.1.1 Repetibilidad del sistema instrumental 32
3.7.3.2.1.2 Repetibilidad del método 32
3.7.3.2.2 Precisión inmediata 32
3.7.3.2.3 Reproducibilidad 32
3.7.3.3 Ámbito de aplicación 32
3.7.4 EXACTIDUD 33
3.7.4.1 Definición 33
3.7.4.2 Ámbito de aplicación 33
3.7.4.3 Procedimiento de determinación de la exactitud 33
3.7.4.4 Determinación 34
3.7.5 LIMITE DE DETECCION Y LÍMITE DE CUANTIFICACION 35
3.7.5.1 Definición 35
3.7.5.2 Ámbito de aplicación 36
3.7.5.3 Procedimientos de determinación del LD y LQ 36
3.7.6 ROBUSTEZ 36
3.7.6.1 Definición 36
3.7.6.2 Ámbito de aplicación 37
3.7.7 ESPECIFICIDAD 38
3.7.7.1 Definición 38
3.7.7.2 Determinación 38
3.8 VALORACION MICROBIOLOGICA DE ANTIBIOTICOS 39
3.8.1 Generalidades 39
3.8.2 Definiciones 39
3.8.2.1 Valoración de antibióticos 39
3.8.2.2 Potencia real 40
3.8.2.3 Potencia asignada 40

xi
3.8.2.4 Potencia estimada 40
3.8.2.5 Limites de confianza (Intervalo de confianza) 40
3.8.3 METODO 40
3.8.4 Validación 41
3.8.4.1 Linealidad 41
3.8.4.2 Repetibilidad (Precisión) 41
3.8.4.3 Exactitud 42
3.8.4.4 Selectividad 42
4. FORMULACIÓN DEL PROBLEMA 43
5. JUSTIFICACION 45
6. OBJETIVOS 47
7. MATERIALES Y METODOS 48
7.1 Estándar de Referencia 48
7.2 Muestras de estudio 48
7.3 Preparación y estandarización de la suspensión del microorganismo de ensayo 49
7.3.1 Cultivo bacteriano 49
7.3.2 Preparación del inoculo 49
7.3.3 Determinación de la cantidad de suspensión madre para inoculo 49
7.4 Preparación del estándar (Método de la curva patrón) 50
7.4.1 Diluciones del patrón 50
7.4.2 Diluciones finales del patrón 50
7.5 Preparación de la muestra 51
7.5.1 Dilución de la muestra 51
7.5.2 Dilución de prueba de la muestra 51
7.6 Obtención del placebo 51
7.7 Preparación de placas de valoración 52
7.8 Validación del método de cuantificación del principio activo (USP, 30) 52
7.8.1 Especificidad 52

xii
7.8.2 Selectividad 53
7.8.3 Linealidad del sistema 54
7.8.4 Linealidad del método 54
7.8.5 Precisión del método 55
7.8.6 Exactitud 55
7.8.7 Limite de detección 55
7.8.8 Limite de cuantificación 56
8. RESULTADOS Y DISCUCION 57
8.1 Especificidad del método 57
8.2 Selectividad del método 57
8.3 Linealidad del sistema 59
8.4 Linealidad del método Bacitracina Zinc 59
8.5 Linealidad del método Bacitracina Metilen Disalicilato 60
8.6 Precisión del método 61
8.7 Exactitud del método 64
8.8 Limite de detección 65
8.9 Limite de cuantificación 65
9. CONCLUIONES 67
10. RECOMENDACIONES 69
11. REFERENCIAS 70
12. ANEXOS 74

xiii
LISTA DE FIGURAS Pagina
Figura 1. Bacitracina (Según Maier y Groger, 1972) 14
Figura 2. Diferentes tipos de estudio en la precisión 30

xiv
LISTA DE TABLAS Pagina
Tabla 1. Espectro de acción de la Bacitracina (Según Wege, 1969) 16
Tabla 2. Datos Requeridos para la Validación de Métodos Analíticos (USP 30) 26
Tabla 3. Variación de factores en el estudio de la precisión 31
Tabla 4. Diluciones de la curva patrón (intervalo de concentraciones 0.1 a 0.25 UI/ml) 50
Tabla 5. Diluciones de la curva patrón (intervalo de concentraciones 0.5 a 2.5 UI/ml) 51
Tabla.6 Diluciones del las muestras para la evaluar la Exactitud 55
Tabla. 7 Diluciones del las muestras para determinar el limite de detección 56

xv
LISTA DE ANEXOS Pagina
ANEXO 1. CALDOS, MEDIOS DE CULTIVO Y BUFFERS 74
ANEXO 2. LINEALIDAD DEL SISTEMA 75
ANEXO 3, LINEALIDAD DEL MÉTODO BACITRACINA ZINC 80
ANEXO 4. LINEALIDAD DEL MÉTODO BACITRACINA METILEN DISALICILATO 85
ANEXO 5. ESPECIFICIDAD BACITRACINA ZINC 90
ANEXO 6. ESPECIFICIDAD BACITRACINA METILEN DISALICILATO 91
ANEXO 7. SELECTIVIDAD BACITRACINA ZINC 92
ANEXO 8. SELECTIVIDAD BACITRACINA METILEN DISALICILATO 96
ANEXO 9. PRECISIÓN DEL METODO BACITRACINA ZINC 100
ANEXO 10. PRECISIÓN DE METODO BACITRACINA METILEN DISALICILATO 110
ANEXO11. PRECISION DEL SISTEMA 120
ANEXO 12. EXACTITUD METODO BACITRACINA ZINC 121
ANEXO 13. EXACTITUD DEL METODO BACITRACINA METILEN DISALICILATO 127
ANEXO 14. LIMITE DE CUANTIFICACION 133
ANEXO 15. LIMITE DE DETECCIÓN 136

1
1. RESUMEN
Se realizo la validación del método analítico para la cuantificación de Bacitracina, para ser
utilizado en el control de calidad de materias primas y en los productos farmacéuticos con
este principio activo. En el presente trabajo se describió y desarrollo el proceso de
validación de la valoración microbiológica de antibióticos en cilindro-placa (difusión en
agar), para la determinación cuantitativa de Bacitracina Zinc al 15% y Bacitracina Metilen
Disalicilato al 11%, que incluye los requisitos exigidos en la determinación de parámetros
analíticos de linealidad del sistema, linealidad del método, especificidad, exactitud,
selectividad, limite de detección, limite de cuantificación y la precisión expresada en sus dos
formas: repetibilidad y reproducibilidad.
Se demostró mediante el diseño experimental, con la evaluación estadística de los
resultados experimentales y teniendo como base los criterios de aceptación permitidos, que
el método analítico es específico, selectivo, lineal (r2 0. 993 linealidad del sistema, r2 0.995
linealidad del método Bacitracina Zinc y r2 0.99 linealidad del método Bacitracina Metilen
Disalicilato), preciso (CV< 5%), exacto (Sesgo < 3% y texp.<ttab.) en el intervalo de
concentraciones estudiadas. Se obtuvo el límite de cuantificación en la concentración 0.02
UI/ml y el límite de detección en la concentración 0.005 UI/ml.
De esta forma mediante los estudios realizados se establece que las características de
desempeño analítico cumplen con los requisitos para la aplicación analítica propuesta
siendo confiable para ser utilizado en la comprobación de las especificaciones de calidad.

2
ABSTRACT
The validation of the analytical methods method for the quantitative of Bacitracin was carried
out to be used in the quality control in a raw material and the pharmaceutical products
finished with this active principle. In this work was described and developed the validation
process of microbiological cylinder-plate determination method for antibiotics (diffusion in
agar) for the quantitative determination of Bacitracin Zinc 15% and Bacitracin Methylene
Disalicylate 11%, it includes the necessary requirements in the determination of the analytic
parameters: method linearity, system linearity, specificity, exactness, selectiveness,
detection limit, quantification limit and accuracy, which was expressed in its 2 forms:
repeatability and reproducibility.
It was demonstrated by through experimental design, with the statistical evaluation of the
experimental data and having like base the allowed approaches of acceptance that the
analytic method is specific, selective, lineal (r2 0. 993 system linearity, r2 0.995 method
linearity of Bacitracin Zinc y r2 0.99 method linearity Bacitracin Methylene Disalicylate),
precise (CV< 5%), exact (Sesgo < 3% y texp.< ttab.) in the interval of studied concentrations.
The quantification limit and detection limit was 0.02 UI/ml and 0.005 UI/ml respectively. For
that reasons, states that the characteristics of analytic acting fulfill the requirements for the
application analytic proposal, therefore, they are reliable and may be used in the checking of
the quality specifications of the raw material and the pharmaceutical products finished with
this active principle.

3
2. INTRODUCCIÓN
La validación es el proceso establecido para la obtención de pruebas documentadas,
mediante estudios sistemáticos de laboratorio y demostrativos, de que un método de
análisis es lo suficientemente fiable y reproducible para producir el resultado previsto
dentro de intervalos definidos. El proceso de validación permite el conocimiento de las
características de funcionamiento del método y proporciona un alto grado de confianza
en el mismo y en los resultados obtenidos al aplicarlo. (AEFI, 2001)
Se define como método analítico a la adaptación específica de una técnica analítica
para un propósito de medición seleccionado. La validación de un procedimiento analítico
es un procedimiento para establecer por medio de estudios laboratoriales una base de
datos que demuestren científicamente que un método analítico tiene las características
de desempeño (exactitud, precisión, especificidad, límite de detección, límite de
Cuantificación, linealidad y intervalo de linealidad) que son adecuadas para cumplir los
requerimientos de las aplicaciones analíticas pretendidas. Implica la demostración de la
determinación de las fuentes de variabilidad y del error sistemático y al azar de un
procedimiento, no solo dentro de la calibración sino en el análisis de muestras reales.
(USP, 30)
La valoración microbiológica de antibióticos es un método analítico que permite bajo las
condiciones adecuadas demostrar la actividad (potencia) de los antibióticos por medio
de su efecto inhibidor sobre los microorganismos. Se utilizan dos métodos generales: la
valoración en difusión en gel de agar (cilindro placa) y la valoración turbidimetrica en
tubo. (USP, 30) básicamente en los dos métodos la potencia de un antibiótico se estima
mediante la comparación de la actividad de un producto (problema) y la de un muestra
Estándar de referencia (patrón) en presencia de un microorganismo testigo. (AEFI,
2001)
VICAR FARMACEUTICA S.A. fabrica y comercializa productos farmacéuticos
veterinarios, posee una línea de más de cuarenta productos en el mercado para la
sanidad animal. Dentro de estos productos se encuentra Bactran, antibiótico cuyo
principio activo dependiendo su presentacion es la Bacitracina Zinc o Bacitracina Dimetil
Salicilato.
Posee un espectro antimicrobiano de acción activa frente algunas bacterias Gram
Positivas como estafilococo, estreptococo (particularmente el estreptococo del grupo A)

4
y clostridio. Es también activa frente a Actnomyces, Treponema pallidum y algunas
especies Gram negativas, como Neisseria y Haemophilus influenzae; sin embargo, la
mayoría de los microorganismos Gram. Negativos son resistentes. (Sweetman, C.
2003). Su espectro de acción abarca también, algunos corinebacterias, espiroquetas,
Nocardidia, Entamoeba histolytica. (Trolldenier, 1985). Las salmonellas, E.coli, Proteus,
los hongos y los virus son resistentes. Los gérmenes sensibles son inhibidos por una
concentración comprendida entre 0,005 y 2,0 UI/mg. Los que necesitan 50 UI/mg o mas
se consideran resistentes. (Trolldenier, 1900). La acción de la bacitracina es
bacteriostática y bactericida. La dosis requerida para que sea bactericida es 5 – 10
veces mayor. La bacitracina influye sobre importantes sistemas enzimáticos. Impide la
construcción de la pared celular bloqueando la desfosforilizacion (Parthier, 1969). La
Bacitracina interfiere en la síntesis de la pared celular bacteriana al bloquear las
funciones de las moléculas transportadoras de lípidos que transfieren las subunidades
de la pared celular a través de la membrana. La Bacitracina se une al undecaprenol-
pirofosfato, bloqueando su desfosforilación, e impidiendo por lo tanto, la regeneración
del transportador de membrana.. (Sweetman, C. 2003). En los estafilococos inhibe la
incorporación del acido glutámico durante la fase de proliferación. (Trolldenier, 1984)
La Bacitracina y la Bacitracina zinc se aplican por vía tópica, a menudo junto con otros
antimicrobianos como la Neomicina o Polimixina B, y algunas veces con
corticosteroides, en el tratamiento de las infecciones locales. La bacitracina se emplea
en infecciones de piel (piodermitis, heridas infectadas, Impetigo contagioso, foliculitis,
furunculosis, ulcera decubitus, dermatitis infecciosa eczematoid, escabiosis, y
dermatofitosis), conjuntivas (causadas por S. aureus, S. pyogenes, entre otros),
sinusitis, faringitis, traqueobronquitis, infecciones mandibulares (actinomicosis),
oculares, entre otros. La bacitracina ha sido efectivamente usada oralmente para el
manejo de amebiasis intestinal, pero se encuentran disponibles otros amebicidas más
potentes. (Remington´s. 1980)
La misión de VICAR FARMACEUTICA S.A. es contribuir al progreso de la Sanidad
Animal y de la Medicina Veterinaria en los países hispanoamericanos, suministrando a
los médicos veterinarios productos farmacéuticos de la más alta calidad en el momento
oportuno. Para alcanzar el propósito de la misión, la validación de cada uno de los
métodos analíticos (como por ejemplo la valoración microbiológica de Bacitracina)
aplicados en un laboratorio específico, podrá demostrar con un alto grado de confianza,
por medio de evidencia documentada que el proceso producirá de forma consistente y
permanente productos que poseen las características de calidad predefinidas,

5
compitiendo y generando valor al cliente. Con métodos de análisis validados se
alcanzan las metas de calidad que se haya trazado como parte de los procesos de
mejoramiento continúo del sistema de calidad, formando una empresa cada vez más
líder en la industria farmacéutica veterinaria del país.
El presente trabajo tiene como objetivo describir el proceso de validación del método
analítico para la cuantificación de Bacitracina efectuado en el laboratorio de VICAR
FARMACEUTICA S.A. mediante estudios de laboratorio que permitan la determinación
y el estudio de las característica de desempeño analítico para la validación del método.

6
3. REVISION DE LITERATURA
3.1. ANTIBIÓTICOS
3.1.1 Definición
El primero que expresó el concepto de antibiótico fue Waksman (1942): los antibióticos
son sustancias de acción antimicrobiana producidas por microorganismos o plantas
superiores en el curso de su metabolismo normal, sustancias que inhiben el crecimiento
de otros microorganismos en concentraciones mínimas. Esta definición ha sido
ampliada posteriormente en virtud de los conocimientos adquiridos sobre su obtención,
y con objeto de deslindar otros productos metabólicos: un antibiótico es una sustancia
químicamente definida, producida en el metabolismo de células vivas y aislada de ellas
por primera vez, o uno de sus derivados producidos por métodos sintéticos o
biosintéticos, el cual ejerce su acción bacteriostática o bactericida en pequeña
concentración contra microorganismos vegetales y animales.( Brunner y Machek,
1962).
Algunos de los antibióticos mas empleados son producidos por actinomicetales
(Estreptomicina, Cloranfenicol, Tretraciclinas, Eritromicina), hongos (Penicilina,
Griseofulvina) y bacterias (Polimixinas, Bacitracina). (Trolldenier, 1900)
Bacteriostatico: Inhibición o interrupción de la multiplicación microbiana tras un periodo
variable de latencia, en general reversible Estos antimicrobianos inhiben la
multiplicación, no destruyen, son antibióticos bacteriostáticos de tal manera que cuando
el microorganismo desaparece puede volver a crecer, el fin es que el sistema inmune
acabe con ellos después de haber tomado el antibiótico. (Thrum y Bocker, 1971)
Bactericida: Eliminación irreversible de los gérmenes en periodo de reproducción o
reposo sin daño para el microorganismo. Las condiciones previas son: dosificación
óptima, necesaria duración terapéutica, concentración suficiente donde esté localizada
la infección.
La acción bactericida in Vitro se desarrolla en tres fases:
1. fase de latencia: generalmente corta, dura unos 5 – 15 minutos. Es probable que
entonces tenga lugar la penetración en la célula bacteriana.

7
2. fase de muerte: inhibición del crecimiento o muerte de los gérmenes. El número de
bacterias que sobreviven disminuye espontáneamente mientras dura la acción letal si la
concentración es constante.
3. fase tardida: la reducción de gérmenes disminuye, pero sin que cesé por completo.
Esta fase también se puede llamar persistencia. (Thrum y Bocker, 1971)
3.1.2 Clasificación de los antibióticos
3.1.2.1 Espectro de acción
Todos los antibióticos poseen un espectro de actividad conocido sobre los gérmenes
patógenos en virtud a su mecanismo de acción específica. Por los microorganismos o
agentes afectados, dividimos los antibióticos en bacteriostáticos, bactericidas,
fungistáticos, virostáticos, rickettsiostáticos y citostáticos. En cuanto al número de
especies o familias sensibles el espectro de los antibióticos puede ser reducido, medio o
amplio. El espectro es muy variable siendo la mayoría de tipo amplio el mayor en
cefalosporinas de 4ª generación, carbapenemas y piperacilina-tazobactam, seguido de
cefalosporinas de 3ª generación incluyendo Gram Negativos, Gram Positivos y
espiroquetas. De espectro más reducido destacan la bencilpenicilina y
fenoximetilpenicilina (estreptococos y Neisseria), cloxacilina (antiestafilococo) y
aztreonam (sólo Gram negativos) y los de espectro medio suelen ser activos frente a
gérmenes Gram Positivos y Gram negativos y a ellos pertenecen las penicilinas, los
antibióticos macrólidos, algunos polipeptídicos y los aminoglucosídicos, la amoxicilina-
clavulánico y cefalosporinas de 1ª y 2ª generación.(Trolldenier, 1900)
3.1.2.2 Mecanismo de acción
Otra forma de agrupar los antibióticos es en función de las "dianas" sobre las que
actúan y con las que interfieren:
3.1.2.2.1 Antibióticos que interfieren con la biosíntesis de la pared celular
Su acción esta limitada a la fase de proliferación. La mayoría de los antibióticos inhibe la
síntesis de diferentes compuestos celulares. Algunos de los fármacos más empleados
interfieren con la biosíntesis de peptidoglicanos (PG), el principal componente de la
pared celular. Ejercen su efecto bactericida sobre bacterias en crecimiento. Inhibe
determinados pasos en el ciclo de la síntesis y ensamblaje del PG, provocan la
acumulación de precursores de PG desencadenando autolisinas de la bacteria, que
degradan el PG provocando la lisis celular por ingreso de agua a la célula. Estos

8
antibióticos no lesionan las células humanas ya que éstas no poseen pared celular.
(Pareja Iañez, 1998)
En conclusión esta clase de antibióticos, inhiben la síntesis de peptidoglicanos . Una
vez que se inhibe la síntesis de la pared celular puede ocurrir autolisis enzimática de la
pared celular. Sin la influencia restrictiva de la pared celular, la elevada presión osmótica
dentro de la célula hace estallar a la membrana interna y/o externa de la bacteria. Por lo
tanto estos antibióticos son generalmente bactericidas. (Figueroa , P y Luna Torres, L.
2006).
Algunos antibióticos que presentan esa actividad son:
- Betalactámicos que dependiendo de su estructura química, se clasifican en penicilinas,
cefalosporinas o carbapénem. Todos los antibióticos betalactámicos comparten una
estructura química similar en forma de anillo. Este anillo impide la unión de los péptidos
a las cadenas laterales en el proceso de formación de la pared celular. Estos
compuestos inhiben la síntesis de peptidoglicanos pero no interfieren con la síntesis de
componentes intracelulares. De este modo, continúan formándose materiales dentro de
la célula que aumentan la presión sobre la membrana hasta el punto en que ésta cede,
el contenido celular se libera al exterior, y la bacteria muere. (Pareja Iañez, 1998).
- Fosfomicina: Inhibe el primer estadio de la síntesis de peptidoglicano al competir por
analogía estructural con el PEP. (Pareja Iañez, 1998).
- Cicloserina: Se comporta la D-alanina, inhibiendo la actuación de la racemasa que
convierte la L-ala a D ala, así como la reacción de unión de dos D-ala. (Pareja Iañez,
1998).
- Vancomicina y ristocetina: inhiben la segunda transglucosidación, es decir la unión de
diversas unidades
disacarídicas. (Pareja Iañez, 1998).
- Bacitracina: se une al undecaprenol-pirofosfato, bloqueando su desfosforilación, e
impidiendo por lo tanto, la regeneración del transportador de membrana. (Pareja Iañez,
1998).
3.1.2.2.2 Antibióticos que actúan sobre la membrana celular
A diferencia de los antibióticos que actúan a nivel de pared, los que interfieren con la
membrana celular ejercen sus efectos independientemente de que el microorganismo

9
esté o no creciendo. Suelen carecer de especificidad (afectan a membranas de
procariotas y de organismos superiores), por lo que resultan más o menos tóxicos para
los mamíferos y, en general, han encontrado escasa aplicación clínica. Algunos de los
antibióticos que pertenecen a este grupo son: Polienos, Polimixinas, Imidazoles, entre
otros. (Pareja Iañez, 1998). La Estreptomicina, la Polimixina B y la Colistina, perturban
las funciones de la membrana citoplasmática que regula las condiciones de
permeabilidad, de tal modo que puede producirse la muerte de la célula por
desregulaciones osmóticas. Esta acción no exige división celular y es posible también
en la fase de reposo. (Trolldenier, 1984)
3.1.2.2.3 Antibióticos que inhiben la síntesis de proteínas
Los antibióticos que interfieren en la síntesis de proteínas son muy variados y
abundantes, y la mayoría de ellos funcionan interfiriendo con el ribosoma, sobre todo los
que se unen a proteínas ribosómicas y/o a alguno de los ARN ribosómicos. Los más
útiles son aquellos que tienen efectos selectivos frente a los ribosomas 70S
procarióticos, pero no sobre los 80S eucarióticos. Dentro de ellos y siguiendo el orden
natural del funcionamiento de la elongación de la cadena polipeptídica, podemos
agruparlos según la fase concreta de la elongación sobre la que actúan:
Inhibición del reconocimiento de un aminoacil-ARNt (aa-ARNt) hacia el sitio A del
ribosoma;
Introducción de errores en la lectura de los ARNm;
Inhibición de la reacción de formación del enlace peptídico;
Inhibición de la traslocación del peptidil-ARNt (pp-ARNt) desde el sitio A al sitio P.
Bloqueo de los factores de elongación.
Esta acción inhibidora del metabolismo no depende tampoco de la división celular, pero
se desarrolla con mayor rapidez y seguridad durante la fase de proliferación.
(Trolldenier, 1900). Algunos de los antibióticos que pertenecen a este grupo son:
Tetraciclinas, Aminoglucósidos, Anfenicoles, Lincosamidas, Macrólidos, entre otros.
(Pareja Iañez, 1998)
3.1.2.2.4 Antibióticos que actúan sobre la síntesis de ácidos nucleicos.
Son antibióticos de síntesis química, su toxicidad selectiva es baja y son
bacteriostáticos. Estos antibioticos operan sobre las enzimas que actúan en el proceso.

10
Sus mecanismos de acción son: a). Por bloqueo de la trascripción:- Impide que actué la
ARN polimerasa bacteriana que es la que sintetiza el ARN. - Rifampicina. b). Por
bloqueo de la duplicación del ADN:- Actúan inhibiendo la acción de las enzimas que
enrollan y desenrollan la cadena de ADN, estos antibióticos impiden que la cadena se
desenrolle. - Quinolonas: Oflozacino, cinoxacino, norfloxacino. - Novobiocina:
Benzamida. c) Por interferencia en la síntesis de bases nitrogendas:- Impiden la síntesis
de bases nitrogenadas, Adenina, timina, etc. (método exclusivo de las bacterias). -
Sulfamidas - Diaminopirimidinas. Algunos de los antibióticos que pertenecen a este
grupo son: Quinolonas, Ansamicinas, Sulfonamidas, entre otros. (Pareja Iañez, 1998)
3.1.2.3Estructura química
Una forma de estudiarlos es agrupándolos por clases según su naturaleza química.
Desde el punto de vista químico, se clasifican en grandes familias:
3.1.2.3.1 Aminoglucosidos
Grupo de antibióticos bactericidas estrechamente relacionados, derivados de bacterias
del orden Actinomicetales o, mas concretamente, del genero Streptomyces(
Framicetina, Kanamicina, neomicina, paromomicina, estreptomicina y tobramicina) y del
genero Micromonospora (gentamicina y sisomicina). Los aminoglucosidos poseen un
espectro antimicrobiano similar y actúan interfiriendo en la síntesis proteica bacteriana.
Son más activos frente a bacilos gramnegativos que en los grampositivos. (Sweetman,
2003)
3.1.2.3.2 Anfenicoles
El cloranfenicol (y tianfenicol) son inhibidores de la síntesis proteica por acción en el
ribosoma a nivel de la subunidad 30S y 50S respectivamente. El cloranfenicol por el
contrario está limitado a su uso en preparados tópicos, pero en el pasado fue utilizado
para el tratamiento de múltiples cuadros infecciosos, desde banales hasta muy graves,
pero se ha ido retirando por la potencial toxicidad hematológica. (Delgado-Iribarren,
2001).
3.1.2.3.3 Antimicobacterianos
Constituyen un grupo variado de antibacterianos cuyo espectro de actividad incluye
Mycobacterium spp. Forman parte del grupo, las rifamicinas, también conocidas como
ansamicinas, un grupo de antibióticos aislados a partir de una cepa de Amycolatopsis
mediterranei (Nocardida mediterranei;Streptomyces mediterranei).Estos antibióticos se

11
utilizan para el tratamiento de tuberculosis, la lepra y otras infecciones micobacterianas.
(Sweetman, 2003).
3.1.2.3.4 Cefalosporinas y otros B-lactamicos
Las cefalosporinas son antibacterianos semisinteticos derivados de la cefalosporina C,
un antibiótico natural producido por el moho Cephalosporium acremonium. Las
cefalosporinas son bactericidas y actúan inhibiendo la síntesis de la pared bacteriana.
Las nuevas generaciones de cefalosporinas generalmente poseen un incremento de
actividad frente a las bacterias gramnegativas y grampositivas.
3.1.2.3.5 Glucopeptidos
Poseen una estructura glucopeptidica. Actúan interfiriendo la síntesis de la pared
bacteriana y es activa frente a cocos grampositivos. Algunos antibióticos que pertenecen
a este grupo son: Avoparcina, ramoplanina, teicoplanina, vancomicina, entre otros.
(Sweetman, 2003) Actúan sobre la segunda fase de la síntesis de la pared bacteriana
inhibiendo la formación de peptidoglucano, interfieren en la formación del precursor D-
alanyl –D-alanina, afectan la permeabilidad de la membrana citoplasmática de los
protoplastos y alteran la síntesis de RNA. (Pareja Iañez, 1998).
3.1.2.3.6 Lincosaminas
Es un antibiótico producido por una cepa de Streptomyces lincolnensis. Las
lincosaminas son bacteriostáticas o bactericidas, según la concentración, y son activas
principalmente frente a bacterias grampositivas y Bacteroides spp. Al parecer tambien
poseen cierta actividad antiprotozoaria. Las lincosamidas poseen una actividad
antimicrobiana actuando sobre el ribosoma bacteriano para suprimir la síntesis proteica.
(Sweetman, 2003).
3.1.2.3.7 Macrólidos
Es un amplio grupo de antibióticos, principalmente producidos por Streptomyces spp.
Los macrólidos pueden ser bacteriostáticos o bactericidas, según su concentración y el
tipo de microorganismo y se cree que interfiere en la síntesis proteica bacteriana. Son
activos frente a microorganismos como Legionella pneumophila,Micoplasma
pneumoniae y algunas rickettsias y clamidias.
3.1.2.3.8 Penicilinas
La penicilina fue el primer antibiótico utilizado terapéuticamente y se obtuvo en un

12
principio como una mezcla de penicilinas conocidas como F, G, X y K, a partir del moho
Penicillium notatum. Se obtuvieron mejores rendimientos utilizando P. chrysogenum.
Son bactericidas por medio de su acción inhibitoria sobre la síntesis de la pared
bacteriana. La bencilpenicilina puede considerarse el compuesto original de las
penicilinas y es activa principalmente frente a bacterias grampositivas y Neisseria spp.
Algunas penicilinas son activas frente algunos microorganismos gramnegativos (ejemplo
ampicilina, mecilinam, temocilina, entre otros). (Sweetman, 2003).
3.1.2.3.9 Quinolonas
Inhiben la girasa (topoisomerasa II, genes gyrA y gyrB) y la topoisomerasa IV (genes
parC y Par E, con mayor importancia en gram positivos) por unión al complejo ADN-
girasa. Si bien estos compuestos se obtienen por síntesis química su mecanismo de
acción no es nuevo en la naturaleza puesto que existen también algunos compuestos
naturales que la presentan como por ejemplo la Novobiocina (producida por
Streptomyces), cumermicinas y ciclotilidina. Las topoisomerasas son enzimas
implicadas en el desarollamiento y decatenación del ADN lo que es necesario para su
replicación. El espectro de estos antimicrobianos ha evolucionado desde una limitación
a infecciones del tracto urinario y actividad limitada a gramnegativos hasta los
compuestos actuales con actividad en grampositivos y anaerobios, menor selección de
mutantes y mejora en la farmacocinética. (Delgado-Iribarren, 2001)
3.1.2.3.10 Sulfamidas y Diaminopirimidinas
Son normalmente bacteriostáticas e interfieren en la síntesis de ácido fólico de
microorganismos sensibles. Estos se emplean en el tratamiento de la profilaxis de
algunas infecciones por protozoos. El empleo clínico de las sulfamidas es sumamente
reducido, en general están indicadas únicamente para el tratamiento de las infecciones
de las vías urinarias y algunos trastornos como la nocardiosis. Las sulfamidas como la
sulfaguanidina, el succinilsulfatiazol y el ftalilsulfatiazol se han utilizado para el
tratamiento de infecciones gastrointestinales. (Sweetman, 2003).
3.1.2.3.11 Tetraciclinas
Son un grupo de antibacterianos, inicialmente derivados de ciertos Streptomyces spp.
Interfieren en la síntesis proteica en organismos sensibles, poseen un amplio espectro
de actividad frente a bacterias grampositivas y gramnegativas, clamidias, rickettsias
(rickettsias tificas y maculosas), micoplasmas (neumonía atípica, enfermedad
inflamatoria pélvica, la enfermedad de Lyme, la brucelosis, la turalemia, la peste, el

13
colera, acne), espiroquetas, algunas micobacterias y algunos protozoos. (Sweetman,
2003)
3.1.2.3.12 Polipeptidicos
Es un grupo de antibióticos que se diferencia de los demás en cuanto a su mecanismo
de acción y su espectro antibacterial. Son antibióticos producidos por especies de
Bacillus durante las primeras fases de la esporulación. Se trata de moléculas con
aminoácidos en configuraciones L y D, y con presencia de ciertos aminoácidos "raros"
(no proteinogenéticos). Algunos de estos antibióticos son polipéptidos cíclicos. Su
síntesis no se realiza en los ribosomas, sino que se produce por una secuencia de
reacciones enzimáticas que nada tienen que ver con el proceso de traducción de los
mensajeros genéticos. Suelen ser antibióticos de efecto bactericida. Su mecanismo
consiste en que se unen a la cara externa de la membrana citoplásmica y, además, a la
membrana externa de las bacterias Gram.-negativas, alterando su estructura y su
permeabilidad osmótica; ello condiciona la inhibición de procesos básicos de la
membrana, así como la salida de metabolitos del citoplasma. Algunos antibióticos que
pertenecen a este grupo son: polimixina, tirocidina-a y gramicidina-s. (Pareja, 1998)
3.2 BACITRACINA
3.2.1 Descubrimiento
En Junio de 1943, Una niña de 7 años llamada Margaret Tracy, ingreso a la sala de
urgencias del Hospital Presbiteriano de Columbia de la ciudad de Nueva York, pues la
había atropellado un coche, ocasionándole una fractura abierta en la tibia. De esta
herida se tomo una muestra y en el análisis microbiológico inicial se determino la
presencia de Staphylococus aureus. Sin embargo, a su vez otras muestras fueron
enviadas al laboratorio de bacteriología, donde su directora, Balbina Jonson, describió
que el Staphylococus aureus visto en el examen inicial microscópico había
desaparecido de la noche a la mañana. Con la ayuda de Fran L. Meleney y H. Anker,
consiguieron aislar a partir de la muestra de la herida una cepa de un bacilo muy activo
frente S. Aureus, al que dominaron ¨Tracy I¨. Tras filtrar el caldo de cultivo se detecto la
presencia de un potente antibiótico a este antibiótico le dieron el nombre de Bacitracina,
de la combinación del termino ¨bacilo¨ y ¨tracy¨, apellido de esta niña. (Martín, 2005)
3.2.2 Sinónimos
Aifivina, Baxi-max, Penitracina, Zutracina (Negwer, 1971). Asociación con neomicina:
Nebacetina. (Trolldenier, 1900)

14
3.2.3 Formula empírica
Bacitracina A: C66H103N17O16S
Bacitracina B: C71H112 N18O17S
Bacitracina F: C66H97N15O17S
(Trolldenier, 1900)
3.2.4 Formula estructural
Figura 1. Bacitracina (Según Maier y Groger, 1972)
3.2.5 Peso molecular
Bacitracina (mezcla): ˜ 1500 Daltons
Bacitracina A: 1470 Daltons
(Trolldenier, 1900)
3.2.6 Descripción, Solubilidad, Conservación, Estabilidad
Según Farmacopua Europea 2002: la Bacitracina esta compuesta de uno o mas
polipéptidos antimicrobianos producidos por ciertas cepas de Bacillus lincheniformis y B.
subtilis var. Tracy. La potencia no es inferior a 60 UI/mg, calculándola con respecto a la
sustancia seca. Según USP 30 tiene una potencia no inferior a 40 UI/mg.
Es un polvo higroscópico de color blanco a amarrillo pálido, inodoro o con ligero olor.
Fácilmente soluble en agua; soluble en alcohol, acido acético glacial y metanol; la
solución en disolventes orgánicos a menudo presenta un residuo insoluble; insoluble en
acetona cloroformo y éter. Estas soluciones se deterioran fácilmente a temperatura
ambiente. Precipita en estas soluciones y se inactiva por sales de algunos metales

15
pesados. (USP 30). Forma sales estables con el cinc y el manganeso, las cuales son
relativamente insolubles (0,23 – 0,45 % a 25oC). (Trolldenier, 1984)
En solución de pH 5-7 es estable a 4 oC durante 4 semanas (Jawets 1956), y a 20 oC
pierde del 33 al 50% de su actividad en 14 días. (Meyer- Jones. 1956). Posee máxima
estabilidad en medio acido pH 4 – 5. La actividad biológica disminuye rápidamente a
pH >9. (Trolldenier, 1984)
De la mezcla se han aislado diversas (5 – 10) bacitracinas: A, A´, B, C, D, E, F1, F2, F3,
G. La conservación requiere ausencia de aire y oscuridad. La sustancia seca se
conserva durante 1,5 y 2 años a baja temperatura. (Patsch, 1975). En solución acuosa
al 1% presenta un pH entre 6 y 7. Conservar a temperatura entre 8 y 15 oC en envases
herméticos. (F. EUR). El pH en una solución acuosa que contiene 10.000UI/ml oscila
entre 5,5 y 7,5. (USP 30).
3.2.7 Espectro antimicrobiano de acción
Es activa frente algunas bacterias Gram Positivas como estafilococo, estreptococo
(particularmente el estreptococo del grupo A) y clostridio. Es también activa frente a
Actinomyces, Treponema pallidum y algunas especies Gram negativas, como Neisseria
y Haemophilus influenzae; sin embargo, la mayoría de los microorganismos Gram
Negativos son resistentes. (Sweetman, C. 2003). Su espectro de acción abarca
también, algunos corinebacterias, espiroquetas, Nocardidia, Entamoeba histolytica.
(Trolldenier, 1900) Las salmoneras, E.coli, Proteus, los hongos son resistentes. Los
gérmenes sensibles son inhibidos por una concentración comprendida entre 0,005 y 2,0
UI/mg. Los que necesitan 50 UI/mg o mas se consideran resistentes. (Trolldenier, 1900).
En la tabla 1 se muestra el espectro de acción de la Bacitracina.

16
Tabla 1. Espectro de acción de la Bacitracina (Según Wege, 1969)
Microorganismo Espectro de acción
Microorganismo Espectro de acción
Microorganismo Espectro de acción
Microorganismo Espectro de acción
Estreptococos +++ Salmonelas / Clostridios ++ Haemophilus +
Estafilococos +++ E. coli / Pasterelas / Actinomyces israeli
++
Neumococos ++ Shigelas / Brucelas + Treponemas ++
Corinebacterias ++ Aerobacter aerogenes
/ Fusobacterium necrophorum
/ Leptospiras +
Listeria monocytogenes
/ klebsielas / Vibriones / Toxoplasmas /
Erysipelothrix insidiosa
/ Proteus / Mycobacterium tuberculosis
/ Coccidias /
Bac. Anthracis + Pseudomonas aeruginosa
/ Rickettsias /
+ = Grados de sensibilidad / = Resistencia o inactividad
3.2.8 Tipo y mecanismo de acción
La acción de la Bacitracina es bacteriostática y bactericida. La dosis requerida para que
sea bactericida es 5 – 10 veces mayor a la concentración mínima inhibitoria (la menor
concentración capaz de inhibir el crecimiento). La Bacitracina influye sobre importantes
sistemas enzimáticos. Impide la construcción de la pared celular bloqueando la
desfosforilizacion (Parthier, 1969). La Bacitracina interfiere en la síntesis de la pared
celular bacteriana al bloquear las funciones de las moléculas transportadoras de lípidos
que transfieren las subunidades de la pared celular a través de la membrana la
Bacitracina se une al undecaprenol-pirofosfato, bloqueando su desfosforilación, e
impidiendo por lo tanto, la regeneración del transportador de membrana.(Sweetman, C.
2003). En los estafilococos inhibe la incorporación del acido glutámico durante la fase de
proliferación. (Trolldenier, 1900)
3.2.9 Farmacocinética
La Bacitracina no se absorbe de forma apreciable en el tubo digestivo. Cuando se
administra en inyección intramuscular se absorbe rápidamente. Entre el 10 y el 40% de
una dosis única inyectada se excreta por la orina en 24 horas. La Bacitracina difunde
fácilmente hacia el líquido pleural y ascético, pero pasa en poca cantidad el LCR. Se
ha descrito que la absorción es despreciable tras la aplicación tópica, pero puede
producirse después de un lavado peritoneal. (Sweetman, C. 2003).

17
3.2.10 Indicaciones y administración
La Bacitracina y la Bacitracina zinc se administra por vía tópica, en algunos casos se
combina junto con otros antimicrobianos como la Neomicina o Polimixina B, y con
corticosteroides, para el tratamiento de las infecciones locales. La Bacitracina se utiliza
en infecciones de piel (piodermitis, heridas infectadas, Impetigo contagiosa, foliculitis,
ecthyma, furunculosis, ulcera decubitus, dermatitis infecciosa eczematoid, scabies, y
dermatofitosis), conjuntivas (causadas por S. aureus, S. pyogenes, entre otros),
sinusitis, faringitis, traqueitis, traqueobronquitis, infecciones mandibulares
(actinomicosis), oculares, entre otros. La Bacitracina ha sido administrada efectivamente
de forma oral para el manejo de amebiasis intestinal, pero se encuentran disponibles
otros amebicidas más potentes. Se pueden presentar o producir efectos adversos a
partir de la absorción de esta en heridas abiertas y desde la vejiga o la cavidad
peritoneal; sin embargo la toxicidad de la dosis restrictiva de preparaciones combinadas
se considera que es debida a la Neomicina. (Sweetman, 2003)
Bacitracina también ha sido usado de forma oral como un antiséptico intestinal. Su
administración oral como suplemento alimenticio en algunas especies animales (pollos,
pavos, cerdos y conejos) actúa como promotor del crecimiento y terapéutico para
infecciones entéricas. La dosis de 2000 U/Kg de p.v. reduce moderadamente la flora
intestinal y una dosis de 10000 U/Kg de p.v. ( peso vivo) la destruye en gran parte. La
Bacitracina se elimina con la heces en el curso de hasta 3 días después de la ultima
administración. (Trolldenier, 1900)
3.2.11 Interacciones
Puede producirse nefrotoxicidad adicional si se administra Bacitracina de forma
sistemática con otros fármacos nefrotoxicos. Se ha descrito que la Bacitracina aumenta
la acción de bloqueo neuromuscular de otros fármacos. (Sweetman, 2003)
3.2.12 Efectos adversos
Cuando se administra Bacitracina de forma sistemática puede producir nefrotoxicidad
grave. Pueden aparecer repercusiones cutáneas, anorexia, nauseas y vómitos, así
como dolores el lugar de inyección. Pueden producirse reacciones de hipersensibilidad,
entre ellas exantemas y anafilaxia, tanto con administración sistémica como con
administración tópica, aunque esta ultima es excepcionalmente. (Sweetman, 2003)

18
3.3 BACITRACINA ZINC
3.3.1 Descripción, solubilidad, conservación
Según la Farmacopea Europea es un complejo de Bacitracina y zinc. Su potencia no
es inferior a 60UI/mg, calculada con respecto a la sustancia seca. Polvo higroscópico
blanco o ligeramente verde amarillento. Poco soluble en agua o alcohol, muy poco
soluble en éter. El filtrado de una solución saturada tiene un pH entre 6 y 7.5. Y según
la USP 30, es una sal de zinc de un tipo de Bacitracina o mezcla de dos o más sales
similares. Tiene una potencia no inferior a 40UI/mg. Contiene no menos de 2,0 por
ciento y no mas de 10,0 por ciento de zinc. (Zn), calculado con respectó a la sustancia
seca. Polvo higroscópico blanco o de ligero color marrón, inodoro o con un ligero olor.
Bastante soluble en agua. El pH en una solución acuosa saturada oscila entre 6 y 7.5.
Se Conserva en envases herméticos a una temperatura entre 8 y 15 oC.
3.3.2 Estabilidad
La Bacitracina zinc es más estable que la Bacitracina y puede conservarse durante 18
meses a una temperatura superior a 40 oC sin pérdidas apreciables. Las tabletas de
Bacitracina zinc, pomadas y comprimidos que contiene Bacitracina zinc con Neomicina
son mas estables que las correspondientes preparaciones de Bacitracina. La Bacitracina
zinc es más amarga que la Bacitracina y el sabor se enmascara más fácilmente.
(Sweetman, 2003)
3.3.3 Incompatibilidades
La Bacitracina se inactiva ligeramente en bases que contienen alcohol este arílico,
colesterol, derivados de polioxietileno y laurinsulfato sódico y se inactiva rápidamente en
bases que contienen agua, macrogoles, propilenglicol, glicerol, cloruro de cetilpiridinio,
cloruro de benzalconio, ictamol, fenol y acido tanico. (Sweetman, 2003)
3.3.4 Acción farmacológica
Antibiótico polipeptídico. Inhibe la síntesis del mucopéptido que forma la pared celular.
De esta manera, impide la formación de la pared celular y hace a la bacteria
osmóticamente sensible, llevándola a la lisis.
Su acción exige la presencia de cationes bivalentes como el Zinc.

19
3.3.5 Indicaciones de uso, dosis recomendadas, vías de aplicación.
La Bacitracina de Zinc es el antibiótico más comúnmente utilizado en patologías
digestivas, por ser activa frente a bacterias Gram positivas y por ser escasamente
absorbible en el tracto digestivo. Para su actividad, este antibiótico precisa de cationes
bivalentes como el Zinc. (King et al.1980),
Existe la hipótesis de que la Bacitracina no se limita al control de patógenos intestinales,
sino que también puede actuar sobre la cinética de absorción de nutrientes (Abecia et
al. 2004), dado que en otras especies se ha observado que aquellos animales que la
han ingerido presentan un menor grosor de su pared intestinal (King et al.1980), y por
tanto pudieran favorecer la absorción de nutrientes
Especies a las que se destina (Pollos, pavos, cerdos, conejos, entre otros) se emplea
como promotor de crecimiento y terapéutico para infecciones entéricas y superficiales.
Para mejorar la producción de huevo, la eficiencia alimenticia en la gallina y el peso de
la carcasa o canal. (Abecia et al. 2004), (King et al.1980).
Dosis indicativa en especies a las que se destina: 5 a 10 g por tonelada de alimento.
(Abecia et al. 2004),
3.3.6 Condiciones de almacenamiento
En recipientes de cierre perfecto y al abrigo de la luz se mantiene estable. Mantiene su
estabilidad hasta dos años a temperatura de 25°C
3.4 BACITRACINA METILEN DISALICILATO
3.4.1 Descripción, solubilidad, conservación
Antibiótico polipeptídico producido por ciertas cepas de Bacillus lincheniformis y B.
subtilis var. Tracy.
Es un polvo granular de color amarrillo a café, olor tenue, de sabor amargo, es insoluble
en agua y soluble en alcohol y metanol. (Tianjin XinXing, 2007). Debe almacenarse en
un lugar frío y seco protegido de la luz solar directa y la humedad. (Alpharma Inc. 2007).
3.4.2 Indicaciones de uso
La Bacitracina Metilen Disalicilato se ha administrado a pollos de engorde, pavos en
crecimiento y cerdos sin presentar efectos adversos. En pollos de engorde para la
prevención y control de la enteritis necrótica causada por Clostridium perfringens,
agente sensible a la Bacitracina. En pavos se utiliza para el control de la enteritis

20
contagiosa (cresta azul, fiebre del lodo) en pavos, complicada por organismos
susceptibles a la Bacitracina. En cerdos se administra para el tratamiento de la
disentería porcina asociada a Treponema hyodysenteriae. También se está indicado su
uso como mejorador del desempeño y para prevenir o controlar la enteritis necrótica en
pollo de engorde, gallinas de postura y reproductoras, aves de reemplazo y pavos. Es
eficaz en el control de bacterias Gram Positivas y altamente efectivo contra Clostridium
perfringens, causante de enteritis necrótica. (Alpharma Inc. 2007).
Como promotor del crecimiento y para mejorar la conversión alimenticia. Para el
tratamiento de la enteritis necrótica de las aves por clostridios. (Alpharma Inc. 2007).
No se absorbe a partir del tracto intestinal y no desarrolla residuos detectables en los
tejidos. No causa resistencia transferible entre las bacterias contra el medicamento,
Se administra en Broiler y pavos para mejorar la ganancia de peso, la conversión
alimenticia y para el control de enteritis necrótica. En aves de postura: Aumenta la
eficiencia en la producción de huevos, con un mejoramiento en la conversión alimenticia
y aumenta el número de huevos producidos por ave. Se utiliza en cerdos produce un
aumento en la ganancia de peso y mejora la conversión alimenticia, con un aumento en
la uniformidad de los cerdos. Controla cuadros de enteritis producidos por Clostridium
perfringes y en combinación con clortetraciclina se utiliza para la prevención y control de
ileitis. En vacunos para aumentar la ganancia de peso diaria y reducción de abscesos
hepáticos. (Farquímica, 2004)
3.5 Micrococcus luteus
3.5.1 Clasificación científica
Dominio: Bacteria
Phylum Actinobacteria
Orden: Actinomycetales
Familia: Micrococcaceae
Genero: Micrococcus
Especie: M. luteus
3.5.2 Características
Micrococcus luteus es una bactéria Gram positiva de forma esférica, es un
microorganismo saprófito, aeróbio obligado. M.luteus se encuentra en ambientes

21
diversos como en el suelo, polvo, agua, aire, como parte de la flora normal de la piel de
mamíferos. Esta bacteria también coloniza en la boca, mucosa, en la parte superior del
tracto respiratorio de los humanos. Se ha aislado de animales y productos lácteos y de
cerveza. (Sciencenet Multimedia Publishing, 2003).
M.luteus tolera ambientes secos y altas concentraciones de sal. M.luteus no puede
sobrevivir mucho tiempo en el suelo. (Sciencenet Multimedia Publishing, 2003).
M. luteus es coagulasa negativo, susceptible a la Bacitracina, forma colonias de color
amarillo pálido al crecer en medios de cultivos nutritivos. Se a demostrado que M. luteus
sobrevive en ambientes oligotróficos por largos periodos de tiempo. (Sciencenet
Multimedia Publishing, 2003).
3.5.3 Bioquímica
M.luteus produce pigmentos insolubles en agua de amarrillo crema. Puede crecer sobre
agar de nitrógeno inorgánico y pocos pueden reducir nitrato. Son oxidasa positiva.
M.luteus no produce ácido a partir de glucosa o glicerina bajo condiciones aeróbicas y
no produce arginina hidrolasa o galactosidasa. Los carbohidratos son oxidados a CO2 y
a agua. (Sciencenet Multimedia Publishing, 2003).
3.5.4 Patogénesis
Genera Infecciones intestinales e infecciones extraintestinales. M. luteus no se
considera específicamente como un microorganismo patógeno, pero es visto como
patógeno oportunista asociado particularmente con pacientes inmunocomprometidos.
Se han reportado infecciones del tracto unitario. (Sciencenet Multimedia Publishing,
2003).
3.5.5 Usos industriales
Mientras algunas especies son utilizadas para el mejoramiento del sabor y olor de
productos carnicol fermentados M.luteus han sido usado en la producción económica de
hidrocarburos alifáticos de cadenas largas (C21 - C34). Éstos podrían ser útiles como
aceites de lubricación y poder ser sustitutos de productos del petróleo. (Sciencenet
Multimedia Publishing, 2003)

22
3.6 VALIDACION DE METODOS ANALITICOS
3.6.1 Definición
El termino validación ha sido definido en la literatura, de diversas maneras y por
numerosos autores. Aunque los términos dados son diferentes el significado de las
mismas es siempre el mismo: a) especificar e implementar, b) aprobar y c) documentar.
(AEFI, 2001)
Definición General
Según las Normas de Correcta Fabricación (edicion 99):
Validación: obtención de pruebas con arreglo a las Normas de Correcta Fabricación, de
que cualquier procedimiento, proceso, equipó, material, actividad o sistema produce en
realidad el resultado previsto. (AEFI, 2001)
Definición Analítica
Validación: es el establecimiento de la evidencia documental de que un procedimiento
analítico conducirá, con un alto grado de seguridad, a la obtención de resultados
precisos y exactos, dentro de las especificaciones y los atributos de calidad previamente
establecidos. (AEFI, 2001)
3.6.2 Métodos Susceptibles a ser Validados
Son validables los métodos analíticos clasificados en la siguiente forma (AEFI, 2001):
Ensayos de identificación
Ensayos para la identificación del analito de interés de una materia prima o de una
especificidad farmacéutica.
Ensayos para la determinación de características inherentes. (Ejemplo test de
disolución).
Ensayos de límite de impurezas y de cuantificación de impurezas.
Ensayos para la determinación de analitos en líquidos biológicos y en productos
naturales.
Ensayos microbiológicos.

23
3.6.3 Entorno Legal
3.6.3.1 Norma de Correcta Fabricación de Medicamentos
Las Norma de Correcta Fabricación de Medicamentos de la CEE en el capitulo de
Control de Calidad indico que los métodos de análisis deben estar validados. De igual
forma las Good Manufacturing Practice de los EEUU indican que deben establecerse y
documentarse la exactitud, sensibilidad, especificidad y reproducibilidad de los métodos
analíticos utilizados. (AEFI, 2001)
3.6.3.2 Farmacopeas
Validación frente a los Métodos Oficiales y/o de Farmacopeas:
Se puede diferenciar entre validación de métodos de análisis de principios activos y
especialidades farmacéuticas.
Principios activos de síntesis: los métodos oficiales o de farmacopeas se consideran
validados siempre y cuando se apliquen a principios activos con la misma ruta de
síntesis y por lo tanto el mismo perfil de impurezas que aquellos para los que fuera
redacta la Monografía.
Especialidades: No es recomendable considerar ningún método oficial o de farmacopea
totalmente validado para una especificación, puesto que difícilmente tendrá los mismos
componentes ni la misma proporción de estos.
No obstante pueden emplearse como punto de partida métodos desarrollados para
especialidades tipo, como pueden ser los de Farmacopea Europea (EP), Farmacopea
Americana (USP) o Farmacopea Británica (BP), que permitirán obviar una gran parte del
desarrollo analítico.
3.6.4 Fases en el desarrollo de un método analítico y criterios de validación
No existe una guía oficial que indique la optima secuencia de experimentos analíticos
necesarios para el desarrollo de un método, ya que esto depende del método en si
mismo. No obstante, el desarrollo lógico de un método analítico transcurre en diferentes
fases.
3.6.4.1 Definición de las características de practicabilidad
Han de evaluarse parámetros de practicabilidad del método analítico: precisión exigible,
sensibilidad deseable, grado de selectividad, tiempo, coste, tamaño de muestra,

24
calificación del personal, tipo de equipo e instrumentación, condiciones de seguridad,
entre otras. (AEFI, 2001)
3.6.4.2 Estudios de estabilidad de la muestra preparada para análisis
La estabilidad de la muestra preparada para analizar se evalúa durante la fase de
desarrollo del método junto con la robustez. La estabilidad de las disoluciones de la
muestra, después de su preparación según los métodos de análisis, debe ser evaluada
de acuerdo al tiempo requerido para su realización. Muchos laboratorios utilizan equipos
automáticos que procesan muestras durante largos periodos de tiempo, con lo que la
muestra puede permanecer horas preparada antes de ser analizada. De la misma forma
deben demostrarse la estabilidad de las muestras y patrones preparados si se utilizan
durante varios días. (AEFI, 2001)
3.6.4.3 Puesta a punto. Características de idoneidad
La puesta a punto del método analítico, incluye desde los primeros estudios de tanteo
con patrones, hasta la utilización del método en muestras reales que garanticen el buen
funcionamiento del sistema en el momento de análisis. (AEFI, 2001)
El estudio de robustez se utiliza para optimizar y ver la criticidad del valor de los
parámetros del método antes de validar. A partir de este estudio se definirán las
características de idoneidad o conjunto de parámetros que garantizan que el sistema
responde, en el momento del análisis, a los requisitos fijados. Dichas características se
reúnen en un ensayo conocidas como ensayo de idoneidad. (System Suitability Test).
(AEFI, 2001)
La comprobación de la idoneidad forma parte integral del método y debe realizarse
cada día al inicio del análisis (dependiendo de la duración de este, será conveniente
realizarlo a intervalos de tiempo), para comprobar el correcto funcionamiento del
sistema. Los requisitos y parámetros a evaluar en un ensayo de idoneidad dependerán
del tipo de método. (AEFI, 2001)
La idoneidad del sistema, es el conjunto de ensayos que permiten comprobar en el
momento de utilización del método que el sistema (analista, reactivos, e instrumentos)
es adecuado para llevar a cabo la determinación para la que se ha establecido y
validado dicho método. (AEFI, 2001)

25
3.6.4.4 Características de fiabilidad
Esta última permitirá conocer las características de fiabilidad del método para su
aplicación rutinaria. Dichas características son las que demuestran la capacidad de un
método analítico para mantener a lo largo del tiempo ¨ los criterios fundamentales de
validación¨. Las características de fiabilidad comprenden los cinco criterios
fundamentales de validación. (No necesariamente aplicados a todos los casos) y de los
que derivan en la práctica todos los parámetros de validación (AEFI, 2001):
Selectividad
Linealidad
Rango
Precisión
Exactitud
Limite de Cuantificación
Limite de Detección
Los requisitos de las pruebas farmacopeicas varían desde valoraciones analíticas muy
rigurosas hasta evaluaciones de tributos subjetivos. Considerando esta amplia variedad,
es lógico que diferentes procedimientos de prueba requieran diferentes esquemas de
validación. A continuación se indican las categorías de pruebas más habituales para
las que se exigen datos de validación según la USP 30:
Categoría I: los procedimientos analíticos para la cuantificación de los componentes
principales de fármacos a granel o ingredientes activos (incluyendo concertantes) en
productos farmacéuticos terminados.
Categoría II: los procedimientos analíticos para la determinación de impurezas en
fármacos a granel o de productos de degradación en productos farmacéuticos
terminados. En estos análisis incluyen análisis cuantitativos y pruebas de límite.
Categoría III: los procedimientos analíticos para la determinación de las características
de desempeño (por ejemplo, disolución, liberación del fármaco).
Categoría IV: pruebas de identificación

26
Para cada categoría se requieren diferente información analítica. En la Tabla 2 se
indican los elementos de datos que normalmente se requieren para cada una de estas
categorías.
La validez de un procedimiento analítico puede verificarse solo mediante estudios de
laboratorio, por lo tanto, la documentación de la finalización con éxitos de dichos
procedimientos constituye un requisito básico para determinar si un procedimiento es
adecuado para su aplicación prevista.
Tabla 2. Datos Requeridos para la Validación de Métodos Analíticos (USP 30)
Categoría II
Características de Desempeño
Analítico
Categoría I
Pruebas de Limite Cuantitati
vas
Pruebas de Limite
Cualitativas y Limite
Categoría III
Categoría IV
Exactitud Si Si * * No
Precisión Si Si No Si Si
Repetibilidad Si No Si No
Precisión Inmediata
Si No Si No
Especificidad Si Si Si * Si
Limite de Detección
No No Si * No
Limite de Cuantificación
No Si No * No
Linealidad Ni Si No * No
Intervalo Si Si * * No
* Pueden requerirse, dependiendo de la naturaleza de la prueba especifica.

27
3.7 CARACTERÍSTICAS DEL DESEMPEÑO ANALÍTICO
La validación de un procedimiento analítico es un proceso que establece, mediante
estudios en el laboratorio, que las características de desempeño del procedimiento
cumplen con los requisitos para las aplicaciones analíticas previstas. Las características
de desempeño analítico habituales que deben considerarse en la validación de los tipos
de procedimientos farmacopeicos, se indican y describen a continuación (USP 30):
3.7.1 SELECTIVIDAD
3.7.1.1 Definición
La capacidad de un método para determinar el analito sin interferencias de impurezas,
productos de degradación, excipientes u otras sustancias presentes en la muestra, se
relaciona con el término de selectividad. La selectividad es la capacidad de un método
analítico para medir y/o identificar simultánea o separadamente los analitos de interés
de forma inequívoca, en presencia de otras sustancias químicas que pueden estar
presentes en la muestra. (AEFI, 2001)
Frecuentemente el termino especificidad se utiliza como sinónimo del anterior, aunque
debería reservarse para aquellas situación donde la respuesta obtenida solo se puede
producir con una única entidad química, algo que no es posible cuando se refiere
procedimientos analíticos que emplea instrumentación no especifica. Como hay pocos
métodos que den respuesta sólo a un único analito, el termino selectividad es
normalmente mas apropiado. (AEFI, 2001)
La presencia de interferencias puede tener distintos efectos en la determinación del
analito como:
Imposibilitar su inequívoca identificación (aparición de falsos positivos).
Distorsionar la respuesta del analito (afecta normalmente a la pendiente y ordenada en
el origen de la recta de calibrado). Este efecto puede delatar la presencia de
interferencias desconocidas, aunque también puede ser consecuencia de
recuperaciones no lineales.
La selectividad de un método analítico se debería determinar antes de iniciar el estudio
de cualquier otro parámetro de validación, dado que debe conocerse en que grado la
respuesta del método es únicamente proporcionada por el analito, sin interferencia de
otras sustancias relacionadas con él de una u otra forma. (AEFI, 2001)

28
3.7.1.2 Ámbito de aplicación
En el análisis farmacéutico la tendencia mayoritaria es la utilización de métodos lo mas
selectivas posibles, en los que la presencia de otros componentes tiene escasa
influencia en los resultados. De hecho es muy difícil declarar que no existe interferencia
en la determinación de un analito por que siempre existe la posibilidad de encontrar
alguna sustancia, hasta el momento desconocida, que interfiera. También se puede dar
el caso contrario, de hallar alguna posible interferencia que en la práctica diaria sea
improbable que se produzca. (AEFI, 2001)
Para efectuar estudios de selectividad se precisa la máxima información sobre
impurezas y productos de degradación potencialmente presentes en la muestra, así
como posibles interferencias debidas a excipiente u otros componentes. (AEFI, 2001)
Los criterios de selectividad que debe satisfacer un método puede diferir dependiendo
de la finalidad con la que se aplique. El grado de selectividad asociado a un método
adquiere mayor relevancia según su finalidad. En un método de control de calidad de
rutina la exigencia de alguna interferencia se podría aceptar si esta es conocida y de
magnitud aceptable. En estos casos la selectividad puede entrar en conflicto con el
coste y el tiempo necesario para la determinación del analito. (AEFI, 2001)
Las conclusiones de los estudios de selectividad están vinculadas al origen de la
muestra, la optimización de la preparación, la especificidad de la medida y las
condiciones instrumentales. (AEFI, 2001)
3.7.1.2.1 Según el objetivo de ensayo
El estudio de la selectividad varia según el objetivo del ensayos; ensayo de
identificación, ensayos de pureza y/o determinación cuantitativa de un compuesto o
riqueza de un principio activo.
Cuando el objetivo del ensayo es la determinación cuantitativa de un compuesto o
riqueza de un principio activo, el método debe evitar la interferencia de excipientes,
productos de degradación y/o impurezas en la respuesta proporcionada por el
compuesto o el principio activo objeto de la evaluación analítica. (AEFI, 2001)
3.7.1.2.2 Según la técnica analítica aplicada
El estudio de la selectividad varía también según la técnica analítica aplicada; ensayos
específicos, ensayos absolutos y ensayos separativos. (AEFI, 2001)

29
3.7.2 LINEALIDAD
3.7.2.1 Definición
La linealidad es la capacidad del método para proporcionar resultados que son
directamente (o promedio de transformaciones matemáticas) proporcionales a la
concentración del analito en la muestra dentro de un rango establecido. Siempre que
sea posible se busca una respuesta de tipo lineal que facilitara su trazado, interpolación
e interpretación. (AEFI, 2001) La linealidad en un procedimiento analítico es su
capacidad para obtener resultados de prueba que sean proporcionales ya sea
directamente, o por medio de una transformación matemática bien definida, a la
concentración del analito en muestras en un intervalo dado. La linealidad se refiere a la
relación entre la concentración y la medida de valoración. El objetivo es obtener un
modelo que describa con precisión la relación de la concentración versus respuesta, ya
sea lineal o no. (USP 30).
El rango se define como el intervalo entre la concentración superior e inferior de analito
para el cual se ha demostrado la correcta precisión, exactitud y linealidad del método
descrito. (AEFI, 2001)
Aunque el proceso lógico consistiría en evaluar cuales son los limites de concentración
en los que el método analítico pierde su linealidad, normalmente se toma como punto de
partida un intervalo de concentraciones ya establecido de acuerdo con la experiencia, el
conocimiento analítico de la técnica empleada y principalmente en función de las
especificaciones. (AEFI, 2001)
El intervalo de un procedimiento analítico es la amplitud entre las concentraciones
inferiores y superior de analito en el cual se puede determinar al analito con un nivel
adecuado de precisión, exactitud y linealidad utilizando el procedimiento según se
describe por escrito. El intervalo normalmente se expresa en las mismas unidades que
los resultados de la prueba obtenidos mediante el procedimiento analítico. (USP 30)
El intervalo del procedimiento se valida verificando que el procedimiento analítico
proporciona precisión, exactitud y linealidad aceptables cuando se aplica a las muestras
que contienen el analito en los extremos del intervalo al igual que dentro del intervalo.
La ICH recomienda que, para establecer la linealidad se utilicen normalmente un mínimo
de cinco concentraciones. También recomienda que se consideren los intervalos
especificados mínimos que se indican a continuación (USP 30):

30
Valoración de un fármaco o de un producto terminado: de 80% a 120% de la
concentración de la prueba.
Determinación de una impureza: de 50% a 120% del criterio de aceptación.
Para uniformidad del contenido: un mínimo de 70% a 130% de la concentración de la
prueba, a no ser que justifique un intervalo mas amplio o mas apropiado, basándose en
la naturaleza de la forma farmacéutica.
3.7.2.2 Ámbito de aplicación
Según la guía ICH Q2A se estudia la linealidad en todos los métodos de tipos
cuantitativo:
Valoración del contenido de principio activo
En la especialidad farmacéutica los límites de especificaciones suelen establecerse
entre 95 – 105% a liberación, 90 – 110% a caducidad, respecto al valor nominal. En
materia prima los límites son 98 – 102% o 99 – 101%. Debido a esto se suele evaluar la
linealidad de los métodos en un rango más amplio, las ICH recomiendan del 80- 120%.
3.7.3 PRECISION
3.7.3.1 Definiciones
La precisión expresa el grado de concordancia (grado de dispersión) entre una serie de
medidas de tomas múltiples a partir de una misma muestra homogénea en las
condiciones prescritas. La procedencia de las muestras destinadas al estudio de
precisión puede ser de muestras reales o preparadas en el laboratorio.
El objeto del estudio de la predicción es conocer la variabilidad o el mas-menos del
método de ensayo. Esta variabilidad es debida a errores aleatorios inherentes a todo
método de ensayo. Como consecuencia de la existencia de estos errores, los análisis
efectuados sobre muestras idénticas, en las mismas circunstancias, no conducen
generalmente a resultados idénticos. Los factores susceptibles a influir sobre los
resultados de un ensayo no pueden ser siempre controlados (analista, equipo
instrumental, reactivos, tiempo, entre otros.) de aquí la importancia del estudio de la
precisión (AEFI, 2001)

31
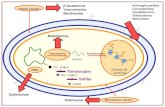
3.7.3.2 Diferentes tipos de estudio en la precisión
Figura 2. Diferentes tipos de estudio en la precisión
En la tabla (Huber, 1999) se resumen los factores que pueden o no variar en el estudio
de repetibilidad, precisión intermedia y reproducibilidad.
Tabla 3. Variación de factores en el estudio de la precisión
Precisión Repetibilidad Inmediata
Reproducibilidad
Instrumento Igual diferente diferente DIA de análisis Igual diferente diferente
Analista Igual diferente diferente
Otros factores Igual diferente diferente
Laboratorio igual Igual diferente
3.7.3.2.1 Repetibilidad
Estudia la variabilidad del método efectuando una serie de análisis sobre la misma
muestra en las mismas condiciones operativas (por un mismo analista, con los mismos
aparatos y reactivos, entre otros), en un mismo laboratorio y en un periodo de tiempo
corto. (AEFI, 2001)
La repetibilidad se expresa matemáticamente por el coeficiente de variación (desviación
estándar relativa) de una serie de medidas.
Uno de los factores que pueden influir en la repetibilidad del método de análisis es la
concentración del analito, ya que la desviación estándar de las respuestas obtenidas
aumenta al disminuir la concentración del analito. Por otro lado el valor aceptado del
coeficiente de variación depende del intervalo de aceptación especificado en el método
de análisis. El numero de replicas se deduce a partir del coeficiente de variación de
repetibilidad del método. (AEFI, 2001)
PRECISION
Repetibilidad Del M étodo
Reproducibilidad Precisió n inmediata Repetibilidad
Repetibilidad Instrumental

32
3.7.3.2.1.1 Repetibilidad del sistema instrumental
Este parámetro estudia la variabilidad debida únicamente al instrumento y se determina
analizando repetidamente una misma muestra de forma consecutiva de 6 a 10 veces.
En el caso que se analice el principio activo de una materia prima o de una
especificación farmacéutica se prepara la muestra a la concentración nominal. (AEFI,
2001)
3.7.3.2.1.2 Repetibilidad del método
El ensayo de repetibilidad del método se efectúa sobre una serie de alícuotas de una
muestra homogénea que se analiza independientemente desde el principio (preparación
de la muestra) hasta el final (lectura de resultados) por el mismo instrumento y mismo
analista. Se proponen dos alternativas para realizar este estudio: un mínimo de 6
muestras a la concentración nominal. (AEFI, 2001)
3.7.3.2.2 Precisión inmediata
Estudia la variabilidad del método efectuado una serie de análisis sobre la misma
muestra pero en condiciones operativas diferentes (diferentes analistas, aparatos, días,
entre otros) y en un mismo laboratorio. El objeto del estudio de precisión inmediata es
determinar la variabilidad del método efectuando una serie de análisis sobre la misma
muestra, en un mismo laboratorio pero en condiciones operativas diferentes. (AEFI,
2001)
3.7.3.2.3 Reproducibilidad
Estudia la variedad del método bajo condiciones operativas diferentes y en distintos
laboratorios. La reproducibilidad de dicho método de análisis se determina analizando
una serie de alícuotas procedentes de lotes homogéneos en diferentes laboratorios,
diferentes analistas y utilizando condiciones operativas y ambientales distintas pero
siguiendo el procedimiento descrito en el método. (AEFI, 2001)
La reproducibilidad también es definida como la medida de la precisión de los resultados
de ensayos realizados sobre la misma muestra homogénea, pero ejecutados por
diferentes analistas en días diferentes. (Calpena AC. et al, 1991)
3.7.3.3 Ámbito de aplicación
Según la ICH Q2B el estudio de precisión se debe realizar únicamente para la
determinación cuantitativa de principios activos y cuantificación de impurezas. Por lo

33
tanto la evaluación de la precisión no es necesaria ni en el ensayo de identificación ni
en el test limite de impurezas. (AEFI, 2001)
3.7.4 EXACTITUD
3.7.4.1 Definición
La exactitud de un procedimiento analítico expresa la proximidad entre el valor que es
aceptado convencionalmente como el valor verdadero o un valor referencia y el valor
experimental encontrado. No debe confundirse la exactitud y predicción, la precisión
esta relacionada con la dispersión de una serie de mediciones, pero no da ninguna
indicación de lo cerca que esta del valor verdadero. Se puede tener mediciones muy
precisas pero poco exactas; sin embargo, para que un método sea exacto se requiere
un cierto grado de precisión. (AEFI, 2001)
De la definición de exactitud surge el principal problema: cual es el valor verdadero del
analito en la muestra?, el valor verdadero en muchos casos se desconoce. No obstante,
cuando se dispone de patrones de referencia certificados, el valor de dicho patrón es el
que se acepta como valor verdadero y la exactitud puede evaluarse aplicando el método
sobre dicho patrón, o bien analizando muestras de placebo o de problema a las que se
ha añadido una cantidad conocida de dicho patrón. También se acepta la comparación
de resultados con un método de referencia validado del que ya se ha demostrado su
exactitud; entonces el valor verdadero es el que se obtiene con dicho método de
referencia y se compara con el valor hallado con el método nuevo que se quiere validar.
(AEFI, 2001)
3.7.4.2 Ámbito de aplicación
Según la guía (ICH, Q2A) debe ensayarse la exactitud en métodos de análisis para la
valoración en materia prima y en producto terminado y en métodos de análisis de
cuantificación de impurezas, según la USP 30 también debe evaluarse en métodos de
análisis de estudios de la velocidad de disolución.
3.7.4.3 Procedimiento de determinación de la exactitud
La exactitud debe demostrarse en todo el rango especificado para el método analítico
Se recomienda un mínimo de 9 determinaciones sobre 3 niveles de concentración del
analito que cubran el rango especificado. En función del tipo de método a validar y de
cada caso concreto se deberá tener en cuenta el rango de concentraciones de trabajo:
Riqueza de un principio activo en materia prima o en producto acabado: 80 – 120%

34
Impurezas: desde el 50% del nivel de especificación hasta el 120% de dicho nivel.
La exactitud se expresa como porcentaje de recuperación en la valoración de una
cantidad conocida de analito añadida sobre la muestra o como la diferencia entre la
media obtenida y el valor aceptado como verdadero junto con los intervalos de
confianza. (AEFI, 2001)
3.7.4.4 Determinación
En la valoración de un fármaco, la exactitud puede determinarse mediante la aplicación
del procedimiento analítico con respecto a un analito de pureza conocida (por ejemplo
un estándar de referencia), o comparando los resultados del procedimiento con los de
un segundo procedimiento bien caracterizado, cuya exactitud se haya comprobado o
definido. En la valoración de un fármaco en un producto formulado, la exactitud puede
determinarse mediante la aplicación del procedimiento analítico a mezclas sintéticas de
los componentes del producto farmacéutico al que se hayan añadido cantidades
conocidas de analito dentro del intervalo de procedimiento. Si no resulta posible obtener
muestras de todos los componentes del producto farmacéutico, se puede aceptar tanto
el agregado de cantidades conocidas del analito al producto farmacéutico (¨Spike¨)
como la comparación de los resultados con los de un segundo procedimiento bien
caracterizado, cuya exactitud haya sido comprobada o definida. (USP 30)
En el análisis cuantitativo de impurezas, la exactitud debe evaluarse en muestras (del
fármaco o producto farmacéutico) a las que se les hayan agregado cantidades
conocidas de impurezas. Cuando no sea posible obtener muestras de algunas
impurezas o de productos de degradación, los resultados deben compararse con los
obtenidos mediante un procedimiento independiente. En ausencia de otra información,
puede resultar necesario calcular la cantidad de una impureza basándose en la
comparación de su respuesta con la del fármaco, pero el cociente entre las respuestas
de cantidades iguales de la impureza y del fármaco (factor de respuesta relativo) debe
ser utilizado siempre que se le conozca. (USP 30)
La exactitud se calcula como el porcentaje de recuperación de la cantidad valorada con
respecto a la cantidad conocida de analito añadida a la muestra, o como la diferencia
entre la medida de la valoración y el valor verdadero aceptado, considerando los
intervalos de confianza. (USP 30)
La evaluación de la exactitud puede efectuarse de varias maneras, incluyendo la
evaluación de la recuperación del analito (porcentaje de recuperación) en todo el

35
intervalo de la valoración, o evaluando la linealidad de la reacción entre las
concentraciones estimadas y las reales. El criterio estadístico de preferencia es que el
intervalo de confianza para la pendiente este comprendido dentro de un intervalo
definido al rededor de 1.0; o alternativamente, que el valor de la pendiente sea cercano
a 1.0. En ambos casos, tanto el intervalo como la definición de cercanía deberían
especificarse respectivamente en el protocolo de validación. El criterio de aceptación
dependerá de la valoración, de su variabilidad y del producto. No es aceptable basar un
criterio de aceptación basado en la falta de significancía estadística para la hipótesis
nula de que la pendiente es 1.0. (USP 30)
3.7.5 LIMITE DE DETECCION Y LÍMITE DE CUANTIFICACION
3.7.5.1 Definición
Dado un método analítico determinado, se entiende por límite de cuantificación (LQ) de
dicho método, la mínima cantidad de analito presente en la muestra que se puede
cuantificar, bajo las condiciones experimentales descritas, con una adecuada predicción
y exactitud. El límite de cuantificación es una característica de las valoraciones
cuantitativas de compuestos que se encuentran en baja concentración en la matriz de
una muestra. (AEFI, 2001)
El límite de detección (LD) se define como la mínima cantidad de analito en la muestra
que se puede detectar aunque no necesariamente cuantificar bajo dichas condiciones
experimentales. El límite de detección es una característica de las pruebas de límite. La
cantidad mínima de la muestra que puede detectarse, aunque no necesariamente
cuantificarse, en las condiciones experimentales indicadas. Las pruebas de límite
simplemente comprueban que la cantidad del analito se encuentra por encima o por
debajo de un nivel determinado. El límite de detección se expresa habitualmente en
forma de concentración de analito (por ejemplo, porcentaje, partes por millón, entre
otras). (AEFI, 2001)
El limite de cuantificación es por lo tanto un termino cuantitativo mientras que el limite de
detección es solo cualitativo, encontrándose en ambos términos un rango de
concentraciones en el que si bien no se puede cuantificarse el analito en cuestión con
razonable certeza, si puede detectarse su presencia sin incurrir en falsos positivos.
(AEFI, 2001)

36
3.7.5.2 Ámbito de aplicación
Se establece necesaria la determinación del límite de detección en métodos de análisis
destinados a la evaluación de impurezas mediante ensayos límite. Esto es ensayos en
los que simplemente se determina si la cantidad de impurezas presente en la muestra
es superior o no al límite establecido en especificaciones, sin dar un valor numérico. Se
trata de demostrar de esta forma que el método es realmente capaz de detectar la
concentración límite y superiores. Por el contrario se considera necesario establecer
únicamente el limite de cuantificación en métodos destinados a la determinación
numérica de impurezas; y es aquí donde puede surgir la primera duda, puesto que hoy
en día la pureza de gran parte de los principios activos farmacéuticos se define a partir
de una serie de test limites de impurezas conocidas y desconocidas junto, con la suma
total de estas, y parece obvio que si se a de dar finalmente una suma porcentual del
contenido de impurezas, previamente estas se han de haber cuantificado con suficiente
precisión y exactitud; siempre que se deba dar un valor numérico al total de impurezas
se reconoce implícitamente la necesidad de determinar el limite de cuantificación para
cada una de ellas.
Cuando el método se define como un método de análisis de valoración de contenido
en el cual siempre se trabaja en rangos muy alejados de la mínima cantidad detectable
o cuantificable por el equipo, no seria necesaria la determinación de estos parámetros(
AEFI, 2001)
3.7.5.3 Procedimientos de determinación del límite de detección (LD) y límite de cuantificación (LQ)
Método basado en el examen visual
Según ICH Q2B, tanto el LD como el LQ podrían determinarse a partir del análisis de
muestras con concentraciones conocidas y decrecientes del analito, estableciéndose
visualmente la mínima concentración detectable como aquella concentración limite que
permite cuantificar con razonable precisión y exactitud la señal obtenida. (AEFI, 2001)
3.7.6 ROBUSTEZ
3.7.6.1 Definición
La guía ICH, Q2A define la robustez de un método analítico como la medida de su
capacidad para permanecer inalterado ante pequeñas pero deliberadas variaciones en
ciertos parámetros, proporcionando idea de su fiabilidad o estabilidad durante su

37
empleo. Es por lo tanto la capacidad que demuestra el procedimiento de análisis para
proporcionar resultados validos en presencia en presencia de pequeños cambios
respecto de las condiciones descritas en el método, susceptibles de producirse durante
su utilización. (AEFI, 2001)
La robustez de un procedimiento analítico es una medida de su capacidad para no
resultar afectando por variaciones pequeñas pero deliberadas en los parámetros
enumerados en la documentación del procedimiento, y a la vez, da una idea de su
aptitud durante su uso normal. La robustez puede determinarse durante la etapa de
desarrollo del procedimiento analítico. (USP 30)
La robustez (Robustness) no debe confundirse con el termino Ruggedness. Este ultimo
no se menciona en las guías ICH, pero si en la farmacopea USP. Esta define el termino
Ruggedness como el grado de reproducibilidad de los resultados mediante el análisis
de las mismas muestras bajo una variedad de condiciones tales como diferentes
laboratorios, diferentes analistas, diferentes instrumentos, lotes de reactivos, días,
tiempos diferentes temperaturas, entre otros. (AEFI, 2001)
3.7.6.2 Ámbito de aplicación
Aunque la USP define la robustez junto con los parámetros de validación de un método
analítico, no es considerado, todavía, un requisito necesario para registro de
especialidades, sino que se trata de un estudio que sugirió con el fin de resolver los
problemas que se planteaban en la transferencia de métodos analíticos entre
laboratorios. Las guías ICH recomienda incluir la robustez en una fase apropiada del
desarrollo del método y no en la validación propiamente dicha , dado que si la robustez
del método no se comprueba con anterioridad a iniciar la validación, puede suceder que
se intente validar un método poco robusto, con lo consiguientes malos resultados y
perdida de tiempo y dinero. Incluso después de realizar el estudio de robustez podría
concluirse que se debe modificar algún parámetro del método, obligando a la
consiguiente revalidación de los puntos necesarios. De hecho la consecuencia directa
de los resultados del estudio de robustez ha de ser la definición razonada del test de
idoneidad del método, que en muchas ocasiones es fijado de una forma arbitraria y sin
saber la ciencia cierta si los requisitos que impone son realmente necesarios o limitan la
realización del método a unas condiciones escasamente reproducibles.(USP, 30)
Todos los métodos, sea cual sea la técnica empleada, son susceptibles a ser sometidos
a un estudio de robustez. Algunos pueden tener muchos parámetros sobre los que

38
actuar y otros menos. Además estos no tienen por que ser solo factores relacionados
con la medida final, sino que pueden ser de cualquier etapa del procedimiento analítico,
Por esto la primera etapa del estudio es precisamente analizar todo el método y definir
que factores son los que se espera que influyan mas en el resultado final. (AEFI, 2001)
3.7.7 ESPECIFICIDAD
3.7.7.1 Definición
Los documentos ICH definen especificidad como la capacidad de evaluar de manera
inequívoca el analito en presencia de aquellos componentes cuya presencia resulta
previsible, como impurezas, productos de degradación y componentes de la matriz. La
falta de especificidad de un procedimiento analítico individual puede compararse
utilizando otros procedimientos analíticos complementarios otras autoridades
internacionales de reconocido prestigio (IUPAC, AOAC-I) han preferido el termino
selectividad reservando especificidad para procedimientos que resulten completamente
selectivos. Para las pruebas que se indican a continuación, la definición anterior tiene
las siguientes consecuencias (USP 30):
Pruebas de identificación: garantiza la identidad del analito.
Pruebas de Pureza: garantiza que todos los procedimientos analíticos efectuados
permiten declarar con exactitud el contenido de impurezas de un analito.
Valoraciones: proporcionan un resultado exacto, que permitan una declaración exacta
del contenido o potencia del contenido en una muestra.
3.7.7.2 Determinación
En análisis cualitativos (pruebas de identificación), debe demostrarse la capacidad de
distinguir compuestos de estructura estrechamente relacionada cuya presencia resulta
probable. Esta capacidad debería confirmarse mediante la obtención de resultados
positivos a partir de muestras que contengan el analito (quizás mediante comparación
con un material de referencia conocido), junto con los resultados negativos de dicha
muestra que no contengan dicho analito y mediante la confirmación que no se obtiene
una respuesta positiva de materiales con estructura similar o estrechamente relacionada
a la del analito. (USP 30)
En un procedimiento analítico para impurezas, la especificidad puede establecerse
mediante la adición al fármaco o producto farmacéutico de una cantidad conocida de

39
impurezas en concentraciones adecuadas y la demostración de que esas impurezas se
determinan con exactitud y precisión adecuadas. (USP 30)
En una valoración, la demostración de especificidad requiere evidencia que el
procedimiento no resulta afectado por la presencia de impurezas o excipientes. En la
práctica esto puede hacerse agregando al fármaco o producto farmacéutico una
cantidad conocido de excipientes o de impurezas en concentraciones adecuadas y
demostrando que el resultado del análisis no resulta afectado por la presencia de estos
materiales extraños. (USP 30)
Si no dispone de estándares de impurezas o de los productos de degradación, puede
demostrarse la especificidad comprobando los resultados de las muestras que
contengan impurezas o productos de degradación con los de un segundo procedimiento
bien caracterizado (por ejemplo un procedimiento farmacopeico u otro procedimiento
validado). Estas comparaciones deberían incluir muestras sometidas a condiciones
forzadas relevantes (por ejemplo, luz, calor, humedad, hidrólisis acida, hidrólisis alcalina,
oxidación, entre otros.) en una valoración deben comparece los resultados; en pruebas
de impurezas cromatoqraficas, deben compararse los perfiles de impurezas. (USP 30)
3.8 VALORACION MICROBIOLOGICA DE ANTIBIOTICOS
3.8.1 Generalidades
Bajo las condiciones adecuadas, la actividad (potencia) de los antibióticos puede
demostrarse por su efecto inhibidor sobre los microorganismos. En consecuencia las
valoraciones microbiológicas o biológicas siguen siendo, por lo general, el estándar para
disipar dudas en cuanto a la posible perdida de la actividad. (USP 30)
La potencia de un antibiótico se estima mediante la comparación de la actividad de un
producto (problema) y la de una muestra de referencia (patrón) en presencia de un
microorganismo testigo. (AEFI, 2001)
3.8.2 Definiciones
3.8.2.1 Valoración de antibióticos
La valoración de antibióticos se puede efectuar por difusión en agar o turbimetria,
dependiendo de la naturaleza de la muestra a ensayar. La base de los ensayos por
difusión en agar, es que la respuesta obtenida frente a distintas dosis de antibióticos
son proporcionales a los diámetros de los halos de inhibición; en los ensayos
turbimetricos la respuesta se mide en forma de turbidez. (AEFI, 2001)

40
Básicamente la valoración de antibióticos por difusión en agar se fundamenta en la
difusión del antibiótico desde un cilindro vertical (o desde una perforación circular en el
agar) a través de una capa de agar solidificada en una placa de petri hasta inhibir
totalmente el crecimiento del microorganismo añadido, en un área circular o zona de
inhibición entorno al cilindro que contiene una solución antibiótico. El método
turbidimetrico se basa en la inhibición del crecimiento de un cultivo microbiano en una
solución uniforme del antibiótico en un medio líquido que promueva su rápido
crecimiento en ausencia del antibiótico. (USP 30)
3.8.2.2 Potencia real o verdadera
La potencia de la materia o producto acabado cuando se realiza el ensayo. (AEFI, 2001)
3.8.2.3 Potencia asignada
Es el valor nominal asignado a un producto acabado a partir de la potencia de la
materia prima. (AEFI, 2001)
3.8.2.4 Potencia estimada
Potencia calculada a partir de los datos del ensayo. (AEFI, 2001)
3.8.2.5 Limites de confianza (Intervalo de confianza)
La Farmacopea aplica como intervalo de confianza el que se calcula con probabilidad
de 95% sobre el valor real obtenido, no obstante, se puede calcular con otro nivel de
probabilidad. (AEFI, 2001)
3.8.3 METODO
El diseño mas simple para esta prueba es un ensayo con una curva estándar. Para ello
se prepara el patrón a 5 concentraciones o dosis (A, B, C, D, E) que mantengan entre si
una relación logarítmica, y una solución de la preparación a ensayar a una
concentración teórica equivalente a la intermedia del patrón (C). Se considera el ensayo
como preliminar si la potencia de la muestra una vez interpolada en la curva construida
con las respuestas del patrón es inferior al 80% o superior al 120%. En tal caso se
debe preparar la muestra a una concentración teórica mas centrada a la del patrón y
repetir el ensayo. Otro diseño seria del cuadrado latino, en el que la potencia del
problema se determina por comparación entre una recta constituida por el patrón y otra
constituida por el problema. (AEFI, 2001)

41
Los sistemas biológicos presentan una variabilidad que obliga a tener diferentes criterios
para verificar y realizar ensayos. Realmente la verdadera potencia se puede encontrar
dentro de un rango de valores que vendrá definido por los límites de confianza de error
calculados para el ensayo, que nos dará los valores de los extremos con una
probabilidad de un 95%.( AEFI, 2001)
El grado de precisión requerido depende de los límites de aceptación. Una especialidad
acabada con un intervalo de aceptación del 95-105% o del 90-110% requiere un numero
de replicas bajo (n= 2-3). Si los limites de aceptación son mas estrechos (98-102%) el
numero de replicas debe ser mucho mayor (n≥ 6). (AEFI, 2001)
3.8.4 Validación
El ensayo debe diseñarse de tal forma que permita examinar la validez del método
matemático en el que se basa la ecuación de la potencia. Si se escoge el modelo de
líneas paralelas, las dos líneas de logaritmos de dosis-respuesta deben ser paralelas, y
lineales en el rango de dosis usadas en el cálculo. Estas condiciones deben verificarse
por ensayos de validación con una probabilidad P= 0.05. Pueden usarse otros modelos
matemáticos si se demuestra su validez. (AEFI, 2001)
Los pasos a seguir para la validación de una valoración de antibióticos son según la
USP 30
3.8.4.1 Linealidad
Demostrar que la recta de regresión constituida con el logaritmo de la dosis de
antibiótico patrón y la respuesta cumple con los parámetros de regresión lineal y análisis
de la varianza.
Demostrar que la recta de regresión construida con la muestra de producto acabado que
contiene el antibiótico a las mismas dosis que la recta patrón, presenta una relación Log.
Dosis-respuesta que cumple con los parámetros de regresión lineal y análisis de
varianza.
3.8.4.2 Repetibilidad (Precisión)
Se determina a partir de un blanco de excipientes al que se le añade la cantidad de
antibiótico correspondiente al 100% teórico. Después de realizar la valoración (9
replicas) se obtienen unos resultados con los cuales se calcula:
La media, la desviación estándar (variabilidad del método), la desviación estándar de la

42
media, coeficiente de variación, limites de confianza de la media y la tolerancia, que
expresa la variabilidad del método respecto al intervalo entre las especificaciones
superior e inferior.
3.8.4.3 Exactitud
Para determinar la exactitud se preparan tres alícuotas de un blanco con los excipientes,
se añaden a una de ellas la cantidad de antibiótico correspondiente al limite inferior de
aceptación, en la otra alícuota se añade la cantidad correspondiente al 100% y en la
tercera la cantidad correspondiente al limite superior de aceptación. Se efectúan las
valoraciones de cada una de las alícuotas y con los resultados obtenidos se comprueba
que se cumplan los parámetros estadísticos que definen la exactitud:
Homogeneidad de varianzas, Test t de Student y determinación del sesgo o error
determinado
3.8.4.4 Selectividad
Se determina analizando por duplicado el blanco de excipientes. Si el resultado no es
cuantificable se demuestra la selectividad del método. Si la respuesta es cuantificable,
se deberá tener en cuenta la misma en la obtención de resultados. En estos casos se
debe determinar cual es el producto que interfiere, y tratar de eliminarlo (por dilución o
por neutralización) o bien añadirlo a los patrones, de forma que tanto los patrones como
los problemas tengan la misma concentración de sustancia interferente. (AEFI, 2001)

43
4. FORMULACION DEL PROBLEMA
La vocación de la industria farmacéutica permanentemente ha sido producir
medicamentos de calidad y con total garantía de seguridad. La calidad de los
medicamento se logra en todos y cada uno de los pasos de su proceso de producción,
desde su investigación hasta el último análisis sobre el producto final, debido a que al
elaborar un producto destinado a curar la enfermedad, salvar vidas o mejorar la calidad
de vida ya sea humana o animal, no puede haber el mínimo margen para el error (García,
M. 2001).
Alcanzar un alto nivel de calidad de los medicamentos requiere garantizar que cada una
de las etapas de la producción se realice de forma adecuada y cumpliendo aquellos
parámetros de calidad que se han establecido previamente. Con los años, se han ido
desarrollando recomendaciones e incorporando requerimientos que han evolucionado
hasta una reglamentación estricta. Sin embargo, a pesar de los esfuerzos de control y
fabricación, se exige una mejora continua y máximas garantías de la calidad y este
máximo grado de seguridad tan solo lo proporcionan los procesos de validación (García,
M. 2001).
Para el desarrollo químico-farmacéutico de un medicamento es necesario e indispensable
la utilización de un método analítico que permita cuantificar el producto mayoritario en
forma de materia prima o como ingrediente activo de una formulación. (Rampazoo P,
1990) La valoración microbiológica de antibióticos es un método analítico que nos
proporciona información del contenido o potencia del analito de interés en una muestra,
su implementación en el control de calidad de productos farmacéuticos terminados
permite cumplir con las exigencias legales, asegurar la calidad y eficacia del producto
para salir al mercado. Razón por la cual se debe asegurar que el métodos analíticos sea
sometido a un proceso de validación, por medio del cual se compruebe si el método es lo
suficientemente confiable, adecuado para el propósito y aplicación analítica propuesta y si
los resultados previstos se obtienen dentro de las condiciones prefijadas.
La utilización de métodos analíticos, adecuados para el propósito, permite obtener
resultados trazables con un nivel apropiado de incertidumbre; dichos resultados
generalmente son usados como base para la toma de decisiones financieras, regulatorias,
entre otros., relacionadas con el desarrollo y fabricación de productos, así como con la
prestación de servicios y otras actividades de importancia en las economías nacionales,
regionales e internacionales.

44
El laboratorio que implementa un método analítico seleccionado para un propósito
determinado, sean éstos normalizados, no normalizados o desarrollados por el
laboratorio, es responsable de verificar su desempeño contra las especificaciones de la
validación, tanto antes de ponerlo en uso como durante su utilización rutinaria, para
demostrar que lo domina y usa correctamente.
Para el cumplimiento del Sistema de Garantía de Calidad la validación es un requisito
imprescindible que está establecido por los entes reguladores en Colombia (INVIMA e
ICA) y por comisiones de Farmacopeas (United States Pharmacopeial Convention USP).

45
5. JUSTIFICACION
VICAR FARMACEUTICA S.A. fabrica y comercializa productos farmacéuticos
veterinarios, posee una línea de más de cuarenta productos en el mercado para la
sanidad animal, dentro de estos productos encontramos antibióticos (Bactran que
poseen como principio activo Bacitracina) a los cuales se les debe garantizar su
efectividad y calidad para lo cual son destinados. La efectividad de estos productos
antimicrobianos, se evalúa para determinar la capacidad de los mismos de otorgar la
protección necesaria o su efecto inhibidor contra cualquier tipo de infección, viral o
bacteriana. Para esto se realiza la valoración microbiológica de antibióticos que nos
permite cuantificar la concentración y la potencia de un principio activo en el fármaco
para obtener una medida del efecto de este comparado con la misma dosis de un
estándar y de esta forma salir al mercado con las características predeterminadas.
En el control de calidad de antibiótico se requiere del análisis específico por medio de
la valoración microbiológica del antibiótico, que sometido a un proceso de validación
garantice de forma consistente y permanente la confiabilidad y validez de los datos
obtenidos y poder así juzgar de la seguridad (calidad) del producto para su
comercialización.
Al validar este método analítico, se obtendrá un procedimiento específico para el
análisis en las condiciones descritas. Se crea evidencia documentada de un alto grado
de confianza, que el procedimiento descrito suministra una serie de direcciones precisas
y definitivas del método analítico que deben seguirse al realizarse y efectuarse en el
laboratorio para garantizar y cumplir los requerimientos de la aplicación analítica
propuesta. La validación de técnica permite no solo el conocimiento del método analítico
que proporciona resultados y datos validos sino también el cumplir con las exigencias
legales tanto del registro de especialidades farmacéuticas como de las Buenas
Prácticas de manufactura de productos farmacéuticos vigentes, que garantizan la
calidad y eficacia del producto. (WHO Technical Report Series, No 823, 1992)
Se buscara la optimización y estandarización del procedimiento de proceso de la técnica,
al estudiar las características de desempeño analítico y al minimiza el número de fallos y
repeticiones permitiendo un importante ahorro de costos. De esta forma se podrá prestar
un servicio a terceros como un laboratorio que establece procesos con procedimientos

46
consistentes, que se llevan a cabo por medio de técnicas y métodos exactos,
reproducibles y sólidos. (WHO Technical Report Series, No 823, 1992)
La norma ISO/IEC 17025 no requiere la validación de los métodos normalizados
aplicados en un laboratorio específico, pero sí establece que se deberán obtener datos
sobre el rendimiento de su propio uso, es decir que siempre resulta apropiado contar
con algún grado de validación, incluso cuando se utilicen métodos normalizados.
Normalmente se asume que los métodos normalizados se pueden aplicar directamente
y que se alcanzarán los niveles de rendimiento publicados por quienquiera que utilice el
método, pero este no es un supuesto seguro. Se debe al menos practicar con el método
a través de un proceso de capacitación para alcanzar una competencia aceptable.
Razón por la cual laboratorio de microbiología de VICAR FARMACEUTICA S.A. debe
establecer el grado de validación requerido de acuerdo con las necesidades del cliente,
con las políticas de calidad, con la naturaleza de los cambios realizados a un método
previamente validado, o con las metas de calidad que se haya trazado como parte de
los procesos de mejoramiento continuo del sistema de calidad, con la finalidad de ser
competente y líder en la industria farmacéutica veterinaria del país. (Sánchez, .2003)
Por otra parte se encuentran las normas ISO 9000 presentes en un manual de calidad
conciso que establece políticas básicas fundamentadas en la descripción de
procedimientos de procesos que reflejen en pocas palabras lo que se hace en la
industria. La norma ISO 9000 busca mejorar y certificar las industrias de manufactura en
el ámbito nacional e internacional mediante la estandarización de cada uno de los
procesos de producción (Teormina, 1997). Al ir realizando la validación de cada uno de
los métodos analíticos que se desarrollan en esta industria farmacéutica se estan
alcanzando las pautas para la certificación de la empresa, alcanzando un alto nivel de
calidad que tiene como resultado el desarrollo, crecimiento y alto grado de
competitividad en la industria farmacéutica a nivel nacional e internacional, ser líder en
prestación de servicios de análisis de laboratorio, tener reconocimiento del alto nivel de
calidad de los productos que ofrece al consumidor, logrando su misión y visión.

47
6. OBJETIVOS
6.1 OBJETIVO GENERAL
Validar el método analítico para la cuantificación de Bacitracina en el laboratorio de
control de calidad de VICAR FARMACEUTICA S.A.
6.2 OBJETIVOS ESPECIFICOS
6.2.1 Desarrollar el proceso de validación del método analítico para la cuantificación de
Bacitracina Zinc.
6.2.2 Desarrollar el proceso de validación del método analítico para la cuantificación de
Bacitracina Metilen Disalicilato.
6.2.3 Evaluar cada una de las características de desempeño analítico para la validación
del método.
6.2.4 Crear evidencia documentada de la declaración de validez de que el método
analítico se ajusta al uso propuesto

48
7. MATERIALES Y METODOS
7.1 Estándar de Referencia
La potencia de los antibióticos en el estudio se estableció en ¨Unidades¨ de actividad.La
¨Unidad¨ de actividad de Bacitracina que se empleo es la establecida y definida según
el maestro federal designado para este antibiótico. De esta forma para el desarrollo del
estudio se empleo el Estándar de Referencia USP de Bacitracina calibrado según el
estándar maestro, de Lote N1E200 y potencia de 75.1 UI/mg, obtenido de la U.S.
Pharmacopeial Convention, Inc.
7.2 Muestras de estudio
La primera muestra que se utilizo en el análisis fue Bacitracina Zinc al 15% como
principio activo, de Lote 20071102-6 y potencia asignada 6006 U/g en base seca
(indicada en el certificado de Análisis por el fabricante).
La segunda muestra utilizada en el análisis fue Bacitracina Metilen Disalicilato al 11%
como principio activo, de Lote LO70701 y la potencia asignada 4.49 U/g en base seca.
(Indicada en el certificado de Análisis por el fabricante).
La planificación y ejecución de las valoraciones microbiológicas de los antibióticos
muestra y la validación de la técnica de cuantificación de Bacitracina se realizó según lo
establecido en la USP con respecto a las especificaciones para Bacitracina descritos en
la técnica de valoraciones microbiológicas de antibióticos y en las especificaciones
descritas para la realización de la validación de los procedimientos farmacopeicos. (USP
30, Antibióticos – Valoraciones Microbiológicas (81) pag.111 y Validación de
Procedimientos Farmacopeicos (1225) pag. 749) También se realizo según la
metodología y parámetros descritos en el Procedimiento Operativo Estándar para
validación de métodos analíticos empleado por Vicar Farmaceutica
Los análisis estadísticos para la Validación del Método Analítico se realizaron utilizando
Statgraphics Plus for Windows 2.0 (1996). Statistical Graphics Corp. Serial Number:
3862216 para la linealidad del sistema y las linealidades del método y se utilizo
Microsoft Office Exel 2007 para el análisis de datos de la precisión, exactitud,
selectividad, especificidad, limite de cuantificación, limite de detección, linealidad del
sistema y linealidad del método.

49
7.3 Preparación y estandarización de la suspensión del microorganismo de ensayo
Basados en la técnica de valoraciones microbiológicas descrita en la USP 30, se
determino:
Microorganismo de prueba para el antibiótico Bacitracina: Micrococcus luteus ATCC
10240
Medio de cultivo (Agar) a emplear para los repiques: tripticasa soya
Método de valoración: difusión en placa
7.3.1 Cultivo bacteriano: la cepa de Micrococcus luteus liofilizada se obtuvo de las
colecciones estandarizadas de la American Type Culture Collection (ATCC). Se
reconstituyo el vial liofilizado y a partir de este cultivo de origen se sembró por
agotamiento en placas con agar tripticasa soya (TSA) (Anexo 1) y en caldo BHI (Anexo
1.) para su recuperación, los medios se incubaron de 32 a 35 oC durante 24 horas.
A partir de los aislamientos del cultivo primario se realizo su identificación a través de
métodos microscópicos mediante tinción de Gram y macroscópicos mediante la
observación de las características de las colonias. Para mantener la viabilidad del
microorganismo durante la validación a partir del cultivo primario se realizaron
subcultivos en placas con TSA cada 3 dias.
7.3.2 Preparación del inoculo: Se preparo una suspensión madre en la que se
adiciono con un asa estéril colonias del microorganismo provenientes de un subcultivo
de Micrococcus luteus ATCC 10240 en 10 ml de solución salina 0.9% estéril utilizando
vortex para homogenizar la muestra hasta que se obtuvo una suspensión con una
turbidez igual al patron de MacFarland con valor de trasmitancía de 25%.Para facilitar la
comparación del patrón de MacFarland y la suspensión de microorganismo se trazo una
línea negra gruesa sobre una hoja de papel y sobre esta se colocaron simultáneamente
los dos tubos, para observar la línea con la misma nitidez en los dos tubos. La población
bacteriana se estimó comparando el grado de turbidez de la solución madre de
Micrococcus luteus ATCC 10240, con el patrón de turbidez de la escala de MacFarland
que presento trasmitancía de 25%.
7.3.3 Determinación de la cantidad de suspensión madre para inoculo: la cantidad
de suspensión madre del microorganismo que se utilizo como inoculo se determino
inoculando diferentes volúmenes de la suspensión madre, comenzando con el volumen

50
sugerido (0.3ml / 100ml medio) para inoculo por la USP 30. Los volúmenes de prueba
que se utilizaron de suspensión madre fueron: 0.3, 0.5, 1.0 y 2.0 ml por cada 100 ml de
medio antibiótico No 1 (Anexo 1). Cada volumen de prueba se hizo por triplicado. Se
agrego 6ml de inoculo sobre cada una de las cajas petri con capa de agar base. Se
dejaron las cajas 45 minutos sobre una superficie plana hasta que el inoculo se
solidificara para perforarlas con el sacabocados de 6 perforaciones y se retiro el residuo
de agar de cada uno de los pozos, en cada pozo se sembró 100 microlitros del la
dilución media del estándar de referencia en una concentración de 1.0 UI/ml. Se
incubaron las placas de 32 a 35 oC durante 18 horas. Después del periodo de
incubación se determino la cantidad de suspensión madre para el inoculo que mostró
una demarcación satisfactoria de las zonas de inhibición obtenida por la relación dosis-
respuesta optima a partir de la cantidad de cultivo del microorganismo en las placas.
(USP, 30)
7.4 Preparación del estándar (Método de la curva patrón)
7.4.1 Diluciones del patrón: La preparación de la solución madre y diluciones de
prueba del estándar se realizaron según lo establecido por la USP 30 en la valoración
microbiológica de antibióticos. Se tomo una muestra del estándar de Bacitracina y se
sometió a secado a 60oC durante 3 horas en horno. Para la solución madre del patrón
se utilizo acido clorhídrico 0.01N como solvente inicial. Se disolvió una cantidad de
16.66mg de Bacitracina seca equivalente 1250UI (Estándar de Referencia USP) en
acido clorhídrico 0.01N en balón aforado de 25ml. La solución se sometió durante 15
minutos a ultrasonido
7.4.2 Diluciones finales del patrón: la valoración se realizo con 10 niveles (desde A
hasta J) del Estándar. Se preparo a partir de la solución madre 10 diluciones en
concentraciones de: 0.05 UI/ml , 0.1 UI/ml , 0.15 UI /ml , 0.20 UI/ml , 0.25 UI/ml , 0.50
UI/ml , 1.0 UI/ml, 1.5 UI/ml, 2.0 UI/ml y 2.5 UI/ml utilizando solución amortiguadora No 1,
1%, pH 6 (Anexo 1) como diluyente ( tabla.4 y 5). La dilución media utilizada fue de 1.0
UI por ml según lo especificado en la USP 30.
Tabla 4. Diluciones de la curva patrón (intervalo de concentraciones 0.1 a 0.25 UI/ml)
Volumen de 0.5 UI/ml (ml) Volumen de Diluyente (ml) Concentracion Final (UI/ml)
2 8 0.13 7 0.154 6 0.25 5 0.25

51
Tabla 5. Diluciones de la curva patrón (intervalo de concentraciones 0.5 a 2.5 UI/ml)
Volumen de Solucion Madre (ml) Volumen de Diluyente (ml) Concentracion Final (UI/ml)1 99 0.51 49 1.03 97 1.52 48 2.0
2.5 47.5 2.5
7.5 Preparación de la muestra
7.5.1 Dilución de la muestra: se determino la cantidad de muestra a pesar para la
valoración del antibiótico presente en el producto a partir de información que
proporciono el fabricante de la potencia asignada al producto en el certificado de
análisis. La primera muestra contiene Bacitracina Zinc al 15% como principio activo, la
potencia calculada es de 5.753 UI/g en base húmeda. La potencia de la muestra se
dividió en el equivalente del estándar para obtener la cantidad de 0.21g de muestra a
pesar para preparar la solución madre. Se disolvió los 0.21g en acido clorhídrico 0.01N
en balón aforado de 25ml. La segunda muestra contiene Bacitracina Metilen Disalicilato
al 11% como principio activo, la potencia calculada es de 4.283 UI/g en base húmeda.
Se determino la cantidad de 0.29g de muestra a pesar para preparar la solución madre.
Se disolvió la cantidad de 0.29g de muestra en acido clorhídrico 0.01N en balón aforado
de 25ml. Las diluciones madre de las muestras se sometieron por 15 minutos a
ultrasonido. Terminado los 15 minutos las soluciones se utilizaron para preparar la
dilución de prueba de la muestra.
7.5.2 Dilución de prueba de la muestra: La valoración se realizo con 10 niveles del
estándar requiriendo un solo nivel de la muestra. De esta forma se diluyo la solución
de la muestra para obtener una concentración igual al nivel medio del estándar (dilución
G de concentración 1.0 UI/ml). La dilución de prueba de la muestra se preparo con 1ml
de solución madre de muestra que se preparo anteriormente aforando en balón de 50 ml
con el mismo diluyente final utilizado para el Estándar de Referencia (solución
amortiguadora No 1, 1%, pH 6). La dilución de prueba de cada una de las muestras se
trabajó en concentración de 1.0 UI/ml igual al nivel medio del estándar.
7.6 Obtención del placebo
Para el estudio no fue posible obtener el placebo de cada uno de los productos a
analizar de esta forma se realizo la inactivación del principio activo para poder analizar
los excipientes presentes en la muestra. Para la desactivar el principio activo se

52
realizaron diluciones madres de cada una de las muestras y se les adiciono 5ml de HCl
1N posteriormente se sometieron 60 minutos a 90 0C en baño de termostatado. Pasado
el periodo de tiempo se adiciono 5 ml de NaOH 1N con el fin de neutralizar la muestra.
Finalmente se afora el balon de 50ml con Buffer 1 al 1% pH6. Se realizaron estudios
para la confirmación de que no existiera actividad ni presencia de la molécula del
principio activo.
7.7 Preparación de placas de valoración
Se prepararon placas de valoración utilizando cajas petri de 90 x 15 mm a las que se
les adiciono 20ml de medio antibiótico No 1.(Anexo 1) se dejo solidificar el medio
durante 40 minutos para formar una capa de agar base lisa. Se agrego 6 ml de inoculo
como capa de siembra, sobre la superficie de la capa de agar base. El inoculo se
preparo adicionando un volumen de 0.5 ml de suspensión madre del microorganismo
Micrococcus luteus ATCC 10240 por cada 100 ml de medio agar antibiótico No 1
fundido a una temperatura de 45 a 50 oC. Se dejo solidificar durante 1 hora. Pasado el
tiempo se perforaron las placas con el sacabocados de 6 perforaciones equidistantes
entre ellas. El residuo de agar en cada perforación fue retirado con pinzas dejando el
pozo disponible para la siembra de muestras a analizar. Las placas de valoración se
rotularon de tal forma que 3 pozos alternos de los seis fueran para la muestra de la
concentración de referencia del patrón del estándar (serie de concentración 1.0 UI/ml) y
los tres pozos restantes se rotularon como muestra. Las placas de valoración una vez
sembradas con la muestra se incubaron de 32-35 oC durante 18 horas para realizar la
lectura del diámetro que presento la zona de inhibición con un calibrador.
7.8 Validación del método de cuantificación del principio activo (USP, 30)
Todos los parámetros y características del desempeño analítico de la validación se
evaluaron para cada tipo de Bacitracina (Bacitracina Zinc y Bacitracina Metilen
Disalicilato)
7.8.1 Especificidad: se verificó la especificidad del método analítico observando la
capacidad de este, de detectar el analito de forma inequívoca sin interferencias de otro
compuesto y/o sustancias químicas diferentes que pueden estar presentes en una
misma muestra. Se prepararon diluciones de las muestras y del estándar de referencia
hasta obtener una concentración de 1.0 UI/ml. Se sembró por separado 100 microlitros
de las muestras, el estándar, el placebo y el diluyente en cajas de valoración. El análisis

53
se realizo con 3 replicas para cada uno. Se observo si existió o no la formación de halo
de inhibición.
7.8.2 Selectividad: se verifico la selectividad del método analítico preparando muestras
al 100% del estándar de referencia y de las muestras. Se prepararon 3 replicas
independientes para el estándar y las muestras. A cada una de ellas se le verifico los
posibles interferencias de metabolitos de degradación sometiendo la molécula a
condiciones externas de temperatura, condiciones acidas, condiciones alcalinas y a
fotolisis por luz UV. Las muestras y el estándar a una concentración del 100% se
sometieron a condiciones acidas para esto se adiciono 1ml de cada una de las muestras
y el estándar (concentración al 100%) en balón de 50 ml. Se preparo una muestra para
hidrólisis acida empleando HCL 1N, se adiciono 5ml a cada una de las muestras en el
balón de 50ml, posteriormente se sometieron por una hora a 90oC en baño termostatado
finalizado el tiempo se adiciono 5ml de NaOH 1N a cada una de las muestras en el
mismo balón de 50ml para neutralizar la muestra y se aforo con Buffer 1 al 1% pH6.
Para someter las muestras a condiciones básicas se adiciono 1ml de cada una de las
muestras y el estándar (concentración al 100%) en balón de 50 ml. Se preparo muestra
para hidrólisis básica empleando NaOH 1N, se adiciono 5ml a cada una de las
muestras en el balón de 50ml posteriormente se sometieron por una hora a 90 oC en
baño termostatado finalizado el tiempo se adiciono 5ml de HCl 1N a cada una de las
muestras en el mismo balón de 50ml para neutralizar la muestra y se aforo con Buffer 1
al 1% pH6.
Para evaluar las muestras en condiciones externas de temperatura se adiciono 1ml de
cada una de las muestras y el estándar (concentración al 100%) en balón de 50 ml
posteriormente se sometieron a 90 oC en baño termostatado durante una hora.
Transcurrido el periodo de tiempo se realizaron diluciones para obtener una
concentración de 1.0 UI/ml.
Para observar la degradación por acción de la luz las muestras se colocaron bajo luz
UV por un tiempo de 8 días a luz solar, transcurrido el periodo de tiempo se realizaron
diluciones para obtener una concentración de 1.0 UI/ml. Una vez que se obtuvieron los
datos de la valoración de cada una de las condiciones a las que se sometieron las
muestras, se realizo una segunda prueba en la que se llevó acabo los mismos
procedimientos solo que el periodo de exposición a la temperatura cambio siendo de 30
minutos a 90 oC, en las condiciones acidas y básicas únicamente. Se realizo esta
segunda prueba ya que los resultados que se obtuvieron mostraron una degradación

54
total de la molécula del principio activo al ser sometidas a 90oC en baño de maría
durante 1 hora en las diferentes condiciones, por esta razón se analizo en un periodo de
tiempo mas corto para determinar si la respuesta de la molécula era la misma en un
periodo de tiempo mas corto en las mismas condiciones de prueba.
Se determinó por medio de un estudio estadístico, el porcentaje de degradación de cada
una de las moléculas sometidas a las diferentes condiciones de estrés.
7.8.3 Linealidad del sistema: Para el estudio de la linealidad del sistema se preparó
una curva de calibración en un intervalo de concentración desde 0.05 hasta 2.5 UI/ml,
que incluyó 10 niveles de concentraciones diferentes (0.05, 0.1, 0.15, 0.2, 0.25, 0.5,
1.0, 1.5, 2.0 y 2.5 UI /ml) del Estándar de Referencia USP Bacitracina (Ver Tabla. 6). El
análisis se realizó por triplicado en cada concentración. Los niveles de concentración se
encuentran dentro de los intervalos establecidos para el tipo de análisis (80% 100%
120% 140%).
A partir de los datos obtenidos de la prueba, se realizo un análisis estadístico
determinando las siguientes especificaciones: ecuación de la recta de regresión,
representación grafica de la recta de regresión, coeficiente de correlación, coeficiente de
determinación y análisis de variancia para la regresión lineal.
7.8.4 Linealidad del método: para esta determinación se analizo el método preparando
10 muestras de diferentes niveles de concentración de analito de muestra. Las
concentraciones verificadas previamente, son las mismas que se utilizaron en la
linealidad del sistema. El intervalo de concentraciones se utilizo desde 0.05 hasta 2.5
UI/ml que incluyó 10 niveles de concentraciones diferentes (0.05, 0.1, 0.15, 0.2, 0.25,
0.5, 1.0, 1.5, 2.0 y 2.5 UI /ml) del Estándar de Bacitracina mas placebo. De cada una de
las concentraciones se realizaron 3 replicas. A cada una de las diluciones se le adiciono
1ml de placebo antes de aforar los balones con Buffer 1 al 1% pH6. El placebo se
obtuvo sometiendo una solución madre de muestra a una hidrólisis acida con 5ml de
HCl 1N posteriormente se sometió a 60 minutos a una temperatura de 90 oC en baño
termostatado transcurrido el tiempo se neutralizo con 5ml de NaOH 1.0N. De esta
forma se inactivo el principio activo y la muestra represento el placebo.
A partir de los datos obtenidos de la prueba, se realizo un análisis estadístico
determinando las siguientes especificaciones: ecuación de la recta de regresión,
representación grafica de la recta de regresión, coeficiente de correlación, coeficiente de
determinación y análisis de variancia para la regresión lineal.

55
7.8.5 Precisión del método: a una muestra de concentración única que representó el
100,0% de la cantidad teórica declarada se le realizo dilución hasta obtener una
concentración de 1.0 UI/ml; se efectuaron las valoraciones por 2 analistas en 2 días
diferentes en la que cada analista realizo diluciones para obtener muestras de
concentración de 1.0UI/ml del estándar y las muestras para ser analizadas. Para su
evaluación se realizó un análisis de varianza. De la muestra se realizaron 3 replicas por
analista y para cada día de análisis.
En el caso de la precisión del sistema se determino 10 lecturas de la concentración
central del estándar.
Los datos obtenidos se estudiaron introduciéndolos en el programa de validación
determinando las siguientes especificaciones: media, desviación estándar, coeficiente
de variación, intervalo de confianza y los límites de confianza de la media.
7.8.6 Exactitud: Para establecer la exactitud del método analítico se prepararon 3
soluciones de cada muestra mas placebo a concentraciones de 80, 100,120% (Tabla 6)
para cada nivel de concentración se prepararon tres muestras independientes. Los
datos obtenidos se analizaron introduciéndolos en el programa de validación
determinando las siguientes especificaciones: el porcentaje de recuperación,
homogeneidad de variancias (Test Cochran), determinación del sesgo y test de t
Student.
Tabla.6 Diluciones del las muestras para la evaluar la Exactitud
Muestra % Exactitud
Cantidad a Pesar (g)
Volumen de Diluyente (ml)
Volumen de Solucion Madre
(ml)
Volumen de Diluyente (ml)
Bacitracina Zinc 80 0.17 25 1 49Bacitracina Metilen 80 0.22 25 1 49Bacitracina Zinc 100 0.22 25 1 49Bacitracina Metilen 100 0.28 25 1 49Bacitracina Zinc 120 0.26 25 1 49Bacitracina Metilen 120 0.33 25 1 49
DILUCION FINALSOLUCION MADRE
7.8.7 Limite de detección: se determino el limite de detección preparando diluciones de
estándar de referencia en un intervalo de concentraciones de 0.005, 0.01, 0.015 y 0.025
UI/ml. (Tabla 7) Cada concentración se realizo por triplicado para su valoración. En la
valoración de las muestras se determino cual era la concentración en la que no se
observo halo de inhibición que correspondió al límite de detección ya que es el nivel
mínimo del analito que puede detectarse confiablemente.

56
Tabla. 7 Diluciones del las muestras para determinar el limite de detección
Volumen de Solución Madre (ml)
Volumen de Diluyente Buffer 1%
ph 6 (ml)
Concentración Final (UI/ml)
Volumen de Solución Madre (ml)
Volumen de Diluyente Buffer 1% ph 6 (ml)
Concentración Final (UI/ml)
1 99 12.76 1 49 0.011 99 12.76 1.5 48.5 0.0151 99 12.76 2.5 47.5 0.025
PRIMERA DILUCION SEGUNDA DILUCION
7.8.8 Límite de cuantificación: el límite cuantitativo se determino preparando una
dilución que represento más o menos tres o cuatro veces el límite de detección. Se
estableció como concentración de trabajo 0.02 UI/ml preparando seis replicas
independientes a esta concentración para ser valoradas. Con los datos obtenidos se
estableció el límite mínimo del analito que se puede determinar con exactitud y precisión
aceptables.
Una vez finalizado el análisis se genero informe de validación y de acuerdo con los
resultados obtenidos se concluyo y se demostró estadísticamente que el método es
adecuado para el propósito determinado, es decir que posee un alto grado de
confiabilidad que puede ser aplicado a un amplio numero de muestras y matrices que
es practico con respecto al costo y el tiempo requerido en el análisis.

57
8. RESULTADOS Y DISCUSIÓN
Validación del Método Analítico para de Cuantificación de Bacitracina Zinc y Bacitracina Metilen Disalicilato 8.1 ESPECIFICIDAD El método tiene la capacidad de diferenciar precisa y específicamente el principio activo
de Bacitracina Zinc y Bacitracina Metilen Disalicilato, en presencia de los demás
componentes como lo son el diluyente utilizado y el placebo, que se espera estén
presentes en la matriz de la muestra. (WHO Technical Report Series, No 823, 1992)
A partir de los resultados obtenidos de la especificidad presentados en el Anexo 5 y 6
se muestra evidencia de que el procedimiento no resulta afectado por la presencia del
diluyente o excipientes, ya que al sembrar el placebo y el diluyente en las placas de
valoración no se observo formación de halo lo que demuestra que estos no intervienen
en la formación de halo al cuantificar el principio activo. Al sembrar la concentración
central del principio activo en las placas de valoración se observo la formación de halos
de inhibición en de Bacitracina Zinc y en Bacitracina Metilen Disalicilato.
8.2 SELECTIVIDAD En el Anexo 8 y 7 se presentan los porcentajes de degradación de cada una de las
muestras (M1 estándar, M2 muestra y M3 placebo) en los tratamientos con Bacitracina
Zinc y Bacitracina Metilen Disalicilato sometidas a condiciones externas de temperatura,
radiación UV, condiciones acidas y condiciones alcalinas. .
Se observo una degradación química apreciable en medio acido y básico ya que al
termino de una hora a 90oC con tratamiento con HCl 1N y con NaOH 1N
respectivamente se obtuvo un porcentaje de degradación del principio activo de: en el
Estándar Bacitracina (M1) un 99.9% de degradación en condiciones acidas y básicas,
en la muestra Bacitracina Zinc (M2) y muestra Bacitracina Metilen Disalicilato (M2)
mostraron una degradación un poco mas acentuada presentando un 100% de
degradación en condiciones acidas y básica. De esta forma se determina que el
principio activo es susceptible a la degradación en medio acido y básico siendo un
interferente que hay que tener en cuenta a la hora de su fabricación, almacenamiento y
en realización de pruebas en los análisis de calidad (prueba de potencia).

58
A partir de los porcentajes de degradación se observa como la molécula al ser expuesta
a condiciones acidas y básicas presenta degradación coincidiendo con la información
obtenida en cuanto a la estabilidad de la Bacitracina, determinando que esta es
rápidamente inactivada en soluciones que tienen un pH mayor a 9 y menores de 4.
(McEvoy, G.K., 1993)
Se observo una degradación apreciable al someter las muestras durante ocho días a
radicación solar directa, el Estándar Bacitracina (M1) presento un porcentaje de
degradación de 18.4%, a partir de este se determina que el principio activo es afectado
por la radiación UV. La muestra Bacitracina Zinc (M2) y muestra Bacitracina Metilen
Disalicilato (M2) mostraron una degradación mucho mas acentuada presentando un
82.6% y 76.6% de degradación correspondientemente siendo mas sensibles a la
exposición de luz solar durante un periodo mayor o igual a 8 días. Al someter las
muestras a una temperatura de 90oC durante un periodo de una hora se obtuvo un
porcentaje de recuperación de: 22.1% en el Estándar Bacitracina (M1), 75.5% en
Bacitracina Zinc (M2) y 73.0% en Bacitracina Metilen Disalicilato (M2). Se determino
que los principios activos son susceptibles o pierden su estabilidad al someterlos a altas
temperaturas, aunque el Estándar de Bacitracina presento un porcentaje de
degradación mas bajo es afectada igualmente. Los dos tipos de Bacitracina tuvieron un
porcentaje de degradación muy cercano lo cual nos muestra que las dos se ven aun
mas afectadas al someterlas a altas temperaturas y que las dos responden de igual
manera al someterlas a 90oC por una hora.
A partir de los datos anteriores se determina que el principio activo es susceptible a la
degradación cuando se somete o se encuentra expuesto a radiación UV y a
temperaturas iguales o mayores de 90oC durante un periodo de tiempo. Estas
condiciones resultan siendo un interferente que hay que tener en cuenta a la hora de su
fabricación, almacenamiento y en realización de pruebas en los análisis de calidad
(prueba de potencia). Por esta razón el principio activo debe almacenarse a temperatura
ambiente y protegido de la luz solar para evitar la perdida de la potencia del antibiótico.
Muestra evidencia de que el procedimiento resultara afectado por la presencia de
productos y condiciones drásticas de degradación del principio activo, en este caso cada
una de las Basitracinas muestra degradación si se trabaja en presencia de condiciones
acidas, básicas, radiación UV y altas temperaturas siendo estos los productos que
interfieren al querer cuantificar nuestro principio activo. Se observo mayor degradación
en Bacitracina Zinc y Bacitracina Metilen Disalicilato que en la Bacitracina Estándar,

59
esto puede deberse a la presencia de una sustancia de degradación en los excipientes
del producto farmacéutico, que hace que la muestra genere un mayor halo de inhibición
y por lo tanto un porcentaje mayor de degradación.
8.3 LINEALIDAD DEL SISTEMA Al realizar el estudio estadístico de los datos obtenidos se obtuvo los siguientes
resultados:
La curva de calibración realizada entre el logaritmo de la concentración en la variable
dependiente (Y) y el diámetro del halo (mm) en la variable independiente (X) resultó ser
lineal en el intervalo de concentraciones comprendidas entre 0,05 y 2,55 UI/ml. Al
aplicar la regresión lineal a los datos se obtuvo la ecuación de la recta que se expresó
según y = 0,127843 x – 3,13256 (LogConc = -3,13256 + 0,127843*Diametro). El
coeficiente de correlación fue de 0,996924. (R-squared = 99,3857 percent). (Anexo2)
La regresión lineal obtenida es el diseño del modelo matemático, representado como
una ecuación, que permite establecer o simular el comportamiento de la variable
dependiente con respecto a la variable independiente. En el Anexo 2. se muestra la
cuerva de calibración para Bacitracina (Estandar) teniendo una regresión lineal y un
coeficiente de correlación de 0.996924 hasta una concentración de 2.55 UI/ml arriba de
esta concentración el sistema puede perder su respuesta lineal (Reyes Aguero C.,
2007). Dentro del intervalo de concentraciones 0.05 y 2.55 mg/ml se puede construir
una curva de calibración lineal es el rango lineal.
El coeficiente de correlación obtenido es nuestro índice estadístico que mide la relación
lineal entre las dos variables cuantitativas (log de concentración y diámetro). Este mide
la correlación entre la variable dependiente xi (Diámetro halo) y una variable
independiente yi (Log de concentración), El coeficiente de correlación obtenido es muy
cercano a 1 existiendo una correlación positiva casi perfecta. El índice indica que existe
una dependencia total entre las dos variables denominada relación directa: cuando el
halo tiene un mayor diámetro (mm) la concentración (UI/ml) del principio activo es
mayor, es decir cuando una de las variables aumenta, la otra también lo hace en
idéntica proporción, es decir hay una relación directamente proporcional.(Reyes Aguero
C., 2007).
8.4 LINEALIDAD DEL METODO BACITRACINA ZINC Al realizar el estudio estadístico de los datos obtenidos se obtuvo los siguientes
resultados:

60
La curva de calibración realizada entre el logaritmo de la concentración en la variable
dependiente (Y) y el diámetro del halo (mm) en la variable independiente (X) resultó ser
lineal en el intervalo de concentraciones comprendidas entre 0,05 y 2,55 UI/mL. Al
aplicar la regresión lineal a los datos se obtuvo la ecuación de la recta que se expresó
según y = 0.168504x – 4.19447 (LogConc= -4.19447 + 0.168504*Diámetro). El
coeficiente de correlación fue de 0,997576. (R-squared = 99.5158 percent). (Anexo 3)
La regresión lineal obtenida es el diseño del modelo matemático, representado como
una ecuación, que permite establecer o simular el comportamiento de la variable
dependiente con respecto a la variable independiente. En el Anexo 3. se muestra la
curva de calibración para Bacitracina (Estandar) teniendo una regresión lineal y un
coeficiente de correlación de 0.997576 hasta una concentración de 2.55 UI/ml arriba de
esta concentración el sistema puede perder su respuesta lineal (Reyes Aguero C.,
2007). Dentro del intervalo de concentraciones 0.05 y 2.55 UI/ml se puede construir una
curva de calibración lineal en el rango lineal.
El coeficiente de correlación obtenido es nuestro índice estadístico que mide la relación
lineal entre las dos variables cuantitativas (log de concentración y diámetro). Este mide
la correlación entre la variable dependiente xi (Diámetro halo) y una variable
independiente yi (Log de concentración), El coeficiente de correlación obtenido es muy
cercano a 1 existiendo una correlación positiva casi perfecta. El índice indica que existe
una dependencia total entre las dos variables denominada relación directa: cuando el
halo tiene un mayor diámetro (mm) la concentración (UI/ml) del principio activo es
mayor, es decir cuando una de las variables aumenta, la otra también lo hace en
idéntica proporción. (Reyes Aguero C., 2007).
8.5 LINEALIDAD DEL METODO BACITRACINA METILEN DISALICILATO Al realizar el estudio estadístico de los datos obtenidos se obtuvo los siguientes
resultados:
La curva de calibración realizada entre el logaritmo de la concentración en la variable
dependiente (Y) y el diámetro del halo (mm) en la variable independiente (X) resultó ser
lineal en el intervalo de concentraciones comprendidas entre 0,05 y 2,55 UI/mL. Al
aplicar la regresión lineal a los datos se obtuvo la ecuación de la recta que se expresó
según y = 0.187593x – 4.52561 (LogConc= -4.52561 + 0.187593*Diámetro). El
coeficiente de correlación fue de 0,980127. (R-squared = 96.0649 percent). (Anexo 4)
La regresión lineal obtenida es el diseño del modelo matemático, representado como
una ecuación, que permite establecer o simular el comportamiento de la variable

61
dependiente con respecto a la variable independiente. En el Anexo 4. se muestra la
curva de calibración para Bacitracina (Estandar) teniendo una regresión lineal y un
coeficiente de correlación de 0.980127 hasta una concentración de 2.55 UI/ml arriba de
esta concentración el sistema puede perder su respuesta lineal (Reyes Aguero C.,
2007). Dentro del intervalo de concentraciones 0.05 y 2.55 UI/ml se puede construir una
curva de calibración lineal en el rango lineal.
El coeficiente de correlación obtenido es nuestro índice estadístico que mide la relación
lineal entre las dos variables cuantitativas (log de concentración y diámetro). Este mide
la correlación entre la variable dependiente xi (Diámetro halo) y una variable
independiente yi (Log de concentración), El coeficiente de correlación obtenido es
cercano a 1 existiendo una correlación positiva. El índice indica que existe una
dependencia total entre las dos variables denominada relación directa: cuando el halo
tiene un mayor diámetro (mm) la concentración (UI/ml) del principio activo es mayor, es
decir cuando una de las variables aumenta, la otra también lo hace en idéntica
proporción. (Reyes Aguero C., 2007).
Se observo como la recta de la regresión constituida con el diámetro del halo y su
respuesta en la concentración cumple con los parámetros establecidos del coeficiente
de correlación. En los resultados obtenidos (Anexo 2, 3 y 4) del coeficiente de
correlación ninguno fue menor o igual a 0.95, de esta forma se encuentra en los criterios
de aceptación.
Los valores obtenidos en el P-value en los análisis de varianza (ANOVA) (Anexo 2, 3 y
4) realizados a cada una de las Bacitracinas es menor a 0.01, lo que muestra evidencia
estadísticamente significativa de la relación entre el logaritmo de la concentración y el
diámetro del halo con un nivel de confianza del 99%. De esta forma cumple con los
criterios de aceptación.
En el Anexo 2, 3 y 4 se muestra el análisis de la varianza de cada una de las
Bacitracinas, a partir de estos resultados se puedo concluir que existen diferencias
significativas entre las concentraciones establecidas dentro de un intervalo de 0.05
hasta 2.55. Es decir que las concentraciones que se trabajaron presentaron diferencia
en sus halos y de esta forma se puede establecer diferencia entre las concentraciones
para así poder realizar una cuantificación del principio activo.
8.6 PRECISIÓN
La precisión obtenida expresa la cercanía de coincidencia (grado de dispersión) entre
los datos de las mediciones de halos (mm) de los múltiples muestreos de una misma
muestra homogénea bajo condiciones establecidas. Se evaluó la precisión por medio de

62
la repetibilidad que es la precisión obtenida bajo las mismas condiciones de operación
en un intervalo de tiempo (mismo día), por un mismo analista, en la misma muestra
homogénea y con los mismos eguitos (Taylor, 1993). La repetibilidad se evaluó en los
Grupos 1, 2, 3 y 4 que se muestran en el Anexo 9 y 10. Y la reproducibilidad que es la
precisión obtenida dentro del laboratorio por diferentes analistas, diferentes equipos,
días distintos con la misma muestra homogénea. (Calpena AC. et al, 1991) La precisión
inmediata se evaluó en el Grupos 5 que se muestran en el Anexo 9 y 10.
La desviación estándar obtenida en cada uno de los Grupos nos muestra la medida del
grado de dispersión de los datos del valor promedio o media. Valores grandes de la
desviación estándar indican que los datos (puntos) están lejos de la media y valores de
la desviación estándar pequeños indica que los datos están agrupados cerca de la
media. (AEFI, 2001) En todos los grupos la desviación estándar obtenida es
relativamente pequeña indicando que existe una agrupación de datos muy cercanos
alrededor de la media. La desviación estándar de cada uno de los grupos de medidas
nos indican la precisión de estas, ya que se muestra que tan lejos están estas del valor
real o media al ser realizado en diferentes condiciones (día, analista, equipó) pero con
una misma muestra. Las desviaciones estándar que se obtuvieron fueron de valores
pequeños lo que indico que no se observo una diferencia significativa entre los datos de
los grupos siendo un método preciso.
El coeficiente de variación (CV) en cada una de los grupos de datos para la repetibilidad
y para la reproducibilidad no fue mayor al 5% mostrando que el método cumple con los
parámetros establecidos, siendo el ensayó repetitivo.
El coeficiente de variación (CV) nos indica la relación existente entre la desviación de
una muestra y su media. Al dividir la desviación típica por la media se convierte en un
valor de unidad de medida. Si comparamos la dispersión en varios Grupos de
mediciones, tendrá menor dispersión aquella que tenga menor coeficiente de variación.
(AEFI, 2001) En los Anexos 9 y 10 se muestran los valores obtenidos de los coeficientes
de variación de cada uno de los Grupos. En el análisis con Bacitracina Zinc el analista
1 en el día 1 obtuvo el valor mas bajo del coeficiente de variación CV= 0.127 y CV=
0.911 teniendo la menor dispersión entre los valores del diámetro del halo de inhibición
y en el porcentaje de recuperación respectivamente, por otro lado se observo el valor
mas alto del coeficiente de variación CV= 0.389 y CV= 2.72 en el Grupo 5 (Analista 1 y 2
Días 1 y 2) presentando la mayor dispersión entre sus datos, pero aun así no se
encuentran por fuera de los criterios de aceptación.

63
En el análisis con Bacitracina Metilen Disalicilato el analista 2 en el día 1 obtuvo el valor
mas bajo del coeficiente de variación CV= 0.055 Y CV= 0.261 teniendo la menor
dispersión entre los valores del diámetro del halo de inhibición y en el porcentaje de
recuperación respectivamente, por otro lado se observo el valor mas alto del coeficiente
de variación CV= 0.464 y CV= 3.421 en el Grupo 4 (Analista 2 Días 2) presentando la
mayor dispersión entre sus datos, pero aun así no se encuentran por fuera de los
criterios de aceptación.
Las medias de cada uno de los analistas en dos días, de cada uno del analista en un
mismo día, los dos analistas en un mismo día, o presentaron diferencias significativas lo
cual muestra la buena repetitibilidad del método y reproducibilidad. No se observaron
diferencias significativas entre las medias de ambos analistas, por tanto el método
analítico fue reproducible por ambos analistas, de igual forma no se detectaron
diferencias significativas entre las medias de ambos días siendo el método analítico
reproducible en diferentes días. De esta forma el método analítico posee repetibilidad
en diferentes días y por diferentes analistas, al igual que diferentes días por el mismo
analista.
Con un nivel de confianza de 95% que se corresponde con valores α de 0.05 informa
con un 95% de seguridad que nuestro valor estimado se encuentra en un intervalo de
confianza. Los valores obtenidos de los intervalos de confianza (Anexo 9 y 10),
muestran los valores que componen el intervalo dentro de la cual se considera que se
encuentra el verdadero valor de aquella característica que se esta estimando, el
diámetro del halo en mililitros con respecto a la concentración del principio activo.(AEFI,
2001)
El coeficiente de variación obtenido en la precisión del sistema fue menor al 5%, de esta
forma se encuentra dentro del criterio de aceptación establecido. La desviación estándar
obtenida muestra la dispersión de los 10 datos obtenidos con respecto a su media.
(Anexo 11).
La precisión del método en Bacitracina Zinc y Bacitracina Metilen Disalicilato cumple
con los parámetros establecidos de esta forma el ensayo es repetitivo y reproducible.

64
8.7 EXACTITUD Como forma de medir la dispersión de los datos hemos determinado la homogeneidad
de variancias. La varianza es una medida de dispersión que nos permite conocer que
tanto se dispersan los datos alrededor de su promedio o media. Los valores obtenidos
de la variancia de cada uno de los tratamientos con Bacitracina se muestran en los
Anexos 12 y 13, estos valores nos permiten identificar la diferencia promedio que hay
entre cada uno de los valores respecto a su punto central (la media). En el tratamiento
con Bacitracina Zinc los datos que presentaron la menor dispersión alrededor de su
media fue la concentración 120% con una variancia de 0.311 y en el tratamiento con
Bacitracina Metilen Disalicilato los datos que presentaron la menor dispersión alrededor
de su media fue la concentración 120% con una variancia de 0.062.
A partir del estudio de la homogeneidad de variancias por medio del test de Cochran, se
obtuvo el Valor Gexp=0.682 en Bacitracina Zinc y Gexp=0.790 en Bacitracina Metilen
Disalicilato que son inferiores al G3-.2-.0.05 (0.8709) (Anexos 12 y 13). Se acepta la
hipótesis de homogeneidad (igualdad) de variancias de las 3 poblaciones de origen, ya
que Gexp=0.682 en Bacitracina Zinc y Gexp=0.790 en Bacitracina Metilen Disalicilato es
inferior a G3-.2-.0.05 ( 0.8709).es decir que las variancias son homogéneas. La hipótesis de
igualdad de variancias no se rechaza por que el valor G obtenido no es superior al
correspondiente valor G (K,v,α) dado por la tabla e la prueba de COCHRAN. Los valores
optenidos de Gexp son mayores a 0.05 lo que indica que no hay diferencias significativas
en las variancias por lo que hay homogeneidad de variancias.
Los valores obtenidos del sesgo (e%) en cada uno de los tratamientos con Bacitracina
se muestran en los Anexos 12 y 13. Los valores obtenidos del sesgo es el error
sistemático, que se produce de igual modo en todas las mediciones que se realizan de
la magnitud. Este puede estar originado en un defecto del instrumento, en una
particularidad del operador o del proceso de medición, entre otros. (Vaqué. J, 2007).
Ninguno de los valores que se obtuvieron del e% fue mayor al 3% lo que nos indico que
se encuentran dentro de los criterios de aceptación. El tratamiento que presento menor
error sistemático fue el tratamiento de Bacitracina Zinc con un e%=1.24, el tratamiento
con Bacitracina Metilen Disalicilato presento un e%= 2.2 también entra en los criterios
de aceptación pero con un mayor error sistemático que el tratamiento con Bacitracina
Zinc.
De acuerdo con la prueba t de Student se obtuvo un Valor texp 1.208 para Bacitracina
Metielen Disalicilato y un Valor texp 0.39 para Bacitracina Zinc valores son menores a lo
que indica para p= 0.05/2 y v= 8 tiene un valor de 2.306: no hay diferencia significativa

65
entre la recuperación de la media obtenida y el 100% por lo que la exactitud es
conforme.
La exactitud es la capacidad que tiene el método para generar mediciones que se
acerquen al valor verdadero (USP, 30), por esta razón se analizan tres concentraciones
diferentes del analito para observar su porcentaje (%) de recuperación en cada una de
ellas. El porcentaje de recuperación esperado de acuerdo con la experiencia
experimental debe encontrarse entre un 90% - 110%, con un error relativo de ± 10%. En
cada uno de los tratamientos con Bacitracina los porcentajes de recuperación (Anexos
12 y 13). Se encuentran dentro del rango establecido, ninguno es mayor a 110% o
menor de 90%, en cada una de las concentraciones.
La Exactitud de Bacitracina Zinc y Bacitracina Metilen Disalicilato cumplen con los
parámetros establecidos. En los dos casos concentraciones extremas de problema
(principio activo) se detectan como tales.
8.8 LIMITE DE DETECCION
A partir del análisis cualitativo se determino el limite de detección en la concentración de
0.005 UI/ml de Bacitracina, en esta concentración no se detecto la formación de halo. Es
la cantidad mínima de Bacitracina en una muestra que puede detectarse, aunque no
necesariamente cuantificarse, en las condiciones experimentales indicadas. (USP,30)
De esta forma; en la concentración de 0.005 UI/ml se observo el nivel mas bajo de la
concentración de Bacitracina que pudo determinarse como estadísticamente diferente
del blanco analítico. (WHO Technical Report Series, No 823, 1992) Se determina que el
método es capas de detectar cantidades mínimas de Bacitracina en una muestra,
siempre que estén por encima de la concentración de 0.005 UI/ml.
Los resultados obtenidos del análisis estadístico se muestran con más detalles en el
Anexo 15.
8.9 LIMITE DE CUANTIFICACIÓN
La concentración mínima de Bacitracina (analito), que puede ser determinada
cuantitativamente con precisión y exactitud aceptables en condiciones experimentales
indicadas es de 0.02 UI/ml. (Anexo 14)
A partir del análisis cuantitativo se determino el limite de cuantificación en la
concentración de 0.02 UI/ml de Bacitracina, en esta concentración se detecto y
cuantifico la formación de halo de inhibición. Es la cantidad mínima de Bacitracina en

66
una muestra que puede cuantificarse en las condiciones experimentales indicadas. De
esta forma; se determina que el método es capaz de cuantificar en forma confiable
cantidades mínimas de Bacitracina en una muestra, siempre que tengan una
concentración igual o mayor a 0.02 UI/ml .
En la Tabla 18 se muestran los datos obtenidos del análisis estadístico. La desviación
estándar obtenida de 0.223 muestra el nivel de dispersión de los resultados con
respecto a la media obtenida , esta refleja que los resultados obtenidos de los diámetros
de los halos de inhibición son similares o homogéneos ya que es un valor bajo cercano
a cero. El coeficiente de variación (CV) obtenido es de 1.272% este es menor a 5%
(porcentaje del CV que se acepta en la precisión del método). Este valor pequeño del
CV obtenido muestra que la distribución de la variable medida es muy homogénea. Con
un nivel de confianza del 95% se definió los limites de confianza 17.33 -17.68 (Anexo
14) que determinan el intervalo dentro del cual se considera que se encuentra el
verdadero valor de medida para el halo de inhibición de principio activo en la
concentración que se trabajo 0.02 UI/ml. (AEFI, 2001)
Los resultados obtenidos del análisis estadístico se muestran con más detalles en el
Anexo 14.

67
9. CONCLUSIONES
9.1 Se comprobó el cumplimiento de la linealidad del sistema y la linealidad del método
en el intervalo de concentraciones que se estudiaron por su elevado valor del coeficiente
de correlación alcanzado que es muy cercano a 1.
9.2 Se debe tener presente a la hora de realizar el método analítico para la
cuantificación de Bacitracina que no debe realizarse en condiciones que exista la
presencia de soluciones acidas o básicas este seria un interferente a la hora de realizar
la cuantificación de principio activo.
9.3 La molécula de Bacitracina Zinc y Bacitracina Metilen Disalicilato en soluciones
acidas y básicas es inestable perdiendo su potencia.
9.4 Las moléculas del principio activo disminuyen su actividad al someterlas a una
temperatura de 90oC por periodos mayores o iguales a una hora y al someterlas a
radicación solar UV durante un periodo de ocho días, por esta razón se debe mantener
el principio activo a temperatura ambiente y protegido de la luz solar.
9.5 La exactitud del método analítico cumple con los parámetros y/o criterios de
aceptación, concluyendo que los resultados de la prueba obtenidos mediante el
procedimiento establecido bajo condiciones descritas posee una proximidad al valor
verdadero.
9.6 El método analítico para la cuantificación de Bacitracina es preciso dentro del
ensayo al ser efectuado cualquier día, por cualquier analista y cualquier muestra. Es un
procedimiento analítico preciso ya que posee un grado de concordancia entre los
resultados de las pruebas individuales cuando se aplica el procedimiento repetidamente
en el laboratorio.
9.7 Los resultados en la precisión mostraron que los coeficientes de variación son
aprobados, si el valor aceptable debe ser menor o igual que 5%, los coeficientes de
variación resultaron ser menores que 5%, lo cual demuestra la buena repetibilidad del
método de cuantificación..
9.8 No se observaron diferencias significativas entre las medias de ambos analistas y
ambos días por lo tanto el método analítico fue reproducible por ambos analistas.

68
9.9 A partir del análisis cuantitativo se determino el limite de cuantificación en la
concentración de 0.02 UI/ml de Bacitracina, esta concentración corresponde a la mas
baja cantidad de Bacitracina que puede determinarse cuantitativamente con precisión y
exactitud aceptables observando claramente la formación de halo.
9.10 Los resultados permiten concluir que el método analítico para la cuantificación de
Bacitracina presenta resultados de linealidad, especificidad, precisión y exactitud
satisfactorios que permiten obtener resultados seguros y confiables en la detección y
cuantificación de Bacitracina en las muestras al 15% y 11%.

69
10. RECOMENDACIONES
Para la correcta cuantificación del analito de interés se requiere que la señal producida se
deba inequívocamente a su presencia y que no existan interferencias de sustancias y/o
compuestos de degradación ácidos o básicos que puedan estar presentes en la muestra, su
preparación, condiciones instrumentales y/o material de trabajo. Es importante verificar que
estas sustancias interferentes y compuestos de degradación estén ausentes para no generar
interferencia significativa en el resultado.
El estudio de muestras de principio activo a condiciones de estrés, tales como exposición a
altas temperaturas y radiación UV, permitió identificar la presencia de compuestos de
degradación potencialmente interferentes, razón por la cual es importante que durante los
procesos de fabricación, empaque, almacenamiento y en los análisis de control de calidad
no se exponga el producto a ambientes con temperaturas superiores a 90ºC y a radiaciones
UV.
Si se desarrolla el método analítico dentro del rango de concentraciones 0.05 UI/ml hasta
2.55UI/ml se obtendrá una respuesta de tipo lineal, obteniendo resultados que son
directamente proporcionales a la concentración del analito dentro de la muestra.
Por medio de este método analítico bajo las condiciones experimentarles descritas, la
mínima cantidad de analito presente en una muestra que se puede cuantificar con razonable
certeza, precisión y exactitud es de 0.02 UI/ml. Y la mínima cantidad de analito en una
muestra que se puede detectar pero no cuantificar es de 0.005 UI/ml, razón por la cual se
sugiere realizar la cuantificación del analito en muestras que contienen concentraciones
iguales o mayores a 0.02 UI/ml evitando así falsos positivos.
Para las posteriores validaciones en la prueba de exactitud tener en cuenta para la
preparación y montaje de las muestras a valorar, el volumen de placebo que debe
adicionarse en las muestras con el analito a concentraciones coincidas sean iguales a los
porcentajes en los cuales este se encuentra en la formulación del producto acabado. Con el
fin de optimizar la preparación de la muestra para mejorar el factor de recuperación.

70
11. REFERENCIAS
ABECIA, L., BALCELLS, J., FONDEVILA, M., BELENGUER, A, CALLEJA, L. 2004.
Anim. Res. 54, 307-314.
AEFI. Asociación Española de Farmacéuticos de la Industria. Validación de Métodos
Analíticos. - -Monografía. Comisión de normas de buena fabricación y control de calidad.
2001
Antibióticos que afectan la pared celular. (Figueroa Arredondo, P y Luna Torres, L.
2006). Microbiología e inmunólogia On – line. Bacteriología – capítulo cinco. Escuela de
la medicina. Universidad de Carolina del sur. Instituto Politécnico Nacional de México..
http://pathmicro.med.sc.edu/Spanish/chapter5.htm. Consulta: 1 Mayo 2008
Antibioticos y quimioterapeuticos: Bacitracina Metileno Disalicilato 11% (Farquímica,
2004). Farquímica Ltda. salud animal y productos farmacéuticos. Av. Los Cerrillos
602 .Santiago. Chile.
http://www.farquimica.com/catalogo/espanol/catalog/default.php?cPath=139&PHPSESSI
D=30b5e6992df73dfe99ef90f595cc5169. Consulta: 10 Marzo 2008
Bacitracina. Epónimos Científicos. (2005: Martín Algarra Rafael V.).Universidad
Cardenal Herrera-CEU. Moncada (Valencia).
<http://www.uch.ceu.es/principal/eponimos_cientificos/inicio.asp?menusuperior=>.
Consulta: 10 Octubre 2007.
Bacitracin Methylene Disalicylate (BMD) 10% 11%, Powder Granular, Premix. Tianjin
XinXing, 2007). Tianjin XinXing Veterinary Pharmaceutical Factory, The South of
Huozhuang Bridge, Beichen District Tianjin Tianjin 300402 China.
http://buy.ecplaza.net/search/1s1nf20sell/bacitracin_methylene_disalicylate.html.
Consulta: 10 Marzo 2008
Bacitracina Metileno Disalicilato Soluble grado veterinario (Alpharma Inc. 2007).
Alpharma Inc. Animal Health Division. Fort Lee, NJ 07024, USA.
http://www.alpharma.com Consulta: 10 Marzo 2008
Bacteriology: Micrococcus luteus (Sciencenet Multimedia Publishing, 2003).
MicroBioNet: Sciencenet Multimedia Publishing, Microbiology Universe on the Internet.

71
40 Hastings Road, Hawthorn East, 3123, Victoria, Australia.
/www.microbionet.com.au/mluteus.htm. Consulta: 10 Marzo 2008
British pharmacopoeia 2002.Department of Health , London
BRUNNER, R., UND MACHEK, G...1962: Die antibioka, Band I, 1. Teil. Verlag Hans
Carl, Nurnberg.
CALPENA AC, ESCRIBANO E, FERNÁNDEZ C. Validación de los métodos analíticos.
Farm Clin 1991;7(9):749-58.
ICH- Techical Coordination- R. Bass, (1998); ICH Topic Q1A Stabilitu testing Guidelines:
Stabilitesting of new drug substances and product.
Errores y Sesgos. (Vaqué Josep, 2007). Hospital Universitari Vall d´Hebron. Facultad
de Medicina – UAB. Consulta: 10 Mayo 2008
www.vhebron.net/preventiva/docencia/mastphoenix/t12_validez_sesgos_diapos_fx.pdf -
GARCÍA MONTOYA, Encarnación., ¨Optimización, validación y modelación de un proceso
de fabricación de comprimidos. Desarrollo de una aplicación interactiva multimedia¨. Tesis
doctoral. Universidad de Barcelona. Facultad de Farmacia. España. 2001.
JAWETZ, E.1956. History, development and chemistry. Antibiotics Monographs, No
5,50-69
KING, J. O. L. 1980. Br. Vet. Sci. 136, 240-248.
LENNETTE, E. H.; A. BALOWS ; W. J. JR. HAUSLEY;. J. R. TRUANT. 1980. Manual of
Clinical Microbiology. Third edition. American Society for Microbiology.. Washington,
U.S.
MAIR, W.,UND GROGER, D. 1972. Biosynthese von peptidantibiotika. Pharmazie 27,
491-505
MCEVOY, G.K. ed. 1993.. American Hospital Formulary Service - Drug Information 93.
Bethesda, MD: American Society of Hospital Pharmacists, Inc., 1993 (Plus Supplements,
1993)., p. 325
MEYER-JONES, L.1956. Veterinary Pharmacology and Therapeutics.Iowa State College
Press, Ames/Jowa.
Microsoft Office Exel 2007

72
NEGWER, M. 1971. Organisch-chemische Arzneimittel und ihre Synonyma. Akademie-
Verlag, Berlin.
PARTHIER, B.1969. Antibioca. Molekularbiologische Wirkungsmechanismen.Nova Acta
Leopold. N.F, 34, Nr. 188, Verlag Joh.Ambrosius Barth, Leipzig.
PATSCH, R. 1975. Antibioka-Ratgeber, 3. Aufl, VEB Gustav Fischer Verlag, Jena.
Principios Básicos de la Antibiótico terapia. (2001:A. Delgado-Iribarren). Programa Anual
2001-2002 de Formación Continuada Acreditada para Médicos de Atención Primaria.
<http://www.medynet.com/elmedico/aula2001/tema10/bioterapia.htm#3>. Consulta: 29
de Enero 2008.
Procedimiento para la validación de métodos analíticos CIDIGO PR-IIT-143. (Reyes
Aguero C., 2007). Universidad Autónoma de Ciudad Juárez.FO- DGPDI- 001- 02.
Fecha de Aprobación: 22 de Mayo de 2006. Fecha de Revisión: 21 Febrero de 2007.
http://www.uacj.mx/transparencia/Acervo/Documentos/Ensayos%20en%20el%20laborat
orio%20ambiental%20-IIT/PR-IIT-143.pdf. Consulta: 1 Mayo 2008
Quimioterápicos de Síntesis y Antibióticos (1998: Pareja Iañez Enrique). Curso de
microbiología general de Enrique Ianez Pareja.
<http://fai.unne.edu.ar/biologia/microgeneral/micro-ianez/20_micro.htm>. Consulta: 29
Enero 2008.
RAMPAZOO P. Standardisation and Validation of Analytical Methods in the
Pharmaceutical Industry. II Farmaco 1990;45:807-15.
SÁNCHEZ,DIANA.2003. Validación de métodos para la determinación en aguas
superficiales de metales alcalinos (sodio y potasio) por absorción atómica a la llama y
alcalinotérreos (calcio y magnesio) por volumetría con EDTA. Licenciatura en Química.
Universidad Distrital Francisco José de Caldas. Facultad de Ciencias y Educación.
Bogota.
Statgraphics Plus for Windows 2.0 (1996). Statistical Graphics Corp. Serial Number:
3862216
SWEETMAN, C. 2003. Guia completa de consulta farmacoterapia. Primera Edición.
Pharma Editores. Barcelona (España)
TAYLOR, JOHN K. Validation of Analitical Methods. Analitycal Chemistry, Vol. 55 No
6(05, 1993)

73
THRUM, H., UND BOCKER, H.1971.:Antibioka – Woher, wofur?, Urania-Verlag, Leipzig-
Jena-Berlín
TROLLDENIER, H.1984 .Antibióticos en medicina veterinaria. Editorial Acribia. Zaragoza
.España.
USP, United States Pharmacopoeial Convention, 30 ed.Rockville: Mack Printing, 2007
WEGE, V. 1969. Die Antibioka und Sulfonamidtherapie in der Schweinepraxis. Dtsch.
Tierarztl. Wschr, 76, 123-126, 158-164.
WHO Expert Comité on Specifications for Pharmaceutical Preparations. Reporte 32.
Genova, World Health Organization, 1992. (WHO Technical Report Series, No 823,
1992)

74
11. ANEXOS
ANEXO 1. CALDOS, MEDIOS DE CULTIVO Y BUFFERS
CALDO BRAIN HEART BROTH (BHI)
Substrato alimenticio ( extracto de cerebro, estracto de corazon) 27.5g/L
Peptona 27.5 g/L
D-glucosa 2.0 G/L
Cloruro sódico 5.0 g/L
Agar-agar 15.0 g/L
AGAR TRIPTICASA SOYA (TSA)
Peptona de caseína
Peptona de arina de soja
Cloruro sódio
Agar-agar
MEDIO ANTIBIOTICO No1.
Peptona 6.0 g/L
Digerido pancreático de caseína 4.0 g/L
Extracto levadura 3.0 g/L
Extracto de carne 1.5 g/L
Dextrosa1.0 g/L
Agar 15.0 g/L
pH despues de la esterilizacio 6.6 +/- 0.1
SOLUCION AMORTIGUADORA DE FOSFATO No 1. POR CIENTO, Ph 6.0
2.0 g/L fosfato dibasico de potasio
8.0 g/L fosfato monobasico de potasio
Ajustar pH com acido fosfórico 18N o hidróxido de potasio 10N a 6.0 +/-0.05

75
ANEXO 2. LINEALIDAD DEL SISTEMA
• Regresión lineal de la linealidad del sistema generado por el programa Statgraphics Plus for Windows 2.0
Regression Analysis - Linear model: Y = a + b*X
-----------------------------------------------------------------------------
Dependent variable: LogConc
Independent variable: Diametro
-----------------------------------------------------------------------------
The linearity of the method is tested with the following data :
Puntos Diámetro Concentración Log (Conc.) (mm) (UI/ml)
S1 14,75 0,05 -1,2919 S2 16,13 0,10 -0,9908 S3 17,73 0,15 -0,8147 S4 19,50 0,20 -0,6898 S5 20,24 0,26 -0,5929 S6 24,90 1,02 0,0092 S7 25,96 1,53 0,1853 S8 26,68 2,04 0,3102 S9 27,51 2,55 0,4071
------------------------------------------------------------------------------
Standard T
Parameter Estimate Error Statistic P-Value
-----------------------------------------------------------------------------
Intercept -3,13256 0,0834659 -37,5311 0,0000
Slope 0,127843 0,0037989 33,6526 0,0000
----------------------------------------------------------------------------------------------------

76
Analysis of Variance
----------------------------------------------------------------------------------------------------
Source Sum of Squares Df Mean Square F-Ratio P-Value
----------------------------------------------------------------------------------------------------
Model 3,08248 1 3,08248 1132,49 0,0000
Residual 0,0190529 7 0,00272185
----------------------------------------------------------------------------------------------------
Total (Corr.) 3,10153 8
Correlation Coefficient = 0,996924
R-squared = 99,3857 percent
Standard Error of Est. = 0,0521713
The StatAdvisor
---------------
The output shows the results of fitting a linear model to describe
the relationship between LogConc and Diametro. The equation of the
fitted model is
LogConc = -3,13256 + 0,127843*Diametro
Since the P-value in the ANOVA table is less than 0.01, there is a
statistically significant relationship between LogConc and Diametro at
the 99% confidence level.
The R-Squared statistic indicates that the model as fitted explains
99,3857% of the variability in LogConc. The correlation coefficient
equals 0,996924, indicating a relatively strong relationship between
the variables. The standard error of the estimate shows the standard
deviation of the residuals to be 0,0521713. This value can be used to
construct prediction limits for new observations by selecting the
Forecasts option from the text menu.

77
-----------------------------------------------------------------------------Plot of the residuals
Diámetro
Log
conc
entra
ción
0 2 4 6 8 10-0,09
-0,06
-0,03
0
0,03
0,06
0,09
-----------------------------------------------------------------------------
Test for the existence of a significant slope (F1)
Confidence level 95.00
Degrees of freedom (1,2) 8
F table 113.49

78
BACTRANLINEALIDAD DEL SISTEMA BACITRACINA
ACTIVO: BACITRACINA ZINCConcentracion: 15g/100g LOTE N1E200Curva Estandar
Caja 1 Caja 2 Caja 3 Total Promedio Promedio corr.S7-G 25,17 24,84 25,12 24,52 25,16 25,63 25,84 25,85 26,08 228,21 25,36S1-A 15,07 15,49 15,20 14,54 15,23 14,69 15,17 14,84 16,59 136,82 15,20 14,75S7-G 26,31 26,33 26,46 26,71 25,50 26,00 26,08 26,10 26,06 235,55 26,17S2-B 17,93 16,78 18,01 17,22 17,33 18,00 16,80 17,06 17,46 156,59 17,40 16,13S7-G 26,23 26,00 26,12 25,12 25,62 25,33 25,89 26,01 25,23 231,55 25,73S3-C 20,01 19,22 18,12 18,63 18,80 17,52 17,75 18,07 18,86 166,98 18,55 17,73S7-G 25,34 26,27 25,81 24,89 25,12 24,56 26,18 25,47 26,24 229,88 25,54S4-D 20,87 21,01 20,87 20,58 19,14 19,36 19,67 19,43 20,38 181,31 20,15 19,50S7-G 23,78 25,14 24,64 24,49 23,93 24,07 24,26 24,13 23,99 218,43 24,27S5-E 19,72 19,98 18,92 20,10 19,15 20,17 18,75 20,00 19,78 176,57 19,62 20,25S7-G 23,03 24,79 24,14 24,21 23,11 24,44 24,84 23,81 24,55 216,92 24,10S6-F 21,66 23,75 23,64 23,50 23,78 23,73 23,62 24,00 23,46 211,14 23,46 24,26S7-G 24,81 24,07 23,72 24,29 24,65 23,40 24,62 23,96 24,85 218,37 24,26S8-H 25,53 24,61 25,36 25,67 25,97 25,10 25,27 24,65 25,70 227,86 25,32 25,96S7-G 23,68 24,60 23,76 25,07 24,26 25,15 23,69 24,22 24,09 218,52 24,28S9-I 26,14 25,98 25,11 26,25 26,33 27,00 25,60 26,38 25,72 234,51 26,06 26,68S7-G 25,17 24,80 24,79 24,12 24,57 24,37 23,29 24,74 23,75 219,60 24,40S10-J 27,19 27,21 26,93 26,54 27,25 27,19 26,71 27,55 26,51 243,08 27,01 27,51
XS7 24,90CURVA ESTANDAR
Puntos Diametro Concentracio Log ( Conc.)(mm) (mg/ml) DATOS ESTANDAR
S1 14,75 0,05 -1,2919 Peso (mg) 17S2 16,13 0,10 -0,9908 Potencia (P) UI/mg 75,1S3 17,73 0,15 -0,8147 Fecha de Vencimiento N.AS4 19,50 0,20 -0,6898 Lote N1E200S5 20,25 0,26 -0,5929 DATOSS6 24,26 0,51 -0,2919 Pendiente 0,1278 Pr T (X S3)es mayor que Pr R= SumaS7 24,90 1,02 0,0092 Intercepto -3,1322 Pr T (X S3)es menor que Pr R= RestaS8 25,96 1,53 0,1853 Factor de Dilucion (D) 1250S9 26,68 2,04 0,3102 Promedio General
S10 27,51 2,55 0,4071 Concentracion Central 24,90

79
• Análisis de la Varianza de la Linealidad del Sistema
Shapiro Wilk Ho: Si hay normalidad
si p<0.05 rechazo la Ho
si p>0.05 acepto la Ho
Levene Ho: Si hay homogeneidad de varianzas
Si p< 0.05 rechazo la Ho
Si p >0.05 acepto la Ho
ANOVA Ho: No hay diferencias significativas
Si p<0.05 rechazo la Ho
Si p > 0.05 acepto la Ho
KruskalWallis Ho: No hay diferencias significativas
Si p<0.05 rechazo la Ho
Si p>0.05 acepto la Ho
Bartlett Ho: Si hay homogeneidad de varianzas
Si p< 0.05 rechazo la Ho
------------------------------------------------------------------------------------------
Shapiro-Wilk normality test
data: resultado$residuals
W = 0.9845, p-value = 0.3839
Bartlett test of homogeneity of variances
data: values by ind
Bartlett's K-squared = 20.5401, df = 9, p-value = 0.01486
Si hay normalidad, No hay homogeneidad de varianzas
Kruskal-Wallis rank sum test
data: values by ind
Kruskal-Wallis chi-squared = 83.1197, df = 9, p-value = 3.87e-14
Si hay diferencias significativas entre los tratamientos con el estandar (Kruskal-Wallis p< 0.05)

80
ANEXO 3. LINEALIDAD DEL MÉTODO BACITRACINA ZINC
• Regresión lineal de la linealidad del método Bacitracina Zinc generado por
el programa Statgraphics Plus for Windows 2.0
Regression Analysis - Linear model: Y = a + b*X
-----------------------------------------------------------------------------
Dependent variable: LogConc
Independent variable: Diametro
-----------------------------------------------------------------------------
The linearity of the method is tested with the following data :
Puntos Diámetro Concentración Log (Conc.) (mm) (UI/ml)
S1 16,91 0,05 -1,3010 S2 19,32 0,10 -1,0000 S3 19,87 0,15 -0,8239 S4 20,69 0,20 -0,6990 S5 21,41 0,25 -0,6021 S6 23,50 0,51 -0,2924 S7 24,66 1,02 0,0086 S8 26,23 1,53 0,1847 S9 26,52 2,04 0,3096 S10 27,21 2,55 0,4065
Standard T
Parameter Estimate Error Statistic P-Value
-----------------------------------------------------------------------------
Intercept -4,19447 0,0950577 -44,1255 0,0000
Slope 0,168504 0,00415557 40,5489 0,0000
---------------------------------------------------------------------------------------------------

81
Analysis of Variance
----------------------------------------------------------------------------------------------------
Source Sum of Squares Df Mean Square F-Ratio P-Value
---------------------------------------------------------------------------------------------------
Model 3,13721 1 3,13721 1644,21 0,0000
Residual 0,0152642 8 0,00190803
-----------------------------------------------------------------------------
Total (Corr.) 3,15247 9
Correlation Coefficient = 0,997576
R-squared = 99,5158 percent
Standard Error of Est. = 0,043681
The StatAdvisor
---------------
The output shows the results of fitting a linear model to describe
the relationship between LogConc and Diametro. The equation of the
fitted model is
LogConc = -4,19447 + 0,168504*Diametro
Since the P-value in the ANOVA table is less than 0.01, there is a
statistically significant relationship between LogConc and Diametro at
the 99% confidence level.
The R-Squared statistic indicates that the model as fitted explains
99,5158% of the variability in LogConc. The correlation coefficient
equals 0,997576, indicating a relatively strong relationship between
the variables. The standard error of the estimate shows the standard
deviation of the residuals to be 0,043681. This value can be used to
construct prediction limits for new observations by selecting the
Forecasts option from the text menu.

82
---------------------------------------------------------------------------Plot of the residuals
Diámetro (mm)
Log
conc
entra
ción
0 2 4 6 8 10-0,07
-0,04
-0,01
0,02
0,05
0,08
0,11
-----------------------------------------------------------------------------
Test for the existence of a significant slope (F1)
Confidence level 95
Degrees of freedom (1,2) 9
F table 1644.21

83
ACTIVO Bacitracina Zinc
Concentración 15g/100g Lote 200711026
Curva EstándarTotal Promedio Promedio corr.
S7-G 24,86 24,61 24,39 24,12 24,74 24,81 24,22 25,07 24,47 221,29 24,59S1-A 16,01 16,49 16,48 15,70 17,41 º6.38 16,77 17,02 16,90 132,78 16,60 16,91S7-G 24,80 24,91 24,85 24,56 25,30 24,16 14,72 25,06 24,75 213,11 23,68S2-B 19,10 18,94 18,59 17,81 17,06 18,22 18,29 16,83 18,04 162,88 18,10 19,32S7-G 24,53 24,63 24,77 24,74 24,41 24,34 24,65 24,33 24,69 221,09 24,57S3-C 19,98 19,28 20,27 18,45 18,61 19,37 19,70 20,40 19,79 175,85 19,54 19,87S7-G 24,89 24,85 24,89 25,65 25,81 24,98 25,00 25,10 24,90 226,07 25,12S4-D 21,26 21,47 20,27 20,59 21,28 20,66 21,39 20,78 20,49 188,19 20,91 20,69S7-G 24,77 24,95 24,92 25,30 24,63 25,05 25,02 24,81 24,49 223,94 24,88S5-E 21,50 21,35 21,01 21,03 21,66 21,15 21,69 21,42 21,73 192,54 21,39 21,41S7-G 24,70 25,19 25,23 24,49 24,31 24,27 24,59 25,02 25,30 223,10 24,79S6-F 24,69 24,16 24,18 23,10 22,49 22,29 22,84 22,94 23,78 210,47 23,39 23,50S7-G 25,19 24,72 24,78 24,97 24,87 24,46 24,42 24,36 24,98 222,75 24,75S8-H 25,60 25,89 25,54 26,30 26,55 26,33 26,24 26,45 25,86 234,76 26,08 26,23S7-G 25,08 24,49 24,83 24,80 24,88 24,75 24,83 25,20 24,59 223,45 24,83S9-I 26,52 26,33 26,19 26,54 25,72 26,95 26,63 26,52 26,62 238,02 26,45 26,52S7-G 25,00 25,20 25,04 24,20 24,66 24,40 25,26 24,32 24,88 222,96 24,77S10-J 28,41 27,57 27,60 26,90 26,79 26,43 26,50 27,24 26,30 243,74 27,08 27,21
24.9024.9DATOS 24
Puntos Diámetro Concentración Log (Conc.) Peso (mg) 17,0(mm) (mg/ml) Potencia (P) UI/mg 75,1
S1 16,91 0,05 -1,3010 Fecha de Vencimiento N.AS2 19,32 0,10 -1,0000 Lote N1E200S3 19,87 0,15 -0,8239 DATOSS4 20,69 0,20 -0,6990 Pendiente 0,1278S5 21,41 0,25 -0,6021 Intercepto -3,1322S6 23,50 0,51 -0,2924 Factor de Dilucion (D) 1250S7 24,66 1,02 0,0086 Promedio General S8 26,23 1,53 0,1847 Concentracion Central 24,90S9 26,52 2,04 0,3096S10 27,21 2,55 0,4065 Pr T (X S3)es mayor que Pr R= Suma
Pr T (X S3)es menor que Pr R= Resta
CURVA ESTANDAR ESTANDAR
BACTRAN 15%LINEALIDAD METODO BACITRACINA
Caja 1 Caja 2 Caja 3

84
• Análisis de la Varianza de la Linealidad Bacitracina Zinc
Shapiro Wilk Ho: Si hay normalidad
si p<0.05 rechazo la Ho
si p>0.05 acepto la Ho
Levene Ho: Si hay homogeneidad de varianzas
Si p< 0.05 rechazo la Ho
Si p >0.05 acepto la Ho
ANOVA Ho: No hay diferencias significativas
Si p<0.05 rechazo la Ho
Si p > 0.05 acepto la Ho
KruskalWallis Ho: No hay diferencias significativas
Si p<0.05 rechazo la Ho
Si p>0.05 acepto la Ho
Bartlett Ho: Si hay homogeneidad de varianzas
Si p< 0.05 rechazo la Ho
--------------------------------------------------------------------------------------------
Shapiro-Wilk normality test
data: resultado$residuals
W = 0.9903, p-value = 0.7595
Bartlett test of homogeneity of variances
data: values by ind
Bartlett's K-squared = 18.6254, df = 9, p-value = 0.02857
Si hay normalidad, No hay homogeneidad de varianzas
Kruskal-Wallis rank sum test
data: values by ind
Kruskal-Wallis chi-squared = 86.2592, df = 9, p-value = 9.14e-15
Si hay diferencias significativas entre los tratamientos con zinc (Kruskal-Wallis p< 0.05)
(k=86.25 GL=9 N=90 p<0.05)

85
ANEXO 4. LINEALIDAD DEL MÉTODO BACITRACINA METILEN DISALICILATO
• Regresión lineal de Linealidad del método Bacitracina Metilen Disalicilato generado por el programa Statgraphics Plus for Windows 2.0
Regression Analysis - Linear model: Y = a + b*X
-----------------------------------------------------------------------------
Dependent variable: LogCon
Independent variable: Diametro
-----------------------------------------------------------------------------
The linearity of the method is tested with the following data :
Puntos Diámetro Concentración Log (Conc.) (mm) (UI/ml)
S1 18,65 0,05 -1,3010 S2 18,74 0,10 -1,0000 S3 19,19 0,15 -0,8239 S4 20,03 0,20 -0,6990 S5 20,50 0,25 -0,6021 S6 22,66 0,51 -0,2924 S7 23,42 1,02 0,0086 S8 25,09 1,53 0,1847 S9 26,08 2,04 0,3096 S10 26,63 2,55 0,4065
------------------------------------------------------------------------------
Standard T
Parameter Estimate Error Statistic P-Value
-----------------------------------------------------------------------------
Intercept -4,52561 0,299245 -15,1234 0,0000
Slope 0,187593 0,0134235 13,9749 0,0000

86
Analysis of Variance
----------------------------------------------------------------------------------------------------
Source Sum of Squares Df Mean Square F-Ratio P-Value
----------------------------------------------------------------------------------------------------
Model 3,02528 1 3,02528 195,30 0,0000
Residual 0,123924 8 0,0154905
-----------------------------------------------------------------------------
Total (Corr.) 3,1492 9
Correlation Coefficient = 0,980127
R-squared = 96,0649 percent
Standard Error of Est. = 0,124461
The StatAdvisor
---------------
The output shows the results of fitting a linear model to describe
the relationship between LogCon and Diametro. The equation of the
fitted model is
LogCon = -4,52561 + 0,187593*Diametro
Since the P-value in the ANOVA table is less than 0.01, there is a
statistically significant relationship between LogCon and Diametro at
the 99% confidence level.
The R-Squared statistic indicates that the model as fitted explains
96,0649% of the variability in LogCon. The correlation coefficient
equals 0,980127, indicating a relatively strong relationship between
the variables. The standard error of the estimate shows the standard
deviation of the residuals to be 0,124461. This value can be used to
construct prediction limits for new observations by selecting the
Forecasts option from the text menu.

87
Diámetro (mm)
Log
conc
entra
ción
18 20 22 24 26 28-1,4
-1
-0,6
-0,2
0,2
0,6
LogCon = ‐4,52561 + 0,187593*Diametro
---------------------------------------------------------------------------Plot of the residuals
Diámetro
Log
conc
entra
ción
0 2 4 6 8 10-0,15
-0,1
-0,05
0
0,05
0,1
0,15
-----------------------------------------------------------------------------
Test for the existence of a significant slope (F1)
Confidence level 95
Degrees of freedom (1,2) 9
F table 195.30

88
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11g/100g Lote LO70701
Curva EstándarTotal Promedio Promedio corr
S7-G 23,58 23,66 23,76 22,98 23,80 23,66 24,18 23,50 23,57 212,69 23,63S1-A 17,09 17,91 17,37 17,70 16,91 17,40 17,14 17,80 17,09 156,41 17,38 18,65S7-G 22,80 23,54 23,23 24,03 24,33 24,29 23,63 24,50 23,80 214,15 23,79S2-B 16,99 17,30 17,37 18,42 18,10 18,66 16,61 17,68 16,52 141,04 17,63 18,74S7-G 24,04 23,41 23,35 23,19 23,70 23,58 23,60 23,12 23,22 211,21 23,47S3-C 16,98 18,20 18,42 17,50 17,06 17,94 17,87 18,23 17,58 159,78 17,75 19,19S7-G 23,02 23,51 22,82 23,99 23,64 23,46 23,57 22,66 22,40 209,07 23,23S4-D 18,36 18,82 18,22 19,38 18,37 18,26 17,16 17,90 18,81 165,28 18,36 20,03S7-G 23,10 23,18 24,15 23,41 23,82 24,02 23,44 23,20 23,67 211,99 23,55S5-E 18,73 18,87 19,14 18,77 19,41 19,42 18,73 19,70 19,63 172,40 19,16 20,50S7-G 23,20 20,09 23,01 23,77 23,25 24,43 23,26 23,18 23,33 207,52 23,06S6-F 20,84 20,54 21,90 20,11 20,86 21,04 20,54 20,45 21,07 187,35 20,82 22,66S7-G 23,90 23,32 23,68 22,94 23,24 23,20 23,92 23,75 23,54 211,49 23,50S8-H 24,57 23,53 23,03 23,93 23,95 23,58 23,17 23,72 23,72 213,20 23,69 25,09S7-G 24,80 23,62 23,38 23,31 23,60 23,22 23,58 23,06 23,22 211,79 23,53S9-I 24,13 25,01 25,60 24,21 24,18 24,19 24,68 25,50 24,93 222,43 24,71 26,08S7-G 23,29 23,03 22,86 23,21 23,03 23,05 23,13 23,00 22,60 207,20 23,02S10-J 24,79 25,22 24,80 24,60 25,11 24,04 24,90 24,83 24,52 222,81 24,76 26,63
S7-G 23,42 24.9024.9DATOS 24
Puntos Diámetro Concentración Log (Conc.) Peso (m g) 17,0(mm) (mg/ml) Potencia (P) UI/m g 75,1
S1 18,65 0,05 -1,3010 Fecha de Vencim ientoS2 18,74 0,10 -1,0000 Lote N1E200S3 19,19 0,15 -0,8239 DATOSS4 20,03 0,20 -0,6990 Pendiente 0,1278 Pr T (X S3)es mayor que Pr R= SumaS5 20,50 0,25 -0,6021 Intercepto -3,1322 Pr T (X S3)es menor que Pr R= RestaS6 22,66 0,51 -0,2924 Factor de Dilucion (D) 1250S7 23,42 1,02 0,0086 Prom edio General S8 25,09 1,53 0,1847 Concentracion Central 24,90S9 26,08 2,04 0,3096S10 26,63 2,55 0,4065
CURVA ESTANDAR ESTANDAR
BACTRAN 11%LINEALIDAD METODO BACITRACINA
Caja 1 Caja 2 Caja 3

89
• Análisis de la Varianza de la Linealidad Bacitracina Metilen Disalicilato
Shapiro Wilk Ho: Si hay normalidad
si p<0.05 rechazo la Ho
si p>0.05 acepto la Ho
Levene Ho: Si hay homogeneidad de varianzas
Si p< 0.05 rechazo la Ho
Si p >0.05 acepto la Ho
ANOVA Ho: No hay diferencias significativas
Si p<0.05 rechazo la Ho
Si p > 0.05 acepto la Ho
KruskalWallis Ho: No hay diferencias significativas
Si p<0.05 rechazo la Ho
Si p>0.05 acepto la Ho
Bartlett Ho: Si hay homogeneidad de varianzas
Si p< 0.05 rechazo la Ho
Shapiro-Wilk normality test
data: resultado$residuals
W = 0.9903, p-value = 0.7595
Bartlett test of homogeneity of variances
data: values by ind
Bartlett's K-squared = 11.5462, df = 9, p-value = 0.2401
Si Hay normalidad, Si hay homogeneidad de varianzas
ANOVA
Df Sum Sq Mean Sq F value Pr(>F)
ind 9 759.33 84.37 347.35 < 2.2e-16 ***
Residuals 79 19.19 0.24
Signif. codes: 0 '***' 0.001 '**' 0.01 '*' 0.05 '.' 0.1 ' ' 1 1 observation deleted due to missingness
Si hay diferencias significativas entre los tratamientos con metilen (ANOVA de una via p< 0.05)

90
ANEXO 5 ESPECIFICIDAD BACITRACINA ZINC
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL M UESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
Caja 1 Caja 2 Caja 3 Promedio Promedio corrS3 22,81 22,49 22,82 22,29 23,21 23,05 23,11 23,09 23,06 22,88MUESTRA 23,05 23,36 22,89 22,86 23,1 23,21 22,98 23,01 23,09 23,06 25,08
Caja 1 Caja 2 Caja 3 Promedio
S3 23,48 22,99 23,76 23,47 23,11 23,29 22,49 22,99 22,76 23,15PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
Caja 1 Caja 2 Caja 3 PromedioS3 24,67 24,68 24,28 24,42 24,35 24,21 24,52 24,34 23,84 24,37DILUENTE --- --- --- --- --- --- --- --- --- 0,00 ---
MUESTRA PLACEBO DILUENTE Peso (mg) 17,025,08 0,00 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,183 Fecha de vencim iento N.A.Log (Concentración) 0,073 N1E200
217,1 217,16,8 --- --- Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,90
RESULTADOM1 MUESTRA 6,8 g / 100gM2 PLACEBO NO PRODUCE HALO
M3 DILUENTE NO PRODUCE HALO Pr T (X S3)es mayor que Pr R= Suma
Pr T (X S3)es menor que Pr R= Resta
BACTRAN 15%ESPECIFICIDAD
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra (mg) DATOSg Bacitracina /100 g
Factor de Dilución (D)

91
ANEXO 6 ESPECIFICIDAD BACITRACINA METILEN DISALICILATO
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL M UESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
Caja 1 Caja 2 Caja 3 Promedio Promedio corrS3 24,13 24,99 24,78 24,63 24,69 25,09 25,20 24,53 24,59 24,74MUESTRA 24,66 24,80 24,84 25,50 24,92 24,52 25,62 24,37 24,74 24,89 25,05
Caja 1 Caja 2 Caja 3 Promedio
S3 22,73 23,21 22,91 23,01 23,35 22,38 23,12 22,84 22,17 22,86PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
Caja 1 Caja 2 Caja 3 PromedioS3 24,67 24,68 24,28 24,42 24,35 24,21 24,52 24,34 23,84 24,37DILUENTE --- --- --- --- --- --- --- --- --- 0,00 ---
MUESTRA PLACEBO DILUENTE Peso (mg) 17,025,05 0,00 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,17 Fecha de vencimiento N.A.Log (Concentración) 0,07 N1E200
292,30 292,35,01 --- --- Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,9
RESULTADOM1 MUESTRA 5,0 g / 100gM2 PLACEBO NO PRODUCE HALO
M3 DILUENTE NO PRODUCE HALO Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%ESPECIFICIDAD
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra (mg) DATOSg Bacitracina /100 g
Factor de Dilución (D)

92
ANEXO 7. SELECTIVIDAD BACITRACINA ZINC
ACTIVO Bacitracina Zinc
Concentración 15 g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL M UESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,23 21,94 22,01 23,39 22,91 21,52 22,24 23,84 23,80 22,65ESTANDAR --- --- --- --- --- --- --- --- --- 0,00 ---
Promedio
S3 22,06 21,51 22,90 22,27 22,83 22,57 22,63 23,16 23,34 22,59MUESTRA --- --- --- --- --- --- --- --- --- 0,00 ---
PromedioS3 23,78 25,14 24,64 24,49 23,93 24,07 24,26 24,13 23,99 24,27PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,00,000 0,000 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recupe 0,001 0,001 Fecha de vencimiento N.A.Log (Concentración) -3,132 -3,132 N1E200
17,00 217,20 217,201,021 0,004 Pendiente 0,12780,072 0,028 --- Intercepto -3,1322
1250Promedio General Concentracion Central 24,90
M UESTRA DEGRADACIONM1 ESTÁNDAR 99,9M2 MUESTRA 100,0
M3 PLACEBO ---- Pr T (X S3)es mayor que Pr R= Suma
Pr T (X S3)es menor que Pr R= Resta
BACTRAN 15%SELECTIVIDAD CONDICION ACIDA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje %
Factor de Dilución (D)

93
ACTIVO Bacitracina Zinc
Concentración 15 g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,42 22,62 22,90 22,60 21,83 22,72 21,87 22,86 21,92 22,42ESTANDAR --- --- --- --- --- --- --- --- --- 0,00 ---
Promedio
S3 23,42 23,38 21,86 22,82 21,50 21,94 22,70 22,29 22,71 22,51MUESTRA --- --- --- --- --- --- --- --- --- 0,00 ---
PromedioS3 23,04 24,31 23,37 24,15 23,55 24,08 23,77 23,36 23,73 23,71PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,00,000 0,000 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,001 0,001 Fecha de vencimiento N.A.Log (Concentración) -3,132 -3,132 N1E200
17,00 217,20 217,201,021 0,004 Pendiente 0,12780,072 0,028 --- Intercepto -3,1322
1250Promedio General Concentracion Central 24,90
MUESTRA DEGRADACION
M1 ESTÁNDAR 99,9 Pr T (X S3)es mayor que Pr R= SumaM2 MUESTRA 100,0 Pr T (X S3)es menor que Pr R= RestaM3 PLACEBO ----
BACTRAN 15%SELECTIVIDAD CONDICION BASICA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje
Factor de Dilución (D)

94
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 24,11 23,53 23,97 23,50 23,52 23,77 23,67 23,27 23,20 23,62ESTANDAR 22,09 22,96 22,47 22,80 22,49 22,36 22,34 22,30 22,21 22,45 23,73
Promedio
S3 23,98 23,42 23,83 23,43 24,50 24,42 24,17 23,54 24,82 24,01MUESTRA 22,48 22,76 22,32 21,21 21,34 21,44 22,16 22,88 22,32 22,10 22,99
PromedioS3 23,48 22,99 23,76 23,47 23,11 23,29 22,49 22,99 22,76 23,15PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,023,73 22,99 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,795 0,639 0,001 Fecha de vencimiento N.A.Log (Concentración) -0,099 -0,194 -3,132 N1E200
17,0 217,2 217,21,021 3,680 0,000 Pendiente 0,1278
77,886 24,532 --- Intercepto -3,13221250
Promedio General Concentracion Central 24,90
MUESTRA DEGRADACION Pr T (X S3)es mayor que Pr R= SumaM1 ESTÁNDAR 22,1 Pr T (X S3)es menor que Pr R= RestaM2 MUESTRA 75,5M3 PLACEBO ---
BACTRAN 15%SELECTIVIDAD CONDICION TERMICA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje %
Factor de Dilución (D)

95
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,01 24,38 23,91 24,06 23,76 23,18 24,25 23,40 23,03 23,66ESTANDAR 23,14 22,92 23,40 23,10 22,83 22,24 22,33 22,27 22,36 22,73 23,97
Promedio
S3 24,14 23,76 24,22 23,26 24,88 23,88 23,94 24,66 24,58 24,15MUESTRA 23,94 23,90 24,84 23,76 23,84 23,84 24,61 23,47 24,32 24,06 24,81
PromedioS3 23,48 22,99 23,76 23,47 23,11 23,29 22,49 22,99 22,76 23,15PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,023,968 24,811 0,000 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,853 1,093 0,001 Fecha de vencimiento N.A.Log (Concentración) -0,069 0,039 -3,132 N1E200
17,40 217,90 217,201,045 6,271 Pendiente 0,1278
81,584 17,432 --- Intercepto -3,13221250
Promedio General Concentracion Central 24,90
MUESTRA DEGRADACION Pr T (X S3)es mayor que Pr R= SumaM1 ESTÁNDAR 18,4 Pr T (X S3)es menor que Pr R= RestaM2 MUESTRA 82,6M3 PLACEBO ----
BACTRAN 15%SELECTIVIDAD CONDICION ULTRAVIOLETA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje %
Factor de Dilución (D)

96
ANEXO 8. SELECTIVIDAD BACITRACINA METILEN DISALICILATO
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL M UESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,23 21,94 22,01 23,39 22,91 21,52 22,24 23,84 23,80 22,65ESTANDAR --- --- --- --- --- --- --- --- --- 0,00 ---
Promedio
S3 22,72 21,94 22,64 22,29 22,73 22,58 23,07 21,89 21,86 22,41MUESTRA --- --- --- --- --- --- --- --- --- 0,00 ---
PromedioS3 23,49 23,32 23,59 23,56 23,71 24,05 24,35 23,55 23,93 23,73PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,00,0 0,0 0,0 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,001 0,001 Fecha de vencimiento N.A.Log (Concentración) -3,132 -3,132 N1E200
17,0 293,1 293,11,021 0,003 Pendiente 0,12780,072 0,029 --- Intercepto -3,1322
1250Promedio General Concentracion Central 24,9
M UESTRA DEGRADACIONM1 ESTÁNDAR 99,9M2 MUESTRA 100,0
M3 PLACEBO ---- Pr T (X S3)es mayor que Pr R= Suma
Pr T (X S3)es menor que Pr R= Resta
BACTRAN 11%SELECTIVIDAD CONDICION ACIDA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje %
Factor de Dilución (D)

97
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,42 22,62 22,90 22,60 21,83 22,72 21,87 22,86 21,92 22,42ESTANDAR --- --- --- --- --- --- --- --- --- 0,00 ---
Promedio
S3 23,67 22,38 23,03 23,31 22,53 23,28 23,34 22,15 22,52 22,91MUESTRA --- --- --- --- --- --- --- --- --- 0,00 ---
PromedioS3 24,43 24,70 24,36 23,85 23,84 23,33 24,92 24,26 24,08 24,20PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,00,0 0,0 0,0 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,001 0,001 Fecha de vencimiento N.ALog (Concentración) -3,132 -3,132 N1E200
17,0 293,1 239,11,021 0,003 Pendiente 0,12780,072 0,029 --- Intercepto -3,1322
1250Promedio General Concentracion Central 24,9
MUESTRA DEGRADACIONM1 ESTÁNDAR 99,9 Pr T (X S3)es mayor que Pr R= SumaM2 MUESTRA 100,0 Pr T (X S3)es menor que Pr R= RestaM3 PLACEBO ----
BACTRAN 11%SELECTIVIDAD CONDICION BASICA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje
Factor de Dilución (D)

98
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 24,11 23,53 23,97 23,50 23,52 23,77 23,67 23,27 23,20 23,62ESTANDAR 22,09 22,96 22,47 22,80 22,49 22,36 22,34 22,30 22,21 22,45 23,73
Promedio
S3 22,58 22,40 22,71 22,66 23,14 22,52 21,70 22,36 21,80 22,43MUESTRA 20,62 21,49 21,45 21,46 20,53 21,12 19,36 20,91 20,30 20,80 23,27
PromedioS3 22,73 23,21 22,91 23,01 23,35 22,38 23,12 22,84 22,17 22,86PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,023,73 23,27 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,795 0,695 Fecha de vencimiento N.A.Log (Concentración) -0,099 -0,158 N1E200
17,0 293,1 293,11,021 2,966 Pendiente 0,1278
77,886 26,963 --- Intercepto -3,13221250
Promedio General Concentracion Central 24,9
MUESTRA DEGRADACION Pr T (X S3)es mayor que Pr R= SumaM1 ESTÁNDAR 22,1 Pr T (X S3)es menor que Pr R= RestaM2 MUESTRA 73,0M3 PLACEBO ----
BACTRAN 11%SELECTIVIDAD CONDICION TERMICA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje %
Factor de Dilución (D)

99
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,01 24,38 23,91 24,06 23,76 23,18 24,25 23,40 23,03 23,66ESTANDAR 23,14 22,92 23,40 23,10 22,83 22,24 22,33 22,27 22,36 22,73 23,97
Promedio
S3 23,95 25,30 24,18 23,83 24,93 24,18 24,18 23,44 23,55 24,17MUESTRA 24,10 24,48 24,40 24,41 24,80 24,44 23,83 23,43 23,50 24,15 24,88
PromedioS3 22,73 23,21 22,91 23,01 23,35 22,38 23,12 22,84 22,17 22,86PLACEBO --- --- --- --- --- --- --- --- --- 0,00 ---
ESTANDAR MUESTRA PLACEBO Peso (mg) 17,023,97 24,88 0,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperada 0,853 1,117 Fecha de vencimiento N.A.Log (Concentración) -0,069 0,048 N1E200
17,4 292,5 293,11,0 4,77 Pendiente 0,127882 23 --- Intercepto -3,1322
1250Promedio General Concentracion Central 24,9
MUESTRA DEGRADACION Pr T (X S3)es mayor que Pr R= SumaM1 ESTÁNDAR 18,4 Pr T (X S3)es menor que Pr R= RestaM2 MUESTRA 76,6M3 PLACEBO ----
BACTRAN 11%SELECTIVIDAD CONDICION ULTRAVIOLETA
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje %
Factor de Dilución (D)

100
ANEXO 9. PRECISIÓN DEL METODO BACITRACINA ZINC
• PRECISION DE METODO BACITRACINA ZINC
La precisión del método es evaluado con los siguientes datos:
DATOS DEL GRUPO 1 - PRECISION DIA 1 ANALISTA 1
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.90 107.64
2 1,0 24.85 106.00
3 1,0 24.91 107.73
Media 24.886 107.123 Tendencia central
Desviación Estándar
0.032
0.976
Expresa la variabilidad del método
Coeficiente de variación
0.001 (0.127%)
0.009 (0.911%)
Debe ser inferior al 5%
Desviación estándar de la media
0.096
2.829
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.886±4.303* 0.032/√3
IC= 107.12± 4.303*0.976/√3
24.80-24.96
104.6-109.5
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.001
0.95

101
DATOS DEL GRUPO 2 - PRECISION DIA 1 ANALISTA 2
Muestra Concentración (UI/ml) Diámetro (mm) %
Recuperación
1 1,0 24,82 105.12
2 1,0 24.94 108.83
3 1,0 24.90 107.18
Media 24.887 107.043 Tendencia central
Desviación Estándar
0.060
1.857
Expresa la variabilidad del método
Coeficiente de variación
0.002
(0.241%)
0.017
(1.735%)
Debe ser inferior al 5%
Desviación estándar de la media
0.096
2.829
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.887±4.303* 0.060/√3
IC = 107.04 ± 4.303 *1.857/√3
24.73-25.03
102.4-111.6
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.004
3.45

102
DATOS DEL GRUPO 3 - PRECISION DIA 2 ANALISTA 1
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.71 101.79
2 1,0 24.65 99.84
3 1,0 24.77 103.43
Media 24.711 101.692 Tendencia central
Desviación Estándar
0.060
1.797
Expresa la variabilidad del método
Coeficiente de variación
0.002
(0.243%)
0.018
(1.767%)
Debe ser inferior al 5%
Desviación estándar de la media
0.096
2.829
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.711±4.303* 0.06/√3
IC = 101.6±4.303 *1.797/√3
24.56-24.86
97.13-106.0
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.004
3.23

103
DATOS DEL GRUPO 4 - PRECISION DIA 2 ANALISTA 2
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.96 103.32
2 1,0 24.91 106.56
3 1,0 24.91 107.44
Media 24.925 107.772 Tendencia central
Desviación Estándar
0.031
1.410
Expresa la variabilidad del método
Coeficiente de variación
0.001
(0.124%)
0.013
(1.308%)
Debe ser inferior al 5%
Desviación estándar de la media
0.096
2.829
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.925±4.303* 1.410/√3
IC = 107.7 ± 4.303 * 1.41/√3
21.42-28.42
104.2-111.2
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.001
1.99

104
DATOS DEL GRUPO 5 - PRECISIONES ANALISTAS
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.90 107.64
2 1,0 24.85 106.00
3 1,0 24.91 107.73
4 1,0 24,82 105.12
5 1,0 24.94 108.83
6 1,0 24.90 107.18
7 1,0 24.71 101.79
8 1,0 24.65 99.84
9 1,0 24.77 103.43
10 1,0 24.96 103.32
11 1,0 24.91 106.56
12 1,0 24.91 107.44
Media 24.853 105.907 Tendencia central
Desviación Estándar
0.097
2.880
Expresa la variabilidad del método
Coeficiente de variación
0.004
(0.389%)
0.027
(2.720%)
Debe ser inferior al 5%
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.85±2.201* 0.097/√12
IC= 105.9±2.201* 2.88/√11
24.78-24.91
103.9-107.8
Limites de confianza de la media

105
# Diámetro % Recuperación Sesgo (b) 1 24,886 107,123 7,123 2 24,887 107,043 7,043 3 24,711 101,692 -1,692 4 24,925 107,772 7,772
Varianza 0,009 8,005 Media 24,852 Ř 105,908 5,062
Desviación estándar 0,096 2,829 4,514 Coeficiente de
variación 0,004 0,027 0,892 % Coeficiente de
variación 0,386 2,671 89,186
t de Student
texp = (100 – Ř) √n / CV%
texp = (100 – 105.908) √4 / 2.671 = 4.423
Para p= 0.05/2 y v= 4 tTablas tiene un valor de 3.182:
X= X ± t S/√n X= X ± t S/√n
X= 24.852± 0.1527 X= 105.908 ± 4.5009
X1= 24.699 X2= 25.004 X1= 101.407 X2= 110.408
Números de datos 12
Números de datos usados en el calculo
11
Nivel de confianza 95%
Varianza del grupo % Recuperación
Varianza del grupo
0.009
8.296
Numero de datos totales para el calculo 12
Nivel de confianza (1-α/2) 95.00
Grados de libertad 11
t (table) ( Test T Student) 3.182

106
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,81 22,49 22,82 22,29 23,21 23,05 23,11 23,09 23,06 23,02M1 23,05 23,36 22,89 22,86 23,10 23,21 22,98 23,01 23,09 23,02 24,90
Promedio
S3 23,19 23,06 24,50 24,20 23,31 23,19 23,81 24,00 23,57 23,72M2 23,10 23,04 24,25 23,57 23,63 24,23 23,65 24,09 24,06 23,67 24,85
PromedioS3 23,82 24,58 23,82 23,14 23,74 23,84 23,19 24,46 23,78 23,82M3 23,51 24,17 23,95 23,80 23,60 24,17 23,46 24,27 23,50 23,83 24,91
M1 M2 M3 Peso (mg) 17,024,90 24,85 24,91 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,122 1,106 1,124 Fecha de vencimiento N.A.Log (Concentración) 0,050 0,044 0,051 N1E200
0,2171 0,2171 0,21726.461 6366 6470 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Factor de Dilución (D)Potencia Promedio 6432% 107,1
Lote Cantidad Muestra (g) DATOSg Bacitracina Zinc /100 g
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACTRAN 15%PRECISION DIA 1 ANALISTA 1
Caja 1 Caja 2 Caja 3

107
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,03 24,01 23,27 23,49 23,31 24,76 23,19 23,59 23,83 23,61M1 23,26 23,20 23,09 23,52 23,80 24,45 23,87 23,08 23,52 23,53 24,82
Promedio
S3 24,36 24,40 23,50 24,77 23,64 24,26 24,05 23,81 23,81 24,21M2 24,50 24,15 24,22 24,71 24,41 24,70 24,15 24,23 23,65 24,25 24,94
PromedioS3 24,15 23,55 24,24 23,33 23,89 24,01 23,75 24,21 24,19 23,92M3 24,40 23,31 23,91 23,00 24,11 24,22 23,88 23,96 24,49 23,92 24,90
M1 M2 M3 Peso (mg) 1724,82 24,94 24,90 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,097 1,135 1,121 Fecha de vencimiento N.A.Log (Concentración) 0,040 0,055 0,049 N1E200
0,2172 0,2173 0,21766314 6531 6437 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Factor de Dilución (D)Potencia Promedio 6.427% 107,0
Lote Cantidad Muestra (g) DATOSg Bacitracina Zinc/100 g
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACTRAN 15%PRECISION DIA 1 ANALISTA 2
Caja 1 Caja 2 Caja 3

108
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 25,34 23,98 24,57 25,58 24,65 25,20 24,95 25,30 25,41 24,93M1 24,65 23,83 24,51 24,86 23,63 24,13 25,68 25,24 25,00 24,74 24,71
Promedio
S3 25,53 25,32 25,37 25,63 25,20 25,60 25,89 25,68 24,77 25,39M2 25,52 25,32 25,01 25,25 25,07 24,96 25,24 24,87 24,73 25,14 24,65
PromedioS3 24,53 24,19 24,33 24,66 24,93 24,77 25,10 25,88 25,50 24,88M3 24,33 24,39 25,04 24,54 24,57 24,65 25,52 25,05 24,63 24,75 24,77
M1 M2 M3 Peso (mg) 17,024,71 24,65 24,77 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,061 1,042 1,080 Fecha de vencimiento N.ALog (Concentración) 0,026 0,018 0,033 N1E200
0,2171 0,2173 0,21736.109,3 5.996,8 6.212,4 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Factor de Dilución (D)Potencia Promedio 6.106% 101,7
Lote Cantidad Muestra (g) DATOSg Bacitracina Zinc /100 g
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACTRAN 15%PRECISION DIA 2 ANALISTA 1
Caja 1 Caja 2 Caja 3

109
ACTIVO Bacitracina Zinc
Concentración 15g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.2 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 25,43 24,54 24,54 25,57 25,38 24,89 24,80 25,62 24,89 25,07M1 25,18 24,20 25,42 25,73 25,11 25,63 25,01 25,58 24,35 25,13 24,96
Promedio
S3 24,48 24,74 25,34 24,96 25,12 25,33 24,53 25,28 24,12 24,88M2 24,57 25,61 24,97 24,96 25,47 25,34 24,33 24,67 24,07 24,89 24,91
PromedioS3 25,21 26,11 25,24 25,01 24,56 26,18 25,31 25,57 24,80 25,52M3 24,46 25,66 25,80 25,90 26,13 25,83 25,47 25,28 25,79 25,52 24,91
M1 M2 M3 Peso (mg) 1724,96 24,91 24,91 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,142 1,125 1,125 Fecha de vencimiento N.ALog (Concentración) 0,058 0,051 0,051 N1E200
0,2175 0,2198 0,21776.566 6.400 6.462 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Factor de Dilución (D)Potencia Promedio 6.476% 107,8
Lote Cantidad Muestra (g) DATOSg Bacitracina Zinc /100 g
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACTRAN 15%PRECISION DIA 2 ANALISTA 2
Caja 1 Caja 2 Caja 3

110
ANEXO 10. PRECISIÓN DE METODO BACITRACINA METILEN DISALICILATO
• PRECISION DE METODO BACITRACINA METILEN DISALICILATO
La precisión del método es evaluado con los siguientes datos:
DATOS DEL GRUPO 1 - PRECISION DIA 1 ANALISTA 1
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.88 106.28
2 1,0 24.87 105.93
3 1,0 24.84 104.90
Media 24.863 105.704 Tendencia central
Desviación Estándar
0.024
0.720
Expresa la variabilidad del método
Coeficiente de variación
0.001
(0.097%)
0.007
(0.681%)
Debe ser inferior al 5%
Desviación estándar de la media
0.078
2.368
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.86±4.303* 0.024/√3
IC = 105.7 ± 4.303 * 0.720/√3
24.80-24.91
103.9-107.4
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.001
0.517

111
DATOS DEL GRUPO 2 - PRECISION DIA 1 ANALISTA 2
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24,91 106.90
2 1,0 24,97 109.39
3 1,0 25,00 109.98
Media 24.961 108.755 Tendencia central
Desviación Estándar
0.049
1.638
Expresa la variabilidad del método
Coeficiente de variación
0.002
(0.194%)
0.015
(1.50%)
Debe ser inferior al 5%
Desviación estándar de la media
0.11
2.368
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.96±4.303* 0.049/√3
IC = 108.75 ± 4.303*1.638/√3
24.83-25.08
104.6-112.8
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.002
2.682

112
DATOS DEL GRUPO 3 - PRECISION DIA 2 ANALISTA 1
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.92 107.64
2 1,0 24.93 108.0
3 1,0 24.95 108.20
Media 24.935 107.947 Tendencia central
Desviación Estándar
0.014
0.282
Expresa la variabilidad del método
Coeficiente de variación
0.001
(0.055%)
0.003
(0.261%)
Debe ser inferior al 5%
Desviación estándar de la media
0.078
2.368
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.935±4.303* 0.014/√3
IC = 107.9 ± 4.303 * 0.282/√3
24.90-24.96
107.2-108.6
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.0002
0.080

113
DATOS DEL GRUPO 4 - PRECISION DIA 2 ANALISTA 2
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.73 101.86
2 1,0 24.71 101.10
3 1,0 24.92 107.58
Media 24.786 103.512 Tendencia central
Desviación Estándar
0.115
3.542
Expresa la variabilidad del método
Coeficiente de variación
0.005
(0.464%)
0.034
(3.421%)
Debe ser inferior al 5%
Desviación estándar de la media
0.078
2.368
Expresa la variabilidad del método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.78±4.303* 0.115/√3
IC = 103.51 ± 4.303*3.542/√3
24.49-25.06
94.71-112.3
Limites de confianza de la media
Números de datos 3
Números de datos usados en el calculo
3
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.01
12.54

114
DATOS DEL GRUPO 5 - PRECISIONES ANALISTAS
Muestra Concentración (UI/ml) Diámetro (mm) % Recuperación
1 1,0 24.88 106.28
2 1,0 24.87 105.93
3 1,0 24.84 104.90
4 1,0 24,91 106.90
5 1,0 24,97 109.39
6 1,0 25,00 109.98
7 1,0 24.92 107.64
8 1,0 24.93 108.0
9 1,0 24.95 108.20
10 1,0 24.73 101.86
11 1,0 24.71 101.10
12 1,0 24.92 107.58
Media 24.886 106.48 Tendencia central
Desviación Estándar
0.089
2.728
Expresa la variabilidad del método
Coeficiente de variación
0.004
(0.357%)
0.025
(2.561%)
Debe ser inferior al 5%
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.88±2.201* 0.089/√12
IC= 106.48±2.201*2.728/√12
24.82-24.94
104.7-108.2
Limites de confianza de la media
Números de datos 12
Números de datos usados en el calculo
12
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.008
7.441

115
# Diámetro %
Recuperación Sesgo (b) 1 24,86 105,704 5,704 2 24,96 108,775 8,775 3 24,94 107,947 7,947 4 24,786 103,512 3,512
Varianza 0,006 5,610 Media 24,886 Ř 106,485 6,485
Desviación estándar 0,078 2,369 2,369 Coeficiente de variación 0,003 0,022 0,365
% Coeficiente de variación 0,315 2,224 36,526
t de Student
texp = (100 – Ř) √n / CV%
texp = (100 – 106.485)√4 / 2.224 = 5.83
Para p= 0.05/2 y v= 3 tTablas tiene un valor de 3.182:
X= X ± t S/√n X= X ± t S/√n
X= 24.886 ± 0.1240 X= 106.485 ± 3.769
X1= 24..761 X2= 25.010 X1= 1102.715 X2= 110.254
Numero de datos totales para el calculo 12
Nivel de confianza (1-α/2) 95.00
Grados de libertad 11
t (table) ( Test T Student) 3.182

116
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 24,13 24,99 24,78 24,63 24,69 25,09 25,20 24,53 24,59 24,81M1 24,66 24,80 24,84 25,50 24,92 24,52 25,62 24,37 24,74 24,79 24,88
Promedio
S3 25,13 24,12 24,84 24,94 24,47 24,48 25,36 24,56 25,17 24,87M2 24,30 24,83 24,85 24,80 24,68 24,80 25,12 25,34 25,50 24,84 24,87
PromedioS3 25,10 25,45 25,20 24,75 24,54 25,20 25,62 24,83 24,80 25,05M3 25,20 25,20 25,16 24,71 25,22 24,50 25,04 24,88 25,00 24,99 24,84
M1 M2 M3 Peso (mg) 17,024,88 24,87 24,84 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,115 1,112 1,101 Fecha de vencimiento N.ALog (Concentración) 0,05 0,05 0,04 N1E200
0,2923 0,2924 0,29224770 4755 4710 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%PRECISION DIA 1 ANALISTA 1
MUESTRAS DATOS ESTANDAR
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
% Factor de Dilución (D)105,7
Diámetro
Lote Cantidad Muestra (g) DATOS
Caja 1 Caja 2 Caja 3
4745,0g Bacitracina Metilen Disalicilato /10
Potencia Promedio

117
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 25,72 25,75 25,33 25,19 25,03 25,11 25,10 25,51 25,51 25,36M1 25,82 25,60 25,27 25,04 25,46 24,54 25,41 25,69 25,49 25,37 24,91
Promedio
S3 24,52 25,23 24,82 25,08 24,99 24,66 24,59 24,49 24,81 24,80M2 24,57 25,55 24,71 24,76 24,90 25,20 24,56 24,45 25,16 24,87 24,97
PromedioS3 24,74 24,89 25,00 25,28 24,70 25,05 24,96 24,84 25,01 24,94M3 24,97 24,80 25,16 25,48 24,85 25,25 25,30 24,08 25,50 25,04 25,00
M1 M2 M3 Peso (mg) 17,024,91 24,97 25,00 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,125 1,147 1,156 Fecha de vencimiento N.ALog (Concentración) 0,051 0,060 0,063 N1E200
0,2929 0,2919 0,29274800 4911 4938 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%PRECISION DIA 1 ANALISTA 2
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra (g) DATOSg BacitracinaMetilen Disalicilato /100
Potencia Promedio 4.883% 108,8 Factor de Dilución (D)

118
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,14 21,99 21,76 23,05 22,09 22,41 21,54 22,49 23,05 22,28M1 22,67 22,17 21,84 21,93 22,07 23,20 22,76 22,20 21,89 22,30 24,92
PromedioS3 21,83 22,63 23,03 22,91 21,90 21,65 21,97 22,32 22,76 22,33M2 22,67 22,78 22,92 22,39 22,15 22,29 21,14 22,54 22,41 22,37 24,93
PromedioS3 21,58 22,53 21,61 21,37 21,84 23,01 23,08 21,99 21,78 22,26M3 22,96 22,10 21,80 21,33 22,78 23,23 22,56 22,72 22,22 22,31 24,95
M1 M2 M3 Peso (mg) 17,024,92 24,93 24,95 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,130 1,133 1,139 Fecha de vencimiento N.ALog (Concentración) 0,053 0,054 0,056 N1E200
0,2922 0,2920 0,29304.833 4.849 4.858 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%PRECISION DIA 2 ANALISTA 1
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra (g) DATOSg Bacitracina Metilen Disalicilato/100
Potencia Promedio 4.847% 107,9 Factor de Dilución (D)

119
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 292 mg 25 HCl 0,01N 1.0 UI/mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 21,25 23,45 23,20 23,51 23,70 23,30 23,21 23,60 22,48 23,08M1 21,85 22,70 22,17 23,76 23,12 22,20 23,83 23,03 23,52 22,91 24,73
Promedio
S3 23,18 23,26 23,09 22,23 23,89 22,65 22,92 23,67 23,18 23,05M2 22,95 23,52 23,32 22,35 22,20 22,07 22,78 23,12 23,41 22,86 24,71
PromedioS3 23,62 22,70 23,60 22,79 22,59 22,67 22,07 23,08 22,94 22,90M3 22,50 22,93 22,86 22,41 23,55 23,02 23,33 22,57 23,05 22,91 24,92
M1 M2 M3 Peso (mg) 17,024,73 24,71 24,92 Potencia (P) UI/mg 75,1
Concentración (UI/ml) 1,068 1,060 1,128 Fecha de vencimiento N.ALog (Concentración) 0,028 0,025 0,052 N1E200
0,2918 0,2920 0,29194.574 4.539 4.830 Pendiente 0,1278
Intercepto -3,13221250
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%PRECISION DIA 2 ANALISTA 2
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra (g) DATOSg Bacitracina Metilen Disalicilato /10
Factor de Dilución (D)Potencia Promedio 4.648% 103,5

120
ANEXO11. PRECISION DEL SISTEMA
• PRECISION DEL SISTEMA BACITRACINA
La precisión del método es evaluado con los siguientes datos:
Muestra Concentración (UI/ml) Diámetro (mm) %
Recuperación 1 1.0 24.84 107.79 2 1.0 24.89 109.58 3 1.0 24.76 105.50 4 1.0 24.82 107.44 5 1.0 24.66 102.30 6 1.0 24.77 105.80 7 1.0 24.81 107.10 8 1.0 24.77 105.85 9 1.0 24.83 107.46 10 1.0 24.83 107.55
Media 24.798 106.641 Tendencia central
Desviación Estándar
0.062
1.938
Expresa la variabilidad del método
Coeficiente de variación
0.003
(0.251%)
0.018
(1.817%)
Debe ser inferior al 5%
IC 95% para la media
(IC= X ± t * s/√n)
IC = 24.798±2.262* 0.062/√10
IC = 106.64 ± 2.262 * 1.938/√10
24.75-24.84
105.25-108.02
Limites de confianza de la media
Números de datos 10
Números de datos usados en el calculo
10
Nivel de confianza 95%
Varianza del grupo Diámetro (mm)
Varianza del grupo % Recuperación
0.004
3.755

121
ANEXO 12. EXACTITUD METODO BACITRACINA ZINC
• EXACTITUD DEL METODO BACITRACINA ZINC
La exactitud del método es evaluado con los siguientes datos:
Concentración Concentración Concentración
L. inferior 80% %
recuperación Teórico 100% %
recuperación L. superior120% %
recuperación
23,766 100,230 24,893 111,790 24,862 92,410
23,878 103,710 24,888 111,660 24,830 91,430 23,231 85,690 24,530 100,450 24,830 91,460
variancia 91.374 42.379 0.311
Homogeneidad de variancias (Test Cochran)
Gexp = S2max / S2
li +S2t +S2
is
Gexp = 91.374/ 91.374+42.379+0.311 = 0.682
Determinación del sesgo o error determinado
# %
recuperacion Sesgo (b) 1 100,230 -0,230 2 103,710 -3,710 3 85,690 14,310 4 111,790 -11,790 5 111,660 -11,660 6 100,450 -0,450 7 92,410 7,590 8 91,430 8,570 9 91,460 8,540
Promedio Ř 98,759 Б 1,241 Desvest 9,246 Media 98,759
CV 0,094 CV% 9,362
Variancia 85.485 e% 1,24
Valor de referencia 100,00
e [%]= (Б / valor de referencia ) * 100
e [%]= (1.241/100)*100= 1.24

122
t de Student
texp = (100 – Ř) √n / CV%
texp = (100 – 98,759) √9 / 9,362 = 0.39
para p= 0.05/2 y v= 8 tiene un valor de 2.306: no hay diferencia significativa entre la
recuperación de la media obtenida y el 100% por lo que la exactitud es conforme.
# halos 1 23,766
2 23,878 3 23,231 4 24,893 5 24,888 6 24,530 7 24,862 8 24,830 9 24,830
Varianza 0,390 Media 24,412
IC 0,408 Desvest 0,625
n 9 CV 0,026
CV% 2,559
Determinación
resultados Criterios de aceptación
Homogeneidad de variancias
P Valor Gexp = 0.682 P >0.005 (no significativo)
Sesgo
e%
1.24 Inferior al 3%
T de Student P Valor texp = 0.39 P > 0.05 ( no significativo)

123
Area
Confidence level (1-�/2) 95.00
Variance 0.390
Mean 24.41
Confidence interval 0.408
Coefficient of variation of repeatability 2.55%
Recovery
Variance 85.485
Coefficient of variation of repeatability 9.362%
Confidence level (1-�/2) 95.00
Degrees of freedom 8
Mean recovery 98.759
Interval confianza(+-) 6.040

124
ACTIVO Bacitracina Zinc
Concentración 15 g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 173.8 mg 25 HCl 0,01N 0,8 UI / mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,36 24,41 23,29 23,34 23,03 23,23 23,30 23,10 23,24 23,37M1 22,64 23,01 22,53 22,17 22,01 22,26 21,68 21,75 22,04 22,23 23,77
Promedio
S3 23,54 23,34 23,92 23,91 24,00 24,04 23,60 23,35 22,95 23,63M2 23,36 22,88 23,06 22,33 22,40 22,39 22,41 22,17 22,45 22,61 23,88
PromedioS3 23,36 24,64 23,59 24,30 24,08 24,49 24,42 23,66 24,03 24,06M3 21,28 22,97 22,45 22,27 22,86 23,59 21,99 22,69 21,45 22,39 23,23
M1 M2 M3 Peso (mg) 1723,766 23,878 23,231 Potencia (P) UI/mg 5,76
Concentración (UI/ml) recup 0,804 0,831 0,687 Fecha de vencimiento N.ALog (Concentración) -0,095 -0,081 -0,163 N1E200
174,0 173,8 173,90,802 0,801 0,801 Pendiente 0,1278
100,23 103,71 85,69 Intercepto -3,1322
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 15%EXACTITUD AL 80%
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje Recuperado%Porcentaje % 96,5 Factor de Dilución (D)

125
ACTIVO Bacitracina Zinc
Concentración 15 g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 217.27 mg 25 HCl 0,01N 1,0 UI / mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,51 22,20 23,73 23,83 23,73 23,37 23,87 23,27 23,34 23,43M1 22,12 23,36 24,10 23,56 23,82 23,34 23,76 23,45 23,28 23,42 24,89
Promedio
S3 23,34 22,92 23,16 22,96 22,25 23,13 23,19 24,02 24,13 23,23M2 23,33 23,83 22,24 22,92 22,95 23,43 23,23 23,22 23,84 23,22 24,89
PromedioS3 24,31 24,11 23,94 23,57 29,07 23,68 24,43 23,36 23,88 24,48M3 24,50 23,21 24,21 23,62 23,84 24,34 24,39 24,60 24,31 24,11 24,53
M1 M2 M3 Peso (mg) 1724,89 24,89 24,53 Potencia (P) UI/mg 5,76
Concentración (UI/ml) recup 1,120 1,118 1,006 Fecha de vencimiento N.ALog (Concentración) 0,049 0,048 0,003 N1E200
217,4 217,3 217,41,00 1,00 1,00 Pendiente 0,1278
111,79 111,66 100,45 Intercepto -3,1322
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 15%EXACTITUD AL 100%
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje Recuperado%Porcentaje % 108,0 Factor de Dilución (D)

126
ACTIVO Bacitracina Zinc
Concentración 15 g / 100g Lote 200711026
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 260.73 mg 25 HCl 0,01N 1,2 UI / mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,44 23,60 23,67 23,46 23,53 23,01 23,96 23,88 23,95 23,61M1 23,57 23,63 23,52 23,20 23,23 23,95 23,78 23,67 23,61 23,57 24,86
Promedio
S3 24,26 23,50 24,38 23,27 23,64 23,47 23,38 23,63 23,65 23,69M2 24,13 24,46 24,06 23,61 23,63 23,76 23,70 23,48 23,61 23,83 24,83
PromedioS3 23,44 23,96 23,72 24,38 24,09 23,82 24,19 24,62 24,02 24,03M3 23,93 24,02 23,86 24,21 23,59 23,84 24,50 24,39 23,27 23,96 24,83
M1 M2 M3 Peso (mg) 1724,86 24,83 24,83 Potencia (P) UI/mg 5,76
Concentración (UI/ml) recup 1,110 1,099 1,099 Fecha de vencimiento N.ALog (Concentración) 0,045 0,041 0,041 N1E200
260,6 260,9 260,81,20 1,20 1,20 Pendiente 0,1278
92,41 91,43 91,46 Intercepto -3,1322
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 15%EXACTITUD AL 120%
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje Recuperado%Porcentaje % 91,8 Factor de Dilución (D)

127
ANEXO 13. EXACTITUD DEL METODO BACITRACINA METILEN DISALICILATO
• EXACTITUD DEL METODO BACITRACINA METILEN DISALICILATO
La exactitud del método es evaluado con los siguientes datos:
Homogeneidad de variancias (Test Cochran)
Gexp = S2max / S2
li +S2t +S2
is
Gexp = 8.012/ 2.537+8.012+0.068 = 0.754
Determinacion del sesgo o error determinado
# % recuperacion Sesgo (b) 1 98,663 1,337 2 95,477 4,523 3 97,071 2,929 4 105,449 5,449 5 105,449 5,449 6 100,547 0,547 7 101,256 1,256 8 101,654 1,654 9 101,745 1,745
Promedio Ř 100,812 Б 2,766 Desvest 3,390 Media 100,812
CV 0,034 CV% 3,363
Variancia 11,492 e% 2,766
Valor de referencia 100,000
e [%]= (Б / valor de referencia ) * 100
e [%]= (2.766/100)*100= 2.76
Concentración Concentración Concentración
L. inferior 80% %
recuperación Teórico 100% %
recuperación L. superior120% %
recuperación
23.54 98.66 24.52 105.44 25.01 101.26 23.43 95.48 24.52 105.44 25.02 101.65 23.49 97.07 24.36 100.54 25.02 101.75
variancia 2.537 8.012 0.068

128
t de Student
texp = (100 – Ř) √n / CV%
texp = (100 – 100.812) √9 / 3.363 = 0.724
Para p= 0.05/2 y v= 8 tiene un valor de 2.306: no hay diferencia significativa entre la
recuperación de la media obtenida y el 100% por lo que la exactitud es conforme.
# halos 1 23,540 2 23,430 3 23,488 4 24,526 5 24,526 6 24,369 7 25,011 8 25,024 9 25,024
Variancia 0,456 Media 24,327
Desvest 0,675 n 9,000
CV 0,028 CV% 2,776
Determinación
resultados Criterios de aceptación
Homogenidad de variancias
P Valor Gexp = 0.754 P >0.005 (no significativo)
Sesgo e% 2.7 Inferior al 3%
T de Student O Valor texp = 0.724 P > 0.05 ( no significativo)

129
Area
Confidence level (1-�/2) 95.00
Variance 0.479
Mean 24.32
Coefficient of variation of repeatability 2.77%
Recovery
Variance 11.49
Coefficient of variation of repeatability 3.36%
Confidence level (1-�/2) 95.00
Degrees of freedom 8
Mean recovery 100.81

130
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 222.7 mg 25 HCl 0,01N 0,8 UI / mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,91 23,21 23,62 22,90 23,47 23,11 23,09 23,63 22,80 23,09M1 21,04 22,17 20,92 21,86 21,56 20,29 21,98 21,76 20,63 21,73 23,54
Promedio
S3 23,58 23,97 23,64 24,44 24,15 23,30 23,97 23,43 23,48 23,69M2 21,42 21,33 22,18 23,00 22,50 21,73 22,38 21,74 22,01 22,22 23,43
PromedioS3 23,58 22,94 23,00 23,59 23,64 24,12 23,09 23,01 23,39 23,37M3 22,79 21,67 21,79 24,12 21,09 22,51 20,97 21,80 20,91 21,96 23,49
M1 M2 M3 Peso (mg) 1723,54 23,43 23,49 Potencia (P) UI/mg 4,28
Concentración (UI/ml) recup 0,752 0,728 0,741 Fecha de vencimiento N.ALog (Concentración) -0,124 -0,138 -0,130 N1E200
222,6 222,7 222,80,76 0,76 0,76 Pendiente 0,127898,7 95,5 97,1 Intercepto -3,1322
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%EXACTITUD AL 80%
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra g DATOSUI reales / mg Porcentaje Recuperado%Porcentaje % 97,1 Factor de Dilución (D)

131
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 278.3 mg 25 HCl 0,01N 1,0 UI / mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 22,62 22,84 23,30 22,84 23,04 23,00 23,75 23,30 23,99 23,40M1 23,06 23,10 23,42 23,19 23,11 22,90 23,39 22,80 23,00 23,02 24,53
Promedio
S3 23,25 22,77 23,60 23,41 22,69 23,78 23,77 23,41 22,61 23,54M2 23,28 23,44 23,52 23,56 22,08 23,69 23,70 22,87 23,39 23,16 24,53
PromedioS3 23,24 23,94 23,86 24,25 23,24 24,07 24,73 24,38 24,29 24,10M3 23,48 23,77 23,13 23,08 24,52 23,69 23,53 24,20 23,52 23,56 24,37
M1 M2 M3 Peso (mg) 1724,526 24,526 24,369 Potencia (P) UI/mg 4,28
Concentración (UI/ml) recuperada 1,01 1,01 0,96 Fecha de vencimiento N.ALog (Concentración) 0,00 0,00 -0,02 M1E200
278,40 278,40 278,800,95 0,95 0,95 Pendiente 0,1278
105,449 105,449 100,547 Intercepto -3,1322
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
BACTRAN 11%EXACTITUD AL 100%
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Diámetro
Lote Cantidad Muestra mg DATOSUI reales / mg Porcentaje Recuperado%Porcentaje % 103,8 Factor de Dilución (D)

132
ACTIVO Bacitracina Metilen Disalicilato
Concentración 11 g / 100g Lote LO70701
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 334.07 mg 25 HCl 0,01N 1,2 UI / mL1 50 BPH6 1 50 BPH6
MuestrasPromedio Promedio corr
S3 23,63 24,53 23,51 22,65 23,53 23,63 24,04 24,64 24,04 23,80M1 24,05 24,55 23,75 23,88 23,87 24,56 23,62 23,19 23,73 23,91 25,01
Promedio
S3 24,14 23,77 24,40 23,43 23,94 23,38 24,00 24,01 23,85 23,88M2 24,65 23,20 23,44 23,81 23,47 23,07 24,48 23,85 23,71 23,74 25,02
PromedioS3 24,64 23,66 23,09 23,84 23,76 24,41 23,63 23,69 23,41 23,79M3 24,04 23,85 24,01 24,50 23,20 24,49 24,09 23,70 23,37 23,92 25,02
M1 M2 M3 Peso (mg) 1725,01 25,02 25,02 Potencia (P) UI/mg 4,28
Concentración (UI/ml) recup 1,159 1,164 1,164 Fecha de vencimiento N.ALog (Concentración) 0,064 0,066 0,066 N1E200
334,4 334,4 334,11,14 1,14 1,14 Pendiente 0,1278
101,26 101,65 101,75 Intercepto -3,1322---
Promedio General Concentracion Central 24,9
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Porcentaje Recuperado%Porcentaje % 101,6 Factor de Dilución (D)
Lote Cantidad Muestra mg DATOSUI reales / mg
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACTRAN 11%EXACTITUD AL 120%
Caja 1 Caja 2 Caja 3

133
ANEXO 14. LIMITE DE CUANTIFICACION
• LIMITE DE CUANTIFICACION DEL METODO BACITRACINA ESTANDAR
El método es evaluado con los siguientes datos:
# Concentración
(UI/ml) Diámetro (mm)% recuperación
1 0,02 17,82 669.00
2 0,02 17,55 616.90 3 0,02 17,57 620.60 4 0,02 17,55 617.30 5 0,02 17,15 548.20
6 0,02 17,40 591.30
Varianza 0.050 1572.275
Media 17.51 610.55 Tendencia central
Desviación Estándar
0.223
39.65
Expresa la variabilidad del
método
Coeficiente de variación
0.013
(1.272%)
0.065
(6.49%)
Debe ser inferior al 5%
Desviación estándar de la media
0.100
----------
Expresa la variabilidad del
método
IC 95% para la media
(IC= X ± t * s/√n)
IC = 17.51±2.571* 0.233/√6
IC= 610.55± 2.571*39.65/√6
17.26-17.75
568.93-652.16
Limites de confianza de la media
Números de datos 6
Números de datos utilizados en el calculo
6
Nivel de confianza 95%
Grados de libertad 5

134
ACTIVO: BACITRACINA ZINC
LOTE N1E200
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 17 mg 25 HCl 0,01N 0,02 UI/mL1 50 BPH6 1 100 BPH6
2 50 BPH6
MuestrasPromedio Promedio corr
S3 23,27 23,15 24,00 23,41 23,52 23,24 23,42 23,38 24,07 23,50M1 16,63 17,67 16,61 16,34 16,66 16,31 15,66 16,60 15,30 16,42 17,82
Promedio
S3 22,99 23,13 23,33 22,74 23,53 23,65 23,30 22,94 23,23 23,20M2 15,79 16,20 16,83 16,60 15,32 15,02 15,16 15,76 16,00 15,85 17,55
PromedioS3 23,17 24,56 23,36 23,35 23,65 23,83 22,89 23,67 23,70 23,58M3 16,07 16,36 16,71 14,68 15,47 16,65 16,20 17,44 16,62 16,24 17,57
M1 M2 M3 Peso (mg) 1717,824 17,549 17,569 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recup 0,140 0,129 0,130 Fecha de vencimiento N.ALog (Concentración) -0,854 -0,889 -0,887 N1E200
17,400 17,400 17,4000,021 0,021 0,021 Pendiente 0,1278
669,044 616,934 620,576 Intercepto -3,1322---
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Porcentaje Recuperado%Porcentaje % 635,5 Factor de Dilución (D)
Lote Cantidad Muestra mg DATOSUI reales / mg
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACITRACINALIMITE DE CUANTIFICACION
Caja 1 Caja 2 Caja 3

135
ACTIVO: BACITRACINA ZINC
LOTE N1E200
ESTANDAR 1250 25 HCl 0,01N 1.0 UI / mL MUESTRA 17 mg 25 HCl 0,01N 0,02 UI/mL1 50 BPH6 1 100 BPH6
2 50 BPH6
MuestrasPromedio Promedio corr
S3 23,36 22,69 23,36 24,12 23,73 23,77 23,60 23,27 23,52 23,49M1 16,33 15,74 15,80 15,65 15,90 16,00 16,16 16,89 16,81 16,14 17,55
Promedio
S3 23,27 23,45 23,85 23,26 23,17 24,54 23,30 23,27 23,61 23,52M2 15,82 16,07 15,82 16,10 14,83 15,42 15,77 16,40 15,72 15,77 17,15
PromedioS3 23,73 23,70 23,90 23,44 23,69 23,47 24,03 23,65 23,57 23,69M3 15,63 16,36 15,92 16,55 16,16 16,68 16,76 16,01 15,65 16,19 17,40
M1 M2 M3 Peso (mg) 1717,551 17,148 17,404 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recup 0,129 0,115 0,124 Fecha de vencimiento N.ALog (Concentración) -0,889 -0,941 -0,908 N1E200
17,400 17,400 17,4000,021 0,021 0,021 Pendiente 0,1278
617,338 548,248 591,260 Intercepto -3,1322---
Promedio General Concentracion Central 24,90
Pr T (X S3)es mayor que Pr R= SumaPr T (X S3)es menor que Pr R= Resta
Porcentaje Recuperado%Porcentaje % 585,6 Factor de Dilución (D)
Lote Cantidad Muestra mg DATOSUI reales / mg
MUESTRAS DATOS ESTANDAR
Diámetro
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
BACITRACINALIMITE DE CUANTIFICACION
Caja 1 Caja 2 Caja 3

136
ANEXO 15. LIMITE DE DETECCIÓN ACTIVO Bacitracina Zinc BACITRACINA
Lote M1E200
ESTANDAR MUESTRA 1250 25 HCl 0,01N1250 25 HCl 0,01N 1.0 UI / mL 1 100 BPH6
1 50 BPH6
0,5 1 1,5 2,5
50 50 50 50 BPH60,005 0,01 0,015 0,025 UI/ml
MuestrasPromedio Promedio corr
S3 23,65 24,46 23,70 24,16 23,59 25,17 24,43 23,94 23,30 24,04
0,005 UI/ml --- --- --- --- --- --- --- --- --- 0,00 ---
Promedio Promedio corr
S3 23,73 23,67 23,39 24,23 24,53 23,77 22,84 23,39 23,73 23,63
0,01 UI / mL 11,54 11,04 11,74 10,00 11,45 11,05 11,21 11,01 11,70 11,19 12,46
Promedio
S3 23,62 23,62 23,25 23,48 23,70 23,11 23,22 23,66 23,94 23,51
0,015 UI / mL 15,66 15,21 15,14 14,14 14,72 14,44 14,47 13,47 14,18 14,60 15,99
Promedio
S3 23,51 23,41 24,76 23,67 24,05 23,26 23,38 23,64 23,72 23,71
0,025 UI / mL 16,77 17,18 16,69 16,23 16,86 16,56 15,59 15,64 16,30 16,42 17,61
0,005 0,01 0,015 0,025 Peso (mg) 170,0 12,46 15,99 17,61 Potencia (P) UI/mg 75,1
Concentración (UI/ml) recuperación 0,001 0,029 0,082 0,131 Fecha de vencimiento N.ALog (Concentración) -3,1322 -1,540 -1,088 -0,881 N1E200
16,90 16,90 16,90 16,900,005 0,010 0,015 0,025 Pendiente 0,1278
Intercepto -3,1322Promedio General Concentracion Central 24,90
CONCENTRACIÓN RESULTADO
M1 ST 0,005 UI/ml No se detecta halo de inhibición Pr T (X S3)es mayor que Pr R= SumaM2 ST 0.01 UI / Ml Se detecta halo de inhibición Pr T (X S3)es menor que Pr R= RestaM3 ST 0.015UI / mL Se detecta halo de inhibición
M4 ST 0.025UI / mL Se detecta halo de inhibición
UI reales / mg
Diámetro
Lote Cantidad Muestra mg DATOS
Caja 1 Caja 2 Caja 3
MUESTRAS DATOS ESTANDAR
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3
Caja 1 Caja 2 Caja 3