UNIVERSIDAD CENTRAL DEL ECUADOR … · RESUMEN La candidiasis oral es una patología cada vez más...
Transcript of UNIVERSIDAD CENTRAL DEL ECUADOR … · RESUMEN La candidiasis oral es una patología cada vez más...
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE ODONTOLOGÍA
CARRERA DE ODONTOLOGÍA
EFECTO ANTIMICOTICO DE LA STEVIA COMERCIAL Y EL
EXTRACTO ETANÓLICO DE Stevia rebaudiana AL 30% SOBRE
CEPAS DE Candida albicans. ESTUDIO IN VITRO
Proyecto de investigación presentado como requisito previo a la obtención del
título de odontóloga
Autor: Estacio Moreira Katherine Alexandra
Tutora: Dra. Myriam Katherine Zurita Solís
Quito, Octubre 2016
ii
AUTORIZACIÓN DEL AUTOR
Yo, Estacio Moreira Katherine Alexandra en calidad de autora del trabajo de Investigación
previo a la obtención del título de odontóloga realizado: “EFECTO ANTIMICOTICO DE
LA STEVIA COMERCIAL Y EL EXTRACTO ETANÓLICO DE Stevia rebaudiana
AL 30% SOBRE CEPAS DE Candida albicans. ESTUDIO IN VITRO”, autorizo a la
Universidad Central del Ecuador a hacer uso del contenido total o parcial que me pertenecen,
con fines estrictamente académicos o de investigación.
Los derechos que como autor me corresponden, con excepción de la presente autorización,
seguirán vigentes a mi favor, de conformidad con lo establecido en los artículos 5, 6, 8; 19
y demás pertinentes de la Ley de Propiedad Intelectual y su Reglamento.
También, autorizo a la Universidad Central del Ecuador realizar la digitalización y
publicación de este trabajo de investigación en el repositorio virtual, de conformidad a lo
dispuesto en el Art. 144 de la Ley Orgánica de Educación Superior.
Firma:
-----------------------------------------------------
Estacio Moreira Katherine Alexandra
C.C. N° 0804014439
iii
APROBACIÓN DEL TUTOR DEL TRABAJO DE TITULACIÓN
Yo, Myriam Katherine Zurita Solís, en mi calidad de tutor del trabajo de titulación,
modalidad Proyecto de Investigación, elaborado por KATHERINE ALEXANDRA
ESTACIO MOREIRA: cuyo título es: “EFECTO ANTIMICOTICO DE LA STEVIA
COMERCIAL Y EL EXTRACTO ETANÓLICO DE Stevia rebaudiana AL 30%
SOBRE CEPAS DE Candida albicans. ESTUDIO IN VITRO”, previo a la obtención de
Grado de Odontóloga: considero que el mismo reúne los requisitos y méritos necesarios en
el campo metodológico y epistemológico, para ser sometido a la evaluación por parte del
tribunal examinador que se designe, por lo que lo APRUEBO, a fin de que el trabajo sea
habilitado para continuar con el proceso de titulación determinado por la Universidad
Central del Ecuador.
En la ciudad de Quito a los 22 días del mes de septiembre del año 2016
--------------------------------------------------
Dra. Myriam Katherine Zurita Solís
DOCENTE-TUTOR
C.C. 1708118854
iv
APROBACIÓN DE LA PRESENTACIÓN ORAL/TRIBUNAL
El Tribunal constituido por: Dr. Fernando Rivadeneira, Dr. Ruth Vaca, Dr. Juán Viteri.
Luego de receptar la presentación oral del trabajo de titulación previo a la obtención del
título de odontóloga, presentado por la señorita Estacio Moreira Katherine Alexandra.
Con el título:
“EFECTO ANTIMICOTICO DE LA STEVIA COMERCIAL Y EL EXTRACTO
ETANÓLICO DE Stevia rebaudiana AL 30% SOBRE CEPAS DE Candida albicans.
ESTUDIO IN VITRO”
Emite el siguiente veredicto APROBADO
Fecha: 26 de octubre del 2016
Para la constancia de lo actuado firman:
Nombre Apellido Calificación Firma
Presidente Dr. Fernando Rivadeneira 18 …………...………
Vocal 1 Dr. Ruth Vaca 19 ….…..……..….....
Vocal 2 Dr. Juan Viteri 16 ……….…….…….
v
DEDICATORIA
A mis padres Rodrigo y Blanca por su amor incondicional, por ser motivación, inspiración
y ejemplo de lucha durante cada día en especial los más difíciles transcurridos en el
trayecto para la finalización de mi carrera universitaria.
vi
AGRADECIMIENTOS
A Dios por la hermosa familia que me dio, mi pilar.
A mi tutora Katherine Zurita Solís por su valioso tiempo dedicado a las asesorías para la
realización del presente trabajo.
A la Dra. Rachide Acosta y F. B. Darwin Roldan por su colaboración y asesoramiento en
el laboratorio de la Facultad de Ciencias Químicas de la Universidad Central del Ecuador
A mis hermanos por sus palabras de aliento y ejemplo de perseverancia.
A Pedro Luis Barreiro por su paciencia en los días de estrés y por sus palabras de aliento.
vii
TABLA DE CONTENIDO
AUTORIZACIÓN DEL AUTOR ...................................................................................... ii
APROBACIÓN DEL TUTOR DEL TRABAJO DE TITULACIÓN ............................ iii
APROBACIÓN DE LA PRESENTACIÓN ORAL/TRIBUNAL .................................. iv
DEDICATORIA .................................................................................................................. v
AGRADECIMIENTOS ..................................................................................................... vi
TABLA DE CONTENIDO ............................................................................................... vii
ÍNDICE DE TABLAS ......................................................................................................... x
ÍNDICE DE GRÁFICOS ................................................................................................... xi
ÍNDICE DE FIGURAS ..................................................................................................... xii
RESUMEN ......................................................................................................................... xv
ABSTRACT ...................................................................................................................... xvi
INTRODUCCIÓN ............................................................................................................... 1
CAPITULO I ....................................................................................................................... 2
PLANTEAMIENTO DEL PROBLEMA ............................................................ 2
FORMULACIÓN DEL PROBLEMA................................................................. 3
OBJETIVOS .......................................................................................................... 4
1.3.1 OBJETIVO GENERAL ....................................................................................... 4
1.3.2 OBJETIVOS ESPECÍFICOS .............................................................................. 4
HIPÓTESIS ........................................................................................................... 5
JUSTIFICACIÓN ................................................................................................. 6
CAPITULO II ...................................................................................................................... 8
2 MARCO TEÓRICO.............................................................................................. 8
ANTECEDENTES ................................................................................................ 8
MICROBIOLOGIA .............................................................................................. 9
2.2.1 HONGOS ............................................................................................................. 10
CLASIFICACIÓN DE LOS HONGOS ............................................................ 10
RESISTENCIA Y SENSIBILIDAD DE LOS HONGOS A LOS
ANTIMICÓTICOS ............................................................................................. 11
viii
MICROFLORA MICÓTICA NORMAL DE LA BOCA................................ 12
2.2.2 CANDIDA ALBICANS ...................................................................................... 12
MORFOLOGÍA DE LA CANDIDA ALBICANS ............................................. 13
FACTORES DE VIRULENCIA ........................................................................ 13
FACTORES ESPECÍFICOS QUE AFECTAN LA DISTRIBUCIÓN DE
CANDIDA EN LA CAVIDAD BUCAL ............................................................. 15
CANDIDIASIS..................................................................................................... 15
2.3.1 CANDIDIASIS ORAL ........................................................................................ 15
ETIOPATOGENIA ............................................................................................. 15
TIPOS DE CANDIDIASIS ORAL .................................................................... 16
2.3.1.2.1 CANDIDIASIS SEUDOMEMBRANOSA AGUDA (MUGUET) ................... 16
2.3.1.2.2 CANDIDIASIS ATRÓFICA (ERITEMATOSA) ............................................ 17
2.3.1.2.3 CANDIDIASIS HIPERPLASICA CRÓNICA ................................................. 17
TRATAMIENTO ................................................................................................ 18
STEVIA REBAUDIANA .................................................................................... 18
2.4.1 HISTORIA DE LA STEVIA REBAUDIANA .................................................. 18
2.4.2 REGULACIONES............................................................................................... 19
2.4.3 CULTIVO EN ECUADOR................................................................................. 20
2.4.4 COMPOSICIÓN DE LA STEVIA .................................................................... 20
2.4.5 PROPIEDADES DE LA STEVIA ..................................................................... 20
CAPITULO III .................................................................................................................. 23
3 METODOLOGIA ............................................................................................... 23
TIPO DE DISEÑO DE LA INVESTIGACIÓN ............................................... 23
POBLACIÓN Y MUESTRA DEL UNIVERSO DE ESTUDIO ..................... 24
3.2.1 CRITERIOS DE INCLUSIÓN .......................................................................... 25
3.2.2 CRITERIOS DE EXCLUSION ......................................................................... 25
VARIABLES ........................................................................................................ 25
3.3.1 DEFINICIÓN DE VARIABLES ........................................................................ 25
3.1.1. OPERACIONALIZACIÓN DE VARIABLES................................................. 26
PROCEDIMIENTO ............................................................................................ 27
3.4.1 PROCEDIMIENTO DE OBTENCIÓN DE EXTRACTO DE STEVIA
REBAUDIANA .................................................................................................... 27
ix
3.4.2 PREPARACIÓN DEL INOCULO: ACTIVACIÓN ....................................... 29
3.4.3 PREPARACIÓN DE MEDIO DE CULTIVO: SABOURAUD GLUCOSADO
AGAR ................................................................................................................... 33
3.4.4 PREPARACIÓN DE DISCOS ........................................................................... 34
3.4.5 SIEMBRA EN EL AGAR SABOURAUD GLUCOSADO.............................. 35
3.4.6 COLOCACIÓN DE LOS DISCOS EN EL CULTIVO ................................... 35
3.1.2. LECTURA DE LOS HALOS DE INHIBICIÓN ............................................. 37
3.4.7 MANEJO DE DESECHOS ................................................................................ 37
CAPITULO IV ................................................................................................................... 38
ANÁLISIS E INTERPRETACIÓN DE RESULTADOS ................................ 38
DISCUSIÓN ......................................................................................................... 44
CAPITULO V .................................................................................................................... 46
CONCLUSIONES ............................................................................................... 46
RECOMENDACIONES ..................................................................................... 47
BIBLIOGRAFÍA ............................................................................................................... 48
ANEXOS ............................................................................................................................ 51
x
ÍNDICE DE TABLAS
Tabla 1 Distribución de Frecuencias de la prueba de Stevia comercial de Multidulzura ... 38
Tabla 2 Distribución de Frecuencias de la prueba del Extracto de Stevia al 30% .............. 39
Tabla 3 Distribución de Frecuencias de la prueba control positivo .................................... 40
Tabla 4 Cálculo estadístico de los extractos ........................................................................ 42
Tabla 5 Prueba t student pata muestra única ....................................................................... 43
xi
ÍNDICE DE GRÁFICOS
Gráfico 1 Distribución de frecuencias de la Stevia comercial Multidulzura ....................... 38
Gráfico 2 Distribución de frecuencias del Extracto de Stevia al 30%................................. 39
Gráfico 3 Distribución de frecuencias de Clorhexidina 0.125% ......................................... 40
Gráfico 4 Distribución intercuartil del Extracto de Stevia al 30% ...................................... 41
Gráfico 5 Distribución intercuartil de la Stevia comercial Multidulzura ............................ 41
Gráfico 6. Comparación de medias ..................................................................................... 42
xii
ÍNDICE DE FIGURAS
Figura 1. Esquema que muestra las fases de un hongo. ...................................................... 11
Figura 2. Esquema de la morfología de la Candida albicans. yemas(1); Pseudohifas (2);
micelio(3); clamidosporas (4). .......................................................................... 13
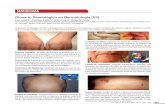
Figura 3. Candidiasis pseudomembranosa. ......................................................................... 16
Figura 4. Dorso lingual marcadamente depilado, típico de candidiasis eritematosa crónica.
.......................................................................................................................... 17
Figura 5. Formulación de muestra. ...................................................................................... 24
Figura 6. Hojas secas de Stevia rebaudiana ......................................................................... 27
Figura 7 Proceso de percolación para obtención del extracto de Stevia rebaudiana al 30%
.......................................................................................................................... 27
Figura 8. Proceso de filtración. ............................................................................................ 28
Figura 9. Radiación durante una hora. ................................................................................. 29
Figura 10. Cepa de Candida albicans sellado ...................................................................... 30
Figura 11. Ampolla que contiene la cepa. ........................................................................... 31
Figura 12. Hisopo sometido en cepa de Candida albicans .................................................. 31
Figura 13. Comparación del inoculo con el estándar Mcfarland de 0,5 turbidez. ............... 32
Figura 14. Inóculo primario de Candida albicans................................................................ 32
Figura 15. Inóculo en incubación. ....................................................................................... 33
Figura 16. Agar Sabouraud glucosado ................................................................................ 34
Figura 17. Preparación de discos con pipeta digital. ........................................................... 34
Figura 18. Siembra de Candida albicans en Agar Sabouraud Glucosado. .......................... 35
Figura 19. Rotulaión de placas. ........................................................................................... 36
Figura 20. Cultivos listos para incubar. ............................................................................... 36
Figura 21. Halo de inhibición medido mediante calibrador para método Kirby Bauer. ..... 37
Figura 22. Área de esterilización de desechos del laboratorio clínico de la Facultad de
Ciencias Química UCE ..................................................................................... 55
Figura 23. Aza estéril........................................................................................................... 59
Figura 24. Cámara de bioseguridad donde fue realizada la prueba. .................................... 59
Figura 25. Pinza estéril para colocación de discos. ............................................................. 60
Figura 26. Pipeta digital. ..................................................................................................... 60
xiii
Figura 27. 30 cajas petri utilizadas ...................................................................................... 61
Figura 28. Suero fisiológico utilizado como control negativo. ........................................... 61
Figura 29. Cepa de Candida albicans. ................................................................................ 62
Figura 30. Extracto etanólico al 30%; clorhexidina utilizada como control positivo; Stevia
comercial "Multidulzura" ................................................................................. 62
Figura 31. Discos divididos en grupos. ............................................................................... 63
Figura 32. Luz fluorescente para clara medición de resultados. ......................................... 63
Figura 33. Cultivo después de 48 horas de incubación. ...................................................... 64
xiv
ÍNDICE DE ANEXOS
Anexo 1.Certificado de control de calidad del extracto etanólico de stevia rebaudiana al 30%
............................................................................................................................. 51
Anexo 2. Certificación de la cepa de Candida albicans ...................................................... 52
Anexo 3. Certificado del Lab. Clínico de la Facultad de Ciencias Químicas UCE de haber
realizado el experimento. .................................................................................... 53
Anexo 4. Protocolo de manejo de desechos. ....................................................................... 54
Anexo 5 Realización de prueba piloto. ................................................................................ 56
xv
Efecto antimicotico de la stevia comercial y el extracto etanólico de stevia rebaudiana al
30% sobre cepas de candida albicans. Estudio in vitro
Autor: Katherine Alexandra Estacio Moreira
Tutora: Dra. Myriam Katherine Zurita Solís
RESUMEN
La candidiasis oral es una patología cada vez más frecuente, Siendo la Candida albicans su
principal causante. Objetivo: determinar el efecto antimicótico de la Stevia rebaudiana en
dos diferentes presentaciones frente a la Candida albicans. Materiales y métodos: Para la
realización de éste estudio se elaboró un extracto etanólico de Stevia rebaudiana al 30% y
se adquirió comercialmente una presentación liquida, ambas fueron utilizadas para realizar
la prueba de sensibilidad sobre cultivos de Agar sabouraud con siembra de Candida
albicans; como control positivo el compuesto fue la clorhexidina al 0.12% y como control
negativo suero fisiológico. Se utilizó una muestra de 30 cultivos los cuales fueron incubados
por 48 horas a 37°C. Resultados: Se obtuvo halos de inhibición de crecimiento con una
media de 10,33mm de diámetro para la Stevia comercial y de 9,27mm para el extracto
etanólico de Stevia rebaudiana al 30%, el control positivo entro en un rango de muy sensible
y el control negativo no obtuvo efectividad. Conclusiones: Se determinó mediante la prueba
de T STUDENT que las dos presentaciones de Stevia generaron efecto antimicótico sobre
Candida albicans.
PALABRAS CLAVES: CANDIDIASIS ORAL / Candida albicans / Stevia rebaudiana.
xvi
Antifungal effect of commercial stevia and ethanolic extract of stevia rebaudiana at 30% on
strains of candida albicans. In vitro study
Author: Katherine Alexandra Estacio Moreira
Tutora: Dra. Myriam Katherine Zurita Solís
ABSTRACT
The oral candidiasis is an increasingly common condition being Candida albicans the
principal etiological agent. Objective: determinate the antifungal effect of Stevia rebaudiana
in two diferent presentations against Candida albicans. Materials and methods: To carry
out this study, elaborated an 30% ethanol extract of Stevia rebaudiana and the another was
a commercial presentation acquired a liquid form, both were used to perform sensitivity test
on cultures of Agar Sabouraud with planting Candida albicans was prepared; as a positive
control compound was 0.12% chlorhexidine and physiological saline as negative control.
We used 30 cultures that were incubated for 48 hours at 37 ° C was used. Results: we
obtained inhibition halos were an average of 10,33mm for commercial Stevia and 9,27mm
for the 30% ethanolic extract of Stevia rebaudiana, the positive control entered a range of
very sensitive and the negative control did not get effectiveness. Conclusions: it was
determined through T STUDENT test that both Stevia’s presentations generated antifungal
effect against Candida albicans.
KEY WORDS: ORAL CANDIDIASIS / Candida albicans / Stevia rebaudiana.
1
INTRODUCCIÓN
Candida albicans es un microorganismo del reino fungi que si bien es cierto pertenece a la
microflora habitual de la boca siendo inofensiva, ésta puede volverse patógena por diferentes
factores desencadenantes principalmente cuando se produce una alteración o disminución
del sistema de defensa del cuerpo humano, provocando la candidiasis. (Brooks, Carroll,
Butel, Morse, & Mietzner, 2011)
Los pacientes que más comúnmente se ven afectados son aquellos inmunodeprimidos como
los portadores de VIH, pacientes que han sido sometidos a quimioterapia, personas en edades
extremas, es decir, los adultos mayores y los recién nacidos. Son también susceptibles a
desencadenar candidiasis los pacientes portadores de prótesis dentales en especial cuando
no se tiene un correcto aseo de la prótesis. (Cawson & Edell, 2009)
A nivel oral la candidiasis se presenta afectando la mucosa, la manera de tratar puede ser
medicamentosa vía parenteral con antimicóticos como la nistatina o el fluconazol entre otros
antimicóticos. Debido a la resistencia que poseen cada vez con mayor fuerza los
microorganismos a los medicamentos es necesario optar por soluciones alternativas, Waizel
(2010), menciona que las plantas medicinales usadas de forma correcta y con el debido
conocimiento son una buena opción, por lo que es de gran importancia conocer si plantas
como en éste caso la Stevia rebaudiana poseen actividad contra microorganismos aportando
así para futuras investigaciones.
Basándonos en estudios ya realizados en los cuales se analiza el efecto antimicrobiano de la
Stevia rebaudiana sobre otros microorganismos, nos animamos a realizar la presente
investigación, con el fin de determinar el efecto de inhibición de crecimiento que posee la
Stevia rebaudiana sobre Candida albicans.
Para la investigación se utilizó dos tipos de Stevia rebaudiana, una elaborada en laboratorio
el extracto etanólico de Stevia rebaudiana al 30% y la otra presentación fue una ya fabricada
que puede ser adquirida comercialmente. Ambas presentaciones se dispusieron con una
muestra de 30 repeticiones en cultivos de Candida albicans, junto con un control positivo y
uno negativo. Mediante el método de Kirby Bauer que es un método para determinar la
susceptibilidad de un microorganismo a un antimicrobiano se determinaron los resultados.
2
CAPITULO I
PLANTEAMIENTO DEL PROBLEMA
“El género Candida incluye ocho especies de hongos, de los cuales Candida albicans es,
con diferencia, el más prevalente” (Saap, Eversole, & Wysocki , 2005), principal causante
de la candidiasis que agrupa variantes mucocutáneas, entre estas la que corresponde al área
de estudio como es la candidiasis oral. (Regezi& Sciubba, 1991)
Saap (2005), menciona que la candidiasis oral es una patología que se presenta en varias
formas clínicas como son: la candidiasis seudomembranosa aguda (muguet), patologia
comunmente en recien nacido; la candidiasis atrófica (eritematosa), frecuente en portadores
de prótesis removibles mal ajustadas y con mas frecuencia en los pacientes que no limpian
efectivamente las prótesis ni se las quitan por la noche; la candidiasis hiperplasica crónica
que se presenta como placa blanca tambien conocida como leucoplasia candidiásica.
Según Regezi los grupos mas afectados son los lactantes y los ancianos,el 65% de los casos
de candidiasis cronica ocurre en adultos mayores que usan protesis totales, otro grupo es el
de pacientes con leucemia en los que esta presente en mas de la mitad, ademas de el 70% de
los pacientes con sida.
Como se ha descrito la Candida albicans es un hongo presente en flora normal de la mucosa
oral pero que frente a estímulos como una prótesis mal adaptada o un descenso del sistema
inmunológico hace que éste aumente y provoque la candidiasis (Neville, Damm, Allen, &
Bouquot, 2004). Cawson describe que para conbatir dicha patología se debe realizar un
tratamiento enérgico anti fúngico, pero que en ocasiones alguna placa residual puede
persistir y las lesiones recidivan después del tratamiento (2009).
Se sabe que el uso prolongado de antimicrobianos afecta el sistema de defensa, es por esto
que se realizan estudios sobre plantas para su uso como tratamiento coadyuvante. Algunos
estudios indican la actividad antimicrobiana de la Stevia rebaudiana, en especial con las
bacterias y hongos que atacan la mucosa oral. (Chilaca & Cava, 2014)
3
FORMULACIÓN DEL PROBLEMA
La presente investigación se realizará con el fin de evaluar si la Stevia rebaudiana en dos
diferentes presentaciones posee efectividad antimicótica sobre Candida albicans.
¿Genera la Stevia rebaudiana efectividad antimicótica in vitro frente a Candida albicans?
4
OBJETIVOS
1.3.1 OBJETIVO GENERAL
Determinar el efecto de inhibición de crecimiento que posee la Stevia comercial y el extracto
etanólico de Stevia rebaudiana al 30% sobre cepas de Candida albicans.
1.3.2 OBJETIVOS ESPECÍFICOS
Medir la inhibición de crecimiento producida por la Stevia comercial y el extracto
etanólico de Stevia rebaudiana al 30% sobre Candida albicans ATCC® 1023,
utilizando el método Kirby-Bauer.
Comparar la inhibición de crecimiento producida sobre la Candida albicans tanto
por la Stevia comercial como por el extracto etanólico al 30% de la Stevia rebaudiana
con el control positivo.
5
HIPÓTESIS
El extracto etanólico de Stevia rebaudiana al 30% genera mayor efecto de
inhibición de crecimiento sobre las cepas de Candida albicans en relación con la
Stevia comercial “Multidulzura” después de 48 horas de incubación.
La Stevia comercial “Multidulzura” genera mayor efecto de inhibición de
crecimiento sobre las cepas de Candida albicans en relación con el extracto
etanólico de Stevia rebaudiana al 30% después de 48 horas de incubación.
6
JUSTIFICACIÓN
“Las propiedades medicinales de una gran cantidad de plantas es un hecho indiscutible y
reconocido por todos” (Rivas Ponce & Soriano, 1988), es por esto que basándose en el
estudio de Manish, Tadhani, & Rema en el que se encontró actividad inhibitoria in vitro en
extractos de hojas de Stevia rebaudiana contra hongos como R. oligosporus y A. niger
(2006), además de una recopilacion bibliográfica de Martínez Pérez que menciona actividad
antimicrobiana de la stevia tanto para bacterias como para hongos.(s.f) se ha decidido
realizar el presente estudio.
La presente investigación analiza a la Stevia rebaudiana en dos diferentes presentaciones
una desarrollada en laboratorio y otra adquirida comercialmente, siendo ésta última de
importancia ya que en caso de tener efecto antimicótico sobre Candida albicans, es a la que
el paciente puede acceder más fácilmente.
El poder medicinal de las plantas es debido en muchos casos a un solo producto químico de
entre los muchos que contiene o, en otros casos, a una mezcla de aquéllos “si éstos productos
son extraidos de la planta y no son destruidos al extraerlos, se podrán aplicar en dosis mas
precisas que las que se consiguen tomando una infusion de la planta” (Rivas Ponce &
Soriano, 1988).
Marsh & Martin mencionan que la variedad y numero de agentes antihongos que existe es
baja debido a la dificultad de desarrollar un agente antihongos que sea eficaz contra un
organismo determinado y esté desprovisto de efectos tóxicos contra las células del huesped
(2011), Saap, Eversole, & Wysocki , 2005 describen que los microorganismos fúngicos se
encuentran en la superficie del epitelio o próximos a la misma, por lo que la medicación anti
fúngica tópica es más efectiva que la medicación administrada por vía sistémica.
Un punto importante es que no hay reportes de algún efecto adverso por usar la Stevia, por
lo que tiene un amplio margen de seguridad. “En japón se consumen hasta 100 toneladas
métricas al año, donde tampoco se ha reportado reacciones adversas” (Vitery Sapuyes,
Escribano, Gamboa, & Chavarría, 2010). En septiembre de 1995 la Agencia Americana de
Drogas y Alimentos (FDA) aprobó a la Stevia como un complemento dietético.
7
Cabe mencionar la importancia del uso de productos fitoquímicos y extractos de plantas para
sustituir el efecto de la resistencia a las drogas antihongos que como describen Marsh &
Martin es un fenómeno cada vez más reconocido y se puede definir clínicamente como la
persistencia de signos y sintomas de la infección a pesar de la entrega adecuada de un nivel
normalmente apropiado y tolerable de la droga (2011).
Abreu, McBain, & Simoes ofrecen una posible solución al problema de la resistencia
medicamentosa que existe, haciendo referencia a estos componentes de origen natural que
con frecuencia actúan a través de diferentes mecanismos que los antimicrobianos
convencionales y pueden, por lo tanto, ser de uso en el tratamiento de microorganismos
resistentes. (2012)
Los resultados que se obtengan de esta investigación servirán como base para la realización
de futuras investigaciones de productos ya que como lo menciona Vitery Sapuyes,
Escribano, Gamboa, & Chavarría (2010) la Stevia posee propiedades unicas que la hacen
ideal como componente de enjuague bucal y pasta dental.
8
CAPITULO II
2 MARCO TEÓRICO
ANTECEDENTES
La candidiasis oral causada por Candida albicans es la principal micosis que se puede hallar
en boca (Marsh Philip D, 2011), la cual se puede presentar preferentemente en pacientes con
edades extremas como lo menciona Velasco (2002), y en pacientes inmunodeprimidos, o
con prótesis dentales. Para tratar esta patología se medica antimicóticos tópicos como la
nistatina. (Bascones, 2004)
Debido al aumento de resistencias a los antimicrobianos la medicina a través de las plantas
ofrece una alternativa, en este caso mediante el uso de la Stevia rebaudiana. Durante siglos,
las tribus guaraníes de Paraguay y Brasil han usado diferentes especies de Stevia,
especialmente la Stevia rebaudiana como endulzante para disminuir el sabor amargo de los
medicamentos a base de diferentes platas, y con fines medicinales. (Durán, Rodríguez,
Cordón, & Record, 2012)
La Stevia rebaudiana fue descrita por primera vez destacando su sabor dulce en 1887 por el
botánico suizo Moisés Santiago Bertoni, y en 1900 el químico paraguayo Ovidio Rebaudi
la estudió más a fondo logrando aislar sus principios activos responsables del dulzor.
(Brandle, Richman , Swason , & Chapman , 2002) Desde entonces se ha estudiado a la Stevia
no solo por sus propiedades endulzantes, sino también por sus características
antimicrobianas.
Varios son los estudios que han determinado que la Stevia rebaudiana tiene efecto
antimicrobiano utilizando un método in vitro con medios de cultivos y técnica de Kirby-
Bauer en la que se determina la efectividad de un antimicrobiano midiendo halos de
inhibición, a continuación se describirán algunos de estas investigaciones.
El estudio realizado por Manish en el 2006 titulado “In vitro antimicrobial activity of Stevia
rebaudiana Bertoni leaves” en el que determina el efecto que causa extractos de Stevia
9
rebaudiana elaborados en diferentes solventes como agua, metanol, etanol, y hexanol
utilizándolos sobre bacterias como: S. aureus, E. coli, P. vulgaris, B. megaterium, P.
aeruginosa, M. luteus; además de hongos como el R. oligosporus, y el A. niger.
En otra investigación brindada por Vitery y cols. (2010) Se estudió la “Actividad inhibitoria
de la Stevia rebaudiana sobre el Lactobacillus acidophillus y el Streptococcus mutans” en
donde se comparó los resultados obtenidos con un control positivo de vancomicina,
En el 2012 Chila y Cava, valoraron la actividad antimicótica del extracto etanólico al 10%,
20%, y 30% de Stevia rebaudiana contra Candida albicans utilizando medio de cultivo
Sabouraud Agar Glucosado que impide el crecimiento de bacterias. En el método utilizaron
una muestra de 30 cultivos.
La Dra. Pérez (2013) en su estudio evaluó el efecto antibacteriano in vitro del extracto
etanólico en diferentes concentraciones de Stevia rebaudiana sobre Streptococcus mutans
ATCC 25175, en el cual describe además la concentración mínima inhibitoria y la
concentración mínima bactericida de Stevia rebaudiana necesaria para actuar sobre S.
mutans.
MICROBIOLOGIA
Brooks, Carroll, Butel, Morse, & Mietzner (2011) describe a la microbiología como la
ciencia que estudia los organismos visibles con el auxilio de microscopio. La microbiología
médica que incluye la estomatológica, está compuesta por varias ramas que son la
bacteriología, la micología, la virología, la parasitología y la inmunología. (Negroni, 2009)
La parte de la microbiología que se encarga del estudio de los hongos es la micología, el
interés por esta rama de la ciencia se incrementó notablemente en las últimas tres décadas
debido a un considerable aumento de la frecuencia de las infecciones debidas a hongos y
este aumento a su vez se produjo por el incremento de las causas de inmunodepresión.
(Negroni, 2009)
10
2.2.1 HONGOS
Según Brooks, Carroll, Butel, Morse, & Mietzner (2011) se han descrito 80000 especies de
hongos, de los cuales 400 poseen importancia médica y solo 50 de ellos causan más del 90%
de las micosis presentes en humanos y otros animales. Velasco, (2002) menciona que dentro
del reino Fungi se distinguen dos grupos de hongos, los inferiores que no poseen pared
celular y que carecen de interes en patología humana y el grupo de los hongos verdaderos
que si poseen pared celular y se encuentran en el cuerpo humano.
Las células fúngicas son estructuralmente conformada como una célula eucariota (Murray,
Rosental, & Pfaller, 2007), y morfológicamente se presentan en formas ovaladas o
filamentosas en células alargadas, poseen una pared celular rígida integrada por quitina,
glucanos, mananos y proteínas. (Negroni, 2009). Brooks et al. (2011) menciona que los
hongos pueden ser unicelulares conocidos como levaduras o los pluricelulares conocidos
como mohos.
CLASIFICACIÓN DE LOS HONGOS
Los hongos unicelulares denominados levaduras son de forma redondeada u ovoide y
como menciona Ryan & Ray (2010) se reproducen asexualmente mediante gemación
formando protrusiones o yemas (también llamados blastoconidios) que irán creciendo hasta
separarse y formar una nueva célula. En ocasiones las células hijas no se separan y forman
cadenas de células, que se denominan seudohifas y pueden confundirse con una hifa. Sin
embargo, algunas levaduras pueden llegar a formar hifas verdaderas. (Brooks, Carroll, Butel,
Morse, & Mietzner, 2011) (Prats, 2008)
Hongos filamentosos (mohos)
Prats (2008) describe a los hongos filamentosos pluricelulares como células alargadas con
la anchura de 3 a 15 um de diámetro y longitud variable. Crecen por extensión apical,
tabicándose para formar nuevas células que no se desprenden lo cual recibe el nombre de
hifas y éstas cuando se ramifican se denominan micelio. Los hongos filamentosos pueden
ser superiores generalmente de células delgadas (2-5 um) y que forman esporas externas, y
11
los hongos filamentosos inferiores se presentan con células más anchas (10-15 um), no están
tabicadas y sus esporas son formadas en el interior de estructuras suculares. (Brooks, Carroll,
Butel, Morse, & Mietzner, 2011) (Lamont, Hajisshengallis, & Jenkinson, 2014)
Figura 1. Esquema que muestra las fases de un hongo.
Fuente. (Velasco, 2002, pag. 218)
El medio de cultivo tradicional en micología, es el agar de Sabouraud que contiene glucosa
y peptona modificada y que no permite el crecimiento de bacterias además a este medio se
le puede agregar gentamicina o cloranfenicol para inhibir bacterias y hongos saprofitos
especialmente cuando la muestra no es estéril. (Brooks, Carroll, Butel, Morse, & Mietzner,
2011)
RESISTENCIA Y SENSIBILIDAD DE LOS HONGOS A LOS
ANTIMICÓTICOS
El estudio de la sensibilidad de los microorganismos es una de las funciones más importantes
de los laboratorios de microbiología clínica, su realización se desarrolla mediante las
pruebas de sensibilidad o antibiograma, cuyo principal objetivo es evaluar en el laboratorio
la respuesta de un microorganismo a uno o varios antimicrobianos. El antibiograma define
la actividad in vitro de un antimicrobiano frente a un microorganismo determinado y refleja
su capacidad para inhibir su crecimiento. (Murray, Rosental, & Pfaller, 2007)
Brooks et al. (2011) menciona que muchas micosis son difíciles de tratar, esto es debido a
que los hongos son eucariotas que como explica Negroni (2009), poseen un núcleo
estructural con membrana nuclear, al igual que lo seres humanos por lo que se comparte
12
genes homólogos y a consecuencia de esto son pocos los puntos de ataque en que actúan los
fármacos.
MICROFLORA MICÓTICA NORMAL DE LA BOCA
Los hongos constituyen generalmente una proporción relativamente pequeña de la
microflora oral. La población más grande de microflora de hongos en la boca humana se
compone de la Candida spp. Y de estas la Candida albicans es en gran medida la especie
más común, entre otras especies de Candida que se han aislado en boca incluyendo la
Candida glabrata, tropicalis, krusei, parapsilosis, y la guilliermondii. (Marsh & Martin,
2011) (Bascones, 2004)
2.2.2 Candida albicans
La Candida se distribuye uniformemente a través de la boca pero el sitio de aislamiento más
común en ésta es el dorso de la lengua. La presencia de Candida aumenta con la aplicación
de dispositivos intraorales tales como dentaduras o aparatos ortodónticos, particularmente
en el maxilar superior en la superficie del paladar. La Candida spp. Puede adherirse
fuertemente al acrílico. (Marsh Philip D, 2011). (Ceccotti, Sforza, Carzoglio, Luberti, &
Flichman, 2007)
La especie de Candida albicans es normalmente comensal inofensivo, cuando las
condiciones en la boca se alteran a una que favorezca la proliferación de la cándida, puede
ocurrir un cambio a un estado patógeno. (Marsh & Martin, 2011) Cawson, 2009 describe a
la Candida albicans como un parásito intracelular que crece dentro del citoplasma de las
células epiteliales, después de observarlas en el microscopio electrónico.
Se estima que está presente en más del 80% de todas las levaduras orales aisladas. (Marsh
& Martin, 2011). Entre un 25% y un 50% de las personas sanas portan microorganismos de
Candida en la microflora normal de la boca y de estos Candida albicans representa entre en
70% y 80% de las cepas. (Murray, Rosental, & Pfaller, 2007)
13
Morfología de la Candida albicans
Este hongo se presenta inicialmente con forma redondeada u ovoide y es unicelular, es decir,
como una levadura que produce yemas para su reproducción, su morfología puede cambiar
tornándose en células alargadas llamadas seudohifas
Candida albicans es un hongo dimórfico que como describe Pratz (2008) es todo
microorganismo que cambia su morfología Negroni (2009) menciona la capacidad de los
hongos del género Candida para crecer como levaduras, es decir células unicelulares ovoides
con blastoconidios que no son otra cosa que brotes en un extremo de la membrana, esto en
medios ricos en monosacáridos o disacáridos y en condiciones de aerobiosis; mientras que
en microaerobiosis y enriquecimiento con polisacáridos forman células alargadas llamadas
seudohifas. (Lamont, Hajisshengallis, & Jenkinson, 2014)
Figura 2. Esquema de la morfología de la Candida albicans. yemas(1); Pseudohifas (2);
micelio(3); clamidosporas (4).
Fuente. (Prats, 2008, pag. 95)
FACTORES DE VIRULENCIA
Adherencia.- Negroni (2009) la describe como la capacidad de adherirse tanto a
células del hospedero como a otros microorganismos e incluso a biomateriales de
dispositivos protésicos, en la cavidad oral esto permite que el organismo impida la
remoción a través de los efectos del flujo salival y del tragado. Marsh (2011) y
Lamont (2014) concuerdan en que las moléculas de la superficie de la Candida que
14
están implicadas en su adherencia se describen como adhesinas entre las cuales están
las manoproteinas y las adhesinas fibrilares y a su vez el componente de las células
huésped con que estas interactúan se refiere como receptores.
Morfología.- la Candida y particularmente la C. albicans una vez adherido al
huésped posee la capacidad de cambiar su morfología de levadura a una forma
filamentosa, con seudohifas o hifas verdaderas para penetrar el epitelio y aumentar
su resistencia a la fagocitosis. (Brooks, Carroll, Butel, Morse, & Mietzner, 2011)
(Lamont, Hajisshengallis, & Jenkinson, 2014)
Dimorfismo fenotípico.- son los cambios reversibles en la morfología de la colonia
inducida por la exposición a varios estímulos ambientales. El dimorfismo tiene
efectos en la adherencia, ya que como mencionan Ryan y Ray (2010) al cambiar la
forma de levadura a hifa ésta última tiene la capacidad de formar fijaciones fuertes a
las células epiteliales humanas. El dimorfismo es un factor que dependerá de la
virulencia que posea la cepa. (Murray, Rosental, & Pfaller, 2007)
Enzimas hidrolíticas.- facilita la destrucción de los tejidos del huésped, Marsh
(2011) describe las siguientes:
o Secreción de aspartil proteasa (SAP).- capacidad de degradar las proteínas
extracelulares de la matriz del huésped sería un factor patógeno obvio como
la destrucción de las proteínas del huésped implicadas en la defensa contra la
infección.
o Fosfolipasas (FP).- son enzimas que hidrolizan los fosfolípidos en ácidos
grasos. Su producción podría contribuir al daño de la membrana de la célula
huésped que podría promover a la lisis celular o exponer los receptores
facilitando la adherencia.
15
FACTORES ESPECÍFICOS QUE AFECTAN LA DISTRIBUCIÓN DE
Candida EN LA CAVIDAD BUCAL
El crecimiento de estos hongos está controlado por la microflora bacteriana, cuando esta
disminuye, por ejemplo por el tratamiento prolongado con antibióticos o cambios en el pH
hay proliferación de Candida y produce lesión. (Pérez & López , 2007)
CANDIDIASIS
La candidiasis ocurre en formas localizada y diseminada. La localizada se observa con
eritema y placas blanquecinas en pliegues cutáneos húmedos o en superficies mucosas
(algodoncillo oral). La enfermedad diseminada y en tejidos profundos se limita de manera
casi exclusiva a los individuos con inmunodepresión. (Ryan & Ray, 2010)
Es una enfermedad micótica causada por cualquiera de las especies del género Candida,
constituyéndose como una enfermedad oportunista, muy frecuente en nuestros días, en la
que siempre debemos investigar la presencia de factores favorecedores del crecimiento y
transformación patógena del germen. (Velasco, 2002)
2.3.1 CANDIDIASIS ORAL
Es la infección fúngica oral más frecuente, se la considera una micosis superficial producida
por agentes del género Candida especialmente C. albicans los cuales forman parte de la
microflora oral normal en muchas personas, especialmente en las que sufren de diabetes
mellitus y las que utilizan prótesis removibles. (Ibsen & Phelan, 2014) (Ceccotti, Sforza,
Carzoglio, Luberti, & Flichman, 2007)
ETIOPATOGENIA
Según Brooks (2014) la candidiasis oral surge por un incremento en el número local de
células de Candida y daño del epitelio, lo que permite la invasión local de levaduras y
seudohifas, ésta se hace sistémica cuando Candida penetra en la corriente sanguínea y las
defensas del hospedador no bastan para detener su proliferación. Velasco (2002) describe
16
los factores que facilitan la rotura del equilibrio saprófito-huésped, es decir, factores
predisponentes subdividiéndolos en:
Factores fisiológicos: edades extremas. Recién nacidos y adulto mayor.
Factores predisponentes generales: padecimientos sistémicos como diabetes,
leucemias, carencias de vitaminas, tratamientos quimioterápicos, SIDA e ingesta
prolongada de antibióticos y/o corticoides.
Factores predisponentes locales: xerostomía, mala higiene, mal estado bucal, y
prótesis defectuosas.
TIPOS DE CANDIDIASIS ORAL
2.3.1.2.1 CANDIDIASIS SEUDOMEMBRANOSA AGUDA (MUGUET)
“Forma clínica de infección por C. albicans, que consiste en placas blandas, cremosas, de
epitelio descamativo que contiene numerosos micelios enmarañados sobre una mucosa
eritematosa que se elimina fácilmente” (Saap, Eversole, & Wysocki, 2005). La
sintomatología suele ser mínima, pero puede producir dolor, ardor o disfagia en casos
extensos (Bascones, 2004).
Figura 3. Candidiasis pseudomembranosa.
Fuente. (Velasco, 2002, pag. 223)
DeLong & Burkhar (2015) hace referencia a este tipo de candidiasis como una encontrada
comúnmente en neonato de la misma manera Pérez y López (2007) mencionan que el recién
nacido debido a que no tiene colonización saprofita desarrollada puede infectarse con
Candida al pasar por el canal del parto; además generalmente está presente en
17
inmunodeprimidos, quimioterapias, uso prolongado de antibióticos, siendo más frecuente
en pacientes infectados por el VIH. (Ceccotti, Sforza, Carzoglio, Luberti, & Flichman, 2007)
2.3.1.2.2 CANDIDIASIS ATRÓFICA (ERITEMATOSA)
Marsh & Martin, (2011) la describe como una variedad de candidiasis a la cual la mucosa
está adelgazada, lisa y de color rojo brillante, con síntomas de ardor y aumento de
sensibilidad; normalmente se encuentra en el paladar, bajo una prótesis, pero también se
puede encontrar sobre la lengua y otras superficies mucosas. (Saap, Eversole, & Wysocki,
2005)
Figura 4. Dorso lingual marcadamente depilado, típico de candidiasis eritematosa crónica.
Fuente. (Velasco, 2002, pag. 224)
Se ha denominado también estomatitis protésica debido a que se presenta en área de prótesis
mal ajustadas y con más frecuencia en pacientes que no se retiran la prótesis por la noche.
Los pacientes se quejan de sensibilidad intensa y dolor ante la exposición a líquidos calientes
y fríos. (Ibsen & Phelan, 2014) (Negroni, 2009)
2.3.1.2.3 CANDIDIASIS HIPERPLASICA CRÓNICA
Produce una gruesa placa adherida a la mucosa, la cual como describe Ibsen & Phelan (2014)
no se desprende fácilmente al frotar a diferencia del muget, y se distingue de una leucoplasia
mediante biopsia. La localización clásica es el “dorso de la lengua y la mucosa oral
retrocomisural”, la placa es de grosor variable, y suele tener una textura nodular. (Cawson
& Edell, 2009)
18
TRATAMIENTO
Ryan & Ray (2010) hace énfasis en que se debe eliminar todo factor pre disponente como
una prótesis mal ajustada o contaminada, xerostomía y factores de tipo sistémico. Velasco,
(2002) describe que en el caso de estomatitis protésica se debe reparar los posibles desajustes
protésicos o la confeccion de nueva protesis de ser necesario, realizar una correcta higiene
de ésta, dejar de usarla al dormir y colocarla en anfotericina B o Clorhexidina al 2% o
hipoclorito al 5-10%.
Lamont, Hajisshengallis, & Jenkinson (2014) mencionan que el tratamiento para la
candidiasis oral es tópico, concuerda con esto Arce Mendoza (2009) argumentando que tanto
la nistatina como la anfotericina B o el ketoconazol en gel dan buen resultado al usarlo sobre
la mucosa de tres a cuatro veces al día, y solo en casos más complicado como cuando la
superficial se ha hecho sistémica o en pacientes inmunodeprimidos después de una
valoración del caso se deberá administrar antimicóticos de forma parenteral como el
ketoconazol de 200 a 400 mg diarios o fluconazol 100mg al día.
Stevia rebaudiana
La Stevia rebaudiana es una planta originaria del sudeste de Paraguay, pertenece a la familia
de las asteráceas. Es un arbusto que puede alcanzar de 65 a 80cm, y cultivadas hasta 1 m de
altura, sus hojas son lanceoladas sin peciolos, opuestas, con margen y miden alrededor de
5cm de longitud por 2 cm de ancho, crece en suelos arenosos cerca de arroyos de la parte
selvática subtropical. (Durán, Rodríguez, Cordón, & Record, 2012) (Bertoni, 2011)
2.4.1 HISTORIA DE LA Stevia rebaudiana
HISTORIA
Desde hace varios años las hojas de Stevia se han utilizado como endulcolorante para el mate
o como té medicinal entre los indígenas del Paraguay, quienes la conocen como “Kaa hee”
que significa hierba dulce (Durán, Rodríguez, Cordón, & Record, 2012)
19
En la época de la colonia en el siglo XVI, los españoles reportaron por primera vez el
consumo de la Stevia, (por los nativos sudamericanos). En 1887 fue identificada por el
botánico Moises Bertoni, quien fue el primero en elaborar estudios y publicaciones sobre
esta planta (Bertoni, 2011)
Posteriormente el químico paraguayo Ovidio Rebaudio aisló los principios activos de esta
planta y fue así como se descubrió que los componentes endulzantes eran glucósidos:
esteviósido y rebaudiósido A (Wallin, 2008).
2.4.2 Regulaciones
En 1970 en Japón se aprobó el uso de la Stevia en alimentos y bebidas, lo que significó la
sustitución de los endulcolorantes químicos artificiales. En Paraguay, Brasil, Chile y
Argentina también están autorizados su producción y comercialización. (Marin, 2004)
En Estados Unidos en 1995, la FDA aprobó la Stevia como endulcolorante, sometiéndola,
sin embargo a un sinnúmero de restricciones, como por ejemplo, solo se la podía consumir
como ingrediente de productos dietéticos, y venderse únicamente en tiendas naturistas
(Wallin, 2008)
En la unión europea han existido, de igual manera, prohibiciones para la comercialización
de Stevia. Sin embargo, como se menciona en la reunión 69de la JEFCA (Joint FAO/OMS
Expert Commite on food additives) en el año 2008, la Unión Europea extendió la aprobación
para la utilización de la Stevia en todos los usos actualmente aceptados para el aspartame, lo
que sugiere que el mercado en Europa tiene un gran potencial de expansión. Recientemente
(Abril del 2010), la autoridad Europea de Seguridad Alimentaria (EFSA) evaluó la
estabilidad de los esteviol glicósidos y estableció inclusive una ingesta diaria admitida (IDA)
para su uso de hasta 4 mg/Kg de peso corporal, lo que equivale a 720 mg para una persona
de 60 kg.
20
2.4.3 Cultivo en ecuador
La producción de Stevia en Ecuador ha ido creciendo los últimos años, se ha establecido que
la empresa Agroestevia que pertenece al ingenio Valdez es el mayor productor a nivel
nacional; está ubicada en cerecita provincia del Guayas y tiene 17 hectáreas de Stevia,
aunque actualmente se encuentra ampliando su cultivo. El ingenio Valdez exporta gran parte
de su producción, utiliza otra parte para su industrialización y una mínima cantidad lo vende
al mercado local. (Ibarra, 2011)
2.4.4 COMPOSICIÓN DE LA Stevia
Los principios de la Stevia rebaudiana se deben a sus componentes activos naturales
presente en las hojas, que son el Esteviósido y rebaudiósidos A, B, C, D, y E; dulcósido A y
Esteviolbiósido. (Kolb, Herrera, Ferreira, & Uliana, 2001), aparte de los glucósidos ya
mencionados, las hojas de Stevia contienen Ac. ascórbico, β-caroteno, cromo, cobalto,
magnesio, hierro, potasio, fósforo, rivoflavina, tiamina, estaño y zinc; además de estos se
encuentran productos químicos como apigenina, austroinilina, avicularin, β-sitoesterol,
ácido caféico, campesterol, cariofileno, centaureidin, ácido clorogénico, clorofila,
kaempferol, luteolina, quercetina, estigmasterol entre otras. (Sharma, y otros, 2006)
2.4.5 PROPIEDADES DE LA Stevia
Contra la diabetes
La principal propiedad analizada de la Stevia rebaudiana es la de endulzar mediante sus
glucósidos sin alterar el nivel de glucosa en las personas que lo consumen por lo que se está
abriendo campo cada vez más como endulcolorante mayormente usado por pacientes de
diabetes. (Anton et. Al 2010) (Chen et. Al. , 2005)
21
Control de peso y la obesidad
El consumo de Stevia es importante para la gente que desea perder peso, no solo porque
ayuda a disminuir la ingesta de calorías, sino porque reduce los antojos y la necesidad de
estar comiendo dulces.
Anton et. Al. (2010) midieron los efectos de la Stevia sobre la ingesta de alimentos, saciedad,
glucosa y niveles de insulina en comparación con el aspartamo y la sacarosa. Durante 3 días
aplico una precarga de cada endulzante (Stevia 290 kcal, aspartamo 290 kcal y sacarosa 493
kcal) 20 minutos antes de cada comida (desayuno, almuerzo y cena) a 40 individuos (19
normales y 12 obesos entre 18 y 50 años), además midió los niveles de glucosa en sangre 20
minutos antes y después de cada precarga. Los resultados de este experimento revelaron que
las personas que recibieron las precargas de Stevia y aspartame consumieron la misma
cantidad de alimentos que las que recibieron sacarosa a pesar de que consumió menos
calorías, además se observó una reducción en los niveles de glucosa e insulina postprandial
en aquellos que consumieron Stevia y una reducción de 1 Kg de peso.
La Stevia contra la hipertensión
Por años, las tribus guaraníes de Paraguay y Brasil han usado diferentes de Stevia
especialmente la Stevia rebaudiana, como endulzante para contrarrestar el sabor amargo de
los medicamentos a base de diferentes plantas y bebidas con fines medicinales que incluyen
la regulación de la glicemia y la hipertensión. (Lee et. Al. 2001)
Los primeros estudios tanto en animales y seres humanos demostraron que el esteviosido y
el extracto de Stevia tiene efecto vasodilatador, diurético y cardiotónico regulando la presión
y los latidos del corazón (Melis, Rocha, & Augusto, 2009)
Se han realizado diversos estudios sobre el efecto del extracto de hojas de Stevia contra la
hipertensión: Melis 1996 observo un efecto hipotensor en ratas entre 40 y 60 días después
de la administración de extracto de hojas de Stevia; del mismo modo, se reduce la presión
arterial en ratas después de dosis orales repetidas de esteviósido a 25 mg / Kg peso corporal
por día durante 6 semanas. (Chen, Jeppesen, Nordentoft, & Hermansen, 2007)
22
Los estudios en seres humanos han demostrado también el efecto del esteviósido en el
sistema cardiovascular. El esteviósido provoca bradicardia e hipotensión. Del mismo modo
un efecto hipotensor ligero fue observado en personas que recibieron un te preparado a base
de Stevia rebaudiana al día durante 30 días. (Kolb, Herrera, Ferreira, & Uliana, 2001)
Stevia como inmunomodulador
Un inmunomodulador es cualquier sustancia que ayuda a regular el sistema inmunológico,
no tiende a aumentar la inmunidad sino que la normaliza optimizando la respuesta inmune.
Este comportamiento se debe a que contiene alcaloides que contribuyen a la defensa celular
y valor hormonal. (Sharma, y otros, 2006)
Chen, (2005) realizó un ensayo en ratas para determinar la actividad inmunomoduladora del
esteviósido en diferentes parámetros del sistema inmune en tres dosis diferentes (6,25; 12,5;
25 mg/Kg peso). El estudio demostró que los esteviósidos aumentan sustancialmente la
proliferación en el LPS de Coe-A y B y células T estimuladas, respectivamente. Por lo tanto,
demostró que la Stevia es prometedora como agente inmuno-modulador, pues actúa
mediante la estimulación de la inmunidad celular y función fagocítica.
Efecto antimicrobiano
Se ha demostrado en estudios realizados que la Stevia contribuye a la prevención de la caries
ya que este no puede ser fermentado (11), además de comprobarse su efecto batericida y
bacteriostático sobre varias bacterias entre estas el Streptococcus muttans principal agente
que interviene en la caries dental. Manish (2006) hace mención también sobre sus
características antibióticas y anti fúngicas.
Actualmente se realizan investigaciones en Ecuador para la implementación de la Stevia
como parte del alimento de animales por sus propiedades antibióticas, por lo cual constituye
un producto promisorio en el área de producción orgánica de animales.
23
CAPITULO III
3 METODOLOGIA
Tipo de Diseño de la investigación
Este trabajo será realizó basado en diferentes tipos de investigación:
Estudio Experimental de Tipo Microbiológico.- Ya que es un estudio in vitro, que
fué realizado en un laboratorio microbiológico bajo condiciones de control.
Estudio transversal.-debido a que las variables fueron observadas en un solo
momento.
Prospectivo: Estudio en el cual el registro de los datos será orientado al futuro, ya
que pueden ser utilizados como base para nuevas investigaciones.
24
POBLACIÓN Y MUESTRA DEL UNIVERSO DE ESTUDIO
UNIVERSO: No se conoce con exactitud el tamaño total de la población por ello se estima
con fórmulas que no consideran ese aspecto.
MUESTRA.- Para determinar el tamaño de la muestra se utilizó la fórmula para
comparación de medias:
Elaboración: Ing. Guerrero
Figura 5. Formulación de muestra.
25
3.2.1 CRITERIOS DE INCLUSIÓN
Cepas puras de Candida albicans ATCC® 1023
Cultivo Agar Sabouraud Glucosado.
Extracto etanólico de Stevia rebaudiana al 30% conservado con las debidas medidas
de almacenamiento.
Stevia comercial en estado líquido con registro sanitario.
3.2.2 CRITERIOS DE EXCLUSION
Cultivo de Candida albicans con mala práctica de almacenamiento.
Cultivo Agar Sabouraud Glucosado libre de contaminación antrópica.
Stevia comercial expirado.
VARIABLES
3.3.1 DEFINICIÓN DE VARIABLES
VARIABLE DEPENDIENTE
Efecto inhibitorio: Impide o detiene el crecimiento del microorganismo, en este caso la
Candida albicans. Para medición se utilizara el método Kirby-Bauer, en el que se miden los
halos de inhibición observados alrededor de los discos que contienen la sustancia inhibitoria.
Para la incubación y crecimiento del hongo se utilizara el medio de cultivo Agar Sabouraud
Glucosado. (Marsh Philip D, 2011)
VARIABLE INDEPENDIENTE
Stevia rebaudiana: es una especie del género Stevia de la familia de las Asteráceas nativa
de la región tropical de Sudamérica, hace varias décadas se cultiva por sus componentes
edulcorantes y su contenido calórico, además se han publicado artículos donde describe
propiedades antimicrobianas. (Abreu, McBain, & Simoes, 2012)
Control positivo: Clorhexidina al 0.12%
Control negativo: suero fisiológico
26
3.1.1. OPERACIONALIZACIÓN DE VARIABLES
VARIABLES CONCEPTO DIMENSIÓN INDICADORES ESCALA
DEPENDIENTE
Efecto inhibitorio
Es la capacidad que posee
una sustancia de impedir
el crecimiento de un
microorganismo, en este
caso de la Cándida
Albicans ATCC® 10231,
en cual se medirá a través
de halos de inhibición
conocido como Método
Kirby-Bauer.
Regla milimétrica
< a 9mm es Resistente.
De 9 mm a 13 mm es
sensible al límite.
De 14mm a 18 mm es
sensible intermedio
>a 19mm es sumamente
sensible.
Cuantitativa
0
1
2
3
INDEPENDIENTE
Stevia rebaudiana
Especie del
género Stevia de la familia
de las Asteráceas que se
usa como endulcolorante
y se estudian sus
propiedades
antimicrobianas.
Extracto de las hojas secas
trituradas en la q se utilizó
como solvente alcohol
etanólico, por
percolación.
1: Extracto etanólico de
Stevia rebaudiana al 30%
Nominal
0
1
Extracto acuoso de hojas
de Stevia
2: Stevia comercial
Variable control
Sustancias control
Sustancias probadas de
inhibición o no de
crecimiento de C. albicans
1: control positivo
2:control negativo
1: Clorhexidina al 0.12%
2: suero fisiológico
0
1
27
PROCEDIMIENTO
3.4.1 Procedimiento de obtención de extracto de Stevia rebaudiana
1. Para obtener el extracto de Stevia rebaudiana se partió de la planta lavada
desinfectada y seca en una proporción de 1: 3, 1 parte de planta y 2.5 partes de
solución extractora; la solución extractora compuesta por 70 % alcohol etílico
potable y 30 % de agua destilada, para este caso particular se partió de un peso de
30 g de las hojas secas trituradas de la planta y un volumen de 70 ml de etanol
absoluto potable y de 30 ml de agua destilada estéril.
Figura 6. Hojas secas de Stevia rebaudiana
Fuente: investigación.
Elaboración: Katherine Estacio.
Figura 7 Proceso de percolación para obtención del extracto de Stevia rebaudiana al 30%
Fuente: investigación.
Elaboración: Katherine Estacio.
28
2. La planta junto con la solución extractora se las colocó en un recipiente de polietileno
con boca ancha y se sometió a percolación por 72 horas. La percolación es un proceso
mediante el cual la solución extrae los principios activos presentes en la planta la
cual al estar en contacto continuo con la solución extractora logra que se produzca
el fenómeno de difusión de los activos de la planta hacia el solvente hasta que se
alcance un equilibrio, este equilibrio se logra entre las 60 y 72 horas de percolación.
3. Una vez obtenido el extracto se lo sometió a calentamiento por 30 minutos a
temperatura de alrededor de 45 ° para concentrar el extracto; se lo filtró y luego se
dejó en reposo por 24 horas.
Figura 8. Proceso de filtración.
Fuente: investigación.
Elaboración: Katherine Estacio.
29
4. Pasado este tiempo se lo envasó en los recipientes previamente lavados y
desinfectados; se sometió a irradiación con el fin de eliminar la contaminación
bacteriana. El proceso se lo realizó en cámara de radiación ultravioleta por 1 hora.
Figura 9. Radiación durante una hora.
Fuente: investigación.
Elaboración: Katherine Estacio.
5. Con este procedimiento de extracción se obtienen extractos fluidos al 100 % de
concentración de activos puesto que al llegar a un equilibrio de concentración de
principios activos en la planta y en la solución extractora, el fenómeno de difusión
se detiene y la extracción llega a su límite máximo; es decir, no se pueden extraer
más activos de la planta.
3.4.2 Preparación del inoculo: Activación
Se utilizó una cepa de Cándida albicans ATCC® 1023. El significado de ATCC es
American Type Culture Collection, lo que indica que es un material biológico
certificado. Para la activación de la cepa de Candida Albicans se utilizó las
indicaciones entregadas por MEDIBAC, empresa proveedora de la misma:
30
1. Se dejó el duopack que contenía la cepa sin abrir para que se equilibre a la
temperatura ambiente. Se rasgó la funda.
Figura 10. Cepa de Candida albicans sellado
Fuente: investigación.
Elaboración: Katherine Estacio.
2. Se arrancó la porción de lengüeta con la etiqueta y se adjuntó al cultivo primario
para darle registro de control de calidad.
3. Se sujetó (sólo una vez) la ampolla en la parte superior del empaque (justo debajo
del menisco de fluido de la ampolla) encontrando la tapa para liberar el
hidratante.
4. Se sostuvo verticalmente y se presionó en la superficie dura para facilitar el flujo
de fluido a través del eje en la parte inferior de la unidad que contenía una bolita.
Se permitió que el fluido pase a través del mango de la torunda y en la parte
inferior de la unidad que contenía el sedimento.
31
Figura 11. Ampolla que contiene la cepa.
Fuente: investigación.
Elaboración: Katherine Estacio.
5. Se apretó en la parte inferior de la unidad, se aplastó el precipitado en el líquido
hasta que la suspensión estuvo homogénea.
6. Inmediatamente, fuertemente se saturó un hisopo con los materiales hidratados y
se hizo la transferencia a un T.S.B. de 10ml que es el Agar Tripcasa de Soya el
cual permite el crecimiento vigoroso de microorganismos, en éste caso de
Candida albicans.
Figura 12. Hisopo sometido en cepa de Candida albicans
Fuente: investigación.
Elaboración: Katherine Estacio.
32
7. Para la preparación del inóculo se tomó como referencia un estándar con una
turbidez de 0.5 Mcfarland. Se comparó la turbidez de manera visual.
Figura 13. Comparación del inoculo con el estándar Mcfarland de 0,5 turbidez.
Fuente: investigación.
Elaboración: Katherine Estacio.
8. Mediante la eliminación adecuada de riesgo biológico, se desechó el empaque.
9. Se incubó inmediatamente el inóculo a la temperatura de 35 centígrados durante
48 horas.
Figura 14. Inóculo primario de Candida albicans.
Fuente: investigación.
Elaboración: Katherine Estacio.
33
Figura 15. Inóculo en incubación.
Fuente: investigación.
Elaboración: Katherine Estacio.
3.4.3 Preparación de medio de cultivo: Sabouraud Glucosado Agar
Medio que se utilizó para el aislamiento, identificación y conservación de hongos patógenos
y saprófitos.
Fundamento
Medio de cultivo recomendado por Nolteen 1986 para el aislamiento y desarrollo de hongos.
En el medio de cultivo, la pluripeptona y la glucosa, son los nutrientes para el desarrollo de
microorganismos. “El alto contenido de glucosa, la presencia de cloranfenicol y el pH ácido,
favorecen el crecimiento de hongos por sobre el de bacterias, además, al medio de cultivo,
pueden agregarse otros agentes selectivos de crecimiento” (Williams & Lewis, 2000).
Procedimiento
Se suspendió 65g de polvo del medio deshidratado por litro de agua destilada. Se dejó
reposar 5 minutos y se mezcló hasta uniformar. Se calentó agitando frecuentemente y se
hirvió 1 minuto hasta disolver. Se esterilizó 15 minutos a 121ºC y se colocó Gentamicina
(presentación en ampollas adquirida comercialmente). Finalmente se vertió en cajas Petri se
dejó enfriar y solidificar.
34
Figura 16. Agar Sabouraud glucosado
Fuente: investigación.
Elaboración: Katherine Estacio.
3.4.4 Preparación de discos
Se dispusieron los discos de papel filtro previamente esterilizados en autoclave y secados en
estufa en cajas Petri estériles, donde se los dividió en 4 grupos de 30, se le colocó 20
microlitros de cada sustancia a evaluar para cada grupo, es decir, al primer grupo de discos
Stevia comercial “Multidulzura”, al segundo grupo extracto etanólico de Stevia rebaudiana
al 30%, al tercer grupo el control positivo que fue la Clorhexidina al 0.12% y al cuarto grupo
el control negativo que en éste caso fue el suero fisiológico, esto utilizando una micropipeta
digital para mejor exactitud, puesto que una sobrecarga falsearía los resultados.
Figura 17. Preparación de discos con pipeta digital.
Fuente: investigación.
Elaboración: Katherine Estacio.
35
3.4.5 Siembra en el Agar Sabouraud Glucosado
Una vez que estuvo solidificado el Agar Sabouraud Glucosado, se procedió a realizar una
siembra por agotamiento o estría múltiple con un hisopo estéril se sumergió en el inóculo ya
preparado, posterior se realizaron estrías con dicho hisopo en el agar, las estrías se las realizó
en tres direcciones y alrededor lo que permitió en la Candida albicans crezca en toda la
superficie.
Figura 18. Siembra de Candida albicans en Agar Sabouraud Glucosado.
Fuente: investigación.
Elaboración: Katherine Estacio.
Se dejó secar las placas por 5 minutos para luego proceder a la colocación de los discos las
preparados.
3.4.6 Colocación de los discos en el cultivo
Previo a la colocación de los discos se rotuló cada una de las cajas Petri con el número de
repetición y la señalización de “Cl” para la Clorhexidina al 0.12%, “Sf” para el suero
fisiológico, “MD” para la Stevia comercial “Multidulzura” y “PE” para el extracto etanólico
al 30% de la planta Stevia rebaudiana.
36
Figura 19. Rotulaión de placas.
Fuente: investigación.
Elaboración: Katherine Estacio.
Se dispuso con una pinza estéril 1 disco en cada caja Petri por cada presentación de Stevia
(Stevia comercial “Multidulzura” y extracto etanólico de Stevia rebaudiana al 30%) al igual
que 1 disco del control positivo que en éste caso fue la Clorhexidina al 0.12% y 1 por el
control negativo que en este fue suero fisiológico, quedando cuatro discos por cada cultivo.
Se dejó reposar la caja petri durante 15 minutos para luego voltearla y depositarla en la estufa
de incubación a 37°C por 48 horas.
Figura 20. Cultivos listos para incubar.
Fuente: investigación.
Elaboración: Katherine Estacio.
37
3.1.2. Lectura de los halos de inhibición
Después de dos días con un calibrador para método de ensayo de la susceptibilidad de Kirby
Bauer se midieron los halos de inhibición que se produjeron en cada una de las cajas Petri,
para lo cual se tomó como referencia las pautas de Duraffourd.
Figura 21. Halo de inhibición medido mediante calibrador para método Kirby Bauer.
Fuente: investigación.
Elaboración: Katherine Estacio.
Posterior se compararon las lecturas con los halos de inhibición que resultaron del control
positivo que fue la clorhexidina al 0.12%, para interpretar.
3.4.7 Manejo de desechos
Para evitar riesgo de contaminación por desechos, en el laboratorio en el que se trabajó se
realizó un adecuado manejo interno y externo de residuos peligrosos biológicos infecciosos,
de modo que no atenta contra la salud de los seres humanos.
38
CAPITULO IV
ANÁLISIS E INTERPRETACIÓN DE RESULTADOS
Una vez realizada la investigación procede al análisis de los resultados obtenidos para la
medición de la inhibición de crecimiento, producida por la Stevia comercial y el extracto
etanólico de Stevia rebaudiana al 30%, sobre Cándida albicans ATCC® 1023, mediante el
método Kirby-Bauer, utilizando la herramienta estadística SPSS V22 y el Excel 2016.
Inicialmente se realizará el análisis descriptivo de los datos según el tipo de presentación de
Stevia aplicado:
Tabla 1 Distribución de Frecuencias de la prueba de Stevia comercial de Multidulzura Categoría Medición
en mm
Frecuencia Porcentaje
válido
Porcentaje
acumulado
Sensible al
límite
9 mm 7 23.3 23.3
10 mm 12 40.0 63.3
11 mm 8 26.7 90.0
12 mm 3 10.0 100.0
Total 30 100.0
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
La tabla 1 refleja los grupos de datos que han sido utilizados para la demostración del efecto
inhibitorio de la Stevia comercial de nombre “Multidulzura”, para el crecimiento de las cepas
de Candida albicans en 48 horas; donde el 40% de las mediciones corresponden a 10mm,
mientras que un 26,7% miden 11 mm; así mismo, el 23.3% posee un diámetro de 9 mm
quedando finalmente un 10% que mide 12 mm de donde estos resultados indican que este
extracto es sensible al límite.
Gráfico 1 Distribución de frecuencias de la Stevia comercial Multidulzura
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
712
830
51015
Stevia comercial Multidulzura
39
El gráfico 1 permite determinar con claridad la distribución de la variable Stevia comercial
“Multidulzura” en referencia al diámetro de los halos y la frecuencia de cada resultado
obtenido en el que se destaca el de 10 mm con 12 repeticiones.
Tabla 2 Distribución de Frecuencias de la prueba del Extracto de Stevia al 30% CATEGORÍA MEDICIÓN Frecuencia Porcentaje
válido
Porcentaje
acumulado
Sensible al
límite
8 mm 3 10.0 10.0
9 mm 16 53.3 63.3
10 mm 11 36.7 100.0
Total 30 100.0
Fuente: Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
En la tabla 2 se aprecian los grupos de datos que han sido utilizados para la demostración
del efecto inhibitorio del extracto etanólico d-e Stevia rebaudiana al 30%, para el
crecimiento de las cepas de Candida albicans en 48 horas; donde el 53.3% de las mediciones
corresponden a 9 mm, mientras que un 36,7% miden 10 mm; finalmente un 10% que mide
8 mm. Estos resultados indican que este extracto es sensible al límite.
.
Gráfico 2 Distribución de frecuencias del Extracto de Stevia al 30% Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
El gráfico 2 muestra la distribución del variable extracto de Stevia al 30%, en referencia al
diámetro de los halos y la frecuencia de cada resultado obtenido donde se destaca que la
medida con mayor frecuencia es 9 mm con 16 repeticiones.
316 11
0
10
20
Extracto de Estevia al 30%
40
Tabla 3 Distribución de Frecuencias de la prueba control positivo
Con Clorhexidina 0,125% CATEGORÍA MEDICIÓN Frecuencia Porcentaje
válido
Porcentaje
acumulado
Sensible al
límite
13 mm 1 3.3 3.3
Muy Sensible 14 mm 8 26.7 30.0
15 mm 14 46.7 76.7
16 mm 7 23.3 100.0
Total 30 100.0
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
La tabla 3 refleja los grupos de datos que resultaron del grupo control con Clorhexidina al
0.125% para el crecimiento de las cepas de Candida albicans en 48 horas; donde el 46.7%
de las mediciones corresponden a 15mm, el 26,7% miden 14 mm; así mismo, el 23.3% posee
un diámetro de 16 mm quedando finalmente un 3.3% que mide 13 mm.
Gráfico 3 Distribución de frecuencias de Clorhexidina 0.125%
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
También se establecieron las comparaciones entre los efectos inhibitorios producidos por la
Stevia comercial y el extracto etanólico de Stevia rebaudiana al 30% sobre Candida albicans
para finalmente establecer el efecto inhibitorio con el control positivo que en este caso es la
Clorhexidina al 0,125%
18
147
05
1015
13 14 15 16
Sensible allímite
Muy Sensible
Clorhexidina 0,125%
41
Gráficos de caja y bigote para establecer la distribución intercuartil de los datos en las
distribuciones:
Gráfico 4 Distribución intercuartil del Extracto de Stevia al 30%
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
El gráfico 4 permite observar la distribución intercuartil del extracto etanólico de Stevia al
30%, donde se observa que está sesgada a la izquierda y no posee valores atípicos, cabe
anotar que la mayoría de datos se concentran entre la mediana y el tercer cuartil.
Gráfico 5 Distribución intercuartil de la Stevia comercial Multidulzura
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
El gráfico 5 permite observar la distribución intercuartil del extracto de la Stevia comercial
“Multidulzura”, donde se observa que presenta una simetría y no posee valores atípicos, cabe
anotar que la mayoría de datos se concentran entre la mediana y el tercer cuartil.
Q1
Q3
Me
Me
Q1
Q3
42
Tabla 4 Cálculo estadístico de los extractos
Estadísticas de muestra única Estadísticos
MULTI DULZURA N 30
Media 10.33
Desviación estándar 0.935
Media de error estándar 0.171
EXTRACTO DE ESTEVIA
AL 30%
N 30
Media 9.27
Desviación estándar 0.640
Media de error estándar 0.117
CLORHEXIDINA 0,125% N 30
Media 14.90
Desviación estándar 0.803
Media de error estándar 0.145
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
La tabla 4 permite observar los estadísticos calculados para cada uno de los extractos en
donde se tiene la media, desviación estándar y la media del error estándar. En lo que respecta
a la media aritmética, el valor más bajo corresponde al extracto etanólico de Stevia al 30%
(9.27); sin embargo, el valor 9.27 ˃ 8, que es el límite entre resistencia a la inhibición y la
sensibilidad a la misma según las pautas utilizadas.
Gráfico 6. Comparación de medias
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerro
En el gráfico 6 se evidencia la comparación de medias, donde se observa un promedio de
14,90mm de halos de inhibición para el control positivo, un promedio de 10,33mm de halos
de inhibición para la Stevia comercial “Multidulzura” representado con la barra azul, y para
el extracto etanólico de Stevia rebaudiana al 30% se obtuvo un promedio de 9,27mm de
10,339,27
14,90
Media en milimetros
Comparación de medias
MULTIDULZURA
EXTRACTO DEESTEVIA AL30%CLORHEXIDINA 0,125%
43
diámetro representado con la barra roja siendo el promedio más bajo obtenido en relación
con los antes mencionados.
Para determinar el efecto antimicótico producido nos basamos en las pautas de Duraffourd
descritas en la tabla 1. Se determinó mediante T-student la significancia con relación a las
pautas de Duraffourd.
DIÁMETRO DE HALO CARACTERÍSTICA DE
SENSIBILIDAD
INFERIOR A 8 mm Nula (-)
ENTRE 8 Y 14 mm Sensibilidad límite
(sensible=+)
ENTRE 14 Y 20 mm Muy sensible (++)
SUPERIOR A 20 mm Sumamente sensible (+++)
Tabla 5 Prueba t student pata muestra única
Valor de prueba = 8
t Gl Sig.
(bilateral)
Diferencia
de medias
95% de intervalo
de confianza de la
diferencia
Inferior Superior
MULTI
DULZURA
13.079 29 0.000 2.233 1.88 2.58
EXTRACTO DE
ESTEVIA AL
30%
10.846 29 0.000 1.267 1.03 1.51
CLORHEXIDINA
0,125%
47.064 29 0.000 6.900 6.60 7.20
Fuente : Resultados pruebas de laboratorio
Elaboración : Ing. Fernando Guerrero
La tabla 5 presenta los resultados de la prueba t student, para muestra única, se aplicó esta
prueba para establecer el nivel de inhibición comparado con el valor límite (r ˂ 8) para
determinar la sensibilidad de cada uno de los extractos utilizados.
Como se analizó en la tabla 4, todos los extractos son sensibles o a su vez producen el efecto
inhibitorio del crecimiento de las cepas de Candida albicans, la prueba de t student devuelve
valores de p (Sig.) que tienden a 0 por lo tanto si 0 ˂ 0.05, se puede rechazar la hipótesis
nula dado que se ha obtenido y valor de α menor. Por otra parte, el valor t calculado en cada
caso es mayor al valor t teórico según los grados de libertad y el nivel de confianza, por los
tanto se ratifica que se rechaza la hipótesis nula.
44
DISCUSIÓN
En el estudio in vitro realizado se analizó a la Stevia rebaudiana en dos presentaciones: el
extracto etanólico al 30% de la planta y a la Stevia comercial “Multidulzura” ambas para
determinar el efecto antimicótico que pudiesen tener sobre Candida albicans, dando como
resultado halos de inhibición con una media de 10,33mm de diámetro para la Stevia
comercial y de 9,27mm de diámetro para el extracto etanólico de Stevia rebaudiana al 30%,
lo que indicó que Candida albicans es sensible a mencionadas presentaciones de Stevia,
basándonos en las pautas de Durafford al igual que en la investigación de finalización de
carrera presentada por Pérez (2013) “efecto antibacteriano in vitro del extracto etanólico de
Stevia rebaudiana sobre Streotococcus mutans” donde los extractos se consideraron activos
si el diámetro de la zona de inhibición era de 8 mm o más.
Chilaca y Cava (2014) en su estudio “Valoración in vitro de la actividad antimicótica del
extracto de Stevia rebaudiana contra Candida albicans” determinaron que el extracto de
Stevia rebaudiana al 10% sobre la siembra de Candida albicans genera un halo promedio
de 12 mm; para el extracto de Stevia rebaudiana al 20% generó un halo promedio de 16 mm
y para el extracto al 30% se obtuvo un halo promedio de 20 mm, siendo valores mayores
que los obtenidos en el presente estudio, se asume que la diferencia de datos puede estar
dada por el método para la obtención del extracto de Stevia.
Existen estudios en los que se analizó a la Stevia rebaudiana sobre otros microorganismos
que cabe mencionar como el realizado por Manish, Tadhani, & Rema (2006), en el cual
elaboraron extractos de Stevia con diferentes solventes como agua, metanol, acetato de etilo
y hexano contra cuatro bacterias gram positivas (B. subtilis, S. aureus, M. letus, B.
megaterium), cuatro gram negativas (S. marcensens, P. aeruginosa, E. coli, P. valgaris) y
hongos como R. oligosporus y A. niger en los que se observo resultados con halos desde los
9 mm contra B. sublitis, hasta 22 mm contra R. oligosporus, siendo resultados muy elevados
en contraste con los resultados q generó en éste estudio sobre Candida albicans.
De la misma forma Vitery Sapuyes, Escribano, Gamboa, & Chavarría, (2010) realizo un
estudio in vitro similar al de Manish donde se comparó la influencia de extractos de Stevia
rebaudiana elaborados con diferentes solventes, pero en éste caso sobre microorganismos
45
que comúnmente se encuentran en cavidad oral como son Streptococcus mutans y
Lactobacillus acidophilus del cual resultó que el extracto con agua como solvente dio un
halo de 9 mm de diámetro tanto para S. mutans como para L. acidophillus; el extracto
metanólico produjo un halo promedio de 11.5mm para el S. mutans y 12mm para el L.
acidophillus; del extracto con acetato de etilo como solvente resultó 11.5mm para el S.
mutans y 10.5 mm para el L. acidophillus; del extracto con hexano como solvente se obtuvo
14.5 mm y 15.5 mm para S. mutans y L. acidophillus.
A diferencia de ésta investigación en la que se tomaron los datos a las 48 horas, en el estudio
de Vitery se tomaron las mediciones de los halos a las 72 horas de incubación de los cultivos
por lo que se podría decir que los extractos de Stevia rebaudiana tuvieron un efecto tardío
sobre los microorganismos.
46
CAPITULO V
CONCLUSIONES
Se determinó que tanto la Stevia comercial como el extracto etanólico de Stevia
rebaudiana al 30% genera inhibición de crecimiento sobre la cepa de Candida
albicans basado en las pautas de Durafford.
Mediante el método de Kirby Bauer se obtuvo un halo de inhibición de crecimiento
de Candida albicans para la Stevia comercial con una media de 10,33 mm, siendo
mayor que la media de los halos que generaron el extracto etanólico al 30% de Stevia
rebaudiana un halo de 9, 27mm.
El control positivo en éste caso la Clorhexidina al 0.12% obtuvo un halo de inhibición
de una media de 14,90mm lo que indicó un mayor efecto antimicótico que la Stevia
rebaudiana en sus dos presentaciones, tomando en cuenta que son productos
sintéticos elaborados con este fin q poseen investigaciones de años de precedencia.
47
RECOMENDACIONES
Se debe realizar nuevas investigaciones con diferentes porcentajes de concentración
de la Stevia rebaudiana para encontrar mejores resultados.
Analizar si la Stevia tiene efecto sobre otras especies de Candida, como Candida
glabrata, C. krusei, y C. tropicalis; esto debido a que son especies que también se
encuentran presentes en la candidiasis aunque en menor porcentaje.
Continuar con investigaciones que permitan conocer el poder antimicrobiano que
pueda poseer la Stevia rebaudiana en especial contra microorganismos que afectan
a nivel oral con el fin de a futuro determinar la viabilidad para desarrollar enjuagues
bucales a base Stevia rebaudiana que puedan servir como tratamiento coadyuvante
o de prevención a enfermedades de cavidad bucal.
Se debería analizar la sensibilidad de Candida albicans sometida a extractos de
Stevia rebaudiana a diferentes tiempos de incubación, es decir, a las 24 horas, a las
48 horas y las 72 horas.
48
BIBLIOGRAFÍA
Abreu, A. C., McBain, A., & Simoes, M. (2012). Plants as sources of new antimicrobials
and resistance-modifying agents. Natural Product Reports, 1007-1021.
Anton, S., Martin, C., Han, H., Coulon, S., Cefalu, W., & Geiselman, P. (2010). Effects of
Stevia, aspartame and sucrose on food intake, satiety and postprandial glucose and
insulin levels. Appetite, 37-43.
Arce Mendoza, A. (2009). Inmunología e Inmunopatología Oral. México : El Manual
Moderno.
Bascones, A. (2004). Medicina Bucal. Barcelona: ARIEL.
Bertoni, F. M. (junio de 2011). El sorprendente legado que nos dejó el sabio Moisés Bertoni:
El Ka´a He´e. Mem. Int. Investig. Cienc. Salud, (9)1, 60-63.
Brandle, J., Richman , A., Swason , A., & Chapman , B. (2002). Leaf ESTs from Stevia
rebaudiana: a resource for gene discobery in diterpene synthesis . Plant Mol Biol,
613-622.
Brooks, G., Carroll, K., Butel, J., Morse, S., & Mietzner, T. (2011). Microbiología Médica.
México: Mc Graw Hill.
Cawson, R., & Edell, E. (2009). Fundamentos de Medicina y Patología Oral. Barcelona-
España: ELSEVIER.
Ceccotti, E., Sforza, R., Carzoglio, J., Luberti, R., & Flichman, J. (2007). El Diagnóstico en
Clínica Estomatológica. Buenos Aires: MEDICA PANAMERICANA.
Chen, J., Jeppesen, P., Nordentoft, I., & Hermansen, K. (2007). Stevioside improves
pancreatic? cell function during glucotoxicity via regulation of acetyl-CoA
carboxilase. Am J Physiol Endocrinol Metab, 292.
Chen, T., Chen, S., Chan, P., Chu, Y., Yang, H., & Cheng, J. (2005). Mechanism of the
hipoglycemic effect of estevioside, a glycoside of Stevia rebaudiana. Planta Med,
108-113.
Chilaca, G., & Cava, C. (2014). Valoración in vitro de la actividad antimicótica del etracto
de Stevia rebaudiana contra la Cándida albicans. ECORFAN-Bolivia, 368-403.
De la Rosa, E. V. (2012). Factores de riesgo para candidosis asociada a protesis bucal.
Revista ADM, 69(6), 267.
DeLong, L., & Burkhart, N. (2015). Patología Oral y General en Odontología. Barcelona:
Wolters Kluwer.
49
Durán, S., Rodríguez, M., Cordón, K., & Record, J. (2012). Estevia (Stevia rebaudiana),
endulcorante natural y no calórico. Rev Chil Nutr, 203-206.
Espinel, I. (2008). Mechanisms of resistance to antifungal agents: Yeasts and filamentous
fungi. Rev Iberoam Micol, 25, 101 .
Ibarra, C. (2011). "Estudio de factibilidad para la implementación del cultivo de estevia
(Stevia rebaudiana Bertoni) en Pedro Vicente Maldonado, Pichincha." TESIS.
Quito: Universidad de San Francisco.
Ibsen, O., & Phelan, J. (2014). Patología Oral para el Higienista Dental. Barcelona:
ELSEVIER.
Kolb, N., Herrera, J., Ferreira, D., & Uliana, R. (2001). Analysis of sweet diterpene
glycosides from Stevia rebaudiana: Improved HPLC method. J Agric Food Chem,
38-41.
Lamont, R., Hajisshengallis, G., & Jenkinson, H. (2014). Microbiologia e Inmunología Oral.
México: El Manual Moderno.
Manish, B., Tadhani, & Rema. (June de 2006). In vitro antimicrobial activity of Stevia
Rebaudiana Bertoni leaves. Trópical Journal of Pharmaceutica Research, 5, 557-
560.
Marsh Philip D, M. M. (2011). Microbiologia Oral. En M. M. Marsh Philip D, Microbiologia
Oral (pág. 117). Amolca.
Marsh, P. D., & Martin, M. V. (2011). Microbiología Oral. Venezuela: ELSEVIER.
Martínez Pérez, T. (s.f). La hierva dulce. historia usos y cultivo de la Stevia rebaudiana.
Quito: Universidad Central Del Ecuador.
Martinez, C. (2006). Plantas Medicinales de los Andes Ecuatorianos. En C. Martinez ,
Plantas Medicinales de los Andes Ecuatorianos (págs. 285-296). Quito.
Melis, M., Rocha, S., & Augusto, A. (2009). Steviol effect, a glycoside of Stevia rebaudiana,
on glucose clearances in rats. Braz J Biol, 371-374.
Mukherjee Pk, C. J. (2003). Mechanical of Fluconazol resistence in Candida Albicans
biofilms: phase specific role of efflux pumps and membrane sterols. Infection and
Immunity, 71(4333), 40.
Murray, P., Rosental, K., & Pfaller, M. (2007). Microbiología médica. Madrid-España:
ELSEVIER.
Negroni, M. (2009). Microbiología Estomatológica Fundamentos y guía práctica. Buenos
aires: EDITORIAL MÉDICA PANAMERICANA.
50
Neville, B., Damm, D., Allen, C., & Bouquot, J. (2004). Patología Oral y Maxilofacial. Rio
de Janeiro-Brasil: Guanabara Koogan.
Paredes Garcés, W. G. (2010). Como desarrollar una tesis. S&S.
Pérez, R., & López , E. (2007). Principios de Patología. México: Médica Panamericana.
Prats, G. (2008). Microbiología Clínica. Madrid: Médica Panamericana.
Regezi, J., & Sciubba, J. (1991). Patología bucal. México-México: Interamericana.
Rios M, Y. V. (2009). Plantas medicinales de Salinas de Guaranda. En Y. V. Rios M, Plantas
medicinales de Salinas de Guaranda (págs. 78-79). Quito: Ediciones Abya-Yala.
Rivas Ponce, M. A., & Soriano, C. (1988). Plantas Variedad y modos de vida. Barcelona-
España: IMAGO.
Ryan, K., & Ray, G. (2010). MICROBIOLOGÍA MÉDICA Sherris. New York - USA: Mc
Graw Hill.
Saap, J. P., Eversole, L. R., & Wysocki, G. P. (2005). Patología Oral y Maxilofacial
Contemporanea 2 ED. Madrid-España: ELSEVIER.
Sharma, N., Kaushal, N., Chawla, A., Mohan, M., Sethi, A., & Sharma, Y. (2006). Stevia
rebaudiana-A review. Agrobios newslett, 46-48.
Soto Salinas, A. (2011). Incidencia, diagnostico y prevencion de estomatitis subprotesica en
adultos mayores portadores de protesis totales. Universidad Nacional de Loja, 7.
Soto, A., & Del Val, S. (2002). Extraccion de los principios endulcolorantes de la Stevia
rebaudiana. Revista de Ciencias Agrarias y Tecnología de los Alimentos, 20, 5-9.
Tortora, G. F. (2007). Introducción a la microbiología, 9 Ed. Buenos Aires: Medica
Panamerican.
Vela, E. (2011). Microbilogia Estomatológica. En E. Vela, Microbilogia Estomatológica
(págs. 87 - 94). Quito : Universidad Central del Ecuador.
Velasco, E. (2002). Odontoestomatología y SIDA. Barcelona: ESPAXS.
Vitery Sapuyes, G., Escribano, S., Gamboa, F., & Chavarría, N. (2010). Actividad inhibitoria
de la Stevia rebaudiana sobre el lactobacillus acidophillus y el Streptococcus mutans.
Revista Nacional de Odontología, 57-64.
Waizel, J. (2010). Las plantas medicinales y las ciencias: una visión multidiciplinaria.
México D.F.: Instituto Politécnico Nacional, 591.
Williams, D., & Lewis, M. (2000). Insolation and Identification of Candida from the oral
cavity. Oral Diseases, 3-11.
51
ANEXOS
Anexo 1.Certificado de control de calidad del extracto etanólico de stevia rebaudiana al 30%
53
Anexo 3. Certificado del Lab. Clínico de la Facultad de Ciencias Químicas UCE de haber
realizado el experimento.
55
Figura 22. Área de esterilización de desechos del laboratorio clínico de la Facultad de
Ciencias Química UCE
56
Anexo 5 Realización de prueba piloto.
Proceso de filtración
Radiación por 1 hora
ELABORACIÓN DEL EXTRACTO ETANÓLICO DE STEVIA REBAUDIANA AL
30%
Stevia comercial
y clorhexidina
Extracto etanólico d
Stevia rebaudiana al
30%
ACTIVACION Y SIEMBRA DE Candida albicans
57
Esterilización de aza
para preparar la Candida
albicans
Nivel de turbidez 0.5
Mcfarland
siembra de Candida albicans en Sabouraud Agar
Glucosado
cepa ya activada
Hisopo cargado en Cándida
albicans
58
PREPARACIÓN Y COLOCACIÓN DE DISCOS DE KIRBY-BAUER CON
SUSTANCIAS A EVALUAR
Colocación de los discos
Medida de 20 micro
litros con la pipeta
Colocación de los 20 micro litros de
cada una de las sustancias.
Resultado de prueba piloto
Se presentó un halo de inhibición
de 9.8 mm con el extracto etanólico
de Stevia rebaudiana al 30%.
59
MATERIALES UTILIZADOS
Figura 23. Aza estéril
Figura 24. Cámara de bioseguridad donde fue realizada la prueba.
61
Figura 27. 30 cajas petri utilizadas
Figura 28. Suero fisiológico utilizado como control negativo.
62
Figura 29. Cepa de Candida albicans.
Figura 30. Extracto etanólico al 30%; clorhexidina utilizada como control positivo; Stevia
comercial "Multidulzura"
63
Figura 31. Discos divididos en grupos.
Figura 32. Luz fluorescente para clara medición de resultados.