UNIVERSIDAD CENTRAL DEL ECUADOR … · Conteo de aerobios mesófilos en Agar Sangre 27 Figura 8....
Transcript of UNIVERSIDAD CENTRAL DEL ECUADOR … · Conteo de aerobios mesófilos en Agar Sangre 27 Figura 8....
i
UNIVERSIDAD CENTRAL DEL ECUADOR
FACULTAD DE ODONTOLOGÍA
CARRERA DE ODONTOLOGÍA
DETERMINACIÓN DE MICROFLORA PRESENTE EN EQUIPO ODONTOLÓ-
GICO DE LA CLÍNICA DE TERCER NIVEL DE LA FACULTAD DE ODONTO-
LOGÍA DE LA UNIVERSIDAD CENTRAL DEL ECUADOR
Proyecto de Investigación presentado como requisito previo a la obtención del
Título de Odontóloga
AUTOR: Solano Altamirano Dennis Karolina
TUTOR: B.F. María Fernanda Caicedo Breedy M.Sc.
Quito, abril 2017
ii
©DERECHOS DE AUTOR
Yo, Dennis Karolina Solano Altamirano en calidad de autora del trabajo de investiga-
ción: “DETERMINACIÓN DE MICROFLORA PRESENTE EN EQUIPO ODON-
TOLÓGICO DE LA CLÍNICA DE TERCER NIVEL DE LA FACULTAD DE
ODONTOLOGÍA”, autorizo a la Universidad Central del Ecuador a hacer uso del conte-
nido total o parcial que me pertenece, con fines estrictamente académicos o de investiga-
ción.
Los derechos que como autor me corresponden, con excepción de la presente autorización,
seguirán vigentes a mi favor, de conformidad con lo establecido en los artículos 5, 6, 8; 19
y demás pertinentes de la Ley de Propiedad Intelectual y su Reglamento.
También, autorizo a la Universidad Central del Ecuador realizar la digitalización y publi-
cación de este trabajo de investigación en el repositorio virtual, de conformidad a lo dis-
puesto en el Art. 144 de la Ley Orgánica de Educación Superior.
Firma:
Dennis Karolina Solano Altamirano
CC. Nº 0201969383
iii
APROBACIÓN DEL TUTOR/A
DEL TRABAJO DE TITULACIÓN
Yo, María Fernanda Caicedo Breedy, en mi calidad de tutora del trabajo de titulación,
modalidad Proyecto de Investigación, elaborado por DENNIS KAROLINA SOLANO
ALTAMIRANO; cuyo título es: DETERMINACIÓN DE MICROFLORA PRESEN-
TE EN EQUIPO ODONTOLÓGICO DE LA CLÍNICA DE TERCER NIVEL DE LA
FACULTAD DE ODONTOLOGÍA, previo a la obtención del Título de Odontólogo;
considero que el mismo reúne los requisitos y méritos necesarios en el campo metodológi-
co y epistemológico, para ser sometido la evaluación por parte del tribunal examinador
que se designe, por lo que lo APRUEBO, a fin de que el trabajo sea habilitado para conti-
nuar con el proceso de titulación determinado por la Universidad Central del Ecuador.
En la ciudad de Quito, a los 20 días del mes de marzo de 2017
B.F. María Fernanda Caicedo Breedy M.Sc.
DOCENTE – TUTOR
C. C 0602384083
iv
APROBACIÓN DE LA PRESENTACIÓN ORAL/TRIBUNAL
El Tribunal constituido por: Dr. Jaime Luna Herrera, Dra. Grace Revelo Motta
Luego de receptar la presentación oral del trabajo de titulación previo a la obtención del
título de Odontólogo, presentado por la Señora Dennis Karolina Solano Altamirano.
Con el título:
“Determinación de microflora presente en equipo odontológico de la Clínica de tercer
nivel de la Facultad de Odontología de la Universidad Central del Ecuador”
Emite el siguiente veredicto: APROBADO
Fecha: 26 de abril de 2017
Para constancia de lo actuado firman:
Nombre Apellido Calificación Firma
Presidente Dr. Jaime Luna 19 .. ………………
Vocal Dra. Grace Revelo 19 .. ………………
v
DEDICATORIA
El presente trabajo se lo dedico en primer lugar a Dios, quien mediante me ha permitido
llegar a la culminación de esta etapa de vida, a mis padres quienes han hecho un enorme
sacrificio y esfuerzo para que me convierte en profesional, siendo el apoyo en todo mo-
mento motivando con dulces y sabios consejos; por su ejemplo de trabajo duro y perseve-
rancia para alcanzar los sueños que han plasmado mi vida.
A mis hermanas Mónica y Ma. Belén que fue de gran apoyo y sostén en las noches de vela
y por ser las mejores pacientes que pude tener, por su cariño y amor incondicional en todo
momento bueno y malo.
A mi amado esposo Alexei quien fue caminando a mi lado en los momentos duros y fue mi
guía para no perder la calma.
A mí adorado hijo Pedrito quien me hace sentir un amor indescriptible que me fortalece
para seguir con mi sueño pese al cansancio y las obligaciones de madre.
A mis familiares en especial a mi abuelito Roberto quien me ha entregado su amor incon-
dicional y ha sido paciente en las horas de clínica.
Dennis Solano Altamirano
vi
AGRADECIMIENTO
Con todo mi cariño y mi amor para las personas que formaron parte activa en mi formación
académica y práctica, para que yo pudiera lograr mi sueños, por motivarme y darme la
mano cuando sentía que el camino se terminaba, a ustedes por siempre mi corazón y mi
agradecimiento Papá y Mamá que con su paciencia y comprensión, prefirieron sacrificar su
tiempo para apoyarme a cumplir mi meta.
A mis amigas por apoyarme, ser incondicional en los buenos y malos momentos brindán-
dome su amistad.
A ti Alexei por ser paciente y amoroso, siempre motivándome para que alcance este gran
sueño de ser Odontóloga, impulsándome cada día a llegar aún más lejos.
Mi eterno agradecimiento a mi guía y tutora de tesis B.F Ma. Fernanda Caicedo quien con
bondad y paciencia me ayuda a constituir este trabajo, por su empeño me fortaleció para
ver terminado este trabajo.
Dennis Solano Altamirano
vii
ÍNDICE DE CONTENIDOS
RESUMEN ........................................................................................................................................ xii
ABSTRACT ..................................................................................................................................... xiii
CAPÍTULO I ...................................................................................................................................... 1
MARCO TEÓRICO ........................................................................................................................... 1
1.1 Riesgo biológico en la práctica odontológica........................................................................... 1
1.2 Clínica Odontológica................................................................................................................ 2
1.2.1. Equipo Odontológico ....................................................................................................... 2
1.2.2. Contaminación en el Consultorio Odontológico .............................................................. 3
1.2.3 Fuente de la contaminación ............................................................................................... 4
1.3 Bioseguridad ............................................................................................................................ 4
1.3.1 Bioseguridad en Odontología ............................................................................................ 5
1.3.2 Clasificación de los factores de riesgo. ............................................................................. 9
1.3.2 Niveles de Bioseguridad de acuerdo a los factores de riesgos en la Facultad de
Odontología- UCE.................................................................................................................... 10
1.4 Microflora presente en la superficie del Equipo Odontológico.............................................. 10
2.1.1 Bacterias. ......................................................................................................................... 11
2.1.2 Virus ................................................................................................................................ 12
2.1.3. Mohos y levaduras ......................................................................................................... 12
1.5 Infecciones Intrahospitalarias ................................................................................................. 13
1.5.1 Enfermedades transmisibles en Odontología .................................................................. 13
1.6 Estudios preliminares sobre el tema de investigación. ........................................................... 15
CAPÍTULO II .................................................................................................................................. 16
PLANTEAMIENTO DEL PROBLEMA ......................................................................................... 16
2.1 Planteamiento del problema ................................................................................................... 16
2.2 Objetivos ................................................................................................................................ 17
2.2.1 Objetivo General ............................................................................................................. 17
2.2.2 Objetivos Específicos ...................................................................................................... 17
2.3 Hipótesis ................................................................................................................................. 17
CAPITULO III ................................................................................................................................. 18
3.1 Metodología ........................................................................................................................... 18
3.1.1 Tipo de la Investigación .................................................................................................. 18
viii
3.1.2 Población de estudio y muestra ....................................................................................... 18
3.2 Criterios de inclusión y exclusión .......................................................................................... 20
3.2.1 Criterios de inclusión. ..................................................................................................... 20
3.2.2 Criterios de exclusión. ..................................................................................................... 20
3.3 Variables ................................................................................................................................ 20
3.3.1 Conceptualización de las variables.................................................................................. 20
3.4 Operacionalización de las variables ....................................................................................... 21
3.5 Procedimientos y técnicas ...................................................................................................... 22
3.5.1 Etiquetado de las muestras .............................................................................................. 22
3.5.2 Preparación de Medios de cultivo ................................................................................... 22
3.5.3 Muestreo de superficies ................................................................................................... 23
3.5.3. Conservación y transporte de la muestra ........................................................................ 25
3.5.4 Análisis microbiológico .................................................................................................. 25
3.5.5 Recuento microbiológico ................................................................................................ 27
3.5.6 Recolección de la Información ........................................................................................ 28
CAPITULO IV ................................................................................................................................. 29
RESULTADOS ................................................................................................................................ 29
4.1 Resultados .............................................................................................................................. 29
4.2 Análisis de resultados ............................................................................................................. 33
4.2.1 Prueba de Normalidad: .................................................................................................... 33
4.2.2. Procesamiento estadístico para aerobios totales ............................................................. 34
4.2.3 Procesamiento estadístico para mohos y levaduras. ........................................................ 34
4.2.4 Procesamiento estadístico para superficie más contaminada por aerobios ..................... 35
4.2.5 Procesamiento estadístico para superficie más contaminada por mohos y levaduras ..... 37
CAPITULO V .................................................................................................................................. 40
DISCUSIÓN .................................................................................................................................... 40
CAPITULO VI ................................................................................................................................. 42
CONCLUSIONES ........................................................................................................................... 42
RECOMENDACIONES .................................................................................................................. 43
BIBLIOGRAFÍA .............................................................................................................................. 44
ANEXOS.......................................................................................................................................... 46
ix
LISTA DE TABLAS
Tabla 1. Clasificación de los factores de riesgo………………………………………… 9
Tabla 2. Niveles de Bioseguridad ………………………………………………………… 10
Tabla 3. Clasificación de enfermedades transmisibles en Odontología ………………… 14
Tabla 4. Clasificación de enfermedades transmisibles en Odontología ………………… 14
Tabla 5. Universo y tamaño de la muestra ……………………………………………… 19
Tabla 6. Operacionalización de las variables …………………………………………… 21
Tabla 7. Codificación de recipientes de muestra …………………………………………. 22
Tabla 8. Recuento de aerobios mesófilos ………………………………………………… 29
Tabla 9. Recuento de mohos y levaduras ………………………………………………… 20
Tabla 10. Recuento de coliformes ……………………………………………………… 30
Tabla 11: Recuento de E. coli ………………………………………………………….. 31
Tabla 12: Recuento de mohos y levaduras en MT ……………………………………… 32
Tabla 13: Recuento de aerobios en MT ………………………………………………… 32
Tabla 14: Pruebas de normalidad ………………………………………………………… 33
Tabla 15: Estadísticas de muestras emparejadas aerobios totales ……………………… 34
Tabla 16: Estadísticas de muestras emparejadas mohos y levaduras …………… 34
Tabla 17: Estadística para superficie más contaminada (aerobios …………………… 35
Tabla 18:Estadística para superficie más contaminada (mohos y levaduras ………… 37
x
LISTA DE GRÁFICOS Y FIGURAS
Figura 1. Medios de cultivo Agar Sangre 22
Figura 2. Toma de muestra de agarradera de la Lámpara 23
Figura 3. Toma de muestra de mesa de trabajo 23
Figura 4. Toma de muestra de Jeringa Triple 24
Figura 5. Colocación en el medio de dilución 25
Figura 6. Siembra de cultivos en Agar Sangre y Agar Saboraud 26
Figura 7. Conteo de aerobios mesófilos en Agar Sangre 27
Figura 8. Conteo de mohos y levaduras en Agar Saboraud 28
Figura 9. Conteo de coliformes y E. coli en placa Petrifilm 28
Figura 10. Prueba de Kruskal Wallis para superficie más contaminada por aerobios (an-
tes) 36
Figura 11. Prueba de Kruskal Wallis para superficie más contaminada por aerobios (des-
pués) 37
Figura 12. Prueba de Kruskal Wallis para superficie más contaminada por mohos y leva-
duras (antes) 38
Figura 13. Prueba de Kruskal Wallis para superficie más contaminada por mohos y leva-
duras (después) 39
xi
LISTA DE ANEXOS
Anexo 1. Solicitud para ingreso al Tercer Nivel de la Clínica Integral. ……………….. 46
Anexo 2. Certificado del subcomité de Ética. …………….…………….……………… 47
Anexo 3. Solicitud para el uso del Laboratorio de Microbiología de la Facultad Odontolo-
gía-UCE. …………….…………….…………….…………….…………….………….. 48
Anexo 4. Factura de la compra de materiales e instrumental. …………….……………. 49
Anexo 5. Renuncia a derechos de autor por parte de Estadístico…………….…………50
Anexo 6. Reporte Anti plagió URKUND…………….…………….……………………51
xii
TEMA: Determinación de microflora presente en equipo odontológico de la clínica de
tercer nivel de la Facultad de Odontología de la Universidad Central del Ecuador
Autor: Dennis Karolina Solano Altamirano
Tutora: B.F. María Fernanda Caicedo Breedy M.Sc.
RESUMEN
En consideración que el riesgo de infección para los profesionales odontólogos y pacientes
está presente de manera constante en la práctica clínica, esta investigación se planteó como
objetivo determinar la presencia y cantidad de microflora en la superficie de trabajo del
equipo odontológico en la clínica de tercer nivel de la Facultad de Odontología de la Uni-
versidad Central del Ecuador, como una medida indirecta de evaluación de la eficacia de
los protocolos de bioseguridad de la facultad, tomando en cuenta que gran parte de las in-
fecciones pueden ser transmitidas directa o indirectamente por medio de núcleos de gotas
evaporadas, aerosoles, instrumentos y equipos contaminados. Se utilizó el método experi-
mental mediante cultivo microbiológico para determinar la población microbiana de aero-
bios mesófilos totales, coliformes, Escherichia coli, mohos y levaduras de las superficies
del equipamiento de la clínica, antes y después de la atención odontológica.; los resultados
revelaron que existe una carga microbiológica variable y que en las superficies en estudio
ya estaban contaminadas antes del comienzo de la actividad clínica presentando una carga
microbiológica alta.
PALABRAS CLAVE: CONTAMINACIÓN, EQUIPAMIENTO CLÍNICO, MICROOR-
GANISMOS.
xiii
TOPIC: Determination of microflora present in dental equipment of the third-level Clinic
of the School of Dentistry of the Central University of Ecuador
Author: Dennis Karolina Solano Altamirano
Tutor: B.F. María Fernanda Caicedo Breedy M.Sc.
ABSTRACT
Considering that the risk of infection for dental professionals and patients is constantly
present in clinical practice, this research is intended to determine the presence and amount
of microflora on the work surface of the dental equipment in the third-level Clinic of the
School of Dentistry of the Central University of Ecuador, as an indirect measure of evalua-
tion of the effectiveness of the biosafety protocols of the School, since many of the infec-
tions can be transmitted directly or indirectly through nuclei of evaporated drops, aerosols,
contaminated instruments and equipment. The experimental method was employed trough
microbiological culture, in order to determine the microbial population of total mesophilic
aerobes, coliforms, Escherichia coli, molds and yeasts on the surfaces of the clinic equip-
ment, before and after dental care. The results revealed that there is a variable microbio-
logical load and that in the surfaces under study were already contaminated before the be-
ginning of the clinical activity, presenting a high microbiological load.
KEYWORDS: CONTAMINATION, CLINICAL EQUIPMENT, MICROORGANISMS.
1
CAPÍTULO I
MARCO TEÓRICO
1.1 Riesgo biológico en la práctica odontológica
Otero (1) y Espinoza (2), refieren que la Odontología es considerada una profesión de alto
riesgo de contagio de enfermedades infectocontagiosas, por el carácter médico de los actos
que a diario realizamos; los Odontólogos como el personal Auxiliar son susceptible de
contraer enfermedades infectocontagiosas como SIDA, hepatitis B, tuberculosis y herpes.
Negroni (3) menciona que la cavidad bucal de los pacientes es la mayor fuente de infección
a que los profesionales de Odontología están expuestos, la American Dental Association
(ADA) recomienda considerar a todos los pacientes que acuden a la consulta odontológica
como portadores de agentes infecciosos. Para una práctica preventiva y segura de la odon-
tología es fundamental comprender los principios básicos de la esterilización y la desinfec-
ción para contribuir a evitar la infección cruzada.
Según Pasquarella et al (4) (p1):
‘La práctica Odontológica está asociada con un alto riesgo de infecciones, tanto pa-
ra el profesional, como para los pacientes que pueden estar expuestos a una varie-
dad de microorganismos que colonizan o infectan la cavidad oral y las vías respira-
torias, o que se transporten en el agua utilizada durante los tratamientos. Las princi-
pales fuentes de infección son las líneas de agua, aerosoles microbianos, y superfi-
cies clínicos’.
La jeringa triple es de especial atención durante la práctica odontológica orientada a la pre-
vención de infecciones, debido a que esta tiene un contacto directo con las mucosas, flui-
dos orales y estructuras dentarias del individuo que está siendo tratado. (5)
Esta información pone de manifiesto que el riesgo de infección para el paciente y los pro-
fesionales odontólogos siempre estará latente en la práctica clínica, debido a la exposición
a fluidos biológicos como sangre o saliva de manera directa o indirecta por medio de nú-
cleos de gotas evaporadas, aerosoles, instrumentos y equipos contaminados. En este senti-
do, el personal de salud y de servicio que trabajan en la Clínica Integral de tercer nivel de
2
la Facultad de Odontología de la Universidad Central forman parte del grupo de alto riesgo
de contraer y dispersar microorganismos patógenos y potencialmente patógenos a través
del contacto con secreciones biológicas o reservorios en las superficies, instrumental, ropa,
piel, instalaciones físicas, etc. Razón por la cual hoy la transmisión de microorganismos
patógenos al paciente mediante los procedimientos odontológicos, podrían alterar el pro-
nóstico de cualquier tratamiento elaborado.
1.2 Clínica Odontológica
Según manifiesta Barrancos (5), la sala operatoria del consultorio odontológico ideal, re-
quiere que este sea multifuncional, flexible, accesible, de calidad y estético; dando al uso
de mobiliario fabricado con materiales higiénicos, seguros y resistentes con el objetivo de
optimizar el trabajo realizado por el odontólogo en su consultorio, lo cual además agrega
otro valor, tomando en cuenta que un consultorio bien planificado tendrá un efecto inme-
diato y positivo en todas las facetas del desempeño del profesional mejorando su producti-
vidad, a la vez que disminuye su estrés.
1.2.1. Equipo Odontológico
Para Martínez (6), el equipamiento del consultorio clínico también denominado como “uni-
dad dental”, es un artilugio de herramienta electro-hidráulica con la capacidad de articular-
se según la necesidad a los diversos procedimientos clínicos odontológicos, donde se en-
cuentran agrupados ordenadamente una serie de dispositivos de uso diverso pudiendo va-
riar de partes según modelos y accesorios disponibles. Y está constituido por las siguientes
partes:
Sillón Dental.- Es un mueble anatómico que brinda confort al paciente permitiendo tam-
bién al Odontólogo una posición ergonómica para que realice los diferentes procedimien-
tos. Dispuesto de reguladores de posición tanto para altura como para el respaldo que se
controlan con un pedal que se acciona con el pie, incluye un cabezal y apoyabrazos recu-
biertos de un revestimiento tipo vinílico fácil de limpiar y desinfectar. (6)
Lámpara de Luz o lámpara de iluminación Oral.- Aumenta la visión del campo opera-
torio, articulada para que el Odontólogo pueda manejarla con facilidad, forma una ventana
lumínica de 20 centímetros de ancho por 10 centímetros de alto y un espectro de luz cerca-
do a la luz del día, compuesta por las siguientes partes: Asa de la Lámpara, Interruptor
3
on/off, Interruptor de intensidad, brazo flexible, alojamiento del interruptor, horquilla de
articulación de la lámpara, pantalla de la lámpara. (6) (7)
Mesa de trabajo o Bandeja de Instrumental.- soldado al sillón mediante brazos articula-
dos, su función es sostener todo el instrumental cerca del lugar de trabajo, incluye un apo-
yo para la colocación de la Jeringa Triple función, mangueras donde se conectaran los ins-
trumentos rotatorios, panel de mandos para el sillón y escupidera. (6)
Jeringa Triple.- Dispositivo que ayuda aclarar la visibilidad del área oral a tratar, está
formado por dos botones, uno de agua y otro de aire comprimido los cuáles al pulsarlos al
mismo tiempo se obtiene un spray a presión, adicionalmente tiene una punta alargada y
angular de 12 cm que es la parte activa que se encuentra en contacto con el paciente. (8)
Sistema de succión (eyector de saliva).- Es un sistema cuya función es succionar los flui-
dos de la cavidad bucal durante el procedimiento clínico. (6)
Escupidera.- Depósito donde el paciente desecha los fluidos y restos del material utilizado
durante un procedimiento clínico. (7)
1.2.2. Contaminación en el Consultorio Odontológico
Se manifiesta principalmente por la contaminación cruzada adquirida de persona a persona,
siendo el consultorio Odontológico un ambiente propicio por las bacterias adquiridas du-
rante el desarrollo de los diferentes procedimientos clínicos odontológicos. Los medios
más frecuentes a través de los cuales se producen las infecciones cruzadas son: (5)
A. El agua (aerosoles) y otras sustancias expelidas por las turbinas, los micromotores y
los aparatos para profilaxis, que pueden diseminar grandes cantidades de microor-
ganismos de la boca del paciente hacia todos los ambientes del consultorio. (5)
B. El contacto directo de la mano del profesional con los equipos, los instrumentos y
los materiales contaminados con saliva o sangre del paciente. (5)
Tortora et al, (9), al caracterizar al biofilm manifiesta que los microorganismos de la natu-
raleza rara vez son encontrados viviendo en colonias aisladas de una sola especie como si
ocurre en los laboratorios, de hecho los microorganismos conviven en comunidades for-
mando verdaderos ecosistemas biológicos denominados Bio-películas. Así mismo Negroni
(3) le describe como un sistema en el cual los microorganismos se comunican, conviven y
4
cooperan mutuamente. Ambos autores (3) (9) coinciden en que el Biofilm se puede formar en
cualquier superficie: sólida, blanda, animada e inanimada; lo cual evidencia que el instru-
mental Odontológico, las piezas de mano y las partes de la unidad dental son vectores de
contaminación para el profesional y el paciente.
1.2.3 Fuente de la contaminación
Según Villena (10) los mecanismos de transmisión de estos microorganismos se resumen en:
1. Contacto directo con lesiones, sangre, fluidos orales y secreciones nasofaríngeas
contaminadas.
2. Contacto indirecto con instrumentos, superficies y equipos dentales contaminados.
3. Salpicaduras de fluidos biológicos directamente a la piel o mucosas como sangre,
saliva o secreciones nasofaríngeas.
Se observa que los componentes rotatorios del sillón odontológico no siempre se lavan ni
esterilizan durante la consulta entre paciente y paciente, en consecuencia se forman cúmu-
los de microorganismos en la superficie y en el interior de las líneas de agua; lo cual es un
factor que potencia el desarrollo de una película bacteriana. (10)
Las superficies del consultorio son clasificadas y manejadas en tres categorías:
Superficies de contacto: Son las tocadas y contaminadas durante los procedimientos den-
tales (agarradera de la lámpara de la unidad dental, interruptores de la unidad dental, cabe-
zal de la unidad). Debiéndose limpiar o desinfectar entre pacientes y ser cubiertos con una
barrera impermeable desechable. (11)
Superficies de transferencia: son aquellas que no son tocadas pero entran en contacto con
los instrumentos contaminados (bandejas para el instrumental, soportes para las piezas de
mano). Debiéndose limpiar o desinfectar entre pacientes y ser cubiertos con una barrera
impermeable desechable. (11)
Superficies de salpicaduras y aerosoles: Todas las superficies dentro del área de trabajo
distintas a las de contacto y transferencia. (11)
1.3 Bioseguridad
Según Espinoza (2), Otero (1), la bioseguridad es el conjunto de normas de carácter preventi-
vo cuyo fin es preservar la salud y seguridad de los profesionales de salud y pacientes fren-
5
te a riesgos propios de la actividad diaria de tipo biológico, físico, químico y mecánico;
contando con una serie de pasos, los cuales disminuyen el riesgo del trabajador de la salud
a adquirir infecciones en el medio laboral.
Espinoza (2) (p 6) define el objetivo de la bioseguridad como:
‘Es un conjunto de acciones cuya finalidad es limitar el riesgo biológico y reducir la
exposición del personal de laboratorios, clínicas, hospitales, personal de apoyo,
administrativos, pacientes y acompañantes, a potenciales agentes infecciosos’
Por otro lado, Otero (1) hace referencia a la frase dicha por la doctora Kaplan, profesora de
Odontopediatría de la Universidad de Nueva York:
‘Si los odontólogos y auxiliares mejoraran el control de infecciones en sus consul-
torios, ellos vivirían más y gozarían de mejor salud…. y la mejor defensa contra las
enfermedades infecciosas consiste en romper la cadena de acontecimientos que
conducen a la infección mediante un reforzamiento de la cadena que conduce a la
asepsia’
1.3.1 Bioseguridad en Odontología
1.3.1.1 Principios de Bioseguridad en Odontología
a. Universalidad: Las medidas que se aplica a todos los pacientes que se les brinda aten-
ción clínica, implica considerar que todo paciente que acude al consultorio es un po-
tencial portador de agentes infecciosos, así como que todo fluido corporal es un poten-
cial contaminante, independientemente de conocer la patología del paciente. (12)
b. Uso de barreras: Consiste en minimizar el riesgo de exposición directa a sangre y
otros fluidos biológicos potencialmente contaminantes, mediante la utilización de ma-
teriales adecuados que se interpongan al contacto de los mismos. El uso de guantes,
mascarillas, lentes protectores; no evitan accidentes por contacto con estos fluidos, pe-
ro disminuyen las consecuencias. (12)
c. Medios de eliminación de material contaminado o manejo de residuos.- Compren-
de el conjunto de dispositivos y procedimientos adecuados a través de los cuales los
materiales utilizados en la atención de pacientes, son depositados y eliminados sin
riesgo. (12)
6
d. Medidas de control.- La inmunización activa de los trabajadores, docentes, estudian-
tes y personal auxiliar involucrados en procesos de la salud, además de un completo
examen médico, apoyado con exámenes de laboratorio periódico y jornadas de vacu-
nación. (12)
1.3.1.2 Precauciones Universales (13)
1. Uso de equipo de protección personal: guantes, batas, mascarillas y lentes de protec-
ción ocular.
2. Lavado de manos inmediatamente después del contacto con secreciones bucales, nasa-
les, lágrimas, orina, sangre y otros fluidos.
3. Prevenir lesiones que causan tijeras, láminas, agujas, bisturís, de tapones de sueros,
ampolletas rotas y otros objetos cortos punzantes. Si se sufre de una cortadura en ma-
nos/antebrazos o lesiones exudativas en ellas, se debe evitar el contacto directo con los
pacientes, sanación definitiva.
4. Disponer de contenedores para todos los objetos corto punzantes que puedan ocasionar
lesiones en la piel.
5. Las áreas contaminadas con fluidos biológicos, deben limpiarse y desinfectarse con
cloro u otro similar.
6. Utilizar técnicas de alto nivel de desinfección, para esterilizar equipamiento en contac-
to con membranas mucosas de los pacientes, por ejemplo: espejos y exploradores buca-
les.
7. El personal de quirófano debe vacunarse contra la Hepatitis A- B y tétanos
1.3.1.3 Normas de bioseguridad para la Facultad de Odontología
Toda la comunidad de la facultad: docentes, administrativos, estudiantes, personal auxiliar
y técnico, deben conocer los riesgos potenciales a los que están expuestos, pero con mayor
razón prevenir y controlar los riesgos biológicos en forma oportuna y apropiada. Es por
ello que la comisión de Bioseguridad ha establecido una normativa orientada a esta pre-
vención y control de riesgos biológicos, que se recoge en el Manual de Bioseguridad de la
7
Facultad (13), este documento expresa los siguientes lineamientos para el trabajo en clíni-
cas:
1) Se debe tener señalizadas las áreas de acuerdo a los niveles de bioseguridad estableci-
dos.
2) Todas las áreas de la Facultad deben contar con un botiquín, extintores (en un lugar
visible) y señalética apropiada.
3) No está permitido fumar en ninguna de las áreas de la facultad, cualquiera que sea el
nivel de bioseguridad.
4) Los trabajos de mantenimiento de los equipos y de las instalaciones, se debe realizar
en horarios diferentes a los de atención clínica.
5) Debe evitarse la prestación de los servicios, cuando se presente una enfermedad infec-
ciosa y contagiosa durante el periodo de transmisión de la misma: varicela, hepatitis,
cuadros gripales comunes.
6) Está estrictamente prohibido el uso de celulares en atención clínica. Se puede mante-
ner en modo silencio (contaminación auditiva y electromagnética).
7) Para el ingreso y atención en todas las clínicas los estudiantes no deben usar aretes,
anillos, relojes u otro tipo de joyas en sus manos, tampoco maquillaje.
8) Si se porta lesiones exudativas, dermatitis o heridas se debe evitar todo tipo de contac-
to directo con el paciente, hasta que la afección haya sanado completamente.
9) Se debe mantener actualizado el esquema de vacunación. (Hepatitis, Antitetánica)
10) El personal de la salud femenino en estado de embarazo puede trabajar en el área de
riesgo, a menos que presenten algunas patologías del embarazo que lo impida; sin em-
bargo se debe ponderar las medidas de bioseguridad para minimizar el riesgo de infec-
ciones.
11) Con los guantes solo puede tomar el instrumental y los materiales que se utilizará en la
boca del paciente, no puede manipular el equipo dental, las historias clínicas o salir de
su área de trabajo con los guantes puestos. Si es necesario se debe sacar al salir del
área y dejar sobre la mesa de trabajo clínico.
8
12) Para todos los procedimientos clínicos se debe utilizar barreras de protección.
13) Al inicio y después de cada procedimiento clínico y al terminar el turno, el personal
obligatoriamente debe lavarse las manos.
14) Los equipos dentales y el instrumental de trabajo se debe desinfectar y esterilizar des-
pués de cada procedimiento.
1.3.1.4 Desinfección
Espinoza (2) (p8) define a la desinfección como:
´El proceso para la prevención y control de infecciones, para destruir los microor-
ganismos patógenos y no patógenos capaces de producir enfermedades infeccio-
sas, que no destruye las esporas bacterianas. Generalmente se usan agentes quími-
cos denominados desinfectantes.´
Algunos autores (3) (14) definen a la desinfección como un procedimiento cuyo objetivo es
inactivar, inhibir o eliminar agentes infecciosos presentes en el ambiente, mediante el uso
de sustancias químicas y físicas o juntas.
Por otro lado, Barrancos (5) menciona la importancia de desinfectar la unidad dental perió-
dicamente tanto al inicio como al final de la jornada de trabajo, utilizando un agente quí-
mico germicida que puede ser solución de yodo durante 5 minutos o glutaraldehído alca-
lino al 2% por 10 minutos.
(a) Limpieza
Según varios autores (3) (15), es un método de desinfección que mediante técnica de arrastre
que contribuye a la remoción y disminución de los materiales extraños (detritus, sangre,
proteínas, etc.), que se adhieren a la superficie de objetos inanimados.
La limpieza puede realizarse en forma (1) húmeda, con agua, elementos mecánicos o jabón
y (2) en seco, mediante el empleo de polvos, paños o aspiradoras.
(b) Uso de desinfectantes
Son agentes antimicrobianos que se emplean solamente sobre objetos inanimados o medios
inertes. Según la Federación Dental Americana son sustancias, capaces de destruir en 10 a
9
15 minutos los microorganismos depositados sobre el material inerte, sin alterar significa-
tivamente el objeto sobre el que actúan. (3)
Consiste en la eliminación de los microbios patógenos sin destruir las formas vegetativas
llamadas esporas, a veces pueden llegar a actuar y servir como esterilizantes según el tiem-
po de aplicación. (5)
Según algunos autores tenemos los siguientes tipos:
a. De bajo nivel biocida: elimina la mayoría de formas vegetativas de microorganismos
patógenos y los virus con cubierta lipídica o de tamaño medio, pero no tiene efecto al-
guno sobre virus o gérmenes resistentes como el virus de la Hepatitis B o las micobac-
terias (Tuberculosis) (5) (16)
b. De mediano nivel biocida: destruye todos los patógenos microbianos excepto las en-
doesporas bacterianas. (5) (16)
c. De alto nivel biocida: destruye todos los patógenos microbianos excepto grandes nú-
meros de esporas bacterianas. (5) (16)
1.3.2 Clasificación de los factores de riesgo.
Tabla 1. Clasificación de los factores de riesgo
FACTOR DE RIESGO TIPO DE RIESGO ENFERMEDADES
Físicos
Ruido
Vibraciones
Temperaturas extremas
Iluminación
Radiación ionizante
Radiación no ionizante
Sordera profesional
Hipotermia
Presbicia profesional
Cáncer
Químicos
Material particulado
Gases y vapores
Humos metálicos
Líquidos químicos
Problemas pulmonares
Problemas oculares y der-
matológicos
Biológicos
Virus
Bacterias
Hongos
Parásitos
Enfermedades víricas, bac-
terianas, micóticas
10
Mecánicos
Mecanismos en movi-
miento
Técnica deficiente de
equipos e instrumental
Caídas
Cortes
Salpicaduras de partículas
a los ojos
Ergonómicos
Posturas inadecuadas
Sobreesfuerzo físico
Diseño del puesto de tra-
bajo
Deformaciones Oseas
Lumbalgias
Túnel Carpiano
Psicosociales
Jornada laboral extensa
Trabajo monótono
Trabajo de presión
Insomnio
Estrés
Malas relaciones persona-
les
Predisposición a los acci-
dentes
Síndrome de Burnout Fuente: Protocolos de Bioseguridad de la Facultad de Odontología
1.3.2 Niveles de Bioseguridad de acuerdo a los factores de riesgos en la Facultad de
Odontología- UCE.
Tabla 2. Niveles de Bioseguridad
NIVELES DE
BIOSEGURIDAD RIESGO
FACTORES
DE RIESGO
ÁREAS DE LA FACULTAD
DE ODONTOLOGÍA UCE
I Bajo
Mecánicos
Ergonómicos
Psicosociales
- Área administrativa de pregrado
y posgrado.
II Medio
Mecánicos
Físicos
Químicos
- Área de laboratorios protésicos
- Área de anatomía
III Alto
Mecánicos
Físicos
Químicos
Biológicos
Ergonómicos
Psicosociales
- Área de laboratorios clínicos
- Clínicas integrales de pregrado y
posgrado
- Clínica de Imagenología
Fuente: Protocolos de Bioseguridad de la Facultad de Odontología
1.4 Microflora presente en la superficie del Equipo Odontológico.
Casillas y Morán (17) indican que el personal de las clínicas odontológicas se encuentran
expuestos a una gran variedad de microorganismos provenientes de fluidos como saliva,
secreciones nasofaríngeas y en ocasiones sangre de los pacientes.
11
Según Otero (1) y Espinoza (2) la enfermedad de mayor preocupación para el odontólogo es
la infección con virus de la hepatitis B. Existe varios informes de profesionales odontólo-
gos y técnicos de laboratorio que han sido infectados por haberse expuesto a materiales
contaminados. Se ha comprobado que algunos casos de infecciones en el personal de salud
estos han ocurrido por contacto accidental con sangre o material contaminado con el virus.
2.1.1 Bacterias.
Son microorganismos con una sola célula de estructura relativamente simple, denominados
procariontes dado que su material genético no está encerrado por una membrana nuclear,
no poseen mitocondrias, aparato de Golgi, ni retículo endoplasmático y se reproducen por
división asexual (9) (16).
Según Murray (16) se encuentran bacterias en todo el ambiente que nos rodea: el aire que se
respira, el agua que se bebe y los alimentos que se comen; aunque muchas son limitada-
mente avirulentas, otras son capaces de provocar enfermedades potencialmente mortales.
Murray (16) (p56) señala que:
´El desarrollo de una infección depende de las complejas interacciones entre 1) la sus-
ceptibilidad del hospedador a la infección, 2) el potencial de virulencia del organismo y
3) las posibles interacciones entre el hospedador y el organismo´
2.1.1.1 Coliformes.
La AOAC Internacional y el Manual de análisis Bacteriológico de la FDA de los Estados
Unidos definen a las bacterias coliformes como colonias de bacilos Gram negativos que
producen ácido y gas durante la fermentación metabólica de la lactosa.
Los coliformes totales incluye una variedad de bacilos aerobios y anaerobios facultativos,
gramnegativos no esporulantes capaces de proliferar en presencia de concentraciones rela-
tivamente altas de sales biliares fermentando la lactosa y produciendo ácido o aldehído en
24 h a 35-37ºC. El grupo coliformes es constante, abundante y casi exclusivo de la materia
fecal, aunque sus características les permiten sobrevivir y multiplicarse fuera del intestino
en el agua potable. Clínicamente los coliformes más importantes son: Escherichia coli,
Enterobacter, Klebsiella y Citrobacter. (18) (19)
12
E.coli
Es un bacilo corto Gram negativo, clasificado dentro la familia Enterobacteriaceae, presen-
te como comensal en el intestino delgado de humanos y animales; algunas cepas de E.coli
patógenas provocan enfermedades diarreicas. (19)
Este microorganismo se asocia a múltiples enfermedades, incluida la gastroenteritis e in-
fecciones extra intestinales tales como: infecciones urinarias, meningitis y sepsis. (16)
2.1.2 Virus
Son partículas infecciosas de menor tamaño, cuyo diámetro oscila entre los 18 hasta los
600nm. El virus mayoritariamente encontrado en el área Orofacial es el Herpes simplex
tipo 1 (VHS-1), un alto número (80-90%) de adultos ha sufrido la infección.
El Herpes Simplex 1 (VHS-1) y 2 (VHS-2), son virus que penetran por piel, mucosa oral o
genital, produciendo lesiones consistentes en vesículas dolorosas, pruriginosas, con erite-
ma, ulceran y al final se convierten en costra. El VHS-1 manifiesta en la boca por gingi-
voestomatitis y vesículas en labios, mejillas, nariz; las lesionas sanan en una o dos sema-
nas. Ocasionalmente el personal médico y odontológico puede padecer de panadizo herpé-
tico por atender a pacientes con herpes buco-faríngeo. El VHS-2 demuestra lesionas seme-
jantes a las bucales pero en genitales siendo posible detectar estas en boca. (20)
Por otro lado, el virus Epstein- Barr, puede transmitirse por medio de secreciones respira-
torias y se manifiesta por un síndrome mononucleósico que caracteriza a la Mononucleosis
infecciosa. (20)
2.1.3. Mohos y levaduras
La estructura celular de los hongos es más compleja que la de las bacterias, son microorga-
nismos eucariotas que poseen un núcleo bien definido. Los hongos pueden existir en una
forma unicelular (levadura) replica de manera asexual, o en una forma filamentosa (moho),
se replica de manera asexual como sexual. (16)
Hongos que se pueden encontrar como patógenos en cavidad oral son: (20)
Cándida Albicans
13
Paracoccidiodes brasiliensis
Histoplasma capsulatum
Cryptococcus neoformans
El primero responsable de micosis intermedia (piel y mucosas), los tres restantes capaces
de micosis profundas o viscerales. (20)
1.5 Infecciones Intrahospitalarias
Según la Organización Mundial de la Salud (OMS) (21), las infecciones intrahospitalarias
son infecciones asociadas a la atención sanitaria y la infección nosocomial es la infección
contraída por el paciente mientras ocurre tratamiento en un hospital y que no se había pre-
sentado signos y síntomas en el momento de ingreso; incluyendo también en esta categoría
las infecciones ocupacionales que contrae personal sanitario debido a su ocupación o expo-
sición.
Para Cole et. al. (22) se define a la infección intrahospitalaria como uno de los efectos adver-
sos ligados a la hospitalización, y que se constituye en una infección por resistencia a gér-
menes debido muchas veces a la mala información del personal sobre técnicas de aisla-
miento y medidas de protección para ambas partes (paciente y profesional de salud), o in-
fección oportunista. Constituyendo un problema de Salud Pública a escala nacional y mun-
dial dado que se asocian a un incremento de mortalidad, morbilidad y costos, tanto hospita-
larios como para los pacientes, sus familias y la sociedad en general.
Pérez et. al. (23) mencionan que los agentes que tienen mayor relevancia epidemiológica
para estas infecciones son las bacterias, otros patógenos como virus y hongos son menos
frecuentes pero de igual importancia a tomarles en atención.
1.5.1 Enfermedades transmisibles en Odontología
Negroni (3) menciona, que se ha determinado que en la práctica Odontológica se pueden
adquirir o diseminar con relativa facilidad los agentes causantes de las siguientes enferme-
dades indicadas en la Tabla 3.
14
Tabla 3. Clasificación de enfermedades transmisibles en Odontología
TIPO MICROORGANISMO PATOLOGÍA
Bacterianas
Tuberculosis
Meningitis
Sífilis
Difteria
Escarlatina
Otras estreptococias
Estafilococias
Tos ferina
Virus
Influenza (gripe)
Infección por rinovirus
Hepatitis B
Hepatitis C
Mononucleosis Infecciosa
Infección por Herpes tipo I y II
Varicela
Parotiditis epidémica
Rubeola
Sarampión
SIDA
Micóticos Candidiasis
Parasitarios Pediculosis
Fuente: Negroni (3), Microbiología estomatológica (2009)
Según lo descrito por González (12) el modo de transmisión, periodo de incubación, secue-
las y complicaciones se detallan en la Tabla 4.
Tabla 4. Clasificación de enfermedades transmisibles en Odontología
ENFERMEDAD AGENTE MODO DE
TRANSMISIÓN
PERIODO DE
INCUBACIÓN
SECUELAS Y
COMPLICACIONES
Hepatitis
Tipo B Virus
Sangre, saliva, material
contaminado 2 a 6 meses
Carcinoma de híga-
do
SIDA Virus
Contacto sexual, con-
tacto con sangre, ma-
dre-niño
Hasta 10 años Muerte
Tuberculosis Bacteria Inhalación, saliva, ins-
trumentos contaminados
Hasta 6 meses
latente
Inhabilitación, muer-
te
Herpes simple
Tipo I Virus
Contacto con saliva
infectada. 3 a 7 días latente Dolor, inhabilitación
Herpes simple
Tipo II Virus
Contacto sexual, saliva
y sangre
Hasta 2 semanas
latente Lesiones dolorosas
Conjuntivitis
herpética Virus
Auto inoculación con
saliva infectada 3 a 7 días latente Ceguera
Gonorrea Bacteria Contacto sexual, saliva
y sangre 1 a 7 días
Artritis, esterilidad
en mujeres
15
Sífilis Bacteria Contacto directo, san-
gre, contacto sexual 2 a 12 días
Daño cerebral y
muerte
Tétano Bacteria Heridas abiertas 7 a 10 días Inhabilitación, muer-
te
Mononucleosis
Infecciosa Virus Saliva, sangre 4 a 7 semanas
Inhabilitación tem-
poral
Paperas Virus Inhalación 14 a 25 días
Inhabilitación tem-
poral, esterilidad en
hombres
Infecciones Es-
treptocósicas Bacteria
Contacto con secrecio-
nes, ulceras orales, pe-
riodontitis
1 a 3 días Osteomielitis, reu-
matismo cardiaco
Infecciones Es-
tafilocócicas Bacteria
Exposición a heridas
cutáneas 4 a 10 días
Osteomielitis, neu-
monía
Resfrió Virus Saliva, sangre 48 a 72 horas Inhabilitación tem-
poral
Fuente: González (12), Código Ecuatoriano de Bioseguridad (2008)
1.6 Estudios preliminares sobre el tema de investigación.
Pasquarella et. al (4), llevaron a cabo un estudio microbiológico ambiental en diez clínicas
dentales en Italia, donde pudieron determinar una variación amplia en la contaminación
ambiental microbiana para los diferentes tiempos de muestreo. Como resultados del estu-
dio demostraron que la práctica dental está asociada con un alto riesgo de infecciones, tan-
to para el personal encargado, como para los pacientes que pueden estar expuestos a una
variedad de microorganismos que colonizan o infectan la cavidad oral y las vías respirato-
rias, o que se transporten en el agua utilizada durante los tratamientos.
Se observó que la acumulación microbiana en las superficies aumentó significativamente
durante las horas de trabajo, en algunos casos se observó un alto grado de contaminación,
con situaciones inaceptables, que podían suponer un riesgo para el personal sanitario y los
pacientes (sobre todo al aumento del número de los que están inmunocomprometidos). Sin
embargo, en algunas clínicas dentales, las condiciones eran satisfactorias, lo que demuestra
que un alto nivel de calidad se puede conseguir en la medida que se apliquen estrategias
preventivas de control del riesgo biológico y las infecciones asociadas.
En la actualidad no existe un estudio a nivel de país o Latinoamérica que permita determi-
nar un umbral de contaminación ambiental de equipos odontológicos que pueda utilizarse
como parámetro de comparación para establecer el nivel de salubridad.
16
CAPÍTULO II
PLANTEAMIENTO DEL PROBLEMA
2.1 Planteamiento del problema
Según Montufar (15), la infección en las clínicas, hospitales, etc., constituye un tema de ex-
traordinaria actualidad por su frecuencia, gravedad y repercusión humana y económica,
viene condicionada por tres determinantes principales: el huésped, el agente patógeno y el
propio ambiente de la clínica.
Pasquarella et al (4) definen que la práctica dental está asociada con un alto riesgo de infec-
ciones, tanto para el personal encargado, como para los pacientes que pueden estar expues-
tos a una variedad de microorganismos que colonizan o infectan la cavidad oral y las vías
respiratorias, o que se transporten en el agua utilizada durante los tratamientos. Las princi-
pales fuentes de infección son las líneas de agua, aerosoles microbianos, y superficies clí-
nicos. Aunque se reconoce que los factores ambientales como en aire el agua y las superfi-
cies clínicas de contacto pueden actuar como reservorios de microorganismos y juegan un
rol muy importante como vehículos de infección, los datos de contaminación microbioló-
gica en ambientes clínicos dentales son todavía escasos.
Los riesgos de contaminación e infección para el personal de salud y pacientes siempre
están presentes durante los procedimientos clínicos odontológicos, ya que varias de las
infecciones podrían ser trasmitidas por la saliva o por la sangre en manera directa o indi-
recta; mediante gotas, aerosoles, instrumentos y equipos contaminados con sustancias de
riesgo.
En este sentido, es interesante conocer si existe variabilidad cuantitativa en la flora micro-
biana antes y después de la atención odontológica. Los resultados serán un indicador indi-
recto de la eficacia de los procesos de desinfección antes y después de la atención odonto-
lógica.
Debido a la problemática indicada surgen las siguientes preguntas de investigación:
¿Existe variabilidad en la presencia de microflora de bacterias aerobias, coliformes, E.
coli, mohos y levaduras, en la superficie de trabajo del equipo odontológico de la clínica
de tercer nivel de la Facultad de Odontología antes y después de la atención odontológi-
ca?
17
¿Cuáles son las superficies de trabajo más contaminadas del equipo odontológico de la
clínica de tercer nivel de la Facultad de Odontología?
2.2 Objetivos
2.2.1 Objetivo General
Determinar la cantidad de microflora (bacterias aerobias, coliformes, E. coli, mohos y le-
vaduras) en las superficies de trabajo del equipo odontológico en la clínica de Tercer nivel
de la Facultad de Odontología de la Universidad Central del Ecuador: mesa de trabajo,
jeringa triple, agarradera de lámpara de luz y manguera de la succión antes y después de la
atención clínica, identificando el área con mayor contaminación.
2.2.2 Objetivos Específicos
1) Cuantificar la contaminación microbiana de Coliformes, Aerobios totales, Mohos y
levaduras en la jeringa triple, mesa de trabajo, agarradera de lámpara de luz y mangue-
ra de la succión antes y después de la atención odontológica.
2) Comparar la cantidad de contaminación bacteriana de Coliformes, Aerobios totales,
Mohos y levaduras antes y después de la atención clínica.
3) Identificar que equipo odontológico está más contaminado.
2.3 Hipótesis
H1: Existe contaminación microbiológica de coliformes, aerobios totales, mohos y levadu-
ras en el equipo odontológico de la clínica de tercer nivel de la Facultad de Odontología
antes y después de la atención odontológica.
H0: No existe contaminación microbiológica de coliformes, aerobios totales, mohos y le-
vaduras en el equipo odontológico de la clínica de tercer nivel de la Facultad de Odontolo-
gía antes y después de la atención odontológica.
H1: La jeringa triple y la manguera de la succión están más contaminadas que otras super-
ficies del equipo odontológico.
H0: La jeringa triple y la manguera de la succión no están más contaminadas que otras
superficies del equipo odontológico.
18
CAPITULO III
3.1 Metodología
3.1.1 Tipo de la Investigación
Estudio de tipo experimental, in vitro, cuantitativo y descriptivo.
Es una investigación experimental porque trata de comprender y resolver una situación, o
un problema en un contexto determinado. Mediante este estudio se tratará de verificar la
contaminación de la superficie del Equipo Odontológico de la Clínica de tercer nivel de la
Facultad de Odontología UCE.
Se utilizó un enfoque cuantitativo, teniendo una perspectiva Descriptiva.
Para la recolección de muestras se empleó la técnica de hisopado de superficies, estás fue-
ron almacenadas para su conservación y transporte en Tubos de ensayo de 10 ml, con tapa
hermética y una solución diluyente de agua de peptona al 0,1% (rica en péptidos y aminoá-
cidos).
3.1.2 Población de estudio y muestra
Para este proyecto de investigación la muestra se tomó de las superficies de trabajo del
Equipo Odontológico de la Clínica Integral de Tercer nivel de la Facultad de Odontología
de la Universidad Central del Ecuador
Universo: La Clínica Integral de tercer nivel está conformada por un número de (35)
Equipos Odontológicos, tomó en cuenta (4) superficies de análisis por cada equipo; las
cuales son: Jeringa Triple, agarradera de lámpara de luz, mesa de trabajo; excepto de la
manguera de la succión que cuentan incorporadas solo en 4 equipos dentales.
Muestra: La muestra se estimó mediante la fórmula estadística de muestra finita:
Con los siguientes parámetros:
N= 35 (población) por cuatro sectores = 35 x 3 = 105 (unidades de estudio)
p= 0,95 Probabilidad a favor que se van a encontrar contaminación en las superficies
19
q= Probabilidad en contra (1-p) 1-0,95= 0,05
e= 0.05 (error de estimación)
Z= 1,96 (nivel de confianza al 95%)
Dando:
𝒏 =𝟏𝟎𝟓 ∗ 𝟑, 𝟖𝟒𝟏𝟔 ∗ 𝟒, 𝟕𝟓%
𝟏𝟎𝟒 ∗ 𝟎. 𝟎𝟎𝟐𝟓 + 𝟑. 𝟖𝟒𝟏𝟔 ∗ 𝟒. 𝟕𝟓%
𝒏 =𝟏𝟗
𝟎. 𝟒𝟒𝟐𝟓
n=43.30
Con lo que se requiere de 43.30 unidades muéstrales, tomando en cuenta el concepto de
aproximación por decimales, se tomó 45 unidades muéstrales.
Tabla 5. Universo y tamaño de la muestra
Superficie de
análisis
Unidades por sector
(cantidad)
Unidades por sector
(porcentual)
Tamaño de la
muestra
Mesa de trabajo 35 33% 15
Jeringa Triple 35 33% 15
Agarradera de
Lámpara 35 33% 15
Total 105 100% 45
Fuente: elaborado por la investigadora
Los equipos que cuentan con succión incorporada suman 4 en total, razón por la cual será
considerado para el estudio todo del universo, es decir se tomó muestras de los cuatro
equipos de succión.
Superficie de
Análisis
Unidades por sector
(cantidad)
Unidades por sector
(porcentual)
Tamaño de la
muestra
Manguera de
succión 4 100% 4
Fuente: elaborado por la investigadora
20
3.2 Criterios de inclusión y exclusión
3.2.1 Criterios de inclusión.
- Sillones Odontológicos en funcionamiento
- Jeringas triples que van a usarse en la atención
- Agarraderas de las lámparas de luz en funcionamiento
- Superficie de la Mesa de trabajo con protección de bioseguridad
- Superficie de la Mesa de trabajo sin protección de bioseguridad
- Mangueras de succión en funcionamiento
3.2.2 Criterios de exclusión.
- Hisopos que accidentalmente cayeron o se pusieron en contacto con otra superficie
o cubículo diferente al que fueron predestinados.
- Muestras transportadas sin cierre hermético.
- Muestras que no se hayan transportado al laboratorio en el máximo de 3 horas.
3.3 Variables
3.3.1 Conceptualización de las variables
Variable dependiente
Contaminación microbiológica: Es la contaminación de microorganismos que puede ser
indicador de la calidad o salubridad de determinada superficie.
Variable independiente
- Superficies de trabajo: Mesa de Trabajo, Jeringa Triple, Agarradera de Lámpara de
luz, Manguera de la succión
- Tiempo: antes de la atención Clínica/ después de la atención Clínica.
21
3.4 Operacionalización de las variables
Tabla 6. Operacionalización de las variables
VARIABLES DEFINICIÓN
CONCEPTUAL TIPO
CLASIFICA-
CIÓN
INDICADOR
CATEGÓRICO
ESCALAS DE
MEDICIÓN
Contamina-
ción Microbio-
lógica
Es la contamina-
ción de microor-
ganismos que
puede ser indi-
cador de la cali-
dad o salubridad
de determinada
superficie.
Dependiente Cuantitativa
discreta
Número de
unidades forma-
doras de colo-
nias
(ufc/ml)
(ufc/m2)
Tiempo
Periodo deter-
minado en el que
se ejecuta una
acción o se desa-
rrolla un proce-
dimiento
Independiente Ordinal
Antes de la
atención Clínica/
después de la
atención Clínica
0-1
Mesa de traba-
jo
Apoyo o susten-
tación sobre el
Odontólogo
coloca material e
instrumental
durante la prác-
tica Clínica
Independiente Cuantitativa
discreta
Nivel de conta-
minación ufc/cm2
Jeringa Triple
Dispositivo o
accesorio cuya
función es pro-
veer agua, aire
comprimido y
una combinación
de las dos ante-
riores.
Independiente Cuantitativa Nivel de conta-
minación
ufc/ml
Agarradera de
lámpara
Apoyo sobre el
cual el profesio-
nal manipula la
dirección de la
luz
Independiente Cuantitativa Nivel de conta-
minación ufc/ml
Manguera de
succión
Aditamento del
equipo odonto-
lógico para suc-
cionar saliva
durante la aten-
ción.
Independiente Cuantitativa Nivel de conta-
minación ufc/ml
Fuente: elaborado por la investigadora
22
3.5 Procedimientos y técnicas
La parte experimental se realizó en el Laboratorio de Microbiología de la Facultad de
Odontología de la UCE, con el apoyo técnico y la supervisión de la tutora del proyecto que
tiene formación en el Área de Microbiología.
3.5.1 Etiquetado de las muestras
Se identificaron los tubos de ensayo que contiene las muestras con etiquetas, según la Ta-
bla 7.
Tabla 7. Codificación de recipientes de muestra
EQUIPO CÓDIGO
EQUIPO CÓDIGO DE MUESTRAS
TOTAL
TUBOS
Manguera de succión MS MS1, MS2, MS3, MS4, 4
Jeringa Triple JT JT1, JT2, JT3, JT4, JT5, JT6, JT7, JT8, JT9, JT10, JT11,
JT12, JT13, JT14, JT15 15
Agarradera de lám-
para AL
AL1, AL2, AL3, AL4, AL5, AL6, AL7, AL8, AL9,
AL10, AL11, AL12, AL13, AL14, AL15 15
Mesa de trabajo MT MT1, MT2, MT3, MT4, MT5, MT6, MT7, MT8, MT9,
MT10, MT11, MT12, MT13, MT14, MT15 15
TOTAL 49
Fuente: elaborado por la investigadora
3.5.2 Preparación de Medios de cultivo
Se procedió con la ayuda de la técnica encargada del Laboratorio de Microbiología de la
Facultad de odontología a preparar el agar sangre, agar saboraud y agua de peptona según
las instrucciones del fabricante, se realizó la esterilización en autoclave y se colocó en ca-
jas bi - Petri, para finalmente almacenar en el refrigerador a 4°C, hasta su utilización para
la siembra de las muestras.
Figura 1. Medios de cultivo Agar Sangre
23
Fuente: fotografiado por la investigadora
3.5.3 Muestreo de superficies
El muestreo de las superficies se realizó mediante la Norma Técnica Ecuatoriana NTE
INEN 1 529 – 2:99, en cuanto al método de hisopado para muestreo de superficies inertes.
La muestra fue tomada en condiciones asépticas, de forma rápida pero cuidadosa, se tomó
el hisopo del algodón estéril, se retiró la tapa rosca del tubo de ensayo de vidrio que con-
tiene 9 mL de solución diluyente esterilizada de agua de peptona al 0,1% y se humedeció
el hisopo en este caldo con movimientos rotatorios y presionando contra las paredes del
tubo para eliminar el exceso de caldo peptona. Se cerró herméticamente el tubo con la tapa
rosca y se procedió a frotar el hisopo 4 veces sobre el equipo odontológico con ligeros
movimientos rotatorios.
Figura 2. Toma de muestra de agarradera de la Lámpara
Fuente: fotografiado por la investigadora
24
Figura 3. Toma de muestra de mesa de trabajo
Fuente: fotografiado por la investigadora
Figura 4. Toma de muestra de Jeringa Triple
Fuente: fotografiado por la investigadora
Realizado el hisopado se regresó el hisopo al tubo de ensayo y se cerró herméticamente,
colocando el tubo de ensayo con la muestra en una gradilla.
25
Figura 5. Colocación en el medio de dilución
Fuente: fotografiado por la investigadora
3.5.3. Conservación y transporte de la muestra
Las muestras obtenidas fueron colocadas en gradillas para tubos de ensayo y llevadas in-
mediatamente al Laboratorio de Microbiología de la Facultad de Odontología para la siem-
bra en los medios de cultivo.
3.5.4 Análisis microbiológico
a. Aerobios totales: las 98 muestras obtenidas (49 antes y 49 después de la atención clíni-
ca), fueron sembradas por duplicado según la norma para recuento en placa.
Se utilizó el método convencional normalizado por organismos internacionales: ISO: In-
ternacional Organization for Standardization, AOAC: Official Methods of Analysis of the
Association of Official Analytical Chemists International para recuento de aerobios mesó-
filos en Agar Sangre, con siembra en estrías. Se incubó a 35º C, en aerobiosis durante 48
horas.
b. Mohos y levaduras: las 98 muestras obtenidas (49 antes y 49 después de la atención
clínica), fueron sembradas por duplicado según la norma para recuento en placa.
Se utilizó el método convencional normalizado por organismos internacionales: ISO: In-
ternacional Organization for Standardization, AOAC: Official Methods of Analysis of the
Association of Official Analytical Chemists International para recuento de mohos y leva-
26
duras en agar Saboraud, con siembra en estrías. Se incubó a temperatura ambiente en aero-
biosis durante 5 días.
Figura 6. Siembra de cultivos en Agar Sangre y Agar Saboraud
Fuente: fotografiado por la investigadora
c. Coliformes totales / E.coli: las 98 muestras obtenidas (49 antes y 49 después de la aten-
ción clínica), fueron sembradas en placas Petrifilm para Coliformes/E.coli.
Se utilizó el método convencional normalizado por organismos internacionales: ISO: In-
ternacional Organization for Standardization, AOAC: Official Methods of Analysis of the
Association of Official Analytical Chemists International para recuento de Coliformes/E.
coli en placas petrifilm. Se incubó a 35º C, en aerobiosis durante 24 horas para coliformes
y 48 horas para E. coli.
27
3.5.5 Recuento microbiológico
Trascurrido los tiempos de incubación respectivos se procedió a extraer de la incubadora
los medios de Cultivos Placas Petrifilm, Cultivos Agar Sangre y Cultivos Agar Saboraud
para cuantificar las colonias siguiendo el siguiente orden cronológico, primero los medios
de cultivo correspondientes al antes de la atención clínica y segundo los de después de la
atención clínica.
En el caso de los aerobios mesófilos aparecieron colonias de color amarillento sobre el
medio de cultivo, se cuenta cada unidad formadora de colonias y se multiplica por el factor
de dilución. En el caso de la mesa de trabajo por ser una superficie regular, se dividió este
resultado para su área de 833 cm2
Figura 7. Conteo de aerobios mesófilos en Agar Sangre
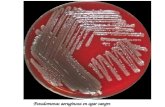
Fuente: fotografiado por la investigadora
Los mohos crecieron como colonias de aspecto aterciopelado de color verde o amarillo, las
levaduras aparecieron colonias cremosas de color amarillento, se cuenta cada unidad for-
madora de colonias y se multiplica por el factor de dilución. En el caso de la mesa de tra-
bajo por ser una superficie regular, se dividió este resultado para su área de 833 cm2
28
Figura 8. Conteo de mohos y levaduras en Agar Saboraud
Fuente: fotografiado por la investigadora
Las coliformes crecen como colonias rojas con halo de gas y las E. coli como colonias azu-
les con halo de gas, se contó las unidades formadoras de colonias y se multiplicó por el
factor de dilución. En el caso de la mesa de trabajo por ser una superficie regular, se divi-
dió este resultado para su área de 833 cm2
Figura 9. Conteo de coliformes y E. coli en placa Petrifilm
Fuente: fotografiado por la investigadora
3.5.6 Recolección de la Información
Los datos obtenidos se los registraron manualmente en una hoja impresa para posterior-
mente almacenarlos en una hoja de Excel para el posterior procesamiento estadístico en el
paquete estadístico SPSS 22.
29
CAPITULO IV
RESULTADOS
4.1 Resultados
Los hallazgos obtenidos en la presente investigación se muestran primero aquellas corres-
pondientes a superficies no regulares: Agarradera de lámpara de luz (AL), Jeringa Triple
(JT) y Manguera de succión (MS); segundo las correspondientes a las de superficies regu-
lares (planas) de la Mesa de Trabajo (MT) debido a que se expresan los resultados por el
área (cm2). Ambas tanto de Aerobios mesófilos, Coliformes, Mohos y Levaduras se expo-
nen en la Tabla 8, 9, 10, 11 y 12.
Tabla 8. Recuento de aerobios mesófilos presentes en la superficie de: Agarradera de
lámpara de luz (AL), Jeringa Triple (JT) y Manguera de succión (MS).
CÓDIGO ANTES DESPUÉS
CÓDIGO ANTES DESPUÉS
ufc/ml ufc/ml ufc/ml ufc/ml
AL1 10000 2000 JT1 1200 4500
AL2 5000 2120 JT2 10000 1400
AL3 10000 1500 JT3 8900 2100
AL4 12500 2400 JT4 12000 5000
AL5 6000 2000 JT5 6000 1100
AL6 9000 1400 JT6 5000 7400
AL7 2100 1000 JT7 2000 1000
AL8 12000 2000 JT8 1000 3000
AL9 12000 4700 JT9 7500 5600
AL10 4800 1600 JT10 6000 1300
AL11 2000 2000 JT11 2000 5000
AL12 2000 1000 JT12 5000 4000
AL13 6000 4000 JT13 2500 5000
AL14 7300 8000 JT14 5000 5000
AL15 4000 6000 JT15 7000 5000
MS1 2400 4000 MS3 2180 2400
MS2 2450 500 MS4 1050 2600
Fuente: elaborado por la investigadora
Tabla 9. Recuento de mohos y levaduras presentes en la superficie de: Agarradera de
lámpara (AL), Jeringa Triple (JT) y Manguera de succión (MS).
CÓDIGO ANTES
ufc/ml
DESPUES
ufc/ml CÓDIGO
ANTES
ufc/ml
DESPUES
ufc/ml
AL1 12500 20 JT1 9600 1000
AL2 1640 20 JT2 2500 820
AL3 18000 1640 JT3 5000 4500
30
AL4 1300 450 JT4 8500 2400
AL5 6800 2000 JT5 8600 2500
AL6 6200 6000 JT6 9000 5600
AL7 200 1500 JT7 6800 10
AL8 5000 3300 JT8 5600 7800
AL9 9800 3000 JT9 2800 5000
AL10 2500 3200 JT10 2600 500
AL11 7860 4800 JT11 1300 8900
AL12 200 6900 JT12 4000 860
AL13 1600 1900 JT13 1320 3720
AL14 4300 840 JT14 5000 5000
AL15 1200 4800 JT15 3000 4800
MS1 1000 1720 MS3 680 2000
MS2 8900 450 MS4 980 1640
Fuente: elaborado por la investigadora
Tabla 10. Recuento de coliformes presentes en la superficie de: Agarradera de lámpara
(AL), Jeringa Triple (JT), Mesa de trabajo (MT) y Manguera de succión (MS).
CÓDIGO ANTES
ufc/ml
DESPUÉS
ufc/ml CÓDIGO
ANTES
ufc/ml
DESPUÉS
ufc/ml
JT1 0 0 AL1 0 0
JT2 0 0 AL2 0 0
JT3 0 0 AL3 0 0
JT4 0 0 AL4 0 0
JT5 0 0 AL5 0 0
JT6 0 0 AL6 0 0
JT7 0 0 AL7 0 0
JT8 0 0 AL8 0 0
JT9 0 0 AL9 0 0
JT10 0 0 AL10 0 0
JT11 0 0 AL11 0 0
JT12 0 0 AL12 0 0
JT13 0 0 AL13 0 0
JT14 0 0 AL14 0 0
JT15 0 0 AL15 0 0
MT1 0 0 MS1 0 0
MT2 0 0 MS2 0 0
MT3 0 0 MS3 0 30
MT4 0 0 MS4 0 0
MT5 0 0
MT6 0 0
MT7 0 0
MT8 0 0
MT9 0 0
31
MT10 0 0
MT11 0 0
MT12 0 0
MT13 0 0
MT14 0 0
MT15 0 0
Fuente: elaborado por la investigadora
Tabla 11: Recuento de E. coli presentes en la superficie de: Agarradera de lámpara de
luz (AL), Jeringa Triple (JT), Mesa de trabajo (MT) y Manguera de succión (MS).
CÓDIGO ANTES
ufc/ml
DESPUÉS
ufc/ml CÓDIGO
ANTES
ufc/ml
DESPUÉS
ufc/ml
JT1 0 0 AL1 0 0
JT2 0 0 AL2 0 0
JT3 0 0 AL3 0 0
JT4 0 0 AL4 0 0
JT5 0 0 AL5 0 0
JT6 0 0 AL6 0 0
JT7 0 0 AL7 0 0
JT8 0 0 AL8 0 0
JT9 0 0 AL9 0 0
JT10 0 0 AL10 0 0
JT11 0 0 AL11 0 0
JT12 0 0 AL12 0 0
JT13 0 0 AL13 0 0
JT14 0 0 AL14 0 0
JT15 0 0 AL15 0 0
MT1 0 0 MS1 0 0
MT2 0 0 MS2 0 0
MT3 0 0 MS3 0 0
MT4 0 0 MS4 0 0
MT5 0 0
MT6 0 0
MT7 0 0
MT8 0 0
MT9 0 0
MT10 0 0
MT11 0 0
MT12 0 0
MT13 0 0
MT14 0 0
MT15 0 0
Fuente: elaborado por la investigadora
32
Tabla 12: Recuento de mohos y levaduras en Mesa de trabajo (MT).
CÓDIGO ANTES
ufc/833cm2
DESPUÉS
ufc/833cm2
ANTES
ufc/cm2
DESPUÉS
ufc/cm2
MT1 9500 9700 45.62 46.58
MT2 4200 60 20.17 0.29
MT3 9200 8000 44.18 38.42
MT4 6500 160 31.21 0.77
MT5 900 4000 4.32 19.21
MT6 12000 5600 57.62 26.89
MT7 7400 500 35.53 2.40
MT8 5600 3800 26.89 18.25
MT9 2400 3200 11.52 15.37
MT10 10000 1500 48.02 7.20
MT11 8000 4500 38.42 21.61
MT12 5000 3500 24.01 16.81
MT13 4200 1000 20.17 4.80
MT14 6900 2100 33.13 10.08
MT15 12000 1000 57.62 4.80
Fuente: elaborado por la investigadora
Tabla 13: Recuento de aerobios en Mesa de trabajo (MT).
CÓDIGO ANTES
ufc/833cm2
DESPUÉS
ufc/833cm2
ANTES
ufc/cm2
DESPUÉS
ufc/cm2
MT1 7000 1500 33.61 6.80
MT2 6500 5000 31.21 22.65
MT3 8000 3500 38.42 15.86
MT4 2000 1500 9.60 6.80
MT5 6000 5000 28.81 22.65
MT6 7500 3750 36.01 16.99
MT7 4500 1100 21.61 4.98
MT8 6000 4000 28.81 18.12
MT9 6000 16000 28.81 72.48
MT10 3100 2800 14.89 12.68
MT11 3000 3150 14.41 14.27
MT12 2000 2000 9.60 9.06
MT13 6250 5000 30.01 22.65
MT14 7000 10000 33.61 45.30
MT15 10000 4300 48.02 19.48
Fuente: elaborado por la investigadora
33
4.2 Análisis de resultados
4.2.1 Prueba de Normalidad:
En primer lugar se verificó que las muestras tomadas provienen de una población con dis-
tribución Normal, esto se realizó con la prueba de Shapiro – Wilk (para menos de 20 da-
tos). En los casos en los cuáles se demostró que las muestras provienen de poblaciones con
distribución normal se realizó pruebas Paramétrica: (media, desviación estándar): T stu-
dent, ANOVA. Del mismo modo en las muestras que NO provienen de poblaciones con
distribución normal entonces se realizó pruebas No Paramétricas (orden, signos): Mann
Whitney, Kruskal Wallis, Wilcoxon.
Considerando que se analizarón 15 equipos por tipo excepto las mangueras de succión que
fueron 4. Si el nivel de significación es superior a 0,05 las muestras provienen de pobla-
ciones con distribución Normal; si es inferior a 0,05 las muestras NO provienen de pobla-
ciones con distribución Normal.
Tabla 14: Pruebas de normalidad
MUESTRAS Shapiro-Wilk
TIPO PRUEBA
Estadístico Gl Sig.
AE
RO
BIO
S
MS ANTES 0,770 4 0,058 Paramétrica
MS DESPUÉS 0,958 4 0,767
JT ANTES 0,948 15 0,493 Paramétrica
JT DESPUÉS 0,897 15 0,084
AL ANTES 0,918 15 0,181 No Paramétrica
AL DESPUÉS 0,779 15 0,002
MT ANTES (833 cm2)
0,937 15 0,345 No Paramétrica
MT DESPUÉS (833 cm2)
0,741 15 0,001
MO
HO
LE
VA
DU
RA
MS ANTES 0,663 4 0,004 No Paramétrica
MS DESPUÉS 0,824 4 0,153
JT ANTES 0,915 15 0,160 Paramétrica
JT DESPUÉS 0,933 15 0,298
AL ANTES 0,873 15 0,038 No Paramétrica
AL DESPUÉS 0,936 15 0,336
MT ANTES (833 cm2)
0,975 15 0,927 Paramétrica
MT DESPUÉS (833 cm2)
0,905 15 0,113
MT
AEROBIOS (1 cm2)
MT ANTES 0,937 15 0,346 No Paramétrica
MT DESPUÉS 0,741 15 0,001
MT MOHO LE-
VADURA (1 cm2)
MT ANTES 0,975 15 0,927
Paramétrica MT DESPUÉS 0,905 15 0,113
Fuente: datos procesados por el programa estadístico
34
4.2.2. Procesamiento estadístico para aerobios totales
Tabla 15: Estadísticas de muestras emparejadas aerobios totales
Media N
Desviación
Estándar
Media de error
estándar Sig. (bilateral)
Par 1 MS ANTES 2020,00 4 657,216 328,608
0,698 MS DESPUÉS 2375,00 4 1438,460 719,230
Par 2 JT ANTES 5406,67 15 3313,062 855,429
0,130 JT DESPUÉS 3760,00 15 1974,408 509,790
Par 3 AL ANTES 6980,00 15 3743,413 966,545
0,003* AL DESPUÉS 2781,33 15 2019,144 521,341
Par 4
MT ANTES (ufc/cm2)
27,1620 15 11,07369 2,85921 0,041*
MT DESPUÉS (ufc/cm2)
20,7180 15 17,35709 4,48158
Fuente: datos procesados por el programa estadístico
Interpretación Manguera de succión ANTES – DESPUÉS: El valor del nivel de significa-
ción (prueba Bilateral) = 0,698), por lo tanto, al ser superior a 0,05 (95% de confiabilidad)
no hay diferencia significativa respecto a la tendencia central de las poblaciones.
Interpretación Jeringa Triple ANTES – DESPUÉS: El valor del nivel de significación
(prueba Bilateral) = 0,130), por lo tanto, al ser superior a 0,05 (95% de confiabilidad), no
hay diferencia significativa respecto a la tendencia central de las poblaciones.
Interpretación Agarradera de lámpara de luz ANTES - DESPUÉS: El nivel de significación
(prueba bilateral) = 0,003) es menor a 0,05 (95% de confiabilidad), razón por la cual existe
diferencia significativa*, siendo mayor la carga microbiana en Agarradera de lámpara de
luz antes de la actividad clínica.
Interpretación Mesa de trabajo ANTES - DESPUÉS (ufc/cm2): El nivel de significación
(prueba bilateral) = 0,041) es menor a 0,05 (95% de confiabilidad, razón por la cual existe
diferencia significativa*, siendo mayor la carga microbiana en Mesa de trabajo antes de la
actividad clínica.
4.2.3 Procesamiento estadístico para mohos y levaduras.
Tabla 16: Estadísticas de muestras emparejadas mohos y levaduras
Media N Desviación
Estándar
Media de error
estándar
Sig.
(bilateral)
Par 1 MS ANTES 2890,00 4 4009,339 2004,670
0,365 MS DESPUÉS 1452,50 4 685,924 342,962
35
Media N Desviación
Estándar
Media de error
estándar
Sig.
(bilateral)
Par 2 JT ANTES 5041,33 15 2866,391 740,099
0,210 JT DESPUÉS 3560,67 15 2712,870 700,460
Par 3 AL ANTES 5273,33 15 5097,818 1316,251
0,112 AL DESPUÉS 2691,33 15 2148,577 554,760
Par 4 MT ANTES 6920,00 15 3288,769 849,156
0,002* MT DESPUÉS 3241,33 15 2853,263 736,709
Fuente: datos procesados por el programa estadístico
Interpretación Manguera de Succión ANTES - DESPUÉS: El nivel de significación (prue-
ba bilateral) = 0,365), por lo tanto, al ser superior a 0,05 (95% de confiabilidad), no hay
diferencia significativa respecto a la tendencia central de las poblaciones.
Interpretación Jeringa Triple ANTES – DESPUÉS: El valor del nivel de significación
(prueba bilateral) = 0,210), por lo tanto, al ser superior a 0,05 (95% de confiabilidad), no
hay diferencia significativa respecto a la tendencia central de las poblaciones.
Interpretación Agarradera de Lámpara de luz ANTES - DESPUÉS: El nivel de significa-
ción (prueba bilateral) = 0,112), por lo tanto, al ser superior a 0,05 (95% de confiabilidad),
no hay diferencia significativa respecto a la tendencia central de las poblaciones.
Interpretación Mesa de trabajo ANTES – DESPUÉS: El valor del nivel de significación
(prueba bilateral) = 0,002) es inferior a 0,05 (95% de confiabilidad), razón por la cual exis-
te diferencia significativa*, siendo mayor la carga microbiana en la mesa de trabajo antes
de la actividad clínica.
4.2.4 Procesamiento estadístico para superficie más contaminada por aerobios
Tabla 17: Estadística para superficie más contaminada (aerobios)
Descriptivos
AEROBIOS N Media Desviación
Estándar
Error
estándar Mínimo Máximo
AN
TE
S
Manguera de la succión 4 2020,00 657,216 328,608 1050 2450
Jeringa triple 15 5406,67 3313,062 855,429 1000 12000
Agarradera de lámpara de luz 15 6980,00 3743,413 966,545 2000 12500
Mesa de trabajo 15 5656,67 2306,115 595,436 2000 10000
Total 49 5688,37 3245,706 463,672 1000 12500
DE
SP
UÉ
S Manguera de la succión 4 2375,00 1438,460 719,230 500 4000
Jeringa triple 15 3760,00 1974,408 509,790 1000 7400
Agarradera de lámpara de luz 15 2781,33 2019,144 521,341 1000 8000
Mesa de trabajo 15 4573,33 3831,676 989,334 1100 16000
Total 49 3596,33 2715,905 387,986 500 16000
Fuente: datos procesados por el programa estadístico
36
Para verificar la existencia de diferencias significativas entre las medias se realizó pruebas
no paramétricas para los valores de antes y después.
Pruebas no paramétricas: ANTES
Figura 10. Prueba de Kruskal Wallis para superficie más contaminada por aerobios (antes) Fuente: datos procesados por el programa estadístico.
Interpretación ANTES: De la Prueba de Kruskal-Wallis, el valor de significación (Sig.
asintótica) = 0,090 es mayor a 0,05 (95% de confiabilidad), no existen diferencias signifi-
cativas respecto a la tendencia central de las poblaciones. La contaminación de aerobios
antes de la atención odontológica es similar en todas las superficies.
37
Pruebas no paramétricas: DESPUÉS
Figura 11. Prueba de Kruskal Wallis para superficie más contaminada por aerobios
(después)
Fuente: datos procesados por el programa estadístico
Interpretación DESPUÉS: De la Prueba de Kruskal-Wallis, el valor de significación (Sig.
asintótica) = 0,255 es mayor a 0,05 (95% de confiabilidad), no existen diferencias signifi-
cativas respecto a la tendencia central de las poblaciones. La contaminación de aerobios
después de la atención odontológica es similar en todas las superficies.
4.2.5 Procesamiento estadístico para superficie más contaminada por mohos y leva-
duras
Tabla 18: Estadística para superficie más contaminada (mohos y levaduras)
Descriptivos
MOHO LEVADURA N Media Desviación
Estándar
Error
estándar Mínimo Máximo
ANTES
Manguera de la succión 4 2890,00 4009,339 2004,67
0 680 8900
Jeringa triple 15 5041,33 2866,391 740,099 1300 9600
Agarradera de lámpara de
luz 15 5273,33 5097,818
1316,25
1 200 18000
Mesa de trabajo 15 6920,00 3288,769 849,156 900 12000
Total 49 5511,84 3926,188 560,884 200 18000
38
DES-
PUÉS
Manguera de la succión 4 1452,50 685,924 342,962 450 2000
Jeringa triple 15 3560,67 2712,870 700,460 10 8900
Agarradera de lámpara de
luz 15 2691,33 2148,577 554,760 20 6900
Mesa de trabajo 15 3241,33 2853,263 736,709 60 9700
Total 49 3024,69 2498,411 356,916 10 9700
Fuente: datos procesados por el programa estadístico
Para verificar la existencia de diferencias significativas entre las medias se realizó pruebas
no paramétricas para los valores de antes y después.
Pruebas no paramétricas: ANTES
Figura 12. Prueba de Kruskal Wallis para superficie más contaminada por mohos y
levaduras (antes)
Fuente: datos procesados por el programa estadístico
Interpretación ANTES: De la Prueba de Kruskal-Wallis, el valor de significación (Sig.
asintótica) = 0,125 es mayor a 0,05 (95% de confiabilidad), no existen diferencias signifi-
cativas con respecto a la tendencia central de las poblaciones. La contaminación de mohos
y levaduras antes de la atención odontológica es similar en todas las superficies.
39
Pruebas no paramétricas: DESPUÉS
Figura 13. Prueba de Kruskal Wallis para superficie más contaminada por mohos y
levaduras (después)
Fuente: datos procesados por el programa estadístico
Interpretación DESPUÉS: De la Prueba de Kruskal-Wallis, el valor de significación (Sig.
asintótica) = 0,539 es mayor a 0,05 (95% de confiabilidad), no existen diferencias signifi-
cativas respecto a la tendencia central de las poblaciones. La contaminación de mohos y
levaduras después de la atención odontológica es similar en todas las superficies.
40
CAPITULO V
DISCUSIÓN
Pasquarella et. al (4) en el estudio microbiológico ambiental en diez clínicas dentales en
Italia, determinaron que la acumulación microbiana en las superficies aumentó significati-
vamente durante las horas de trabajo, sin embargo, en algunas clínicas dentales, las condi-
ciones eran satisfactorias, que según concluye el autor sería el resultado de un alto nivel de
calidad que se puede conseguir en la medida que se apliquen estrategias preventivas de
control del riesgo biológico y las infecciones asociadas.
Los resultados del procesamiento estadístico del presente estudio son consecuentes con los
hallazgos de Pasquarella et. al.; ya que revelan que aunque existe contaminación microbio-
lógica de aerobios mesófilos, mohos y levaduras en todos los equipos analizados; al hacer
la comparación de los datos del antes y después de la atención odontológica, sólo se obser-
va diferencias significativas en la agarradera de lámpara de luz en cuanto a aerobios que es
mayor antes que después; y en mesa de trabajo en cuanto a aerobios, mohos y levaduras
que igualmente es mayor antes que después; mientras que en la manguera de succión y la
jeringa triple no se presenta diferencias significativas respecto a contaminación microbiana
antes y después de la atención. Estos resultados permiten observar que los protocolos de
bioseguridad relativos a la higiene y desinfección de las superficies de trabajo después de
la atención a los pacientes están siendo cumplidos a satisfacción, lo cual permite que no se
potencie la acumulación microbiana.
Según los datos obtenidos, todas las superficies en estudio ya estaban contaminadas antes
del comienzo de la actividad clínica, lo cual es coincidente con el estudio de la calidad de
ambiente en una clínica dental antes y después del procedimiento por parte de Castiglia et.
al. Esta contaminación puede tener su origen en la desinfección inadecuada al final de la
jornada de trabajo en las clínicas de la Facultad de Odontología y que podría estar poten-
ciado por la ausencia de un sistema de extracción de aire apropiada que causa la precipita-
ción de partículas en el aire durante la noche.
A pesar que no se cuenta con valores umbral definidos de contaminación en clínicas denta-
les debido a que aunque se reconoce que las superficies de contacto clínico pueden ser im-
portantes vehículos de infección, los estudios sobre la contaminación microbiana en el en-
torno de la clínica dental no es profunda; y por lo tanto en el presente estudio no se puede
determinar comparativamente el nivel de contaminación de la clínica de tercer nivel de la
41
Facultad de Odontología, los resultados obtenidos si manifiestan que existe el riesgo de
contaminación cruzada por presencia de microorganismos a través de las superficies del
equipamiento, lo cual debe tomarse como un factor a considerar al momento de planificar
las estrategias de bioseguridad de la institución.
Al establecer una comparación de los datos promedio obtenidos para aerobios mesófilos en
la mesa de trabajo antes de la atención: 27,16 ufc/cm2 y después de la atención: 20.71
ufc/cm2 en relación a los datos obtenidos en la investigación de Pasquarella para las enci-
meras y los interruptores de la unidad dental: 2,10 ufc /cm2, se puede decir que en nuestra
mesa de trabajo existe trece veces más contaminación antes de la atención y diez veces
más contaminación después de la atención.
Los resultados permiten aceptar parcialmente la hipótesis de investigación H1 ya que todos
los equipos presentan contaminación de aerobios totales, mohos y levaduras y práctica-
mente ninguno de los equipos presenta crecimiento de coliformes y Escherichia coli.
Por otro lado, al determinar estadísticamente cuál de las superficies evaluadas resultó ser
más contaminada, se obtuvo que no existe diferencias significativas con respecto a la ten-
dencia central de las poblaciones, por lo tanto, la contaminación de aerobios, mohos y le-
vaduras antes y después de la atención odontológica fue similar en todas las superficies. En
consecuencia se acepta la hipótesis alternativa del estudio.
42
CAPITULO VI
CONCLUSIONES
1. Existe presencia de microflora de bacterias aerobias, mohos y leva-duras, en las superfi-
cies de trabajo del equipo odontológico en la clínica de Tercer nivel de la Facultad de
Odontología de la Universidad Central del Ecuador: mesa de trabajo, jeringa triple, aga-
rradera de lámpara de luz y manguera de la succión antes y después de la atención clíni-
ca.
2. La cantidad de contaminación microbiana de aerobios totales, mohos y levaduras en la
agarradera de lámpara de luz y mesa de trabajo antes y después de la atención odontoló-
gica, manifiesta diferencias significativas siendo mayor atención de la atención. La
manguera de succión y la jeringa triple no presentan diferencias significativas respecto a
contaminación microbiana antes y después de la atención.
3. No se identifica que uno de los equipos analizados sea más contaminado, se comprueba
al evidenciar que la contaminación de aerobios, mohos y levaduras antes y después de la
atención odontológica fue similar en todas las superficies.
4. Se acepta parcialmente la hipótesis de investigación H1 ya que todos los equipos presen-
tan contaminación de aerobios totales, mohos y levaduras pero no presentan crecimiento
de coliformes y Escherichia coli.
5. Se acepta la segunda hipótesis alternativa H0 en virtud que la jeringa triple y la mangue-
ra de succión no resultaron estar significativamente más contaminadas que los otros
equipos.
43
RECOMENDACIONES
1. Proponer al INEN estudios multicéntricos para la determinación de estándares microbio-
lógicos de calidad de superficies clínicas dentales.
2. Tomar los resultados de esta investigación como referentes para el establecimiento de
estrategias de prevención de riesgos biológicos en las clínicas de la facultad de Odonto-
logía.
44
BIBLIOGRAFÍA
1. Otero M J, Otero I J. Manual de Bioseguridad en Odontologia. [Online].; 2002 [cited 2016
Octubre 10. Available from: http://www.odontomarketing.com/BIOSEGURIDAD.pdf.
2. Espinoza JM. Manejo adecuado de materiales bioinfecciosos en móviles dentales y ferias
comunitarias. [Online].; 2011 [cited 2016 Octubre 12. Available from:
http://bb9.ulacit.ac.cr/tesinas/publicaciones/040.pdf.
3. Negroni M. Microbiología estomatológica: fundamentos y guía práctica. Segunda ed. Buenos
Aires: Médica Panamericana; 2009.
4. Pasquarella C, Veronesi L, Napoli C, Castiglia P, Liguori G, Rizzetto R, et al. Microbial
environmental contamination in Italian dental clinics: A multicenter study yielding
recommendations for standardized sampling methods and threshold values. Science of the
Total Enviroment. 2012 Enero.
5. Barrancos M, Julio B, J P. Operatoria Dental Integración Clnica Buenos Aires : Panamericana;
2006.
6. Martinez SL. SlideShare. [Online].; 2012 [cited 2017 Marzo 15. Available from:
https://es.slideshare.net/lionsus/conocimiento-de-la-unidad-dental.
7. Odontored. [Online].; 2011 [cited 2017 Marzo 15. Available from:
https://odontored.wordpress.com/2011/08/12/sillon-dental/.
8. Iturralde AV. Repositorio Uce. [Online].; 2015 [cited 2017 Febrero 24. Available from:
http://www.dspace.uce.edu.ec/bitstream/25000/4052/1/T-UCE-0015-143.pdf.
9. Tortora GJ, Funke BR, Case CL. Introducción a la Microbiologia. Novena ed. Buenos Aires:
Medica Panamericana; 2007.
10. Villena GA. Enfermedades transmisibles en Odontología. [Online]. [cited 2016 Octubre 16.
Available from: https://es.scribd.com/doc/140505662/ENFERMEDADES-TRANSMISIBLES-EN-
ODONTOLOGIA.
11. Molina M, Castillo L, Arteaga S, Velasco N, Gonzalez S, Bonomie J, et al. Lo que debemos saber
sobre control de infeccion en el consultotio dental. Revista odontológica de los Andes. 2007
Junio; II(1).
12. González Escudero MA. Codigo Ecuatoriano de bioseguridad y normativo de aplicacion.
Primera ed. Quito: Colegio Odontológico de Pichincha; 2008.
13. Paltas M, Espinoza E. Protocolos de Bioseguridad para las clinicas de Posgrado y Pregrado de
la Facultad de Odontologia-UCE. Quito: Universidad Central; 2013.
45
14. Forbes B. Diagnostico Microbiologico. Duodécima ed. Buenos Aires : Médica Panamericana;
2009.
15. Montufar MF. Análisis del proceso de esterilizacion del instrumental en la Clínica de
Odontopediatría de la Facultad de Odontologia de la Universidad Central. Año 2012. Quito:
Universidad Central del Ecuador; 2012.
16. Murray PR, Rosenthal MA, Ken S. Microbiología médica. Septima ed. Barcelona: Elsevier;
2013.
17. Casillas Alvarez E, Morán Vázquez MA. Bioseguridad en estomatología. Odontologia Actual.
2008 Marzo; V(59).
18. BVSDE. [Online].; 2001 [cited 2017 Febrero 24. Available from:
http://www.bvsde.paho.org/CD-
GDWQ/docs_microbiologicos/Indicadores%20PDF/bacterias%20coliformes.pdf.
19. Camacho A, Giles M, Ortegon A, Serrano B, Velázquez O. Técnicas para el análisis
microbiologico de alimentos. Segunda ed. México: Facultad de Química-UNAM; 2009.
20. Vela C E. Microflora Oral Quito; 2008.
21. Organizacion Mundial de la Salud. [Online].; 2017 [cited 2017 Febrero 24. Available from:
http://www.who.int/gpsc/country_work/burden_hcai/es/.
22. Cole Gutierres R, Martinez J, Cedeño T. Incidencia de Infecciones Intrahospitalarias en el
Hospital San Rafael de Alajuela durante el año 2002. [Online].; 2006 [cited 2016 Octubre 21.
Available from: http://www.scielo.sa.cr/pdf/rccm/v27n3-4/3809.pdf.
23. Perez LH, Zurita IM, Peréz N, Patiño N, Calvimonte O. Scielo Revista Cientifica Ciencia Medica.
2010 Diciembre; XIII(12).
48
Anexo 3. Solicitud para el uso del Laboratorio de Microbiología de la Facultad Odontolo-
gía-UCE.