Unitat 9. Introducció a la química del carboni. Segons el fenomen que causa la isomeria, n’hi ha...
Transcript of Unitat 9. Introducció a la química del carboni. Segons el fenomen que causa la isomeria, n’hi ha...

130
Unitat 9. Introducció a la química del carboni.
HidrocarbUrs i derivats Halogenats
1. Va ser la urea, el 1828. Aquesta primera síntesi a partir d’un compost inorgànic la va realitzar Friedrich Wölher emprant el cianat d’amoni:
NH4NCO calor NH2CONH2
D’aquesta manera s’inicià l’obtenció de compostos que, fins al moment, es creien exclusius dels organismes vius. Aquest pensament, conegut com a vitalisme, afirmava que els compostos que s’obtenien dels éssers vius només podien procedir d’una força vital present en aquests. La síntesi de la urea, un producte abundant en l’orina, va ser l’inici de la química orgànica i la fi del vitalisme.
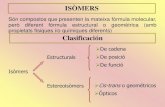
2. Aquest terme s’aplica a compostos diferents que tenen la mateixa fórmula molecular. Segons el fenomen que causa la isomeria, n’hi ha de diferents classes:
a) Quan l’origen es troba en la diferent distribució dels àtoms en les molècules, es parla d’isomeria constitucional, la qual, al mateix temps, pot classificar-se en:
a1) De cadena, quan és causada per una distribució diferent dels àtoms de car-boni i hidrogen. Per exemple, la fórmula molecular del C6H14 presenta uns quants isòmers de cadena, dos dels quals són:
CH3–CH2–CH2–CH2–CH2–CH3 n-hexàCH3–CH2–CH–CH2–CH3 3-metilpentà
CH3
a2) De posició, quan és causada per una distribució diferent de dobles i/o triples enllaços, o del grup funcional. La fórmula molecular C6H12 presenta uns quants isòmers de posició, dos dels quals són:
CH3–CH2–CH2–CH2–CH=CH2 1–hexèCH3–CH2–CH2–CH=CH–CH3 2–hexè
a3) De funció, quan dues o més molècules tenen grups funcionals diferents. La fórmula molecular C2H6O presenta els isòmers de funció següents:
CH3–CH2–CH2–CH2–CH=CH2 1–hexèCH3–CH2–CH2–CH=CH–CH3 2–hexè
b) Quan l’origen es troba en la posició dels àtoms a l’espai, es parla d’estereoisomeria, i cada molècula es diferencia de l’altra per la seva configuració.
L’estereoisomeria geomètrica la causa la diferent distribució dels àtoms a cada costat dels dobles enllaços. És necessari que els dos àtoms de carboni que formen el doble enllaç no tinguin els dos grups idèntics. La fórmula molecular C2Cl2F2 presenta els estereoisòmers geomètrics següents:
F FC=C
Cl Cl
Cl FC=C
F Cl
||
||
||
||
Quimica1_PD_104-154 (CAT).indd 130 26/6/08 11:49:13

131
3. a) CH3—CH2—CH—CH2—CH—CH2—CH—CH2—CH2—CH3
CH3 CH2CH2
CH2CH3
CH3
b) CH3—CH—CH2—CH—CH—CH2—CH2—CH3
CH3 CH3 CH3
c) c) CH3—CH—CH—CH2—CH—CH—CH2—CH2—CH3
CH3 CH3 CH3 CH3
d) d) CH2 CH—CH CH—CH2—CH3
e) c) CH3—CH—CH—CH2—CH—CH—CH2—CH2—CH3
CH3 CH3 CH3 CH3
f) f) CH3
CH2
CH2 CH— C —CH2—CH2—CH2—CH3
CH2
CH3
g) g) CH2 CH—CH2—CH CH—CH3
h) h) CH2 CH—CH—CH—CH CH—CH3
CH3 CH2—CH2—CH3
i) CH2—CH3
i) CH2 C CH—C—CH2—CH CH—CH3
CH2—CH3
Quimica1_PD_104-154 (CAT).indd 131 26/6/08 11:49:14

132
Unitat 9. Introducció a la química del carboni.
j) j) CH2 CH—C CH—C CH—CH CH—CH2—CH3
CH3 CH2
CH3
4. a) a) CH3—C C—CH2—CH3
b) b) CH3—C C—C C—CH3
c) c) CH C—C C—C C—CH2—CH3
d) CH3
CH C—C—C CH
CH3
e) e) CH2 CH—C CHf) f) CH3—CH CH—C C—CH3
g) CH2 CH—CH2—CH2— C C—C CH
CH3 CH2
CH3
h) h) CH2 CH—C C—CH CH—C C—CH2—CH3
i) i) CH2 C—C C—C CH
CH3
j) CH3
j) CH C—CH—C—C C—CH3
CH3 CH3
5. a) c) e) CH2—CH2—CH3
CH3
b) d)
Quimica1_PD_104-154 (CAT).indd 132 26/6/08 11:49:15

133
6. a) e)
CH2—CH3
CH3CH2—CH3
CH3
CH2—CH2—CH3
CH3
CH2—CH3
CH2—CH3
CH3
CH3
CH2—CH2—CH3
CH2—CH2—CH3 CH2—CH2—CH2—CH2—CH3
CH3
b) f)
c) g)
d) h)
7. a) f) g) CH3—CHCl—CH3
CCl3—CH3
CHCl3
CHl Cl—CH2—CH3
CH C—CH—CHBr—CH2—CH3
CH2
CH3
CH2 CH—CHF—CH2—CH3
Cl
Cl
Cl
Cl
Cl
Cl
Cl
Cl
F
Cl
Cl
F
CH3
b)
c)
d)
e) h)
i)j)
8. a) 3-etil-2,5-dimetilheptà e) 3-etil-1,3,5-hexatriè
b) 3-metil-1-pentí f) 3-metil-1-hepten-5-í
c) 5-etil-1,3,5-octatriè g) 4-metil-2-noní
d) 3,4-dimetil-2,4-octadien-7-í
Quimica1_PD_104-154 (CAT).indd 133 26/6/08 11:49:16

134
Unitat 9. Introducció a la química del carboni.
9. a) Toluè o metilbenzè
b) 1-etil-3-metilbenzè o m-etilmetilbenzè
c) 2-etil-1,3-dimetilbenzè
10. a) 2-cloro-3-etilpentà
b) 3-bromo-4-fluoro-1-pentè
c) 6,6,6-trifluoro-4-metil-2-hexí
d) 1-cloro-2-fluorobenzè o o-clorofluorobenzè
e) 1-bromo-3-cloro-5-fluorobenzè
f) 1-bromo-3-metilbenzè o m-bromometilbenzè
g) 1,3-dicloro-5-etilbenzè
h) 4-bromo-3-cloro-2-metilhexà
i) 3-etil-6-iodo-1,4-hexadií
j) 3-bromo-4-iodo-2-metilbutà
k) 2-fluoro-1,1-dimetilciclopentà
l) Nitrobenzè
m) Àcid benzensulfúric
11. CH2 CH—CH2—CH2—CH2—CH2—CH3 1-heptè
CH3—CH CH—CH2—CH2—CH2—CH3 2-heptè
CH3—CH2—CH CH—CH2—CH2—CH3 3-heptè
CH2 CH—CH2—CH2—CH—CH3 5-metil-1-hexè
CH3
CH2 CH—CH2—CH—CH2—CH3 4-metil-1-hexè
CH3
CH2 CH—CH—CH2—CH2—CH3 3-metil-1-hexè
CH3
CH2 C—CH2—CH2—CH2—CH3 2-metil-1-hexè
CH3
CH3—CH CH—CH2—CH—CH3 5-metil-2-hexè
CH3
Quimica1_PD_104-154 (CAT).indd 134 26/6/08 11:49:16

135
CH3—CH CH—CH—CH2—CH3 4-metil-2-he xè
CH3
CH3—CH C—CH2—CH2—CH3 3-metil-2-hexè
CH3
CH3—C CH—CH2—CH2—CH3 2-metil-2-hexè
CH3
CH3—CH2—CH CH—CH—CH3 2-metil-3-hexè
CH3
CH3—CH2—CH C—CH2—CH3 3-metil-3-hexè
CH3
CH2 CH—CH—CH2—CH3 3-etil-1-pentè
CH2
CH3
CH2 C—CH2—CH2—CH3 2-etil-1-pentè
CH2
CH3
CH3—CH C—CH2—CH3 3-etil-2-pentè
CH2
CH3
12. CH3—C C—C C—CH3 2,4-hexadiíCH2 C CH—CH C CH2 1,2,4,5-hexatetraè
13. CCl3—CH2—CH3 1,1,1-tricloropropàCHCl2—CHCl—CH3 1,1,2-tr icloropropàCHCl2—CH2—CH2Cl 1,1,3-tricloropropàCH2Cl—CHCl—CH2Cl 1,2,3-tricloropropàCH2Cl—CCl2—CH3 1,2,2-tr icloropropà
Quimica1_PD_104-154 (CAT).indd 135 26/6/08 11:49:18

136
Unitat 9. Introducció a la química del carboni.
14. CH3 CH3
CH3—CH2—C—CH2—CH2—CH—CH3
CH2 5-etil-2,5-dimetildecà
CH2
CH2—CH2—CH3
15. CH2 CH—CH2—CH3 1-butèCH3—CH CH—CH3 2-butèEl 2-butè presenta dos estereoisòmers:
C C
CH3
H CH3
HE-2-butè o trans-2-butè
CH3
H H
CH3
-2-butè o cis-2-butèC C
16.
1,2,3-trimetilbenzè 1,2,4-trimetilbenzè 1,3,5-trimetilbenzè
CH3
CH3
CH3
CH3
CH3
CH3
CH3CH3
CH3
17. Cl
H H
ClZ-1,2-dicloroetè o cis-1,2-dicloroetè
E-1,2-dicloroetè o trans-1,2-dicloroetè
Cl
H Cl
H
C C C C
18. Els alquens són químicament reactius, i la seva reacció més característica és l’addició als dobles enllaços de l’hidrogen, dels halògens o dels hidràcids. Els alcans, al contrari, són molt poc reactius: per exemple, només reaccionen amb els halògens en presència de llum mitjançant una reacció de substitució.
Amb aquestes dades podem preveure que el 2-hexè reaccionarà fàcilment amb l’hi-drogen, mentre que l’hexà no ho farà pas, de manera que els podrem identificar.
19. CH2Cl—CH2—CH2—CH2—CH3 1-c loropentà
CH3—CHCl—CH2—CH2—CH3 2-cloropentà
CH3—CH2—CHCl—CH2—CH3 3-cloropentà
20. La massa molar dels compostos és:
M (metà, CH4) = 12 + (1 × 4) = 16 g/mol
M (età, C2H6) = (12 × 2) + (1 × 6) = 30 g/mol
Quimica1_PD_104-154 (CAT).indd 136 26/6/08 11:49:18

137
M (propà, C3H8) = (12 × 3) + (1 × 8) = 44 g/mol
M (butà, C4H10) = (12 × 4) + (1 × 10) = 58 g/mol
La densitat es defineix com la massa per unitat de volum. Podem dir que sota les mateixes condicions de temperatura i pressió, la densitat va creixent amb la massa molecular. Així, el propà i el butà seran més densos que l’aire (les seves masses mo-leculars són més grans que la massa molecular mitjana de l’aire). El metà serà menys dens que l’aire. Respecte a l’età, la seva densitat i la de l’aire són iguals.
21. En primer lloc escriurem les reaccions que es donen en el procés.
CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g)
C3H8(g) + 5 O2(g) → 3 CO2(g) + 4 H2O(g)
C4H10(g) + 132 O2(g) → 4 CO2(g) + 5 H2O(g)
Com que tots els gasos estan mesurats en les mateixes condicions de pressió i tempe-ratura, el volum ocupat per un mol de metà és el mateix que l’ocupat per un d’oxigen, de diòxid de carboni o de vapor d’aigua.
Primer calcularem quin volum d’oxigen es consumeix durant les reaccions.
Reacció del metà:
V (O2) = 10,0 cm3 CH4 2 volums O 2
1 volum CH4
= 20,0 cm3 O2
Reacció del propà:
V (O2) = 20,0 cm3 C3H8 5
1 volum C3H8
volums O 2 = 100,0 cm3 O2
Reacció del butà:
V (O2) = 5,0 cm3 C4H10 13/21 volum C4H10
volums O 2 = 32,5 cm3 O2
V (O2)total = 20,0 + 100,0 + 32,5 = 152,5 cm3
Calculem el volum d’oxigen que ha quedat sense reaccionar.
V (O2) = 250 − 152,5 = 97,5 cm3
Seguidament calculem el volum que es forma de cadascun dels gasos.
Reacció del metà:
V (CO2) = 10,0 cm3 CH4 1 volum 2
1 volum CH4 = 10,0 cm3 CO2
V (H2O) = 10,0 cm3 CH4 2 volums H2O1 volum CH4
= 20,0 cm3 H2O
Reacció del propà:
V (CO2) = 20,0 cm3 C3H8 3
1 volum C3H8
volums 2 = 60,0 cm3 CO2
V (H2O) = 20,0 cm3 C3H8 4 1 volum C3H8
volums H2O= 80,0 cm3 H2O
Reacció del butà:
V (CO2) = 5,0 cm3 C4H10 4
1 volum C4H10
volums 2 = 20,0 cm3 CO2
Quimica1_PD_104-154 (CAT).indd 137 26/6/08 11:49:20

138
Unitat 9. Introducció a la química del carboni.
V (H2O) = 5,0 cm3 C4H10 5 volums 2O
1 volum C4H10 = 25,0 cm3 H2O
Sumant tots els volums de gasos que s’han obtingut i el de l’oxigen que no ha reac-cionat:
Vgas = 97,5 cm3 O2 + 10,0 cm3 CO2 + 20,0 cm3 H2O + 60,0 cm3 CO2 +
80,0 cm3 H2O + 20,0 cm3 CO2 + 25,0 cm3 H2O = 312,5 cm3 de gas
compostos orgànics oxigenats i nitrogenats.
22. a) a) CH3 HO
b) CH3—CH2—CH2—CH2OH
c) CH3—CH2—CH2—CH2—CHOH—CH2OH
d) CH3—CH CH—CH2—CHOH—CH3
f) CH3—CH—CH CH—CHF—CH2OH k)
CH3
OH
OH
OH
b)
c)
d)
e)
f)
g) HC 3—CHOH—CH3
3—CH2—CH —CH2OH
3
CH2OH—CHOH—CH2OH
HC 3—CH2—CH CH—CH2—C C—CH2OH
HC
HC
h)
i)
j)
k)
HC 3—CHOH—CH3
3—CH2—CH2—CH2OH
3
CH2OH—CHOH—CH2OH
HC 3—CH2—CH CH—CH2—C C—CH2OH
OH
HC
HC
23. a) a) CH3—CH2—CHO
b) CH3—CH CH—CH2—CH2—CHO
c) CH3—CH2—CH2—CHOH—CH2—CHO
d) CH3—CO—CH2—CH2—CH2—CH3
e) CH3—CCl2—CO—CH2—CH3
f) CH3—CO—CH2—CO—CH2—CO—CH2—CH2—CH2—CH3
g) CH3—CH2—O—CH2—CH3
h) CH3—CH2—CH—CO—CH2—CF2—CHO
CH3
i) CH3—CH2—CH2—CH2—CH—CHOH—CH—CHO
CH2 CH2
CH2 CH3
CH3
b)
c)
d)
e)
f)
g)
Quimica1_PD_104-154 (CAT).indd 138 26/6/08 11:49:20

139
h)
a) CH3—CH2—CHO
b) CH3—CH CH—CH2—CH2—CHO
c) CH3—CH2—CH2—CHOH—CH2—CHO
d) CH3—CO—CH2—CH2—CH2—CH3
e) CH3—CCl2—CO—CH2—CH3
f) CH3—CO—CH2—CO—CH2—CO—CH2—CH2—CH2—CH3
g) CH3—CH2—O—CH2—CH3
h) CH3—CH2—CH—CO—CH2—CF2—CHO
CH3
i) CH3—CH2—CH2—CH2—CH—CHOH—CH—CHO
CH2 CH2
CH2 CH3
CH3
i)
j) j) CH3—CH2—CH2—CH—CHO
CH3
k) CHO—CH2—CH2—CHO
l) CH3—CO—CH3
m) CH3—CO—CH2—CO—CH2—CH3
n) CH3—CH2—CO—CH2—CH=CH2
o) CH3—CH2—CO—CH2—CH2—CHO
p) CH3—CH2—O—CH2—CH2—CH3
k)
l)
m)
n)
o)
p)
24. a) CH3—CH2—CH2—COOH
CH3—CO—CH2—COOH
COOH
b)
c)
d) d) CH3—CH CH—CH2—COOH
f) CH3—CH2—CH2—CH2—CO—CH2—CO—CH2—CH2—COOH
CH3
CH3CH3
COOH e)
f)
g) CH3—CH2—COOH
HOOC—CHOH—CHOH—COOH
HOOC—COOH
CH3—CH —CCl22 —COOH
h)
i)
j)
Quimica1_PD_104-154 (CAT).indd 139 26/6/08 11:49:22

140
Unitat 9. Introducció a la química del carboni.
k)
g) CH3—CH2—COOH
h) HOOC—CHOH—CHOH—COOH
i) HOOC—COOH
j) CH3—CH2—CCl2—COOH
l) CH3—CO—CH2—CHI—COOH
OHCOOH
l)
25. a) CH3—CH2—CH2—COO—CH3
KOOC—CHOH—CHOH—COOK
CH3—CH2—COO—C6H5
C6H5—COO—CH3
b)
c)
d)
e) CH3—CH2—CH CH—CH2—CHCl—COO—CH2—CH2—CH3
CH3—CH —COO—CH22 —CH2—CH2—CH3
CH3—CH2—CH2—CBr2—COOK
CH3—CHOH—CH2—COO—CH2—CH3
HOOC—COONa
CH3—CH2—CO—CH—CH2—COOLi
CH3
f)
g)
h)
i)
j)
26. a) CH3)3N
CH3—CH2—CH2—CH2—NH2
(C6H5)3N
KC N
CH3—CH2—CH2—CH—CH2—COOH
NH2
( b)
c)
d)
e)
f) f) C6H5—CONH2
NH2
g) O C
NH2
h) H—C N
i) CH3—CH—COOH
NH2
j) CH3—C N
k) CH3—CH2—CH2—CH2—C N
g)
h)
i)
j)
k)
Quimica1_PD_104-154 (CAT).indd 140 26/6/08 11:49:22

141
l) l) CH3—CH2—CHOH—CH—CH2—CH2—CO—CH3
NH2
m) CH3—CH2—CH—CONH2
CH3
n) CH3—CH2—CH—CHOH—CH3
NH2
o) C6H5—NH2
p) CH3—NH—CH2—CH2—CH2—CH2—CH3
m)
n)
o)
p)
27. a) 2-metil-2-propanol f) 1,4-butandiol
b) 1,2,4-benzentriol g) àcid 2-hidroxi-3-metil-pentanoic
c) 3,4-diclorofenol h) 2,2-dicloropropanal
d) àcid 4-hidroxibenzoic i) 2-butanol o p-hidroxibenzoic j) àcid 2-metil-3-oxobutanoice) 3,3,3-tricloropropanoat de metil
28. a) àcid 3-metil-pentandioic f) 2,4-pentandiona
b) 3-metil-4-oxopentanal g) 5-hexen-2-ona
c) 5-metil-2-hexenal h) àcid 2-hidroxi-butandioic
d) 4,4,4-trifluoro-3-metilbutanoat d’etil i) àcid propandioic
e) àcid 2-metil-propandioic j) àcid 2-hidroxi-3-clorobenzoic
29. a) 2,2-dimetilpropanoat de metil f) 3-etil-3-butenoat d’etil
b) etanoat d’alumini g) hidrogenoxalat de potassi
c) benzoat de liti h) etilamina
d) dietilamina i) 2-amino-propanoat de metil
e) etildimetilamina j) 1,4-fenildiamina o p-fenildiamina
30. a) 1,3-propildiamina f) benzamida
b) 3,3,3-trifluoroetanamida g) trifenilamina o 3,3,3-trifluoroacetamida h) 3-cianobutanoat de metilc) butannitril
d) 4-cianopentanamida
e) propanamida
Quimica1_PD_104-154 (CAT).indd 141 26/6/08 11:49:24

142
Unitat 9. Introducció a la química del carboni.
31. a) 2-metil-4,6-heptadienal h) trietilamina
b) 1,2-dihidroxi-4-heptanona i) àcid 3-aminobutanoic
c) 3-bromo-1,2-benzendiol j) etandiamina o 2-hidroxi-3-bromofenol k) 2-hidroxi-3-metil-4-pentinoat d’etild) àcid 2-iodo-3-metilpentanoic l) ureae) àcid 3-formilpentandioic m) 2-fluoro-3-metilbutanoat de sodif) àcid 3-bromobenzoic n) hidrogenbutanoat de potassi o m-bromobenzoic
g) 2-cloro-3-hidroxibutanoat de metil
32. CH3—CH2—CH2—CH2OH 1-butanol
CH3—CH2—CHOH—CH3 2-butanol
CH3—CH—CH2OH 2-metil-1-propanol
CH3
CH3—CHOH—CH3 2-metil-2-propanol
CH3
33. CH3—CH2—CH2—CH2—COOH àcid pentanoic
CH3—CH2—CH—COOH àcid 2-metilbutanoic
CH3
CH3—CH—CH2—COOH àcid 3-metilbutanoic
CH3
CH3
CH3—CH2—CH2—CH2—COOH àcid pentanoic
CH3—CH2—CH—COOH àcid 2-metilbutanoic
CH3
CH3—CH—CH2—COOH àcid 3-metilbutanoic
CH3
CH3
CH3—C—COOH àcid 2,2-dimetilpropanoic
CH3
34.
1,2,3-benzentriol o pir ogal·lol 1,2,4-benzentriol 1,3,5-benzentriol
OH
OH
OHOH
OH
OHOHHO
OH
Quimica1_PD_104-154 (CAT).indd 142 26/6/08 11:49:24

143
35. CH3—CH2—CH2OH 1-propanol
CH3—CHOH—CH3 2-propanolCH3—O—CH2—CH3 etil metil èter
36. a) L’equació química és:
C6H12O6 → 2 C2H5OH + 2 CO2
b) Si fermenten 100 g de glucosa amb un 80 % de rendiment la massa d’alcohol obtinguda és:
m (C2H5OH) = 100 g C6H12O6 1 mol C6H12O6
180 g C6H12O6
2 mol C2H5OH1 mol C6H12O6
80100
46 g C2H5OH1 mol C2H5OH
= 40,9 g de C2H5OH
37. a) L’equació que descriu el procés de neutralització de l’àcid acètic és la següent:
2 CH3COOH(aq) + Ca(OH)2(aq) → Ca(CH3COO)2(s) + 2 H2O(l)
I la descomposició de l’acetat de calci és:
Ca(CH3COO)2(s) → CaCO3(s) + CH3COCH3(g)
Observar que per cada 2 mols de CH3COOH s’obté un mol de CH3COCH3 (rendiment 100 %).
b) A partir de les equacions químiques anteriors, es pot calcular la massa d’acetona que s’obtindrà a partir de 10 kg d’àcid acètic:
m (CH3COCH3) =
=
10 kg CH3COOH
95100
1000 g CH3COOH1 kg CH3COOH
1 mol CH3COOH60,05 g CH3COOH
=
1 mol CH3COCH3
2 mol CH3COOH
58,08 g CH3COCH3 1 mol CH3COCH3
1 kg CH3COCH3
1000 g CH3COCH3
=
= 4,6 kg CH3COCH3
Però com que el rendiment de la operació global és del 80 %, la massa d’acetona que s’obté és:
m (CH3COCH3) = 4,6 kg CH3COCH3 80100
= 3,7 kg CH3COCH3
38. a) L’equació química corresponent a l’addició de brom a l’1-butè és:
CH3 −CH2 −CH =CH2 + Br2 →CH3 −CH2 −CHBr −CH2 Br
1-butè brom 1,2-dibromobutà
L’equació química corresponent al tractament del producte de la primera reacció amb hidròxid de plata és:
CH3 CH2 CHBr CH2 Br 2 Ag(OH) CH3 CH2 CHOH CH2OH
1,2-dibromobutà hidròxid de plata 1,2-dihidroxibutà
Quimica1_PD_104-154 (CAT).indd 143 26/6/08 11:49:26

144
Unitat 9. Introducció a la química del carboni.
b) S’han obtingut 10 g de l’alcohol dihidroxilat. S’han de calcular el nombre de mols d’1,2-dibromobutà que caldran per obtenir els 10 g de l’alcohol:
n (1,2-dibromobutà) = 10 g 1,2-dihidroxibutà 1 mol 1,2-dihidroxibutà90 g 1,2-dihidroxibutà
1 mol 1,2-dibromobutà1 mol 1,2-dihidroxibutà
0,11 mols de 1,2-dibrom-butà
Si la reacció tingués un rendiment del 100 % ens caldrien 0,11 mols d’1,2-dibro-mobutà. Com que aquesta reacció té un rendiment del 80 % ens faran falta:
n (1,2-dibromobutà) = 0,11 mol 1,2-dibromobutà 10080
= 0,14 mols
Ara podem calcular el nombre de mols de brom que ens caldran per obtenir 0,14 mols d’1,2-dibromobutà. Sabem, segons la primera reacció, que per obtenir un mol d’1,2-dibromobutà fa falta un mol de brom molecular. Si la reacció tingués un rendi-ment del 100 %, per obtenir 0,14 mols d’1,2-dibromobutà ens fa falta 0,14 mols de brom molecular. Com que la reacció té un rendiment del 70 %, els mols de brom mo-lecular que fan falta serà:
n (Br2) = 0,14 mol Br2 10070
= 0,2 mol Br2
Aplicant l’equació general dels gasos perfectes podrem calcular el volum de brom mo-lecular mesurat a 50 ºC i 105 Pa que fa falta per obtenir 10 g de l’alcohol dihidroxilat:
V (Br2) = 0,2 mol 8,31 J mol-1 K-1 323 K
105Pa= 5,3 × 10−3 m3
Es necessiten 5,3 dm3 de Br2 (gas)
39. Primer escrivim l’equació de neutralització que té lloc.
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(aq)
A partir de les dades de l’enunciat i de l’equació química calculem la massa d’àcid acètic.
m (CH3COOH) = 15,2×10−3 dm3 de solució de NaOH 0,10 mol NaOH1 dm3de solució
1 mol CH3COOH
1 mol NaOH60 g CH3COOH
1 mol CH3COOH= 0,0912 g CH3COOH
Aquest és l’àcid acètic que hi ha en 10 cm3 de vinagre, si tenim 1 litre:
m (CH3COOH) = 0,0912 g CH3COOH 1 dm3
10 10−3 dm3= 9,12 g de CH3COOH
40. a) L’equació química és:
CH3COONH4(s) → CH3CONH2(s) + H2O(l)
b) La massa d’acetamida que s’obté, tenint en compte la puresa de l’acetat d’amoni i el rendiment de la reacció, és:
m (CH3CONH2) = 100 g CH3COONH4 90
1001 mol CH3COONH4
77,08 g CH3COONH4
1 mol CH3CONH2
1 mol CH3COONH4
59 g CH3CONH2
1 mol CH3CONH2
80100
= 55,1 g CH3CONH2
Quimica1_PD_104-154 (CAT).indd 144 26/6/08 11:49:26

145
41. La fórmula molecular dels compostos és:
urea: H2 N −CO− NH2ó CH4N2O; M(CH4N2O) = 60 g/mol
sulfat d’amoni: (NH4)2SO4; M((NH4)2SO4) = 132 g/mol
Un mol d’urea (60g) conté 28 g de nitrogen. Un mol de sulfat d’amoni (132 g) conté també 28 g de nitrogen. Per tant, la urea conté més tant per cent de nitrogen.
42. CH2=CH—CH2—CH2OH 3-buten-1-ol
CH2=CH—CHOH—CH3 3-buten-2-ol
CH3—CH=CH—CH2OH 2-buten-1-ol
CH3—CH2—CH=CHOH 1-buten-1-ol
CH2=C—CH2OH 2-metil-2-propen-1-ol |
CH3
CH3—C=CHOH 2-metil-1-propen-1-ol |
CH3
43. L’alcohol que conté el vi és l’etanol, per tant, l’equació que descriu el procés d’oxidació és:
CH3CH2OH(l) + O2(g) → CH3COOH(l) + H2O(l)
La massa d’àcid acètic que s’obtindrà a partir d’1 dm3 de vi, tenint en compte que el vi conté un 12 % d’alcohol, és:
m (CH3COOH) = 1 dm3 vi ×12 dm3 CH3CH2OH
100 dm3 vi×
790 g CH3CH2OH
1 dm3 CH3CH2OH×
× 1 mol CH3CH2OH46 g CH3CH2OH
×1 mol CH3COOH
1 mol CH3CH2OH×
60 g CH3COOH1 mol CH3COOH
×75
100 =
= 92,7 g de CH3COOH
44. a) S’han obtingut 1,905 g d’aigua. La massa d’hidrogen procedent del compost or-gànic és:
m (H) = 1,905 g H2O ×1 mol H2O18 g H2O
×2 mol H
1 mol H2O×
1 g H1 mol H
= 0,21 g de H
El CO2 obtingut s’ha fet reaccionar amb l’hidròxid de calci segons la reacció:
CO2( g ) +Ca(OH)2(aq) →CaCO3( s) + H2O( l)
S’han obtingut 10,59 g de carbonat de calci. Un mol de diòxid de carboni reacci-ona per donar un mol de carbonat de calci. Suposant que el rendiment d’aquesta reacció ha estat del 100 % podem calcular la massa de CO2 que s’ha obtingut en la combustió:
m (CO2) = 10,59 g CaCO3 ×1 mol CaCO3
100 g CaCO3
×1 mol CO2
1 mol CaCO3
×44 g CO2
1 mol CO2
=
= 4,66 g de CO2
Ara podem calcular la massa de carboni procedent del compost orgànic:
m (C) = 4,66 g CO2 ×1 mol CO2
44 g CO2
×1 mol C
1 mol CO2
×12 g C
1 mol C= 1,27 g de C
Quimica1_PD_104-154 (CAT).indd 145 26/6/08 11:49:28

146
Unitat 9. Introducció a la química del carboni.
En la combustió del compost s’han obtingut 0,21 g d’hidrogen i 1,27 g de carboni. Sumant les masses de carboni i hidrogen:
m = 1,27 + 0,21 = 1,48 g
Aquesta massa és pràcticament igual a la massa inicial del compost orgànic. Així doncs, podrem dir que el compost només està format de carboni i hidrogen.
Ara podem calcular el nombre de mols d’àtoms de cada element:
n (C)=1, 27 g de C 1 mol d'àtoms de C
12,01 g C=0,106 mols d'àtoms de C
n (H)=0, 21 g de H 1 mol d'àtoms de H
1,00 g H=0, 21 mols d'àtoms de H
Dividint pel valor més petit, obtindrem la relació equivalent expressada en nom-bres enters:
0,106 àtoms de C
0,106=1 àtom de C
0,21 àtoms de H
0,106=1,98 ≈ 2 àtoms de H
La fórmula empírica del compost és CH2.
La fórmula molecular és (CH2)n. A 375 K i 9,9 × 104 Pa, 0,620 g del compost ocupen un volum de 0,346 dm3. Podem calcular el nombre de mols que hi ha en aquest volum. Aplicant l’equació general dels gasos perfectes:
n = 9,9 104 Pa 0,346 10-3 m 3
8,314 J K -1 mol-1 375 K = 0,011 mol de compost
La massa molar és:
M (aproximada) =0,620 g
0,011 mol= 56,1 g mol-1
La massa molecular trobada és 56,1. Com que aquesta massa molecular és aproximada-ment quatre vegades més gran que la massa de la fórmula empírica, n és igual a quatre.
n = 56,114
≈ 4
La fórmula molecular és C4H8.
b) Els possibles isòmers són:
1-butè CH2 =CH CH2 CH3
2-butè CH3 CH =CH CH3
2-metil-1-propè CH3 C=CH2 | CH3
ciclobutà metilciclopropà
H2C – CH2
| | H2C – CH2
H2C CH2
CH3
CH2
Quimica1_PD_104-154 (CAT).indd 146 26/6/08 11:49:28

147
45. Sabem que 1,00 g del compost químic ocupen un volum de 440 cm3 a la temperatura de 473 K i 1,01×105 Pa. Per tant podem calcular la massa molar del compost químic fent servir l’equació dels gasos perfectes.
p V = n R T
p V = mM
R T
M (compost) = m R T
p V=
1,00 g × 8,31 J K -1 mol-1 × 473 K1,01×105 Pa × 0,44×10−3 m3 = 88,45 g/mol
La massa de carboni en els 88,45 g de compost és:
m (C) = 88,45 × 54,54
100 = 48,23 g de C
Els mols d’àtoms de carboni són:
n (C) = 48,23 g C
12,01 g/mol ≈ 4 mol de C en el compost químic
Procedint de la mateixa manera amb la massa d’hidrogen i d’oxigen.
m (H) = 88,45 × 9,09 100
= 8,04 g de H
n (H) = 8,04 g H
1,01 g/mol ≈ 8 mol de H en el compost químic
m (O) = 88,45 × 36,36
100 = 32,16 g de O
n (O) = 32,16 g O
15,99 g/mol ≈ 2 mol de O en el compost químic
Per tant, el compost químic obtingut té una fórmula molecular C4H8O2.
La fórmula semidesenvolupada del compost obtingut és:
CH3-CH2-CH2-COOH
Per tant la fórmula semidesenvolupada de l’alcohol és:
CH3-CH2-CH2-CH2OH 1-butanol
46. a) Coneixent la massa molecular aproximada del compost i els percentatges en mas-sa de cada element, podem calcular la massa de cadascun dels elements en 180 g del compost:
180 g × 60
100 = 108 g C
180 g × 35,5100
= 63,9 g O
180 g × 4,5100
= 8,1 g H
Els mols d’àtoms de cada element és:
n (C) = 108 g ×1 mol C12 g C
= 9 mol C
Quimica1_PD_104-154 (CAT).indd 147 26/6/08 11:49:30

148
Unitat 9. Introducció a la química del carboni.
n (O) = 63,9 g ×1 mol O16 g O
= 4 mol O
n (H) = 8,1 g ×1 mol H
1 g H = 8 mol H
Per tant, la fórmula molecular de l’aspirina és : C9H8O4
b) La seva massa molecular és:
Mr (C9H8O4) = 9 × 12.01 + 8 × 1,008 + 4 × 16,00 = 180,15 g/mol
Quimica1_PD_104-154 (CAT).indd 148 26/6/08 11:49:30


















![1 hibridacion isomeria[1][1]](https://static.fdocuments.ec/doc/165x107/5596a15f1a28ab4e718b488f/1-hibridacion-isomeria11.jpg)