1 hibridacion isomeria[1][1]
description
Transcript of 1 hibridacion isomeria[1][1]
![Page 1: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/1.jpg)
HIBRIDACIÓN DEL ÁTOMO DE CARBONO
Tema #1
Universidad Nacional Mayor de San MarcosFacultad de Química e Ingeniería Química
Escuela de Ingeniería de Química
Docente: Mg. Qca. Thais C. Linares Fuentes
![Page 2: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/2.jpg)
QUIMICA ORGANICA
![Page 3: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/3.jpg)
CARACTERÍSTICA COMPUESTOS ORGÁNICOS COMPUESTOS INORGÁNICOS
ComposiciónPrincipalmente formados por carbono,
hidrógeno, oxígeno y nitrógeno.Formados por la mayoría de los elementos de la tabla periódica.
Enlace Predomina el enlace covalente. Predomina el enlace iónico.
SolubilidadSoluble en solventes no polares como
benceno.Soluble en solventes polares
como agua.
Conductividad eléctricaNo la conducen cuando están
disueltos.Conducen la corriente cuando
están disueltos.
Puntos de fusión y ebullición.
Tienen bajos puntos de fusión o ebullición.
Tienen altos puntos de fusión o ebullición.
EstabilidadPoco estables, se descomponen
fácilmente.Son muy estables.
EstructurasForman estructuras complejas de alto
peso molecular.Forman estructuras simples de
bajo peso molecular.
Velocidad de reacción Reacciones lentas Reacciones casi instantáneas
Isomería Fenómeno muy común. Es muy raro este fenómeno
![Page 4: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/4.jpg)
CARACTERÍSTICA
Número atómico 6
Configuración electrónica
Nivel de energía más externo (periodo) 2
Electrones de valencia 4
Masa atómica promedio 12.01 g/mol
Propiedades físicasEs un sólido inodoro, insípido e insoluble en
agua
EL ÁTOMO DE CARBONO
![Page 5: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/5.jpg)
ENLACE COVALENTE EN LOS COMPUESTOS ORGÁNICOS
CARBONO : GRUPO IV
4 e- CAPA EXTERNAC
.. . .
TIPOS DE ENLACE
![Page 6: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/6.jpg)
![Page 7: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/7.jpg)
S P
ORBITALES ATÓMICOS
ORBITALES MOLECULARES
Superposición de orbitales atómicos con 1 e- cada uno
Enlace σ
Cl : Cl
Traslape de orbitales atómicos en una posición
Cl Cl
![Page 8: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/8.jpg)
H HH : Cl
ClH
Enlace π
C C
Se traslapan orbitales p paralelos, cada uno con 1 e-, en dos posiciones.
![Page 9: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/9.jpg)
CONFIGURACIÓN ELECTRÓNICA DEL CARBONO
1s 2s 2p 1s 2s 2p
C Promoción C*
Orbitales atómicos de la capa externa del carbono
Orbitales s y tres p
![Page 10: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/10.jpg)
HC
H
H
H H
H H
H
REPRESENTACIONES:
C..
.
.H
H
H
H..
.
.
![Page 11: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/11.jpg)
HIBRIDACIÓN DEL ÁTOMO DE CARBONO
HIBRIDACIÓNCOMBINACIÓN DE ORBITALES ATOMICOS PARA LA
FORMACIÓN DE OTROS CON NUEVAS FORMAS Y ORIENTACIONES
Hibridación sp3
sp3
sp3sp3
sp3
C+ 4 H
H
H
H
C
H
1s² (2sp³)¹ (2sp³)¹ (2sp³)¹ (2sp³)¹.
![Page 12: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/12.jpg)
Hibridación sp2
p
sp2
sp2
p
sp2
120o
p
sp2
sp2
psp2
p
sp2
p
sp2
sp2
+
H s
s H
H s
s H
1s² (2sp²)¹ (2sp²)¹ (2sp²)¹ 2pz¹
![Page 13: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/13.jpg)
p
sp2sp2
p
sp2
p
sp2
p
sp2
σ sp2
H s
H s
s H
s H
π
π
![Page 14: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/14.jpg)
Hibridación sp
sp spsp sps H H sCC
1s² (2sp)¹ (2sp)¹ 2py¹ 2pz¹
![Page 15: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/15.jpg)
π1
π 2
s
s
σ
σ
σ
s
s
sp
spsp
sp
p
p
sp
sp
p
p
![Page 16: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/16.jpg)
![Page 17: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/17.jpg)
![Page 18: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/18.jpg)
![Page 19: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/19.jpg)
ORBITALES sp3 TETRAEDRICOS PARA EL H2O
2e-
2e-O
HH
![Page 20: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/20.jpg)
TIPOS DE CARBONO
PRIMARIO.-
CH3-CH2-CH3
SECUNDARIO
CH3-CH2-CH3
TERCIARIO CUATERNARIO
![Page 21: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/21.jpg)
Carbono Tipo de hibridación
Geometría molecular
Ángulo de enlace
Tipo de enlace
Tipo de carbono
a) Tetraédrica 109.5° Sencillo Primario
b) Tetraédrica 109.5° Sencillo Cuaternario
c) Triangular plana 120° Doble Secundario
d) Lineal 180° Triple Primario
e)Triangular
plana 120° Doble Secundario
f) Lineal 180° Triple Secundario
![Page 22: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/22.jpg)
Carbono Tipo de enlace
Tipo de carbono
Tipo de hibridación
Geometría molecular
Ángulo de
enlace
a) b) c) d) e) f) g)
![Page 23: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/23.jpg)
Carbono Tipo de hibridación
Ángulo de
enlace
Geometría molecular
Tipo de carbono
Tipo de enlace
a) b) c) d) e) f) g) h)
![Page 24: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/24.jpg)
A hibridación sp3 1 Puente H
B doble enlace 2 radicales
C etanol 3 alqueno
D hibridación sp 4 109.5º
E homolisis 5 enlaces covalentes
F alcanos 6 solo enlaces sigma
G σ y π 7 180º
Relaciona conceptos entre columnas
![Page 25: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/25.jpg)
SITIOS DE REACCIONES ORGÁNICAS
ATOMOS O GRUPOS DONDE EXISTE DISPONIBILIDAD O DEFICIENCIA DE
ELECTRONES
ELECTROFILO NUCLEOFILO
![Page 26: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/26.jpg)
REACCIONES TÍPICAS EN QUIMICA ORGANICA
REACCION DE SUSTITUCION
![Page 27: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/27.jpg)
REACCION DE ELIMINACION
![Page 28: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/28.jpg)
REACCION DE ADICIÓN
![Page 29: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/29.jpg)
Ruptura heterolítica o heterolisis
Ruptura homolítica u homolisis
DA LUGAR A RADICALES LIBRES
DA LUGAR A IONES
FORMACION DE INTERMEDIARIOS
![Page 30: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/30.jpg)
Ejemplos
![Page 31: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/31.jpg)
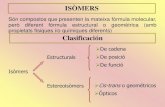
Dos especies químicas diferentes se dice que son isómeras cuando tienen la misma composición elemental y el mismo peso molecular y presentan propiedades físicas y/o químicas diferentes.
Isomería.
¿Qué son isómeros?
![Page 32: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/32.jpg)
![Page 33: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/33.jpg)
Son moléculas muy diferentes tanto en sus propiedades físicas como químicas.
ISÓMEROS CONSTITUCIONALES O ESTRUCTURALES
Isomería de cadena
Isomería de posición
Isomería de función
Son isómeros que difieren entre sí en que sus átomos están unidos de diferente forma.
![Page 34: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/34.jpg)
A) ISOMERÍA DE CADENA
¿Cuántos isómeros tiene el butano?
¿Cuántos isómeros tiene el pentano?
Los isómeros de cadena difieren en la forma en que están unidos los átomos de carbono entre sí
para formar una cadena
![Page 35: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/35.jpg)
B) ISOMERÍA DE POSICIÓN
Hay dos isómeros estructurales con la
fórmula molecular C3H7Br
Del alcohol con fórmula molecular C4H9OH se obtienen:
Los isómeros de posición difieren en las posiciones que ocupan sus grupos en la estructura carbonada
![Page 36: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/36.jpg)
En los derivados del benceno se dan casos muy importantes de isomería de posición
Fórmula molecular C7H8Cl
![Page 37: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/37.jpg)
C) ISOMERÍA DE FUNCIÓN
Fórmula molecular C3H6O
2-propen-1-ol
Los isómeros de función difieren en sus grupos funcionales
- La forma en que están unidos los átomos da lugar a grupos funcionales distintos
Fó rmula molecular C3H6O2
![Page 38: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/38.jpg)
Tienen el mismo grupo funcional sustituido de formas distintas.
D) METÁMEROS.
![Page 39: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/39.jpg)
ESTEREOISÓMEROS.
Son aquellos que se interconvierten rápidamente a temperatura ambiente mediante rotaciones sobre
enlaces sencillos.
ISÓMEROS CONFORMACIONALES O CONFÓRMEROS
Esta clase de isómeros no pueden separarse a
temperatura ambiente
La barrera energética a superar para la
interconversión es baja
H
CH3
H
H3C
H
H
butanoconformación anti
H
CH3
H
H
H3C
H
butanoconformación gauche
CH3
H H
H H
CH3
CH3
H H
H CH3
H
![Page 40: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/40.jpg)
ESTEREOISÓMEROS.ISÓMEROS CONFIGURACIONALES
Para transformar uno en otro, no basta con realizar giros alrededor de enlaces sencillos sino que es necesario
romper y formar enlaces.
Son estereoisómeros aislables por separado a temperatura ambiente o
próxima a ella
Isómeros geométricos
Los que se originan por la distinta orientación espacial de átomos o grupo de átomos alrededor de un enlace doble
![Page 41: 1 hibridacion isomeria[1][1]](https://reader034.fdocuments.ec/reader034/viewer/2022042506/5596a15f1a28ab4e718b488f/html5/thumbnails/41.jpg)
ESTEREOISÓMEROS.
ISÓMEROS CONFIGURACIONALES
Los que se originan por la distinta orientación espacial de átomos o grupos de átomos alrededor de un carbono tetraédrico
COOH
H CH3
OH
ácido láctico
COOH
H3C H
OH
Enantiómeros Diastereoisómeros
Son imágenes especulares No son imágenes especulares