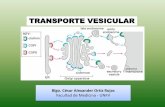
t 14 Trafico Vesicular 05 06
-
Upload
monica-avila-cruz -
Category
Documents
-
view
938 -
download
5
Transcript of t 14 Trafico Vesicular 05 06

1
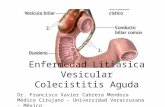
Biología celular – 2005-06
Tráfico vesicular
Lodish (2000) Molecular Cell Biology, f. 17-50, p. 734
El transporte a lo largo de la ruta de secreciónes vesicular, con diferentes tipos de vesículas quese forman en los diferentes compartimentos y queson direccionadas de manera eficiente hacia el compartimento de destino.

2
Lodi
sh20
03, t
able
17-1
Tráfico vesicular
Las etapas en un paso de transporte mediado por vesículas (tráfico vesicular) :
1. ‘Sorting’ o clasificación del material a ser transportado
2. Vesiculación (‘budding’), mediante el reclutamiento de proteínas citosólicas que recubrirán la vesícula formada
3. Desprendimiento de las proteínas de la cubierta
4. Direccionamiento / transporte de la vesícula, a un destino especificado por las proteínas de direccionamiento.
5. Reconocimiento de la membrana diana.
6. Fusión de las membranas y liberación del contenido del orgánulo

3
Componentes de las vesículas
Caveolina transcitosis ?, señalización?
Lodi
sh(2
000)
Mol
ecul
ar C
ellB
iolo
gy, f
ig17
-51
vesi
cula
ción
Farquhar and Palade (1998) The Golgi apparatus : 100 years of progress and controversy. TCB 8 : 2-10 (tcb8-01-02)
Tráfico vesicular en la ruta de secreción
CCV : ‘Clathrin coatedvesicles
COPI
COPII
Caveolin
vesi
cula
ción

4
Figure 17-35
Cubiertas de clatrina, COP I y COPII
Lodish (2000) Molecular Cell Biology, fig. 17-52 Robinson (1997) Coats and vesicle budding. TCB 7: 99-102, bar 230 nm
vesi
cula
ción
Distribución de las diferentes cubiertas en la via de secreción
CCV
COPII
COPI
vesi
cula
ción

5
Vesículas recubiertas de clatrina
Descubierta a partir de aislamiento de vesículas recubiertas (‘coated pits’) en oocitos de Aedes aegypti. Con un diámetro entre 50 y 100 nm
El elemento básico es la clatrina, proteína heterodimérica formada por 3cadenas pesadas (1675 AA, 180 Kda, codificada por HC17) y tres ligeras (35-40 Kda), en una estructura denominada triskelion. Existen dos tipos de cadenas ligeras, alfa y beta, con una similaridad de un 60%.
La polimerización de clatrina es dependiente de concentración (conc crítica)
vesi
cula
ción
Polimerizacion clatrina (web)
Fotin, Cheng, Grigorieff, Harrison, Kirchausen, Walz (2004) ‘Molecular model for a complete clathrin lattice from electron cryomicroscopy. Nature (elec publis Oct 2004)

6
Steer y Hanover (1991) Intracellular transportof proteins, Cambridge Univ Press, p. 61
vesi
cula
ción
¿cómo se encuentra la clatrina en la célula?
En la célula la autopolimerización de la clatrina está limitada pues el pool detriskelions soluble está secuestrado por hsp70 (chaperona citosólica), en un mecanismo análogo al de respuesta a las proteínas mal plegadas del RER.
Uncoating 70 KdaATPase
Steer y Hanover (1991) Intracellular transportof proteins, Cambridge Univ Press, p. 72
vesi
cula
ción

7
La clatrina se une a las membranas mediante unas proteínas : adaptadores
Entre la red de clatrina y la membrana de la vesícula hay un espacio de 20 nm en el que se encuentran las partículas de proteínas adaptadoras, de 350 Kda.
Se han descrito 4 complejos de adaptadores diferentes
Rolbinson y Bonifacino (2001) Adaptorrelated proteins COCB 13:444-453 (cocb13-04-13)
Los adaptadores reconocen lasregiones de membrana que contienen receptores con la señalde transporte . Por ejemplo, lasubunidad micra2 de AP2 se unea : TyrXXhidrof / LL
TGN
Los adaptadores : - reconocen el cargo- reclutan clatrina- reclutan proteínas auxiliares
‘Mickey mouse’ structures
vesi
cula
ción
Rolbinson y Bonifacino (2001) Adaptor related proteins COCB 13:444-453 (cocb13-04-13)
GG
A :
Gol
gi-lo
caliz
edγ
ear c
onta
inin
g, A
RF
bind
ing
prot
ein
vesi
cula
ción

8
Rolbinson y Bonifacino (2001) Adaptor related proteins COCB 13:444-453 (cocb13-04-13)
Miembros de la familia de proteínas Stoned B
vesi
cula
ción

9
Steer y Hanover (1991) Intracellular transportof proteins, Cambridge Univ Press, p. 66
Purified clathrin triskelion reacted with HA-II
vesi
cula
ción
Dinamina
Proteína GTPasa asociada a los ‘coated pits’. Identificada en Drosophila como shibire, incapaz de endocitar via ‘coated pits’. Se aisló a partir de shibirets.
Citosólica, de 900 AA, se une al coated pit y polimeriza. La hidrólisis de GTPregula la contracción de la dinamina. Los mutantes dinamina GTP- forman largos ‘cuellos’ que no se separan de la membrana.
Terminales nerviososincubados con GTP-gammaS. Anti-dinamina.
Lodish (2000) Molecular CellBiology, f. 17-55, p. 737Takel et al (1995) Nature374 : 186
vesi
cula
ción

10
vesi
cula
ción
Modelo de formación de ‘coated pits’
1. Reconocimiento de la membrana (y delos receptores) por los adaptadores2. Unión de triskelions, polimerización
3. Crecimiento de la malla de triskelions4. Unión de dinamina, contracción
5. Separación de la vesícula, recubierta
6. Pérdida de la cubierta proteica
Lodish (2000) Molecular Cell Biology, f. 17.54, p. 737
vesi
cula
ción

11
Vesículas COPI
Aisladas por Rothman et al en ensayos ‘in vitro’ de transporte intraGolgi ( Golgi,ATP, soluciones tampon, etc…).
Recubiertas por unos complejos citosólicos que denominó coatómero (alfa, beta,gamma, delta, épsilon, p20, ARF1) y que polimerizan sobre la vesícula con unasfunciones similares a las de los adaptadores y la clatrina, reconociendo la regióncitosólica de receptores y deformando la membrana para formar la vesícula.
Vesículas COPI, purificadas de Golgi dehepatocitos de rata incubado con citosol y ATP
Lodish (2000) Molecular Cell Biology, f. 17-56, p. 738
Implicadas en el transporte retrógrado dentro del complejo de Golgi y entre éste y el RER.
vesi
cula
ción
Sistema de transporte intra-Golgi libre de células
Lodish (2000) Molecular Cell Biology, f. 17-57, p. 739
vesi
cula
ción

12
Componentes citosólicos de las vesículas COPI
Arf1p 20kDa smGTP-BP, N-term myristoilated
Coatomer 70 kDa complex comprised of seven units (α, β, β’, χ, δ, ε y ξ)RET1, SEC26, SEC27, SEC21, RET2 Y RET3 codifican lassubunidades (α, β, β’, χ, δ y ξ respectivamente, en Saccharomyces cerevisiaeEl subcomplejo α, β’ y ε reconoce la secuencia KKXX in vivo
Wieland y Harter (1999) COCB 11:440-446 (cocb11-4-05.pdf)vesi
cula
ción
ADP-ribosilation factor. Se han descrito tres en levaduras, y seis en células demamífero.
smGTP-BP : ARF-GDP (citosólica)ARF-GTP (unida a membrana)
La unión de ARF a la membrana se produce por el ácido miristílico de N-ter en unaregión de 17 residuos amfipáticos.
- En levaduras ARF1 y ARF2 son identicos en un 96%, son intercambiables, y el doble mutante arf1- arf2- es letal- ARF1-yeast vs ARF1-hum es 77% identico, ARF2-yeast vs ARF5-hum es 69%identico- Se han diferenciado tres clases de ARF en mamíferos :
1- clase I. ARF1, 2 y 3. Ensamblaje de vesículas en Golgi-ER-endosomas,por ej clatrina-AP1 en TGN, clatrina-AP3 en endosomas y COPI en Golgi2- clase II. ARF4 y 5. Se conoce muy poco3- clase III. ARF6, en membrana plasmática / endosomas
Jackson y Casanova (2000) Turning on ARF: the Sec7 family of guanine-nucleotideexchange factors. TCB 10 : 60-67, (tcb10-2-11.pdf)
ARF
vesi
cula
ción

13
Papel de ARF-GTP en el ensamblaje de COPI y en la selección del cargo
Wieland y Harter (1999) COCB 11:440-446 (cocb11-4-05.pdf)
vesi
cula
ción
Modelo de la acción de ARF en el ensamblaje de las cubiertas COPI
Chavrier y Gould (1999) COCB 11 : 466-475(cocb11-4-09.pdf)
ARF precisa de GEF específicas.Todas ellas (sec7 family of GEF) contienen un dominio Sec7 (200 AA).
Jackson y Casanova (2000) TCB 10 : 60-67(tcb10-2-11.pdf)
vesi
cula
ción

14
Modelo de formación de las vesículas COPI
Lodish (2000) Molecular Cell Biology, f. 17-58, p. 740
1. ARF-GTP se activa (une GTP)2. ARF-GTP se une a su receptor enla membrana del Golgi3. Reclutamiento de coatómero4. ‘Budding’5. Separación de la vesícula (requiereFatty-Acil-CoA) (?)
vesi
cula
ción
6. ARF hidroliza GTP, liberandoel coatómero.
La vesícula queda descubierta
Lodish (2000) Molecular Cell Biology, f. 17-58, p. 740
vesi
cula
ción

15
Positive and negative feedback mechanisms control the guaninenucleotide bound by ADP-ribosylation factor (ARF)
Roth (1999) Lipid regulators of membrane traffic through the Golgi complexTCB 9 : 174-179
vesi
cula
ción
Evidencias de la implicación de las vesículas COPI en el transporte retrógrado en el Complejo de Golgi y entre éste y el RER
1. Células de levadura que expresan mutantes ts de componentes de COPI presentan fenotipo sec clase B (retención ER) ¿está COPI implicada en la salida de ER a Golgi?
2. Receptor KDEL, recuperación de proteínas del RER, tiene señal KKXX en dominio citoplasmático, reconocida por COP alfa / beta. Mutantes ts de COP alfa/beta no reciclan las proteínas del RER escapadas… con el tiempo el RER sequeda sin proteínas propias, lo que impide la salida de las de nueva síntesis, produciendo un fenotipo sec clase B
vesi
cula
ción
Lodi
sh, 2
003

16
Vesículas COPII
Aisladas a partir de un extracto del RER incubado con citosol, ATP, GTP, …
Mutantes de COPII son sec de clase B
Sec12 cataliza la activación de Sar1 (homóloga a ARF) intercambiando GDP por GTP. La unión de Sar1-GTP a la membrana recluta el complejo formado por Sec23 / Sec24, seguido de la unión de Sec13 / Sec31. Posteriormente seune Sec16, una proteína fibrosa que interacciona con los dos complejos previos (Sec23/24 y Sec13/31) actuando a modo de ‘scaffold’ de la vesícula.
Las proteínas del RER reclutadas en las vesículas COPII contienen una señal diacídica (Asp-X-Glu).
Experimentos con proteínas quiméricas VSV-G-GFP muestran que las vesículasCOPII migran hasta 1 micra para fusionarse con el Golgi. En otros casos, en los que la distancia ER - Golgi era mayor, se ha observado la fusión de varias vesículasCOPII formando el ‘compartimento intermedio ER-Golgi’. Estas vesículas (CI)son transportadas por MT hasta el Golgi.
vesi
cula
ción
Componentes citosólicos de las vesículas COPII
Sar1p 24 kDa smGTP-BP, similar a ARF-type GTP-BP
Sec23 complex Formado por Sec23p y Sec24p. Sec23p es la proteína activadoraGTPasa de Sar1p. Sec24p es necesaria para la unión delcomplejo Sec13 a la membrana.
Sec13 complex Formado por Sec13p y Sec31p.
vesi
cula
ción

17
Secuencia de reclutamiento de los componentes citosólicos de COPII en una membrana del RER
Kuehn y Scheckman (1997) COPII and secretory cargo capture into transport vesicles COCB 9 :477-483
vesi
cula
ción
GEF
Todas las vesículas formadas (CCV, COPI Y COPII) pierden las cubiertaspoco después de formarse, pero en ellas permanecen un conjunto de proteínasimplicadas en el direccionamiento y reconocimiento de la membrana diana : hipótesis SNARE. Estas proteínas son comunes a todos los tipos de vesículas.
Des
pren
dim
ient
o / d
irecc
iona
mie
nto
/ rec
onoc
imie
nto

18
Elementos de direccionamiento de vesículas y reconocimiento de membranas
1. SNARE-v. Receptor de la membranan de la vesícula, queda descubiertocuando la vesícula pierde la cubierta. Es el receptor vesicular, característicode cada membrana donadora.
2. SNARE-t. Receptor de la membrana diana, reconoce a la SNARE-v comple-mentaria y asegura el reconocimiento de la membrana aceptora.
3. Rab. smGTPase. Proteína smGTP-BP, 200 AA, familia ras (Rab = ‘ras from brain’. Más de 30 conocidas en mamíferos. Implicada en la activación de los mecanismos que aseguran el transporte de la vesícula y el reconocimiento dela membrana diana.
4. SNAP-25. Proteína de fusión, ubícua.
5. NSF. N-etilamide sensitive factor, proteína soluble, ATPasa
6. γ-SNAP, ‘Soluble NSF Attached Protein’
dire
ccio
nam
ient
o / r
econ
ocim
ient
odi
recc
iona
mie
nto
/ rec
onoc
imie
nto

19
Modelo de ciclo funcional de las proteínas Rab
Chavrier y Goud (1999) The role of ARF and GTPases in membrane transport COCB 11 : 466
dire
ccio
nam
ient
o / r
econ
ocim
ient
odi
recc
iona
mie
nto
/ rec
onoc
imie
nto

20
Chavrier y Goud (1999) The role of ARF and GTPases in membrane transport COCB 11 : 466
dire
ccio
nam
ient
o / r
econ
ocim
ient
ofu
sión
La fusión de membranas
El proceso de fusión de membranas es muy común en multitud de procesos celulares. En general se diferencian dos tipos :
1. Fusión endoplásmica, en la que las caras citosólicas de las membranas sefusionan.
2. Fusión ectoplásmica, en la que son las caras de las membranas que se encuentran en contacto con el medio extracelular las que se fusionan (fertilización, formación de sincitios, entrada de virus a las células, etc…)
1. Gran parecido entre las estructuras de las proteínas fusogénicas celularesy las que permiten la entrada de virus (p ej hemaglutinina)
2. Lípidos que inhiben la fusión viral también inhiben la fusión de membranasen general.
Todos los procesos de fusión de membranas son similares

21
Dos hipotéticas estructuras del sitio inicial de fusión de membranas
Stalk : ‘is the minimal lipidic structure that merges the contacting leaflets ofthe fusing bilayers. It has a specificgeometry that differentially packslipids’
Connexon like structure : ‘this proteinaceousfusion pore is initially closed, then opens tofirst form a pore than then radially expands tomix lipids between protein subunits’
fusi
ón
Zimmerberg (2001) How can proteolipids be central playersin membrane fusion? TCB 11 : 233 (tcb11-06-11.pdf)
fusi
ón
Modelo de rotación de la subunidad VO. Las subunidades de una membrana intercambian con las de la otra membrana y como consecuencia las membranasse fusionan.
Zimmerberg (2001) How can proteolipids be central players in membrane fusion? TCB 11 : 233(tcb11-06-11.pdf)
Un modelo de fusión mediante proteínas : subunidad VO de la ATPasa vacuolar

22
fusi
ón
Zimmerberg (2001) How can proteolipids be central playersin membrane fusion? TCB 11 : 233 (tcb11-06-11.pdf)
Pero al final… el intermediario es siempre un lípido, pues las dos láminas de las membranas se tienen que mezclar…
Proteína GMembranaNucleocápsideGenoma
Ciclo vital de un virus recubierto (VSV) en una célula eucariotaDe Alberts, Molecular Biology of the Cell, 3rd. edit.
fusi
ón

23
Lodish (2000) Molecular Cell Biologyf. 6-13 y f. 17-27, p.
Tinción negativa de virus influenza
En el Golgi furina cortaformando dos subunidadesHA1 y HA2 (péptido defusión, N-ter)
Hemaglutinina de Influenza-v
fusi
ónfu
sión
Cambios conformacionales inducidos por un cambio de pH de 7.0 a 5.5 en la hemaglutinina de influenza-v
Lodish (2000) Molecular Cell Biology, f. 17-60, p. 744

24
Lodish (2000) Molecular Cell Biology, f. 17-61, p. 745
fusi
ón
Para la fusión de membranas inducida por HA-influenza es necesariala participación de entre 9 y 12 moléculas.
fusi
ón
HIV entry
Entrada del virus HIV a CD4+
Inhibidores unión
Inhibidores co-receptor
Inhibidores de fusion

25
fusi
ón
…¿y como se explica la fusión vesícula - membrana?
Mayer (1999) Intracellular membrane fusion, SNARES only? COCB 11 : 447-452(tcb11-4-06.pdf)
fusi
ón
Mayer (1999) Intracellular membrane fusion, SNARES only? COCB 11 : 447-452 (tcb11-4-06.pdf)
Dos modelos alternativos para las fases finales de la fusión de vesículas
A) SNARE driven fusion / B) SNARE function as an intermediate stage
CalmodulinProtein phosp1

26
Modelos de acción de NSF - SNAP en la interacción SNARE
Hay y Scheller (1997) SNARE and NSF in targeted membrane fusion COCB 9 : 505-512
dire
ccio
nam
ient
o / r
econ
ocim
ient
odi
recc
iona
mie
nto
/ rec
onoc
imie
nto

27
dire
ccio
nam
ient
o / r
econ
ocim
ient
ore
cicl
aje …¿y el reciclaje de todos los componentes a las mebranas de destino?
… esta será otra historia