Remisión espontánea de una aplasia de médula ósea asociada a una trisomía del cromosoma 8, con...
Transcript of Remisión espontánea de una aplasia de médula ósea asociada a una trisomía del cromosoma 8, con...
Cartas al Editor / Med Clin (Barc). 2013;141(1):40–4542
7. Ministerio de Sanidad y Consumo. Protocolo comun para la actuacion sanitariaante la violencia de genero. Madrid: Ministerio de Sanidad y Consumo, Centro dePublicaciones; 2007.
Ana Castello, Francesc Frances y Fernando Verdu*
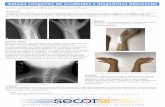
Figura 1. A) Estudio citogenetico inicial (47,XY,+8[8]/46,XY[12]). B y C) Estudio citogene
cromosoma 8. D) Estudio citogenetico que expone la reaparicion de la trisomıa del cro
Unidad Docente de Medicina Legal, Facultad de Medicina,
Universitat de Valencia EG, Valencia, Espana
* Autor para correspondencia.Correo electronico: [email protected] (F. Verdu).
http://dx.doi.org/10.1016/j.medcli.2012.11.008
Remision espontanea de una aplasia de medula osea asociada auna trisomıa del cromosoma 8, con posterior evolucion aleucemia monoblastica aguda y reaparicion de la alteracionclonal
Spontaneous remission of bone marrow aplasia associated withchromosome 8 trisomy, with subsequent evolution to acute
monoblastic leukemia and recurrence of the clonal abnormality
Sr. Editor:
La leucemia mieloide aguda (LMA) es una enfermedad demarcada heterogeneidad clınica, biologica y pronostica, queocasionalmente puede asociarse a anomalıas citogeneticas comola trisomıa del cromosoma 8 (Cr8+), cuya importancia pronosticaaun continua siendo tema de debate en la LMA1–6. Por esta razonpresentamos el caso de una leucemia monoblastica aguda con Cr8+y un comportamiento atıpico desde el punto de vista clınico-biologico. Se trata de un varon de 29 anos de edad, sin antecedentespatologicos, que presentaba un cuadro de pancitopenia y fiebre de10 dıas de evolucion, refractario al tratamiento antibiotico y sinfocalidad clınica infecciosa. En la exploracion fısica no presentabaadenopatıas perifericas ni visceromegalias.
En la analıtica destacaba: leucocitos 0,6 � 109/L, neutrofilos0,1 � 109/L, monocitos 0,04 � 109/L, linfocitos 0,42 � 109/L, Hb 107g/L y plaquetas 22 � 109/L. En la extension de sangre periferica nose observaban elementos blasticos ni rasgos displasicos, y elinmunofenotipo (IMF) era normal. En la bioquımica solo destacaba
una LDH de 9.090 U/l y en la hemostasia los dımeros D eran de18.957 mg/l, sin alteracion de los tiempos de coagulacion. Loscultivos de sangre, orina y medula osea para patogenosoportunistas eran esteriles, y las serologıas y el estudio deautoinmunidad, normales. La TAC toracoabdominal y el ecocar-diograma no evidenciaban alteraciones. En el aspirado medular nose obtuvo grumo y en la biopsia osea la celularidad hematopoyeticaestaba disminuida a expensas de la serie mieloide madura, con unaserie eritroide ligeramente reducida y una serie megacariocıticaconservada. La reticulina era normal. Ademas, presentaba celulasinmaduras cuyo inmunofenotipo no era concluyente. El estudiomolecular (BCR/ABL y PML-RAR a) era negativo y la citogeneticamedular mostraba una Cr8+ (47,XY,+8[8]/46,XY[12]) (fig. 1).Considerados los datos descritos, el paciente fue diagnosticadode aplasia medular de causa idiopatica con Cr8+. Ante lapersistencia del cuadro febril se realizo una amplia coberturaantibiotica empırica y los cultivos seriados fueron persistente-mente esteriles. Sin recibir ningun otro tratamiento, y transcurridomes y medio, presento resolucion de la clınica y estrictanormalizacion de los datos analıticos (Hb144 g/L, leucocitos 6,8� 109/L, neutrofilos 4,48 � 109/L, monocitos 0,53 � 109/9L yplaquetas 206 � 10/L). El estudio medular resulto normal desdeel punto de vista morfologico, citoquımico e inmunofenotıpico.La citogenetica medular tambien se normalizo (46,XY[20])(fig. 1). Se realizo estudio mediante tecnica FISH del cromosoma8 (sonda centromerica), que descarto la anomalıa clonal. Lanormalizacion de los datos analıticos se mantuvo durante 6semanas de seguimiento. Posteriormente, presento un nuevo
tico y FISH (sonda centromerica) que demuestran la desaparicion de la trisomıa del
mosoma 8: 48,XY,4,8[12]/46,XY,add(1p36)[8].
Cartas al Editor / Med Clin (Barc). 2013;141(1):40–45 43
proceso febril y hepatoesplenomegalia. En la analıtica seobservaba: leucocitos 56,6 � 109/L (53% blastos, monocitos del38,7%), Hb 157 g/L y plaquetas 19 � 109/L. El IMF de losblastos era de habito monoblastico (CD45, CD13, CD33, CD14,CD64, CD36, CD56 y MPO IC positivos). En el aspirado medularse apreciaba una infiltracion absoluta por elementosblasticos con el mismo IMF que en sangre periferica; y en el estudiocitogenetico reaparecio la Cr8+ asociada con un cariotipo complejo:48,XY,+4,+8[12]/46,XY,add (1p36)8. Se diagnostico leucemiamonoblastica aguda (M5a) y el paciente fallecio en 48 h por sepsiscon fallo multiorganico (fig. 1).
Consideramos el diagnostico inicial de aplasia medular por nocumplir los criterios diagnosticos de LAM segun la OMS4. Noobstante, no es una presentacion tıpica de la aplasia medular por lapresencia de elementos celulares inmaduros en la medula (dedifıcil cuantificacion por la hipocelularidad) y la Cr8+, lo queinicialmente justifica el diagnostico diferencial con un procesoleucemico agudo. La evolucion posterior con resolucion esponta-nea e ıntegra del hemograma, la normalizacion de la celularidadhematopoyetica medular y la desaparicion de la Cr8+ (confirmadapor FISH) con citogenetica normal podrıa considerarse como unproceso transitorio y no clonal. Sin embargo, la aparicion 6semanas despues en forma de leucemia monoblastica aguda(subtipo M5a), mas la reaparicion de la Cr8+ (formando parte deun cariotipo complejo), sugiere un proceso evolutivo conpresentacion atıpica de la LMA. En nuestro paciente la deteccionde la Cr8+ como unica alteracion citogenetica identificable en elinicio de la aplasia medular podrıa conllevar una mayorprobabilidad de evolucion a LMA o, al menos, condicionar sudesarrollo7,8. Posteriormente, la presencia de la Cr8+ como partede un cariotipo complejo hace pensar que otras alteracionescitogeneticas de alto riesgo condicionan su pronostico9,10.Creemos que debe realizarse un estrecho seguimiento de lospacientes con aplasia medular asociada a Cr8+ ante la posibleevolucion a LMA.
Agradecimientos
Finalmente, queremos agradecer a los doctores ElizabetTalavera, Maria Jose Panades, Monserrat Teixido, Armando Luanay Josep Macia Virgili su colaboracion en este caso.
Vease contenido relacionado en DOI: http://dx.doi.org/10.1016/j.medcli.2012.03.008
Bibliografıa
1. Grimwade D, Walker H, Oliver F, Wheatley K, Harrison C, Harrison G, et al. Theimportance of diagnostic cytogenetics on outcome in AML: Analysis of 1,612patients entered into the MRC AML 10 trial. Blood. 1998;92:2322–33.
2. Schoch C, Haase D, Fonatsch C, Haferlach T, Loffler H, Schlegelberger B, et al. Thesignificance of trisomy 8 in de novo acute myeloid leukaemia: The accompanyingchromosome aberrations determine the prognosis. Br J Haematol. 1997;99:605–11.
3. Byrd JC, Mrozek K, Dodge RK, Carroll AJ, Edwards CG, Diane C, et al. Pretreatmentcytogenetic abnormalities are predictive of induction success, cumulativeincidence of relapse, and overall survival in adult patients with de novo acutemyeloid leukemia: results from Cancer and Leukemia Group B (CALGB 8461).Blood. 2002;100:4325–36.
4. Vardiman JW, Thiele J, Arber DA, Brunning RD, Borowitz MJ, Porwit A, et al. The2008 revision of the World Health Organization (WHO) classification of myeloidneoplasms and acute leukemia: Rationale and important changes. Blood.2009;114:937–51.
5. O’Donnell MR, Appelbaum FR, Coutre SE, Damon LE, Erba HP, Foran J, et al. Acutemyeloid leukemia: NCCN clinical practice guidelines in oncology, v.2.2010.National Comprehensive Cancer Network On-Line [consultado 18 Abr 2010].Disponible en: http://wwwnccnorg
6. Grimwade D, Hills RK. Independent prognostic factors for AML outcome.Hematology Am Soc Hematol Educ Program. 2009;385–95.
7. Wolman SR, Gundacker H, Appelbaum FR, Slovak ML, Southwest OncologyGroup. Impact of trisomy 8 (+8) on clinical presentation, treatment response,and survival in acute myeloid leukemia: A Southwest Oncology Group Study.Blood. 2002;100:29–35.
8. Haferlach T, Schoch C, Schnittger S, Kern W, Loffler H, Hiddemann W, et al.Distinct genetic patterns can be identified in acute monoblastic and acutemonocytic leukaemia (FAB AML M5a and M5b): A study of 124 patients. Br JHaematol. 2002;118:426.
9. Elliott MA, Letendre L, Hanson CA, Tefferi A, Dewald GW. The prognosticsignificance of trisomy 8 in patients with acute myeloid leukemia. LeukLymphoma. 2002;43:583–6.
10. Estey E. High cytogenetic or molecular genetic risk acute myeloid leukemia.Hematology Am Soc Hematol Educ Program. 2010;2010:474–80.
Rosa Isabel Upeguia,*, Vıctor Marco Betesa,Francesc Soleb y Ricard Lopezc
aServicio de Hematologıa, Hospital Universitario Arnau de Vilanova,
Lleida, EspanabServicio de Citogenetica, Hospital del Mar, Barcelona, EspanacServicio de Citogenetica, Hospital Universitario Arnau de Vilanova,
Lleida, Espana
* Autor para correspondencia.Correo electronico: [email protected] (R.I. Upegui).
http://dx.doi.org/10.1016/j.medcli.2012.10.019
Prediccion de fracturas por fragilidad o prediccionde osteoporosis densitometrica.
!
Esta es la cuestion!
Prediction of frailty fractures or prediction of densitometricosteoporosis. That is the question!
Sr. Editor:
Hemos leıdo con interes el artıculo de Gomez-Vaquero et al.1 yquisieramos realizar algunas aportaciones que consideramos deinteres. Una, que puede parecer una cuestion de semantica, puedeconvertirse en conceptual. Los autores emplean en el artıculo eltermino «riesgo de fractura mayor», que entendemos provienedel termino ingles «major osteoporotic fracture»2. La traduccion alcastellano de «major» tambien incluye la definicion «principal» yotras como «importante», «frecuente», etc. Pensamos que latraduccion «fractura principal» se ajusta mejor al termino «major
fracture» que «fractura mayor». Esta definicion podrıa entendersemal por los clınicos no especializados, porque puede dar a entenderque una fractura de muneca es mayor, mientras que una fractura,por ejemplo, de tibia, es menor.
El artıculo1 esta centrado en evaluar una propuesta utilizandolos factores de riesgo clınicos (FRC) incluidos en la herramientaFRAX12 para seleccionar mejor a las mujeres posmenopausicasque se remiten para realizar una densitometrıa osea por absorciondual de rayos X (DXA). Estamos totalmente de acuerdo con losautores en utilizar la herramienta FRAX1 para este fin, y nuestrogrupo ya demostro, en la cohorte FRIDEX, que utilizar laherramienta FRAX1 podrıa reducir de forma significativa lasDXA a realizar en nuestro paıs3, aunque tomando precaucionesrespecto a las propuestas de la National Osteoporosis Guideline
Group (NOGG)4,5. Otro punto de acuerdo con los autores es que, apesar de que la capacidad predictiva de FRAX1 para poblacionespanola no esta bien ajustada todavıa, ya que globalmenteinfraestima el riesgo de fractura principal6, su utilizacion puedeser de gran ayuda en la toma de decisiones, especialmente en