organizacion atomica
-
Upload
hector-rojas -
Category
Documents
-
view
219 -
download
0
description
Transcript of organizacion atomica
ORGANIZACIN ATMICA6ORGANIZACIN ATOMICA22
TECNOLOGIA DE LOS MATERIALES
HENRY ELIAS ROJAS GARCIA
U.P.T.P JUAN DE JESUS MONTILLAINGENIERIA MECANICAGUANARE2015ndice
introduccin3Organizacin atmica4Celdas unitarias5Puntos, direcciones y planos en las celdas unitarias12 Sitios intersticiales15Estructura atmica18 Estructura del tomo19 Enlaces atmicos20 Energa de enlace23 Esparcimiento interatmico23Conclusin 24Bibliografa25
Introduccin:El presente trabajo fue hecho con el fin de lograr un mejor entendimiento acerca de lo que conocemos como la organizacin atmica y la estructura atmica.Es un resumen de lo que se refiere a este tema, ya que es bastante extenso, algunos de los puntos que se presentan son las celdas unitarias, puntos y planos en las celdas unitarias, estructura del tomo, enlaces atmicos y esparcimiento interatmico.
ORGANIZACIN ATMICA
Celdas Unitarias
La estructura atmica influye en la forma en que los tomos se unen entre s; esto adems nos ayuda a comprender la clasificacin de los materiales como metales, semiconductores, cermicos y polmeros y nos permite llegar a ciertas conclusiones generales referentes a propiedades mecnicas y comportamiento fsico de estas cuatro clases de materiales. La estructura electrnica del tomo, que queda descrita por cuatro nmeros cunticos ayuda a determinar la naturaleza de los enlaces atmicos y las propiedades fsicas y mecnicas de los materiales. a) Enlace metlico: encontrado en los metales, los electrones de valencia se mueven con facilidad, en consecuencia, los metales son dctiles y tienen alta conductividad elctrica y trmica.
b) El enlace covalente se encuentra en muchos materiales cermicos, semiconductores y polmeros. Requiere que los tomos compartan electrones de valencia, los enlaces son fuertes y altamente direccionales, haciendo que estos materiales sean frgiles y tengan baja conductividad elctrica y trmica.
c) El enlace inico encontrado en muchos cermicos se produce cuando un tomo muy electropositivo dona un electrn a otro muy electronegativo generando un anin y un catin que se unen electrostticamente. Al igual que los materiales enlazados covalentemente, estos tienden a ser frgiles y malos conductores.
d) Fuerzas de Van der Waals unen principalmente a molculas que tienen una distribucin desigual de cargas o estn polarizadas. Son de naturaleza electrosttica y se encuentran en polmeros termoplsticos. La energa de unin est relacionada con la fuerza de los enlaces y es alta en materiales unidos en forma inica o covalente. Los materiales con energa de unin alta normalmente tienen: Alta temperatura de fusin Alto mdulo de elasticidad Bajo coeficiente de expansin trmica. Estructura Cristalina El arreglo de los tomos juega un papel importante en la microestructura, comportamiento y propiedades de un material slido.
En los metales, algunas disposiciones atmicas permiten una excepcional ductilidad, mientras que otras una gran resistencia. Algunas propiedades fsicas de las cermicas dependen del arreglo atmico.
Los transductores usados para producir una seal elctrica en un estreo deben a su estructura cristalina la capacidad de producir cadas de carga permanente en el material. Los diferentes comportamientos exhibidos por los polmeros como: gomas, plsticos y resinas epxicas dependen de las diferencias en los arreglos atmicos. En este captulo se describirn los arreglos atmicos tpicos que se encuentran en los materiales slidos perfectos, as como tambin la nomenclatura para designar dichos arreglos. Una vez conocidos estos aspectos, se estar preparado para entender como las imperfecciones que existen en los slidos juegan un papel importante en la comprensin de la deformacin y cambios que sufren muchos materiales. Si en un material slido se desprecian las imperfecciones (suponindolo perfecto), pueden encontrarse tres formas de arreglo atmico: Sin ordenamiento: como por ejemplo en los gases nobles en donde los tomos se ubican al azar llenando completamente el espacio donde se encuentran confinados. Ordenamiento corto: es caracterstico de los materiales que presentan arreglos atmicos que se extienden desde un tomo en cuestin hasta su vecino ms cercano. Por ejemplo en el vapor de agua el tomo de oxgeno est enlazado covalentemente a dos tomos de hidrgeno y fuera del sistema que compone una molcula de agua no existe un arreglo especfico.
Este tipo de arreglo es caracterstico de polmeros y vidrios. En el polietileno es una cadena carbonada donde cada tomo de carbono est unido a dos de hidrgeno. Un caso similar es el vidrio en el cual cuatro tomos de oxgeno se unen a uno de silicio. Estos materiales son considerados amorfos porque muestran buena resistencia y tenacidad adems de comportamiento quebradizo. Adems se caracterizan por poseer un arreglo atmico regular y predecible slo en una corta distancia (uno o dos espacios atmicos). Ordenamiento largo: est presente en metales, cermicas, semiconductores y algunos polmeros. En estos materiales, el arreglo se extiende a travs de todo el material.
Los tomos forman un patrn regular y repetitivo llamado retculo. Un retculo est conformado por un conjunto de puntos o tomos llamados puntos reticulares los cuales se localizan ordenados siguiendo un patrn peridico, de manera que cada retculo est rodeado por otros retculos idnticos. Los retculos varan de un material a otro tanto en tamao como en forma dependiendo del tamao de los tomos y de los enlaces entre ellos. La estructura cristalina de un material se refiere al tamao, forma y ordenamiento de los tomos en el retculo.
Los puntos reticulares se sitan en las esquinas de la celda y en algunos casos en los centros de las caras o en el centro de la misma celda. Una celda unitaria queda denotada completamente por los parmetros reticulares. Los parmetros reticulares definen el tamao y la forma de una celda unitaria. Estos incluyen las dimensiones de los lados de la celda y el ngulo entre ellos. Por ejemplo, para la celda unitaria cbica simple. El parmetro reticular es la longitud de uno de sus lados (ao). El ngulo y las dems aristas estn sobreentendidos. Esta longitud se expresa en angstroms o nanmetros. Celdas unitarias ms complejas requieren un mayor nmero de parmetros reticulares para ser descritas. Por ejemplo, una celda unitaria ortorrmbica debe especificarse con tres parmetros reticulares que son las dimensiones de los tres lados. Principales estructuras cristalinas metlicas: La mayora de los metales elementales alrededor del 90%, cristalizan en tres estructuras cristalinas densamente empaquetadas: Cbica centrada en el cuerpo BCC Cbica centrada en las caras FCC Hexagonal compacta HCP La razn de que se presenten este tipo de estructuras es que los ordenamientos compactos poseen menos energa.
A continuacin se analizarn las tres estructuras cristalinas.
Estructura cbica centrada en el cuerpo BCC En esta celda el tomo central se encuentra rodeado de 8 vecinos ms cercanos y se dice que tiene un nmero de coordinacin de 8. Si se asla la celda unidad de esferas rgidas obtendremos una celda con un equivalente de 2 tomos por celda. 1 tomo en el centro + 1/8 de esfera por cada vrtice Si consideramos los tomos como esferas rgidas el factor de empaquetamiento atmico o la fraccin de volumen ocupada por los tomos en la celda unidad est definido por: Factor de empaquetamiento =
Para la celda BCC:
= =8,373
= ==12,32
Factor de empaquetamiento= =0,68
Estructura cbica centrada en las caras FCC En esta celda hay un punto reticular en cada vrtice del cubo y uno en el centro de cada cara del cubo. Figura FCC Una celda FCC tiene 4 tomos por celda unidad: en cada vrtice + en cada cara
La relacin entre el radio y el parmetro de red a
El factor de empaquetamiento es 0,74 y representa el mximo posible para tomos esfricos.
Estructura hexagonal compacta HCP Esta celda posee un factor de empaquetamiento de 0,74 igual que FCC. En esta estructura cada tomo est rodeado de 12 tomos, por lo que el nmero de coordinacin es 12.
La celda unidad HCP tiene dos tomos asociados a cada punto reticular: uno en cada vrtice y otro centrado dentro de cada celda. De esta manera se tienen
tomos centrados en la celda + tomos en los vrtices agudos + en los vrtices obtusos = 2 tomos por celda
La estructura HCP est integrada por 3 celdas para dar un total de 6 at. La relacin c/a ideales aquella que resulte de esferas tan prximas como sea posible y vale 1,633.
Puntos, direcciones y planos en una celda unitaria: Coordenadas de puntos: se emplean para localizar las posiciones de los tomos en la red o dentro de la celda unitaria. La distancia se mide en parmetros de red usando un sistema cartesiano. Direcciones en la celda: Algunas direcciones son de particular importancia. Los metales se deforman a lo largo de aquellas direcciones a travs de las cuales los tomos estn en contacto ms estrecho. Estas direcciones se abrevian usando los ndices de Miller. El procedimiento es el que sigue: 1. Usando el sistema de coordenadas ubique dos puntos que estn contenidos en esa direccin. 2. Preste a las coordenadas del punto final las del inicial. 3. Reduzca las fracciones o resultados obtenidos a mnimos enteros, encierre los tres nmeros entre corchetes y de haber algn negativo colquelo como una barra sobre el nmero. Los ndices de Miller para las direcciones tienen las siguientes caractersticas: 1. Una direccin y su negativo no son iguales, representan una misma lnea con direcciones opuestas. 2. Una direccin y sus mltiplos son idnticas slo falto reducirlas a sus mnimos enteros. 3. Ciertos grupos de direcciones son equivalentes. Sus ndices particulares dependen de cmo se construyen las coordenadas. Estas pueden representarse como familias de direccin encerrados entre parntesis angulares. La densidad lineal es el nmero de puntos de red por unidad de longitud a lo largo de una direccin. Tambin podra calcularse el factor de empaquetamiento lineal en una direccin particular, es decir, la fraccin verdaderamente cubierta por tomos.
Fraccin de empaquetamiento lineal = densidad lineal * Longitud ocupada por los tomos en la direccin Planos en la celda unitaria: algunos planos de tomos son significativos. Los metales se deforman a lo largo de los planos de empaquetamiento ms compacto. La determinacin de los ndices de Miller se hace de la siguiente manera: 1. Identifique los puntos en los cuales el plano interseca los ejes coordenados. Si el plano pasa a travs del origen el origen debe moverse. 2. Tome los recprocos de las intersecciones. 3. Elimine las fracciones pero no reduzca a mnimos enteros. 4. Encierre los nmeros resultantes entre parntesis ( ). Los nmeros negativos se escriben con una barra. En relacin a los ndices de Miller de los planos es importante: 1. Los planos y sus negativos son idnticos. 2. Los planos y sus mltiplos no son idnticos. Para demostrar lo anterior se recurre a la densidad planar: es el nmero de tomos por unidad de superficie cuyo centro est sobre el plano. De la misma forma, la fraccin de empaquetamiento, es el rea sobre el plano cubierta por tomos. 3. Para una celda unitaria los planos de una familia se representan encerrndolos entre llaves { } ndices de Miller para celdas unitarias hexagonales: El sistema usa cuatro ejes en lugar de tres con un eje redundante. El procedimiento para localizar los ndices de los planos requiere cuatro intersecciones. Comportamiento isotrpico y anisotrpico Un material es anisotrpico si el valor de las propiedades depende de la direccin cristalogrfica a lo largo de la cual se mide la propiedad. Por el contrario, si el valor de la propiedad es el mismo en todas las direcciones en las que se mide, el material es isotrpico. Distancia interplanar: la distancia entre dos planos de tomos, paralelos y adyacentes con los mismos ndices de Millar se conoce como distancia interplanar. La distancia interplanar para materiales cbicos est dada por:
=
En donde ao es el parmetro de red y h, l, k, representan los ndices de Millar de los planos adyacentes considerados.
Sitios intersticiales En cualquiera de las estructuras que han sido descritas, existen pequeos huecos entre los tomos de la red que pueden ser ocupados por tomos ms pequeos. Estos espacios se conocen como sitios intersticiales. El tomo intersticial tiene un nmero de coordinacin igual al nmero de tomos que toca. Existe el sitio cbico con un nmero de coordinacin de 8, el tetradrico con nmero de coordinacin de 4 y el octadrico con nmero de coordinacin de 6.
Difraccin de rayos X
Cuando un haz monocromtico con una longitud de onda del mismo orden de magnitud que los espacios interatmicos del material golpea al mismo se produce la dispersin de la mayor parte de la radiacin. Sin embargo, los rayos x que golpean los planos cristalogrficos en ngulos especficos se ven reforzados en vez de eliminados. Este refuerzo ocurre siempre que las condiciones satisfagan la Ley de Bragg
=
es la mitad del ngulo de difraccin, es la longitud de onda de los rayos empleados, es la distancia interplanar del refuerzo constructivo del haz.
Cuando el material se prepara en forma de polvo fino, siempre habr algunas partculas de polvo cuyos planos h, k, l, queden orientados en el ngulo para satisfacer la ley de Bragg. En un difractmetro, un detector mvil de rayos x registra los ngulos 2 , dando un patrn caracterstico de difraccin.
Para identificar la estructura cristalina de un material cbico:=En los cbicos simples: 1,2, 3, 4, 5, 6,8En los cbicos centrados en el cuerpo: 2, 4,6En los cbicos centrados en las caras: 3, 4, 8, 11, 12,16BCC y =0,5
ESTRUCTURA ATOMICA
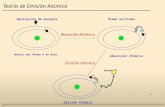
Estructura del atomoel atomo esta compuesto por un nucleo central compuesto por protones y neutrones, que constituyen la parte positiva del atomo y que contine casi toda su masa y electrones con carga negativa que giran alrederdor del nucleoionesson los atomos que han perdido o ganado electrones, con lo que han obtenido una carga electrica positiva o negativa respectivamente.IsotoposSon atomos del mismo elemento, y por tanto con el mismo numero atomico, que presentan diferente contenido en neutrones, y por ello distinto numero masico.numero atomicoes el numero de protones que hay en el nucleo atomico, se simboliza con la letra Z. coincide con el numero de electrones si el atomo es neutro.Numero masicoEs la sima del numero de protones mas el numero de neutrones(es el numero de nucleones). Se representa con la letra A.Unida de masa atomica (UMA)Es el patron de medida de las masas atomicasy vale la deceava parte de la masa del atomo de carbono 12.Masa atomica de un elementoMasa del elemento segn la abundancia relativa de sus isotopos en la naturaleza.Masa molecular Es la suma de las masas atonicas de los atomos que componen la molecula.
Tabla periodica o sistema periodico de los elementosRefleja la ordenacion de los elementos quimicos, en grupos (columnas) y periodos (filas), en base a dos criterios:a) Orden crecientede numeros atomicosb) Similitud de propiedades entre los elementos de que estan en la misma columna
Fig.n 01: tabla periodica actual
Enlaces atomicos
Un enlace atmico es un enlace qumico. El enlace qumico es el proceso fsico responsable de las interacciones entre tomos y molculas. La variedad de enlaces es amplia. Est el covalente, el inico, el de hidrgeno, el metlico, as como otros tipos de enlaces, y todos tienen una conexin que funciona en muchas cosas diarias. Hay dos tipos diferentes de enlaces atmicos: los primarios y los secundarios. Los enlaces primarios producen los enlaces qumicos que mantienen a los tomos unidos.
Tipos de enlaces atmicos
Hay dos tipos de enlaces: los primarios y los secundarios; y los primarios se dividen en tres, el metlico, el covalente y el inico. Los enlaces secundarios son subdivisiones de los enlaces, y se consideran ms dbiles.
Enlace metlico
Los enlaces metlicos son un metal y comparten vnculos externos con los tomos de un slido. Cada tomo desprende una carga positiva perdiendo sus electrones ms externos, y los electrones (de carga negativa) mantienen a los tomos metlicos unidos.
Enlace inico
Los tomos est rellenos con una capa externa de electrones. Estas capas de electrones se llenan transfiriendo electrones de un tomo al de al lado. Los tomos donantes obtienen una carga positiva y los receptores tendrn carga negativa. Se atraern entre ellos al ser positivo y negativo, y entonces ocurrir el enlace.
Enlaces covalentes
A los tomos les gusta compartir sus electrones y esto hace que su capa externa est completa. Un enlace covalente se produce cuando se comparten tomos y electrones. Esto produce un fuerte enlace covalente.
Enlaces secundarios
Los enlaces secundarios son significativamente ms dbiles que los primarios ya que producen conexiones ms dbiles, y crean deformaciones en el enlace. Los enlaces secundarios incluyen los de hidrgeno y los de van der Waals.
Enlaces de hidrgeno
Un enlace comn es el enlace de hidrgeno. Son los ms comunes en las molculas con enlace covalente que contengan hidrgeno. Los enlaces de hidrgeno se producen entre tomos covalentes y oxigenados. Esto lleva a cargas elctricas muy pequeas alrededor del enlace de hidrgeno, y cargas negativas alrededor de los enlaces oxigenados.
Enlaces de van der Waals
Los enlaces de van der Waals son el enlace ms dbil, pero son unos gases increblemente importantes, que son enfriados a temperaturas bajas. Estos enlaces son creados por pequeas cargas de electrones positivos y negativos que producen una carga dbil. Los enlaces de van der Waals se anulan por la energa trmica, causndoles una disfuncin.
Energia de enlace
La energa de enlace es la energa total promedio que se desprendera por la formacin de un mol de enlaces qumicos, a partir de sus fragmentos constituyentes (todos en estado gaseoso).1 Alternativamente, podra decirse tambin que es la energa total promedio que se necesita para romper un mol de enlaces dado (en estado gaseoso).
Los enlaces ms fuertes, o sea los ms estables, tienen energas de enlace grandes. Los enlaces qumicos principales son: enlaces covalentes, metlicos e inicos. Aunque tpicamente se le llama enlace de hidrgeno al puente de hidrgeno, ste no es un enlace real sino una atraccin intermolecular de ms baja energa que un enlace qumico.
Esparcimiento interatmicoEspacio intermolecular es el trmino utilizado en la qumica y fsica para referirse a los espacios existentes entre las molculas, al estar stas en un estado bsico de la materia (slido, lquido o gaseoso). Las molculas, al pasar por un cambio de estado, cambian tambin su espacio intermolecular junto con su energa cintica; por ejemplo: Un slido (Que tiene un espacio intermolecular muy corto), al pasar por la fusin se convierte en un lquido (Que tiene un espacio intermolecular ms extenso).
Conclusin
Podemos concluir con que este trabajo muestra una pequea parte del avance que se ha hecho con respecto a la informacin que se tiene acerca del tomo, cabe destacar que este es un tema bastante extenso y esto solo es un pequeo resumen algunos puntos importantes con respecto a los tomos.
BibliografaReferencias:http://www.mundonets.com/normas-apa/http://www.mundonets.com/normas-apa/http://www.mcgraw-hill.es/bcv/guide/capitulo/8448180488.pdfhttp://webdelprofesor.ula.ve/ingenieria/marquezronald/wp-content/uploads/2009/08/1_Introduccion-a-los-Materiales.pdf