Fisica Atomica
description
Transcript of Fisica Atomica

4) FISICA ATÓMICA

4.0) INTRODUCCION
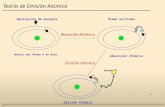
Aplicación de la mecánica cuántica a átomos multielectrónicos
Modelo : Versión cuántica del átomo del H
H cuántico XZ : z e-s
H cuántico H B-B
3 aspectos que la teoría de Bohr- De Broglie no puede responder:
:# de líneas
: intensidades
: multipletes
B-B :n rn , En n?
#s cuánticos spin

4.1) Modelos Atómicos
1. M. Atomistas { ~V aC} “ultimo estadio”
2. M. Newton { XVII – XVIII} Partícula
3. M. J.J Thomson {~1897}“Budín de Pasas”
4. M. E. Rutherford { 1911} “Modelo Planetario”
5. M. Niels Bohr {1913} espectros cuánticos: L=nh
6. M. LV Broglie { 1923} e-= e-(onda de materia)
7. M. Cuántico Relativista { 1929} M. Dirac – A. Sommerfeld e-
s relativistas, órbitas elípticas

4.2) Reformulación del átomo de H de N Bohr
n
l
ml
msn: # cuántico principal
e-

i) FALLAS DEL MODELO DE BOHR
No puede explicar las líneas espectrales de los espectros de emisión-absorción en cuanto a:
# de líneas
Densidad de las líneas
Multipletes
Interacciones atómicas
¿? Los mismos átomos siendo tan “diferentes” tenían comportamientos tan similares

ii) NÚMEROS CUÁNTICOS
j) NUMERO CUÁNTICO PRINCIPAL O ENERGÉTICO , n
k) n Energía, cuantizar
kk)
kkk) n: 1,2,3,…
jj) NUMERO CUÁNTICO ORBITAL , l
12 2
13.6n
EE
n n
k) l vinculado al L
El L (o l )es un NO OBSERVABLE
kk) ; l = 0,1,…., (n-1)
kkk) l cuantización del espacio
( 1)L l l

jjj) NUMERO CUÁNTICO MAGNÉTICO ORBITAL ,ml
k) la componente z del L si es “observable” , Lz
Lz ( o ) representan la cuantización del R3
kk) , ,...,0...z l lL m m l l
lm
lm
Z
z
ve
θi
kkk) “Orientación del L”
( 1) ( 1)l lz m mL
CosL l l l l
L
Lz

kv) La medición de Lz se efectúa mediante el z, debido a que todo L tiene asociado un
22
:
( ) ( )2
2 2 2
2 2
l
zz
e eL L
m
L m
L rx p mrvu
e e rIA u r u
rTv
erv ermv eu u L
m m
m
��������������
������������������������������������������
��������������
������������� �
v) Magnetón de Bohr
24 2
{ }2 2
9,27*1
2
0
( )
?
B
z l l
B
emagnetón de Bohr
e em
m
mm m
Am

jv) NUMERO CUÁNTICO MAGNÉTICO SPIN ,mS
k) Origen
l) Experimento de Stern- Gerlach
En 1921, en donde se estudió la desviación de radiación de átomos de Ag por campo magnético desuniforme.
Z
12
31. Colimador
2. B desuniforme
3. Pantalla
Resultados :
Teórico Experimental

Ag
B
. cos
...
pm
pm pmm
E B B
f E E ix
B B B Zx y z
��������������
•En física Clásica
el es continuo
•En Física Cuántica
2 1l
z l
L l m
L m l
Los L (Lz) no permiten, inclusive cuánticamente, explicar el resultado experimental.
L ¿?

ll) S Goudsmit y G Uhlembeck
En 1924, introducen el spin para satisfacer o justificar el espectro de emisión del gas de Na.
580 nm
580 nm 580,9 nm
Na
W. Pauli manifiesta que esta diferencia de λs se debería atribuir a un efecto de giro, SPIN , intrínseco del e-

lll) En 1927, Phipps y Taylor reproducen el experimento de Stern- Gerlach usando el átomo de H.
Resultado Experimental
.
B
1 0 0 0 0
( : )
0
l z zn l m
Estado Base
L
L S J orbital s n
l
pi
Este experimento permite introducir un spin del e-, asociado a un momento magnético “Angular”, en acuerdo con el momento magnético orbital,
l
s
L
S
������������������������������������������
����������������������������

lv) En 1929, P. Dirac (1919, A Sommerfeld) resolviendo la ecuación de Schroedinger relativista, determina la necesidad de introducir un cuarto numero cuántico para describir adecuadamente al e-, esto es el spin, s
s relativistas ½ e-
kk) Momento “angular” del Spin ,S
( 1)S s ss
s
sz
s= 1/2
S
Sz

kkk) La componente Sz de S
1 1: , , ,
2 21 1,
2 2
s z s s
z
m S m m s s
S
kv) El momento magnético de Spin
24, 9,27*10 ( )
2
s
s z z s B
eS
me e eS m magnetónde Bohr
m m m

iii ) ESTADOS ELECTRÓNICOS
Ee-=Ee {n,l,ml,ms } = Ψ(n,l, ml,ms)
j) Unicidad
Cada e- será descrito por un cuarteto de números cuánticos, n,l, ml,ms .
jj) Capa o Nivel
Son electrones que comparten el mismo n
n = 1,2,3,…
Capa : K, L, M, ….

jjj) Subcapa o subnivel
Estados electrónicos conformados por es de iguales n y l
l = 0 ,1,2, 3…
Subcapa : s, p, d, f…
jv) Orbital
Estado electrónico donde son iguales n , l y ml
Estos estados se diferencian por el ms

v) Funciones de onda Ψ(n,l, ml,ms)
j) Ψ1s
11 3 1 0
1
, ( )
, ,
1
.
1 0
r
rs r a radio de Bohr
Esta posee simetría radial esto es depende solamente
er
r
ESTAD
de
n lO ASAL
sB

Debido a que la Ψ solo depende de r, tendríamos que reescribir la densidad de probabilidad solo en esta variable,
Ψ | Ψ|2: densidad volumétrica de probabilidad
P(r) = 4 r2 | Ψ(r)|2 : densidad radial de probabilidad
2 2
22r
Pr ( ) 4
P ( ) 4 ( ) :
obabilidad r r dr
P r r r densidad radial de probabilidad
Un casquete esférico de grosor dr determina un volumen 4 r2 dr, la probabilidad para este volumen será,

Grafico de Pr y Ψr
r (ao)
z
x
y
Pr
1 2
Ψ= Ψ1,s
1
1
22r 1 1
2
231
2
231
P 4 ( )
14
1: 4
s s
r
r
r
r
P r r
r er
el r esperado r r r e drr

1
3
22
21 1
1 1( ) 2
4 2
r
rs
rr e
r r
jj) Ψ2s
n=2 l=0,1 s
Simétrica radialmente
1er estado excitado
OBS : l=0 simetría esférica o radial

z
x
y
5r1
Grafico de Pr y Ψr
r (r1=a0)
Pr
5 I00
Ahora, usando esta , calculamos el valor esperado de r,

1
1
22r 2 2
2
22
1 1
2
22 21 10
P 4 ( )
1 14 2
4 2
1: 4 2
?
32
s s
rr
rr
P r r
rr e
r r
rel r esperado r r r e dr
r r
r
El valor esperado será el más probable?

jjj) Ψ2p
122 3/ 2
11
1
3(2 )
r
rp
re
rr
n=2 l=0,1 p, Asimetría Radial
Estado excitado
Ψ2p(r,,) =Ψ2p(r) Ψ2p(,)
La asimetría es producida por Ψ2p (,)
2 ( , )p x x y y z zA p A p A p
Donde la funciones p son orientacionales.

z
xy
Pr
r (a0)5 12
0.2
Grafico de Pr y Ψ2py(,)
Observar como la parte angular de 2p , 2p(, ), es altamente direccional (asimétrica)

4.3 Descripción Electrónica de los elementos. Configuraciones.
i) Descripción electrónica para el H
n cuánticos : n, l , ml, ms
Ψn,l,ml,ms: posibles estados del e-
ii) Descripción electrónica de átomos multielectrónicos
H He, Li, B ……
Usando los mismos estados de e-s : Ψn,l,ml,ms
k) Descripción electrónica de los elementos

iii) Principio de exclusión de Pauli
1925
Describe el # máximo de e-s por orbital : 2,
distinguiéndose por su ms
iv) Estados Electrónicos posibles para un Elemento

n=4 1100
2
2
121 1
2
8
131 1
2
18
1422
2
32
n l m l m s
1 0 02 0 0
1 -101
3 0 01 -1
01
2 -2-1012
4 0 01 -1
01
2 -2-1012

v) Regla de Hund
“ La ocupación electrónica de orbitales de igual energía es tal que se efectúa con un número máximo de orbitales desapareados”.
Esta forma de ocupación de las orbitales se debe a que el sistema atómico busca estados de menor energía.
E1 E2
E1
E2

H
He
Li
B
Be
C
N
1s1
1s2
1s2 2s1=[He]2s1
1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3

kk) Configuraciones electrónicas
l ) Orden de llenado
Nivel de energía
Regla de Hund
Z

ll ) Tabla Períódica
Grupo I Alcalinos
VIII Gases nobles
IV-V Tierras Raras
Lantánidos “Super conductividad”
Actínidos

* Tabla peridodica de nucleidos {Nucleos)?
A
Z
kkk) Energia
Las energías serán básicamente las iniciales { E= (-13.6 )/n2 } pero afectadas de un Z efectivo,Zef
22
13.6efE Z
n

Estos Zef se debe a un apantallamiento electrónico del núcleo,
+Ze-n=1 : (Z-1)=zef
n=2 : (Z-2)=zef
n=3 : (Z-10)=zef
:

4.4 Transiciones electrónicas y espectros atómicosi) Transiciones electrónicas
Ei
Ef
f iE E E E
10 ( )t ns típico
j) Absorción estimulada

jj) Emisión espontánea
Ei
Ef
if EEE *
10 ( )t ns típico
Transcurrido dicho intervalo de tiempo el electrón regresa al nivel i emitiendo un fotón
jjj) Emisión estimulada
Ei
E*f
Ef* estado metaestable: el intervalo de tiempo en este caso puede ser de 10-4 – 10-5s.

jv) Regla de selección para las transiciones
La conservación de L conduce a las siguientes reglas
l = +-1 y ml= 0, +-1
ii) Espectros atómicos
l=0 l=1
Z=11
Z=12


















![Los primeros modelos de atomos16ecc1a7c49bf161.jimcontent.com/download/version...[LOS PRIMEROS MODELOS DE ATOMO] FISICA ATOMICA Y NUCLEAR MORENO VEGA , JOSE LUIS |MATEMATICA, FISICA](https://static.fdocuments.ec/doc/165x107/5e33012e6beb867c652e9f16/los-primeros-modelos-de-at-los-primeros-modelos-de-atomo-fisica-atomica-y.jpg)