Modelo atómico de Bohr-Somerfield, clase 3
-
Upload
brenda-yanez -
Category
Documents
-
view
302 -
download
0
description
Transcript of Modelo atómico de Bohr-Somerfield, clase 3
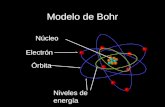
Modelo atmico de Bohr
Bohr aplic las ideas de la hiptesis de Planck en su estructura atmica, el sugera que la cuantizacin de las energas de los electrones en tomos era una propiedad fundamental de estas.
Modelo atmico de Bohr
La menor energa total de un tomo se denomina estado fundamental o nivel E 1. Cuando un electrn del tomo capta la energa adecuada para estar en cualquiera de los niveles de mayor energa, digamos E3 se dice que el tomo est en estado excitado y que el electrn ha sido excitado. Para volver a la energa del estado fundamental, el electrn tiene que liberar el exceso de energa.
Teora de Bohr del tomo de hidrgeno.Entonces la energa estaba dada por :
1 E n = Rh 2 n Y cuando pasaban de un estado a otro:
1 1 E = Rh 2 2 nf ni R es la constante de Rydberg y tiene un valor de 2,18x10-18 J
Modelo atmico de Bohr SommerfeldEl modelo atmico de Bohr funcionaba muy bien para el tomo De hidrgeno, sin embargo, en los electrones de un mismo nivel Energtico se observaba que tenan distinta energa, mostrando, Que algo andaba mal, entonces concluy que dentro de un mismo Nivel energtico existan subniveles de energa.
Sommefeld perfeccion el modelo atmico de Bohr dando las siguientes modificaciones Los electrones se mueven alrededor del ncleo en orbitas circulares o elpticas. A partir del segundo nivel energtico existen dos o ms subniveles en el mismo nivel. El electrn es una corriente elctrica minscula La excentricidad de la orbita dio lugar a un nuevo nmero cuntico, el azimutal, que determina La forma de los orbitales, se representa con la letra l y toma valores que van desde 0 hasta n-1. Las orbitas con: l igual a 0 se denominaran posteriormente orbitales s o sharp
l igual a 1 se denominaran 2 p o principal. l igual a 2 se denominaran d o diffuse. l igual 3 se denominaran f o fundamental.
Principio de dualidad de De Broglie
En 1924 Louis De Broglie postul que el comportamiento de los electrones en movimiento Se poda describir considerando que tenan comportamiento similares a las ondas, su modelo Indicaba que la longitud de onda de una partcula en movimiento es proporcional
Principio de incertidumbre de Heisenberg
En el mundo submicroscpico del tomo no es posible determinar tanto la posicin como el momento de un cuerpo en el espacio. En mecnica cuntica si se conoce la posicin del electrn, entonces Su velocidad (y su momento) es incierto y viceversa.
px h