MODELO ATÓMICO DE BOHR Jhoan Manuel Martínez Ruiz Universidad Nacional de Colombia.
-
Upload
xavier-martin-camacho -
Category
Documents
-
view
247 -
download
0
Transcript of MODELO ATÓMICO DE BOHR Jhoan Manuel Martínez Ruiz Universidad Nacional de Colombia.

MODELO ATÓMICO DE BOHR
Jhoan Manuel Martínez RuizUniversidad Nacional de Colombia

CONTENIDOIntroducción¿Quién fue Niels Bohr?Espectro atómicoModelo atómico de BohrConclusionesReferencias

INTRODUCCIÓN Bohr se basó en el átomo de hidrógeno
para hacer el modelo que lleva su nombre. Su objetivo era proponer un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases.

INTRODUCCIÓN El modelo atómico de Bohr partió del modelo de
Rutherford y de las ideas sobre cuantización desarrolladas por Max Planck y Albert Einstein años atrás.
E. Rutherford A. EinsteinM. Planck

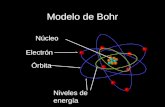
INTRODUCCIÓN En este modelo los electrones giran en órbitas
circulares alrededor del núcleo, ocupando la órbita de menor energía posible. Bohr supuso que los electrones solamente se podían mover en órbitas específicas.

INTRODUCCIÓN Bohr supuso además que el momento
angular de cada electrón estaba cuantizado y sólo podía variar en fracciones enteras de la constante de Planck. De acuerdo al número cuántico principal calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.

INTRODUCCIÓN Cada órbita tiene electrones con distintos niveles
de energía obtenida que después se tiene que liberar y por esa razón el electrón va saltando de una órbita a otra hasta llegar a una que tenga el espacio y nivel adecuado.

¿QUIÉN FUE NIELS BOHR?
Niels Bohr (Copenhague, 7 de octubre de 1885, 18 de noviembre de 1962) fue un físico danés que realizó contribuciones fundamentales para la comprensión de la estructura del átomo y la mecánica cuántica, ganó el Premio Nobel de física en 1922.

ESPECTRO ATÓMICO
Cada átomo es capaz de emitir o absorber radiación electromagnética, aunque solamente en algunas frecuencias que son características propias de cada uno de los diferentes elementos químicos.

ESPECTRO ATÓMICO
Si, mediante suministro de energía calorífica, se estimula un determinado elemento en su fase gaseosa, sus átomos emiten radiación en ciertas frecuencias del visible, que constituyen su espectro de emisión.

ESPECTRO ATÓMICO
De manera similar, el espectro de absorción de un material muestra la fracción de la radiación electromagnética incidente que un material absorbe dentro de un rango de frecuencias.

ESPECTRO ATÓMICO

MODELO ATÓMICO DE BOHR

MODELO ATÓMICO DE BOHR
Para el desarrollo de su modelo, Bohr se basó en tres postulados:
Primer postulado
Los electrones describen órbitas circulares en torno al núcleo del átomo sin irradiar energía.

MODELO ATÓMICO DE BOHR Segundo postulado No toda órbita para electrón está permitida, tan solo
se puede encontrar en órbitas cuyo radio cumpla que el momento angular, L, del electrón sea un múltiplo entero de h/(2π). Esta condición matemáticamente se escribe:
Con n = 1,2,3,…
.

MODELO ATÓMICO DE BOHR Tercer postulado El electrón solo emite o absorbe energía en los saltos
de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón, cuya energía viene dada por la ley de Planck:
donde identifica la órbita inicial y la final, y es la
frecuencia.
.

CONCLUSIONES El modelo de Bohr permitió explicar
adecuadamente el espectro del átomo de hidrógeno, pero fallaba al intentar aplicarlo a átomos polielectrónicos y al intentar justificar el enlace químico.
Además, los postulados de Bohr suponían una mezcla un tanto confusa de mecánica clásica y mecánica cuántica.

CONCLUSIONES A pesar de ser un modelo con ciertas
inconsistencias, sirvió como base para el desarrollo de un nuevo modelo atómico más completo (modelo de Sommerfeld). Por tanto, el modelo de Bohr se considera como uno de los grandes avances de la física moderna.

CONCLUSIONES
Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitió a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica.

REFERENCIASModelo atómico de Bohr [en línea]. URL disponible
en: http://www.eis.uva.es/~qgintro/atom/tutorial-08.html
Imágenes tomadas de: http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Bohr