Ligandos multivalentes con residuos de tioazúcares. Síntesis
Transcript of Ligandos multivalentes con residuos de tioazúcares. Síntesis
-
Ligandos multivalentes con residuos detioazcares. Sntesis y actividad biolgica
Cagnoni, Alejandro J.2013
Tesis Doctoral
Facultad de Ciencias Exactas y NaturalesUniversidad de Buenos Aires
www.digital.bl.fcen.uba.ar
Contacto: [email protected]
Este documento forma parte de la coleccin de tesis doctorales y de maestra de la BibliotecaCentral Dr. Luis Federico Leloir. Su utilizacin debe ser acompaada por la cita bibliogrfica conreconocimiento de la fuente.
This document is part of the doctoral theses collection of the Central Library Dr. Luis Federico Leloir.It should be used accompanied by the corresponding citation acknowledging the source.
Fuente / source: Biblioteca Digital de la Facultad de Ciencias Exactas y Naturales - Universidad de Buenos Aires
-
UNIVERSIDAD DE BUENOS AIRES
Facultad de Ciencias Exactas y Naturales
Departamento de Qumica Orgnica
Ligandos multivalentes con residuos de tioazcares.
Sntesis y actividad biolgica.
Tesis presentada para optar por el ttulo de
Doctor de la Universidad de Buenos Aires
en el rea Qumica Orgnica
Lic. Alejandro J. Cagnoni
Directores de la Tesis: Dra. Mara Laura Uhrig y Dr. Jos Kovensky.
Consejero de Estudios: Dra. Mara Laura Uhrig.
Trabajo realizado en el Departamento de Qumica Orgnica, Facultad de
Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina y en el
Laboratoire des Glucides, Universit de Picardie Jules Verne, Amiens, Francia.
Buenos Aires, 2013.
-
THSE DE DOCTORAT
Discipline : Chimie Organique
Spcialit : Glycochimie
prsent par
Alejandro Cagnoni
Pour obtenir le grade de
Docteur de lUniversit de Picardie Jules Verne
LIGANDS MULTIVALENTS CONTENANT DES THIOSUCRES.
SYNTHSE ET ACTIVIT BIOLOGIQUE.
Soutenance prvue le Vendredi 10 Mai 2013
Aprs avis favorable des rapporteurs Devant le jury dexamen:
Professeur Jos KOVENSKY Directeur de Thse, Laboratoire des Glucides, Amiens.
Professeur Mara Laura UHRIG Directeur de Thse, Universit de Buenos Aires, Argentine.
Professeur Dulce PAPY-GARCA Universit Paris Est, Crteil.
Professeur Stphane VINCENT Universit de Namur, Belgique.
Professeur Carola GALLO Universit de Buenos Aires, Argentine.
Professeur Miriam STRUMIA Universit Nationale de Crdoba, Crdoba, Argentine.
Professeur Adolfo IRIBARREN Universit Nationale de Quilmes, Buenos Aires, Argentine.
-
Palabras claves: ligandos multivalentes, tioazcares, -tiogalactsidos, galectinas, glicosidasas, reaccin click.
LIGANDOS MULTIVALENTES CON RESIDUOS DE TIOAZCARES.
SNTESIS Y ACTIVIDAD BIOLGICA.
Las interacciones especficas entre hidratos de carbono y protenas regulan una gran
diversidad de fenmenos biolgicos, puesto que desencadenan numerosos procesos de
transferencia de informacin. Para lograr interacciones de alta afinidad, la Naturaleza ha
diseado biomolculas que presentan mltiples copias de un determinado residuo
oligosacardico, que acta como elemento de reconocimiento de una protena. Esto conlleva al
efecto cluster glicosdico o efecto multivalente, en el cual la afinidad del proceso global
resulta mucho mayor que la simple suma de las interacciones individuales. Asimismo, estas
interacciones entre ligandos multivalentes y sus protenas receptoras (en la mayora de los
casos, lectinas) conducen a redes entrecruzadas que desencadenan procesos biolgicos
especficos. En bsqueda de compuestos de alta afinidad por lectinas que pudieran interferir
con este tipo de procesos, y que adems resultaran estables en medios biolgicos sin sufrir
degradacin por glicosidasas endgenas, se plante como objetivo principal de este trabajo de
tesis la sntesis de ligandos multivalentes con unidades de tioazcares especficamente
diseados para estudiar fenmenos biolgicos regulados por lectinas. Estos ligandos se
disearon para ser resistentes a la degradacin enzimtica, y a la vez, afines a lectinas que
reconocen -galactsidos (lectina de man y galectinas). Para ello, se sintetizaron cuatro
elementos de reconocimiento distintos derivados de -galactsidos: -tiogalactsidos, -
tiolactsidos, anlogos isostricos de la 3-desoxilactosa y anlogos de tiodigalactsido. Su
preparacin requiri el desarrollo de metodologa de sntesis especficas en cada caso. Estos
fragmentos se conectaron a plataformas biocompatibles derivadas de hidratos de carbono a
travs de la reaccin click, la cicloadicin de azidas y alquinos catalizada por Cu(I) o Ru(II).
Se evalu la afinidad de los ligandos sintetizados por lectinas as como tambin su actividad
enzimtica como inhibidores de glicosidasas. Asimismo, se realizaron estudios
conformacionales de los tioazcares y anlisis de la interaccin enzima-inhibidor mediante
tcnicas de RMN y de modelado molecular.
-
Key words: multivalent ligands, thiosugars, -thiogalactosides, galectin, glycosidase, click reaction.
MULTIVALENT LIGANDS BEARING THIOSUGARS.
SYNTHESIS AND BIOLOGICAL ACTIVITY.
The specific interactions between carbohydrates and proteins are determinant in a number
of biological phenomena, since they trigger a myriad of biological processes related with
communication processes. To achieve high affinity interactions, Nature has designed
biomolecules presenting several copies of specific oligosaccharidic moieties recognized by a
protein. This fact leads to the cluster glycosidic effect, also called multivalent effect,
described as a high affinity process which is stronger than the simple sum of monovalent
interactions.
Moreover, these interactions between multivalent ligands and their protein receptors
(mainly lectins), produce complex lattices which trigger specific biological responses. In
order to obtain compounds with high affinity for lectins, being at the same time stable in
biological fluids and resistant to endogenous glycosylhydrolases, the aim of this work was the
synthesis of multivalent ligands bearing thiosugars, specifically selected to study lectin-
mediated biological events.
These ligands have been designed to interact with lectins that recognize -galactosides (peanut lectin and galectins), and to be resistant to enzymatic degradation. Thus, four different
recognition elements derived from -galactosides have been synthesized: -thiogalactosides, -thiolactosides, isosteric analogues of 3-deoxylactose and thiodigalactoside analogues.
Specific methodology has been developed in each case to achieve their preparation. These
fragments were connected to biocompatible carbohydrate-derived scaffolds through the
click reaction, the cycloaddition between azides and alkynes catalyzed by Cu(I) or Ru(II).
The affinity of the synthesized ligands for lectins, as well as their activity as glycosidase
inhibitors was determined. In addition, conformational studies of the thiosugars and the
analysis of the enzyme-inhibitor interactions were performed using NMR techniques and
molecular modeling.
-
Un cientfico debe tomarse la libertad de plantear cualquier
cuestin, de dudar de cualquier afirmacin, de corregir errores.
Julius Robert Oppenheimer (1904-1967)
En el fondo, los cientficos somos gente con suerte: podemos
jugar a lo que queramos durante toda la vida.
Lee Smolin (1955- )
Cuando el objetivo te parezca difcil, no cambies de objetivo,
busca un nuevo camino para llegar a l.
Confucio (551 a.C.-479 a.C.)
La ciencia ser siempre una bsqueda, jams un descubrimiento
real. Es un viaje, nunca una llegada.
Karl Popper (1902-1994)
http://www.proverbia.net/citasautor.asp?autor=1214http://www.proverbia.net/citasautor.asp?autor=932http://www.frasecelebre.net/Frases_De_Karl_Popper.html
-
A mis paps, Silvia y Daniel, que me
ensearon a disfrutar y dar lo mejor
de m en cada cosa que haga.
A mis hermanos, que siempre estn
cuando los necesito.
A Ceci, que siempre me ayuda, me
acompaa, me apoya y me hace feliz.
-
A Mara Laura (Dra. Uhrig), por
todo lo que aprend con ella y por
ensearme a disfrutar la qumica.
A Jos (Dr. Kovensky), por
haberme transmitido todo su
conocimiento y experiencia.
-
Quiero recordar y agradecer a todas las personas que me acompaaron, ayudaron e hicieron posible esta tesis
A Mara Laura, porque siempre ser mi madre qumica, por transmitirme su pasin y
afecto, por haber sido una gua y una gran docente, por haberme apoyado en todo lo que
necesit, por explicarme la Teora de la Decisin y tantas cosas ms.
A Jos, por haberme dado la oportunidad de tener una experiencia formativa tan
interesante en Europa. Por todo lo que me ayud para poder viajar, disfrutar, aprender y
trabajar en Francia.
Mi profundo agradecimiento a Oscar (Dr. Varela), que me abri las puertas de su
laboratorio, por transmitirme toda su experiencia, por sus consejos, y por estar en el da a da
para resolver cualquier problema.
A Chili, mi querida hermana menor del laboratorio, que es una dola. Gracias por todo lo
que me ayudaste en el labo y fuera de l, por estar en los momentos difciles y por ser una gran
amiga.
A mis compaeros del L13, en donde pas la mayor parte del doctorado. A Verito, mi
hermana mayor, por la que entr al labo y la que me ayud siempre desde que empec. A Eva,
Adri, Lore y Romi que estaban desde que entr en el laboratorio y siempre me acompaaron.
A Juampi, Guille O. y Marcos L. que me hacen reir mucho. Y a Dani, la ms normal, que le
traa un poco de coherencia al grupo. Gracias a todos ellos el laboratorio era algo muy ameno y
divertido.
A mis compaeros del L9, en donde pas el ltimo ao de la tesis, Guille M., Ceci, Carla,
Eva, Pablo, Ale C. y Marcos C., Jonny, con los que se form un muy lindo grupo de
laboratorio, que se extendi fuera de la facultad.
A mis compaeros del Laboratoire des Glucides que siempre me hicieron sentir en casa a
pesar de la distancia: a Marilyne y Christophe, mis primeros compaeros de labo en Amiens
que me ayudaron muchsimo a adaptarme y a entender cmo funcionaban las cosas ah; a
Mehdi, el hiperactivo que siempre encontraba algo para hacer y musicalizaba el laboratorio; a
Rmi, con su carcter irascible que siempre me haca rer; a Maxime, que me aloj 10 das en
su casa cuando no tena donde quedarme; a Seb D., que siempre se ocupaba de organizar los
torneos de ftbol y los prodes (oh la-la); a Lucie y Celia, las chicas del grupo que me
invitaban a cualquier salida que se organizara; a Seb Gouin, que tambin me ayud mucho al
principio, sobre todo con las azidaciones y las reacciones click; a Marc , Albert, Eric, Sylvestre,
Grome, Cedric, Virginie, Joaqun, Estefana y Guillaume que me ayudaron mucho a conocer
Francia y a no sentirme tan lejos.
-
A mis amigos de toda la vida, Nico, Chae, Andrs, Cel, Aldu, Dot, Iza y Eze, que me
acompaaron a lo largo de todo el secundario, la facultad y la tesis. Nos conocimos cuando
tenamos 13 aos y ahora ya estn casados y tienen hijos... Por suerte, seguimos siendo amigos
desde entonces y estn para cualquier cosa que necesite.
A mis amigos de la facultad que, por algo, quedaron: Ceco, Pol, Gi, Lu, Maru, Charly,
Leti, Ceci S., Ale F., Juan y Lau, que hicieron toda la carrera conmigo, con los que armamos un
muy lindo grupo y con los que me divierto muchsimo.
A mis compaeros de QO, Javi (un gran amigo en todos los mbitos: facultad, doctorado,
OAQ y, sobre todo, ftbol), Fer, Vicky, Mati, Vale, Sebas, Hernn, Pau y Mario, por
acompaarme durante la tesis y hacer mucho ms llevaderos estos aos luchando con las
reacciones y espectros.
A mis amigos de ftbol, los Enfiestados, que conoc hace menos tiempo, pero que siempre
estn, sobre todo en los momentos difciles como con mi operacin de rodilla.
A Luis Calle Jimnez, Jess Jimnez-Barbero y su grupo del CIB de Madrid, por la
fructfera colaboracin para los estudios con la -galactosidasa.
A docentes y profesores con quienes compart turnos de ayudanta.
A David (UPJV) y Gabriel Cases (UBA) por los espectros de masa.
A Mary y Vicente, por los microanlisis.
A Carlos Stortz y Gerardo Burton por su ayuda con los clculos computacionales.
A Cyrille Grandjean, por su ayuda con el ITC y las galectinas.
A Florence Pilard (UPJV), que me recibi en el Laboratoire des Glucides, me trat con
mucha amabilidad y dio el curso de RMN avanzado.
A Jos y Gernot por los RMN realizados. A Dominique por toda su colaboracin con el
RMN en Francia.
Al labo de Micro de los alimentos por prestarme tantas veces las micropipetas para los
ensayos de inhibicin.
A Fernando Durn y Gerardo Burton por el Equipo de Microondas.
A Maripi y Nancy por toda la ayuda con los miles de papeles y trmites diarios. A Agns
por ayudarme con los documentos para viajar y durante mi estada en Francia.
A Hernn, Mabel, Sergio, Bety, Rosa, Nilda, Diego y a todo el personal no docente de
QO.
-
A toda mi familia que siempre me acompaa. A mis paps, que son un ejemplo a seguir, y
siempre me apoyan, guan y acompaan. A Edu y Pablo, mis hermanos, que estn para
absolutamente todo lo que necesite. A mi abuela Elva, que ya no est, pero que s que siempre
me va a acompaar de alguna forma. A mi abuela Celia, mis tos, mis primos, mis padrinos, Lis
y toda mi familia que me acompaan en todos mis proyectos. Y a Rosi, sin la cual nada sera
posible.
A Ceci, la que ms sufri con la tesis y mis viajes. Gracias por acompaarme, por estar
cuando te necesito, por darme tantas alegras y aguantarme mis problemas. Te amo!
Quera agradecer tambin a las instituciones que hicieron posible esta tesis de doctorado:
A CONICET por las becas otorgadas. A gide (Ministre des Affaires trangres et Europennes) por la Beca Eiffel. A la UBA por el subsidio de viajes al exterior. Al Ministerio de Educacin y la Embajada Francesa en Argentina por la Beca Saint
xupery.
Al Departamento de Qumica Orgnica (FCEyN - UBA) y el Laboratoire des Glucides (UPJV) por el lugar de trabajo e infraestructura.
-
NDICE
INTRODUCCIN
CAPTULO I - Modulacin de interacciones protenas-hidratos de carbono
mediante ligandos multivalentes sintticos
1
1. Interacciones protenas-hidratos de carbono 1
2. Glicosidasas 4
2.1. Tioazcares como inhibidores de glicosidasas 6
3. Lectinas 7
4. Galectinas 9
4.1. Funciones biolgicas de las galectinas 10
4.2. Dominio de reconocimiento de hidratos de carbono 12
5. Interacciones multivalentes 13
5.1. Ligandos multivalentes 14
5.2. Reaccin click 17
5.3. Desarrollos recientes de ligandos multivalentes 19
5.4. Plataformas derivadas de hidratos de carbono 23
5.5. Mecanismos de interaccin multivalente 26
6. Mtodos de estudio de interacciones protenas - hidratos de carbono 28
7. Referencias 32
CAPTULO II - Objetivos de la tesis 37
RESULTADOS Y DISCUSIN
CAPTULO III - Sntesis de ligandos multivalentes con unidades de 1-tio--D-galactosa
41
Introduccin 41
Resultados y discusin 42
1. Sntesis de tiogalactsidos con un grupo alquino terminal 43
-
2. Sntesis de las plataformas oligosacardicas con grupos azida. 45
3. Acoplamiento de los tiogalactsidos con las plataformas oligosacardicas por
reaccin click
46
4. Desacetilacin de los ligandos sintetizados para obtener los compuestos
libres.
57
5. Evaluacin de la actividad inhibitoria 61
Conclusiones 65
Bibliografa 65
CAPTULO IV - Sntesis de tiolactsidos multivalentes por cicloadicin catalizada por rutenio (II)
69
Introduccin 69
Resultados y discusin 71
1. Sntesis de tiogalactsidos y tiolactsidos conectados por un alquino interno 71
2. Acoplamiento de los dmeros 110 y 118 a las plataformas oligosacardicas.
Desacetilacin para la obtencin de los compuestos libres.
76
3. Modificacin de las plataformas oligosacardicas para la obtencin de
ligandos de mayor valencia.
81
4. Ensayos de Titulaciones por Calorimetra Isotrmica (ITC) 89
Conclusiones 92
Bibliografa 93
CAPTULO V - Sntesis de ligandos divalentes con residuos de 3-desoxi-4-(S--
D-galactopiranosil)-4-tio--D-ribo-hexopiransidos, anlogos isostricos de 3-
desoxilactosa, como elementos de reconocimiento
95
Introduccin 95
Resultados y discusin 97
Parte A: Tiodisacridos con unidades de pentopiranosa. Sntesis, actividad
inhibitoria y estudios conformacionales por tcnicas de RMN y modelado
molecular.
97
1. Sntesis de tiodisacridos con unidades de pentopiranosa en el extremo no
reductor.
97
-
2. Sntesis de tiodisacridos con unidades de pentopiranosa en el extremo
reductor.
104
3. Desproteccin de los tiodisacridos 110
4. Evaluacin de la actividad inhibitoria frente a glicosidasas 113
5. Estudios conformacionales de tiodisacridos inhibidores de la -galactosidasa
de E. coli. Anlisis de las interacciones enzima-inhibidor.
115
5.1. Estudios conformacionales de los tiodisacridos en solucin acuosa. 118
5.2. Estudios conformacionales de los tiodisacridos en el complejo enzima-
sustrato.
124
5.3. Estudios de docking de los complejos enzima-inhibidor 129
5.4. Simulaciones de dinmica molecular 131
6. Conclusiones Parte A 134
Parte B: Ligandos divalentes con anlogos isostricos de 3-desoxilactosa como ER.
Actividad inhibitoria frente a la -galactosidasa y afinidad por la lectina de man.
136
1. Sntesis de residuos de 3-desoxi-4-(S--D-galactopiranosil)-4-tio--D-ribo-
hexopiransidos, anlogos isostricos de 3-desoxilactosa funcionalizados con
grupos alquino
136
2. Estudios experimentales y tericos del mecanismo de isomerizacin-
reduccin
146
3. Acoplamiento de los tiodisacridos a las plataformas oligosacardicas. 150
4. O-Desacetilacin de los ligandos sintetizados para obtener los compuestos
libres.
152
5. Evaluacin de la actividad inhibitoria. 154
6. Ensayos ITC 156
7. Conclusiones Parte B 158
Bibliografa 159
CAPTULO VI - Sntesis de ligandos multivalentes con anlogos de
tiodigalactsido como elemento de reconocimiento.
163
Introduccin 163
Resultados y discusin 164
-
1. Sntesis del tiodisacrido anlogo de tiodigalactsido 164
2. Acoplamiento del ER 215 a las plataformas oligosacardicas. 169
3. Desacetilacin de los ligandos sintetizados para obtener los compuestos
libres.
178
4. Evaluacin de la actividad inhibitoria 182
5. Ensayos ITC 183
Conclusiones 185
Bibliografa 185
EXPERIMENTAL
CAPTULO VII - Tcnicas experimentales 187
Instrumentos y Mtodos Generales 187
1. Sntesis de ligandos multivalentes con unidades de 1-tio--D-galactosa 188
1.1. Procedimiento general para la sntesis de los alquilbromuros 50 y 51 188
1.2. Procedimiento general para la sntesis de los tiogalactsidos 52, 53 y 54 189
1.3. Procedimiento general para la sntesis de las plataformas oligosacardicas
con grupos azida
192
1.4. Procedimiento general para la reaccin click CuAAC 194
1.5. Desacetilacin de los ligandos multivalentes con unidades de -D-
tiogalactosa
207
2. Sntesis de tiolactsidos multivalentes por cicloadicin catalizada por
rutenio(II)
219
2.1. Sntesis de los tiogalactsidos y tiolactsidos divalentes 219
2.2. Procedimiento general para la cicloadicin catalizada por rutenio(II) 223
2.3. Modificacin de las plataformas oligosacardicas para la obtencin de
ligandos de mayor valencia
226
2.4. Desacetilacin de los tiogalactsidos y tiolactsidos multivalentes por
cicloadicin catalizada por rutenio(II)
233
3. Sntesis de tiodisacridos con unidades de pentopiranosa 239
3.1. Sntesis de tiodisacridos por adicin de Michael y reduccin 239
3.2. Desacetilacin de los tiodisacridos con unidades de pentopiranosa 251
-
4. Sntesis de anlogos isostricos de la 3-desoxilactosa como elementos de
reconocimiento en ligandos divalentes
254
4.1. Procedimiento general para la sntesis de las enonas 179 y 183 254
4.2. Sntesis de tiodisacridos por adicin de Michael y reduccin 255
4.3. Sntesis de ligandos mono y divalentes con anlogos isostricos de la 3-
desoxilactosa por reaccin click
260
4.4. Desacetilacin de los anlogos isostricos de la 3-desoxilactosa como
elementos de reconocimiento en ligandos mono- y divalentes
262
5. Sntesis de ligandos multivalentes con anlogos de tiodigalactsido como
elemento de reconocimiento
266
5.1. Sntesis del tiodisacrido anlogo de tiodigalactsido 266
5.2. Sntesis de la plataforma derivada de celobiosa 269
5.3. Sntesis de ligandos multivalentes con anlogos de tiodigalactsido por
reaccin click
272
5.4. Desacetilacin de los ligandos multivalentes con anlogos del
tiodigalactsido como elemento de reconocimiento
274
6. Procedimiento general para el estudio de la cintica de inhibicin enzimtica 278
7. Estudio de la interaccin de los ligandos multivalentes con lectinas por
Titulaciones de Calorimetra Isotrmica (ITC)
279
8. Detalles experimentales de los estudios conformacionales de los tiodisacridos
con unidades de pentopiranosa inhibidores de la -galactosidasa de E. coli
280
9. Clculos computacionales para el estudio del mecanismo de reduccin
isomerizacin.
282
10. Bibliografa 283
APNDICE 287
Abreviaturas 287
Resumen 289
Rsum 293
-
CAPTULO I
-
Captulo I
MODULACIN DE INTERACCIONES PROTENAS-HIDRATOS DE
CARBONO MEDIANTE LIGANDOS MULTIVALENTES SINTTICOS
1. Interacciones protenas - hidratos de carbono
La importancia de los hidratos de carbono como intermediarios en procesos de
generacin de energa y de sealizacin celular, y como marcadores de reconocimiento y
componentes de las clulas se ha demostrado ampliamente en los ltimos 20 aos, con
numerosos ejemplos en todo tipo de tejidos y organismos. Asimismo, resulta sorprendente
que una cantidad relativamente pequea de genes en un genoma tpico (las que regulan el
metabolismo de los azcares), d origen a una variabilidad biolgica tan compleja, ligada al
crecimiento celular, desarrollo y funcionamiento de los seres vivos.1
Muchas macromolculas presentes en la Naturaleza portan azcares unidos
covalentemente. Las estructuras que se encuentran van desde monosacridos sencillos a
oligosacridos complejos, neutros o cargados, que se denominan de manera genrica
glicanos. Muchos de ellos se encuentran en la superficie externa de las clulas y otros
forman parte de molculas que son secretadas al medio extracelular. Todo esto los hace
partcipes de procesos regulatorios, as como tambin de una amplia variedad de interacciones
clula-clula, clula-matriz extracelular y clula-molculas solubles, crticas para el desarrollo
y funcionamiento de un organismo multicelular complejo. Tambin pueden participar en los
procesos de comunicacin entre organismos diferentes, como por ejemplo, entre clulas de un
husped y un parsito, un virus o una bacteria (Figura I-1).
El proceso a travs del cual ocurre la unin covalente de los azcares a las protenas se
denomina glicosilacin, y es la modificacin postraduccional ms importante de las
protenas.2 La glicosilacin est mediada por enzimas capaces de enlazar un azcar especfico
a un aceptor proteico. Entre ellas, se encuentran las glicosiltransferasas, que catalizan la
transferencia de un residuo de un monosacrido especfico desde un nucletido-azcar donor,
a un sustrato aceptor. Por otra parte, las glicosidasas son enzimas que hidrolizan los enlaces
glicosdicos. Del balance de las actividades de glicosiltransferasas y glicosidasas, y de la
-
Tesis Doctoral Alejandro J. Cagnoni
2
compartamentalizacin de los procesos dentro de la clula, ocurre la regulacin del proceso
global de glicosilacin, dando forma a los glicanos expresados en los glicoconjugados.
Figura I-1. Interacciones intercelulares mediadas por uniones protenas-hidratos de carbono.
Tanto las glicosiltransferasas como las glicosidasas son especficas del residuo de azcar.
La expresin de estas enzimas est regulada en base al metabolismo celular, la activacin, los
cambios ambientales y la edad, de lo que se deduce la complejidad del proceso global.
Adems, frecuentemente ocurre que no todas las molculas de una protena poseen glicanos
idnticos. Estas especies de protenas idnticas que presentan diferentes estructuras
glicosdicas, se denominan glicoformas.
Existen dos tipos diferentes de glicanos unidos a protenas, que se clasifican dependiendo
del tipo de enlace que los une a la cadena polipeptdica de una protena. Los enlaces pueden
ser N-glicosdicos u O-glicosdicos. Un enlace N-glicosdico se establece entre un residuo de
N-acetilglucosamina (GlcNAc) y un residuo de asparagina, a travs de un tomo de nitrgeno
en una secuencia consenso de N-glicosilacin (o secun): Asn-X-Ser/Thr. Los N-glicanos
tienen una estructura bastante conservada con un core comn de cinco azcares: dos residuos
de GlcNAc y tres residuos de manosa (Figura I-2).2
Durante el proceso de glicosilacin, el core es sustituido por otros azcares para formar
estructuras ms complejas que se pueden clasificar como: i) de alta manosa; ii) complejas; iii)
hbridas. Las de alta manosa poseen un oligosacrido altamente conservado de 9 manosas. En
los N-glicanos complejos las manosas suelen estar sustituidas por el disacrido N-
O-glicanos
N-glicanos
glicoesfingolpidos
lectinas
-
Introduccin Captulo I
3
acetillactosamina(-Gal(14)GlcNAc). Tambin son frecuentes las cadenas de
polilactosamina y la presencia de cido N-acetilneuramnico (cido silico). Los glicanos se
pueden clasificar en di-, tri- o tetraantenarios en base al nmero de cadenas que sustituyen al
core. Por ltimo, las hbridas pueden tener mezclas de cadenas de tipo complejo en una desus
cadenas y de alta manosa en otra.
Figura I-2. Estructuras de los N-glicanos: a) complejos, b) hbridos y c) de alta manosa.
Los O-glicanos tienen estructuras menos conservadas y presentan mayor diversidad
estructural. Existen ocho cores distintos, que presentan en comn un residuo de GalNAc
unido a travs de un enlace O-glicosdico a serina (Ser) o treonina (Thr). En ciertos sistemas,
tambin existen uniones a 4-OH-prolina y 5-OH-lisina (Figura I-3).
Figura I-3. Estructuras de los O-glicanos.
-
Tesis Doctoral Alejandro J. Cagnoni
4
Es sabido que los azcares presentan mayor complejidad y diversidad estructural que las
protenas o los cidos nucleicos, por lo que poseen un gran potencial para el almacenamiento
y la transmisin de informacin biolgica. Si bien durante muchos aos los hidratos de
carbono de glicoconjugados se consideraron modificaciones postraduccionales, a los que se
les adjudicaba el nico rol de preservar a la protena de una degradacin prematura, luego
result evidente que las glicoprotenas exhiben una variedad de funciones biolgicas
relevantes, especficas del glicano.3 Lo mismo ocurre con los glicolpidos y
glicosaminoglicanos.
El reconocimiento de los azcares complejos que decoran la superficie celular por parte
de protenas especficas es el detonante de una mirada de procesos intra- y extracelulares
fisiolgicos y patolgicos. Dentro de las protenas que exhiben la capacidad de
reconocimiento de azcares se encuentran anticuerpos especficos de azcares, enzimas
activadas por hidratos de carbono, protenas transportadoras de azcares y, sobre todo,
lectinas.4
2. Glicosidasas
Las glicosidasas son enzimas que catalizan la hidrlisis de los enlaces glicosdicos en
oligosacridos y glicoconjugados. En general, estas enzimas son especficas del residuo, es
decir que el reconocimiento y su accin biolgica depende del nmero, de la posicin y de la
configuracin de los grupos hidroxilo del azcar.5
Se han descripto al menos 76 familias distintas de glicosidasas. Se conoce la estructura
tridimensional de al menos 30 de estas familias. El anlisis de estas estructuras mostr que, a
pesar de la gran diversidad estructural, todas estas enzimas catalizan la misma reaccin: la
hidrlisis de un acetal.6
La actividad de las glicosidasas es fundamental en numerosos procesos bioqumicos,
como, por ejemplo i) la degradacin de los polisacridos de la dieta para dar unidades
monosacardicas, que son metabolizadas y utilizadas por el organismo; ii) el catabolismo de
glicoconjugados lisosomales; y iii) la biosntesis de glicoprotenas y glicolpidos.
Durante las ltimas dcadas, se ha observado un gran inters en el desarrollo de
inhibidores teraputicos de las glicosidasas por su potencial aplicacin en el tratamiento de
distintas patologas como diabetes, obesidad, infecciones por HIV y el desarrollo de tumores.7
Una de las glicosidasas emblemticas, la -galactosidasa de Escherichia coli, ha sido
extensamente utilizada como modelo para distintos estudios cientficos del proceso
-
Introduccin Captulo I
5
cataltico.8,9 Esta enzima reconoce especficamente residuos de -galactopiranosa e hidroliza
el enlace glicosdico a una amplia variedad de agliconas.
La -galactosidasa es un tetrmero compuesto por cuatro cadenas peptdicas de 1023
aminocidos cada una (Figura I-4). La enzima requiere de Na+ y Mg2+ para su mxima
actividad, y este ltimo metal se encontr en el sitio activo de las dos formas cristalinas de la
enzima nativa. Los aspectos claves de la hidrlisis del enlace glicosdico y los residuos de
aminocidos involucrados en el reconocimiento del azcar se han estudiado por
espectroscopa de rayos X y mutagnesis.10-12
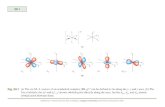
Figura I-4. Estructura de la -galactosidasa de E. coli.
La accin hidroltica de la -galactosidasa ocurre con retencin de la configuracin
anomrica. El aminocido nucleoflico es el cido glutmico E-537, mientras que el cido
glutmico E-461 y la tirosina Y-503, unidos al tomo de magnesio, estn directamente
involucrados en la catlisis (Figura I-5).
Figura I-5. Esquema general para la hidrlisis de un sustrato por una glicosidasa con retencin de configuracin.
-
Tesis Doctoral Alejandro J. Cagnoni
6
2.1. Tioazcares como inhibidores de glicosidasas
Los inhibidores enzimticos son molculas que se unen a las enzimas y disminuyen su
actividad cataltica. La unin de un inhibidor puede evitar que el sustrato entre en el sitio
activo de la enzima o puede obstaculizar que la enzima catalice su reaccin. Esta unin puede
ser reversible o irreversible. Los inhibidores irreversibles suelen reaccionar con la enzima y
cambiar su estructura qumica permanentemente, mientras que los reversibles se unen de
manera no covalente.13 Con estos ltimos se forma un equilibrio entre las especies enzima,
enzima-sustrato y enzima-inhibidor.
Existen tres tipos de inhibidores reversibles, que pueden ser descriptos cuantitativamente
en trminos de la unin del inhibidor a la enzima y/o al complejo enzima-sustrato, y por sus
efectos en las constantes cinticas de la enzima.13 En la inhibicin competitiva, el sustrato y el
inhibidor compiten por el sitio activo de la enzima. El ingreso del inhibidor al sitio activo
impide el ingreso del sustrato. Los inhibidores competitivos tienen en general una estructura
similar a la del sustrato. En el caso de la inhibicin no competitiva, la unin con el sustrato no
se ve afectada por el ingreso del inhibidor. El inhibidor y el sustrato se unen reversiblemente y
al azar en sitios independientes. La unin con un ligando no afecta la constante de disociacin
del otro. Sin embargo, el complejo enzima-sustrato-inhibidor es inactivo. Por ltimo, en la
inhibicin de tipo mixta, tanto el inhibidor como el sustrato se pueden unir a la enzima al
mismo tiempo. La unin del inhibidor afecta la del sustrato y viceversa. Aunque es posible
que los inhibidores se unan al sitio cataltico, generalmente, en este tipo de inhibicin el
inhibidor se une a otro sitio distinto del sitio activo. Se puede determinar el tipo de inhibicin
a partir de los grficos de Lineweaver-Burk (Figura I-6).13
Figura I-6. Grficos de Lineweaver-Burk para los distintos tipos de inhibicin enzimtica reversible.
1/v
1/[S]
> [I]
- 1/Km
1/v
1/[S]
> [I]
- 1/Km
1/v
1/[S]
> [I]
- 1/Km
-
Introduccin Captulo I
7
Los tioazcares son interesantes por su potencial como inhibidores competitivos de endo-
y exo-glicosidasas. Cuando se reemplaza el tomo de oxgeno por azufre en el enlace
glicosdico, se obtienen anlogos de glicsidos naturales resistentes a procesos metablicos de
hidrlisis. Por esa razn, se los ha considerado precursores potenciales de quimioteraputicos
basados en hidratos de carbono. En particular, los tiooligosacridos, en los cuales un tomo de
azufre constituye la unin glicosdica, han demostrado ser herramientas muy tiles y
verstiles para estudios bioqumicos y estructurales de glicosidasas, debido a su similitud con
los sustratos naturales de las mismas.14 El inters de los tiooligosacridos como inhibidores
potenciales de glicosidasas promovi el desarrollo de distintas estrategias sintticas para su
preparacin y posterior estudio de su actividad biolgica.15-19
Utilizando tcnicas de RMN y clculos de mecnica cuntica, el grupo de Jimnez
Barbero mostr que el metil -D-4-tiolactsido (1), anlogo del metil -D-lactsido (2), acta
como inhibidor competitivo de la -galactosidasa de E. coli (Ki 7,7 mM).20 Tambin se verific que la conformacin de los sustratos O-glicosdicos naturales en los complejos
enzima-sustrato difiere de la conformacin que adoptan los inhibidores enzimticos S-
glicosdicos en el sitio activo de la enzima, ya que la enzima distorsiona la conformacin
preferencial de los inhibidores en solucin (Figura I-7).21 El estudio conformacional de los
complejos enzima-sustrato es muy relevante para el diseo de nuevos inhibidores
enzimticos.
Figura I-7. Metil -D-4-tiolactsido (1) y metil -D-lactsido (2).
3. Lectinas
Las lectinas (del latn legere, seleccionar) son protenas que reconocen especficamente
hidratos de carbono de manera reversible sin desarrollar una accin enzimtica ni
inmunognica por s mismas. Las lectinas reconocen estructuras glicosdicas de glicoprotenas
y glicolpidos, y estn presentes en la mayora de los organismos vivos, desde virus y
bacterias hasta plantas y animales.22 En general, la unin de las lectinas a determinados
azcares presentes en glicoconjugados celulares desencadena algn evento biolgico. Pueden
ser secretadas o estar presentes en la superficie celular y tpicamente producen la aglutinacin
-
Tesis Doctoral Alejandro J. Cagnoni
8
de ciertas clulas animales. Se ha demostrado su importancia en numerosos procesos
biolgicos en diferentes especies tales como la adhesin de agentes infecciosos a clulas
husped, la depuracin (clearance) de glicoprotenas del sistema inmune, la inflamacin,
interacciones celulares del sistema inmune, desarrollo de tumores y metstasis.22
En general, las lectinas contienen por lo menos dos dominios de reconocimiento de
carbohidratos (DRC) y, por lo tanto, al interactuar con glicoconjugados de membranas
celulares, se forman redes entrecruzadas que pueden precipitar. Este fenmeno, conocido
como aglutinacin, es una de las caractersticas principales de las lectinas y se utiliza
clsicamente para su deteccin y caracterizacin. Los procesos de aglutinacin y precipitacin
se pueden inhibir con azcares solubles que sean reconocidos por la lectina e impidan la unin
de las lectinas a los glicoconjugados. Las lectinas se pueden clasificar en base a su origen o su
especificidad de reconocimiento de hidratos de carbono (Tabla I-1).23
Origen Familia Lectina Fuente Glicanos reconocidos
Plantas
Tipo L
(leguminosas)
Concanavalina A (ConA) Porotos Jack Man/Glc
Aglutinina de man (PNA) Man Gal, Gal3GalNAc
Aglutinina de soja (SBA) Soja Gal/GalNAc
Fitohemaglutinina L (PHAL) Porotos Gal1-4GlcNAc1-2[Gal1-4GlcNAc1- 6]Man
Aglutinina de Dolichos biflorus Horse gram GalNAc
Cereales Aglutinina de germen de trigo (WGA) Trigo (GlcNAc)1-3, Neu5Ac
Tipo R
(ricina)
Ricina Porotos Castor Gal
Abrina Abrus precatorius
Animales
Tipo-C
(Ca dependientes)
Receptor de asialoglicoprotena Hgado Gal
P-selectina Endotelio sLex
Tipo-I Sialoadhesina (Sn) Macrfagos Neu5Ac
Tipo-P Receptor de Man6P Lisosomas Man6P
Galectinas Galectina-3 Neuronas Gal
Pentraxinas Protena C-reactiva Humana Gal, Gal6P, GalA
Virus Hemaglutininas Hemaglutinina de la influenza Virus de influenza
humana Neu5Ac(2-6)Gal
Bacterias Adhesinas FimH E. coli Man
Tabla I-1. Ejemplos de lectinas, las familias a las cuales pertenecen y su especificidad de glicanos.
-
Introduccin Captulo I
9
4. Galectinas
Las galectinas son lectinas animales que se caracterizan por poseer al menos un dominio
de reconocimiento de carbohidratos (DRC) especfico por residuos de -galactosa.24 sta es
una familia de protenas altamente conservada evolutivamente, e incluso se han encontrado
protenas homlogas en organismos inferiores tales como nematodos, esponjas y
microorganismos.25 En mamferos se han descripto hasta la fecha 15 galectinas diferentes
(Tabla I-2).26
Las galectinas pueden poseer uno o dos DRC que estn asociados a una cadena peptdica
relativamente flexible, y no a otros dominios proteicos. Por lo tanto, a diferencia de otras
lectinas, el DRC de las galectinas puede actuar de manera independiente del resto de la
protena.
Las galectinas se pueden clasificar en tres grupos designados en ingls como: Proto-type,
Chimera-type o Tandem repeat type (Figura I-8).24 Las galectinas Proto-Type pueden existir
como monmeros o formar homodmeros compuestos por dos DRC idnticos. La ms
estudiada es galectina-1 (14,5 kDa), la cual ha sido identificada a nivel de msculo cardaco,
neuronas motoras y sensoriales, rin, placenta, crnea, timo, bazo y ganglios linfticos. Las
de tipo Chimera-Type desempean su funcin a travs de una interaccin dual. Por un lado,
interaccionan con carbohidratos a travs de su DRC situado en el dominio C-terminal y, por
otro, con otros ligandos, como polipptidos y polinucletidos, a travs de su dominio N-
terminal rico en prolina, glicina y tirosina. El nico miembro de esta familia, la galectina-3
(29 kDa), fue identificado en macrfagos activados, basfilos, mastocitos y ciertas clulas
tumorales. Esta galectina puede formar un pentmero cuando interacciona con glicoprotenas
multivalentes. Por ltimo, las galectinas con secuencias repetitivas (Tandem repeat type)
exhiben dos DRC estructuralmente distintos, que les confieren la propiedad de interaccionar
con carbohidratos dismiles.27,28
Figura I-8. Representacin esquemtica de los distintos tipos de galectinas.
Proto-type Chimera- Tandem repeat-
-
Tesis Doctoral Alejandro J. Cagnoni
10
Galectina PM (KDa) Estructura Localizacin
1 14-15 Proto-type Esqueleto, msculo, corazn, placeta, riones,
pulmones, neuronas, clulas dendrticas, macrfagos, mdula sea
2 14 Proto-type Tracto gastrointestinal
3 29 Chimera-type Macrfagos activados, granulocitos, mastocitos,
neuronas, riones
4 36 Tandem repeat-type Tracto gastrointestinal
5 17 Proto-type Eritrocitos y reticulocitos
6 33 Tandem repeat-type Endotelio intestinal
7 15 Proto-type Queratinocitos
8 34 Tandem repeat-type Hgado, riones, corazn, pulmones, cerebro
9 36 Tandem repeat-type Hgado, bazo, riones, intestino delgado, pulmones
10 16,5 Proto-type Eosinfilos, basfilos
11 14 Proto-type Retina
12 35 Tandem repeat-type Adipocitos
13 16 Proto-type Placenta
14 18 Proto-type Eosinfilos
15 15,5 Proto-type tero
Tabla I-2. Peso molecular, estructura y localizacin de las galectinas.29
4.1. Funciones biolgicas de las galectinas
En general, las galectinas son protenas que se encuentran en el citoplasma o en el medio
extracelular pero tambin pueden encontrarse en el ncleo.29 Como las galectinas no poseen
pptido seal no son externalizadas por el mecanismo clsico de secrecin del Retculo
Endoplsmico - Aparato de Golgi, sino por un mecanismo diferente an no completamente
dilucidado en el que participan vesculas (exosomas).29 En general, la concentracin de
galectinas en el citoplasma es mayor, pero la concentracin en la superficie celular aumenta si
la clula se encuentra en condiciones de estrs, tales como la inflamacin o transformaciones
oncolgicas.
-
Introduccin Captulo I
11
Estas protenas han sido involucradas en fenmenos de inmunomodulacin,30,31 adhesin
celular,32,33 regulacin del crecimiento,34 inflamacin,31,35 embriognesis,36,37
reproduccin,38,39 metstasis,40,41 proliferacin,33,42 reconocimiento de patgenos43 y splicing
de precursores de ARN mensajero (Figura I-9).44,45 De todas las galectinas identificadas, las
ms estudiadas han sido galectina-1 y galectina-3. Se ha observado que su unin a
carbohidratos desencadena efectos biolgicos a travs del reconocimiento de azcares
especficos en ligandos intracelulares, receptores de membrana y glicoprotenas
extracelulares. La actividad vara en forma considerable de acuerdo a su localizacin
subcelular, la regulacin temporal y espacial de su expresin, y el estado de activacin
celular.27
Figura I-9. Rol de las galectinas en diferentes procesos biolgicos.
Durante las ltimas dcadas se ha estudiado mucho el rol de las galectinas en la
progresin de tumores y metstasis.46 Se sabe que la transformacin de las clulas normales
en clulas tumorales trae aparejados cambios en el perfil y la composicin de las molculas de
la superficie celular, incluyendo los glicoconjugados. Se ha observado que tambin se
produce un aumento en la expresin de las galectinas, factor que podra estar asociado a un
mecanismo de evasin de la respuesta inmune.47 Como las galectinas estn implicadas en la
adhesin celular, crecimiento celular, respuesta inmune, apoptosis y angiognesis, se puede
pensar que los cambios en la expresin de estas lectinas pueden tener un rol crtico en la
progresin tumoral. Efectivamente, se ha encontrado que la expresin incrementada de
algunas galectinas a nivel de clulas tumorales tiene una relacin directa con el grado de
invasividad y metstasis de ciertos tumores (astrocitoma, tiroides, carcinoma de cabeza y
cuello, y tumores de colon).47
Uno de los campos ms promisorios e interesantes es el desarrollo de inhibidores
selectivos de galectinas para su uso en aplicaciones biomdicas, como potenciales
herramientas de diagnstico o agentes teraputicos en cncer y enfermedades autoinmunes.48
Reconocimiento de
patgenos
Splicing
Embriognesis Inflamacin
Regulacin del crecimiento
Adhesin celular
Metstasis
Reproduccin
Galectinas
-
Tesis Doctoral Alejandro J. Cagnoni
12
4.2. Dominio de reconocimiento de hidratos de carbono (DRC)
El DRC de las galectinas, que incluye 135 residuos de aminocidos, est compuesto por
dos hojas antiparalelas, de cinco (F1-F5) y seis (S1-S6a/6b) lminas, que forman una
estructura de tipo -sandwich (Figura I-10).49,50 El lado cncavo forma una cavidad que
constituye el sitio de unin del azcar y es lo suficientemente grande como para albergar hasta
un tetrasacrido lineal. Leffler y col. propusieron la subdivisin del DRC en 5 regiones o
subsitios denominados A-E, segn su unin con un oligosacrido lineal. Estos estudios se
realizaron con lactosa y N-acetillactosamina como ligandos.24 Los ms importantes son los
subsitios C y D, ya que contienen a los siete aminocidos que presentan mayor interaccin
con el azcar y definen la especificidad de estas lectinas por los -galactsidos (Figura I-
11).24,51 Si bien la mayor interaccin se produce con el residuo de -galactosa no reductor, las
interacciones de los aminocidos del sitio de unin con el residuo de D-glucosa o N-acetil-D-
glucosamina tambin son relevantes. Por esta razn, la afinidad de las galectinas por la lactosa
o la N-acetillactosamina (LacNAc) es de ms de dos rdenes de magnitud que por la D-
galactosa.52
Las distintas galectinas reconocen glicoconjugados que contienen secuencias de LacNAc
presentes en N- u O-glicanos de glicoprotenas. Las cadenas de polilactosamina se pueden
describir como 3-O-X-Gal(14)GlcNAc-Y, en donde los subsitios A y B del DRC de las
galectinas reconocen el fragmento X, el subsitio E el fragmento Y y los subsitios principales
C y D a la N-acetillactosamina. Si bien todas las galectinas se caracterizan por su
reconocimiento de la LacNAc, pueden existir diferencias en la especificidad en base a la
interaccin con los otros subsitios A, B y E de la galectina.24,29
Figura I-10. Representacin esquemtica del complejo galectina-1 con lactosa.
-
Introduccin Captulo I
13
Figura I-11. a) Representacin del DRC de las galectinas con los 5 subsitios A-E. Interacciones entre los
aminocidos del sitio de unin y la lactosa. La N-acetillactosamina tambin es reconocida por las galectinas. Si
se modifica el OH-3 de la LacNAc con un sustituyente aromtico, la afinidad aumenta mucho; b) representacin
esquemtica tridimensional del DRC de galectina-3 complejada con LacNAc.
El grupo hidroxilo en posicin 4 de la galactosa es esencial para el reconocimiento por la
galectina, mientras que el OH-3 no interviene en la formacin de interacciones por puente
hidrgeno. El grupo de Leffler y Nilsson prepar una familia de derivados de la LacNAc con
sustituyentes aromticos en posicin 3 (5a, 5b). Estos compuestos resultaron muy afines a la
galectina-3 por interacciones hidrofbicas entre el anillo aromtico y un residuo de arginina
en el sitio de unin.53
5. Interacciones multivalentes
Como se dijo anteriormente, las interacciones entre protenas e hidratos de carbono son
responsables de numerosos procesos fisiolgicos, como la respuesta inmune y la
reproduccin. Asimismo, intervienen tambin en procesos patolgicos, como las infecciones
virales y bacterianas.4,54 Las etapas iniciales de los ciclos infecciosos de muchas bacterias,
virus y parsitos requieren que los receptores patognicos reconozcan los glicanos de las
glicoprotenas en las membranas celulares del husped.54 Muchos de estos receptores son
lectinas. Por lo tanto, la sntesis de ligandos capaces de controlar estos eventos se presenta
como una meta sumamente interesante (Figura I-12).
a)
b)
-
Tesis Doctoral Alejandro J. Cagnoni
14
La afinidad de las lectinas por los azcares individuales es bastante baja, con constantes
de afinidad de aproximadamente 10-4 M-1.55 En los sistemas naturales, las limitaciones de esta
baja afinidad se superan con la exposicin de numerosas copias de los mismos ligandos en el
espacio extracelular generando interacciones multivalentes. stas se definen como las uniones
especficas simultneas de mltiples ligandos (unidos a una entidad biolgica como una
plataforma o una superficie), a mltiples receptores en otra entidad complementaria, como
una membrana celular, de manera cooperativa.56 Estas interacciones son muy frecuentes en la
Naturaleza y presentan una serie de ventajas en cuanto a la afinidad y selectividad con
respecto a las interacciones monovalentes. Esencialmente, las interacciones multivalentes son
colectivamente mucho ms fuertes que la simple suma de las interacciones monovalentes
correspondientes.54,57
Figura I-12. Estrategias utilizadas para la inhibicin de infecciones virales con ligandos multivalentes. V: virus,
D: dendrmero, MC: membrana celular.
5.1. Ligandos multivalentes
Con el objetivo de estudiar las interacciones entre hidratos de carbono y protenas en los
sistemas biolgicos, en los ltimos 10 aos se sintetiz una enorme cantidad de ligandos de
distinta valencia basados en diferentes tipos de estructuras. La valencia de una molcula, o la
de una entidad biolgica como una clula, un virus o una bacteria, est determinada por el
nmero de unidades estructurales individuales del mismo tipo o similares que estn
conectadas a una plataforma (scaffold).58 Estrictamente, esta definicin se refiere a la valencia
estructural de un ligando, es decir, al nmero de elementos de reconocimiento (ER)
conectados a la plataforma. Sin embargo, puede suceder que no todos los ER presentes en el
ligando multivalente interaccionen con los sitios de unin del receptor y que algunos ER
Infecciones virales
Infeccin
MC Clula de mamfero
Bloqueo de los
receptores del virus
Bloqueo de los
receptores celulares
No hay infeccin
No hay
infeccin
-
Introduccin Captulo I
15
resulten inactivos por cuestiones estricas, por ejemplo. Entonces, para una interaccin
multivalente ligando-receptor, se define como la valencia funcional al nmero de ER del
ligando que estn siendo efectivamente reconocidos por el receptor.59
Los ligandos multivalentes de hidratos de carbono se caracterizan en general por poseer
tres partes: i) el elemento de reconocimiento (ER), que es el residuo de azcar que es
reconocido por la lectina; ii) una plataforma (scaffold en ingls) o estructura central a la cual
se conectan los distintos ER; iii) los espaciadores, que permiten regular la distancia entre los
ER y la plataforma (Figura I-13).60
Figura I-13. Representacin esquemtica de los ligandos multivalentes.
Los espaciadores no slo sirven para conectar los ER a la plataforma sino que proveen la
distancia adecuada entre los distintos ER para que las interacciones multivalentes sean
posibles. Los espaciadores deben ser qumica, biolgica y enzimticamente estables, y no
deben perturbar la interaccin entre el ER y el receptor. En algunos casos, pueden contribuir a
la afinidad del ligando al proveer interacciones favorables con la superficie del receptor. Otro
factor muy importante a tener en cuenta es la flexibilidad del espaciador. Siempre que el
espaciador sea suficientemente largo como para permitir la interaccin multivalente, cuanto
ms rgido es, la asociacin se ver ms favorecida. Esto se debe a que al pasar del estado
libre al asociado, de un gran nmero de conformaciones posibles se pasa un estado de
conformacin restringida. Por lo tanto, cuanto ms flexible sea el espaciador, mayor va a ser
el costo entrpico de la asociacin. Por otro lado, hay que tener en cuenta que un espaciador
muy rgido puede no permitir el contacto adecuado entre los ER y los sitios de unin de la
protena.
La plataforma es la estructura central a la cual se unen covalentemente los distintos ER.
La valencia y la forma de la plataforma influyen significativamente en la afinidad del ligando
multivalente. Se han utilizado numerosos tipos de plataformas distintas para la preparacin de
ligandos multivalentes (Figura I-14).
Plataforma
ER ER ER
ER ER ER
ER ER
-
Tesis Doctoral Alejandro J. Cagnoni
16
Figura I-14. Forma y tamao de las distintas plataformas utilizadas en la sntesis de ligandos multivalentes.
Plataforma linear unidimensional
Plataforma rgida (macrociclos, aromticos, calixarenos, complejos metlicos)
Plataforma ramificada (glicodendrmeros)
Plataforma flexible de cadena (glicopolmeros)
Plataforma tridimensional (neoglicoprotenas)
Plataforma bidimensional (micelas, liposomas, superficies metlicas)
-
Introduccin Captulo I
17
Para los ligandos de baja valencia (< 10 ER) se utilizan plataformas flexibles, lineares o
ramificadas, o estructuras rgidas como ciclodextrinas, porfirinas, macrociclos y calixarenos,
entre otros. Para ligandos de valencia intermedia (10 < ER < 100) las estructuras ms
utilizadas han sido los glicodendrmeros, plataformas altamente ramificadas. Los ligandos
multivalentes de alta valencia (> 100 ER) se obtienen fcilmente polimerizando un ligando
monovalente o bien modificando un polmero preformado conjugndolo con un ligando, para
dar lugar a los glicopolmeros. Por ltimo, las plataformas pueden ser estructuras planas
bidimensionales, como una superficie metlica modificada con los ER, o una superficie
esfrica tridimensional como en el caso de las protenas globulares (Figura I-14).60
Para la conexin de los elementos de reconocimiento a las plataformas se requieren
reacciones que sean de alto rendimiento, rpidas, que den productos estables y que exhiban
compatibilidad con un amplio espectro de grupos funcionales. Los enlaces que se han
utilizado ms frecuentemente con este fin han sido amidas, tioureas y ms recientemente
1,2,3-triazoles resultantes de la llamada reaccin click.56
5.2. Reaccin click
En el ao 2001, Sharpless61 defini por primera vez el trmino Qumica Click para
describir las reacciones que cumplieran los siguientes criterios:
La reaccin debe ser de amplio espectro, dar muy buenos rendimientos, generar slo
productos secundarios inofensivos removibles por mtodos no cromatogrficos, y ser
estereoespecfica. El proceso debe requerir adems condiciones de reaccin simples,
reactivos fcilmente accesibles, el uso de solventes benignos (como el agua) y productos de
fcil purificacin.
A fines del siglo XIX62 se descubri la cicloadicin 1,3-dipolar entre una azida y un
alquino terminal para dar un 1,2,3-triazol, conocida tambin como Reaccin de Huisgen,63
quien describi su potencial sinttico y su mecanismo en la dcada de 1960. Esta cicloadicin
tiene una gran utilidad sinttica ya que los alquinos y azidas se pueden incorporar en una gran
variedad de sustratos. Sin embargo, como el efecto director de los sustituyentes es
generalmente bajo, esta reaccin sufri durante 40 aos la falta de regioselectividad, puesto
que en condiciones trmicas se obtena la mezcla de los 1,2,3-triazoles regioisomricos 1,4- y
1,5-disustituidos (Figura I.15). Adems de los largos tiempos de reaccin y las altas
-
Tesis Doctoral Alejandro J. Cagnoni
18
temperaturas, la separacin de los dos regioismeros era dificultosa por los mtodos
cromatogrficos clsicos.
En 2002, dos grupos describieron independientemente que las sales de cobre(I)
aceleraban la velocidad de reaccin por un factor de hasta 107.64,65 El hecho ms destacable
fue que la cicloadicin catalizada por Cu(I) daba lugar nicamente al regioismero 1,4-
disustituido a temperatura ambiente o con un calentamiento moderado (Figura 15). En estas
condiciones las reaccin se llam Cicloadicin de Azidas y Alquinos Catalizada por
Cobre(I) (Copper(I)-catalyzed azide-alkyne cycloaddition o CuAAC) y es la reaccin que
mejor cumple con los criterios de la Qumica Click hasta la actualidad.
Como catalizadores se pueden utilizar diferentes sales de Cu(I) como, por ejemplo, CuI,
CuOTf.C6H6 y [Cu(NCCH3)4][PF6]. Sin embargo, el Cu(I) es inestable ya que fcilmente
dismuta o se oxida.66 Por lo tanto, se encontr que era ms conveniente generar el catalizador
de Cu(I) in situ a partir de sales de Cu(II), que adems suelen ser ms baratas y ms puras.
Una de las sales ms utilizadas es CuSO4 (usado en cantidades de aprox 0,25-2% de
catalizador) que se reduce con cido ascrbico o ascorbato de sodio. Esta reaccin no requiere
de precauciones especiales, se puede realizar en un amplio rango de pH (4-12) y se completa
entre 6 y 36 horas a temperatura ambiente con excelentes rendimientos. Es compatible con
prcticamente cualquier grupo funcional presente en las molculas y se puede hacer en una
variedad de solventes que incluyen DMF, THF, dioxano, t-BuOH, EtOH e incluso H2O.
Figura 15. Cicloadicin 1,3-dipolar entre azidas y alquinos terminales.
El mecanismo propuesto para la CuAAC64 comienza con la formacin del acetiluro de
cobre I, que slo puede formarse con alquinos terminales. Luego, en lugar de producirse una
cicloadicin concertada [2+3] entre I y la azida, se produce una ciclacin secuencial
IIIIIIV, pasando por el intermediario metalocclico III de seis miembros (Figura I-16).
El primero de estos pasos consiste en el desplazamiento de uno de los ligandos del cobre por
la azida para formar el complejo II. Se produce luego el ataque del carbono nucleoflico C-4
al N-3 de la azida generando la especie metalocclica III (los tomos estn numerados segn
-
Introduccin Captulo I
19
la nomenclatura tradicional de los tirazoles). Luego, se produce una contraccin del anillo por
asociacin del par libre de electrones de N-1 con el orbital antienlazante * C-5-Cu para
formar IV. Por ltimo, el triazol formado se protona liberando el producto y regenerando el
catalizador. Van Maarseveen y col. propusieron que tambin pueden estar involucradas
especies dimricas o multimricas de cobre.67
Figura I-16. Ciclo cataltico propuesto para la CuAAC.
Los triazoles 1,4-disustituidos no resultaron una novedad en qumica medicinal sino que,
por el contrario, ya se haban descripto ms de 70.000 compuestos con esta funcionalidad
antes del descubrimiento de la CuAAC. Los triazoles presentan numerosas ventajas para su
utilizacin en qumica medicinal: son estables frente a la hidrlisis cida o bsica, as como
tambin a condiciones reductoras u oxidativas, dada su alta estabilidad aromtica. Este anillo
tiene un alto momento dipolar (aproximadamente 5 D) por lo que puede participar de la
formacin de interacciones de enlace de hidrgeno, dipolo-dipolo y -stacking. Por ltimo,
son estables frente a la degradacin metablica.68
En conclusin, la CuAAC, dado su amplio espectro de aplicacin, la estabilidad de los
productos y las fciles condiciones de reaccin, resulta una reaccin sumamente eficiente y
verstil para la conexin de los ER a las plataformas en la sntesis de ligandos multivalentes.
5.3. Desarrollos recientes de ligandos multivalentes
Ligandos multivalentes de alta valencia
-
Tesis Doctoral Alejandro J. Cagnoni
20
Los primeros ligandos de alta valencia (> 100 ER) fueron neoglicoconjugados como las
neoglicoprotenas y neoglicolpidos que se prepararon por mtodos sintticos y semi-
sintticos, uniendo los azcares a protenas o lpidos por medio de mtodos qumicos o
enzimticos. La presencia de muchos grupos funcionales en las cadenas laterales de los
aminocidos que constituyen a las protenas, permiti la unin de una gran variedad de
azcares a las mismas. La funcionalidad ms explotada para conectar los ligandos azucarados
fue el grupo amino de la cadena lateral de los residuos de lisina y la protena ms utilizada
para la preparacin de neoglicoprotenas fue la albmina de suero bovino (BSA).69,70
Por otra parte, se desarrollaron neoglicolpidos para el diseo de biosensores de hidratos
de carbono (Figura I-17).71 Los glicolpidos se agregan espontneamente en solucin acuosa
para formar liposomas con residuos de azucares que pueden interactuar con distintas
protenas. Si bien estos compuestos ofrecen gran versatilidad en la composicin qumica,
tienen la desventaja de que pueden ser incorporados no especficamente en las membranas
celulares. Adems, las concentraciones necesarias para formar las micelas en solucin pueden
ser distintas a las de experimentos in vivo.
Figura I-17. Representacin esquemtica de neoglicolpidos multivalentes.
En tercer lugar, los glicopolmeros, constituidos por una macromolcula lineal o
ramificada (polmero) a la cual se unen los distintos ER, constituyen una de las primeras
clases de ligandos multivalentes completamente sintticos. Estos glicoconjugados despertaron
gran inters por sus numerosas aplicaciones. Efectivamente, presentan grandes ventajas tales
como la posibilidad de ligandos de altsima valencia, gran variedad de peso molecular y
facilidad de sntesis. A modo de ejemplo, Kiessling y col. desarrollaron un mtodo de
polimerizacin por mettesis de apertura de anillo que les permiti preparar glicopolmeros
con unidades de manosa que resultaron 2x103 veces ms afines a la lectina Concanavalina A,
en comparacin con el metil -D-manopiransido (Figura I-18).72
-
Introduccin Captulo I
21
Figura I-18. Sntesis de copolmeros por polimerizacin por mettesis de apertura de anillo.
Por ltimo, tambin se han desarrollado ligandos multivalentes basados en nanopartculas
metlicas, fullerenos y nanotubos de carbono, cuyas propiedades pticas inherentes facilitan
su seguimiento para el estudio de las interacciones ligando-receptor.73
Como este tipo de ligandos multivalentes tiene un elevado nmero de ER, la estructura
tridimensional y la distribucin espacial de estos residuos no se puede controlar
satisfactoriamente. Esto resulta una desventaja para su uso en aplicaciones biomdicas ya que
la disposicin espacial de cada azcar en el sistema multivalente es un factor muy importante
para lograr un aumento considerable en la afinidad.
Ligandos de valencia intermedia
Los glicodendrmeros presentan ER unidos a estructuras hiper-ramificadas, constituidas
por unidades repetitivas enlazadas qumicamente a un core central. A diferencia de los
glicopolmeros, los glicodendrmeros tienen estructuras tridimensionales bien definidas y se
pueden sintetizar de una manera iterativa, ya sea convergente o divergente (Figura 19).
Figura I-19. Representacin esquemtica de dos estrategias sintticas para la preparacin de glicodendrmeros.
Sntesis convergente
Sntesis divergente
-
Tesis Doctoral Alejandro J. Cagnoni
22
Algunos dendrmeros con distintas funcionalidades como poli(amidoamina) (PANAM),
poli(propilen)imina y poligliceroles ya son comerciales y se pueden utilizar como core
dendrtico o como precursores de glicodendrmeros. La mayora no son txicos ni
inmunognicos. Como ejemplo, se puede destacar la sntesis divergente de un
glicodendrmero con 32 unidades del disacrido T-antignico (-D-Gal-(13)--D-GalNAc)
como ER unidas a una estructura central de PANAM por medio de enlaces de tipo amida y
tioter (Figura I-20).
Figura I-20. Glicodendrmero con 32 unidades del antgeno T sobre una estructura PANAM comercial.
Estructuras ramificadas con plataformas pequeas
La eficiencia y la especificidad de la interaccin lectina-ligando no slo depende del
nmero de ER sino tambin de la naturaleza de la plataforma y las caractersticas geomtricas
de la misma. Durante las ltimas dcadas se han preparado una gran variedad de ligandos
multivalentes de hidratos de carbono sobre distintas plataformas tales como anillos
aromticos, estructuras alifticas, calixarenos, porfirinas, pptidos y ciclodextrinas (Figura I-
21).
Este tipo de estructuras, de menor peso molecular que los glicopolmeros y
glicodendrmeros, permiten controlar la estructura tridimensional, la distribucin espacial de
21
-
Introduccin Captulo I
23
los ER, la valencia del ligando, la introduccin de grupos funcionales adecuados y el uso de
espaciadores convenientes. La optimizacin de estos parmetros permiti determinar factores
crticos como la geometra ptima para la asociacin y la distancia ptima entre los ER, lo que
result en muchos casos en un enorme aumento en la afinidad de los ligandos multivalentes
por la lectina.
Figura I-21. Ejemplos de plataformas para ligandos multivalentes.
5.4. Plataformas derivadas de hidratos de carbono
Comparado con los polmeros, dendrmeros, y las estructuras aromticas o peptidicas,
los hidratos de carbono como plataformas de ligandos multivalentes han sido mucho menos
explorados. Sin embargo, los azcares resultan plataformas sumamente interesantes por la
posibilidad de funcionalizar selectivamente los distintos grupos hidroxilo y fijar la orientacin
relativa de espaciadores y ER. Es por esto que estos ligandos multivalentes totalmente
derivados de carbohidratos se consideran ideales para determinar los requerimientos
geomtricos ptimos para la interaccin con las lectinas. Asimismo, para las aplicaciones in
vivo, estos ligandos presentan interesantes ventajas biolgicas, ya que se espera una mayor
hidrofilia y mejor farmacocintica que los ligandos multivalentes basados en plataformas
aromticas o polimricas, por mencionar un ejemplo.
En este contexto, se han desarrollado varias estrategias sintticas para la derivatizacin
de plataformas derivadas de hidratos de carbono. El grupo de Lindhorst y col.74 prepararon
-
Tesis Doctoral Alejandro J. Cagnoni
24
ligandos pentavalentes pseudosimtricos a partir de alil 2,3,4,6-tetra-O-alil-- y -D-
glucopiransidos con, por ejemplo, unidades de -manopiranosiltiourea como ER (Figura I-
22).
Figura I-22. Sntesis de un ligando pentavalente pseudosimtrico con -manopiranosiltiourea como ER.
Recientemente, se han sintetizado numerosos ligandos multivalentes con hidratos de
carbono como plataformas por reaccin click. La estrategia sinttica para la preparacin de
estos ligandos consiste en la modificacin de plataformas mono-, di- u oligosacardicas con
grupos azida o propargilo, para luego acoplarlas con ligandos glicosilados que tengan la
funcin complementaria.
A modo de ejemplo, Santoyo-Gonzlez y col.75 prepararon un ligando pentavalente
pseudosimtrico con un derivado propargilado de glucosa como plataforma, y galactosa o
lactosa como ER para estudios de adhesin celular (Figura I-23a). El grupo de Kovensky76
describi la azidacin directa de azcares para la obtencin de plataformas oligosacardicas
con grupos azida en un solo paso. Esto le permiti la preparacin de ligandos multivalentes
con unidades de maltosa, afines a la Concanavalina A (Figura I-23b).
-
Introduccin Captulo I
25
Figura I-23. Ligandos multivalentes con plataformas a) monosacardicas u b) oligosacardicas.
Otra alternativa muy interesante para la construccin de ligandos multivalentes sobre
plataformas derivadas de hidratos de carbono consiste en el uso de ciclodextrinas (CD), como
en los compuestos 43 y 44 (Figura I-24). Este tipo de plataformas tiene algunas propiedades
nicas tales como su gran simetra, que permite una presentacin radial de los ER, y su
cavidad hidrofbica en forma de cono truncado, que puede ser aprovechada para la formacin
de complejos de inclusin de drogas hidrofbicas para su vectorizacin en sistemas
biolgicos. A fin de introducir ER perifricos en estas plataformas macrocclicas, se han
descripto varias estrategias sintticas y se han utilizados distintos enlaces y precursores
glicosdicos, generalmente sin la necesidad del uso de grupos protectores para los hidroxilos.
Figura I-24. Ligandos multivalentes basados en plataformas de ciclodextrinas.
a) b)
-
Tesis Doctoral Alejandro J. Cagnoni
26
5.5. Mecanismos de interaccin multivalente
La mayora de los ligandos multivalentes que se sintetizaron mostraron un aumento en la
afinidad en comparacin con la del ligando monovalente correspondiente, expresada por mol
de residuo de azcar (valencia corregida). Este efecto fue descripto por primera vez por Lee y
col. en 1995 y se conoce como el Efecto Cluster Glicosdico o Efecto Multivalente.77
Se han descripto tres tipos de mecanismos diferentes para explicar el modo de interaccin
entre lectinas y ligandos multivalentes: i) formacin de quelatos; ii) efecto agregativo; iii)
difusin interna (Figura I-25).
Figura I-25. Representacin esquemtica de los mecanismos de interaccin multivalente: a) formacin de
quelatos; b) efecto agregativo; c) difusin interna.
Modo de interaccin de tipo quelato
Se puede observar un efecto quelato si la distancia entre los ER de un ligando
multivalente sinttico es compatible en longitud con dos de los sitios de unin de una lectina
multimrica (Figura I-25a). El efecto quelato est favorecido principalmente por el bajo costo
entrpico necesario para la unin de los ligandos as como tambin por la mayor probabilidad
de interaccin del segundo ligando, una vez que ya se uni el primero. Este efecto puede
aumentar mucho la afinidad de un ligando multivalente por su molcula blanco. En el ao
2000, Kitov y col.78 describieron la sntesis de un ligando decavalente con un ER trisacardico
que era reconocido por la subunidad pentamrica B5 de la Toxina Semejante a Shiga I (SLT-I)
de E. coli. Este compuesto, de estructura tipo estrella de mar, permite quelar cinco sitios de
b) a)
c)
-
Introduccin Captulo I
27
reconocimiento de la toxina y tiene una actividad inhibitoria de hasta 107 veces mayor que el
ligando monovalente (Figura I-26).
Figura I-26. Representacin del complejo formado entre 45 y la subunidad pentamrica B5 de la toxina SLT-I
de Escherichia coli.
Efecto agregativo
La formacin de agregados ligando-receptor es posible si el ligando multivalente posee
sus ER suficientemente distanciados como para que se unan a distintos receptores sin
impedimento estrico.
Las interacciones entre ligandos multivalentes y protenas receptoras (lectinas) permiten
la formacin de redes entrecruzadas que desencadenan procesos biolgicos tales como
mecanismos de traduccin de seales entre las clulas, reconocimiento de patgenos y
modulacin del crecimiento y diferenciacin celular (Figura I-27).26
a)
Proto-type Chimera-type Tandem-repeat type
-
Tesis Doctoral Alejandro J. Cagnoni
28
Figura I-27. a) Representacin esquemtica de las distintas redes entrecruzadas, b) procesos biolgicos
desencadenados por las interacciones entre protenas e hidratos de carbono sobre la superficie celular.
Difusin interna
El efecto de difusin interna se describe como un mecanismo en el cual el receptor va
deslizndose de un ER a otro anclado en la misma plataforma (Figura I-25c). Este
fenmeno est favorecido por la alta concentracin local del ligando en la proximidad del
receptor. Sin embargo, este mecanismo slo es posible si la afinidad entre el ligando y el
receptor no es demasiado alta, de manera que el proceso de asociacin-disociacin sea
reversible y, por lo tanto, el deslizamiento sea posible.
En general, el aumento en la afinidad para ligandos oligomricos con respecto a sus
contrapartes monomricas suele ser moderado. Sin embargo, para ligandos polimricos, el
proceso de deslizamiento debido a la difusin interna de la lectina a lo largo de la cadena
polimrica puede generar un gran aumento en la afinidad, como lo mostraron Brewer y col. en
glicoprotenas de tipo mucinas.79
6. Mtodos de estudio de interacciones protenas-hidratos de carbono
La determinacin de las constantes de afinidad Ka para las interacciones protenas -
hidratos de carbono no es una tarea sencilla y se han desarrollado mtodos variados para la
determinacin de estas afinidades que dan distintos niveles de informacin. En general, el
Interacciones clula-clula,
clula-matriz, clula-patgenos
Transduccin de seales, crecimiento,
diferenciacin y supervivencia celular
Regulacin de la segregacin de receptores b)
-
Introduccin Captulo I
29
objetivo de este tipo de estudios es poder relacionar la estructura del ligando con su afinidad
por la protena.
Ensayo de Inhibicin de la hemoaglutinacin (HIA)
Este ensayo semicuantitativo, descripto por primera vez en la dcada del 60, ha sido el
ensayo ms utilizado histricamente para la determinacin de inhibidores de lectinas. Est
basado en el descubrimiento de que las partculas virales formaban agregados con glbulos
rojos para formar una fase gelatinosa. Esto se debe a la presencia de lectinas en la superficie
celular que forman una red entrecruzada que favorece la precipitacin de los eritrocitos. El
agregado de ligandos que sean afines por la lectina disminuye la precipitacin. En principio,
se pueden utilizar clulas de una gran variedad de mamferos y aves, pero los eritrocitos de
pollo y cerdo son los ms habituales. El ensayo consiste entonces en el agregado de
concentraciones decrecientes de ligando y la determinacin de la mnima concentracin que
inhibe la reaccin de hemoaglutinacin.
El Test de Inhibicin de la Hemoaglutinacin resulta un ensayo sencillo, barato y rpido
que permite clasificar distintos ligandos en base a su afinidad. Sin embargo, presenta la
desventaja de que no permite determinar Ka sino el valor de la concentracin inhibitoria IC50.
Lamentablemente el error en la determinacin es grande y la reproducibilidad es baja.
Ensayo con lectinas ligadas a enzima (ELLA)
Este ensayo es una variante del conocido Ensayo por Inmunoabsorcin Ligado a Enzimas
(ELISA). El ligando soluble cuya afinidad se desea determinar compite con ligandos
inmovilizados por los sitios de unin de una lectina. Esta lectina se encuentra asociada a una
enzima, en general la peroxidasa del rbano (Horseradish peroxidase), que permite su
cuantificacin por medio de una reaccin colorimtrica.
En un ensayo tpico, se recubre una microplaca con un polisacrido de alto peso
molecular, y luego se agrega el complejo lectina-enzima y el ligando cuya afinidad se quiere
determinar. Por ltimo, se agrega un sustrato enzimtico que genera una reaccin
colorimtrica. La absorbancia, proporcional a la concentracin retenida de la lectina e
inversamente proporcional a la afinidad por el ligando soluble, se mide
espectrofotomtricamente y se determina el valor de IC50.
Comparado con el HIA, el ELLA tiene la ventaja de que requiere slo una pequea
cantidad de muestra y la IC50 se determina a partir de los datos de una curva de absorbancia
-
Tesis Doctoral Alejandro J. Cagnoni
30
en funcin de la concentracin, y no por un nico valor. Las desventajas de este ensayo
consisten en que no se logra determinar el valor de Ka y que adems la mayora de los
complejos lectina-enzima no son comerciales.
Resonancia Plasmnica de Superfice (SPR)
Se trata de un mtodo ms moderno y sofisticado que permite determinar la afinidad de
una lectina por un ligando inmovilizado sobre una superficie de oro. Se basa en una onda de
propagacin longitudinal llamada plasmn de superficie, que se genera en la superficie de
contacto entre un metal y un dielctrico. Cuando se hace incidir un haz de luz plano-
polarizada, el plasmn de superficie absorbe parte de esta luz en una manera cuantificable que
depende del espesor y las caractersticas de la superficie.
Esta tcnica presenta numerosas ventajas tales como que utiliza una mnima cantidad de
muestra, permite determinar tanto la constante de afinidad (Ka) como la constante de
disociacin (Kd) y se han desarrollado equipos de SPR acoplados a un espectro de masa
MALDI-TOF. Sin embargo, sta es una tcnica costosa ya que requiere del equipo SPR.
Adems, para obtener valores representativos y reproducibles se debe tener mucho cuidado en
la preparacin de las muestras a analizar, ya que pequeos cambios pueden generar valores
dispares.54
Calorimetra de Titulacin Isotrmica (ITC)
Durante la dcada del 90 se desarrollaron numerosos equipos comerciales de
Calorimetra de Titulacin Isotrmica (ITC), que se basan en la determinacin del calor
involucrado durante la unin del ligando al receptor.
El equipo cuenta con dos celdas, una de medicin y una de referencia que se encuentran
en equilibrio trmico. Tpicamente, en un experimento, se coloca una solucin de
concentracin conocida de lectina en la celda de medicin y se agrega una cantidad de ligando
desde una jeringa en series de 15-20 inyecciones (Figura I-28a). El agregado del ligando
perturba el equilibrio trmico dependiendo de la concentracin y del H de unin, y la aplicacin de un voltaje compensatorio devuelve las celdas al equilibrio. Por lo tanto, el
equipo mide unidades de potencia en funcin del tiempo. La integracin de los picos da lugar
a la curva de titulacin que relaciona directamente la entalpa del proceso con la
concentracin de ligando (Figura I-28b).54
-
Introduccin Captulo I
31
Figura I-28. a) Esquema de un equipo ITC; b) Datos crudos e integrados de un tpico experimento ITC.
La forma de la curva de titulacin es funcin de la concentracin de la lectina y la
constante de afinidad. Se debe asumir un modelo de unin para luego poder ajustar la curva a
los puntos experimentales y obtener los valores de Ka, H de unin y la estequiometra de la unin (n). El ajuste de la curva es ptimo cuando el valor adimensional c, producto de Ka y la
concentracin de sitios de unin, se encuentra entre 10 y 50, y es aceptable entre 1 y 1000
(Figura I-29). Esto genera un lmite prctico en el campo de aplicacin de la tcnica. Si la
afinidad no es muy buena, se requieren grandes cantidades de protena para obtener una curva
que se pueda ajustar de manera aceptable.
Figura I-29. Variacin de la curva de titulacin con el valor de c.
a) b)
-
Tesis Doctoral Alejandro J. Cagnoni
32
Una de las grandes ventajas de esta tcnica es que permite determinar la Ka y no el IC50,
por lo que se puede calcular el valor de G de unin. Asimismo, la ITC es la nica tcnica que permite determinar directamente los valores de H de unin y, adems, la estequiometra de la interaccin. A pesar de estas grandes ventajas, la ITC presenta algunas limitaciones. En
primer lugar, comparando con otras tcnicas, la cantidad de protena requerida es alta (del
orden de los miligramos). En segundo lugar, la calorimetra no brinda informacin sobre la
estructura protena-ligando. Paradjicamente, este dato es crucial ya que se debe suponer un
modelo de unin para poder ajustar la curva y determinar los parmetros termodinmicos de
la unin.
7. Referencias
(1) Varki, A.; Cummings, R. D.; Esko, J. D.; Freeze, H. H.; Stanley, P.; Bertozzi, C. R.;
Hart, G. W.; Etzler, M. E. Essentials of Glycobiology; Cold Spring Harbor Laboratory Press:
New York, 2009.
(2) Taylor, M. E.; Drickamer, K. Introduction to Glycobiology; Oxford University Press:
New York, 2011.
(3) Gabius, H. J. Adv. Drug Deliver. Rev. 2004, 56, 421-424.
(4) Gabius, H.-J. The Sugar code : fundamentals of glycosciences; Wiley-Blackwell:
Weinheim, 2009.
(5) Davies, G.; Henrissat, B. Structure 1995, 3, 853-859.
(6) Borges de Melo, E.; da Silveira Gomes, A.; Carvalho, I. Tetrahedron 2006, 62, 10277-
10302.
(7) Heightman, T. D.; Vasella, A. T. Angew. Chem. Int. Ed. 1999, 38, 750-770.
(8) Griesser, H.-W.; Mller-Hill, B.; Overath, P. Eur. J. Biochem. 1983, 137, 567-572.
(9) Spiwok, V.; Lipovov, P.; Sklov, T.; Buchtelov, E.; Haek, J.; Krlov, B.
Carbohydr. Res. 2004, 339, 2275-2280.
(10) Jacobson, R. H. Z., X.-J.; DuBose, R. F.; Matthews, B. W. Nature 1994, 369, 6.
(11) Matthews, B. W. C. R. Biol. 2005, 328, 549-556.
(12) Juers, D. H.; Heightman, T. D.; Vasella, A.; McCarter, J. D.; Mackenzie, L.; Withers,
S. G.; Matthews, B. W. Biochemistry 2001, 40, 14781-14794.
(13) Segel, I. H. Enzyme Kinetics. Behavior and analysis of rapid equilibrium and steady-
state enzyme systems; John Wiley & sons, inc.: New York, 1993.
(14) Ibatullin, F. M.; Shabalin, K. A.; Ja, J. V. Tetrahedron Lett. 2001, 42, 4565-4567.
-
Introduccin Captulo I
33
(15) Ibatullin, F. M.; Shabalin, K. a.; Jnis, J. V.; Shavva, A. G. Tetrahedron Lett. 2003,
44, 7961-7964.
(16) Uhrig, M. L.; Manzano, V. E.; Varela, O. Eur. J. Org. Chem. 2006, 2006, 162-168.
(17) Witczak, Z. J.; Kaplon, P.; Markus Dey, P. Carbohydr. Res. 2003, 338, 11-18.
(18) Hashimoto, H.; Shimada, K.; Horito, S. Tetrahedron Lett. 1993, 34, 4953-4956.
(19) Szilgyi, L.; Varela, O. Curr. Org. Chem. 2006, 10, 1745-1770.
(20) Montero, E.; Garca-Herrero, A.; Asensio, Juan L.; Hirai, K.; Ogawa, S.; Santoyo-
Gonzlez, F.; Caada, F. J.; Jimnez-Barbero, J. Eur. J. Org. Chem. 2000, 2000, 1945-1952.
(21) Garca-Herrero, A.; Montero, E.; Muoz, J. L.; Espinosa, J. F.; Vin, A.; Garca, J. L.;
Asensio, J. L.; Caada, F. J.; Jimnez-Barbero, J. J. Am. Chem. Soc. 2002, 124, 4804-4810.
(22) Ambrosi, M.; Cameron, N. R.; Davis, B. G. Org. Biomol. Chem. 2005, 3, 1593-1608.
(23) Lis, H.; Sharon, N. Chem. Rev. 1998, 98, 637-674.
(2