LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ...
Transcript of LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ...

4
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER
Dra. Rommy von Bernhardi M. (1)
(1) Profesor Adjunto. Laboratorio de Neurociencias. Departamento de Neurología.Financiamiento: proyectos FONDECYT 1040831 y DIPUC.Correspondencia: [email protected]
Figura 1. Cambios celulares en el envejecimientoEl envejecimiento induce múltiples cambios funcionales y estructurales. Varios de estos cambios se relacionan a inflamación y estrés oxidativo. En general, hay cambios adaptativos que mantienen una función adecuada. Sin embargo, si estos mecanismos fallan o son insuficientes para compensar los cambios deletéreos, pueden generar alteraciones en la función glial y neuronal.
RESUMEN
La Enfermedad de Alzheimer (EA) es la causa principal de demencia. Se postulan múltiples mecanimos fisiopatológicos para explicar el deterioro cognitivo: la toxicidad del Aβ, disfunción colinérgica, alteraciones de Tau, daño oxidativo, disfunción sináptica e inflamación secundaria a las placas. En el laboratorio de Neurociencia planteamos que la inflamación y el estrés celular asociados al envejecimiento participan en el desarrollo de la EA, cuyo evento patogénico central involucraría una disfunción glial.
La asociación de la neuroinflamación con la EA está avalada por estudios neuropatológícos y epidemiológicos. Sin embargo, sigue siendo una incógnita si la inflamación es causa o consecuencia del proceso neurodegenerativo. La inflamación favorece el procesamiento defectuoso del beta-amiloide (Aβ) y de la proteína precursora del amiloide, (APP), favoreciendo la agregación del Aβ, pero también modificando la reactividad al Aβ. Hemos observado que la reactividad microglial al APP y Aβ es baja, pero se potencia en condiciones pro-inflamatorias, indicando que la citotoxicidad dependería de la capacitación inflamatoria de la glía. Proponemos que la acumulación del Aβ, el estrés oxidativo, la disfunción sináptica y la neurodegeneración dependen del estatus inflamatorio del sistema nervioso, que gatilla la desregulación de la activación glial. Los resultados del laboratorio de Neurociencia apoyan nuestra hipótesis que la inflamación es tanto un gatillante de la acumulación del Aβ como una de las causas principales de neurodegeneración en la EA.
La respuesta disfuncional de la glía, además de ser causa de la EA, probablemente participa también en la patogenia de otros desórdenes neurodegenerativos.
ENFERMEDAD DE ALZHEIMER – UNA VISIÓN GENERAL
La EA es la causa de demencia más frecuente. Su neuropatología muestra cambios neurodegenerativos asociados con agregados de β-amiloide (Aβ) en ciertas áreas corticales (1). Evidencias clínicas y experimentales indican que no es una entidad nosológica única, presentando heterogeneidad en sus factores de
riesgo, patogénesis y características neuropatológicas.
Hace 100 años, Alois Alzheimer describió dos lesiones neuropatológicas características, el depósito extracelular de Aβ fibrilar (conteniendo diferentes proteínas, metales y compuestos reactivos), denominado placa amiloidea o senil, y los ovillos neurofibrilares intracelulares constituidos por proteína Tau hiperfosforilada (2). Ambas lesiones están íntimamente asociadas con microglías y astrocitos activados. Sin embargo, persiste la pregunta ¿son las placas y ovillos causa de la enfermedad, o son resultado de otros eventos primigenios del Alzheimer?
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.

5
Figura 2. Modulación de la reactividad mediada por la interacción Neurona-glía – efecto del envejecimiento.A. En condiciones basales, la homeostasis del SNC es mantenida por la modulación recíproca de glías y neuronas. Astrocitos y microglías secretan factores de crecimiento y citoquinas. Las citoquinas pro-inflamatorias inducen la producción de NO y ROS, los que pueden producir daño celular. Neuronas y astrocitos modulan la actividad microglial, reduciendo su actividad inflamatoria (-). Factores como el TGF-β, inducido también por las condiciones inflamatorias, modulan la activación de la glía. B. En el envejecimiento, disminuye el soporte trófico y la actividad moduladora de neuronas y astrocitos. Se produce una mayor activación microglial, con mayor secreción de citoquinas pro-inflamatorias, óxido nítrico y radicales de oxígeno. El TGF-β también está incrementado, pero aparentemente sus vías de transducción están deprimidas. Sobre esta situación pro-inflamatoria, se agregan estímulos adicionales como la hipoxia y diversas formas de injuria que aumentan la activación glial (+).
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.
El Aβ se origina por el procesamiento
proteolítico de la proteína precursora del
amiloide, (APP). La mayoría es procesada
por la proteasa α-secretasa, generando
un APP soluble que tendría actividad
neurotrófica. En contraste, el Aβ es
producido por la acción secuencial de la
β-secretasa y ϒ-secretasa (3), generando
mayoritariamente péptidos amiloidogénicos
de 40 y 42 aminoácidos. Los mecanismos
de daño por Aβ son múltiples y aún objeto
de debate. El Aβ muestra toxicidad in vitro
e in vivo (4,5), y puede ser directa (6,7) o
indirecta a través de la activación glial (8-
10).
La acumulación de Aβ no constituye
necesariamente una placa senil (11).
Existen depósitos corticales extensos de
Aβ (difusos y sin respuesta inflamatoria)
en ancianos cognitivamente preservados
(12), sugiriendo que se requieren factores
adicionales para hacerse patológicos. La
severidad de la demencia se correlaciona
pobremente con la cantidad de placas. Su
correlación con los ovillos neurofibrilares es
mejor, pero éstos serían eventos patológicos
tardíos (13).
Los estudios genéticos revelan mutaciones
en 3 genes, el del APP y de dos presenilinas
(PS1 y PS2, correspondientes a la ϒ-
secretasa). Estas mutaciones aumentan la
producción de Aβ (14) y constituyen las
EA familiares que agrupan al 3-5% de
los pacientes. Además, el alelo E4 de la
Apo-lipoproteína (apoE4), implicada en
la remoción del Aβ, y polimorfismos de
citoquinas (fortaleciendo la participación
de la inflamación), serían factores de riesgo
importantes para la EA.
Este manuscrito presenta el trabajo del
laboratorio de Neurociencia, en el contexto
del estudio de los mecanismos patogénicos
de la EA. Nuestro interés es el estudio de la
neuroinflamación y la participación de la
glía en este proceso. Dada la complejidad
de los mecanismos involucrados, y la
variedad de proposiciones mecanicistas
existentes, el trabajo está dividido en 7
secciones temáticas.
I. ENVEJECIMIENTO Y ENFERMEDAD DE ALZHEIMER
El envejecimiento es el factor de riesgo principal para la EA. Su prevalencia aumenta del 1-3% a los 60-70 años, al 25-35% en mayores de 85 (15). Estudios anatomopatológicos muestran una incidencia aún mayor de lesiones y revelan que la EA frecuentemente se asocia con otras patologías, como la demencia vascular (16). Esta sobreposición sugiere la existencia de mecanismos fisiopatológicos comunes, destacándose la activación glial y el incremento de mediadores inflamatorios. Múltiples cambios asociados al envejecimiento favorecen las enfermedades neurodegenerativas (Fig. 1) (17), como son la disminución de factores de crecimiento (18) y las alteraciones vasculares. Hay cambios en la homeostasis del parénquima cerebral (19), induciendo la expresión del APP (20), el aumento de su procesamiento amiloidogénico (21) y una respuesta inflamatoria (22), con aumento del óxido nítrico (NO), citoquinas (23), estrés oxidativo y reactividad microglial (Fig. 2).

BOLETÍN ESCUELA DE MEDICINA U.C., PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE VOL. 32 Nº1 2007
6
El envejecimiento disminuye la capacidad de degradación y aumenta el potencial oxidativo del Aβ, reduciendo el potencial redox. También modifica la reactividad al Aβ. El Aβ inyectado en el cerebro de monos jóvenes no induce daño. En cambio, causa muerte neuronal y activación microglial en monos añosos (6). Esto sugiere la existencia de cambios con la edad que incrementarían la reactividad al Aβ.
II. INFLAMACIÓN Y ENFERMEDAD DE ALZHEIMER
La inflamación está involucrada en múltiples mecanismos patológicos de la EA (10, 24-28). Estudios clínico-patológicos y de neuroimagen muestran que la inflamación y activación microglial preceden al daño neuronal (29), y que el estrés oxidativo ocurre previo a la citopatología de la EA (30). La Interleuquina-1β (IL-1β), el Factor de Crecimiento Transformante-β (TGF-β) y la ciclo-oxigenasa inducible (COX-2) cerebrales están elevadas en la EA (31). Evidencia epidemiológica (32) y modelos experimentales (33-34) muestran que las condiciones pro-inflamatorias promueven el desarrollo de EA, mientras que el tratamiento anti-inflamatorio crónico modifica la incidencia de la EA (35-36).
No sería la acumulación de Aβ, sino la respuesta inflamatoria al Aβ, la responsable del daño neuronal en la EA. Si bien la inflamación puede ser neuroprotectora en sus estadios tempranos (37), la incapacidad de resolver el estímulo activante puede resultar en una respuesta inflamatoria crónica. La sobre-activación microglial subsiguiente se hace deletérea induciendo la liberación de citoquinas (38). La glía que rodea las placas amiloideas, o la que es expuesta a Aβ in vitro, secreta moléculas pro-inflamatorias incluyendo Factor de Necrosis Tumoral-α, (TNF-α), IL-1β, MCP-1, RANTES (39) y eicosanoides (40). Estas moléculas pueden potenciar la neurodegeneración al aumentar la
sensibilidad neuronal a los radicales libres (41). La óxido nítrico sintasa inducible (iNOS) aumenta en la neuroinflamación (42) y está elevada en la EA (43). Además de su citotoxicidad, TNF-α, TGF-β1 e IL-1β también estimulan la síntesis (44-45) y procesamiento amiloidogénico del APP (46).
El Aβ también tendría un papel en la función y patología sináptica (47), pudiendo inducir su degeneración (48), promoviendo la liberación de neurotransmisores excitatorios, aumentando el calcio intracelular y la producción de especies reactivas de oxígeno (ROS). Por otro lado, las citoquinas también afectan la regulación sináptica. Los efectos son variables dependiendo de la concentración de citoquinas y de factores ambientales. Mientras IL-1β participa en mecanismos de memoria en condiciones fisiológicas, a concentraciones elevadas altera la memoria y la plasticidad neuronal (49), induciendo depresión sináptica (50).
III. CITOQUINAS PRO- Y ANTI-INFLAMATORIAS
Glías y neuronas expresan constitutivamente citoquinas, las que participan en comportamientos complejos y modulan variadas funciones, incluyendo la homeostasis y metabolismo celular, la función y plasticidad sináptica, y la transmisión neural. En respuesta a injuria, infección, o diversas condiciones de estímulo, glías y neuronas producen más quimioquinas, citoquinas -TNF-α, IL-1, IL-6, IFN-ϒ IL-10 y TGFβ- y prostaglandinas.
Además de amplificar la respuesta inflamatoria, las citoquinas también inducen la liberación de factores neuroprotectores (51). Así, el resultado final dependerá del perfil de secreción de citoquinas y otros factores del microambiente. Por ejemplo, IL-1β es un pro-inflamatorio que induce la expresión de iNOS y la producción de NO
mediado por la activación de la quinasa regulada por señales extracelulares (ERK) y NFkB (52), puede tanto contribuir a como limitar la neurotoxicidad (53). Liberada en cantidades pequeñas (54), promueve la remielinización (55) y la sobrevida neuronal (56). La IL-1β aumenta en el envejecimiento, asociada al aumento de la reactividad glial. En la EA, su expresión es inducida temprano (25, 53).
TNF-α tiene efectos pleiotrópicos en las neuronas, incluyendo efectos tóxicos (57) y protectores (58) y la modulación de la neurotransmisión. Su expresión en el SNC normal es controvertida (59). Cuando es inducida por daño, el TNF-α tiene un papel clave como mediador de muerte celular, estando implicada en la patogénesis de muchas enfermedades neurológicas. Sin embargo, también cumpliría un papel protector en modelos de enfermedades desmielizantes y daño traumático (60).
El IFN-ϒ es el mediador central en las enfermedades autoinmunes, aunque también previene la muerte celular de neuronas deprivadas de Factor de Crecimiento Neural (NGF) (61). Además, en combinación con LPS, IFN-ϒ previene la apoptosis inducida por Aβ en cultivos hipocampales (Fig. 3); efecto que se asocia al aumento de TGF-β1 y depende de la activación de astrocitos (4).
TGF-β1 presenta funciones múltiples (62), incluyendo papeles prominentes en el desarrollo, homeostasis y reparación (25). Existen concentraciones bajas de TGF-β1 en el SNC normal, mientras su expresión aumenta en el envejecimiento, aparentemente secundario a la activación glial (63), y en múltiples patologías (64-66). TGF-β1 sería citoprotectora, siendo sintetizada en respuesta a insultos como la isquemia (67) y la neurotoxicidad inducida por Aβ. Su efecto neuroprotector puede ser directo e indirecto, previniendo la sobreactivación microglial (66, 68-69). TGF-β1 modula la producción de NO y radicales superóxido (70), e inhibe la

7
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.
Figura 3. Neurotoxicidad del Aβ in vitro – efecto de factores pro-inflamatorios. Cambios morfológicos de neuronas hipocampales en cultivo. Las neuronas fueron marcadas con �-tubulina III y anticuerpo secundario conjugado con HRP. Los cultivos fueron expuestos a condición control, 2 µM Aβ1–42 (Aβ), 2 µM A� + 1 µg/ml LPS + 10 ng/ml IFN-ϒ(Aβ+ LI) por 24 h. Las imágenes son campos representativos de 4 preparaciones. Las neuronas expuestas a Aβ mostraban un número y longitud de neuritas reducidos comparados al control. El tratamiento con moléculas inflamatorias tenía un efecto protector.
producción de IL-1, TNF-α e IFN-ϒ , y la liberación de NO (71-72).
Tanto citoquinas anti-inflamatorias (TGF-β), como pro-inflamatorias (IL-1β y TNF-α), modulan la activación glial. Nosotros observamos que TGF-β1 e IL-1β, pero no TNF-α, disminuyen la producción de NO en cultivos gliales murinos (73).
Determinamos que la vía de transducción de señales ERK (MAPK) participa en esta modulación. IL-1β y TGF-β1 inhiben la activación de ERK mediada por IFN-ϒ con diferente cinética. La inhibición por IL-1β es rápida y transitoria (30 min) y es prolongada (24 h) con TGF-β1, el cual inhibe la fosforilación de ERK de manera persistente después de horas de activación (73). La modulación de ERK por TGF-β1 e IL-1β podrían regular la amplitud y duración de la activación glial. La inhibición diferencial de la activación microglial por citoquinas inflamatorias sugiere que la temporalidad jugaría un papel clave en la determinación de la respuesta celular. La IL-1β, inducida tempranamente y con efecto autocrino, podría mediar la auto-regulación de la activación microglial.
IV. PARTICIPACIÓN DE LA GLÍA EN LAS ENFERMEDADES
NEURODEGENERATIVAS
Las microglías son células
inmunocompetentes derivadas de
monocito-macrófagos residentes del
sistema nervioso central (SNC), cuyas
características morfofuncionales les
conferirían múltiples papeles en la EA
(Fig. 4). Sintetizan numerosas citoquinas
responsables de la regulación autocrina y
la comunicación con neuronas, astrocitos e
infiltrados leucocitarios (38). Su activación
incluye proliferación, transformación
fagocítica, aumento de moléculas activas,
liberación de citoquinas y factores de
crecimiento, y producción de mediadores
como el NO (y eventualmente ROS).
La activación microglial probablemente
es tanto beneficiosa como dañina (74).
Inicialmente, la microglía activada es
neuroprotectora (75). Sin embargo, cuando
la activación es persistente, la microglía se
hace citotóxica (69).
La Tomografía por Emisión de Positrones
(PET) muestra activación microglial en regiones corticales, incluso en estadios tempranos de EA (76), lo que ha sido corroborado en autopsias (77). La evolución de los depósitos de amiloide hacia placas seniles se acompaña de activación microglial (78-79). El papel de estas microglías es controversial, dada la evidencia de su
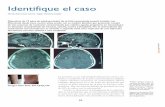
Figura 4. Posibles mecanismos patogénicos mediados por la glía. Doble inmunofluorescencia de un cultivo hipocampal marcado con proteína fibrilar glial acídica (GFAP, marcador de identidad de astrocitos) y lectina (marcador de microglía). Se enuncian diversas funciones gliales que podrían estar involucradas en la génesis o evolución de la EA. En especial las dependientes de su función fagocítica/metabólica y las dependientes de la secreción de mediadores inflamatorios.

BOLETÍN ESCUELA DE MEDICINA U.C., PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE VOL. 32 Nº1 2007
participación tanto en la fagocitosis (80), como en el depósito de Aβ (29, 79). Las microglías asociadas a las placas generan estrés oxidativo. El Aβ (38, 75) induce producción de O2
- mediado por explosión respiratoria (25), y secreción de factores solubles inductores de muerte celular (82). Dicha citoxicidad persiste por varios días (10). Entre los factores identificados, hay citoquinas (IL-1, IL-6 y TNF-α), quimioquinas (IL-8, MCP-1 y MIP-1) y factor de crecimiento M-CSF (83). Así, la neurotoxicidad mediada por microglías depende tanto de ROS como de citoquinas (84-85). En contraste, nosotros observamos que microglías expuestas a Aβ in vitro generan poco ROS y un aumento discreto de nitritos, lo cual es inhibido en presencia de astrocitos. En cambio, las moléculas pro-inflamatorias inducen una gran producción de NO en astrocitos y microglías (86). Esta
Figura 5. Reactividad glial al Aβ y APP - efecto de factores pro-inflamatorios. La concentración de nitritos (NO2- , un producto estable del NO) en el medio de cultivos microgliales (MG) o gliales mixtos (MX) después de 1-4 días en cultivo fue determinada por el ensayo de Griess. Células no-estimuladas (Control). Expuestas a 2 µM Aβ1-42 (Aβ), 1 µg/ml LPS + 10 ng/ml IFNϒ (LI), APP (APP) o ambos (Aβ-LI), (APP-LI) por 1 y 4 días. Las barras corresponden al promedio+SEM de 4-13 experimentos independientes en triplicado. *, ** Indican valores estadísticamente diferentes al control. (*= p<0.05; **= p<0.01). # indican valores estadísticamente diferentes comparado entre las condiciones señaladas (Mann-Whitney U-Test).
activación inflamatoria también induce neurotoxicidad en cultivo (Fig. 5), en un proceso lento que requiere varios días de estimulación (73). Aβ y LPS+IFN-ϒ tienen un efecto sinérgico, tanto en microglías como en cultivos gliales mixtos (10). De manera análoga, la reactividad glial al APP es potenciada en condiciones pro-inflamatorias (Fig. 6). Este sinergismo entre el Aβ/APP y pro-inflamatorios nos llevó a postular que las microglías expresarían reactividad al Aβ/APP sólo bajo ciertas condiciones, las cuales determinarían que la microglía deje de responder al efecto modulador de los astrocitos. Esto podría ser crítico, considerando que microglías y astrocitos se activan en el envejecimiento y en la mayoría de las enfermedades del SNC.
Los astrocitos son el soporte estructural y trófico del SNC (87). Necesarios para la
mantención neuronal, y la formación y modulación de sinapsis, también juegan un papel importante en la inflamación (88). Su activación induce quimioquinas, citoquinas y factores neurotróficos como el factor de crecimiento neural (NGF), S100β, factor de crecimiento derivado del cerebro (BDNF) y neurotrofinas (89).
En la EA, la activación astrocitaria es prominente alrededor de las placas. Microglías y astrocitos trabajan en forma cooperativa ejerciendo regulación mutua (4, 73), contribuyendo a la respuesta inflamatoria local (90). En modelos experimentales, los astrocitos modulan la citotoxicidad microglial (4, 10, 91), aunque hay discusión respecto a si inducen neurotoxicidad o neuroprotección (92). Si bien los astrocitos no producen ROS (93, 94) y cumplen funciones neuroprotectoras (4, 10, 88, 95), también secretan mediadores pro-inflamatorios como IL-1, MCP-1, RANTES y TNF-α (95), producen NO al ser estimulados por Aβ, y potencian daño en la EA (96-97). Nuestros resultados sugieren que los astrocitos tendrían un papel neuroprotector en su activación temprana. En cambio, en estadios tardíos, la alteración de su capacidad moduladora o su inhabilidad de modular la activación persistente, potenciaría la citotoxicidad.
V. MODULACIÓN DE LA ACTIVACIÓN GLIAL: GLÍAS Y
NEURONAS
Glías y neuronas modulan mutuamente su función (Fig. 2). Las neuronas proveen retroalimentación, regulando la producción de factores solubles y proteínas asociadas a la gliosis reactiva. De manera recíproca, microglías y astrocitos producen factores tróficos y moléculas de la matriz extracelular necesarias para la neurona, de tal manera que su inhibición o bloqueo induce apoptosis. Además, citoquinas secretadas por la microglía activan la secreción de factores de crecimiento por
8

Figura 6. Cambios en la interacción glial con el APP inducidos por factores pro-inflamatorios. Efecto de Aβ, biotin-APP y moléculas pro-inflamatorias en el metabolismo de reducción en glías. Condiciones control (Control), expuestas por 24 h a 0.2, 2 o 10 µM Aβ (Aβ), 2 o 10 µM Aβ y LPS+IFNϒ (Aβ+LI), 0.2 µM biotin-APP (APPb), 0.2 µM biotin-APP y LPS+IFNϒ (APPb+LI). Cambios en reducción de 3-[4,5-dimetiltiazol-2-yl]-2,5-difeniltetrazolium bromuro (MTT) inducidos por las diversas condiciones experimentales fueron expresados como porcentaje de la actividad medida en condiciones control. El Aβ disminuye la reducción glial del MTT. La disminución es mayor en la microglía. En contraste, la actividad reductora no cambia en células expuestas a APP o LPS+IFNϒ. Sin embargo, exposición a APP y LPS+IFNϒ produjo una disminución dramática del metabolismo reductor. Los valores corresponden al promedio±SEM de 4–6 experimentos independientes en triplicado expresados como porcentaje del control. *P<0.05; **P<0.01 comparado al control; ##P<0.01 comparado entre las condiciones experimentales indicadas).
los astrocitos. Estas interacciones también
son importantes en la EA (98). Condiciones
que afectan la función neuronal pueden
alterar la modulación glial. Mientras
neuronas activas saludables disminuyen la
activación glial (99), las neuronas dañadas
inducen su activación (100), mediada por la
producción de mediadores inflamatorios.
La actividad citotóxica microglial es
modulada de múltiples maneras, incluyendo
la inducción de enzimas antioxidantes,
como catalasa y superóxido dismutasa,
y citoquinas anti-inflamatorias como IL-
1Ra, IL-4, IL-10 y TGF-β1. Su actividad
también es modulada por los astrocitos. Los astrocitos atenúan la producción de radicales y TNF-α (95), reducen la activación microglial por Aβ (91) y alteran su actividad fagocítica (101). También disminuyen la citotoxicidad del Aβ, tanto en forma directa (4) como indirecta a través de la modulación microglial (10). El TGF-
β1 sería uno de los factores moduladores, disminuyendo la producción glial de O2- y NO. La inmunoneutralización con anticuerpos específicos para TGF-β1 elimina el efecto protector (70). En conjunto, estos resultados sugieren que los astrocitos son elementos clave en la modulación de
la inflamación en el SNC. Las alteraciones de las funciones reguladoras de los astrocitos activados podrían representar un mecanismo patogénico importante en las enfermedades neurodegenerativas.
VI. RECEPTORES QUE MEDIAN LA INTERACCIÓN CELULAR CON Aβ
Hay evidencia que oligómeros de Aβ pueden alterar la función sináptica in vivo, aunque los receptores que median estos efectos no están identificados. Diversas proteínas de membrana podrían participar activando vías de señalización (102-103). Sin embargo, se desconoce si el Aβ se une a unos pocos receptores neuronales específicos o afecta múltiples receptores u otras proteínas necesarias para la señalización. La unión del Aβ a los Receptores Scavenger (RS) podría ser especialmente relevante para entender la asociación de la inflamación con la EA (104). La expresión de RSs cambia con distintas condiciones fisiopatológicas. Por ejemplo, RS-A es expresado por microglías activadas en la vecindad de las placas seniles (105). La unión del Aβ se relaciona al incremento en la expresión de algunos RS, la secreción
de quimioquinas y citoquinas cómo IL-1β, la inducción de explosión respiratoria con liberación de ROS y la activación de varias vías de transducción de señales.
La unión de Aβ al receptor para
productos avanzados de glicación terminal
(RAGE), induce su expresión, estrés
oxidativo y producción de citoquinas
(83), mediado por la activación de NFkB.
Esta retroalimentación positiva puede
contribuir a la inflamación crónica y
al daño tisular. La unión al receptor de
macrófagos con estructura colagenosa
(SR-MARCO), (106), RS-A (107-108),
RS-B, (104) y CD36 también se asocia a
activación inflamatoria. La señalización
dependiente de CD36 involucra la Src
quinasa, los mediadores inflamatorios
Lyn y Fyn, y proteína quinasas activadas
9
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.

BOLETÍN ESCUELA DE MEDICINA U.C., PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE VOL. 32 Nº1 2007
Figura 7. Desregulación Glial: un mecanismo neurobiológico alternativo en la patogénesis de la enfermedad de Alzheimer.Secuencia hipotética de eventos en la cascada patogénica de la EA. La agregación del Aβ puede depender del aumento de la producción o de la reducción de la remoción del Aβ. Ambos mecanismos pueden ser asociados al envejecimiento, al estrés oxidativo y al estatus inflamatorio del sistema nervioso, el cual también puede influir en la función sináptica y eventualmente en la viabilidad neuronal.
por mitógenos p44/42 (109). La unión a los receptores relacionados a receptores de unión a lipoproteínas de baja densidad (LRP) participaría en la depuración del Aβ. De hecho, los niveles de LRP cortical están aumentados en más del 80% en la EA (110).
A diferencia de la microglía que expresa una gran variedad de RS, los astrocitos sólo expresan RS-BI (93), receptor de manosa (111) y RS-MARCO (106). Se sabe muy poco sobre la señalización de RS-MARCO, aunque la unión de ligandos a RS-A estimula la activación de PI3-quinasa, proteína-tirosina quinasa y MAPKs (107-108). El estudio de las vías de transducción de señales activadas por la unión del Aβ a los RSs debería ayudar a clarificar cómo se asocia la inflamación a la activación de los RSs.
VII. RECAPITULACIÓN
El envejecimiento del SNC se asocia a un estado pro-inflamatorio que induce cambios funcionales gliales, modificando la reactividad del SNC, lo que podría favorecer la progresión de procesos neurodegenerativos. Esto nos llevó a proponer un modelo patogénico alternativo para la EA (Fig. 7). Hay evidencia sólida que la EA es de naturaleza compleja y se extiende más allá de las placas amiloideas y los ovillos neurofibrilares. Nosotros proponemos que la acumulación del Aβ es consecuencia y no causa en la patogénesis de la EA. La microglía es necesaria como células scavenger en el SNC. Sin embargo, si deja de responder a los mecanismos regulatorios o se altera su capacidad de remover el Aβ, la microglía puede hacerse citotóxica, perdiendo la capacidad de proveer acciones beneficiosas como la remoción del Aβ (112), la secreción de factores tróficos y la reducción de factores tóxicos.
La activación glial por Aβ es amplificada notoriamente por la capacitación
inflamatoria de la glía. Además, la modulación de la reactividad microglial al Aβ por los astrocitos parece perderse en condiciones pro-inflamatorias (10), fortaleciendo la noción que la inflamación puede ser un factor determinante en la sobre-activación microglial. La pérdida de regulación cambia cualitativa y cuantitativamente la activación microglial, lo a su vez aumentaría la agregación y citotoxicidad del Aβ, estableciendo un círculo vicioso.
Las evidencias discutidas en este manuscrito apoyan nuestra hipótesis que la desregulación glial da origen a la citotoxicidad y al proceso neurodegenerativo en la EA. La determinación de los receptores que median y regulan la activación microglial y la comprensión de los mecanismos moleculares activados por estos receptores son necesarias para generar mejores maneras para tratar y prevenir estas enfermedades. Dado que la interacción del
Aβ con los RS podría mediar la activación glial, uno de nuestros intereses es dilucidar las vías de señalización activadas por los RS, las cuales podrían mediar diversas respuestas celulares dependiendo del estado de activación.
RECONOCIMIENTO:
Mis agradecimientos por su trabajo a los tesistas de pregrado y doctorado, Rodrigo Herrera-Molina, Katherine Saud, Carolina Fuenzalida, Bárbara Godoy, Loreto Olavarría y Juan Tichauer; a los alumnos de pregrado de medicina, bioquímica y biología y a los miembros estables del laboratorio, actuales y pasados, Gigliola Ramírez, y Rodrigo Alarcón.
REFERENCIAS
1. Hardy, J., Selkoe, D.J. The amyloid hypothesis of Alzheimer’s disease: progress
10

and problems on the road to therapeutics. Science 2000; 297: 353-356.
2. Selkoe, D.J.. Amyloid beta-protein and the genetics of Alzheimer’s disease. J. Biol. Chem 1996; 271: 18295-18298
3. Haass, C. Take five-BACE and the gamma-secretase quartet conducts Alzheimer’s amyloid beta-peptide generation. EMBO J 2004; 23: 483-488.
4. Ramírez, G., Toro, R., Döbeli, H., von Bernhardi, R. Protection of rat primary hippocampal cultures from Aß cytotoxicity
by pro-inflammatory molecules is mediated
by astrocytes. Neurobiol Disease 2005; 19:
243-254.
5. Walsh, D.M., Hartley, D.M., Kusumoto,
Y., Fezoui, Y., Condrom, M.M. et al..
Amyloid beta-protein fibrillogenesis.
Structure and biological activity of
protofibrillar intermediates. J. Biol.
Chem.1999; 274: 25945-25952.
6. Geula, C., Wu, C.K., Saroff, D., Lorenzo,
A., Yuan, M. et al. Aging renders the
brain vulnerable to amyloid beta-protein
neurotoxicity. Nat. Med. 1998; 4: 827-831.
7. Lambert, M.P., Barlow, A.K., Chromy,
B.A., Edwards, C., Freeds, R. et al.
Diffusible, nonfibrillar ligands derived
from Aβ1-42 are potent central nervous
system neurotoxins. Proc. Natl. Acad. Sci.
USA 1998; 95: 6448-6453.
8. Meda, L., Cassatella, M.A., Szendrei,
G.I., Otvos, J.L., Baron, P. et al. Activation
of microglial cells by beta-amyloid protein
and interferon-gamma. Nature 1995; 374:
647-650.
9. Ishii, K., Muelhauser, F., Liebl, U., Picard,
M., Kuhl, S. Subacute NO generation
induced by Alzheimer’s beta-amyloid in
the living brain: reversal by inhibition of
the inducible NO synthase, FASEB J. 2000;
14: 1485-1489.
10. von Bernhardi, R., Eugenín, J. Microglia
- astrocyte interaction in Alzheimer’s
disease: modulation of cell reactivity to Aβ.
Brain Res. 2004; 1025: 186-193.
11. Dickson, D.W. The pathogenesis of senile plaques. J. Neuropathol. Exp. Neurol. 1997; 56: 321-339.
12. Knopman, D.S., Parisi, J.E., Salviati, A., Floriach-Robert, M., Boeve, B.F. et al. Neuropathology of cognitively normal elderly. J. Neuropathol. Exp. Neurol.2003; 62: 1087-1095.
13. Naslund, J., Haroutunian, V., Mohs, R., Davis, K.L., Davies, P. et al. Correlation between elevated levels of amyloid beta-peptide in the brain and cognitive decline. JAMA 2000; 283: 1571-1577.
14. Selkoe, D.J. The origins of Alzheimer’s disease: a is for amyloid. JAMA 2000; 283: 1615-1617.
15. Kukull, W.A., Bowen, J.D. Dementia epidemiology. Med. Clin. North Am.2002; 86: 573-590.
16. Fu, C., Chute, D.J., Farag, E.S., Garakian, J., Cummings, J.L. et al. Comorbidity in dementia: an autopsy study. Arch. Pathol. Lab. Med. 2004; 128: 32-38.
17. von Bernhardi R. Aging: Biochemistry and functional changes of the Central Nervous System. Rev. Chil. Neuro-psiq. 2005; 43: 297 - 304.
18. Kelijman, M. Age-related alterations of the growth hormone/insulin-like growth factor-1 axis. J. Am. Geriatr. Soc.1991; 39: 295-307.
19. de la Torre, J.C. Alzheimer’s disease as a vascular disorder: nosological evidence. Stroke 2002; 33: 1152-1162.
20. Kalaria, R.N., Batí, S.U., Lust, W.D., Perry, G. The amyloid precursor protein in ischemic brain injury and chronic hypoperfusion. Ann. N.Y. Acad. Sci.1993; 695: 190-193.
21. Wen, Y., Onyewuchi, O., Yang, S., Liu, R., Simpinks, J.W. Increased beta-secretase activity and expression in rats following
transient cerebral ischemia. Brain Res. 2004; 1009 :1-8.
22. Zhang, Z., Chopp, M., Powers, C. Temporal profile of microglial response following transient (2h) middle cerebral artery occlusion. Brain Res. 1997; 744: 189-198.
23. McCann, S.M. The nitric oxide hypothesis of brain aging. Exp. Geront. 1997; 32(4-5): 431-440.
24. Lukiw, W.J., Bazan, N.G. Neuroinflammatory signalling upregulation in Alzheimer’s disease. Neurochem. Res. 2000; 25 : 1173-1184.
25. Akiyama, H., Barger, S., Barnum, S., Bradt, B., Bauer, J. et al. Inflammation and Alzheimer’s disease. Neurobiol. Aging 2000; 21: 383-421.
26. McGeer, P.L., McGeer, E.G. Inflammation, autotoxicity and Alzheimer’s disease. Neurobiol. Aging 2001; 22: 799-809.
27. Neuroinflammation Working group. Inflammation and Alzheimer’s disease. Neurobiol. Aging 2000; 21 : 383-421.
28. von Bernhardi R, Ramírez G, Toro R, Eugenín J. Pro-inflammatory conditions promote neuronal damage mediated by Amyloid Precursor Protein-and degradation by microglial cells in culture. Neurobiol Disease 2007; 26 : 153-164. (2006 Dec 16; [Epub ahead of print]).
29. Eikelenboom, P., van Gool, W.A. Neuroinflammatory perspectives on the two faces of Alzheimer’s disease. J. Neural. Transm. 2004; 111 : 281-294.
30. Zhu, X., Raina, A.K., Perry, G., Smith, M.A. Alzheimer’s disease: the two-hit hypothesis. Lancet Neurol. 2004; 3 : 219-226.
31. Luterman, J.D., Haroutunian, V., Yemul, S., Ho, L., Purohit, D. et al. Cytokine gene expression as a function of the clinical progression of Alzheimer disease dementia. Arch. Neurol 2000; 57 :
11
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.

BOLETÍN ESCUELA DE MEDICINA U.C., PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE VOL. 32 Nº1 2007
1153-1160.
32. Sala, G., Galimberti, G., Canevari, C., Raggi, M.E., Isella, V. et al. Peripheral cytokine release in Alzheimer patients: correlation with disease severity. Neurobiol. Aging 2003; 24: 909-914.
33. Griffin, W.S., Mrak, R.E. Interleukin-1 in the genesis and progression of and risk for development of neuronal degeneration in Alzheimer’s disease. J. Leukoc. Biol. 2002; 72 : 233-238.
34. Melton, L.M., Keith, A.B., Davis, S., Oakley, A.E., Edwardson, J.A. et al. Chronic glial activation, neurodegeneration, and APP immunoreactive deposits following acute administration of double-stranded RNA. Glia 2003; 44 : 1-12.
35. Broe, G.A., Grayson, D.A., Creasey, H.M., Waite, L.M., Casey, B.J. et al.. Anti-inflammatory drugs protect against Alzheimer’s disease at low doses. Arch. Neurol. 2000; 57 : 1586-1591.
36. Etminan, M., Gill, S., Samii, A. Effect of non-steroidal anti-inflammatory drugs on risk of Alzheimer’s disease: systematic review and meta-analysis of observational studies. BMJ 2003 ; 327 : 128-131.
37. Wyss-Coray, T., Yan, F., Lin A.H., Lambris, J.D., Alexander, J.J. et al. Prominent neurodegeneration and increased plaque formation in complement-inhibited Alzheimer’s mice. Proc. Natl. Acad. Sci. USA 2002; 99 : 10837-10842.
38. Hanisch, U.K. Microglia as a source and target of cytokines. Glia 2002; 40 : 140-155.
39. Hu, J., Van Eldik, L.J. Glial-derived proteins activate cultured astrocytes and enhance beta amyloid-induced glial activation. Brain Res. 1999; 842 : 46-54.
40. Liu, B., Hong, J.S. Role of microglia in inflammation-mediated neurodegenerative diseases: mechanisms and strategies for therapeutic intervention. J. Pharmacol. Exp. Ther. 2003; 304 : 1-7.
41. Combs, C.K., Karlo, J.C., Kao, S-C., Landreth, G.E. Beta-Amyloid stimulation
of microglia and monocytes results in
TNFalpha-dependent expression of
inducible nitric oxide synthase and
neuronal apoptosis, J. Neurosci. 2001; 21:
1179-1188.
42. Wallace, M.N., Geddes, J.G., Farquhar,
D.A., Masson, M.R. Nitric oxide synthase
in reactive astrocytes adjacent to beta-
amyloid plaques. Exp. Neurol. 1997; 144
: 266-272
43. Luth, H., Munch, G., Arendt, T.
Aβerrant expression of NOS isoforms in
Alzheimer’s disease is structurally related
to nitrotyrosine formation, Brain Res.2002;
953 : 135-143.
44. Goldgaber, D., Harris, H.W., Hla, T.,
Maciag, T., Donnelly, R.J. et al. Interleukin
1 regulates synthesis of amyloid beta-
protein precursor mRNA in human
endotelial cells. Proc. Natl. Acad. Sci.
USA.1989; 86 : 7606-7610.
45. Rogers, J.T., Leiter, L.M., McPhee, J.,
Cahill, C.M., Zhan, S.S. et al. Translation
of the Alzheimer amyloid precursor protein
mRNA is up-regulated by interleukin-1
through 5’-untranslated region sequences.
J. Biol. Chem. 1999; 274 ; 6421-6431.
46. Blasko, I., Marx, F., Steiner, E.,
Hartmann, T., Grubeck-Loebenstein, B.
TNFalpha plus IFNgamma induce the
production of Alzheimer beta amyloid
peptides and decrease the secretion of
APPs. FASEB J. 1999; 13 : 63-68.
47. Kamenetz, F., Tomita, T., Hsieh,
H., Seabrook, G., Borchelt, D et al. APP
processing and synaptic function. Neuron
2003; 37 : 925-937.
48. Gylys, K.H., Fein, J.A., Yang, F., Willey,
D.J., Miller, C.A., et al. Synaptic changes
in Alzheimer’s disease: increased amyloid-
b and gliosis in surviving terminals is
accompanied by decreased PSD-95
fluorescence. Am. J. Pathol. 2004; 165 :
1809-1817.
49. Ross, F.M., Allan, S.M., Rothwell, N.J.,
Verkhratsky, A. A dual role for interleukin-1 in LTP in mouse hippocampal slices. J. Neuroimmunol. 2003; 144 : 61-67.
50. Murray, C.A., McGahon, B., McBennet, S., Lynch, M. Interleukin-1 beta inhibits glutamate release in hippocampus of young, but not aged, rats. Neurobiol. Aging 1997; 18 : 343-348
51. Benveniste, E.N. Cytokine actions in the central nervous system. Cytokine & Growth Factors Rev. 1998; 9 : 259-275.
52. Marcus, J., Karackattu, S., Fleegal, M., Sumners, C. Cytokine-stimulated inducible nitric oxide synthase expression in astroglia: Role of Erk Mitogen-activated protein kinase and NF-kB. Glia 2003; 41 : 152-160.
53. Rothwell, N., Luheshi, G. Interleukin 1 in the brain: Biology, pathology and therapeutic target. Trends in Neurosci. 2000; 23 : 618-625.
54. Basu, A., Krady, J., Levinson, S. Interleukin-1: A master regulator of neuroinflammation. J. Neurosci. Res. 2004; 78 : 151-156.
55. Arnett, H.A., Wang, Y., Matsushima, G.K., Suzuki, K., Ting, J.P.Y. Functional genomic analysis of remyelination reveals importance of inflammation in oligodendrocytes regeneration. J. Neurosci.2003; 23 : 9824-9832.
56. Herx, L.M., Rivest, S., Yong, V.W. Central nervous system-initiated inflammation and neurotrophism in
trauma: IL-1β is required for the production of ciliary neurotrophic factor. J. Immunol. 2000; 165 : 2232-1239.
57. Talley, A., Dewhurst, S., Perry, S., Dollars, S., Gummuluru, S. et al. Tumor necrosis alpha-induced apoptosis in human neuronal cells: protection by the antioxidant N-acetylcysteine and the genes bcl-2 and crmA. Mol. Cell. Biol. 1995; 15: 2359-2366.
12

58. Barger, S., Hörster, D., Furukawa, K., Goddman, Y., Krieglstein, J. et al. Tumor necrosis factors alpha and beta protect against APP toxicity: evidence for involvement of a kB-binding factor and attenuation of peroxide and Ca+2 accumulation. Proc. Natl. Acad. Sci. USA. 1995; 92 : 9328-9332.
59. Vitkovic L., Bockaert, J., Jacque, C. “Inflammatory” Cytokines: Neuromodulators in normal Brain? J. Neurochem. 2000; 74 : 457-471.
60. Arnett, H.A., Masson, J., Marino, M., Suzuki, K., Matsushima, G.K. et al. TNFα promotes proliferation of oligodendrocyte progenitors and remyelinization. Nature Neurosci. 2001; 4 :1116-1121.
61. Chang, J.Y., Martin, D.P., Johnson Jr., E.M. Interferon suppresses sympathetic neuronal cell death caused by nerve growth factor deprivation. J. Neurochem. 1990; 55 : 436-445.
62. Hayashida, T., Decaestecker, M., Schnaper, W. Cross-talk between ERK MAP kinase and Smad signaling pathways
TGF-β dependent response in human mesangial cells. FASEB J.2004; 17 : 1576-1578.
63. Bye, N., Zieba, M., Wreford, N.G., Nichols, N.R. Resistance of the dentate gyrus to induced apoptosis during ageing is associated with increases in transforming growth factor-beta 1 messenger RNA. Neuroscience 2001; 105 : 853-862.
64. Zhu, Y., Roth-Eichhorn, S., Braun, N., Culmsee, C., Rami., A. et al. The expression of transforming growth factor-
beta 1 (TGF-β1) in hippocampal neurons: a temporary upregulated protein level after transient forebrain ischemia in the rat. Brain Res. 2000; 866 : 286-298.
65. Meda, L., Baron, P., Scarlato, G. Glial activation in Alzheimer’s disease: the role of Aβ and its associated proteins. Neurobiol. Aging. 2001; 22 : 885-893.
66. Chen, S., Luo, D., Strit, W., Harrison,
J.K. TGF-β1 up regulates CX3CR1
expression and inhibits fractalkine-
stimulated signaling in rat microglia. J.
Neuroimmunol. 2002; 133 : 46-55.
67. Krupinski, J., Kumar, P., Kumar, S.,
Kaluza, J. Increased expression of TGF-
β1 in brain tissue after ischemic stroke in
humans. Stroke 1996; 27 : 852-857.
68. De Sampaio, E., Spohr, T.C., Martinez,
R., da Silva, E.F., Neto, V.M. et al. Neuro-
Glia interaction effects on GFAP gene:
a novel role for TGFβ1. Eur. J. Neurosci.
2002; 16 : 2059-2069.
69. Eyüpoglu, L.Y., Bechmann, L., Nitsch,
R. Modification of microglial function
protects from lesion-induced neuronal
alteration and promotes sprouting in the
hippocampus. FASEB J.2003; 17 : 1110-
1111.
70. Herrera-Molina, R., von Bernhardi, R.
Transforming growth factor-β1 produced
by hippocampal cells modulates glial
reactivity in culture. Neurobiol Disease
2005; 19 : 229-236.
71. McCartney-Francis, N.L., Wahl, S.M.
Dysregulation of IFN-g signaling pathways
in the absence of TGF-b1. J Immunol.
2002; 169 : 5941-5947.
72. Lieb, K., Engels, S., Fiebich, B.L.
Inhibition of LPS-induced iNOS and NO
synthesis in primary rat microglial cells.
Neurochem. Int. 2003; 42 : 131-137.
73. Saud, K., Herrera-Molina, R., von
Bernhardi, R. Pro- and anti-inflammatory
cytokines regulate the ERK pathway:
implication of the timing for the activation
of microglial cells. Neurotox. Res. 2005; 8
: 277-287.
74. Benveniste, E., Nguyen, V., O’Keefe,
G. Immunological aspects of microglia:
relevance to Alzheimer’s disease.
Neurochem. Int. 2001; 39 : 381-391.
75. Streit, W.J. Microglia as neuroprotective,
immunocompetent cells of the CNS. Glia
2002; 40 : 133-139.
76. Cagnin, A., Brooks, D.J., Kennedy, A.M., Gunn, R.N., Myers, R. et al. In-vivo measurement of activated microglia in dementia. Lancet 2001; 358 : 461-467.
77. Rogers, J., Lue, L.F. Microglial chemotaxis, activation, and phagocytosis of amyloid beta-peptide as linked phenomena in Alzheimer’s disease. Neurochem. Int. 2001; 39 : 333-340.
78. Sheng, J.G., Mrak, R.E., Griffin, W.S. Neuritic plaque evolution in Alzheimer’s disease is accompanied by transition of activated microglia from primed to enlarged to phagocytic forms. Acta Neuropathol. (Berl) 1997; 94 : 1-5.
79. Wegiel, J., Wang, K.C, Tarnawski, M., Lach, B. Microglial cells are the driving force in fibrillar plaque formation, whereas astrocytes are a leading factor in plaque degradation. Acta Neuropathol. (Berl.) 2000; 100 : 356-364
80. D’Andrea, M.R., Cole, GM., Ard,
M.D. The microglial phagocytic role with
specific plaque types in the Alzheimer
disease brain. Neurobiol. Aging 2004; 25
: 675-683.
81. Wegiel, J., Wang, K.C., Imaki, H.,
Rubenstein, R., Wronska, A. et al. The role
of microglial cells and astrocytes in fibrillar
plaque evolution in transgenic APP(SW)
mice. Neurobiol. Aging. 2001; 22 : 49-61.
82. Hashioka, S., Monji, A., Ueda, T.,
Kanba, S., Nakanishi, H. Amyloid-β
fibril formation is not necessarily required
for microglial activation by the peptides.
Neurochem. Int. 2005; 47: 369-376.
83. Lue, L.F., Walker, D.G., Brachova, L.,
Beach, T.G., Rogers, J. et al. Involvement of
microglial receptor for advanced glycation
endproducts (RAGE) in Alzheimer’s
disease: identification of a cellular
activation mechanism. Exp. Neurol. 2001;
171 : 29-45.
84. Benzing, W.C., Wujek, J.R., Ward, E.K.,
Shaffer, D., Ashe, K.H. et al. Evidence
13
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.

BOLETÍN ESCUELA DE MEDICINA U.C., PONTIFICIA UNIVERSIDAD CATÓLICA DE CHILE VOL. 32 Nº1 2007
for glial-mediated inflammation in aged
APP(SW) transgenic mice. Neurobiol.
Aging 1999; 20 : 581-589.
85. Mehlhorn, G., Hollbron, M., Schliebs,
R. Induction of cytokines in glial cells
surrounding cortical beta-amyloid plaques
in transgenic Tg2576 mice with Alzheimer
pathology. Int. Dev. Neurosci. 2000 ; 18 :
423-431.
86. von Bernhardi, R., Ramírez, G.,
Matile, H. Döbeli, H. Immobilized APP
constructs: a tool for the in vitro screening
of glial cells reactivity. Eur J. Neurosci.
2001; 14 : 946-956.
87. Kirchhoff, F., Dringen, R., Giaume, C.
Pathways of neuron-astrocyte interactions
and their possible role in neuroprotection.
Eur. Arch. Psychiatry Clin. Neurosci. 2001;
251 : 158-169.
88. Wyss-Coray, T., Loike, J.D., Brionne,
T.C., Lu, E., Anankov, R. et al. Adult mouse
astrocytes degrade amyloid-β in vitro and
in situ. Nature Med.2003; 9 : 453-457.
89. Hock, C., Heese, K., Hulette, C.,
Rosenberg, C., Otten, U. Region-specific
neurotrophin imbalances in Alzheimer
disease: decreased levels of brain-derived
neurotrophic factor and increased levels of
nerve growth factor in hippocampus and
cortical areas. Arch. Neurol. 2000; 57 :
846-851.
90. Vincent, V.A., Lowik, C.W., Verheijen,
J.H., de Bart, A.C., Tilders, F.J. et al. Role of
astrocyte-derived tissue-type plasminogen
activator in the regulation of endotoxin-
stimulated nitric oxide production by
microglial cells. Glia 1998; 22 : 130-137.
91. von Bernhardi, R., Ramírez, G.
Microglia-astrocyte interaction in
Alzheimer’s disease: friends or foes for the
nervous system? Biol Res. 2001; 34 : 123-
128
92. Wyss-Coray, T., Mucke, L. Inflammation
in neurodegenerative disease--a double-
edged sword. Neuron 2002; 35 : 419-432
93. Husemann, J., Silverstein, S.C.
Expression of scavenger receptor class B,
type I, by astrocytes and vascular smooth
muscle cells in normal adult mouse and
human brain and in Alzheimer’s disease
brain. Am. J. Pathol. 2001; 158 : 825-832
94. Husemann, J., Loike, J.D., Kodama,
T., Silverstein, S.C. Scavenger receptor
class B type I (SR-BI) mediates adhesion
of neonatal murine microglia to fibrillar
beta-amyloid. J. Neuroimmunol. 2001; 114
: 142-150.
95. Smits, H.A., van Beelen, A.J., de Vos,
N.M., Rijmus, A., van der Bruggen, T. et
al. Activation of human macrophages by
amyloid-beta is attenuated by astrocytes. J.
Immunol. 2001; 166 : 6869-6876.
96. Aβramov, A.Y., Canevari, L., Duchen.
M.R. Changes in intracellular calcium and
glutathione in astrocytes as the primary
mechanism of amyloid neurotoxicity. J.
Neurosci. 2003; 23 : 5088-5095.
97. Nagele, R.G., Wegiel, J., Venkatamaran,
V., Imaki, H., Wang, K.C. et al. Contribution
of glial cells to the development of amyloid
plaques in Alzheimer’s disease. Neurobiol.
Aging 2004; 25 : 663-674.
98. Griffin, W.S., Sheng, J.G., Royston,
M.C., Gentleman, S.M., McKenzie,
E.J. et al. Glial-neuronal interactions in
Alzheimer’s disease: the potential role of
a “cytokine cycle” in disease progression.
Brain Pathol. 1998: 8 : 65-72.
99. Neumann, H., Wekerle, H. Neuronal
control of the immune response in the
central nervous system: Linking brain
immunity to neurodegeneration. J.
Neuropathol. Exp. Neurol. 1998; 57 : 1-
9.
100. Sudo, S., Tanaka, J., Toku, K., Desaki,
J., Matsuda, S. et al. Neurons induce the
activation of microglial cell in vitro. Exp.
Neurol. 1998; 154 : 499-510.
101. DeWitt, D.A., Perry, G., Cohen, M.,
Doller, C., and Silver, J. Astrocytes regulate
microglial phagocytosis of senile plaque cores of Alzheimer’s disease. Exp. Neurol. 1998; 149 : 329-340
102. Vitolo, O.V., Sant’Angelo, A., Constanzo, V., Battaglia, F., Arancio, O. et al. Amyloid beta-peptide inhibition of the PKA/CREB pathway and long-term potentiation: reversibility by drugs that enhance cAMP signaling. Proc. Natl. Acad. Sci. USA 2002; 99 : 13217-13221.
103. Wang, Q., Walsh, D.M., Rowan, M.J., Selkoe, D.J., Anwyl, R. Block of LTP induction in vitro by cell-derived and synthetic Aβ is mediated via activation of the kinases JNK, Cdk5 and p38 MAPK, and mGluR5. J. Neurosci. 2004; 24 : 6047-6056.
104. Husemann, J., Loike, J.D., Anankov, R., Febbraio, M., Silverstein, S.C. Scavenger receptors in neurobiology and neuropathology: their role on microglia and other cells of the nervous system. Glia 2002; 40 : 195-205.
105. Christie, R.H., Freeman, M., Hyman, B.T. Expression of the macrophage scavenger receptor, a multifunctional lipoprotein receptor, in microglia associated with senile plaques in Alzheimer’s disease. Am. J. Pathol. 1996; 148 : 399-403.
106. Alarcón, R., Fuenzalida, C., Santibañez, M. von Bernhardi, R. Expression of Scavenger Receptors in glial cells: Comparing the adhesion of astrocytes and microglia from neonatal rats to surface-bound b-amyloid. J. Biol. Chem. 2005; 280 : 30406-30415.
107. Hsu, H-Y., Chiu, S-L., Wen, M-H., Chen, K-Y., and Hua, K-F. Ligands of macrophage scavenger receptor induce cytokine expression via differential modulation of protein kinase signaling pathways. J. Biol. Chem. 2001; 276 : 28719-28730.
108. Kim, W.S., Ordija, C.M., Freeman, M.W. Activation of signaling pathways by putative scavenger receptor class A (SR-
14

A) ligands requires CD14 but not SR-A. Biochem. Biophys. Res. Commun. 2003; 310 : 542-549
109. El Khoury, J.B., Moore, K.J., Means, T.K., Leung, J., Terada, K. et al. CD36 mediates the innate response to beta-amyloid. J. Exp. Med. 2003; 197 : 1657-1666.
110. Qiu, Z., Sttickland, D.K., Hyman, B.T., Rebeck, G.W. Elevation of LDL receptor-related protein levels via ligand interactions in Alzheimer’s disease and in vitro. J. Neuropathol. Exp. Neurol. 2001; 60 : 430-440.
111. Burudi, E.M., Riese, S., Stahl, P.D., Regnier-Vigouroux, A. Identification and
functional characterization of the mannose receptor in astrocytes. Glia 1999; 25 : 44-55.
112. Paresce, D.M., Chung, H., Maxfield, F.R. Slow degradation of aggregates of the
Alzheimer’s disease amyloid β-protein by microglial cells. J. Biol. Chem. 1997; 272 : 29390-29397.
15
LA NEUROINFLAMACIÓN EN LA PATOGÉNESIS DE LA ENFERMEDAD DE ALZHEIMER - DRA. ROMMY VON BERNHARDI M.