Gas ideal
-
Upload
jerry-enrique -
Category
Documents
-
view
8 -
download
1
description
Transcript of Gas ideal
-
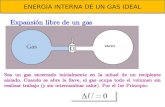
Un gas ideal es un gas terico compuesto de un conjunto de partculas puntuales con desplazamiento aleatorio que no interactan entre s. El concepto de gas ideal es til porque el mismo se comporta segn la ley de los gases ideales, una ecuacin de estadosimplificada, y que puede ser analizada mediante la mecnica estadstica.
En condiciones normales tales como condiciones normales de presin y temperatura, la mayora de los gases reales se comporta en forma cualitativa como un gas ideal. Muchos gases tales como el nitrgeno, oxgeno, hidrgeno, gases nobles, y algunos gases pesados tales como el dixido de carbono pueden ser tratados como gases ideales dentro de una tolerancia razonable.1 Generalmente, el apartamiento de las condiciones de gas ideal tiende a ser menor a mayores temperaturas y a menor densidad (o sea a menor presin),1 ya que el trabajo realizado por las fuerzas intermoleculares es menos importante comparado conenerga cintica de las partculas, y el tamao de las molculas es menos importante comparado con el espacio vaco entre ellas.
-
Presin
1 atm = 760 torr o 760 mm Hg
1 atm = 14,7 libras/pulgada2 o 14,7 psi
1 atm = 1,033 gr/cm2
1 atm = 1,013 x 106 dinas/cm2
Temperatura
C grados centgrados
K grados Kelvin (temperatura absoluta)
F grados Fahrenheit
Volumen
Litro = 1000 ml o 1000 cc (cm3)
1 m3 = 1.000 litros
1 galn = 3,78 litros
1 pie3 = 28,32 litros
LEYES DE LOS GASES Las principales leyes que rigen el estado
gaseoso son:a) Ley de Boyle Mariotte b) Ley de Jacques Charles I y IIc) Ley de Gay Lussacd) Ley Combinada Ecuacin general e) Ley de Dalton
En las leyes de los gases intervienen 3 factores importantes que son: la presiel volumen y la temperatura, por lo tanto se usarn las siguientes medidas
-
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el fsico y qumico irlands Robert Boyle (1662) y el fsico y botnico francs Edme Mariotte (1676), es una de las leyes de los gases que relaciona el volumen y la presin de una cierta cantidad de gas mantenida atemperatura constante.
-
I Ley de Charles
Cuando la presin se mantiene constante, los volmenes de los gases son directamente proporcionales a las temperaturas ABSOLUTAS, es decir, que si la temperatura aumenta, el volumen tambin aumenta. Esta ley se fundamenta en que todo cuerpo por accin del calor se dilata
II LEY DE CHARLES.
Como principio fundamental se tiene que una molcula de cualquier gas que se encuentre a cero grados centgrados y una atmsfera de presin ocupa el volumen de 22,4 litros al cual se lo llama volumen molar. Es necesario recordar que las masas moleculares de las moles de los diferentes gases son diferentes pero el volumen es igual para todos ellos
-
Cuando el volumen se mantiene constante, las presiones que ejercen los gases son directamente proporcionales a sus temperaturas ABSOLUTAS, de manera que si la temperatura aumenta, la presin tambin aumenta.
-
Tomando en cuenta la intervencin simultnea de los tres factores fsicos: presin, volumen y temperatura, es decir, combinando las tres leyes estudiadas Boyle, Charles y Gay Lussac, se tiene la ley combinada.
-
P = presin
V = volumen
N = nmero de moles = Pa = (Peso en gramos del gas)
Ma (Peso molecular del gas)
T = Temperatura en grados Kelvin
R = Constante universal de los gases = 0.082 at li
mol . K
-
La presin total de una mezcla de dos o ms gases que no reaccionan entre s es igual a la suma de las presiones de los componentes
Ejercicio 20:
Si un litro de nitrgeno encerrado en un recipiente ejerce una presin de 80 torr y un litro de oxgeno contenido en otro recipiente ejerce una presin de 30 torr. Cul es la presin si se mezclan en un recipiente de un volumen total de un litro.