Propiedades geotécnicas de la Formación La Argañosa (Cretácico ...
EVOLUCIÓN DE LOS MANGLARES NEOTROPICALES: LA CRISIS … · 2020. 9. 7. · manglar más antiguo...
Transcript of EVOLUCIÓN DE LOS MANGLARES NEOTROPICALES: LA CRISIS … · 2020. 9. 7. · manglar más antiguo...

355NOV - DEC 1998, VOL. 23 Nº 6
PALABRAS CLAVE / Manglares / Palinología / Biogeografía / Evolución / Extinción / Neotrópico / Eoceno /
Valentí Rull es Palinólogo en PDVSA. Licenciado en Ciencias Biológicas (Universitat deBarcelona, Catalunya, España), M. Sc. y Ph. Sc. en Biología (Ecología) (Instituto Venezolano de Investigaciones Científicas,IVIC, Caracas, Venezuela). Intereses profesionales: Paleoecología, Ecología evolutiva, Bioestratigrafía. Dirección: PDVSAExploración y Producción, Ap. 829, Caracas 1010-A, Venezuela, e-mail [email protected]
EVOLUCIÓN DE LOS MANGLARESNEOTROPICALES: LA CRISIS DEL EOCENO
VALENTÍ RULL
n la actualidad, existencuatro géneros principa-les de árboles que deter-
minan la fisionomía de los manglaresneotropicales, tanto del Caribe como enlas costas atlánticas y pacíficas: Rhizo-phora (Rhizophoraceae), Avicennia (Avi-cenniaceae), Laguncularia (Combreta-ceae) y Pelliciera (Tiliaceae) (Tomlinson,1986; Graham, 1995). Algunos autoresincluyen, además, Conocarpus (Chapman,1976). Sin embargo, los manglares deesta región han sufrido profundas varia-ciones evolutivas, biogeográficas yecológicas a través del tiempo que handeterminado, no sólo cambios cuantitati-vos en su extensión espacial y biodiversi-dad, sino también variaciones cualitativasfundamentales en su composición taxonó-mica.
Aunque el género demanglar más antiguo que se conoce en elneotrópico es Nypa, una palma que datadel Cretácico Tardío (Fig. 1) y que hoyen día sólo se encuentra en los manglaresdel sudeste asiático, es difícil precisar elmomento de aparición de los primerosmanglares en el Neotrópico. El conceptode manglar está íntimamente asociado auna fisionomía particular, lo cual es difí-cil de constatar a través del registro fósil,consistente principalmente en polen. Laexistencia de manglares se deduce de laafinidad botánica de ese polen fósil conespecies de manglar conocidas actual-mente, pero el desconocimiento de estasafinidades para la mayoría de especies
0378-1844/98/06/355-08 $ 3.00/0
cretácicas nos impide asegurar o descartarla existencia de manglares de esa edad.De lo que sí estamos más seguros es dela existencia de manglares bien desarro-llados en el Caribe y el Golfo de Méxicodurante el Eoceno y del progresivo enri-quecimiento taxonómico de estas comuni-dades costeras, durante los últimos 50millones de años. En efecto, desde losapenas 4 géneros del Eoceno Temprano,se ha pasado a los 27 actuales, incluyen-do no sólo los taxa dominantes, sinootros constituyentes habituales de losmanglares (Graham, 1995). Este proceso,sin embargo, lejos de ser un enriqueci-miento gradual e ininterrumpido, ha teni-do lugar a través de la sucesión de fasesmás estables con otras de intensa especia-ción e inmigración, reducciones drásticasen la extensión geográfica de los taxa eincluso auténticas extinciones en masa.
Según Van der Hammen(1957, 1961, 1964), los cambios vegeta-cionales, en general, se han producido alo largo de la historia biológica en formaperiódica y se expresan en el registropalinológico a través de cambios cuanti-tativos cíclicos de ciertos taxa a la vezque variaciones cualitativas profundas(apariciones y desapariciones) de otros.Ambos fenómenos deberían ser produci-dos por una única causa, que en opiniónde Van der Hammen (1964) es la perio-dicidad climática, controlada astronómica-mente.
La presente revisión secentra en uno de estos episodios de ex-
tinción, el límite Eoceno/Oligoceno (EO),cuando las comunidades de manglaresneotropicales sufrieron su mayor revolu-ción evolutiva. El principal propósito esilustrar este cambio y discutir sus posi-bles causas, a la luz de lo publicado has-ta el momento; a la vez que proporcionaral lector interesado una forma de obtenermás información sobre el particular, através de la reproducción fotográfica deespecímenes originales del polen de lostaxa involucrados y una bibliografía re-presentativa que puede servir como puntode partida a investigaciones más focaliza-das. Este trabajo está dirigido a todo tipode estudiosos relacionados con el tema,pero especialmente a los ecólogos que seocupan de los manglares actuales, con laesperanza de que lo acontecido en el pa-sado les pueda ser útil para entender me-jor la ecología del presente y predecircon más exactitud (o por lo menos, conmás base factual), lo que puede ocurriren el futuro.
Las extinciones en masa y sus causas
Cuando se habla degrandes crisis biológicas y extincionesmasivas, la primera que viene a la mentees la ocurrida en el límite Cretácico/Ter-ciario (KT), hace 65 millones de años(Ma). Sin duda, ésta es la más popular,debido principalmente a que se extinguie-ron seres vivos tan espectaculares comolos dinosaurios y también a que una delas explicaciones más aceptadas es la caí-

356 NOV - DEC 1998, VOL. 23 Nº 6
da de un gran meteorito, cuyos efectosinmediatos y consecuencias habrían deter-minado grandes alteraciones en laBiosfera. Allaby y Lovelock (1986) pro-porcionan una descripción detallada delos acontecimientos que podrían haberocurrido. Entre otras localidades propues-tas, uno de los lugares más probablespara el impacto del meteorito se ha situa-do precisamente en el área caribeña (enYucatán, México) donde, a través deimágenes de satélite, se ha deducido laexistencia de un cráter submarino deunos 180 km de diámetro, que habríasido producido por el impacto (Sharptonet al., 1992). El choque de un gran me-teorito ya había sido supuesto antes dehallar esta evidencia, debido a la presen-cia de microtectitas (esférulas productode la fusión instantánea de rocas, por im-pacto) y de una capa de arcilla muy ricaen Iridio, en diversas partes del mundo,en el límite KT. Según los autores de lahipótesis del impacto, la elevada concen-tración de Iridio no se puede explicar te-niendo en cuenta únicamente la cantidadde este metal que esta presente en nues-tro planeta; se requiere una fuente adicio-nal (extraterrestre) para producir tan altasconcentraciones (Alvarez et al., 1980).
Otras hipótesis son me-nos espectaculares e intentan explicar lasextinciones mediante cambios ecológicos anivel global, producidos principalmentepor el aumento del CO
2 atmosférico y el
consiguiente deterioro del clima debido al‘efecto invernadero’ (McLean, 1985). Enefecto, la retención de CO
2 en un mar de
fondo anóxico durante 1 millón de años ysu posterior expulsión súbita a la atmósfe-ra podría haber aumentado la concentra-ción de este gas en la misma de 2 a 5 ve-ces (Margalef, 1996, 1997). El hecho deque muchos grupos de organismos, nodesparecieran después del Cretácico ha in-ducido a muchos a creer más en este se-gundo tipo de explicaciones, que habríanafectado selectivamente a ciertos tipos bio-lógicos más dependientes de factores am-bientales. Entre los seres vivos que ‘sobre-vivieron’ son notables las aves (Cooper yPenny, 1997) y las plantas (Méon, 1990;Srivastava, 1994); mientras que la mayoríade extinciones se produjeron en organis-mos marinos unicelulares de aguas some-ras, como foraminíferos bentónicos y algasplanctónicas (Keller et al., 1995), lo cualha llevado a pensar también en los cam-bios del nivel del mar como mecanismodeterminante. Sólo a modo de ejemplo, undescenso del nivel del mar de, unos 100-120 m, dejaría completamente al descu-bierto la plataforma actual, por lo que des-aparecería el hábitat de gran cantidad deorganismos. Tal cambio no es sólo proba-ble, sino que ha ocurrido repetidamente en
la historia de la vida (por ejemplo, durantelas glaciaciones) y su impacto en la extin-ción de muchas especies está fuera deduda.
Sin embargo, la extin-ción masiva del límite KT no ha sido lamás severa, en el sentido de mayor nú-mero de taxa desaparecidos. La mayorextinción se produjo en el límite Pérmi-co/Triásico, hace 250 Ma. Tampoco hasido la última, puesto que hace unos 37Ma (límite Eoceno/Oligoceno, o EO)ocurrió otro de estos eventos masivos deextinción. En total, se han registrado 14a 18 extinciones en masa, a través de lahistoria de la Tierra y se ha hablado deuna posible ritmicidad en las mismas(Kauffman, y Harries, 1996). No todaslas extinciones se han atribuido a unasola causa. En una síntesis de lo publica-do hasta el momento, estos mismos auto-
res clasifican las causas propuestas hastael momento para explicar las extincionesen masa en general, en terrestres yextraterrestres. Entre las primeras se en-cuentran: el vulcanismo a gran escala, fu-gas de gas del manto terrestre, descensosrápidos del nivel del mar, episodios deanoxia en los océanos y cambios rápidosde temperatura y glaciaciones; entre lassegundas destacan: erupciones solares gi-gantes, proximidad de una supernova,acercamiento de estrellas, desplazamien-tos a través del plano galáctico, impactosde meteoritos y ‘tormentas’ de cometas ymeteoritos.
EL LÍMITE EOCENO/OLIGOCENO
La crisis del límite EOafectó severamente a la mayoría de losgrupos de organismos, que van desde los
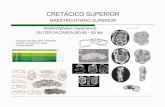
Fig. 1. Escala cronoestratigráfica de referencia (edades según Berggren et al., 1995)

357NOV - DEC 1998, VOL. 23 Nº 6
del plancton y el bentos marino (cocoli-tofóridos, foraminíferos, radiolarios, os-trácodos, moluscos), hasta vertebrados(que sufrieron una reducción del 60%) yplantas terrestres (Cavelier et al., 1981;Molina, 1995). Este evento fue el másimportante del Terciario y eliminó unagran parte de las especies típicas deEoceno, que fueron reemplazadas duranteel Oligoceno por otras que son el origende las actuales (Molina, 1995). En elcaso de las plantas continentales, porejemplo, las evidencias palinológicas lle-varon a Muller (1980) a la conclusión deque el último cambio floral drástico, quedió lugar a la mayoría de grupos actua-les, ocurrió precisamente en el límite EO,siendo éste mucho más significativo queel ocurrido en el límite Oligoceno/Mioce-no (ver también Van der Hammen, 1957;1961; 1964), que tradicionalmente marcala frontera entre Paleógeno y Neógeno(Fig. 1). Es decir, no se puede hablar deuna flora paleógena y otra neógena, sinode una flora eocena y otra post-eocena, omoderna. Sin embargo, esta extinción nofue el producto de una única ‘catástrofe’,sino de por lo menos cuatro eventos, ac-tuando escalonadamente durante 2 a 3millones de años, desde el principio delEoceno Tardío hasta el límite EO (Keller,1986). Cada uno de estos eventos parcia-les habría producido la extinción de alre-dedor de 15% de las especies, por lo queen total se habría producido la sustituciónde unos dos tercios de la biota eocena, locual es muy significativo.
En cuanto a las causasde este evento, parece existir un mayorconsenso. Cerca del límite EO existenvarios niveles de microtectitas, lo cualsugiere la posible acción de impactos demeteoritos. Se han encontrado tambiénvarios cráteres de edades similares (37 a39 Ma) que apoyarían esta hipótesis(Keller, 1986). Sin embargo, a pesar deque estos impactos meteoríticos estánbien documentados, no parecen haber te-nido la suficiente magnitud para produciruna extinción masiva, sino sólo desapari-ciones a nivel local, en regiones cuyarecolonización habría sido relativamenterápida (Molina, 1995). Además, el únicoepisodio de extinción realmente asociadoa tectitas es el tercero, hace unos 37 Ma(Kauffman y Harries, 1996). Las hipóte-sis que invocan mecanismos ambientalesse ven más favorecidas. Por una parte, esaceptado que el límite EO se caracterizapor la presencia de rápidas fluctuacionesquímicas a gran escala, que indican gran-des disrupciones de la circulación oceáni-ca y atmosférica global. También se co-noce que al final del Eoceno se produjoun enfriamiento súbito e intenso (fig. 2),que determinó temperaturas típicas de
una época glacial en los océanos y ma-yor acumulación de hielo en las zonaspolares. Además, poco antes del final delEoceno se alcanzó un máximo de precipi-tación, que de inmediato se redujo drásti-camente, situación que se prolongó du-rante todo el Oligoceno. Así pues, es fá-cil pensar en una biota eocena adaptada acondiciones de temperatura y humedadelevadas, que desaparece en gran parte
cuando su ambiente es sustituido súbita-mente por otro frío y seco. La causaaceptada para este cambio climático estárelacionada con la deriva continental,concretamente con la migración de Aus-tralia y su separación de la Antártida(Fig. 3), lo que determinó la abertura deuna vía para el paso de corrientes mari-nas polares hacia la región de Tethys(Muller, 1980). Esto no sólo provocó el
Fig. 2. Variaciones globales de temperatura y precipitación durante el Cretácico y el Ter-ciario (modificado de Frakes, 1979)
Fig. 3. Posición de las masas continentales en el Cretácico Tardío. Nótese que Antártida yAustralia todavía no se habían separado, como ocurriría después (Eoceno Tardío), permi-tiendo la conexión de los mares polares con el resto de los océanos.

358 NOV - DEC 1998, VOL. 23 Nº 6
enfriamiento climático de las regionestropicales, sino que afectó al clima glo-bal, al crear un nuevo sistema de circula-ción oceánica y el desarrollo de una capade agua fría en los fondos marinos(psicrosfera), así como glaciaciones y caí-das del nivel del mar, que también con-tribuyeron en gran medida a las extincio-nes (Molina, 1995).
LOS MANGLARES NEOTROPICA-LES DEL EOCENO
¿Cómo afectaron loseventos del límite EO a los manglaresneotropicales? En primer lugar, es necesa-rio hacer notar que existió un cambio no-table en la flora neotropical, en general(Rull, 1997). Sirva como ejemplo lo ocu-rrido en el norte de Sudamérica, expresa-do a través de las principales especies depolen fósil. Aproximadamente el 50% delos taxa se extinguieron o aparecieron porprimera vez alrededor del límite EO (Fig.4); sólo la otra mitad cruzó esta frontera,lo que equivale a decir que únicamente lamitad de los componentes principales dela flora eocena forman parte de la florapost-eocena. En cuanto a los manglares,sólo uno de los cuatro componentes actua-les importantes existía ya en el Eoceno:Pelliciera. El llamado ‘helecho de mangle’(Acrostichum aureum), común en los man-glares actuales aunque no determinante ensu fisionomía, también estaba presente.Completaban los manglares eocenos Nypay un componente desconocido, representa-do por el polen fósil Brevitricolpitesvariabilis (Graham, 1995). La Figura 5muestra el polen fósil de los tres principa-les componentes, de los que haremos unbreve análisis individual.
Los primeros registrosque se conocen de Pelliciera correspon-den al Eoceno Temprano, pero existenciertas dudas, por la posible confusión desu polen fósil (Psilatricolporites crassus)con el de Hura crepitans (Muller, 1981).En cualquier caso, parece seguro que noes más antiguo, y también lo es que exis-tió y fue un componente importante enlos manglares neotropicales del Eoceno(Germeraad et al., 1968; Wijmstra, 1968).La posibilidad de su presencia en la zonaecuatorial de África todavía no está con-firmada (Muller, 1981), por lo que por elmomento, parece que se trata de un géne-ro típicamente neotropical en su origen ydistribución (Fig. 6). Las esporas deAcrostichum se conocen, en su forma fó-sil (Deltoidospora adriennis), desde elPaleoceno (Thanikaimoni, 1987) y posi-blemente antes (Graham, 1995) y, aunqueen opinión de Frederiksen (1985), esprácticamente imposible diferenciar lasmismas de las de algunas especies de
Lygodium, Graham (1995) cree queAcrostichum ha sido un componente delos manglares eocenos. Por su parte,Nypa es conocido a través de su polenfósil (Spinizonocolpites) desde el Cretáci-co Tardío, cuando se registra casi simul-táneamente en el Caribe, África, India yBorneo (Muller, 1981). Para ese tiempo,el Océano Atlántico estaba en proceso deformación, India todavía estaba separadade Asia y el Istmo de Panamá no se ha-bía formado. El Mar de Tethys (Fig. 3),gran mar tropical que había separado lasdos masas continentales de Laurasia yGondwana durante todo el Cretácico, to-davía existía y seguía proporcionandouna conexión global para los ecosistemasmarinos, entre ellos los manglares, locual explica una distribución tan extendi-
da de muchos taxa como Nypa (Fig. 6).Para los manglares, tanto las masas conti-nentales, como los grandes océanos sonbarreras biogeográficas. Un buen ejemplolo constituye el Océano Pacífico, ya queno existen manglares en las islas situadasentre aproximadamente los meridianos90ºW (Islas Galápagos) y 170ºE (Samoa)(Tomlinson, 1986). Esto se ha intentadoexplicar por limitaciones en la dispersióny por disrrupción de áreas de distribucióndebidas a la deriva continental (Wood-roffe y Grindrod, 1991; Duke, 1995). Lascondiciones ambientales de los archipié-lagos no son limitantes y prueba de elloes que en Hawaii existen manglares in-troducidos por el hombre que crecen nor-malmente. Por consiguiente, la existenciade un mar como Tethys, tropical, contí-
Fig. 4. Especies de polen fósil que se extinguieron o se originaron alrededor del límiteEoceno/Oligoceno en el norte de Sudamérica (modificado de Muller et al., 1987).
Fig. 5. Polen fósil de tres de los principales representantes de los manglares eocenos. 1.Deltoidospora adriennis (afinidad botánica: Acrostichum aureum), 2. Spinizonocolpitesechinatus (afinidad botánica: Nypa), 3. Psilatricolporites crassus (afinidad botánica: Pelli-ciera). Los especímenes corresponden al Eoceno Medio de la Cuenca de Maracaibo (Fotodel autor).

359NOV - DEC 1998, VOL. 23 Nº 6
nuo y con muchos miles de kilómetrosde costas a ambos lados, parece habersido ideal para la dispersión de los man-glares, tanto si el mecanismo de transpor-te fue migratorio, como si fue debido ala fragmentación de Gondwana y poste-rior deriva de los continentes (McCoy yHeck, 1976; Duke, 1995).
Finalmente, el fósil Bre-vitricolpites variabilis sólo ha sido repor-tado en el Eoceno de Colombia por Gon-zález (1967), en la primera descripciónpublicada de un manglar eoceno. Suabundancia y patrones de distribución, si-milares a los de componentes actuales delos manglares (concretamente Rhizopho-ra), llevó al autor a considerarlo un ele-mento importante de estas comunidades.Graham (1995) es más enfático al consi-derar que este polen corresponde clara-mente al equivalente ecológico de Rhizo-phora. Otros autores, sin embargo, no leconceden la misma importancia (Frederik-sen, 1985) o simplemente, no lo conside-ran (Thanikaimoni, 1987). Otras especiesde polen fósil que han sido consideradospertenecientes a las comunidades costerasde manglar son Proxapertites operculatusy Echitriporites trianguliformis, pero enopinión de Thanikaimoni (1987), no exis-ten evidencias suficientes para ello. Laprimera posee una morfología común amuchas palmas, tanto costeras como delinterior del continente (Lorente, 1986),por lo tanto, su inclusión en los mangla-res puede ser equívoca. De la segunda nose conoce la afinidad botánica, aunque esparecida al polen de algunas proteáceas(Germeraad et al., 1968), pero estudiosrecientes sugieren que se trata más biende polen de plantas que crecen en comu-nidades interiores (Rull, 1998).
En cuanto a la probablefisionomía de los manglares eocenos, elúnico de los cuatro componentes, que po-see ciertas adaptaciones morfológicaspropias de los árboles de manglar es Pe-lliciera (en el caso de B. variabilis, lodesconocemos), por lo que es muy posi-ble que la fisionomía de los manglareseocenos estuviera fuertemente condiciona-da por él. Nypa es un elemento propio dela cara más interna del manglar (Flenley,1979), al igual de Acrostichum, que pue-de llegar a crecer en aguas de muy bajasalinidad, incluso dulces (Chapman,1976; Tomlinson, 1986). Así pues, esprobable que el cinturón costero más ex-terno estuviera ocupado por Pelliciera yel más interno por Nypa, mientras queAcrostichum habitaba probablemente de-trás de los manglares, en los pantanoscosteros menos salinos (Rull, 1998). Sinembargo, de ser ciertas las inferencias deGonzález (1967) con respecto a B. varia-bilis, debemos considerar la posibilidad
de un cinturón externo donde sus plantasproductoras fueran importantes (Fig. 7).
LA SUSTITUCIÓN Y LOSMANGLARES POST-EOCENOS
En el Eoceno Tardío seempezó a preparar la sustitución, aunqueno tuvo lugar todavía. Apareció por pri-mera vez Zonocostites ramonae, el polenfósil de Rhizophora, en cantidades muypequeñas, por lo que puede ser conside-rado un elemento minoritario en los man-glares, que seguían dominados por Pelli-ciera (B. variablis desaparece al final delEoceno Medio), acompañada por Nypa yAcrostichum (Germeraad et al., 1968;Graham, 1995). En el Caribe es donde setienen los primeros registros de Rhizo-phora, cuya distribución eocena tambiénrefleja las costas del mar de Tethys, indi-cando que la conexión todavía no se ha-bía cerrado (Muller y Caratini, 1977). Alfinal del Eoceno se produce la extinciónde Nypa en toda el área del antiguo marde Tethys, excepto en la región indoma-lasia, situación que persiste hoy día (Fig.
6). Así pues, desapareció uno de loscomponentes más importantes de losmanglares neotropicales eocenos. La ex-plicación aceptada actualmente está rela-cionada con el clima. Se cree que, ade-más de la disminución de temperatura yel aumento en la aridez del final delEoceno, el establecimiento de un climacon estacionalidad pronunciada en la pre-cipitación fue también responsable (Ger-meraad et al., 1968; Muller, 1980). Ac-tualmente, esta palma sólo crece en cli-mas muy cálidos y húmedos (Thanikai-moni, 1980).
Después del Eoceno, so-bre todo en el Mioceno, se produjo unaumento espectacular de Rhizophora, quepasó a ser el elemento dominante y de-terminante de la fisionomía de los man-glares del Caribe (Thanikaimoni, 1987).Esto ocurrió cuando ya se había produci-do el cierre de la conexión Este-Oestepor el anterior mar de Tethys (Fig. 3) y apartir de ese momento las Rhizophora delNuevo Mundo evolucionaron separada-mente, originándose tres especies (R.mangle, R. racemosa y R. harrisonii) di-
Fig. 6. Distribución eocena (línea de trazos) y presente (línea contínua) de los dos compo-nentes mayoritarios de los manglares eocenos. Basado en Germeraad et al. (1968), Muller(1980, 1981), Thanikaimoni et al. (1984), Frederiksen (1980, 1985, 1988), Tomlinson(1986), Thanikaimoni (1987), Westgate and Gee (1990), Graham (1995), Pole andMacphail (1996).

360 NOV - DEC 1998, VOL. 23 Nº 6
ferentes de las cuatro asiáticas (R. api-culata, R. mucronata, R. stylosa y R.lamarckii). El mayor cambio ya se habíaproducido, los manglares eocenos, domi-nados por Pelliciera y Nypa, habían sidosustituidos por otros dominados por Rhi-zophora, donde Pelliciera era un compo-nente minoritario y terminaría por des-aparecer casi completamente y Nypa sehabía extinguido en la región (Fig. 8). Elcaso de Pelliciera también es interesante,
ya que en el Eoceno se extendía a la ma-yor parte del área del Caribe, mientrasque actualmente se restringe a una regiónmuy pequeña de Centroamérica (Fig. 6).Esta drástica reducción parece haberseiniciado en el Mioceno y completado enel Plioceno. Según Jiménez (1984), lasPelliciera actuales prefieren climas húme-dos, con abundante escorrentía superfi-cial, y están ausentes en zonas de climassecos. El mismo autor especula sobre laposibilidad de que los climas secos delNeógeno hayan ido restringiendo este gé-nero a los ‘refugios’ de mayor pluviosi-dad, que ocupan actualmente. Los otroscomponentes importantes, Avicennia yLaguncularia, aparecieron en el Miocenoy Plioceno (Fig. 7), respectivamente, que-dando así configurada la composicióntaxonómica típica de los manglares actua-les (Fig. 9). Una última adición impor-tante, la de Conocarpus, tuvo lugar en elCuaternario (Graham, 1995).
CONCLUSIONES Y DISCUSIÓN
El registro palinológicofósil permite constatar que la crisis delfinal del Eoceno afectó profundamente alas comunidades de manglares neotropi-cales. El cambio sufrido por las mismastiene dos componentes, la extinción delos principales elementos eocenos y laaparición evolutiva de los post-eocenos,que hay que analizar separadamente, puesno son simultáneos (Fig. 8) y tal vezobedezcan a causas diferentes. Por unaparte, la extinción de dos componentesimportantes (Nypa y B. variabilis) se pro-duce casi al mismo tiempo, al final delEoceno, mientras que la notable reduc-ción de otro (Pelliciera) es más gradual yno lleva a una desaparición total. La eli-minación de los dos primeros esta rela-cionada con la gran extinción del finaldel Eoceno; B. variabilis podría habersido victima de las primeras fases de di-cha crisis y Nypa de la última. No posee-mos información sobre la primera, perola segunda, como hemos visto, parece sermuy sensible a los cambios climáticos,sobre todo a la disminución de la tempe-ratura y humedad, y al aumento de laestacionalidad. Esto concuerda con la hi-pótesis de la influencia climática en esteevento de extinción, lo cual se une al he-cho de que en la literatura no se mencio-na la presencia de tectitas en los sedi-mentos asociados a la desaparición deNypa (Germeraad et al., 1968; Frederik-sen, 1985; Thanikaimoni, 1987). La su-pervivencia de Acrostichum y Pellicieraestá relacionada probablemente con unamayor plasticidad o capacidad de adapta-ción a diferentes condiciones ambientales.
En el caso de Acrostichum, su conocidatolerancia a un rango amplio de condicio-nes (físico-química del agua, iluminación,etc.) (Medina et al., 1990), la posibilidadde propagación vegetativa y su capacidadde colonizar ambientes perturbados(Chapman, 1976; Tomlinson, 1986), ledan una gran plasticidad fenotípica, capazde adaptarse a situaciones muy variadas.Por el contrario, Pelliciera, parece sermás estricta en sus requerimientos (Jimé-nez, 1984). Tal vez por eso la primera hapersistido sin grandes alteraciones, mien-tras que la segunda ha sufrido una pro-gresiva reducción, hasta su casi total ex-tinción, en el Plioceno. Sin embargo,queda un punto por aclarar: si Pellicieraes tan poco tolerante a climas secos, ¿porqué no despareció totalmente y al mismotiempo que Nypa? Se puede especularcon la intensidad de las variacionesclimáticas sucedidas y con diferentes ni-veles de tolerancia de estos dos taxa a latemperatura y humedad, pero esta es unacuestión que está todavía sobre el tapete.Muller (1980) explica la supervivencia dealgunos taxa tropicales, a pesar de la dis-minución de temperatura, por estar encierto modo pre-adaptados, al ser propiasde habitat montanos. Finalmente, Tomlin-son (1986) especula sobre la posibilidadde una combinación de condicionesclimáticas (incluyendo las glaciaciones),con cambios del nivel del mar y la com-petencia de Rhizophora para explicar elproceso de desaparición gradual de Pelli-ciera.
La aparición de los ele-mentos de los manglares post-eocenos seprodujo de forma progresiva (Fig. 8).Considerando además, no sólo losmangles propiamente dichos, sino tam-bién los elementos asociados (a nivel de
Fig. 7. Diferentes reconstrucciones de laposible composición de la vegetación coste-ra durante el Eoceno en el área del Caribe,basadas en análisis palinológicos.
Fig. 9. Composición general de la vegeta-ción costera post-eocena y actual en lascostas del Caribe. Basado en Muller(1959), Van der Hammen (1963), Chapman(1976), Tomlinson (1986), Tissot et al.(1988), Pannier y Fraíno (1989), Hambaleket al. (1994).
Fig. 8. Rangos de existencia de las princi-pales especies de polen de manglares en elTerciario y Cuaternario. Basado en Muller(1981), Lorente (1986), Frederiksen (1985),Thanikaimoni (1987), Graham (1995).

361NOV - DEC 1998, VOL. 23 Nº 6
género), el registro fósil nos muestra quetodas las extinciones ocurrieron al finaldel Eoceno, o poco antes (Fig. 10). Enotras palabras, desde el Oligoceno hastael presente, no se registra la extinción deningún género de los manglares neotropi-cales, cuya evolución ha estado caracteri-zada únicamente por un contínuo aumen-to de su riqueza florística (Graham,1995). La tasa de aumento taxonómico,sin embargo, no ha sido constante. Du-rante el Oligoceno y el Mioceno, la adi-ción de nuevos taxa se produjo a tasasmuy bajas, pero durante el Plioceno y elCuaternario se incorporaron las dos terce-ras partes de las especies que actualmentecrecen en estas comunidades. Así pues,se puede hablar de un ‘florecimiento’(por lo menos en lo que a biodiversidadse refiere) de los manglares, en tiemposmuy recientes, aunque fisionómicamenteel cambio tal vez no ha sido tan grande,ya que los dos principales constituyentes(Rhizophora y Avicennia) ya estaban pre-sentes en el Mioceno.
Resumiendo, se puedehablar de una desaparición súbita de losmanglares que caracterizaron el Eoceno,al final del mismo y su sustitución pormanglares post-eocenos de composicióntaxonómica muy diferente, que se hanido enriqueciendo progresivamente, peromás intensamente durante los últimos 5millones de años. Los dos tipos de man-glares no llegaron a coexistir. En la Fig.8 se puede observar que la única coinci-dencia es la presencia de Pelliciera enlos manglares post-eocenos dominadospor Rhizophora, donde era un elementoasociado. Con respecto a la causa o cau-sas de este cambio, es lógico pensar quese trate de las mismas que produjeron laextinción masiva del final del Eoceno anivel global. Entre ellas, las relacionadascon cambios climáticos intensos y decorta duración se ven especialmente favo-recidos por las evidencias aportadas aquí.
AGRADECIMIENTOS
Agradezco a T. Van derHammen y un segundo árbitro anónimola revisión crítica del manuscrito, sus co-mentarios y sugerencias.
REFERENCIAS
Allaby, M. y Lovelock, J. (1986): La gran ex-tinción. Blume, Madrid. 226 p.
Alvarez, L.W.; Alvarez, W.; Asaro, F. y Michel,H.V. (1980): Extraterrestrial cause for theCretaceous-Tertiary extinction. Science,208: 1095-1108.
Berggren, W.A., Kent, D. V., Swisher III, C. C.y Aubry, M.-P. (1995): A revised Cenozoic
geochronology and chronostratigraphy. So-ciety of Economic Paleontologists and Min-eralogists Special Publication, 54: 129-212.
Cavelier, C.; Chateauneuf, J.-J.; Pomerol, Ch.;Rabussier, D.; Renard, M. y Vergnaud-Grazzini, C. (1981): The geological eventsat the Eocene/Oligocene boundary. Palaeo-geography, Palaeoclimatology, Palaeoecol-ogy, 36: 223-248.
Chapman, V. J. (1976): Mangrove vegetation. J.Cramer, Vaduz. 447 p.
Colmenares, O. A. y Terán, L. (1993): A bios-tratigraphic study of Paleogene sequences inWestern Venezuela. Palynology, 17: 67-89.
Cooper, A. y Penny, D. (1997): Mass survivalof birds across the Cretaceous-Tertiaryboundary: molecular evidence. Science,275: 1109-1113.
Duke, N. C. (1995): Genetic diversity,distributional barriers and rafting continents- more thoughts on the evolution ofmangroves. Hydrobiologia, 295: 167-181.
Flenley, J. R. (1979): The equatorial rainforest: a geological history. Butterworths,London. 151 p.
Frakes, L. A. (1979): Climates throughout geo-logic time. Elsevier, Amsterdam. 310 p.
Frederiksen, N. O. (1980): Sporomorphs fromthe Jackson Group (Upper Eocene) and ad-jacent strata of Mississippi and westernAlabama. United States Geological SurveyProfessional Paper, 1084: 1-75.
Frederiksen, N. O. (1985): Review of early Ter-tiary sporomorph palaeoecology. AmericanAssociation of Stratigraphical PalynologistsContributions Series, 19: 1-92.
Frederiksen, N. O. (1988): Sporomorph bios-tratigraphy, floral changes, and paleoclima-tology, Eocene and earliest Oligocene ofthe eastern Gulf Coast. Unites States Geo-logical Survey Professional Paper, 1448: 1-68.
Germeraad, J. H.; Hopping, C. A. y Muller, J.(1968): Palynology of Tertiary sedimentsfrom tropical areas. Review of Palaeobotanyand Palynology, 6: 189-348.
González, A. E. (1967): A palynological studyof the Upper Los Cuervos and Miradorformations. Brill, Leyden. 67 p.
Graham, A. (1995): Diversification of Gulf/Caribbean mangrove communities throughCenozoic time. Biotropica, v. 27, p. 20-27.
Hambalek, N.; Rull, V.; Digiacomo, E. y Díazde Gamero, M.L. (1994): Evolución paleo-ecológica y paleoambiental de la secuenciadel Neógeno en el Surco de Urumaco, esta-do Falcón. Estudio palinológico y litoló-gico. Bol. Soc. Venezolana de Geól., 19(1-2): 7-19.
Jiménez, J. A. (1984): A hypothesis to explainthe reduced distribution of the mangrocePellicier rhizophorae Tr. y Pl. Biotropica,16(4): 304-308.
Kauffman, E. G. y Harries, P. J. (1996): Lasconsecuencias de la extinción en masa. Pre-dicciones para la supervivencia y regenera-ción en ecosistemas antiguos y modernos.En Agustí, J. (ed.), La lógica de las extin-ciones. Tusquets Ed., Barcelona. pp. 17-60.
Keller, G. (1986): Stepwise mass extinctionsand impact events: Late Eocene to EarlyOligocene. Marine Micropaleontology, 10:267-293.
Keller, G.; Li, L. y McLeod, N. (1995): TheCretaceous/Tertiary boundary stratotype sec-tion at El Kef, Tunisia: how catastrophicwas the mass extinction? Palaeogeography,Palaeoclimatology, Palaeoecology, 119:221-254.
Lorente, M. A. (1986): Palynology andpalynofacies of the Upper Tertiary in Ven-ezuela. Dissertationes Botanicae, 99: 222 p.
Margalef, R. (1996): ¿Pueden ser de origenendógeno las grandes catástrofes de laBiosfera? La otra sombra de Gaia. EnAgustí, J. (ed.), La lógica de las extincio-nes. Tusquets Ed., Barcelona. pp. 17-60.
Margalef, R. (1997): Our Biosphere. EcologyInstitute, Oldendorf/Luhe. 176 p.
McCoy, E. D. y Heck, Jr., K. L. (1976):Biogeography of corals, seagrasses, and
Fig. 10. Extinciones y apariciones evolutivas de los géneros de manglar del Caribe y el Gol-fo de México desde el Eoceno hasta el presente. Se indica el número de taxa de cada época(barras negras centradas) y la cantidad de los mismos que se extinguen o aparecen en elpaso de una a otra época (barras grises en los límites). Según datos de Graham (1995).

362 NOV - DEC 1998, VOL. 23 Nº 6
mangroves: an alternative to the center oforigin concept. Systematic Zoology, 25:201-210.
McLean, D. M. (1985): Deccan Traps mantledegassing in the terminal Cretaceous marineextinctions. Cretaceous Research, 6: 235-269.
Medina, E.; Cuevas, E.; Popp, M. y Lugo, A. E.(1990): Soil salinity, sun exposure, andgrowth of Acrostichum aureum, the man-grove fern. Botanical Gazette, 151(1): 41-49.
Méon, H. (1990): Palynologic studies of theCretaceous-Tertiary boundary interval at ElKef outcrop, northwestern Tunisia: Paleo-geographic implications. Review of Palaeo-botany and Palynology, 65: 85-94.
Molina, E. (1995): Modelos y causas deextinción masiva. Interciencia, 20(2): 83-89.
Muller, J. (1959): Palynology of recent Orinocodelta and shelf sediments. Micropaleontol-ogy, 5(1): 1-32.
Muller, J. (1980): Palynological evidence forPaleogene climatic changes. Mémoires duMúseum National d’Histoire Naturelle,Nouv. Sér., Sér. B, Botanique, XXVI: 211-218.
Muller, J. (1981): Fossil pollen records ofextant angiosperms. The Botanical Review,47(1): 1-142.
Muller, J. y Caratini, C. (1977): Pollen of Rhi-zophora (Rhizophoraceae) as a guide fossil.Pollen et Spores, XIX(3): 361-389.
Muller, J.; Di Giacomo, E. y Van Erve, A.W.(1987): A palynological zonation for theCretaceous, Tertiary, and Quaternary of
Northern South America. AmericanAssociation of Stratigraphical PalynologistsContributions Series, 19: 7-76.
Pannier, F. y Fraíno, R. (1989): Manglares deVenezuela. Cuadernos Lagoven, Caracas. 67p.
Pole, M. S. and Macphail, M. K. (1996):Eocene Nypa from Regatta Point, Tasmania.Review of Palaeobotany and Palynology,92: 55-67.
Rull, V. (1997): Oligo-Miocene palynology ofthe Rio Chama sequence (Western Venezue-la), with comments on fossil algae aspaleoenvironmental indicators. Palynology,21: 213-229.
Rull, V. (1998): Middle Eocene mangroves andvegetation changes in the Maracaibo basin,Venezuela. Palaios, 13(3): 73-82.
Sharpton, V. L. et al. (1992): More linksbetween the Chicxulub impact structure andthe Cretaceous/Tertiary boundary. Nature,359: 819-821.
Srivastava, S. K. (1994): Palynology of theCretaceous-Tertiary boundary in theScollard Formation of Alberta, Canada, andglobal KTB events. Review of Palaeobotanyand Palynology, 83: 137-158.
Thanikaimoni, G. (1987): Mangrove Palynology.Institut français de Pondichéry, travaux dela Section Scientifique et Technique, XXIV:100 p.
Thanikaimoni, G.; Caratini, C.; Venkatachala,B. S.; Ramanujam, C. G. K. y Kar, R. K.(1984): Selected Tertiary angiospermpollens from India and their relationshipwith African Tertiary pollens. Institutfrançais de Pondichéry, Travaux de la
Section Scientifique et Technique, XIX: 1-92.
Tissot, C., Djuwansah, M.R. y Marius, C.(1988): Evolution de la mangrove enGuyane au cours de l’Holocene. Etudepalynologique. Institut français dePondichéry, Travaux de la SectionScientifique et Technique, XXV: 125-137.
Tomlison, P. B. (1986): Mangrove botany.Cambridge Univ. Press, Cambridge. 413 p.
Van der Hammen, T. (1957): Climaticperiodicity and evolution of SouthAmerican Maastrichtian and tertiary floras.Boletín Geológico, V(2): 49-91.
Van der Hammen, T. (1961): Upper Cretaceousand Tertiary climatic periodicities and theircauses. Ann. New York. Acad. Sci., 5: 440-448.
Van der Hammen, T. (1963): A palynologicalstudy on the Quaternary of British Guiana.Leidse Geologische Mededelingen, 29: 125-180.
Van der Hammen, T. (1964): Paläoclima,Stratigraphie und Evolution. Geol.Rundschau, 54: 428-441.
Westgate, J. W. y Gee, C. T. (1990): Palaeo-ecology of a middle Eocene mangrove biota(vertebrates, plants and invertebrates) fromsouthwest Texas. Palaeogeography, Palaeo-climatology, Palaeoecology, 78:163-177.
Wijmstra, T. A. (1968): The identity ofPsilatricolporites and Pellicier. Acta Bot.Neerl., 17(2): 114-116.
Woodroffe, C. D. y Grindrod, J. (1991):Mangrove biogeography: the role ofQuaternary environmental and sea-levelchanges. Jour. Biogeography, 18: 479-492.

1
THE EVOLUTION OF NEOTROPICAL MANGROVES: THE EOCENE CRISIS Valentí Rull PDVSA Exploration and Production, Caracas, Venezuela. Postal address: PO box 829, Caracas 1010-A, Venezuela. Email: [email protected]. Keywords: mangroves, palynology, biogeography, evolution, extinction, Neotropics, Eocene Note. This paper is the English translation of a former paper published in Spanish 23 years ago. The original reference is Rull, V. 1998. Evolución de los manglares neotropicales. La crisis del Eoceno. Interciencia, 23: 355-362. The translation has been performed by the author according to the original text, without any modification, correction or updating. Some minor errors have been fixed. The figures are original, and the text inside has not been translated. The present address of the author is Valentí Rull, Laboratory of Paleoecology, Geosciences Barcelona (CSIC), C. Lluís Solé i Sabarís s/n, 08028 Barcelona, Spain. Email: [email protected]

2
Introduction The physiognomy of extant Neotropical mangroves, including the Caribbean and the adjacent Atlantic and Pacific coasts, is shaped by four main genera of mangrove trees: Rhizophora (Rhizophoraceae), Avicennia (Avicenniaceae), Laguncularia (Combretaceae) and Pelliciera (Tiliaceae) (Tomlinson, 1986; Graham, 1995). Some authors also include Conocarpus (Chapman, 1976). However, the mangroves of this region have experienced deep evolutionary, biogeographical and ecological variations through time, which have led to quantitative shifts in biodiversity and spatial distribution, as well as qualitative changes in taxonomic composition. Although the oldest known Neotropical mangrove genus is Nypa, a palm dating back to the Late Cretaceous now restricted to the SE Asia mangroves (Fig. 1), the time of emergence of the first Neotropical mangrove communities is difficult to establish. The concept of mangroves is intimately associated with a particular physiognomy, which is difficult to detect in the fossil record, which consists mainly of pollen. The existence of mangroves is deduced from the botanical affinity of this fossil pollen with known extant mangrove species. The ignorance of the botanical affinities for most Cretaceous pollen prevents support or rejection of the occurrence of mangroves of this age. In contrast, the occurrence of well-developed mangrove communities in the Caribbean and the Gulf of Mexico during the Eocene and their progressive taxonomic enrichment during the last 50 million years seem well established. The increase in richness is manifested as a change from the barely 4 Early Eocene mangrove genera to the extant 27 genera, including the dominant and accompanying mangrove elements (Graham, 1995). This enrichment, however, has not been a gradual and uninterrupted process but has proceeded as a succession of more or less stable phases and times of intense diversification and immigration, drastic reductions in the geographical range of some taxa and even true mass extinctions.
Figure 1. Geochronological reference chart. Ages according to Berggren et al. (1995).

3
According to Van der Hammen (1957, 1961, 1964), the vegetation changes, in general, occurred in a periodical fashion, and their palynological expression consisted of quantitative cyclic shifts in certain taxa and significant qualitative variations (appearances and extinctions) of others. Both phenomena seem to have had a single cause that, according to Van der Hammen (1964), was the climatic periodicity under astronomical control. This review deals with one of the extinction events, that at the Eocene/Oligocene boundary, when Neotropical mangrove communities underwent their major evolutionary revolution. The main aims are to illustrate this change and to discuss its possible causes using the available literature, as well as to provide the interested readers with a way of obtaining more information by reproducing the original fossil pollen of the main taxa involved and giving access to a representative literature that may serve as a starting point for more focused investigations. The paper is intended for any researcher interested in the topic, especially ecologists studying extant mangroves, in the hope that the information on the past may be useful to better understand the present mangrove ecology and to predict with more reliability (or at least with more empirical basis) what may occur in the future. Mass extinctions and their causes The first large biological crisis and mass extinction that usually comes to mind occurred at the Cretaceous/Tertiary boundary (KT), 65 million years ago (Ma). The popularity of this event is likely due to the extinction of living beings as spectacular as the dinosaurs and to the fact that the most accepted cause was the impact of a large meteorite, which would have significantly affected the whole biosphere. Allaby & Lovelock (1986) provided a detailed description of the events that would have occurred. Among the localities proposed, the most likely site of meteorite impact has been located in the Caribbean region (Yucatán, México), where a submarine crater approximately 180 km in diameter has been identified using satellite imagery (Sharpton et al., 1992). The meteorite impact had already been deduced before the finding of this structure, due to the presence of microtektites (spherules resulting from the instantaneous fusion of rocks due to impact) and an iridium-rich clay layer around the KT boundary, in several parts of the world. According to the defenders of the meteorite impact hypothesis, the high iridium concentration could not be explained by the impact of rocks from our own planet and required an additional extraterrestrial source to produce such elevated concentrations (Alvarez et al., 1980). Other hypotheses are less spectacular and attempt to explain mass extinction events by worldwide ecological changes, mainly the increase in atmospheric CO2 and the ensuing climatic deterioration due to the “greenhouse effect” (McLean, 1985). According to Margalef (1996, 1997), the retention of CO2 in a sea with an anoxic bottom layer for one million years and its further release to the atmosphere may led to a 2- to 5-fold increase in atmospheric CO2. The fact that many groups of organisms did not disappear after the Cretaceous has reinforced these explanations based on environmental changes that could have selectively affected the organisms more sensitive to environmental factors. Among the survivors of the KT boundary extinction, the birds and the plants are especially noteworthy (Méon, 1994; Cooper & Penny, 1997), whereas the majority of extinctions occurred in marine unicellular organisms living in shallow waters, such as benthic foraminifers and planktonic algae (Keller et al., 1995). This fact suggests that variations in sea level could have also had an influence. As an example, a sea-level decrease of 100-120 m would have left the continental shelf totally exposed, which could have caused the disappearance of the habitat of many shallow-water organisms. Such changes have occurred recurrently during the history of life on Earth (for example, during glaciations), and their impact on the extinction of many species is beyond all doubt.

4
However, the KT extinction was not the most severe, considering the number of taxa that disappeared. The greatest extinction occurred at the Permian/Triassic boundary, 250 Ma. The KT extinction was also not the most recent, as another mass extinction occurred 37 Ma, at the Eocene/Oligocene (EO) boundary. In total, it has been estimated that 14 to 18 mass extinction events took place during the history of life on Earth, possibly following a rhythmic pattern (Kauffman & Harries, 1996). Not all extinctions have been attributed to a single cause. In a synthetic review, Kauffman & Harries (1996) classified the potential causes as terrestrial and extraterrestrial. Among the former, the most accepted are global-scale volcanism, gassing from the terrestrial mantle, rapid sea-level decreases and anoxic events in the oceans linked to rapid temperature changes and glaciation. The most relevant extraterrestrial causes could be giant solar eruptions, proximity to a supernova, star approach, displacement along the galactic plane, meteorite impacts, and meteorite and comet storms. The Eocene/Oligocene boundary The crisis of the EO boundary affected the majority of organismal groups, including marine plankton and benthos (coccolithophores, foraminifers, radiolarians, ostracods, and mollusks); vertebrates, which experienced a reduction of 60%; and terrestrial plants (Cavelier et al., 1981; Molina, 1995). This was the most important extinction event of the Tertiary and removed a large part of the typical Eocene species, which were replaced during the Oligocene by others that gave rise to the present biota (Molina, 1995). For example, in the case of continental plants, palynological evidence suggested that the last drastic floral change that led to present-day groups occurred at the EO boundary (Muller, 1980), rather than at the Oligocene/Miocene boundary (Van der Hammen, 1957; 1961; 1964), which marks the boundary between the Paleogene and the Neogene. Therefore, there is no Paleogene flora and another of Neogene origin, but an Eocene flora and an ensuing post-Eocene, or modern, flora. The EO extinction was not the result of a single event but of at least four stepwise extinction episodes that occurred over 2-3 million years, between the beginning of the Late Eocene and the EO boundary (Keller, 1986). Each of these episodes would have involved the extinction of approximately 15% of Eocene species, for a total of approximately two-thirds of the Eocene biota, which is rather significant. Regarding the causes of the EO extinction event, there is some general consensus. The occurrence of microtektite accumulation levels close to the EO boundary suggests the potential action of meteorite impacts. This is consistent with the presence of several craters of similar ages (37-39 Ma) (Keller, 1986). However, the meteorite impacts, albeit well documented, seem to have been of a magnitude insufficient to cause a mass extinction but sufficient to cause only local extinctions followed by rapid recolonizations (Molina, 1995). In addition, the only extinction episode truly associated with the presence of tektites was the third, occurring by 37 Ma (Kauffman & Harries, 1996). Hypotheses involving major environmental changes seem more well suited. On the one hand, the EO boundary was characterized by frequent worldwide chemical fluctuations, indicating large disruptions in oceanic and atmospheric global circulation patterns. On the other hand, intense and abrupt cooling was recorded at the end of the Eocene (Fig. 2), leading to glacial temperatures in the oceans and ice accumulation in the polar areas. In addition, precipitation experienced a sudden and intense reduction from a maximum recorded just before the end of the Eocene to minimal values that persisted throughout the Oligocene. Therefore, it is reasonable to infer that a large part of the Eocene biota, adapted to warm and wet climates, would have disappeared because of the incoming abrupt shift to cold and dry conditions. It is generally accepted that this climate change was linked to continental drift, especially to the migration of Australia and its separation from Antarctica (Fig. 3), which created a path favoring the passage of marine polar currents to the Tethys region (Muller, 1980). This change not only led to the cooling of tropical areas but also affected global climates by creating

5
a new oceanic circulation system and a cold water layer in the deep oceans (psychrosphere) and promoting glaciations and sea-level drops that also contributed to mass extinction (Molina, 1995).
Figure 2. Global variations in temperature and precipitation during the Cretaceous and the Tertiary. Modified from Frakes (1979).
Figure 3. Position of the continental masses in the Late Cretaceous. Note that Antarctica and Australia were still together; their separation did not occur until the Late Eocene, thus allowing the physical connection of polar seas with the rest of the oceans.
The Eocene Neotropical mangroves How did EO boundary events affect Neotropical mangroves? First, it is necessary to note that the Neotropical flora, in general, underwent significant turnover across this boundary (Rull, 1997). For example, in northern South America, approximately 50% of the main fossil pollen species became extinct or appeared for the first time across the EO boundary (Fig. 4). Only half of the taxa crossed the boundary, which means that only half of the main components of the Eocene flora persisted in the post-Eocene flora. If we look at the mangrove trees, only one of

6
the four extant species mentioned above (i.e., Pelliciera) was already present in the Eocene. The so-called mangrove fern (Acrostichum aureum), which is very common but not physiognomically determinant in present-day mangrove communities, was also present. The Eocene mangroves also included Nypa and an unknown component, represented by the fossil pollen species Brevitricolpites variabilis (Graham, 1995). Figure 5 shows the fossil pollen of the three main components of Eocene mangroves of northern South America, which will be briefly analyzed below.
Figure 4. Fossil pollen species extinction and appearance across the Eocene/Oligocene boundary in northern South America. (Modified from Muller et al. (1987).
Figure 5. Fossil pollen of the three main representatives of the Eocene mangroves. 1) Deltoidospora adriennis (botanical affinity: Acrostichum aureum). 2) Spinizonocolpites echinatus (botanical affinity: Nypa). 3) Psilatricolporites crassus (botanical affinity: Pelliciera). The reproduced specimens correspond to the Middle Eocene of the Maracaibo Basin. Photos: V. Rull.
The first known records of Pelliciera correspond to the Early Eocene, but some of these records might be doubtful due to potential confusion of its fossil pollen (Psilatricolporites crassus) with

7
the pollen of Hura crepitans (Muller, 1981). In either case, it seems that Pelliciera is not older, and it is also well accepted that it was an important component of the Eocene Neotropical mangroves (Germeraad et al., 1968; Wijmstra, 1968). The presence of this species in tropical Africa has not been confirmed (Muller, 1981); therefore, it seems that Pelliciera is a typically Neotropical mangrove component both in origin and in geographical distribution (Fig. 6). The fossil record of Acrostichum, represented by Deltoidospora adriennis, goes back to the Paleocene (Thanikaimoni, 1987), possibly before (Graham, 1995). Although Frederiksen (1985) points out that it is almost impossible to differentiate D. adriennis from some Lygodium species, Graham (1995) believes that Acrostichum was an important component of the Eocene Neotropical mangroves. The fossil pollen of Nypa, known as Zonocolpites, has been recorded since the Late Cretaceous, when it was present almost simultaneously in the Caribbean, Africa, India and Borneo (Muller, 1981). By that time, the Atlantic Ocean was still emerging, India was separated from Asia, and the Panamá Isthmus was still absent (Fig. 3). The Tethys Sea, the large tropical sea separating Laurasia and Gondwana during the Cretaceous, still existed and provided a global connection for marine ecosystems, the mangroves among them, favoring the occurrence of pantropical elements such as Nypa (Fig. 6).
Figure 6. Eocene (dashed lines) and present (solid lines) distributions of the two main components of the Eocene mangroves. Based on Germeraad et al. (1968), Muller (1980, 1981), Thanikaimoni et al. (1984), Frederiksen (1980, 1985, 1988), Tomlinson (1986), Thanikaimoni (1987), Westgate & Gee (1990) and Pole & Mcphail (1996).
For mangroves, both continental masses and large oceans may constitute biogeographical barriers. An example can be found in the Pacific Ocean, where mangroves are absent on islands situated between approximately 90⁰W (Galápagos Islands) and 170⁰W (Samoa) (Tomlinson, 1986). This has been explained by dispersal limitations or by disruptions in the distribution area due to continental drift (Woodroffe & Grindrod, 1991; Duke, 1995). Apparently, the environmental conditions of the islands situated in this region are not adverse for the existence of mangroves, as suggested by the healthy growth of human-introduced mangrove communities in Hawaii. Therefore, the existence of Tethys – a continuous tropical sea with thousands of kilometers of coasts on both sides – was excellent for mangrove expansion, regardless of

8
whether the mechanism was migrational or due to fragmentation and subsequent continental drift (McCoy & Heck, 1976; Duke, 1995). Finally, the fossil pollen Brevitricolpites variabilis has only been reported in the Colombian Eocene by González (1967), in the first published description of an Eocene mangrove. The abundance and distribution patterns of this Eocene pollen were similar to those of modern mangroves (specifically Rhizophora), and the author inferred that the parent plant would have been an important mangrove component. Graham (1995) was more emphatic and considered B. variabilis to be the ecological equivalent of the extant Rhizophora. However, other authors disagree or ignore this fossil pollen taxon (Frederiksen, 1985; Thanikaimoni, 1987). Other species of fossil pollen that have been considered mangrove components are Proxapertites operculatus and Echitriporites trianguliformis, but according to Thanikaimoni (1987), the evidence is not conclusive. The pollen of the first species is morphologically similar to the pollen of many palms living in both coastal and inland environments (Lorente, 1986). The botanical affinity of the second fossil species is unknown, and despite its similarity to some extant Proteaceae (Germeraad et al., 1967), recent studies suggest that the parent plant could be more typical of inland communities (Rull, 1998). Regarding physiognomy, the only Eocene element with morphological adaptations typical of extant mangroves is Pelliciera (the case of B. variabilis is unknown). Therefore, it is possible that the physiognomy of the Eocene mangroves was strongly determined by this mangrove tree. Nypa is an element of the more internal mangrove fringe (Flenley, 1979), as is Acrostichum, which can tolerate low-salinity environments and even freshwater (Chapman, 1976; Tomlinson, 1986). Therefore, it is possible that in the Eocene mangroves, the more external coastal fringe was dominated by Pelliciera, with Nypa on the most internal side and Acrostichum in a back-mangrove position in less saline coastal swamps (Rull, 1998). If the abovementioned inferences about B. variabilis are true, the possibility of its parent plant living in the external mangrove fringe should also be considered (Fig. 7). Floristic turnover and the post-Eocene mangroves Floristic replacement began, but was not completed, in the Late Eocene. The first modern mangrove element to appear was Rhizophora, represented by its fossil pollen (Zonocostites ramonae) in small amounts, which suggested that it was a minor component of coastal communities, still dominated by Pelliciera (B. variabilis disappeared earlier, at the end of the Middle Eocene), accompanied by Nypa and Acrostichum (Germeraad et al., 1968; Graham, 1995). The first records of Rhizophora were found in the Caribbean, and its Eocene distribution also reproduces the coasts of the Tethys Sea, which indicates that the connection was still open (Muller & Caratini, 1977). At the end of the Eocene, Nypa went extinct in most of the Tethys area except the Indomalayan region, a situation that persists today (Fig. 6). This represented the extinction of one of the most important components of the Eocene Neotropical mangroves. Currently, the most accepted explanation is linked to climate. It has been suggested that in addition to the temperature decrease and the aridity increase that occurred at the end of the Eocene, the incoming of a pronounced seasonality in the precipitation regime was also involved (Germeraad et al., 1967; Muller, 1980). At present, Nypa palms only grow in very warm and wet climates (Thanikaimoni, 1980). A spectacular increase in Rhizophora was recorded in post-Eocene times, mainly during the Miocene, and this taxon became the dominant component of Caribbean mangroves and the main taxon responsible for their physiognomy (Thanikaimoni, 1987). This occurred when the east-west connection provided by the ancient Tethys Sea was already closed (Fig. 3). From that

9
Figure 7. Different reconstructions of the possible composition of the Eocene coastal vegetation in the Caribbean area, based on palynological analyses.
moment, the New World Rhizophora lineage evolved separately, giving rise to three species (R. mangle, R. racemosa and R. harrisonii), different from the four Asian species (R. apiculata, R. mucronata, R. stylosa and R. lamarckii). The most important change had already occurred. Indeed, the Eocene mangrove communities of the Neotropics, dominated by Pelliciera and Nypa, had been replaced by others dominated by Rhizophora, with Pelliciera as a minor component and without Nypa, which had gone extinct in the region (Fig. 8). The case of Pelliciera is interesting because the genus was widespread across the Caribbean region during the Eocene but is now restricted to a small region in Central America (Fig. 6). This drastic reduction sems to have been initiated in the Miocene and completed in the Pliocene. According to Jiménez (1984), the extant Pelliciera require wet climates with abundant surficial runoff and are absent in arid climates. The same author speculates about the possibility of a progressive reduction in

10
Pelliciera due to Neogene aridity until its confinement to present-day pluvial refugia. The other important components of post-Eocene mangroves, Avicennia and Laguncularia, appeared in the Miocene and Pliocene, respectively, to set up the taxonomic composition of present-day Neotropical mangroves (Fig. 9). The latest significant addition was Conocarpus, which appeared in the Quaternary (Graham, 1995).
Figure 8. Pollen stratigraphic ranges of the main species of mangroves during the Tertiary and the Quaternary. Based on Muller (1981), Lorente (1986), Frederiksen (1985), Thanokaimoni (1987) and Graham (1995).
Figure 9. General composition of the post-Eocene and present-day coastal vegetation on Caribbean coasts. Based on Muller (1959), Van der Hammen (1963), Chapman (1976), Tomlinson (1986), Tissot et al. (1988), Pannier & Fraíno (1989) and Hambalek et al. (1994).
Conclusions and discussion The fossil pollen record allowed us to verify that the terminal Eocene crisis deeply affected the Neotropical mangrove communities. The change in these communities involved two main components, namely, the extinction of the main Eocene elements and the evolutionary appearance of the post-Eocene elements, which were not simultaneous (Fig. 8) and might be attributed to different causes. Regarding Eocene taxa, the extinction of two important elements

11
(Nypa and B. variabilis) was almost coeval at the end of the Eocene, whereas the drastic reduction in Pelliciera was gradual and did not end in the extinction of this taxon. The extinction of the two dominant elements has been linked to the mass extinction that occurred at the end of the Eocene; B. variabilis could have disappeared in the first phases of this mass extinction and Nypa in the terminal phase. No information is available on the autecology of the former, but the latter seems to be very sensitive to climatic changes, especially to decreases in temperature and increases in aridity and seasonality. These observations, together with the absence of a reference to the presence of tektites in the sediments associated with the disappearance of Nypa (Germeraad et al., 1968; Frederiksen, 1985; Thanikaimoni, 1987), favor the hypothesis of climatic change as an important driver of this particular extinction event. The survival of Acrostichum and Pelliciera might be associated with greater plasticity or adaptability to environmental conditions. The phenotypic plasticity of Acrostichum is well known and confers this taxon the ability to live in a wide range of environments. This plasticity is manifested, for example, in tolerance to a wide range of water and light conditions (Medina et al. 1990), the possibility of vegetative propagation and the ability to colonize disturbed habitats (Chapman, 1976; Tomlinson, 1986). In contrast, Pelliciera seems to be stricter in its ecological requirements (Jiménez, 1984). These differences may explain why Acrostichum has persisted without significant variations, whereas Pelliciera experienced a drastic reduction until the Pliocene, when it attained its present range. An unanswered question is why Pelliciera did not disappear from the Neotropics as it occurred with Nypa, if both are intolerant to dry climates. One may speculate that the answer lies in the intensity of climate change and differences in the tolerance of these two taxa to changes in temperature and moisture, but the question remains open. Muller (1980) suggested that some taxa of montane origin might be preadapted and, hence, able to survive under lower temperatures in nonmontane habitats. Tomlinson (1986) proposed that the gradual decrease in Pelliciera could be due to a combination of several factors, including glaciations, sea-level changes and competition with Rhizophora. The evolutionary appearance of the post-Eocene mangrove elements proceeded in a gradual fashion, with no extinctions recorded since the Oligocene (Fig. 8). Indeed, the fossil record shows that all extinctions – including not only the main mangrove trees but also the other associated elements – occurred at the end of the Eocene or earlier (Fig. 10). Since the Oligocene, the evolution of Neotropical mangroves has been characterized by progressive taxonomic enrichment (Graham, 1995). However, the rate of enrichment has not been constant. During the Oligocene and the Miocene, the addition of new taxa proceeded at low rates, but during the Pliocene and the Quaternary, the enrichment accelerated, and two-thirds of the extant mangrove taxa were incorporated. Therefore, the biodiversity “flourishment” of Neotropical mangroves occurred very recently, although physiognomical changes should not have been significant, as the main mangrove trees (Rhizophora and Avicennia) were already present since the Miocene. In summary, the Eocene Neotropical mangroves disappeared abruptly at the end of this epoch and were replaced by post-Eocene mangroves, which had a very different taxonomic composition and have been progressively enriched taxonomically, especially during the last 5 million years. These two types of mangroves did not coexist at any time. Figure 8 shows that the only coincidence was the presence of Pelliciera, as a minor associated element, in the post-Eocene mangroves dominated by Rhizophora. The same causes suggested by the global mass extinction that occurred at the end of the Eocene have been invoked for the total mangrove replacement. Among these causes, those related to short but intense climatic changes seem to be especially favored by the evidence disclosed here.

12
Figure 10. Number of extinctions and evolutionary appearances of Caribbean and Gulf of Mexico mangrove genera between the Eocene and the present. Raw data from Graham (1995).
Acknowledgments I am grateful to T. Van der Hammen and a second anonymous reviewer for their critical revision of the manuscript, comments and suggestions.

13
References Allaby, M. & Lovelock, J. 1986. La gran extinción. Blume, Madrid. Alvarez, L.W.; Alvarez, W.; Asaro, F. & Michel, H.V. 1980. Extraterrestrial cause for the
Cretaceous-Tertiary extinction. Science, 208: 1095-1108. Berggren, W.A., Kent, D. V., Swisher III, C. C. & Aubry, M.-P. 1995. A revised Cenozoic
geochronology and chronostratigraphy. Society of Economic Paleontologists and Mineralogists Special Publication, 54: 129-212.
Cavelier, C.; Chateauneuf, J.-J.; Pomerol, Ch.; Rabussier, D.; Renard, M. & Vergnaud-Grazzini, C. 1981. The geological events at the Eocene/Oligocene boundary. Palaeogeography, Palaeoclimatology, Palaeoecology, 36: 223-248.
Chapman, V.J. 1976. Mangrove vegetation. J. Cramer, Vaduz. Colmenares, O.A. & Terán, L. 1993. A biostratigraphic study of Paleogene sequences in
Western Venezuela. Palynology, 17: 67-89. Cooper, A. & Penny, D. 1997. Mass survival of birds across the Cretaceous-Tertiary boundary:
molecular evidence. Science, 275: 1109-1113. Duke, N.C. 1995. Genetic diversity, distributional barriers and rafting continents - more thoughts on the evolution of mangroves. Hydrobiologia, 295: 167-181. Flenley, J.R. 1979. The equatorial rain forest: a geological history. Butterworths, London. Frakes, L.A. 1979. Climates throughout geologic time. Elsevier, Amsterdam. Frederiksen, N.O. 1980. Sporomorphs from the Jackson Group (Upper Eocene) and adjacent
strata of Mississippi and western Alabama. United States Geological Survey Professional Paper, 1084: 1-75.
Frederiksen, N.O. 1985. Review of early Tertiary sporomorph palaeoecology. American Association of Stratigraphical Palynologists Contributions Series, 19: 1-92.
Frederiksen, N.O. 1988. Sporomorph biostratigraphy, floral changes, and paleoclimatology, Eocene and earliest Oligocene of the eastern Gulf Coast. Unites States Geological Survey Professional Paper, 1448: 1-68.
Germeraad, J.H.; Hopping, C.A. & Muller, J. 1968. Palynology of Tertiary sediments from tropical areas. Review of Palaeobotany and Palynology, 6: 189-348.
González, A.E. 1967. A palynological study of the Upper Los Cuervos and Mirador formations. Brill, Leyden.
Graham, A. 1995. Diversification of Gulf/Caribbean mangrove communities through Cenozoic time. Biotropica, 27: 20-27.
Hambalek, N.; Rull, V.; Digiacomo, E. & Díaz de Gamero, M.L. (1994): Evolución paleoecológica y paleoambiental de la secuencia del Neógeno en el Surco de Urumaco, estado Falcón. Estudio palinológico y litológico. Boletín de la Sociedad Venezolana de Geólogos, 19: 7-19.
Jiménez, J.A. 1984. A hypothesis to explain the reduced distribution of the mangroce Pelliciera rhizophorae Tr. & Pl. Biotropica, 16: 304-308.
Kauffman, E.G. & Harries, P.J. 1996. Las consecuencias de la extinción en masa. Predicciones para la supervivencia y regeneración en ecosistemas antiguos y modernos. En Agustí, J. (ed.), La lógica de las extinciones. Tusquets Ed., Barcelona, pp. 17-60.
Keller, G. 1986. Stepwise mass extinctions and impact events: Late Eocene to Early Oligocene. Marine Micropaleontology, 10: 267-293.
Keller, G.; Li, L. & McLeod, N. 1995. The Cretaceous/Tertiary boundary stratotype section at El Kef, Tunisia: how catastrophic was the mass extinction? Palaeogeography, Palaeoclimatology, Palaeoecology, 119: 221-254.
Lorente, M.A. 1986. Palynology and palynofacies of the Upper Tertiary in Venezuela. Dissertationes Botanicae, 99: 1-222.
Margalef, R. 1996. ¿Pueden ser de origenendógeno las grandes catástrofes de la Biosfera? La otra sombra de Gaia. En Agustí, J. (ed.), La lógica de las extinciones. Tusquets Ed., Barcelona, pp. 17-60.

14
Margalef, R. 1997. Our Biosphere. Ecology Institute, Oldendorf/Luhe. McCoy, E.D. & Heck, K.L. 1976. Biogeography of corals, seagrasses, and mangroves: an
alternative to the center of origin concept. Systematic Zoology, 25: 201-210. McLean, D.M. 1985. Deccan Traps mantle degassing in the terminal Cretaceous marine
extinctions. Cretaceous Research, 6: 235-269. Medina, E.; Cuevas, E.; Popp, M. & Lugo, A.E. 1990. Soil salinity, sun exposure, and growth of
Acrostichum aureum, the mangrove fern. Botanical Gazette, 151(1): 41-49. Méon, H. 1990. Palynologic studies of the Cretaceous-Tertiary boundary interval at El Kef
outcrop, northwestern Tunisia: Paleogeographic implications. Review of Palaeobotany and Palynology, 65: 85-94.
Molina, E. 1995. Modelos y causas de extinción masiva. Interciencia, 20: 83-89. Muller, J. 1959. Palynology of recent Orinoco delta and shelf sediments. Micropaleontology, 5:
1-32. Muller, J. 1980. Palynological evidence for Paleogene climatic changes. Mémoires du Múseum
National d’Histoire Naturelle, Nouv. Sér., Sér. B, Botanique, XXVI: 211-218. Muller, J. 1981. Fossil pollen records of extant angiosperms. The Botanical Review, 47: 1-142. Muller, J. & Caratini, C. 1977. Pollen of Rhizophora (Rhizophoraceae) as a guide fossil. Pollen et
Spores, XIX: 361-389. Muller, J.; Di Giacomo, E. & Van Erve, A.W. 1987. A palynological zonation for the Cretaceous,
Tertiary, and Quaternary of Northern South America. American Association of Stratigraphical Palynologists Contributions Series, 19: 7-76.
Pannier, F. & Fraíno, R. 1989. Manglares de Venezuela. Cuadernos Lagoven, Caracas. Pole, M.S. & Macphail, M.K. 1996. Eocene Nypa from Regatta Point, Tasmania. Review of
Palaeobotany and Palynology, 92: 55-67. Rull, V. 1997. Oligo-Miocene palynology of the Rio Chama sequence (Western Venezuela), with
comments on fossil algae as paleoenvironmental indicators. Palynology, 21: 213-229. Rull, V. 1998. Middle Eocene mangroves and vegetation changes in the Maracaibo basin,
Venezuela. Palaios, 13: 73-82. Sharpton, V.L.; Dalrymple, G.B.; Marín, L.E., Ryder, G.; Schuraytz, B.C. & Urrutia-Fucugauchi, J.
1992. New links between the Chicxulub impact structure and the Cretaceous/Tertiary boundary. Nature, 359: 819-821.
Srivastava, S.K. 1994. Palynology of the Cretaceous-Tertiary boundary in the Scollard Formation of Alberta, Canada, and global KTB events. Review of Palaeobotany and Palynology, 83: 137-158.
Thanikaimoni, G. 1987. Mangrove Palynology. Institut français de Pondichéry, travaux de la Section Scientifique et Technique, XXIV: 1-100.
Thanikaimoni, G.; Caratini, C.; Venkatachala, B.S.; Ramanujam, C.G.K. & Kar, R.K. 1984. Selected Tertiary angiosperm pollens from India and their relationship with African Tertiary pollens. Institut français de Pondichéry, Travaux de la Section Scientifique et Technique, XIX: 1-92.
Tissot, C., Djuwansah, M.R. & Marius, C. 1988. Evolution de la mangrove en Guyane au cours de l’Holocene. Etude palynologique. Institut français de Pondichéry, Travaux de la Section Scientifique et Technique, XXV: 125-137.
Tomlison, P.B. 1986. Mangrove botany.Cambridge Univ. Press, Cambridge. Van der Hammen, T. 1957. Climatic periodicity and evolution of South American Maastrichtian
and tertiary floras. Boletín Geológico, V: 49-91. Van der Hammen, T. 1961. Upper Cretaceous and Tertiary climatic periodicities and their
causes. Annals of the New York Academy of Sciences, 5: 440-448. Van der Hammen, T. 1963. A palynological study on the Quaternary of British Guiana. Leidse
Geologische Mededelingen, 29: 125-180. Van der Hammen, T. 1964. Paläoclima, Stratigraphie und Evolution. Geologische Rundschau,
54: 428-441.

15
Westgate, J.W. & Gee, C.T. 1990. Palaeoecology of a middle Eocene mangrove biota (vertebrates, plants and invertebrates) from southwest Texas. Palaeogeography, Palaeoclimatology, Palaeoecology, 78:163-177.
Wijmstra, T.A. 1968. The identity of Psilatricolporites and Pelliciera. Acta Botanica Neerlandica, 17(2): 114-116.
Woodroffe, C.D. & Grindrod, J. 1991. Mangrove biogeography: the role of Quaternary environmental and sea-level changes. Journal of Biogeography, 18: 479-492.