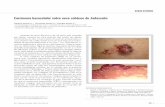
Carcinoma Basocelular Avanzado · •El carcinoma basocelular de piel es un tumor frecuente,...
Transcript of Carcinoma Basocelular Avanzado · •El carcinoma basocelular de piel es un tumor frecuente,...
Biopsia de un ca basocelular
• Nidos redondeados de
células “basaloides”
• Disposición en
empalizada
• Estroma fibromixoide
• Formación de
hendiduras
•3
Formas clínicas del
Carcinoma Cutáneo Basocelular (BCC)
4
Nodular Superficial
Pigmentado Ulcerado Morfeaforme
Epidemiología
• 75-80% de los tumores cutáneos
• Incidencia ajustada por edad (Raza Caucásica) o 475 / 100000 varones
o 250 / 100000 mujeres
• Riesgo de padecer un BCC en raza caucásica: o 33%–39% en varones
o 23%–28% en mujeres
• Riesgo de segundo BCC: 44% en 3 años
• Localmente avanzados: 1-10%
• Rara vez metastatiza : 0.003%–0.5%
• Medicare (USA) - 5º tumor más costoso
Ridky, 2007; ACS, 2012; Rubin et al, 2005; Housman et al, 2003; Christenson et al, 2005; Marcil et al, 2000. J. Dreier et al, B J Dermatol, 2014
7% casos de Hospital Nivel III son complejos !!
* Autosómico dominante: BCC, atrophoderma vermiculata, milia, hipotricosis, tricoepitelioma, vasodilatación periférica.
† Ligado a cromosoma X BCC, atrophoderma folicular, hipotricosis, anhidrosis localizada.
‡ Autosómico dominante: BCC, pits palmoplantares, queratoquistes odontogénicos, costillas bífidas, prominencia frontal bossing, defectos SNC.
Rubin et al, 2005.
BCC – Factores de riesgo
Fenotipo • Pelo rubio o pelirrojo • Ojos azules o verdes • Piel clara
Exposición • Arsénico • Alquitrán de hulla • Radiación ionizante • Tabaco • Cabinas UVA
Genodermatosis • Albinismo • Xeroderma pigmentosum • Síndrome Rombo* • Síndrome Bazex-Dupré-Christol (síndrome Bazex)† • Síndrome carcinoma nevoide basocelular (Gorlin)‡
Inmunosupresión • Transplante de órgano
BCC – Criterios alto riesgo
• Diámetro o ≥ 20 mm tronco/extremidades
o ≥ 10 mm en mejillas/frente/cuello
o ≥ 6 mm en otras zonas de la cara
• Bordes mal definidos
• Inmunosupresión
• Radioterapia previa
• Subtipos: o morfea, basoescamoso,
infiltrativo, mixto, nodular, esclerosante
• Infiltración perineural
NCCN, 1.2.017.
CABEZA Y
CUELLO
(80%)
TRONCO
(15%)
EXTREMIDADES (5%)
Vismodegib: Fase I
• Inhibidor oral selectivo de SMO
• Concentración fija independiente
de dosis
• No toxicidad limitante de dosis
• Seleccionada dosis 150 mg/d
• Tasa de respuesta global: 58%
• Mediana de duración de respuesta:
12.8+ meses ( 3.7–26.4+ meses)
Von Hoff N Engl J Med 2009
1.- Von Hoff N Engl J Med 2009; 2.- Sekulic et al EADO 2011
A.- CBC-la Varón 60 años Síndrome de Gorlin Lesiones en cuero cabelludo Evaluado como Respuesta parcial1
B.- CBC-la Mujer 41 años1
5 meses
2 meses 5 meses2
8 meses Basal C.- CBCm (metástasis en pulmón, hueso y tejido blanco) Varón 67 años Evaluado como Respuesta parcial1
• CBC localmente avanzado: • Inoperable o • Cirugía considerada opción terapéutica no apropiada:
• 1 cm y • 2 recurrencias después de la cirugía y la resección curativa
poco probable • y/o anticipada morbilidad sustancial • y/o deformidad derivada de la cirugía
Sekulic A et al. New Engl J Med 2012;366:2171–9
Pa
cie
nte
s in
clu
ido
s
(n=
10
4)
Vismodegib oral
continuo
150 mg/día
Tratamiento hasta
• Progresión
• Toxicidad intolerable
• Retirada del estudio CBC
metastásico
n = 33
CBC
localmente
avanzado*
n = 71
ERIVANCE BCC: Estudio Pivotal
Máxima reducción de tumor
(Comité Evaluador Independiente)
Respuesta Enfermedad Estable Progresión
-100
-50
0
50
100
Cam
bio
en
diá
me
tro
de
l tu
mo
r (%
)
Sekulic et al, 2011.
ERIVANCE BCC – Respuestas
CBCm (n = 33)
CBC-la (n = 63)
IRF (Obj1º)
INV (Obj2º)
IRF (Obj1º)
INV (Obj2º)
Respondedores (ORR)
(Respuesta completa + parcial)
30.3% (n=10)
45.5% (n=15)
42.9% (n=27)
60.3% (n=38)
Enfermedad Estable 63.6% 45.5% 38.1% 23.8%
Progresión 3.0% 6.1% 12.7% 9.5%
No evaluable 3.0% 3.0% 6.3% 6.3%
IC95% para la respuesta objetiva
(15.6 – 48.2) (28.1 – 62.2) (30.5 – 56.0)
(47.2 – 71.7)
p-valor 0.0011 <0.0001
Sekulic A et al. New Engl J Med 2012;366:2171–9
75% beneficio clínico (respuesta o ausencia de progresión en 24 semanas)
CBCm (n = 33)
CBC-la (n = 63 )
Análisis Primario
(26 de Noviembre 2010)
Análisis Final a 30 meses
(30 de Mayo de 2013)
Análisis Primario
(26 de Noviembre 2010)
Análisis Final a 30 meses
(30 de Mayo de 2013)
Duración mediana de Respuesta (meses) IC95%
12.9m
5.6-12.9
14.8m
5.6-17.0
7.6m
7.4-NE
26.2m
9.0-37.6
Sekulic et al. ASCO 2014; Sekulic et al. JAAD 2015
ERIVANCE BCC
Duración de la Respuesta
Tiempo medio hasta la MÁXIMA REDUCCIÓN DEL TUMOR (5.5-6.7 meses)
SLP CBCm (n = 33) CBC-la (n = 63)
Mediana, meses (IC95%) 9.3 (7.4−16.6) 12.9 (10.2−28.0)
ERIVANCE BCC
Supervivencia Libre de Progresión (SLP)
1. Sekulic et al. ASCO 2014
Sekulic et al. ASCO 2014; Sekulic et al. JAAD 2015
CBCm (n = 33) CBC-la (n = 63)
SG 1 año (IC95%) 78.7% (64.7-92.7) 93.2% (86.8-99.6)
SG 2 años (IC95%) 62.3% (45.4-79.3) 85.5% (76.1-94.8)
SG mediana (IC95%) 33.4 meses (18.1-NE) NE (NE-NE)
ERIVANCE BCC
Supervivencia Global (SG)
Sekulic et al. ASCO 2014
STEVIE: Estudio de Seguridad
Objetivo primario • Seguridad
Objetivo secundario • Tasa de respuesta
• Duración de la respuesta
• Supervivencia libre de progresión
• Supervivencia global
• Calidad de vida del paciente (Skindex 16)
Basset-Seguin et al. Lancet Oncol 2015
Tratamiento hasta
• Progresión
• Toxicidad intolerable
• Retirada del estudio
Vismodegib oral
continuo
150 mg/día
Pacientes con
CBC localmente avanzado
o
CBC metastásico
(n = 1200)
STEVIE - Seguridad (n=1215)
Eventos adversos (EAs) mayoritariamente leves o
moderados (grados 1 o 2)
EAs ≥10% de los pacientes (%)
Todos los Grados
Grado 3 Grado 4
Espasmos musculares 66.4% 7.7% <1%
Alopecia 61.5% 1.2% <1%
Disgeusia 54.6% 2.1% <1%
Pérdida de peso 40.6% 3.9% <1%
Pérdida de apetito 24.9% 1.6% 0%
Astenia 24.0% 1.8% <1%
Náusea 17.9% 0.3% 0%
Ageusia 17.5% 1.2% <1%
Fatiga 16.5% 1.6% <1%
Diarrea 16.2% 0.7% 0%
Artralgia 10.2% 0.3% 0%
Hansson et al. ASCO 2016
ALS Chang J Am Acad Dermatol 2014;70:60-9.
Tiempo hasta la aparición de toxicidad de
los inhibidores de Smo
STEVIE - Skindex-16 (QoL)
• Mejoría clínicamente significativa en:
o Impacto emocional: preocupación persistente o
recurrente, frustración, depresión, irritación, apariencia
física o vergüenza
• Mes 1, Mes 6 y Fin de tratamiento
Hansson et al. EADV 2015
Resistencia a Vismodegib
S Pricl. Mol Oncol 2015
Mutaciones en SMO
Otras alteraciones:
• Amplificación gli2 • Activación sistema PI3K
J Clin Oncol 32:745-751. © 2014
• Reducción proliferación celular: 45% (P .04) • Reducción actividad vía HH: 65% (P .03) • Reducción área tumoral 24% (95% CI, 18.2% - 30.0%). • Respuesta objetiva en pacientes con múltiples tumores : RP 4/8
Inmunoterapia en BCC?
E Hannah. Int J Dermatol 2016,
NCT02690948 - Pembrolizumab With or Without Vismodegib in Treating Metastatic or Unresectable Basal Cell Skin Cancer
Otros conceptos en I+D
• Duración del tratamiento. Intermitencia
• Integración del tratamiento farmacológico
con tratamientos físicos (radioterapia o
cirugía)
Conclusiones
• El carcinoma basocelular de piel es un tumor frecuente, curable con tratamientos locales
• 1-10% presentará tumores localmente avanzados
o Deben ser evaluados en comité multidisciplinar
o Pueden ser candidatos de tratamiento farmacológico.
• Vismodegib es un inhibidor oral selectivo de Smo, autorizado y
financiado en España, que induce:
o respuestas duraderas
en el 43% de los pacientes con BCC localmente avanzados y
en el 30% de los pacientes metastásicos,
o con una toxicidad manejable (calambres, alopecia,
disgeusia, adelgazamiento)