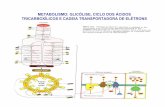
Capítulo 22 Ciclo de los ácidos tricarboxílicos
Transcript of Capítulo 22 Ciclo de los ácidos tricarboxílicos

383
GeneralidadesEn 1937, Szent-Gyorgy propuso un ciclo que llamó del ácido succínico. Casi al mismo tiempo, Krebs describió lo que llamó ciclo del ácido cítrico (ciclo de los ácidos tricarboxílicos o ciclo de Krebs), el cual es un molino metabólico donde confluyen, además de los carbohidratos, varios lípidos y algunos aminoácidos para ser oxidados a CO2 y H2O, con la consecuente producción de NADH + H+, FADH2 y ATP (figura 22-1). Las enzimas están en la matriz mitocon-drial, excepto la succinato deshidrogenasa que está embe-bida en la membrana interna mitocondrial y que tiene un papel dual, ya que también forma parte de la cadena res-piratoria o cadena de transporte de electrones. El ciclo emplea sustratos de cuatro a seis átomos de carbono (C), lo que le da versatilidad para metabolizar compuestos diferentes.
El ciclo de Krebs se inicia con la unión del oxalacetato de cuatro átomos de C al residuo acetilo de la acetil-CoA (2 C), formando citrato de 6 C, durante el ciclo se recupe-ra el oxalacetato a través de dos descarboxilaciones, lo que le permite al ciclo funcionar de manera continua siempre que sea alimentado por el acetil-CoA.
Un aspecto relevante es el número de átomos de hidrógeno que tienen los metabolitos iniciadores del ciclo; lo que permite reducir 3 NAD+ y un
FAD por las deshidrogenasas específicas que permiten re-generar el oxalacetato. En resumen, en cada vuelta del ci-clo se consume 1 mol de acetil-CoA, se producen 2 mol de CO2 y 4 moles de coenzimas reducidas que transfieren sus hidrógenos al O2 a través de la cadena respiratoria, lo que permite que casi la mitad de la energía liberada en estas reacciones se conserve en forma de ATP.
Descarboxilación del piruvato El acetil-CoA se obtiene por la descarboxilación oxidativa del piruvato por la acción del complejo multienzimático de la piruvato deshidrogenasa (PDH) formado por 64 subuni-dades y constituido por al menos tres actividades enzimáticas
Contenido• Generalidades• Descarboxilacióndelpiruvato• Síntesisdecitrato• Síntesisdeisocitrato• Síntesisdeα-cetoglutarato • Síntesisdesuccinato• Síntesisdefumarato• Síntesisdemalato• Síntesisdeoxalacetato• Regulacióndelciclo• ObtencióndeenergíaenelciclodeKrebs• Sitiosdeincorporacióndeaminoácidosalciclode
Krebs • Anaplerosis• ImportanciaintrínsecadelciclodeKrebs• ElciclodeKrebsenotrasfunciones
Edmundo Chávez Cosío, Oscar Flores Herrera, Federico Martínez Montes
Ciclo de los ácidos tricarboxílicos
Capítulo 22
1 ¿Qué productos se generan en el ciclo de Krebs?2 ¿Cómo se regula y cuáles son los productos de la piruvato
descarboxilasa?3 ¿Cuál es la importancia del isocitrato en el ciclo de Krebs?4 ¿Cómo se regula el ciclo de Krebs?5 ¿Cómo se incorporan algunos aminoácidos en el ciclo de
Krebs?6 ¿Qué es la anaplerosis?7 ¿En qué otras vías participa el ciclo de Krebs?
Conceptos clave
1
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

384 Bioquímica de Laguna
independientes: piruvato deshidrogenasa, dihidrolipoil tran-sacetilasa y dihidrolipoil deshidrogenasa; además, tiene cin-co coenzimas: tiamina pirofosfato, ácido lipoico, coenzima A, FAD y NAD+.
La actividad de este complejo enzimático se regula por fosforilación y desfosforilación. Una proteína cinasa de-pendiente de ATP al fosforilar a la PDH la inactiva; mien-tras que una fosfatasa dependiente de calcio, al remover el fosfato, la activa.
La fosforilación de la PDH y su inactivación ocurre cuando la concentración de ATP es alta debido a que la demanda energética de la célula se ha cu-
bierto, por lo que el aporte de acetil CoA para alimentar al ciclo de Krebs y de la cadena respiratoria, debe dismi-nuir. Por el contrario, si la concentración de ATP se hace limitante, la enzima es desfosforilada, lo que permite que se formen más moléculas de acetil-CoA a partir del piru-vato, lo cual alimenta el ciclo de Krebs incrementando el
aporte de coenzimas reducidas para la cadena de transpor-te de electrones y promover la síntesis de ATP a través de la fosforilación oxidativa.
La enzima dihidrolipoil transacetilasa conforma el cen-tro del sistema; está compuesta por 24 subunidades y en cada una contiene tres moléculas de lipoato, además de coenzima A. La enzima dihidrolipoil deshidrogenasa está constituida por 12 subunidades y las coenzimas FAD y NAD+. El paso inicial en la secuencia de reacciones es la unión del piruvato a la coenzima pirofosfato de tiamina (figura 22-2A), permitiendo la eliminación de CO2 y for-mando el intermediario α-hidroxietiltiamina pirofosfato.
El grupo hidroxietilo reacciona con el disulfuro del ácido lipoico (figura 22-2B), que a su vez está unido al α-amino de un residuo de lisina de la proteína dihidroli-poil transacetilasa. El resultado de esta reacción es la re-ducción del puente disulfuro en un tiol y un enlace éster con el otro átomo de azufre del acetilo proveniente de la
Figura 22-1. Secuencia de reacciones en el ciclo de Krebs.
O
O
CH3
CH2
CH2
CH2
CH2
CH2CH2
CH2
CH2
CH2
CO2
Oxalosuccinato
CH2
CH2
CH 2
HIsocitrato
C
H
HC
Cis-aconitato
ATP
Cadenarespiratoria
HO
HO
CC
C
C
C
CC
O
OO
HC
COO–
COO–
COO–
Oxalacetato
COO–
COO–
COO–
COO–
COO–
COO–
COO–
COO–
COO–
COO–
COO–
Malato
CHHO
H2C
H2OCH
CHFumarato
GTP
COO–
COO–
COO–
COO–
COO–
COO–
COO–
COO–
COO–
Citrato
1
3
4
56
6
7
8
9
Succinato
C~Acetil CoA
Succinil coenzima A
HS-CoA
S-CoA
S-CoA
HS-CoA
HS-CoA~ α−cetoglutarato
2
H2O
H2O
3 NADH1 FADH2
2
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

Ciclo de los ácidos tricarboxílicos 385
descarboxilación del piruvato. El paso siguiente es la trans-ferencia del acetilo al grupo sulfhidrilo de la CoA, con lo que se forma acetil-CoA que se libera del complejo, y la reducción del azufre de la lipoamida. La regeneración del puente disulfuro del ácido lipoico se lleva a cabo mediante su oxidación por FAD unido a la dihidrolipoil deshidroge-nasa (figura 22-2C); el FADH2 resultante es oxidado por el NAD+, con lo que se forma NADH + H+, el cual a su vez transfiere el hidruro y el protón a la cadena respiratoria.
La acetil-CoA es un metabolito de encrucijada que puede provenir de la degradación de diferentes moléculas tales como la glucosa, los ácidos grasos e incluso varios aminoácidos (figura 22-3). Los principales destinos del acetil-CoA son: a) condensarse con el oxalacetato para formar citrato, b) unir-se con otra molécula de acetil-CoA para iniciar la síntesis
de ácidos grasos o de colesterol, y c) formar cuerpos cetóni-cos. En este capítulo se estudia la acetil-CoA como alimen-tadora del ciclo de Krebs, cuyo primer paso es la síntesis de citrato.
Síntesis de citrato La síntesis de este ácido tricarboxílico (reacción 1, figura 22-1) la cataliza la citrato sintasa. El equilibrio de la reac-ción está desplazado hacia la síntesis de citrato. El meca-nismo catalítico sugiere que el CH3 del residuo acetilo de la acetil-CoA se une al grupo carbonilo del oxalacetato (figura 22-4); el citroil-CoA formado es un intermediario de vida media corta que libera citrato y CoA.
Figura 22-2A, B y C. Dexcarboxilación del piruvato.
COO–
C
CH3
CH3
CH3CH3
(CH2)4
(CH2)4
Lipoamida
Acetil lipoamida Dihidrolipoamida
(CH2)4
(CH2)4
(CH2)4
R’
CH3 CH3
CH3
CH2
CH2
2CH2
NH2
CH2
CH2
CH2
CH2
CH2
CH2
CH2 CH2SH
SH
DAF +DAF +
FAD
SH
SH
SH
HS-CoA
CH3
CH
CH
CH
CHCH
CH
C
CC
O
O
O
O
O
O–
O–O–
O
P PC
C ~ S-CoA
Acetil CoA
CH
OH
OH
S
S
S
S
NAD+
NADH + H+
S
SS
B
C
O + EN
N
TPP
A
H2
N
N
+
α -hidroxietiltiamina pirofosfato
α -hidroxietiltiaminopirofosfato
C-N-R
H
OC-N-R
H
O
C-N-R
H
O
C-N-R
H
OC-N-R
H
O
Dihidrolipoamida Lipoamida
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

386 Bioquímica de Laguna
Síntesis de isocitrato El objetivo principal del ciclo de Krebs es obtener NAD+ y FAD reducidos; sin embargo, la estructura química del citrato impide su oxidación, por lo que se transforma en isocitrato, un metabolito que resulta del cambio de posición del hidroxilo con la participación del intermediario cis-aconitato y que permitirá la reducción del NAD+. La en-zima que transforma el citrato es la aconitasa (figura 22-1, reacciones 2 y 3) y está formada por dos subunidades, cada una de ellas con un átomo de hierro. La actividad de la en-zima se inhibe por el trans-aconitato y el fluoroacetato; de hecho, este último se transforma en fluorocitrato, que es el verdadero inhibidor. La actividad de citrato sintasa da por re-sultado un equilibrio entre citrato, cis-aconitato e isocitrato. El primer paso es la remoción de una molécula de H2O del citrato y la formación de un doble enlace, lo que causa
la formación de cis-aconitato. El siguiente paso es la rein-corporación de H2O, lo que resulta en la localización del grupo hidroxilo en una nueva posición formando al isoci-trato, el cual puede ser deshidrogenado.
Síntesis de α-cetoglutarato La oxidación del isocitrato la realiza la isocitrato dehidro-genasa (reacciones 4 y 5, figura 22-1), la cual tiene dos isoenzimas, una usa como coenzima al NAD+ y la otra al NADP+. La isoenzima que depende de NAD+ se localiza en las mitocondrias y requiere de Mn2+, el cual puede ser sustituido por Mg2+, tiene cuatro sitios activos donde se fijan cuatro moléculas de NAD+ y cuatro de isocitrato. La enzima se estimula por ADP y citrato y se inhibe por NADH.
Figura 22-3. Caminos metabólicos que convergen y divergen de la acetil coenzima A.
Piruvato
Acetil-CoA
Alanina Cistenía Glicina Serina Treonina
Glucosa
Isoleucina Leucina Triptófano
Citrato Oxalacetato
Colesterol
Ácidos grasos
Cuerpos cetónicos
Ácidos grasos
Condiciones normales
Ayuno prolongado
Ayuno temprano
ATP suficiente
ATP en exceso
Ayuno prolongado
Figura 22-4. Síntesis de citrato, condensación de oxalacetato y acetil CoA.
COO -COO -
COO -
COO -COO -
CH 2
H
H
C C ~ S-CoA C
CH 2
CitratoAcetil coenzima AOxalacetato
+ HS-CoA
CH
H
O
HO
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

Ciclo de los ácidos tricarboxílicos 387
En las mitocondrias, la mayor parte del isocitrato se oxida por la enzima dependiente de NAD+. La pri-mera fase de la reacción es la transformación del iso-
citrato en el intermediario oxalosuccinato más NADH. La segunda fase es la descarboxilación no oxidativa del oxalo-succinato, que da por resultado la formación del α-ceto-glutarato. Este sustrato representa un sitio común en el metabolismo de los carbohidratos y los aminoácidos. Por ejemplo, la transaminación o desaminación oxidativa del glutamato causa la formación de α-cetoglutarato; a la inver-sa, el α-cetoglutarato en presencia del ion amonio, NH4
+, puede a su vez ser transformado en glutamato.
La isoenzima que usa NADP+ como coenzima se loca-liza tanto en las mitocondrias como en el citoplasma y requiere de Mn2+ para su actividad.
Síntesis de succinato El α-cetoglutarato se transforma en succinato (reacción 6, figura 22-1) mediante un mecanismo oxidativo similar a la descarboxilación del piruvato. La α-cetoglutarato deshi-drogenasa es un complejo formado por las enzimas El, E2 y E3. Los cofactores son los mismos que para la piruvato deshidrogenasa: TPP, lipoato, FAD, NAD+ y CoA. El pro-ceso se inicia con la unión del α-cetoglutarato al pirofosfa-to de tiamina, lo que da como resultado su descarboxilación y el α-hidroxi-α-carboxipropiltiaminpirofosfato; el residuo de cuatro carbonos se transfiere a la enzima que contiene ácido lipoico, con lo que se forma el complejo succinil-li-poil-enzima. El succinilo se transfiere a la CoA y la dihi-drolipoamida es oxidada por el NAD+. El succinil-CoA que se forma es un inhibidor competitivo de la enzima, la CoA es eliminada por la succinato tiocinasa y la energía que se libera se asocia a la síntesis de GTP. Esta reacción es un ejemplo de fosforilación a nivel del sustrato. En presencia de ADP y la enzima nucleósido difosfocinasa, el GTP dona su fosfato-gamma al ADP para sintetizar ATP, mientras que el succinato resultante se metaboliza a fumarato.
Síntesis de fumarato La oxidación del succinato a fumarato se realiza por la suc-cinato deshidrogenasa (reacción 7, figura 22-1), una enzi-ma de la membrana interna mitocondrial; contiene tres centros de reacción hierro-azufre y una molécula de FAD unida covalentemente. La oxidación del succinato resulta en la formación de fumarato y FADH2, el cual transfiere sus hidrógenos a la coenzima Q de la cadena de transporte de electrones. El malonato es un inhibidor natural de la succinato deshidrogenasa
Síntesis de malato La formación del malato (reacción 8, figura 22-1) se lleva a cabo por la hidratación del fumarato por la enzima fuma-rasa, que está constituida por cuatro subunidades idénticas.
Síntesis de oxalacetato La regeneración del oxalacetato a partir de malato (reac-ción 9, figura 22-1) se debe a la actividad de la malato deshidrogenasa, que tiene como coenzima al NAD+. Esta reacción, cuyo equilibrio está desplazado hacia el malato, cierra el ciclo.
Regulación del ciclo El ciclo de Krebs tiene varias enzimas alostéricas moduladas por la relación de las concentraciones intramitocondriales de ATP/ADP o AMP, NADH/NAD+, succinil-CoA/CoA o acetil-CoA/CoA. En este sentido, conviene recordar que las mitocondrias tienen concentraciones relativamente constan-tes de estos metabolitos. Supóngase que la concentración to-tal de CoA es de 25 μM y que durante la descarboxilación del piruvato se sintetizan 20 μM de acetil-CoA, lo que le deja 5 μM de CoA libre. Esto quiere decir que la relación es de cuatro acetil-CoA a un CoA libre (20 μM de acetil-CoA/5 μM de CoA). Entonces, si las concentraciones del metabolito en el numerador son altas, la probabilidad de que se una a la enzi-ma que regula el ciclo es alta y la velocidad disminuirá, ya que en estas condiciones la célula cuenta con un valor ener-gético suficientemente elevado, es decir, el contenido de ATP o de equivalentes reducidos (o de ambos) es elevado. Por el contrario, si los valores del denominador son altos y por lo tanto la relación disminuye, la velocidad del ciclo au-menta para contribuir al aporte energético necesario (figura 22-5). La enzima piruvato deshidrogenasa, que proporciona el acetil-CoA para iniciar el ciclo de Krebs se inhibe de ma-nera competitiva por ATP, NADH o acetil-CoA. Por ejem-plo, durante la oxidación de los ácidos grasos, la concentración relativa de los metabolitos citados se encuentra elevada y la piruvato deshidrogenasa se inhibe. Además, como se men-cionó, esta enzima se regula por las concentraciones de Ca2+ libre en la matriz mitocondrial; el aumento de la concentra-ción de calcio libre indica la disminución del contenido energético celular, por lo que las vías catabólicas se activan como respuesta a la necesidad energética.
Aunque la enzima citrato sintasa se inhibe parcial-mente por NADH o succinil-CoA, la velocidad de la reacción depende de manera directa de los nive-
les de oxalacetato. Si la relación malato/oxalacetato es alta, la enzima estará inhibida. Otro punto de regulación es la isocitrato deshidrogenasa, que se inhibe por ATP o NADH en tanto que se activa por ADP o AMP. El isoci-trato es un efector positivo y su unión facilita la unión de los otros efectores a la enzima. En cuanto a la enzima α-cetoglutarato deshidrogenasa, ésta se estimula por el AMP y la fijación de este metabolito a la enzima disminu-ye la KM en un factor de 10, mientras que el NADH y la succinil-CoA son sus inhibidores. La succinato deshidro-genasa se inhibe eficientemente por el oxalacetato, pero el ADP protege de esta inhibición.
3
4
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

388 Bioquímica de Laguna
Obtención de energía en el ciclo de Krebs
El catabolismo tiene la función de generar energía, la cual se concibe como la producción de poder reductor en forma de NAD(P)H + H+ o bien como ATP. En este contexto también se debe considerar la producción de NADPH + H+. En el ciclo de Krebs existen tres reacciones en los que la deshidrogenación de sustratos está acoplada a la formación de NADH + H+ (cuadro 22-1): de isocitrato a α-ceto glu-tarato, de α-cetoglutarato a succinil-CoA y de malato a oxalacetato. La oxidación de 1 mol de NADH por la cade-na respiratoria permite la síntesis de 2.5 moles de ATP en
la fosforilación oxidativa. Se obtiene 1 mol más de ATP mediante la fosforilación a nivel del sustrato en la trans-formación de succinil-CoA a succinato. La oxidación de succinato a fumarato por la succinato deshidrogenasa, de-pendiente de FAD, origina la energía necesaria para sinte-tizar 1.5 moles de ATP en la fosforilación oxidativa. En resumen, el consumo de una molécula de acetil-CoA por el ciclo de Krebs tiene un rendimiento energético de 10 moléculas de ATP. Si se considera desde el piruvato, en-tonces el rendimiento aumenta a 12.5, ya que la oxidación de este metabolito, hasta acetil- CoA, produce 1 mol de NADH + H+, cuya oxidación por la cadena respiratoria y la fosforilación oxidativa genera 2.5 moles de ATP.
Cuadro 22-1. Segmentos del ciclo de Krebs en los cuales se obtiene energía
Segmento Coenzima Moles de ATP
isocitrato ⇒ α-cetoglutarato NADH 2.5
α-cetoglutarato ⇒ succinil CoA NADH 2.5
malato ⇒ oxalacetato NADH 2.5
succinato ⇒ fumarato FADH2 1.5
Fosforilación a nivel de sustrato ATP ⇒ ADP 1
Subtotal 10
piruvato ⇒ acetil CoA NADH 2.5
Total 12.5
Figura 22-5. Regulación del ciclo de Krebs.
ATP, acetil-CoA, NADH,ácidos grasos
Piruvato
NAD+, AMP,CoA, Ca2+
Acetil-CoA
Oxalacetato
Malato
Fumarato
Succinato
ADP
NADH, ATP
NADH, ATP
Citrato
IsocitratoADPCa2+
ATP,NADH
Succinil-CoA
Ca2+
α-cetoglutarato
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

Ciclo de los ácidos tricarboxílicos 389
Sitios de incorporación de los aminoácidos al ciclo de Krebs La entrada al ciclo de Krebs de los 20 aminoácidos que forman las proteínas se distribuye de la manera siguiente (figura 22-6): Diez de ellos son converti-
dos en acetil-CoA a través de piruvato o de acetoacetil-CoA; 5 son transformados en α-cetoglutarato, y 3 en succinil-CoA; los dos restantes, fenilalanina y tirosina, son oxida-dos por dos vías: una parte de su residuo hidrocarbonado se transforma en acetil-CoA y la otra en fumarato. Esto se interpreta como la capacidad que tiene el organismo para enfrentar necesidades energéticas cuando el suministro a partir de carbohidratos o lípidos como los ácidos grasos no está disponible.
Anaplerosis Como se ha descrito, el ciclo del ácido cítrico o de Krebs es la principal vía para obtener equivalentes reductores que sirven para la síntesis de ATP. Sin embargo, este ciclo también proporciona esqueletos de carbono para la cons-trucción de otras biomoléculas que requiere la célula. Por ejemplo, la succinil-CoA se utiliza como estructura básica en la síntesis de porfirinas que se requieren en la síntesis del grupo hemo de la hemoglobina. Asimismo, algunos aminoácidos derivan del oxalacetato o del α-cetoglutarato.
Al proporcionar el ciclo de Krebs moléculas pre-cursoras de metabolitos para otras vías, debe existir un mecanismo anaplerótico (del griego anaplerosis,
rellenar, restaurar) que restituya los metabolitos donados por el propio ciclo, ya que de otra manera se podría correr
el riesgo de muerte celular al no contar con la producción de NADH + H+ para la síntesis de ATP. Por ejemplo, si se toma en cuenta que se necesita el oxalacetato para iniciar el ciclo de Krebs al unirse al acetil-CoA, pero el oxalacetato no estuviese disponible o su concentración no fuera sufi-ciente por haber sido utilizado para la síntesis de aspartato, entonces la velocidad del ciclo sería muy baja e incluso existiría la posibilidad de que el ciclo se detuviera si no se formara nuevo oxalacetato por otro mecanismo, distinto al de la oxidación del malato. Esto se cumple mediante la car-boxilación del piruvato por la enzima piruvato carboxilasa.
Piruvato + CO2 + ATP + H2O → oxalacetato + ADP + Pi + 2H+
Como las principales enzimas que fijan CO2, la piruvato carboxilasa tiene como coenzima la biotina. La fijación de CO2 se lleva a cabo de la siguiente manera:
Biotina-enzima + ATP + HCO 3 ↔ CO 2-biotina-enzima + ADP + Pi
CO 2-Biotina-enzima + piruvato ↔ biotina-enzima + oxalacetato
Importancia intrínseca del ciclo de Krebs
El estudio del ciclo de Krebs aporta gran conocimiento; las enzimas celulares no adoptan una posición al azar, sino que están orientadas de tal manera que actuar como una unidad. El ensamblaje de una serie de enzimas, como las del
Figura 22-6. Incorporación de aminoácidos al ciclo de Krebs.
AlaninaCisteníaGlicinaSerina
Treonina
Piruvato Acetil-CoA
IsoleucinaLeucina
Triptofano
Acetoacetil-CoA
FenilalaninaTirosinaLeucina
TriptófanoLisina
GlutamatoArgininaHistidina
GlutaminaProlina
α-cetoglutarato
Succinil-CoA
Fumarato
OxalacetatoAspartatoAsparagina
TirosinaFenilalanina
IsoluecinaMetionina
Valina
5
6
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

390 Bioquímica de Laguna
ciclo de Krebs, que operan secuencialmente sobre los dife-rentes sustratos, aumenta la eficiencia del proceso total. Se entiende que si la libre difusión es la responsable de que un intermediario metabólico sea transferido de un sitio activo al siguiente, entonces deber ser ventajoso colocar los dos sitios lo más cerca posible. Sin embargo, esta fina organiza-ción hace también más susceptible a la célula, ya que al inhibirse una enzima se detiene toda la vía metabólica. Con el estudio del ciclo de Krebs puede entenderse mejor la importancia que tiene en el aporte energético para los procesos celulares. Es incuestionable que, por mucho, el rendimiento en energía disponible por esta vía metabólica es mayor que el obtenido en la glucólisis (de glucosa a piru-vato), dado que la producción de NADH + H+ y FADH2 son los sustratos que alimentan a la cadena respiratoria que tienen como aceptor final al oxígeno que recibe los electro-nes donados por estas coenzimas, lo que permite formar el potencial electroquímico necesario para la síntesis de ATP. Con esta información es entonces posible explicar la insu-ficiencia contráctil producida durante la anoxia subse-cuente al infarto agudo de miocardio, o la muerte cerebral seguida de la trombosis en una arteria subaracnoidea.
El ciclo de Krebs en otras funciones Si bien la principal función de las mitocondrias es la gene-ración de equivalentes reductores y su empleo en la sínte-sis de ATP, hay otras actividades en que el ciclo de Krebs
participa. Por ejemplo, los tejidos esteroidogénicos como las glándulas suprarrenales, gónadas, placenta y cerebro tienen el cometido de sintetizar hormonas esteroides para mantener la homeostasis corporal. Las hormonas esteroides, como son los andrógenos, estrógenos, progestágenos y glucocorticoides, inician su síntesis con el transporte del colesterol del citoplasma a la mitocondria, el cual es transformado en pregnenolona, molécula precursora del resto de las hormonas esteroides. En estos tejidos, la producción de NADPH + H+ adquiere rele-vancia, ya que son la fuente de energía de la cadena de trans-porte de electrones asociada al citocromo P450scc el cual corta la cadena lateral del colesterol (figura 22-7); se sabe que el NADPH que se requiere proviene de sustratos compartidos en el ciclo de Krebs, lo que con toda seguri-dad hace de la obtención de energía un control más fino.
Por último, el ciclo de Krebs se ha asociado a varios procesos celulares y alteraciones metabólicas que llevan a la enfermedad, como es el caso de la forma-
ción de tumores, por lo que los estudiantes de medicina deberán mantener actualizado sus conocimientos y poder así comprender los aspectos moleculares de las enfermeda-des y su tratamiento.
Agradecimientos Los autores agradecen a la Biol. Exp. Sofía Olvera Sánchez y la M. en C. Mercedes Esparza Perusquía por la lectura y corrección del texto.
Figura 22-7. Rotura de la cadena lateral de colesterol por el citocromo P-450scc.
7
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

Ciclo de los ácidos tricarboxílicos 391
Beutler E: “Pumping” iron: The proteins. Science 2004;306: 2051. Devlin TM: Bioquímica. Libro de texto con aplicaciones clínicas, 5a
ed. Barcelona: Editorial Reverté, 2004. Dowben RM: General physiology. A molecular approach. New
York: Harper and Row, 1969. Ganong WF: Fisiología médica, 20a ed. México: Editorial El Ma-
nual Moderno, 2007. Lozano JA, Galindo JD, García-Borrón JC, Martínez-Liarte JH,
Peñafiel R, Solano F: Bioquímica y biología molecular para ciencias de la salud, 3a ed. Madrid: McGraw-Hill Interameri-cana, 2005.
Melo-Ruiz V, Cuamatzi-Tapia O: Bioquímica de los procesos me-tabólicos. Barcelona: Editorial Reverté, 2004.
Nelson DL, Cox MM: Lehninger. Principios de bioquímica, 4a ed. Barcelona, Omega, 2006.
Raimundo N, Baysal BE, Shadel GS: Revisiting the TCA cycle: sig-naling to tumor formation. Trends Mol Med 2011;17(11):641-649.
Smith C, Marks AD, Lieberman M: Bioquímica básica de Marks. Un enfoque clínico, 2a ed. Madrid: McGraw-Hill Interameri-cana, 2006.
Voet D, Voet JG: Biochemistry, 2nd ed. New York: John Wiley and Sons Inc, 1995.
White A, Handler P, Hill RL, Lehman IR: Principios de bioquímica, 6a ed. Madrid: McGraw-Hill, 1983.
Referencias
Preguntas de reforzamiento1 Enzima considerada como el paso limitante del ciclo de
Krebs.
a) Fumarato hidratasa.b) Citrato sintetasa.c) Succinil CoA sintetasa.d) Aconitasa.e) Malato deshidrogenasa.
4 ¿Cuántas moléculas de ATP se forman a partir de los pro-ductos que se generan de una molécula de acetil CoA que entra al ciclo de Krebs y luego a la cadena de transporte de electrones?
a) 14b) 12c) 16d) 8e) 10
2 Enzima del ciclo de Krebs que contiene un FAD como coenzima.
a) Citrato sintetasa.b) Succinato deshidrogenasa.c) α-cetoglutarato deshidrogenasa.d) Malato deshidrogenasa.e) Isocitrato deshidrogenasa.
5 ¿Cuántas moléculas de CO2 se producen en el ciclo de Krebs a partir de la degradación de dos moléculas de acetil CoA?
a) 1b) 2c) 3d) 4e) 6
3 Enzima que se está anclada a la membrana interna mito-condrial.
a) Citrato sintetasa.b) Succinato deshidrogenasa.c) α-cetoglutarato deshidrogenasa.d) Malato deshidrogenasa.e) Isocitrato deshidrogenasa.
Respuestas: 1. b, 2. b, 3. b, 4. e, 5. d.
Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.

Bioquímica de Laguna y Piña (8a. ed.), edited by Montes, Federico Martínez, et al., Editorial El Manual Moderno, 2018. ProQuest Ebook Central, http://ebookcentral.proquest.com/lib/buufsc-ebooks/detail.action?docID=5635070.Created from buufsc-ebooks on 2020-12-01 13:33:30.
Cop
yrig
ht ©
201
8. E
dito
rial E
l Man
ual M
oder
no. A
ll rig
hts
rese
rved
.