ASIGNATURA: BIOLOGIA PERIODO 4 ESTUDIANTE: … · Iminas: CH 3 C=N CH 3 Amino -Carbonilo R -(C=O)...
Transcript of ASIGNATURA: BIOLOGIA PERIODO 4 ESTUDIANTE: … · Iminas: CH 3 C=N CH 3 Amino -Carbonilo R -(C=O)...
2. ALDEHÍDOS Y CETONAS Los aldehídos y las cetonas son compuestos carbonílicos de amplia difusión en la naturaleza. Se pueden encontrar aislados o formando parte de innumerables compuestos orgánicos, muchos de los cuales NATURALEZA DEL GRUPO FUNCIONAL CARBONILO O La estructura tiene gran interés bioquímico. General del grupo funcional carbonilo es: R—C—El grupo R puede tener una cadena hidrocarbonada lineal (grupo alquilo) o un compuesto aromático (grupo arilo). La cuarta posibilidad de enlace del carbono, puede ser ocupada por grupos o átomos como, H, R’, OH, OR”, ONH2, entre otros. Dependiendo de qué grupo se presente, se tienen: aldehídos, cetonas, ácidos carboxílicos, ésteres o amidas, respectivamente. Aldehídos y cetonas presentan un comportamiento químico común, mientras que los demás grupos difieren considerablemente. El doble enlace C O es similar, en muchos aspectos, al doble enlace C C de los alquenos. El átomo de carbono del grupo carbonilo presenta hibridación del tipo sp2 y forma tres enlaces�. El otro orbital p del carbono se superpone con un orbital p del oxígeno, para formar un enlace�. Dada la naturaleza rígida del doble enlace, los compuestos carbonílicos, al igual que los alquenos, son planares y los átomos enlazados al carbono forman, entre sí, ángulos de enlace cercanos a los 120°. Debido a la electronegatividad del oxígeno la longitud de enlace en el grupo carbonilo es menor (1,22 Å) que en un enlace sencillo C—O (1,43Å) y mucho más fuerte. Igualmente la elevada electronegatividad del oxígeno hace que el doble enlace C O esté polarizado, por esta razón todos los compuestos carbonílicos son polares. Una de las consecuencias más importantes de la polaridad del grupo carbonilo es su gran reactividad química. El carbono carbonilo presenta una carga parcial positiva que lo convierte en un sitio electrófilo. De igual forma, el oxígeno posee una carga parcial negativa que lo convierte en un sitio nucleófilo. 2.2 NOMENCLATURA. ALDEHÍDOS El nombre de los aldehídos se deriva del nombre del alcano correspondiente, adicionando la terminación-al e indicando la posición de los diversos sustituyentes que pueda portar la cadena principal. Los Aldehídos son compuestos orgánicos formados por la unión de un hidrocarburo cualquiera (R) a uno o varios Grupos Carbonilo (-CHO): La fórmula general de los Aldehídos es: CnH2n+1CHO (donde n = 0, 1, 2, 3, 4, .corresponde al número de átomo de Carbono del hidrocarburo).
Etimológicamente, la palabra aldehído proviene del latín científico alcohol dehydrogenatum (alcohol deshidrogenado
Según la nomenclatura IUPAC, se nombran a los Aldehídos de la siguiente manera. Se añade la terminación "-al" hidrocarburo equivalente:
1. HCHO Metanal
2. CH3-CHO Etanal
3. CH3-CH2-CHO Propanal
4. CH3-CH2-CH2-CHO Butanal
5. CH2=CH-CH2-CHO 3-Butenal
6. 2-hidroxi-butanal
7. Si hay dos grupos aldehídos se añade la terminación "-dial":
8. OHC-CH2-CH2-CHO Butanodial
9. OHC-CH2-CH2-CH2-CHO 1,5-Pentodial
10. Para tres o más grupos aldehídos se emplea el prefijo "formil-":3-formilpentanodial
11. Existe también una nomenclatura tradicional para los Aldehídos más comunes:
HCHO Metanal → Formaldehído
CH3-CH2-CH2-CHO Butanal → Butiraldehído o Aldehído Butílico
PROPIEDADES DE LOS ALDEHÍDOS: Punto de Ebullición: superiores al de los correspondientes alcanos pero inferiores al de los alcoholes ya que no forman puentes de hidrógeno intermoleculares
Obtención de los Aldehidos: Oxidación y Deshidrogenación de Alcoholes Carbonilación Oxidación de Halogenuros de Alquilo
Aplicaciones de los Aldehídos:
Fabricación de resinas, plásticos, solventes, pinturas, perfumes...
El Formaldehído es un conservante
GRUPOS FUNCIONALES:
COLEGIO MILITAR GENERAL GUSTAVO MATAMOROS D´CO
"Formamos Hombres Nuevos Para Una Colombia Mejor"
FECHA:
AREA : CIENCIAS NATURALES Y MEDIO AMBIENTE HORAS DE CLASE GRADO 11:º
ASIGNATURA: BIOLOGIA PERIODO 4
ESTUDIANTE: DOCENTE: DALFY YARIMA LÒPEZ ROJAS
Estructura del Grupo Aldehído
Puntos de fusión
Puntos de ebullición
Formaldehído -92; Acetaldehído -121; Propionaldehído -81; n-Butiraldehído -99; n-Valeraldehído -91; Caproaldehído – ; Heptaldehído – 42; Fenilacetaldehído -; Benzaldehído -26.
Formaldehído -21; Acetaldehído 20; Propionaldehido 49; n-Butiraldehido 76; n-Valeraldehido 103; Caproaldehido 131; Heptaldehido 155; Fenilacetaldehído 194; Benzaldehído 178
¿CÓMO SE NOMBRAN?
Dado a que son alcoholes primarios oxidados, al nombre del alcohol se le cambia la terminación –ol por –al. Así, el metanol (CH3OH) si se oxida a CH3CHO se llama metanal (formaldehído); CH3CH2CHO etanal (acetaldehído); CH3CH2CH2CHO propanal y CH3CH2CH2CH2CHO butanal.
Todos los aldehídos recién nombrados tienen el grupo –CHO al final de la cadena. Cuando éste se encuentra en ambos extremos, la terminación –al se le adiciona el prefijo di-. tiene seis carbonos (contando los de ambos grupos formilos), deriva del 1-hexanol y su nombre por tanto es: hexanodial.
Cuando hay un sustituyente, como un radical alquílico, un doble o triple enlace, o un halógeno, se enumeran los carbonos de la cadena principal dándole al –CHO el número 1. Así, el aldehído B se llama: 3-yodohexanal.
No obstante, en los aldehídos C y D el grupo –CHO no tiene prioridad para identificar dichos compuestos de otros. C es un cicloalcano, mientras que D un benceno, ambos con uno de sus H sustituidos por un grupo formilo. En ellos como la estructura principal es cíclica, al grupo formilo se le nombra carbaldehído. Así, C es el ciclohexanocarbaldehído, y D el bencenocarbaldehído (más conocido como benzaldehído).
USOS: Existen en la naturaleza aldehídos capaces de conferir sabores agradables, tal es el caso del cinnamaldehído, responsable del sabor característico de la canela. Por eso se suelen utilizar como saborizantes artificiales en muchos productos como golosinas o alimentos. EJEMPLOS DE ALDEHÍDOS GLUTARALDEHIDO : se presenta en su estructura dos grupos formilos en ambos extremos. Comercializado bajo el
nombre de Cidex o Glutaral, se usa como desinfectante para esterilizar los instrumentos quirúrgicos. Se utiliza en tratamiento de verrugas en los pies, aplicándose como un líquido. También se emplea como un agente fijador de los tejidos en los laboratorios de histología y patología.
BENZALDEHÍDO :Es el aldehído aromático más simple el cual se encuentra formado por un anillo bencénico donde se enlaza un grupo formilo. Se encuentra en el aceite de almendra, de allí su olor característico que le permite su uso como saborizante de alimentos. Además, se utiliza en la síntesis de compuestos orgánicos relacionados con la fabricación de fármacos y en la elaboración de plásticos.
GLICERALDEHIDO : Es una aldotriosa, una azúcar constituida por tres átomos de carbono. Presenta dos isómeros que se denominan enantiómeros D y L. El gliceraldehido es el primer monosacárido que se obtiene en la fotosíntesis durante la fase oscura (ciclo de Calvin).
GLICERALDEHIDO-3-FOSFATO: En la imagen superior se ilustra la estructura del gliceraldehido-3-fosfato. Las esferas rojas junto a la amarilla corresponden al grupo fosfato, mientras que las negras el esqueleto carbonado. La esfera roja enlazada a la blanca es el grupo OH, pero cuando se enlaza a la esfera negra y ésta última a la blanca, entonces es el grupo CHO.El gliceraldehido-3-fosfato interviene en la glucólisis, un proceso metabólico en el cual la glucosa es degradada al ácido pirúvico con la producción de ATP, un reservorio energético de los seres vivos. Además, de la producción de NADH, un agente reductor biológico. En la glucólisis el gliceraldehido-3-fosfato y la dihidroacetona fosfato se originan por el clivaje de D-fructosa-1-6-bifosfato El gliceraldehido-3-fosfato interviene en el proceso metabólico conocido como el ciclo de las pentosas. En éste se genera el NADPH, importante reductor biológico.
11-CIS-RETINAL : El β-caroteno es un pigmento natural presente en varios vegetales, especialmente en la zanahoria. Experimenta una ruptura oxidativa en el hígado, transformándose así en el alcohol retinol o la vitamina A. La oxidación de la vitamina A y la posterior isomerización de uno de sus dobles enlaces, forma el aldehído 11-cis-retinal.
PIRIDOXAL FOSFATO (VITAMINA B6) : Es un grupo prostético unido a varias enzimas, la cual es la forma activa de la vitamina B6 y participa en el proceso de síntesis del neurotransmisor inhibitorio GABA.
¿Dónde está el grupo formilo en su estructura? Nótese que éste se diferencia del resto de los grupos enlazados al anillo aromático.
Grupo Compuestos
Alquilo: alcanos Radicales Alquilo: -CH3 metilo
Alquenilo: alquenos Radicales Alquenilo: -CH=CH-CH3 1-propenilo
Alquinilo: alquinos Radicales Alquinilo: -C≡CH etinilo
Hidroxilo: R-OH Alcoholes: CH3-OH
Alcoxi: R-O-R' Éteres: CH3−O−CH3
Carbonilo: R-(C=O)-R'
Aldehídos: R-HC=O HCHO Metanal Cetonas: R-(C=O)-R' CH3-(C=O)-CH3
Carboxilo: R-(C=O)-OH
Ácidos Carboxílicos: CH3COOH ác. acético Anhídridos de Ácido: CH3-CO-O-CO-CH2CH3
Acilo: R-CO-O-R' Ésteres: CH3-COO-CH3
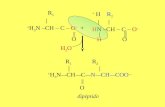
Amino: R-NR'R'' RR'C=N-R''
Aminas: CH3-NH-CH3 Iminas: CH3C=N-CH3
Amino-Carbonilo R-(C=O)-NR'H R-(C=O)-NR'R"
Amidas: CH3-CO-NH2 Imidas: HCONHCOCH3
Nitro: R-NO2 Nitrocompuestos: CH3-CH2-CH2-NO2
Nitrilo: R-C≡N R-N≡C
Nitrilos o Cianuros: H-C≡N Isocianuros: CH3-N≡C
SALICILALDEHIDO: Es una materia prima para la síntesis del ácido acetilsalicílico, medicamento analgésico y antipirético conocido como Aspirina.
Formaldehído
El formaldehído es el aldehído que se produce industrialmente en mayor cantidad. El formaldehido obtenido por la oxidación del metanol se utiliza en una solución al 37% del gas en agua, bajo el nombre de formalina. Esta se usa en el curtido de pieles y en la conservación y embalsamiento de cadáveres. Asimismo el formaldehido se usa como germicida, fungicida e insecticida para plantas y vegetales. Sin embargo, su mayor utilidad es la contribución a la producción de material polimérico. El plástico llamado Bakelita se sintetiza por la reacción entre el formaldehido y el fenol.
Bakelita
La bakelita es un polímero de estructura tridimensional de gran dureza utilizado en numerosos utensilios del hogar como mango de ollas, sartenes, cafeteras, cuchillos, etc. Polímeros semejantes a la bakelita son hechos a partir de formaldehido en combinación con los compuestos urea y melamine. Estos polímeros se usan no sólo como plásticos, sino además se utilizan como pegas adhesivas y material de recubrimiento.
Plywood
El Plywood es el nombre comercial de un material formado por láminas delgadas de madera, unidas por polímeros producidos a partir del formaldehido. Las marcas Formica y Melmac se fabrican con la participación de éste. La Formica es un material plástico usado en el recubrimiento de muebles. El plástico Melmac se utiliza en la elaboración de platos, vasos, tazas, etc. El formaldehido es materia prima para la síntesis del compuesto metilen-difenil-diisocianato (MDI), precursor del poliuretano.
Poliuretano
El poliuretano se usa como aislante en neveras y congeladores, acolchado para muebles, colchones, recubrimientos, adhesivos, suelas, etc.
Butiraldehido
El butiraldehido es el principal precursor para la síntesis del 2-etilhexanol, el cual se emplea como plastificante. Tiene un agradable aroma de manzana que permite su uso en alimentos como saborizante. Además se utiliza para la producción de aceleradores del caucho. Interviene como un reactivo intermedio en la manufactura de solventes
Acetaldehído
El acetaldehído se usaba en la producción de ácido acético. Pero esta función del acetaldehído ha disminuido en importancia, ya que ha sido desplazado por el proceso de Carbonilación del metanol
Síntesis
Otros aldehídos son precursores de los oxoalcoholes, los cuales se utilizan en la producción de detergentes. Los llamados oxoalcoholes se preparan agregando monóxido de carbono e hidrógeno a una olefina para obtener un aldehído. Y finalmente se hidrogena el aldehído para obtener el alcohol. Algunos aldehídos se usan en la fabricación de perfumes, como tal es el caso del Chanel Nº 5. Muchos aldehídos de origen natural tienen olores agradables, por ejemplo: el heptanal posee un olor a hierba verde; el octanal un olor a naranja; el nonanal un olor a rosas y el citral un olor a lima.
REACCIONES DE LOS ALDEHÍDOS:
1. Reacción de oxidación: Los aldehídos pueden oxidarse al ácido carboxílico correspondiente en presencia de
cualquiera de estos compuestos: Ag(NH3)2, KMnO4 o K2Cr2O7. 2. Reducción a alcoholes: Pueden hidrogenarse con ayuda de catalizadores de níquel, platino o paladio. Así, el C=O se
transforma a C-OH. 3. Reducción a Hidrocarburos: En presencia de Zn(Hg), HCl concentrado o en NH2NH2 los aldehídos pierden el grupo
carbonilo y se convierten en hidrocarburos.
4. Adición Nucleofílica: Hay varios compuestos que se adicionan al grupo carbonilo, entre ellos están: reactivos de
Grignard, cianuro, derivados del amoníaco y alcoholes.
ACTIVIDAD COMPLEMENTARIA 1. Realiza un resumen de tu guía de trabajo 2. Explica la importancia, el uso y aplicaciones de los aldehídos 3. Señala la nomenclatura que se utiliza para nombrar los y en que difiere de los alcoholes y cetonas 4. Qué tipo de reacciones sufren los aldehídos y en presencia de que sustancias se produce cada una
5. Señala el nombre correcto para estos compuestos:
1. a) 2,3-propanodial b) 2,3-propanodiol c) 1,2-propanodiol
2. a) 3-butanol b) 2-butanol c) 3-butanal
3. a) 1,2,3-butanotriol b) 2,3,4-butanotriol
4.
c) 1,2,3-butanotirol a) 2,4-hexanol b) 2,4-hexanodiol c) 3,5-hexanodiol
5. a) 2-metil-1,3-pentanodiol b) 2-metil-3,5-pentanodiol c) 4-metil-1,3-pentanodiol
6. a) 4-penten-2-ol b) 1-penten-4-ol c) 2-penteno
7. a) 4-propil-2-penten-5-ol b) 2-propil-3-penten-1-ol c) 4-propil-3-penten-1-ol
8. a) 1,4-bencenodiol b) 1,4-ciclohexanol c) 1,4-ciclohexanodiol
9. a) 2,6-ciclooctadien-1,5-diol b) 1,5-ciclooctadien-3,7-diol c) 1,5-ciclooctadien-4,8-diol
10. a) 1,3-ciclohexadien-5-ol b) 2,4-ciclohexadien-1-ol c) 3,5-ciclohexadien-1-ol
6 .Señala el nombre correcto para estos compuestos:
11. a. 2,3-butanol b. 2,3-butanodiol
c. ) 2,3-butanodial
12. a) 2-butan-1-ol b) 2-buten-1-al c) 2-buten-1-ol
13. a) 3-penten-2-ol b) 3-pentenol-2 c) 3-pentin-2-ol
14. a) 5-hexin-3-en-1-ol b) 3-hexen-1-in-6-ol c) 3-hexen-5-in-1-ol
15. a) 1,2,3-propanol o glicerina b) 1,2,3-propanotriol o glicerina c) 1,2,3-propanotrial o glicerina
16.
a) 4-metil-2,5-pentanodiol b) 2-metil-1,4-pentanodiol c) 2,4-dimetil-1,4-butanodiol
17. a) 1,2-ciclohexanodiol b) 1,2-bencenodiol c) 1,2-ciclohexanol
18. a) 1-ciclohexen-3,5-diol b) 1-ciclohexen-4,6-diol c) 4-ciclohexen-1,3-diol
19. a) 2,3-dietilciclohexanol b) 1,2-dietilciclohexanol c) 1,2-dietilciclohexan-3-ol
20. a. 2-ciclopentenol b. 1-ciclopentenol c. 1-ciclopenten-
ÉTERES De la misma forma que los alcoholes y los fenoles, los éteres pueden considerarse como derivados del agua en los que un átomo de hidrógeno ha sido sustituido por un radical alquilo (alcoholes) o arilo (fenoles). En los éteres, los dos hidrógenos de la molécula de agua son sustituidos por radicales, según la fórmula general R—O—R o R—O—Ar. Si los dos grupos R o Ar son iguales, hablamos de éteres simétricos, mientras que, si son diferentes se denominan éteres asimétricos, como
se ilustra en los siguientes ejemplos: eteres son compuestos de fórmula general R-O-R, Ar-O-R o Ar-O-Ar. Para designar los éteres, por lo general se indican los dos grupos unidos al oxígeno,
seguidos de la palabra éter:
1.3.1 NOMENCLATURA Resulta muy sencilla si teneramos en cuenta que para nombrarlos solamente tenemos que identificar los radicales unidos al oxígeno y luego nombrarlos en orden de complejidad, terminando el nombre con la palabra éter. Estos son algunos ejemplos: 1.3.2 PROPIEDADES FÍSICAS
La presencia del átomo de oxígeno electronegativo hace que los éteres tengan una ligera polarización. Como consecuencia de ello, sus puntos de ebullición son un poco más altos que los de los alcanos semejantes No obstante la polaridad del enlace C—O es más baja en los éteres que en los alcoholes y fenoles, debida a la sustitución del hidrógeno por un radical (R’). Los éteres se comportan como bases de Lewis, a diferencia de alcoholes y fenoles que son preferencialmente ácidos débiles.
1.3.3 PROPIEDADES QUÍMICAS
Comparándolos con los alcoholes y con otras muchas sustancias orgánicas, los éteres resultan químicamente inertes. La desaparición del enlace O—H de los alcoholes reduce considerablemente el comportamiento químico de los éteres y solamente se presenta el que corresponde al enlace C—O. El enlace C—O es fuerte, lo que explica, en parte, la baja reactividad de estas sustancias. Esta propiedad les confi ere una buena capacidad disolvente. Sin embargo, algunos éteres reaccionan lentamente con el aire para formar peróxidos, compuestos que contienen enlaces O—O.
1.3.4 OBTENCIÓN
DESHIDRATACIÓN DE ALCOHOLES: Este método sirve únicamente para producir éteres simétricos a partir de alcoholes primarios, por lo que su uso es algo restringido. La reacción es catalizada con ácido sulfúrico y ocurre a través de la protonación del grupo OH de una molécula de alcohol, dando como resultado la liberación de una molécula de agua. Posteriormente, otra molécula de
alcohol pierde el hidrógeno del grupo OH y se ensambla a la anterior. es una reacción orgánica que transcurre a través del mecanismo SN2, por la cual se forma un éter a partir de un haloalcano primario y un alcóxido (o un alcohol en un medio básico) . Fue desarrollada por el químico inglés Alexander Williamson es muy importante ya que ayudó a probar la estructura de los éteres.
EJERCICIO Escribe los siguientes compuestos en orden de acidez. Justifica tu respuesta:
• Etanol. • • Agua. • Fenol. • Orto-cloro fenol. • Éter etílico
• 2.Escribe las ecuaciones correspondientes para la preparación de las siguientes sustancias:
• o-bromofenol a partir de benceno.
• p-clorofenol a partir de benceno. • Escribe la fórmula para las
siguientes sustancias:
• Éter dimetílico. • Éter metil-propílico. • Cumeno • Fenol • Difenileter • Metil-fenileter • Fenil-ciclohexileter • Dimetil cetona • Éter etílico