Aplicación de ARN de interferencia como tratamiento contra el cáncer
-
Upload
elisa-fernandez -
Category
Documents
-
view
21 -
download
0
description
Transcript of Aplicación de ARN de interferencia como tratamiento contra el cáncer
Aplicacin de ARN de interferencia como tratamiento contra el cncerElisa Fernndez Castillo 1, Sarah Garca Villa 2, Jorge Alejandro Leiva Arrieta 3, Ral Montero Faras 4
1,2,3,4: Estudiantes de quinto semestre de Ingeniera en Biotecnologa en el Instituto Tecnolgico de Monterrey Campus Guadalajara. ResumenEl descubrimiento del ARN de interferencia (ARNi) y su mecanismo de silenciamiento gnico es considerado uno de los mayores logros cientficos en las ltimas dcadas. Estos cidos nucleicos no codificantes cortos, controlan la expresin de genes mediante la represin de ARN mensajeros especficos. Esta capacidad particular, los convierte en armas teraputicas para el tratamiento de enfermedades originadas por la expresin anormal de genes, como es el caso del cncer, donde el ARNi puede inhibir oncogenes o estimular genes supresores de tumores, revirtiendo la malignidad de las clulas cancergenas. Los resultados exitosos de las pruebas clnicas de ARNi sugieren que en un futuro cercano estas molculas podran llegar a tener una amplia aplicacin como terapia contra el cncer. IntroduccinEl ARNi es una respuesta biolgica conservada a ARN de doble hebra (dsARN) que regula la resistencia a cidos nucleicos patgenos y controla pos-transcripcionalmente la expresin gnica. Se cree que el mecanismo, presente en la mayora de los organismos incluyendo el humano, pudo haber surgido de manera natural como defensa a las infecciones virales, la actividad de transposones o para responder a irregularidades en la expresin gnica (Nakamura et al., 2008). La idea de la regulacin en la expresin gnica fue primero observada en caractersticas fenotpicas de una petunia transgnica. En 1990, investigadores insertaron en la flor un gen que codifica para una enzima productora de pigmento con el propsito de incrementar el color prpura de sus ptalos. Para sorpresa de los mismos, tras la insercin de esta secuencia gnica, los ptalos perdieron por completo su pigmentacin morada y como resultado, se expresaron ptalos blancos; a este fenmeno se le denomin silenciamiento gnico pos-transcripcional (PTGS, por sus siglas en ingls) (Karp, 2008).No fue hasta 1998 que se logr comprender este mecanismo con exactitud en el nematodo C. elegans. El experimento llevado a cabo por Andrew Fire y Craig Mello consista en insertar tres estructuras diferentes de ARN en tres diferentes nematodos para determinar cul de ellas produca una reduccin de la expresin del gen unc-22 que codifica para una protena de miofilamento. La primera estructura, llamada hebra con sentido, era un ARN mensajero (mARN) monocatenario con la secuencia codificadora de la protena de inters. La segunda estructura anti sentido contena una secuencia monocatenaria de mARN complementaria a la cadena de mARN de la misma protena. La tercera y ltima estructura de mARN insertada, consista en un ARN de doble cadena: una combinacin de la primera y segunda estructura anteriormente mencionadas. El ARN de doble cadena fue el que result exitoso en el experimento, interfiriendo con la produccin de la protena en el nematodo. Cabe mencionar que ambos investigadores fueron galardonados con el Premio Nobel de Medicina en el 2006 por la descripcin de este mecanismo en clulas animales (Karp, 2008).Ambos fenmenos de silenciamiento gnico pasaron de ser denominados PTGS a ARNi. Este ARNi consiste en dsARN de una longitud de 20-25 nucletidos que se genera por la fragmentacin de precursores ms largos como ARN viral, transposones o dsARN exgeno o endgeno. Mediante la presencia de ARN bicatenario en la clula, se pueden degradar o reprimir los mARNs que contienen secuencias idnticas o muy similares a los de ese dsARN, conduciendo al fenmeno de silenciamiento gnico pos-transcripcional (Imagen 1) (Morales, 2010).Los ARNi se pueden clasificar en dos categoras con base en su origen y mecanismo de accin: los ARN cortos interferentes (siARNs) son ARNs de doble cadena exgenos de 21 a 23 nucletidos de longitud que se hibridan perfectamente al mARN blanco, lo que conlleva a su degradacin por la activacin de nucleasas. Los microARNs (miARNs) son ARNs de doble cadena endgenos de 21 a 22 nucletidos de longitud que se hibridan a las regiones 3' no traducidas de mARNs especficos, reprimiendo su traduccin. El apareamiento de bases entre un miARN y su mARN blanco no es perfectamente complementario, de manera que existen algunos apareamientos errneos en la regin hibridada. Este apareamiento no perfecto conduce a la represin traduccional, a diferencia de la degradacin de los mARNs realizada por los siARNs, lo que distingue entre los dos tipos de ARNi (Lodish et al., 2005). El objetivo de la siguiente revisin es describir el mecanismo de accin del ARNi, su rol en el desarrollo de cncer y exponer el potencial uso de este silenciamiento gnico tipo knock-down como terapia para esta enfermedad que es causada por irregularidades en la expresin de genes.Biognesis y mecanismo de accin de siARNLa biognesis de siARN comienza cuando una enzima llamada Dicer corta dsARN largo, linear y perfectamente complementario en segmentos ms cortos de aproximadamente 20 pares de bases (pb), igualmente bicatenarios, con el extremo 5' fosforilado y el extremo 3 con dos nucletidos salientes. Estos segmentos son los denominados siARNs y adoptan una morfologa tipo tallo-asa (Carthew y Sontheimer, 2009). Estas caractersticas los hacen especficos para que sean reconocidos por el complejo de silenciamiento inducido por ARN (RISC, del ingls ARN-induced silencing complex). El complejo RISC en humanos, consiste en una protena de unin a ARN de doble hebra llamada TRBP y una protena argonauta denominada Ago2 (Gregory et al., 2005). Este complejo es una nucleasa multicomponente que identifica al siARN, y debido a la actividad helicasa de la protena Ago2, se desnaturaliza el ARN bicatenario. El siARN consiste en una hebra gua (la cual se ensambla al complejo protenico RISC formando un complejo denominado siRISC) y una hebra pasajera, la cual al ser separada de la hebra gua, es degradada (Morales, 2010).Una vez que se ha removido la hebra pasajera por la accin de Ago2, la hebra gua de siARN, dirige al complejo siRISC a la cadena diana (Rand et al., 2005). El RISC provee la maquinaria para que el siARN anclado a l se incorpore al mARN diana con la secuencia complementaria de manera completa y perfecta y lo convierta en blanco de endonucleasas para su posterior degradacin (Frstemann et al., 2007). La degradacin del mARN es inducida por la protena Ago2, la cual corta los enlaces fosfodiester en los nucletidos 10 y 11 del mARN diana contando desde el extremo 5. El corte de la protena Ago2 es muy preciso, produciendo terminales 5-monofosfato y 3- hidroxilo (Tomari y Zamore, 2005). Este corte es fundamental en el mecanismo de silenciamiento ya que convierte el mARN en blanco de las dems endonucleasas para completar el proceso degradativo del mismo(Orban e Iizaurralde, 2005). Una vez el que el mARN ha sido degradado por completo, el siARN y el complejo RISC se separan de la cadena de mARN recientemente degradada y el complejo RISC pasa a unirse a otra nueva cadena de siARN para repetir el ciclo del ARNi para el silenciamiento gnico (Rivas et al., 2005).Biognesis y mecanismo de accin de miARNLos miARNs comparten caractersticas similares a los siARNs: oscilan entre los 20 y 23 nucletidos de longitud y son procesados por un mecanismo muy similar en el que se utilizan algunas de las mismas protenas . Como se mencion, un miARN es codificado por un gen en el genoma y se dirige al mARN diana de manera especfica. Esta molcula es parcialmente complementaria al mARN blanco e inhibe la traduccin del mismo, a diferencia del siARN (Carthew y Sontheimer, 2009).Los miARNs son sintetizados por la polimerasa de ARN II como transcritos primarios largos (pri-miARN) con un casquete 5 y una cola poli-A. En el ncleo, el pri-miARN es procesado por una enzima denominada Drosha, produciendo fragmentos llamados pre-miARNs de aproximadamente 70 nucletidos de longitud que adoptan una conformacin tipo tallo-asa. El pre-miARN, es exportado al citoplasma a travs de una protena llamada exportina, donde es procesado por la enzima Dicer para formar los miARNs maduros de 21-23 nucletidos de longitud (Nakamura et al., 2008).Una vez formados los miARNs maduros, stos son procesados de la misma manera que los siARNs: el ARN bicatenario es reconocido por el complejo RISC, y mediante la actividad helicasa de la protena Ago2, es desnaturalizado. La hebra gua se incorpora al complejo, mientras la hebra pasajera es degradada. En el ltimo proceso de regulacin de expresin gnica, el miARN se adhiere al mARN diana por complementariedad de bases y bloquea la traduccin del mismo debido a la hibridacin imperfecta (Imagen 2) (Karp, 2008).Los miARNs juegan un papel biolgico muy importante debido a la regulacin de la expresin gnica de genes involucrados en un sinfn de mecanismos celulares. Recientes estudios proponen que los miARNs participan en la formacin de patrones en el sistema nervioso, el control de la proliferacin, la muerte celular y la diferenciacin de diversos tipos celulares. Debido al alto impacto que tienen estas molculas a nivel celular y a la evidencia que seala que su desregulacin es un detonante de enfermedades genticas, uno de los principales retos de la investigacin cientfica actual se centra en identificar las secuencias de los genes que codifican los miARNs para correlacionar la expresin de miARNs con aspectos clnicos patolgicos y utilizarlos como una herramienta para el silenciamiento gnico mediante la restauracin de la funcin de los miARNs que se encuentren desregulados (Vzquez et, al, 2008). Rol de los miARNs en cncerEl cncer es una enfermedad originada por un aumento descontrolado de la proliferacin celular y la inhibicin de la apoptosis. Estas alteraciones son causadas por modificaciones genticas y epigenticas en dos amplias clases de genes que codifican protenas que regulan la entrada y la salida de las clulas al ciclo celular: los protooncogenes y los genes supresores de tumores. Al sufrir de mutaciones, los protooncogenes se convierten en oncogenes, cuyos productos proteicos estimulan el crecimiento celular acelerado y los genes supresores de tumores, que normalmente restringen el crecimiento, pierden esta capacidad reguladora, lo que induce la proliferacin celular (Lodish et, al. 2005).La primera evidencia de la participacin de los miARNs en las neoplasias humanas surgi del intento de identificar los genes involucrados en el desarrollo de la leucemia linftica crnica (LLC). Para sorpresa del equipo de investigadores que analizaban el cromosoma 13q14 que se encuentra delecionado en esta enfermedad, la secuencia no contena ningn gen supresor de tumor; sin embargo encontraron dos genes que codificaban miARNs: miR-15a y miR-16-1. Esto sugiri el posible rol de los miARNs en la patognesis del cncer (Croce, 2009). Con base en esta hiptesis, varios equipos de investigacin se dedicaron a la localizacin y estudio de los genes de miARNs que pudieran estar relacionados con el cncer y en los ltimos aos se ha demostrado que muchos de ellos regulan la expresin de oncogenes y genes supresores de tumores; por lo que la ganancia o prdida de sus funciones, por irregularidades en las vas de sealizacin o por deleciones o mutaciones en los loci de los miARNs, estn implicadas en el desarrollo de la enfermedad. Estos resultados se correlacionan con los estudios que indican que los loci de miARNs se localizan en regiones cromosmicas propensas a sufrir de deleciones y amplificaciones en el cncer (Tabla 1) (Vzquez et al., 2010).Dependiendo de la regulacin que realicen, los miARNs pueden ser descritos como genes supresores de tumores u oncogenes. Los miARNs definidos como genes supresores de tumores regulan negativamente la expresin de ciertos oncogenes. En la mayora de las neoplasias, stos son blancos de deleciones, lo que resulta en una sobreexpresin del oncogn que regulan, desencadenando la patognesis de varios tipos de tumores humanos. En el caso de LLC, miR-15a y mir-16-1 estn relacionados con la inhibicin de BCL-2, una protena que impide la apoptosis. En esta enfermedad, las secuencias de miARNs estn delecionadas, por lo que existe una sobreexpresin del oncogn que desencadena la proliferacin celular (Vzquez et al., 2010). Los miARNs catalogados como oncogenes, han sido observados en un gran variedad de tumores humanos. La mayora se encuentra amplificada en el ADN, lo que resulta en una sobreexpresin de los miARNs que genera la represin de genes supresores de tumores promoviendo la proliferacin, angiognesis y la inhibicin de apoptosis. El miARN, miR-21 se encuentra sobreexpresado en una gran variedad de tumores, como en el cncer de seno, pulmn, colon, pncreas, hgado, estmago y prstata. Se ha demostrado que miR-21 inhibe las protenas supresoras de tumores PTEN, PDCD4, TIMP1 y TIMP3 (Croce, 2009). Es importante mencionar que la clasificacin de los miARNs como oncogenes o genes supresores de tumores depende del tejido o del tipo celular en el cual se ejecute su funcin, puesto que los miARNs que funcionan como genes supresores de tumores en un tipo celular, pueden ser oncogenes en otro. Por ejemplo, miR-221 y miR-222 inhiben el oncogn KIT, actuando como genes supresores de tumores en las clulas eritroblsticas, sin embargo funcionan como oncogenes al degradar protenas supresoras de tumores como PTEN, p27, p57 y TIMP3 en varios tumores slidos humanos (Croce, 2009).La desregulacin de la expresin de miARNs en cncer puede ser tambin ocasionada por modificaciones epigenticas en su secuencia codificante. Las modificaciones epigenticas en los promotores de los miARNs supresores de tumores es un hallazgo comn en varios tipos de tumores, en particular la metilacin de las islas CpG que contribuye en su silenciamiento y en la generacin de clulas cancergenas. Varios estudios demuestran que un patrn de metilacin aberrante en estas secuencias resulta en una expresin irregular de miARNs. Por ejemplo, cuando se trataron clulas T24 de cncer de vejiga con un inhibidor DNMT, se report un incremento en la expresin de miR-127, un miARN con un promotor rico en islas CpG que se encarga de inhibir el protooncogn BCL-6 y que generalmente se encuentra silenciado en varios tumores. De manera inversa, se encontr que la sobreexpresin del miARN oncognico miR-21 en clulas de cncer de pulmn se deba a la hipometilacin en sus promotores (Iorio y Croce, 2012). Estas evidencias han dado lugar a la utilizacin de agentes metilantes o desmetilantes de ADN como tratamiento para revertir las modificaciones epigneticas, consiguiendo la restauracin de los miARNs y restableciendo el ciclo celular en las clulas cancerosas. De igual forma, se ha demostrado que algunos miARNs que se encuentran desregulados son encargados de controlar a las enzimas metiltransferasas, por lo que la restitucin de su actividad podra revertir el desarrollo de clulas de cncer (Iorio y Croce, 2012). Tratamientos contra el cncer utilizando ARNiEl principio del tratamiento de cncer con ARNi se basa en la dependencia de las clulas cancergenas de los productos de protooncogenes y genes supresores de tumores mutados para mantener su crecimiento constante, por lo que se puede utilizar la capacidad silenciadora del ARNi para anular los productos de estos genes, y as evitar el crecimiento de las clulas cancerosas (Lpez et al.. 2014).El empleo del ARNi como base para el desarrollo de nuevas terapias oncolgicas ha tenido gran auge en las ltimas dcadas debido a su especificidad, su tamao pequeo que no induce respuestas inmunitarias en la clula y la capacidad de silenciar mltiples molculas en el contexto de una va de sealizacin, lo que las hace extremadamente eficientes en regular el conjunto de eventos relacionados con la proliferacin celular (Iorio y Croce, 2012) . El hallazgo de la presencia de una expresin anmala en miARNs que actan como oncogenes o genes supresores de tumores en varios cnceres humanos, ha sugerido que un tratamiento que restaure su funcin, podra ser exitoso. La introduccin de miARNs en tumores en los cuales se ha perdido su funcin, o el silenciamiento de miARNs oncognicos utilizando oligonucletidos anti-miR podra revertir la perturbacin del ciclo celular y mandar a la clula a apoptosis (Croce, 2009). Un reciente estudio en cncer de hgado, demostr que clulas de cncer hepatocelulares exhiben una expresin reducida del miR-26-a que normalmente se encuentra expresado en niveles ms altos en otros tejidos sanos. La expresin de este miARN est asociado a la detencin del ciclo celular mediante el control de las ciclinas D2 y E2. El estudio tuvo como objetivo introducir el miARN desregulado, sin afectar la biognesis de otros miARNs endgenos. Los resultados de este estudio demostraron que el suministro teraputico del ARN bicatenario result en la reduccin del tumor por la inhibicin de la proliferacin de clulas cancerosas e induccin de la apoptosis (Tabernero et. al, 2013). La propiedad ms importante de los oligonucletidos anti-miR utilizados para regular la sobreexpresin de miARNs oncolgicos es su especificidad y su alta afinidad de unin a miARNs para bloquear su expresin. En un estudio realizado en lneas celulares de cncer colorectal que presentan una sobreexpresin del miR21 oncognico, las clulas se trataron con anti-miR21 lo que redujo la viabilidad de las mismas por el incremento en la apoptosis (Song y Rossi, 2013). Diversos estudios indican que la administracin intravenosa de anti-miARNs resulta en una disminucin significativa de los miARNs blancos en hgado, pulmn, rin, corazn, intestino, ovarios y adrenales, sugiriendo su efectividad como terapia oncognica (Krtzfeldt et al., 2012). Asimismo, se ha demostrado que los oncogenes implicados en el desarrollo de cncer pueden ser silenciados por dsARN exgeno (siARNs), resultando en una disminucin de la tumorogenicidad in vivo. El efecto knock-down de estos genes, se debe de inducir mediante la introduccin de un ARN bicatenario a las clulas blanco .El primer oncogn silenciado por ARNi fue K-Ras en un estudio con ratones desnudos atmicos y se observ una inhibicin del crecimiento tumoral. Recientemente se introdujo dsARN en la lnea celular SGC-7901 de carcinoma gstrico humano contra survivina, una protena inhibidora de la apoptosis y se observ una inhibicin en el crecimiento del tumor (Miao, Lu y Zhang, 2007). De igual manera las clulas cancergenas de cncer cervical han sido tratadas con siARNs. Se ha demostrado que las oncoprotenas virales pueden tener propiedades anti-apoptticas por el efecto que tienen sobre los oncogenes E6 y E7. Al introducir siARNs, estas molculas se hibridan a los oncogenes, lo que conlleva a su silenciamiento, restableciendo las funciones de p53 sobre el control del ciclo celular y la apoptosis. Este escenario de silenciamiento que se dirige directamente a los oncogenes representa una ventaja teraputica en comparacin con el uso de agentes quimioteraputicos que solo inhiben la proliferacin celular (Peralta, Bermdez y Madrid, 2010).Debido a los resultados exitosos en varios estudios in vitro, los siARNs comienzan a ser probados in vivo con el objetivo de evaluar su accin sobre diferentes oncogenes para su aplicacin como terapia (Nakamura et al., 2008). Uno de los mayores retos a los que se enfrenta este tipo de terapia gnica, es encontrar mtodos ptimos que introduzcan el siARN en la clula blanco. De los aspectos ms importantes a considerar es que debido a su tamao, estas molculas teraputicas de 7-20 kDa, son eliminadas del torrente sanguneo por los riones. Asimismo, una vez que los siARNs se introducen en el tejido blanco, se debe de asegurar que puedan penetrar la membrana celular y que mantengan su estabilidad (Morales, 2010). En las etapas tempranas de la tecnologa de silenciamiento gnico va ARNi, las clulas eran transfectadas con siARNs desnudos, y aunque s se observaba un efecto silenciador sobre el gen de inters, el efecto de interferencia era temporal, por lo que el gen blanco se estabilizaba a sus condiciones basales y volva a expresarse. Para tratar de prolongar el efecto silenciador, se decidi utilizar vectores de ADN que generaran siARNs constantemente bajo el control de un promotor de tejido especfico, casi siempre el promotor U6 de humano. Este promotor es especfico para la ARN polimerasa III, la cual sintetiza ARNs pequeos hasta que encuentra una cola de poliT. Para generar siARNs en un vector de expresin (Imagen 3), el promotor se coloca en la el extremo 5' seguido de la secuencia de 21-25 nucletidos dirigida contra un mARN blanco, despus se posiciona una secuencia espaciadora, la misma secuencia del siARN pero invertida (para generar la estructura tallo-asa caracterstica de los siARNs) y finalmente una cola de al menos cinco timinas. La ARN polimerasa III transcribe esta secuencia y genera los siARNs que son reconocidos por el RISC para continuar con la interferencia del mARN (Nakamura et al., 2008). Asimismo se han utilizado vectores virales debido a su alta eficacia como vehculos de cidos nucleicos. Aprovechando las estrategias desarrolladas evolutivamente por los virus para poder insertar material gentico en las clulas, son de los mtodos ms utilizados en la actualidad. El vector de adenovirus es uno de los ms efectivos en terapia gnica debido a que las secuencias de cido nucleico que transportan no se integran en el genoma de la clula, haciendo que el riesgo de producir mutagnesis por insercin sea prcticamente nula (Nakamura et al., 2008). Adems de los vectores virales, se han empleado fusiones de siARNs en liposomas con el objetivo aumentar la estabilidad del ARNi en el torrente sanguneo. A estas cpsulas de lpidos se les pueden insertar seales especficas para dirigirlas a un tejido blanco y aumentar la entrada del ARNi en las clulas. Estos liposomas se pueden introducir va intravenosa, intraperitoneal, intratumoral, subcutnea, subretinal y electroporacin y debido a que presentan un tiempo prolongado de retencin en el torrente sanguneo, se pueden acumular en el tejido del tumor (Li et al., 2006).Todos estos mecanismos de introduccin de ARNi estn siendo estudiados intensamente debido a que el xito de esta terapia depende de varios factores entre los que se incluyen la proteccin del ARNi, la eficacia de transfeccin, la estabilidad del ARNi y la prevencin de efectos txicos o no deseables. La superacin de todas estas dificultades tcnicas permitir la aplicacin generalizada de este mecanismo promisorio como terapia oncolgica. (Vzquez et al., 2010). ConclusionesEl empleo de siARNs y miARNs como base para el desarrollo de nuevas estrategias teraputicas oncolgicas, ha despertado un gran inters por ser ms especficos y presentar menor respuesta inmunitaria indeseada una vez que se han aplicado. Pese a que todava es un rea de investigacin y se requiere de mayor tiempo para hacer realidad la terapia gnica con ARNi, el xito que han tenido diversos estudios en diferentes modelos animales, abren la posibilidad de que en un futuro cercano se puedan establecer mejores estrategias para poder utilizarlos. Dentro de los mayores retos de la tecnologa del ARNi se encuentra la identificacin de secuencias de miARNs que podran estar desregulados en una neoplasia y el establecimiento de los medios tcnicos ptimos para introducirlos en clulas blanco. La superacin de estas dificultades permitir la aplicacin generalizada y exitosa de estos esquemas teraputicos. Al tener propiedades anti-apoptticas y generar menor respuesta inmunitaria en el paciente, es posible prever que en un futuro cercano el silenciamiento gnico mediante ARNi tenga una amplia aplicacin clnica, prefiriendo a ste sobre los dems tipos de tratamientos.
ReferenciasCarthew, R. y Sontheimer, E. (2009). Origins and Mechanisms of miARNs and siARNs. Estados Unidos: NIH Public Access
Croce, C. (2009). Causes and consequences of microARN dysregulation in cancer. Estados Unidos: Nature Reviews. Vol.10, pp.704-714.Frstemann, K., Horwich, M.D., Wee, L., Tomari, Y., and Zamore, P.D. (2007). Drosophila microARNs are sorted into functionally distinct Argonaute protein complexes after production by Dicer-1. Alemania: NIH Public Access
Gregory, R.I., Chendrimada, T.P., Cooch, N., and Shiekhattar, R. (2005). Human RISC couples microARN biogenesis and posttranscriptional gene silencing. Estados Unidos: Cell Press. Vol 123, pp. 631-640.
Iorio, M. y Croce, C. (2012). MicroARN dysregulation in cancer: diagnostics, monitoring and therapeutics. A comprehensive review. Estados Unidos: EMBO Molecular Medicine. Vol. 10, pp. 143-159.Karp, Gerarld. (2008). Biologa Celular y Molecular Conceptos y Experimentos. 5.ed. Mxico: McGraw Hill.
Krtzfeldt, Rajewsky, Braich, KRajeev, Tuschl, Manoharan y Stoffel. (2005). Silencing of microARNs in vivo with antagomirs. Estados Unidos: Nature.Li, Parker, Menocal, Xiang, Borodyansky y Fruehauf. (2006). Delivery of ARN interference. Estados Unidos: Landes Bioscience.Lodish, Berk, Matsudaira, Kaiser, Krieger, Scott, Zipursky y Darnell. (2005). Biologa Molecular y Celular. Estados Unidos: Edicin Mdica Panamericana.Lpez et al.. (2014). ARN de interferencia: el silencio de los genes. UNAM. Recuperado de: http://www.ibt.unam.mx/computo/pdfs/libro_25_aniv/capitulo_10.pdfMiao, Lu y Zhang. (2007). Downregulation of survivin by ARNi inhibits growth of human gastric carcinoma cells. China: World JouARNl of Gastroenterology.Morales Snchez, A. (2010). Terapia gnica con ARN de interferencia. Mxico: Universidad Veracruzana, Facultad de Ciencias Qumicas. Nakamura, Esparza, Garrido, Palomar y Gallardo. (2008). Aplicaciones teraputicas del ARN de interferencia. Mxico: Bioquimia. Vol. 34, Nm.1, pp. 26-36. Orban, T.I., and Izaurralde, E. (2005). Decay of mARNs targeted by RISC requires XRN1, the Ski complex, and the exosome. ARN 11, 459469.
Peralta, O., Bermdez, V. y Madrid, V. (2010). ARN de interferencia: biognesis, mecanismos moleculares y sus aplicaciones en cncer cervical. Medigraphic. Recuperado el 19 de octubre de 2014, de http://www.medigraphic.com/pdfs/revinvcli/nn-2010/nn101i.pdf
Rand, T.A., Petersen, S., Du, F., and Wang, X. (2005). Argonaute2 cleaves the anti-guide strand of siARN during RISC activation. Cell 123, 621629.
Rivas, F.V., Tolia, N.H., Song, J.J., Aragon, J.P., Liu, J., Hannon, G.J., and Joshua-Tor, L. (2005). Purified Argonaute2 and an siARN form recombinant human RISC. Nat. Struct. Molecular Biology. 12, 340349.
Song, M. y Rossi, J. (2013). The anti-miR21 antagomir, a therapeutic tool for colorectal cancer, has a potential synergistic effect by perturbing an angiogenesis-associated miR30. Estados Unidos: Frontiers in Genetics. Vol.4.Sylentis. (2010). Tecnologa RNAi. Recuperado de http://www.sylentis.com/index.php/es/tecnologia-rnai.html el 05 de noviembre de 2014.Tabernero et. al. (2013). First-in-Humans Trial of an RNA Interference Therapeutic Targeting VEGF and KSP in Cancer Patients with Liver Involvement. Estados Unidos: Cancer Discovery Tomari, Y., Du, T., and Zamore, P.D. (2007). Sorting of Drosophila small silencing ARNs. Cell 130, 299308.
Vzquez, Contreras, Lizano, Amador, Garca, Snchez y Bentez. (2010). ARN de interferencia y su potencial teraputico en cncer. Mxico: Revista de Investigacin Clnica, Vol. 62, Nm 1, pp. 81-90.
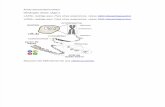
Imagen 1. Mecanismo de silenciamiento gnico mediante ARNi (Tomada y modificada de Sylentis)
Imagen 2. Biognesis y mecanismo de accin de ARNi
Imagen 3. Generacin de siARNs en vectores de expresin (Nakamura et al., 2008)
.
Tabla 1. Localizacin cromosmica de miARNs y su asociacin en diferentes tipos de cncermiARNLocalizacin del genAsociacin con cncerFuncin
miR-15a, miR-16-1Cromosoma 13q14Deletado o desregulado en Leucemia linfoctica crnica de clulas B. Regula negativamente el oncogn BCL-2 ST
miR-143miR-145Cromosoma 5q32-33Disminuido en cncer colo-rectal y desregulado en cncer de mama, prstata y crvixmiR-145 est disminuido en cncer de mamaST
miR-21Cromosoma 17q23.2Factores anti-apoptticos; sobre regulados en glioblastomas y cncer de mamaOG
Miembros de la familia let-7Localizacin mltipleRegula negativamente a oncogenes Ras y se encuentra disminuido en cncer de pulmnST
BIC/ miR-155Cromosoma 21q21Sobre-regulado en linfoma de Burkitt, Hodgkin, linfoma mediastnico primario y difuso de clulas B largas, cncer de mamaOG
Grupos miR-17-19bCromosoma 13q31-32Sobre-regulados por el oncogn MYC; regula negativamente los oncogenes E2F; prdida de heterocigocidad. Este grupo se encuentra en carcinoma hepatocelular. Sobre-expresado en linfoma de clulas B.ST/OG
ST: Supresor de tumor. OG: Oncogn (Modificado de Vzquez et al., 2010)