AMINOÁCIDOS Y PROTEÍNAS · polipeptídica se curva o se pliega Forma la estructura estrechamente...
Transcript of AMINOÁCIDOS Y PROTEÍNAS · polipeptídica se curva o se pliega Forma la estructura estrechamente...
PROTEÍNAS
Son las moléculas orgánicas más abundantes
en las células (50% peso seco).
Presentes en todas las partes de la célula..
Fundamentales en la estructura y función
celular
Son muy versátiles y diversas
PROTEÍNAS
Funciones principales:
Enzimática.
Hormonal
Transportadora (Hemoglobina)
Defensiva (anticuerpos)
Estructural (colágeno)
etc.
PROTEÍNAS
Las proteínas de todo ser vivo están determinadas
genéticamente.
La información genética (DNA) determinan qué
proteínas tendrá un individuo.
PROTEÍNA: Composición química
Todas las proteínas contienen C, H, O y N y casi todas
poseen también S.
También hay proteínas con presencia de: P, Fe, Zn y Cu.
El contenido de N representa, término medio, 16%
de la masa total de la molécula; es decir, cada 6,25 g
de proteínas contienen 1 g de N.
PROTEÍNAS: Composición
Poseen pesos moleculares muy elevados.
Por hidrólisis ácida, dan lugar a moléculas de
bajo peso molecular: Aa.
Generalmente, se encuentran formando la
bases de la estructura de una proteína 20 Aa.
PROTEÍNAS: Composición
Formados por Aa unidos covalentemente
formando polímeros no ramificados.
Cada cadena polipeptidica, posee una
especifica composición química, un PM, y una
secuencia de Aa estructurales y una forma
tridimensional.
Según su composición:
Simples:
Por hidrólisis producen sólo Aa.
Contienen 50% de C, 7% de H, 23% de
O, 16% de N y de 0 – 3% de S.
PROTEINA: CLASIFICACIÓN
Según su composición:
Conjugadas:
Por hidrólisis producen Aa y otros compuestos
orgánicos e inorgánicos.
Se denomina grupo prostético a la porción no
aminoácida.
Subclasificación por origen químico del
grupo prostético.
PROTEINA: CLASIFICACIÓN
Según su composición:
Conjugadas o heteroproteínas:
Por hidrólisis producen Aa y otros compuestos
orgánicos e inorgánicos.
Contienen una porción no aminoacídica llamada grupo
prostético unido al resto de la molécula.
Subclasificación por origen químico del grupo
prostético:
Nucleoproteínas
Lipoproteínas
Fosfoproteínas
Metaloproteínas
Glucoproteínas
PROTEINA: CLASIFICACIÓN
MIOGLOBINA
(153 aa)
Está compuesta por una sola cadena polipeptídica y no posee estructura cuaternaria.
Según su conformación: Característica que
corresponde a la forma tridimensional de la molécula
proteica.
Proteínas fibrosas
Proteínas globulares
PROTEÍNA: Clasificación por su forma
PROTEÍNA Clasificación por su forma
Fibrosas:
Presentan cadenas polipéptidas largas y una
atípica estructura secundaria.
Son insolubles en agua y en soluciones salinas
diluidas.
PROTEÍNA Clasificación por su forma
Fibrosas:
Son los elementos básicos estructurales en el tejido conjuntivo de los animales superiores:
Colágeno: Tendones y la matriz de los huesos.
Queratina: Cabello, cuero, uñas y plumas.
Elastina: Tejido conjuntivo elástico.
PROTEÍNA Clasificación por su forma
Globulares:
Doblan sus cadenas en una forma esférica apretada o compacta:
Grupos hidrófobos hacia adentro de la proteínas
Grupos hidrófilos hacia afuera, lo que produce que sean solubles en solventes polares como el agua.
PROTEÍNA Clasificación por su forma
Globulares:
Desempeñan generalmente una función móvil o dinámica en la célula.
Ejemplo:
La mayoría de las enzimas
Anticuerpos
Algunas hormonas
Proteínas de transporte: Seroalbúmina y la hemoglobina
PROTEÍNA Clasificación por su forma
Mixtas: Situadas entre el tipo fibroso y globular.
Poseen largas estructuras cilíndricas.
Son solubles en las disoluciones acuosas salinas
Ejemplo:
Miosina: elemento estructural del músculo.
Fibrinógeno: Precursor de la fibrina (elemento estructural de los coágulos sanguíneos.
PROTEÍNA Composición estructural
Cuenta con cuatro niveles de organización:
Estructura primaria
Estructura secundaria
Estructura terciaria
Estructura cuaternaria:
PROTEÍNA Composición estructural
Sanger, en 1953 fue el primero en estudiar y
determinar la estructura primaria de una
proteína, la insulina.
PROTEÍNA Composición estructural
Estructura primaria
Es la secuencia de aminoácidos de la proteína.
Corresponde al esqueleto covalente (estabilidad) de
la cadena polipeptídica
aminoácidos
PROTEÍNA Estructura primaria
Indica qué aminoácidos componen la cadena
polipeptídica
Indica el orden de los aminoácidos
La función de una proteína depende de su
secuencia y de la forma que ésta adopte.
PROTEÍNA Estructura primaria
Importancia:
La variación en un solo Aa de una
cadena polipeptídica puede determinar
una falta letal en la proteína completa.
PROTEÍNA Estructura secundaria
hélice
lámina
Dispone la secuencia de
aminoácidos en el espacio.
Evidente en las proteínas
fibrosas y en algunos segmentos
de la cadena polipeptídica de las
proteínas globulares
“Bioquímica” Mathews, van Holde y Ahern.
Addison Wesley 2002
PATRONES DE ENLACES DE HIDRÓGENO PARA 4 HÉLICES
La cadena polipeptídica se pliega adoptando una
forma helicoidal con giro a la derecha que contiene 4
residuos de aminoácidos por vuelta.
PROTEÍNA Estructura secundaria
La cadena polipeptídica se pliega adoptando una
forma helicoidal con giro a la derecha que contiene 4
residuos de aminoácidos por vuelta.
PROTEÍNA Estructura secundaria
PUENTES DE HIDRÓGENO PARA UNA HÉLICE
DISPOSICIÓN EN HÉLICE-
El esqueleto polipeptídico se
encuentra enrollado alrededor del
eje longitudinal de la molécula
Los grupos R de los
aminoácidos sobresalen hacia
el exterior
Es dextrógira
PROTEÍNA Estructura secundaria
Durante la síntesis de proteínas y gracias a la capacidad
de giro de sus enlaces, adquieren una disposición
espacial estable.
PROTEÍNA Estructura terciaria
hoja
hélice
Se refiere al modo como la cadena
polipeptídica se curva o se pliega
Forma la estructura estrechamente
plegada y compacta de las proteínas
globulares.
Facilita la solubilidad en agua
ayudando a realizar funciones de
transporte , enzimáticas , hormonales,
etc.
PROTEÍNA Estructura terciaria
La conformación globular se mantiene estable gracias
a la existencia de enlaces entre los radicales R de los Aa.
Los tipos de enlaces que estabilizan la estructura
terciaria son:
Atracción electrostática de tipo salino entre un
grupo carboxilato (-COO-) y un grupo amino (-NH3+) de
residuos glutamato o aspartato con Usina o arginina.
PROTEÍNA Estructura terciaria
Los tipos de enlaces que estabilizan la estructura
terciaria son:
Puentes de hidrógeno, entre grupos carboxilato,
oxhidrilo (-OH) o los propios grupos carbonilo (-C=0)
de las uniones peptídicas
Interacción de cadenas polares, como los grupos
aromáticos de la fenilalanina o los no aromáticos de
alanina e isoleucina, etc
PROTEÍNA Estructura terciaria
Los tipos de enlaces que estabilizan la estructura terciaria son: Fuerzas de Van der Waals, cuando los residuos son idénticos como dos metilos de la alanina, hidroximetilos de la serina, etc Puentes disulfuro, que se establecen entre los grupos sulfhidrilo (-SH) de la cisteína para dar el enlace covalente disulfuro (-S-S-) entre cadenas vecinas
PROTEÍNA Estructura cuaternaria:
Manifiesta la disposición espacial de proteínas con
mas de una cadena polipeptídica
La mayoría de las grandes proteínas (fibrosas o
globulares) contienen 2 o más cadenas
polipeptídicas.
Ligada a las propiedades reguladoras de las
proteínas, particularmente en los sistemas llamados
alostéricos.
PROTEÍNA Estructura cuaternaria:
Esta estructura informa de la unión , mediante
enlaces débiles ( no covalentes) de varias cadenas
polipeptídicas con estructura terciaria, para
formar un complejo proteico.
= +
Triosafosfato isomerasa de la levadura Saccharomyces cerevisiae.
Niveles estructurales de las proteínas
Estructura
primaria
Estructura
secundaria
Estructura
terciaria Estructura
cuaternaria
Residuos de
aminoácidos Hélice Cadena polipeptídica Subunidades ensambladas
PROTEÍNAS
Las proteínas que poseen este grado de organización estructural se denominan oligoméricas
Las cadenas polipeptídicas individuales que la integran se denominan monómeros, protómeros o subunidades.
Cuando una proteína oligomérica contiene dos o cuatro monómeros o subunidades se denomina dímero o tetrámero, respectivamente.
PROTEÍNAS OLIGOMÉRICAS
Ejemplo de tetrámero:
Hemoglobina:
Pigmento respiratorio de los eritrocitos de la
sangre.
Formado por 4 cadenas polipeptídicas.
Conformación globular compacta.
Estructura estable.
PROTEÍNAS: PROPIEDADES
Varias moléculas proteicas retienen su
actividad biológica dentro de un rango
acotado de pH y T.
Al desnaturalizarse una proteína, pierde
solubilidad en el agua y precipita.
PROTEÍNAS: PROPIEDADES
Al desnaturalizar una proteína pierden todas
las estructuras menos la primaria, debido a
que los enlaces covalentes del esqueleto
peptídico de las proteínas no se rompen.
PROTEÍNAS: PROPIEDADES
Sobre los 60-70ºC se desnaturaliza una
proteína globular:
Albúmina: formación de un coagulo
insoluble blanco.
PROTEÍNAS: PROPIEDADES
La consecuencia mas significativa de la
desnaturalización de una proteína es la
perdida de la actividad biológica.
Calentamiento de las enzimas: perdida de la
capacidad catalítica.
PROTEÍNAS:
Clasificación por su función biológica
Diversidad funcional.
Depende del ordenamiento tridimensional apropiado de sus grupos funcionales.
Las proteínas sólo funcionan cuando están plegadas en su estructura original o conformación nativa.
Enzimas:
Existen mas de dos millares de enzimas diferentes.
Cada una cataliza un tipo diferente de reacción química.
Poseen gran potencia catalítica.
PROTEÍNAS:
Clasificación por su función biológica
Enzimas:
Existen mas de dos millares de enzimas diferentes.
Cada una cataliza un tipo diferente de reacción química.
Poseen gran potencia catalítica.
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Enzimas:
Hexoquinasa:
Cataliza la transferencia del grupo
fosfato desde el ATP a la glucosa.
Es la primera etapa del metabolismo
de la glucosa
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Enzimas:
Citocromo C:
Transfieren electrones hacia el
oxígeno molecular durante la
respiración
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Enzimas:
DNA polimerasa:
Participa e la biosíntesis de los
componentes celulares.
Replica y repara DNA y RNA.
PROTEÍNAS:
Clasificación por su función biológica
Proteínas transportadoras:
Capaces de unirse y transportar
moléculas específicas por la sangre.
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Proteínas transportadoras:
Seroalbúmina:
Se une estrechamente a los Ác. Grasos libres.
Transporta las moléculas entre el tejido adiposo y
otros órganos de los vertebrados.
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Proteínas transportadoras:
Lipoproteína del plasma sanguíneo:
Transporta lípidos entre el intestino, el hígado y
los tejidos adiposos
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Proteínas transportadoras:
Hemoglobina:
Presente en vertebrados
Transporta oxígeno desde los pulmones a los
tejidos
NOTA: En invertebrados las moléculas proteicas que transportan oxígeno son las Hemocianinas.
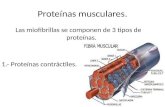
PROTEÍNAS: Clasificación por su función biológica
Tipos y ejemplos Localización o función
* *
*Elementos proteicos principales de los sistemas contráctiles del
mùsculo
PROTEÍNAS:
Clasificación por su función biológica
Ejemplo de Hormonas:
Insulina:
Segregada por células del páncreas.
Regula el metabolismo de la glucosa.
Su déficit provoca la diabetes melitus.
PROTEÍNAS: Clasificación por su función biológica
Tipos y ejemplos Localización o función
Proteína protectora de la
sangre de los vertebrados
* *
* La coagulación de la sangre evita la pérdida de sangre del sistema
vascular de los vertebrados
PROTEÍNA Composición química
SOLUBILIDAD:
Son solubles en agua cuando adoptan una
conformación globular.
La solubilidad es debida a los radicales (-R) libres
de los aminoácidos que, al ionizarse, establecen
enlaces débiles (puentes de hidrógeno) con las
moléculas de agua.
PROTEÍNA Composición química
SOLUBILIDAD:
Cuando una proteína se solubiliza queda recubierta de una capa de moléculas de agua (capa de solvatación) que impide que se pueda unir a otras proteínas lo cual provocaría su precipitación (insolubilización).
Esta propiedad es la que hace posible la hidratación de los tejidos de los seres vivos.
PROTEÍNAS: PROPIEDADES
Solubilidad: Se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH, se pierde la solubilidad.
Capacidad Electrolítica: Se determina a través de la electrólisis, en la cual si las proteínas se trasladan al polo positivo es porque su radical tiene carga negativa y viceversa.
PROTEÍNAS: PROPIEDADES
Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
Amortiguador de pH: (conocido como efecto tampón) Actúan como amortiguadores de pH debido a su caracter anfotero, es decir, pueden comportarse como ácidos (cediendo electrones) o como bases (captando electrones).
Fuentes de proteínas
Las fuentes dietéticas de proteínas incluyen
carne, huevos, granos, legumbres y productos
lácteos tales como leche y queso.
Las fuentes animales de proteínas poseen los
20 aminoácidos.
Fuentes de proteínas: Albúmina
La proteína albúmina de huevo se asimila en un 94%.
Ideal para deportistas que deseen aumentar su rendimiento y
masa muscular
Proporciona mayor vigor y energía
Apoya a niños en su etapa de crecimiento.
Pueden consumirla los adultos y ancianos con una alimentación
deficiente ya que es un complemento de fácil asimilación.
Proporciona proteínas sin elevar su nivel de colesterol.
Fuentes de proteínas: Carne
Ricas en proteína
Ingerimos también todos los desechos del
metabolismo celular presentes en esos tejidos
(amoniaco, ácido úrico, etc.), que el animal no
pudo eliminar antes de ser sacrificado. Estos
compuestos actúan como tóxicos en nuestro
organismo.
Fuentes de proteínas: Carne
El metabolismo de los vegetales es distinto y
no están presentes estos derivados
nitrogenados.
Los tóxicos de la carne se pueden evitar
consumiendo las proteínas de origen animal a
partir de huevos, leche y sus derivados.
Fuentes de proteínas
Las fuentes vegetales son deficientes en
aminoácidos y se dice que sus proteínas son
incompletas. Por ejemplo:
Legumbres carecen de cuatro aminoácidos
incluyendo el aminoácido esencial metionina.
Los granos carecen de tres o cuatro aminoácidos
incluyendo el aminoácido esencial lisina.
Proteínas en Nutrición
Son digeridas a través de la digestión que comienza en el estómago.
Las proteínas son digeridas en polipeptidos más pequeños, por las proteasas, para proveer de aminoácidos al organismo, incluyendo los aminoácidos esenciales que el organismo no puede sintetizar.
Proteínas en Nutrición
Las proteínas, como los carbohidratos, contienen 4 kcal por gramo opuesto a los lípidos los cuales contienen nueve kilocalorías y los alcoholes los cuales contienen 7 kcal.
Las proteínas pueden ser convertidas en carbohidratos a través de un proceso llamado gluconeogénesis.
Exceso de consumo de proteínas
Como el organismo es incapaz de almacenar las proteínas, el exceso de proteínas es digerido y convertido en azúcares o ácidos grasos.
El exceso en el consumo de proteínas también puede causar la pérdida de calcio corporal, lo cual puede conducir a pérdida de masa ósea a largo plazo.
Sin embargo, varios suplementos proteicos vienen suplementados con diferentes cantidades de calcio por ración, de manera que pueden contrarrestar el efecto de la pérdida de calcio.
Exceso de consumo de proteínas
Probablemente estaría ligado a:
Hiperreactividad del sistema inmune.
Disfunción hepática debido a incremento de residuos tóxicos.
Pérdida de densidad ósea, la fragilidad de los huesos es debido a que el calcio y la glutamina son filtrados de los huesos y el tejido muscular para balancear el incremento en la ingesta de ácidos a partir de la dieta. Este efecto no esta presente si el consumo de minerales alcalinos
(a partir de frutas y vegetales, los cereales son ácidos como las proteínas, las grasas son neutras) es alto.
PROTEÍNAS
Todas las proteínas están formadas por los mismos 20 Aa, los cuales por sí solo no tienen ningún efecto biológico.
La conformación tridimensional es la que le confiere a cada proteína su actividad biológica específica.
La conformación se encuentra determinada por la secuencia específica de los Aa en su cadenas polipeptídica.