Word-Cromatografia-de-Afinidad.-analu-jime-cami-chicha-lu-luis (1).docx
-
Upload
lu-martinez -
Category
Documents
-
view
283 -
download
5
Transcript of Word-Cromatografia-de-Afinidad.-analu-jime-cami-chicha-lu-luis (1).docx
CROMATOGRAFIA DE AFINIDADI. Introduccin
A. Definicin de cromatografa (general):Tcnica que separa una mezcla de solutos basada en la velocidad de desplazamiento diferencial de los mismos que se establece al ser arrastrados por una fase mvil (lquida o gaseosa) a travs de un lecho cromatogrfico que contiene la fase estacionaria, la cual puede ser lquida o slida. Las propiedades de los componentes de una mezcla determinan su movilidad entre s y con respecto a la fase mvil. La base de la separacin cromatogrfica ser, por tanto, la diferencia en la migracin de los mismos.
B. Cromatografa de Afinidad:Es un tipo especial de cromatografa de adsorcin slido-lquido en la que la sustancia de naturaleza bioqumica (anticuerpos, cofactores, inhibidores enzimticos, lectinas y otras molculas) denominadas ligandos de afinidad y enlazados qumicamente en soportes slidos adecuados, retienen a los solutos (analitos), tambin de naturaleza bioqumica, de manera reversible y selectiva. Las separaciones se basan en el acoplamiento llave-cerradura tpico de la biologa molecular y enzimologa.Esta tcnica permite la separacin de mezclas, generalmente proteicas, por su afinidad o capacidad de unin a un determinado ligando. En este caso, las protenas que se retienen en la columna son aquellas que se unen especficamente a un ligando que previamente se ha unido covalentemente a la matriz de la columna. Despus de que las protenas que no se unen al ligando son lavadas o eluidas a travs de la columna, la protena de inters que ha quedado retenida en la columna se eluye o libera mediante el empleo de una solucin que contiene bien ligando libre u otro compuesto que rompa la interaccin entre el ligando y la protena.
En otros casos, se han empleado anticuerpos especficos a fin de formar selectivamente complejos con sus antgenos respectivos; es decir, con molculas que han inducido la formacin del anticuerpo usado. Etapas fundamentales:
1. Inmovilizacin del ligando 2. Adsorcin de la muestra3. Desorcin
Distincin de otras cromatografas:
Alta selectividad en el mecanismo de retencin Campo de aplicacin restringido Separacin de un solo soluto o tipo de solutos Empleo de sistema de baja presin Columnas cortas.
II. Interaccin ligando afinante y matrices Son las molculas bioqumicas que se encuentran ancladas qumicamente sobre el soporte slido inerte, y son las responsables de la adsorcin especfica de los solutos-analitos. Pueden considerarse dos clasificaciones de los mismos: Segn su naturaleza, pueden ser macromolculas biolgicas o bien moleculas de bajo peso molecular de biomolculas pequeas o macromolculas bioqumicas, respectivamente. Y segn su actuacin. Que se fundamenta en la selectividad en la retencin que condiciona las caractersticas de la cromatografa de afinidad; se distinguen dos grandes grupos: Ligandos especficos , como los anticuerpos , que se enlazan reversiblemente a un solo soluto, y los ligandos generales enlazados con un determinado grupo de compuestos bioqumicos, como las lectinas y nucletidos.
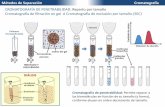
Esquema de un cromatograma de afinidad.Matrices o Soportes El material sobre cuya superficie activada se establece el enlace covalente con el ligando de afinidad. Debe poseer propiedades como tener una gran superficie, tamao del grano controlable, porosidad controlable, carcter suficientemente hidroflico para evitar adsorciones no especficas de protenas u otras molculas, estabilidad mecnica, en especial para trabajar a alta presin. El material utilizado generalmente para el soporte son geles orgnicos derivados de los polisacridos como la agarosa (sepharosa), polmeros de acrilamida, fractogel TSK y slices CPG.En conclusin la matriz ideal debera tener las siguientes propiedades: Insolubilidad. Este punto es muy importante, no solo para prevenir la prdida del adsorbente sino tambin para evitar la contaminacin de la muestra. Gran permeabilidad y rea especfica. Si una matriz no posee la suficiente permeabilidad (referida como el tamao del poro) no se permitir la libre interaccin del ligando con el afinante impidiendo una buena adsorcin de este ltimo a la columna y por tanto una buena purificacin. Es muy importante hacer notar que el rea de superficie especfica (aquella rea que se encuentra en contacto directo con la molcula que se desea aislar) est directamente relacionada con la cantidad de afinante que se desea aislar, por lo tanto entre mayor sea el rea especfica de la columna se esperar purificar mayor cantidad de afinante. Rigidez. Esta propiedad, junto con la forma de la partcula de la matriz, estn directamente relacionadas con el problema de la velocidad de flujo. En general, para cromatografa de afinidad se utilizan flujos lentos con el fin de dar oportunidad al afinante de penetrar los poros de la matriz y encontrar a su ligando. Altas velocidades de flujo provocan que las partculas de la matriz se deformen por compactacin incrementando la resistencia al flujo. Como recomendacin el tamao de la partcula debe estar entre los 5 y los 200 m Adsorcin inespecfica. Como es de imaginarse las matrices deben adsorber lo menos posible (idealmente cero) al afinante. La adsorcin inespecfica del afinante a la matriz provoca cantidades sub-ptimas de recuperacin y puede provocar la desnaturalizacin de la molcula de inters. Es por esta razn que debe evitarse el uso de matrices que contengan grupos ionognicos (p. ej. co-polimeros de etileno con anhidrido malico) principalmente cuando se trabaja a baja fuerza inica (20 mM NaCl). Reactividad y baja fuerza inica. La matriz debe tener suficientes grupos qumicamente reactivos que puedan ser activados o modificados de tal forma que sean capaces de unir a la molcula de inters. La capacidad de una columna, es decir, cuantas molculas de afinante puede unir, esta en funcin directa del nmero de grupos reactivos que existan en la matriz. La modificacin o activacin de la matriz deben hacerse bajo condiciones que no alteren su estructura. De igual forma es importante que la matriz no se altere bajo las condiciones de trabajo as como a diferentes valores de pH, temperatura, fuerza inica y bajo la presencia de agentes desnaturalizantes.y caotrpicos. El hecho de poder reutilizar una columna depende de estas capacidades. Resistencia a biolgicos. La matriz no debe ser degradada por microorganismos y/o enzimas. Este requerimiento lo cumplen muy satisfactoriamente las matrices inorgnicas como las de vidrio o polimeros sintticos (poliacrilamida o hidroxialquilmetacrilato) Las matrices ms utilizadas en cromatografa de afinidad pueden ser de varios tipos.
En este trabajo solo mencionaremos las ms populares, las cuales se dividiran en tres grandes grupos: Matrices de polisacridos - Agarosa: cuyo nombre comercial ms comn es Sefarosa, pura permite utilizarla en concentraciones muy bajas (< 0.5%) y facilita la formacin de poros de tamao muy grande. El agar como tal (agarosa + agaropectina) tambin permite la formacin de poros muy grandes adems de ser muy estable mecnicamente bajo las condiciones que se requieren en cromatografa de afinidad. Sin embargo, laagropectina contiene grupos sulfato y, en menor nmero, grupos carboxilo que le proporcionan al agar caractersticas inicas que no son deseables en el tipo de cromatografa que nos atae
- Celulosa: la celulosa comercial esta preparada en forma de microfibras o microcristales esferoides que exhiben buenas velocidades de flujo. Actualmente tambin puede conseguirse celulosa en forma de gotas. La celulosa en gotas es un producto en forma de partculas esfricas altamente porosas que se componen de celulosa pura (15%) y agua. Cuando las partculas se inchan se produce una estructura macroreticular.
- Dextrano La forma comercial de las matrices de dextrano se conoce como Sephadex la cual se prepara entrecruzando las cadenas de glucosa con epiclrohidrna y se presenta en forma de gotas. Esta matriz tiene una naturaleza altamente hidroflica debido al gran nmero de grupos hidroxilo presentes lo cual permite que se hinche fcilmente en agua y en solucines electrolticas. El proceso de hinchado y secado es reversible y no afecta de A. Carbajal-Saucedo 10 forma significativa las propiedades cromatogrficas de la matriz an despus de varios ciclos.
Matrices sintticas - Poliacrilamida: Una ventaja de las matrices de poliacrilamida es el gran nmero de grupos potencialmente activables lo que, unido a una gran versatildad en las tcnicas de derivatizacin permiten unirle covalentemente muchos posibles ligandos. sto resulta particularmente til cuando se desea purificar un compuesto que muestra baja afinidad por el ligando inmovilizado. Al aumentar el nmero de sitios en los que el afinante pueda unirse se aumentan las probabilidades de obtener mayor cantidad de producto purificado. An cuando han sido matrices muy tiles para aislar una gran cantidad de compuestos (anticuerpos, lisozima, peroxidasa, tripsina, linfocitos, clulas B, entre otros) su uso sigue restringido debido al bajo grado de porosidad que posee lo cual puede provocar que el ligando inmovilizado se encuentre lejos del alcance del afinante.
- Vidrio: La distribucin del tamao de poro en estas matrices es muy restringida (45- 2500 ) lo que la convierte en la matriz ms uniforme de todas las disponibles y permite una buena resolucin y excelente reproducibilidad. El rango de porosidad es suficientemente bueno para incluir la mayora de las biomolculas desde sustratos hasta clulas completas. En cuanto a las caractersticas mecnicas, son matrices completamente insolubles y no se ven afectadas por cambios en el eluyente, presin, velocidad de flujo, pH o fuerza inica. No son atacadas por microorganismos y pueden ser esterilizadas tanto por autoclave como mediante el uso de desinfectantes.
Otras matrices- Hidroxialquilmetacrilato: los grupos hidroxilo de la matriz exhiben propiedades similares a los de las matrices de polisacaridos y son potencialmente activables por bromuro de ciangeno. El nmero de grupos reactivos, la porosidad y el tamao de la partcula de estos geles puede variar significativamente durante su produccin. Los rangos de exclusin de estas matrices van de 105 a 108 y han sido usados para aislar molculas como inhibidores de tripsina y quimotripsina, proteasas, y otros ms.
- Oxiranos acrlicos: Se obtienen de la co-polimerizacin de metacrilamida, metilen-bis-metacrilamida glicidil- metacrilato y/o alil-glicidil-eter. Se conocen bajo el nombre comercial de Eupergit C, son hidroflicas, qumicamente estables en un rango de pH de 0 a 12 por varias horas a temperatura ambiente en suspensin acuosa, en polvo son estables durante meses a 30o C. Dada la naturaleza qumica de la unin matriz-ligando, los ligandos se inmovilizan irreversiblemente a la matriz en un rango de pH de 1 a 10.
Mtodo cromatogrficoLa cromatografa, hablando en general, es un mtodo fsico de separacin para la caracterizacin de mezclas complejas. Es un conjunto de tcnicas basadas en el principio de retencin selectiva, cuyo objetivo es separar los distintos componentes de una mezcla, permitiendo identificar y determinar las cantidades de dichos componentes.Se pueden distinguir dos fases, una mvil y otra estacionaria que es retenida en el tubo. La fase mvil se hace pasar a travs del tubo mediante alguna fuerza impulsora. La fase estacionaria puede ser un slido poroso y un lquido que ha sido colocado.Se puede tener en cuenta que las matrices de cromatografa de afinidad pueden reutilizarse varias veces sin una prdida considerable de capacidad de unin.Mtodos de activacin y acoplamientoLa activacin de la matriz consiste en unir covalentemente el ligando a la matriz. En algunas ocasiones resulta muy til introducir molculas que alejen el ligando de la matriz a fin de aumentar la adsorcin del afinante (seccin de brazos espaciadores). MATRICES DE POLISACRIDOS:Estas matrices (agarosa, celulosa y dextrano) son activadas introduciendo grupos electrofilicos al gel a fin de hacerlos ms reactivos a los grupos nucleofilicos presentes en el ligando o la molecula espaciadoraPueden usarse compuestos como: Imidocarbamato Oxirano AziridinaHalidas de ciangeno: Es el mtodo ms utilizado para unir ligandos a las matrices de polisacridos. La naturaleza qumica de esta activacin est parcialmente explicada. Esta activacin da lugar a un decremento en la capacidad de hinchamiento de la matriz y le proporciona mayor estabilidad trmica debido a que el imidocarbonato reacciona con los hidroxilos de las cadenas vecinas aumentando el entrecruzamiento entre ellas. Llevar a cabo esta activacin en un periodo corto, usualmente de 8-12 min.Triazinas: Las matrices polihidroxiladas tambin pueden ser activadas con dicloro-zym-triazinas o bien con cloruro de ciangeno. Cuando la matriz ha sido activada reacciona muy lentamente con aminas primarias. Mtodo muy adecuado para acoplar protenas a pH alrededor de 7.Bizaridinas: Son agentes bifuncionales que pueden utilizarse para unir ligandos con grupos amino o hidroxilo a la matriz. Desafortunadamente estos agentes son ionognicos pues forman aminas al acoplar el ligando a la matriz y por tanto la convierten en un intercambiador inico.Benzoquinonas: Es una quinona que es mucho muy reactiva al momento de atacar matrices hidroxiladas. El bloqueo de los grupos residuales se lleva a cabo mediante la adicion de glicina.MATRICES SINTTICASPoliacrilamida: consiste bsicamente en segmentos lineares con polietileno con esqueletos alternados de carbono que poseen grupos amida que poseen grupos amida (-CO-NH2). La gran cantidad de estos grupos le proporciona un fuerte carcter hidrofilico y son responsables de la baja adsorcin de macromolculas. La activacin/acoplamiento puede llevarse a cabo de dos formas: MODIFICACIN DIRECTA DE LA MATRIZ: tiene la ventaja de permitir la preparacin directa de la matriz seleccionando los grupos funcionales, el grado de sustitucin, la porosidad y el tamao de la partcula. Los grupos carboxiamida son resistentes a hidrolisis en un rango de pH bastante amplio. Sin embargo, el nitrgeno de la amida es desplazado rpidamente por ciertos compuestos nitrogenados dando lugar a amonio. Aminoetilacin Hidrazinacin Hidrlisis alcalina MODIFICACIN INDIRECTA DE LA MATRIZ: Co-polimerizacin acril-bisacril-ligando: Se obtiene acoplando cido aclico al amino terminar del ligando para entonces copolimerizarlo con acrilamida y N,N metilen bisacrilamida. Esta metodologa permite un fcil control tanto de la porosidad del gel como del nivel de sustitucin del ligando. Lamentablemente la necesidad de sintetizar ligandos con dobles ligaduras hace muy poco til este mtodo. Vidrio: Se trata de usar compuestos que reaccionen con agentes acopladores de silanos. Estos compuestos cuentan con dos grupos funcionales dentro de la misma molcula: Un grupo orgnico en un extremo (generalmente amidas) y un grupo silil alcoxi en el otro. Se usa generalmente para introducir aminas primarias a las matrices de vidrio.
III. LIGANDOSSe pueden utilizar molculas que se unan especfica y reversiblemente a un afinante de inters. Para escoger un afinante se debe tener en cuenta la naturaleza de la interaccin afinante-ligando y la naturaleza del ligando mismo (si presenta o no, y cuntos sitios potenciales). Se utilizan diferentes ligandos segn el objetivo:Aislar una enzima: se utilizan ligandos inhibidores competitivos, sustratos y sus anlogos, productos, cofactores, efectores alostricos, anticuerpos y compuestos que contengan iones metlicos o grupos SH-. Enzimas DNA especficas: se pueden utilizar fragmentos de DNA de cadena sencilla.Purificacin de macromolculas: utilizando anticuerpos (Ab) o antgenos (Ag), tomando en cuenta que la constante de disociacin de una interaccin Ag-Ab cae en un rango de 10-5 10-8 M.Purificacin de Ab: se utilizan los Ag o haptenos usados para su produccin.Aislar carbohidratos: se utilizan lectinas (protenas o glicoprotenas que presentan selectividad por azcares) como ligandos.Aislar glicoprotenas: es recomendable conocer la naturaleza del carbohidrato terminal para poder seleccionar una lectina especfica.Aislar receptores de membrana: utilizando sus correspondientes hormonas como ligandos.Purificacin de transportadores especficos o protenas de unin: se utilizan diversas vitaminas y hormonas. La constante de disociacin de algunos de estos complejos est entre 10-7- 10-16 M. Ya que la concentracin a la cual pueden encontrarse es baja.Aislamiento y caracterizacin de enzimas que participan en sntesis o degradacin de cidos nucleicos: utilizan mononucletidos y oligonucletidos como ligandos.Separar lpidos: se utiliza como ligando la dodecil amina.Separar hormonas: se utilizan como ligandos, anticuerpos, protenas transportadoras o lectinas.
IV. BRAZOS ESPACIADORESMolculas que alejan al ligando de la matriz, lo que permite que el afinante lo encuentre con mayor facilidad. Son de gran importancia cuando el ligando es pequeo, la afinidad del ligando por el afinante es baja (Ki > 10-4 M) y en los casos en los que el ligando involucra protenas de pesos moleculares muy altos. Existen varios tipos de brazos: Hidrofbicos: Un -aminoalquil del tipo NH2(CH2)nR, donde R puede ser una funcin amino o carboxilo, se acopla a una matriz activada.
Ej: Sefarosa + -aminoalcano AH Sefarosa 4B -amino + -carboxialcano CH Sefarosa 4B Hidroflicos: se preparan acoplando 1,3 diamina-2 propanol a matrices de agarosa activadas con CNBr. Tambin se adicionan brazos de oligopptidos como: oligoglicina, glicil-glicil-tirosina, glicil-glicil-serina o glicil-glicil-cido glutmico, los cuales proveen a la matriz grupos fenlicos, tilicos, hidroxilos o carboxilos con ello se introducen nuevos grupos reactivos a la matriz. Macromolculas multivalentes: utilizan polipptidos o protenas como espaciadores hidroflicos con mltiples uniones que reducen la fuga del complejo ligando-espaciador como las interacciones hidrofbicas no especficas.Ej: poli-(L-lisil)-, poli-(DL-alanil-, poli (lisil)-agarosa.Tambin se puede acoplar albmina srica bovina a agarosa activada con CNBr en presencia de una alta concentracin de urea para evitar que se despliegue y ayudar a que se una en ms sitios. Molculas libres de carga: ya que al acoplar aminas primarias a una matriz activada con CNBr se forman N-isoureas que le dan a la matriz fuertes propiedades de intercambiador inico, se puede adicionar dihidrazida de cido adpico, dihidroazida de cido succnico, hidrazida de cido poliglutmico o hidrazida de cido poliacrlico a una matriz activada con CNBr, para solucionar el problema.
V. Bloqueo de los sitios inactivos.Despus que el ligando ha sido unido a la matriz es recomendable bloquear los sitios remanentes (que quedan, que no poseen al ligando) que puedan tener la capacidad de unirlo. En los casos en los que se utilizan grupos amino para unir al afinante las molculas ms comnmente utilizadas para bloqueo son aminas primarias de bajo peso molecular (por ejemplo 2-aminoetanol o glucosamina).En geles que contienen ster como grupos reactivos los sitios inactivos suelen bloquearse adicionando Tris 0.1 M pH 8. En los casos en los que los grupos reactivos son funciones aldehdo los sitios inactivos se bloquean con borohidruro de sodio justo despus de la unin. Este tratamiento no slo ayuda a la reduccin de los aldehdos remanentes sino tambin a la estabilizacin de las uniones entre el afinante y la matriz.Si el ligando se ha unido a un espaciador puede suceder que una regin del espaciador, casi siempre en los extremos amino o carboxilo, permanezca activa. En el caso de ser grupos carboxilo pueden bloquearse con Tris (2-amino, 2-hidroximetilpropano- 1,3-diol) y con N-ciclohexil N [2 (4-morfolinil) etil-carbodiimida metap-tolueno sulfonato. Cuando el ligando se ha unido a una CH Sefarosa 4B mediante unin con carbodiimida se puede bloquear con glucosamina o 2-aminoetanol.En el caso de una AH Sefarosa 4B se utiliza cido actico o anhdrido actico para loquear los grupos amino.Para realizar la cromatografa propiamente dicha consiste:
VI. APLICACIONES DE LA CROMATOGRAFIA POR AFINIDAD EN LA BIOTECNOLOGIA.Casi todas las aplicaciones de la cromatografa de afinidad inciden en el campo de la Bioqumica, donde se utilizan las interacciones especficas en las que estn implicados enzimas y sustratos o coenzimas, anticuerpos y antgenos, receptores y hormonas, etc. Hay que mencionar que esta forma de cromatografa es la nica en la que se disea la fase estacionaria para que interacte con un soluto particular.
VII. PURIFICACIN DE ANTGENOS Y ANTICUERPOS POR CROMATOGRAFA DE AFINIDAD
La cromatografa de afinidad es una tcnica usada en el aislamiento de anticuerpos o antgenos puros. El principio es simple y su aplicacin, muy amplia.
El antgeno o el anticuerpo est unido a travs de sus grupos aminados libres a las partculas de Sepharose activadas con bromuro de ciangeno.
Por ejemplo, pueden usarse anticuerpos insolubilizados para extraer el antgeno correspondiente de la solucin, en la que est presente como un componente de una mezcla compleja, por absorcin a su superficie.
Los residuos que no interesan son eliminados por lavado y el ligando requerido es liberado del absorbente de afinidad mediante la ruptura de los enlaces antgeno-anticuerpo por variaciones de pH o por el agregado de iones caotrpicos como el tiocianato
Del mismo modo, puede utilizarse un antgeno a partir de una mezcla de donde puede purificarse por elusin.
Fig 1. Purificacion de Anticuerpos tpica usando un antgeno inmovilizado en un columna.
La cromatografa de afinidad es una tcnica ampliamente utilizada en Bioqumica e Inmunologa. Puede aplicarse en el aislamiento de una poblacin pura de anticuerpos. Para ello se prepara un inmuno-absorbente en fase slida, que es un antgeno unido covalentemente a un soporte inerte, como otro ejemplo bolitas de dextrano entrecruzadas.
El inmunoabsorbente, se coloca en una columna y la mezcla de anticuerpos se hace pasar a travs de l bajo condiciones fisiolgicas. Los anticuerpos especficos para el antgeno permanecen unidos a la columna, y aquellos que no se unen son eliminados mediante lavado.
En el segundo paso, se eluye la columna, usando un tampn de elucin que disocia la unin antgeno-anticuerpo (por ej., acetato a pH 3.0) para obtener el anticuerpo que se uni al inmunoabsorbente.
A la inversa, colocando anticuerpos en la columna se tendr antgeno puro.
Esta tcnica permite obtener otros tipos de molculas. As una columna de lectina absorber todas las molculas con determinados residuos azcar, que pueden eluirse en un tampn con el azcar libre, ya que ste compite con la protena ligada por los sitios de unin a la lectina.
En 1960 se detect 3 subclases de globulina humana (IgG) en suero humano normal.
Investiga-ciones posteriores revelaron la existencia de 4 subclases de IgG en humanos, designadas IgG1, IgG2, IgG3 e IgG4.
El estudio de las subclases de IgG permiti determinar su importancia en la defensa del organismo frente a agentes patgenos por lo que resulta importante contar con los antisueros especficos que nos permitan su estudio. Para la produccin de esos inmunodiagnosticadores, con una calidad adecuada, es imprescindible un mtodo que nos permita la obtencin del antgeno, con una relativa pureza y un rendimiento adecuado.
MTODOSSe parti de una solucin de Intacglobin (IMEFA, Cuba) La concentracin de las subclases de IgG en la solucin de Intacglobin fue: IgG1 = 29,8 mg/mL; IgG2 =16,8 mg/mL; IgG3 = 2,20 mg/mL e IgG4 = 0mg/mL.Fraccionamiento de las subclases de IgG: Se realiz mediante cromatografa de afinidad en protena A Sepharosa CL 4B (Pharmacia), en una columna K9/15(0,9 x 15 cm) que contena aproximadamente 9 mL de gel, equilibrada con una solucin amortiguadora de fosfato - citrato 0,15 M, pH 7,0.15 Se aplicaron 2 mL de la muestra y se eluyeron los componentes de la mezcla mediante la aplicacin de un gradiente lineal de pH de 7,0 a 3,5, a una velocidad de 20 mL/h, y se recolectaron fracciones de 2,5 mL.RESULTADOSA partir de 100 mg de muestra aplicada se obtuvieron cantidades de: IgG3 = 4,8 mg, IgG2 = 34,6 mg, IgG1 = 14,3 mg, para un rendimiento total del 53,7 %.
Diversos investigadores han empleado la cromatografa de afinidad con Protena A como adsorbente especfico para la purificacin de subclases de IgG y han utilizado para eluir soluciones amortiguadoras con un pH especfico para cada subclase de IgG, con lo cual han obtenido rendimientos totales entre el 36 y 42 %.
OTRO EJEMPLO
REFERENCIAS BIBLIOGRAFICAS. Correo Cientfico Mdico de Holgun 2003; Facultad de Ciencias Mdicas Mariana Grajales Holgun. Purification of rabbit IgG by ion exchange and affinity chromatography.Disponible en: http://www.cocmed.sld.cu/no71/n71ori6.htm Bioqumica. Fundamentos para Medicina y Ciencias de la VidaBy Werner Mller-Esterl. Pg. 107. Universidad Nacional Autonoma de Mexico; Instituto de Biotecnologia; Inmunologia y Tecnicas de Purificacin. Tesis; IBQ. Roco Vanessa Caldern Pascacio Pg 39
Qu molculas es capaz de separar este tipo de cromatografa?Este tipo de cromatografa es usada principalmente para protenas, pero en otros casos tambin es posible retener molculas con un extremo amino.A qu se debe que esta cromatografa est basada en el principio de retencin selectiva?Que gracias a los grupos OH de la matriz y algunas sustancias activadoras solo pueda retener protenas o compuestos con aminos terminales.Por qu se hincha la matriz?Por el alto contenido de iones OH en su superficie, pero este es reversible por un proceso de secado.Por qu debe evitarse el hinchamiento de la matriz?Al momento de hincharse por hidrofilicidad, ms que retener las partculas que queremos, solo las dejara pasar, como si fuese una membrana, es decir, por el fenmeno de difusin.